0daa2ae13aed8004ec690ff91bffb0ce.ppt
- Количество слайдов: 20

第二章 分子结构与性质 第三节 分子的性质 (第 4课时)

四、溶解性 1.影响物质溶解性的外界因素 温度 ⑴影响固体溶解度的主要因素是______。 温度 压强 ⑵影响气体溶解度的主要因素是_____和_____。 2.相似相溶原理:_______________ 非极性溶质一般能溶于非极性溶剂, 极性溶质一般能溶于极性溶剂。 ________________。 ⑴若溶剂和溶质之间能形成氢键,则溶解度______,且氢键 增大 大 作用力越大,溶解度越_______。 相似性 ⑵“相似相溶”还适用于分子结构的_____如乙醇和水。 增大 3. 如果溶质与水发生化学反应可_____其溶解度。

思考与交流 1.比较NH 3和CH 4在水中的溶解度。怎样用相似 相溶规律理解它们的溶解度不同? 2.为什么在日常生活中用有机溶剂(如乙酸乙 酯)溶解油漆而不用水?(油漆的主要成分是非 极性或极性非常小的有机分子) 3.为什么能用CCl 4萃取碘水中的碘?
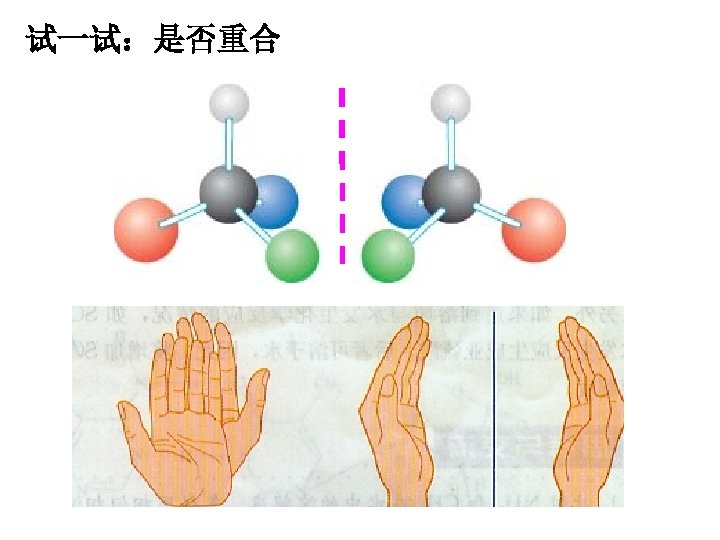
试一试:是否重合

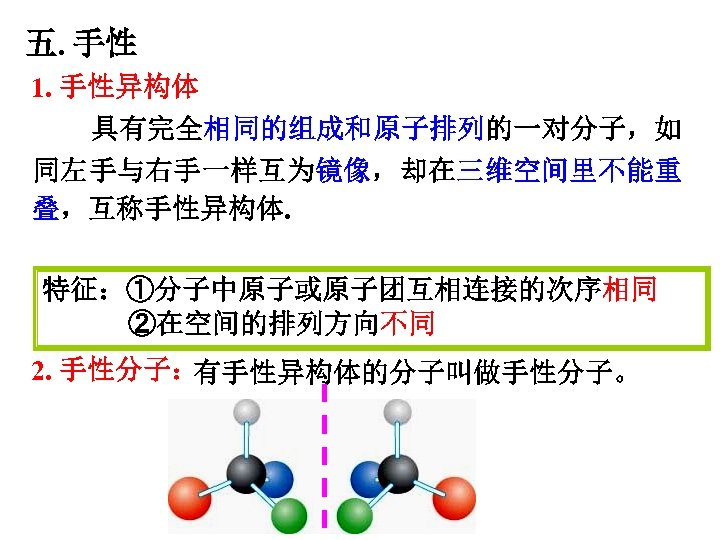
五. 手性 1. 手性异构体 具有完全相同的组成和原子排列的一对分子,如 同左手与右手一样互为镜像,却在三维空间里不能重 叠,互称手性异构体. 特征:①分子中原子或原子团互相连接的次序相同 ②在空间的排列方向不同 2. 手性分子: 有手性异构体的分子叫做手性分子。
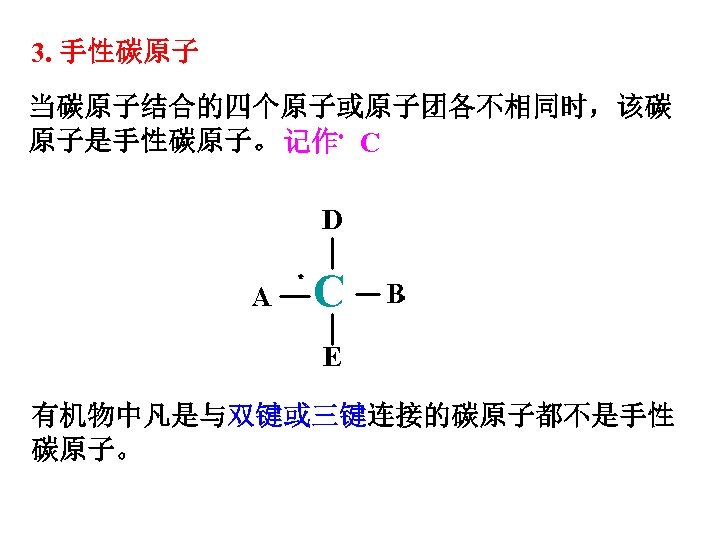
3. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳 原子是手性碳原子。 记作﹡ C ﹡ 有机物中凡是与双键或三键连接的碳原子都不是手性 碳原子。

4. 判断手性分子的方法 (1)一般具有对称面或对称中心的分子,是非手性分子。 (2)根据手性碳原子 Ø当分子中只有一个手性碳原子 ,分子一定有手性。 Ø当分子中有多个手性碳原子时,分子不一定有手性。

“反应停”事件 手性分子在生命科学和生产手性药物方面有广泛的应用。 如图所示的分子,是由一家德国制药厂在 1957年 10月1日 上市的高效镇静剂,中文药名为“反应停”,它能使失眠者 美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。 然而,不久就发现世界各地相继出现了一些畸形儿,后被 科学家证实,是孕妇服用了这种药物导致的随后的药物化 学研究证实,在这种药物中,只有图左边的分子才有这种 毒副作用,而右边的分子却没有这种毒副作用。人类从这 一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后 凡生产手性药物,必须把手性异构体分离开,只出售能治 病的那种手性异构体的药物。

自然界中的手性 珍贵的法螺左旋贝。百 万分之一,十分罕见。

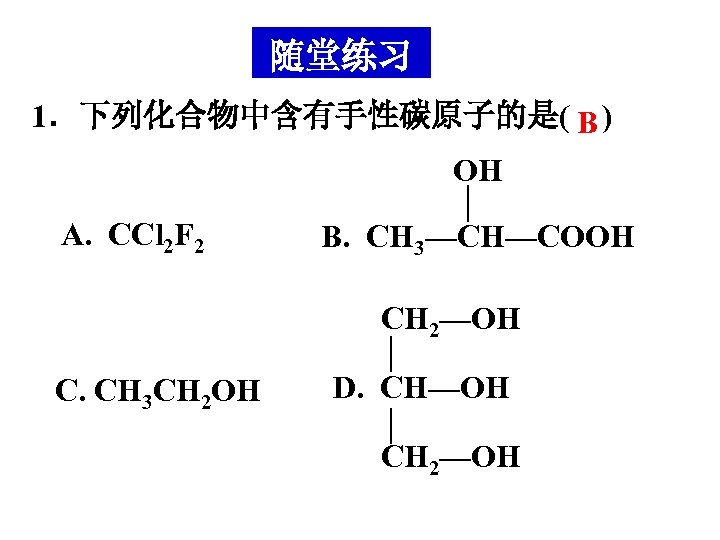
随堂练习 1.下列化合物中含有手性碳原子的是( B ) OH A. CCl 2 F 2 B. CH 3—CH—COOH CH 2—OH C. CH 3 CH 2 OH D. CH—OH CH 2—OH
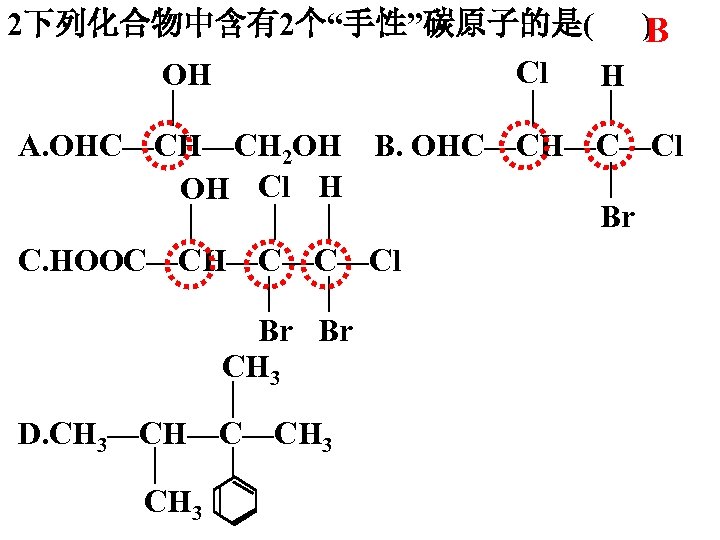
2下列化合物中含有2个“手性”碳原子的是( ) B Cl OH H A. OHC—CH—CH 2 OH B. OHC—CH—C—Cl OH Cl H Br C. HOOC—CH—C—C—Cl Br Br CH 3 D. CH 3—CH—C—CH 3

六. 无机含氧酸的酸性 1、无机含氧酸酸性的比较 ①同周期,最高价含氧酸的酸性, 自左至右增强。 如:H 3 PO 4 < H 2 SO 4 < HCl. O 4 ②同主族、同价态的不同元素,含氧酸的酸性, 自上而下减弱。 HCl. O>HBr. O>HIO 如: HCl. O 2>HBr. O 2>HIO 2 HCl. O 3>HBr. O 3>HIO 3 HCl. O 4>HBr. O 4>HIO 4

③同一元素的含氧酸,该元素的化合价越高, 其含氧酸的酸性越强 H 2 SO 3<H 2 SO 4 HNO 2 <HNO 3 HCl. O < HCl. O 2< HCl. O 3< HCl. O 4
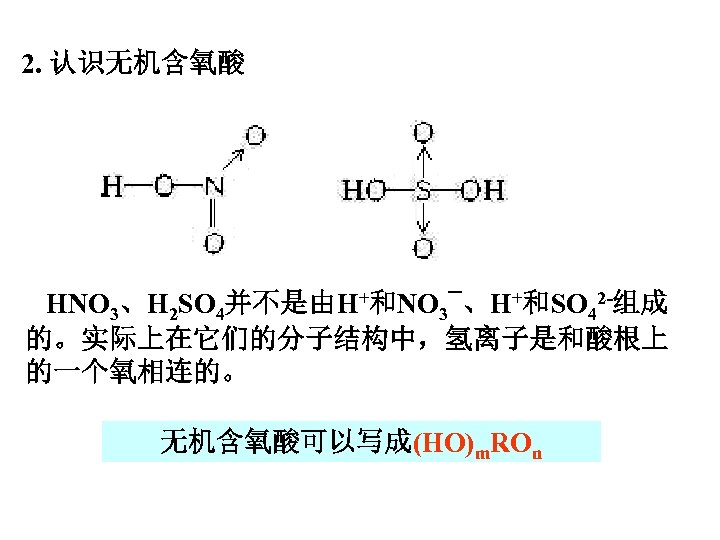
2. 认识无机含氧酸 HNO 3、H 2 SO 4并不是由H+和NO 3¯、H+和SO 42 -组成 的。实际上在它们的分子结构中,氢离子是和酸根上 的一个氧相连的。 无机含氧酸可以写成(HO)m. ROn

【做一做】含氧酸的化学式可写成(HO)m. ROn,请将刚 才的这些含氧酸改写成上述形式,并总结含氧酸的强 弱与m、n的关系。 H 2 SO 3<H 2 SO 4 (HO)2 SO 2 HNO 2 <HNO 3 (HO)NO 2 HCl. O < HCl. O 2< HCl. O 3< HCl. O 4 (HO)Cl. O 2 (HO)Cl. O 3 (HO)m. ROn中,n值越大,酸性越强
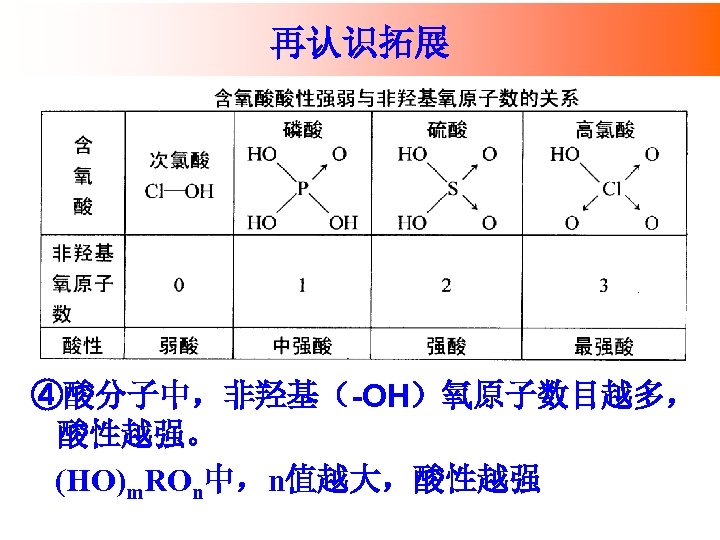
再认识拓展 ④酸分子中,非羟基(-OH)氧原子数目越多, 酸性越强。 (HO)m. ROn中,n值越大,酸性越强

随堂练习 1. 已知含氧酸可用通式XOm(OH)n来表示,如X是S, 则m=2,n=2,则这个式子就表示H 2 SO 4。一般而言, 该式中m大的是强酸,m小的是弱酸。下列各含氧酸 中酸性最强的是( A ) A.HCl. O 4 B.H 2 Se. O 3 C.H 3 BO 3 D.H 3 PO 4

随堂练习 2. 某些含氧酸可表示为(HO)m. ROn,它的强度与酸中的 非羟基氧原子数n有关。n越大,酸性越强:n=0为弱 酸,n=1为中强酸;n=2为强酸;n=3为最强酸。 已知:硼酸(H 3 BO 3)是弱酸,而亚磷酸(H 3 PO 3)是中强酸。 (1)写出这两种酸的结构式:_________ (2)写出这两种酸和过量的Na. OH溶液反应的化学方 程式: H 3 BO 3 + 3 Na. OH = Na 3 BO 3 + 3 H 2 O H 3 PO 3 + 2 Na. OH = Na 2 HPO 3 + 2 H 2 O
0daa2ae13aed8004ec690ff91bffb0ce.ppt