47304fc9d7a6eaae2f255fa2d058cf5b.ppt
- Количество слайдов: 118

曾昭琼《有机化学》第三版CAI教学配套课件 有机化学 主讲:谢启明 教授

第九章 卤代烃 § 9 -1 分类、命名及同分 异构现象 § 9 -2 卤 代 烷 § 9 -3 亲核取代反应历程 § 9 -4 一卤代烯烃和一卤 代芳烃 § 9 -5 卤代烃的制法 § 9 -6 重要的卤代烃 § 9 -7 有机氟化物

前 言 有机分子中一个或几个氢原子被卤素原子取代生 成的有机化合物称为卤代烃。 卤代烃在日常生活中随处可见。例如: 干洗剂 Cl 2 CHCHCl 2 二氯乙烷 制冷剂 CHCl. F 2 二氟一氯甲烷(氟利昂) 灭火剂 CCl 4 四氯化碳 麻醉剂 CF 3 CHBr. Cl 三氟一氯一溴乙烷
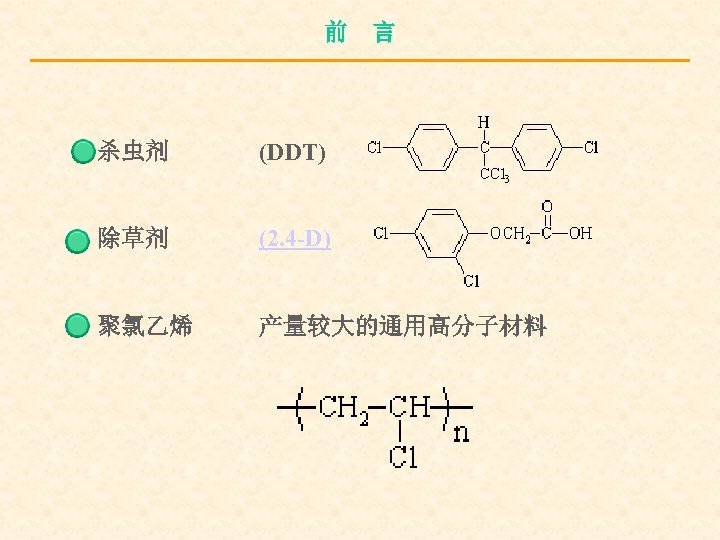
前 言 杀虫剂 (DDT) 除草剂 (2. 4 -D) 聚氯乙烯 产量较大的通用高分子材料
第一节 卤代烃的分类、命名及同分异构现象 一、分类 二、命名 三、同分异构现象

第一节 卤代烃的分类、命名及同分异构现象>一、分类

第一节 卤代烃的分类、命名及同分异构现象>二、命名

第一节 卤代烃的分类、命名及同分异构现象>二、命名

第一节 卤代烃的分类、命名及同分异构现象>三、同分异构现象 卤代烃的同分异构体数目比相应的烷烃的异 构体要多,例如,一卤代烃除了碳干异构外,还 有卤原子的位置异构。
第二节 卤 代 烷 一、物理性质 二、光谱性质 三、偶极矩 四、化学性质 五、多卤代烷的性质

第二节 卤 代 烷 >一、物理性质 状 态:四个碳以下的氟代烷、两个碳 以下的氯代烷以及溴甲烷是气体,一般卤代烷 为液体,高级的为固体。 溶解度:均不溶于水,而溶于醇、醚等有 机溶剂。卤代烃本身也 是常用的有机溶剂。 卤代烃蒸气有毒,应避免吸入。 比 重:大多数卤代烃比重均大于1。

第二节 卤 代 烷 >一、物理性质 沸 点:高于相同碳数的烷烃,且RI >RBr >RCl。卤原子相同的卤代烃的沸点随碳原子数目的增 多和卤素原子序数的增加而升高,同分异构体中,支 链分子的沸点较直链为低,支链越多,沸点越低。 燃烧性能:多卤代烃难燃,离火自熄。如聚氯乙 烯即具有自熄性。卤代烃在铜丝上灼烧时,生成绿色 火焰,这是含卤有机物的初步鉴别方法。

第二节 卤 代 烷 >二、光谱性质 1、卤代烃的红外光谱 C-X键轭伸缩振动落在指纹区,且随着卤素 的原子量轭增大,波数下降: C-F,1210~ 1000 cm-1 S; C-Cl,800~ 600 cm-1 M ;C-Br,700~ 500 cm-1 M ; C—I, 610~ 485 cm-1 M。 Br与I的相对原子质量很大,因此C—Br,C— I键的伸缩振动出现在 700~ 500 cm-1区域,很多 红外光谱仪在 700 cm-1以下没有作用,因此C—Br、 C—I键在一般的红外光谱中不能检出。
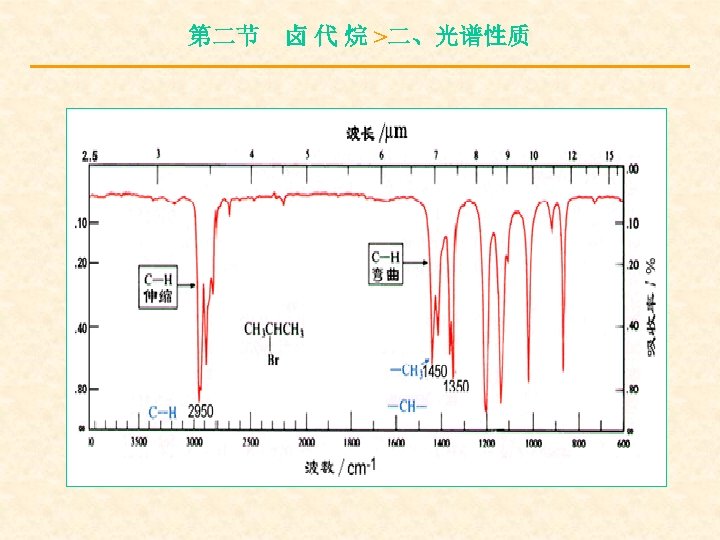
第二节 卤 代 烷 >二、光谱性质
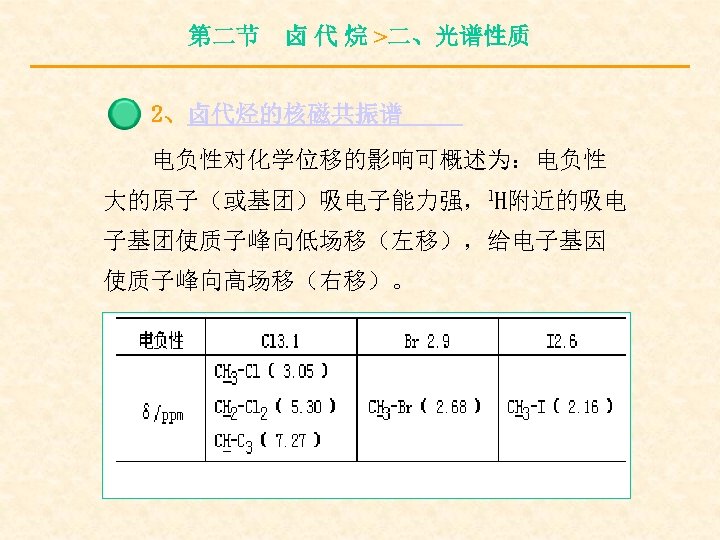
第二节 卤 代 烷 >二、光谱性质 2、卤代烃的核磁共振谱 电负性对化学位移的影响可概述为:电负性 大的原子(或基团)吸电子能力强,1 H附近的吸电 子基团使质子峰向低场移(左移),给电子基因 使质子峰向高场移(右移)。

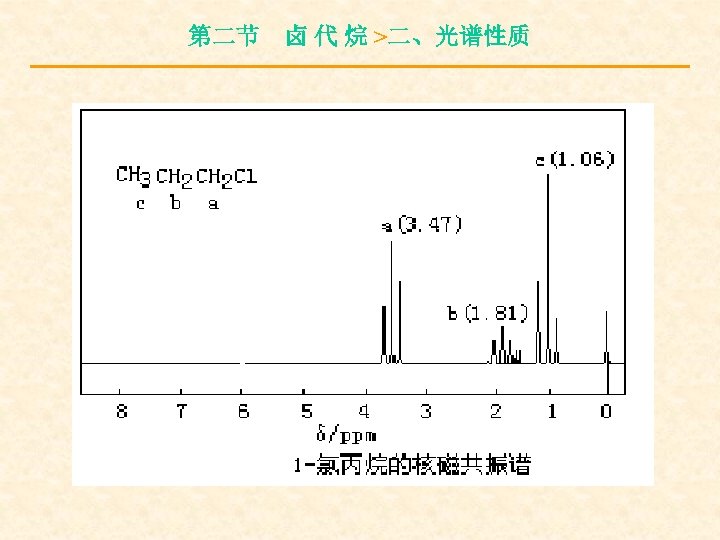
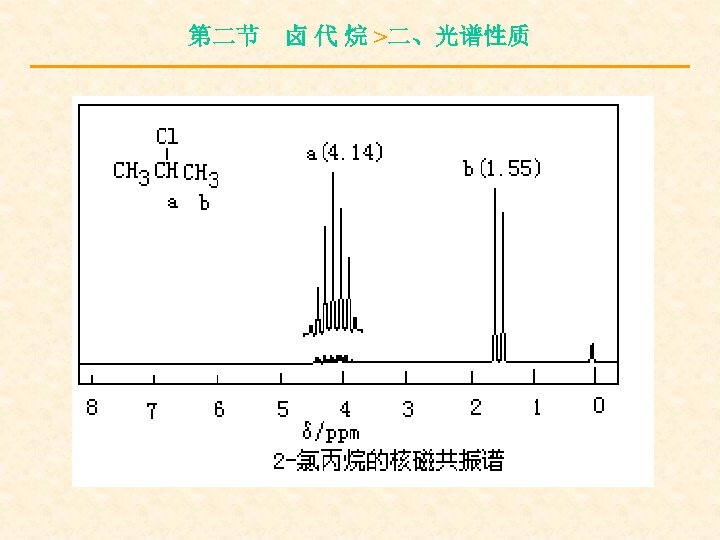
第二节 卤 代 烷 >二、光谱性质 与卤素直接相连的碳原子上的质子化学 位移一般在δ= 2. 16~ 4. 4 ppm之间,相邻碳 上质子所受影响减少,δ= 1. 25~ 1. 55 ppm之 间,相隔一个碳原子时,影响更小,δ= 1. 03~ 1. 08 ppm之间。
第二节 卤 代 烷 >二、光谱性质
第二节 卤 代 烷 >二、光谱性质
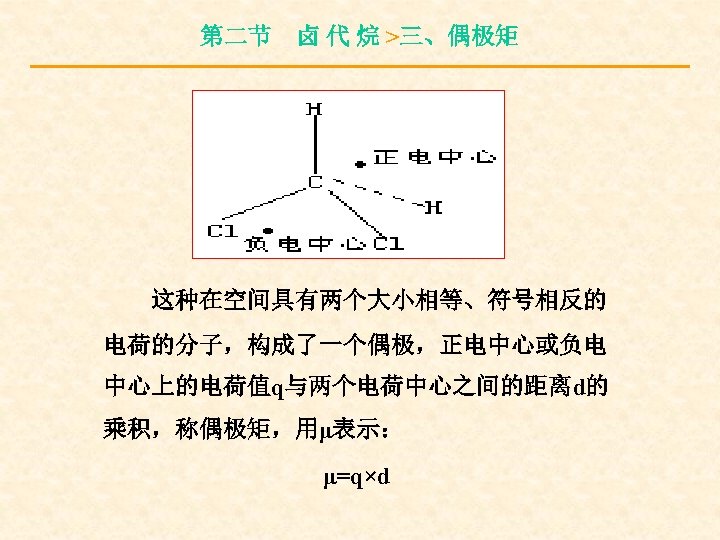
第二节 卤 代 烷 >三、偶极矩 这种在空间具有两个大小相等、符号相反的 电荷的分子,构成了一个偶极,正电中心或负电 中心上的电荷值q与两个电荷中心之间的距离d的 乘积,称偶极矩,用μ表示: μ=q×d
![第二节 卤 代 烷 >三、偶极矩 偶极矩的单位为D[英文 Debye(德拜)的第 一个字母]。偶极矩是有方向性的,用+→表示,箭 头所示方向是从正电荷到负电荷的方向。 卤代甲烷在气相的偶极矩,其方向为 第二节 卤 代 烷 >三、偶极矩 偶极矩的单位为D[英文 Debye(德拜)的第 一个字母]。偶极矩是有方向性的,用+→表示,箭 头所示方向是从正电荷到负电荷的方向。 卤代甲烷在气相的偶极矩,其方向为](https://present5.com/presentation/47304fc9d7a6eaae2f255fa2d058cf5b/image-20.jpg)
第二节 卤 代 烷 >三、偶极矩 偶极矩的单位为D[英文 Debye(德拜)的第 一个字母]。偶极矩是有方向性的,用+→表示,箭 头所示方向是从正电荷到负电荷的方向。 卤代甲烷在气相的偶极矩,其方向为
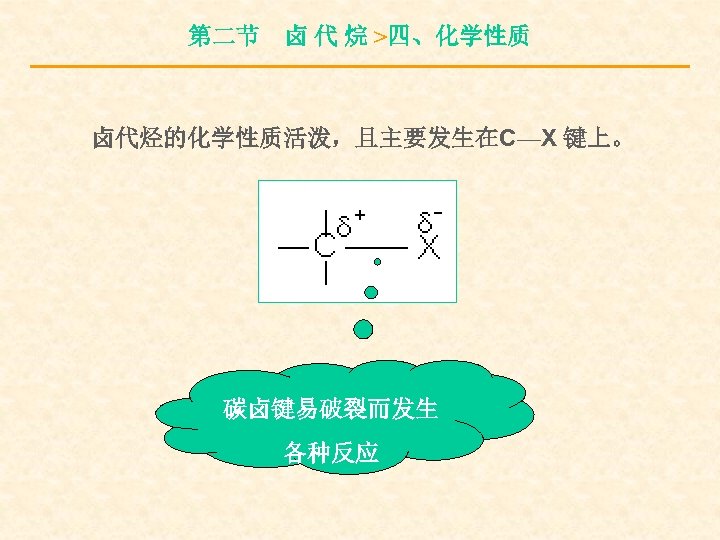
第二节 卤 代 烷 >四、化学性质 卤代烃的化学性质活泼,且主要发生在C—X 键上。 碳卤键易破裂而发生 各种反应
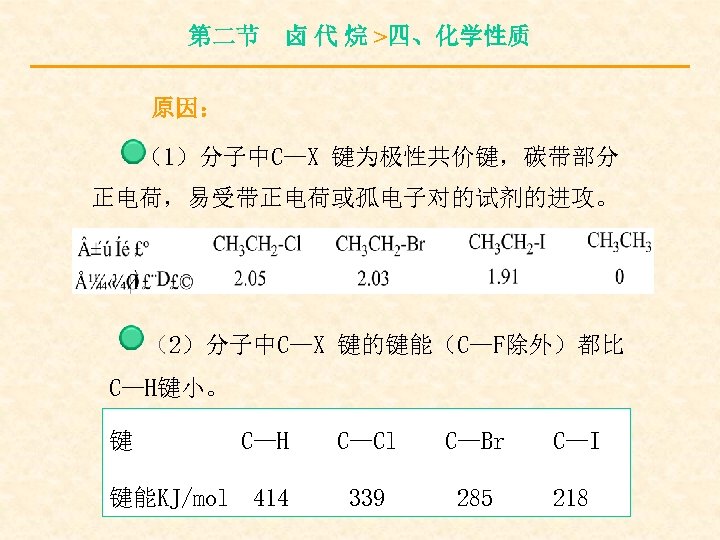
第二节 卤 代 烷 >四、化学性质 原因: (1)分子中C—X 键为极性共价键,碳带部分 正电荷,易受带正电荷或孤电子对的试剂的进攻。 (2)分子中C—X 键的键能(C—F除外)都比 C—H键小。 键 键能KJ/mol C—H C—Cl C—Br C—I 414 339 285 218

第二节 卤 代 烷 >四、化学性质 1、亲核取代反应 亲核度剂: 带负电荷的离子或具有未共用点子对亲核试剂, 像OH-、CN-、R-、H 2 O、NH 3等,它们都具有较大的点子 云密度,在反应中向卤代烷带正电荷的碳进攻,并 向碳提供一对电子,与碳形成新的σ键,卤原子则 以负离子的形式离去。

第二节 卤 代 烷 >四、化学性质 这种由亲核试剂进攻而引起的取代反应叫亲 核取代反应,用SN表示(S代表取代Substitution, N代表亲核Nucleophilic)。

第二节 卤 代 烷 >四、化学性质 这种由亲核试剂进攻而引起的取代反应叫亲 核取代反应,用SN表示(S代表取代Substitution, N代表亲核Nucleophilic)。
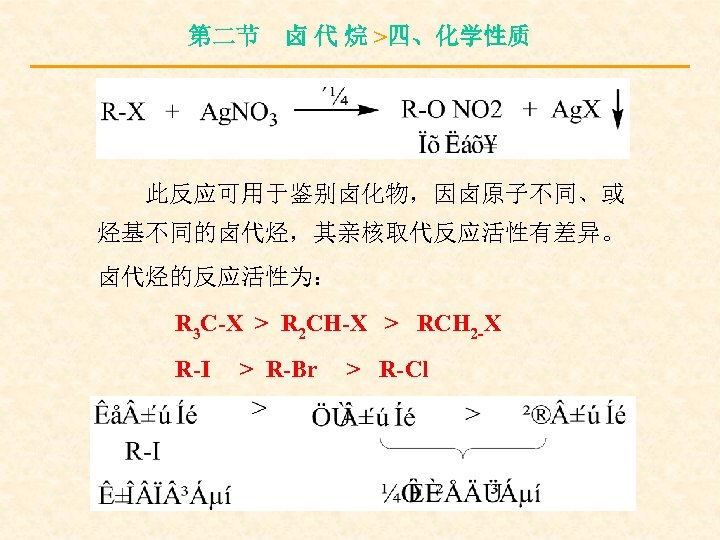
第二节 卤 代 烷 >四、化学性质 此反应可用于鉴别卤化物,因卤原子不同、或 烃基不同的卤代烃,其亲核取代反应活性有差异。 卤代烃的反应活性为: R 3 C-X > R 2 CH-X > RCH 2 -X R-I > R-Br > R-Cl
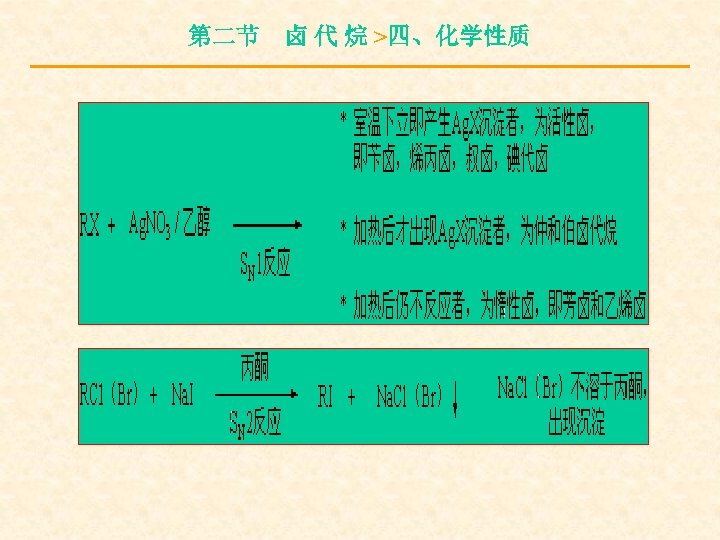
第二节 卤 代 烷 >四、化学性质

第二节 卤 代 烷 >四、化学性质 2、消除反应 从分子中脱去一个简单分子生成不饱和键 的反应称为消除反应,用E表示。 -消除反应、1,2 -消除反应:

第二节 卤 代 烷 >四、化学性质 卤代烃与Na. OH(k. OH)的醇溶液作用时, 脱去卤素与β碳原子上的氢原子而生成烯烃。 消除反应的活性: 3°RX > 2°RX > 1°RX
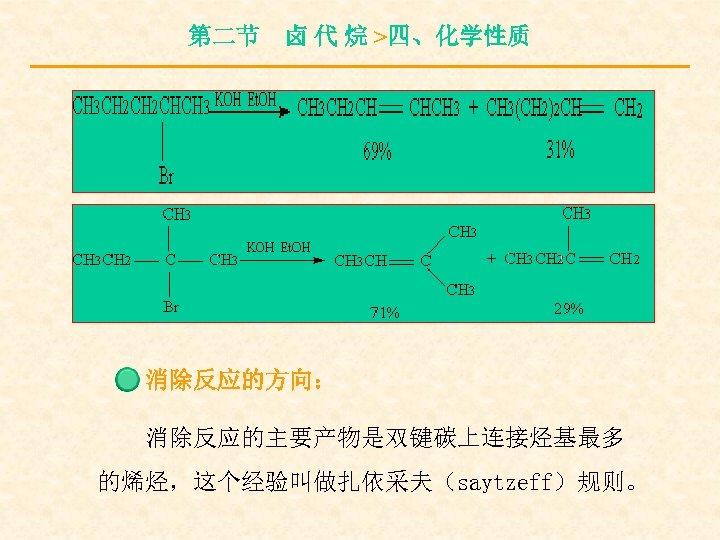
第二节 卤 代 烷 >四、化学性质 消除反应的方向: 消除反应的主要产物是双键碳上连接烃基最多 的烯烃,这个经验叫做扎依采夫(saytzeff)规则。

第二节 卤 代 烷 >四、化学性质 3、与金属的反应 卤代烃可与Li、Na、K、Mg、Al、Cd等金属反应, 生成具有不同极性C-M(M代表金属原子)键的有机 金属化合物。 ⑴与金属镁的反应 活性:R-I > R-Br > RCl

第二节 卤 代 烷 >四、化学性质 格氏试剂的性质非常活泼,能与多种含活泼 氢的化合物作用:
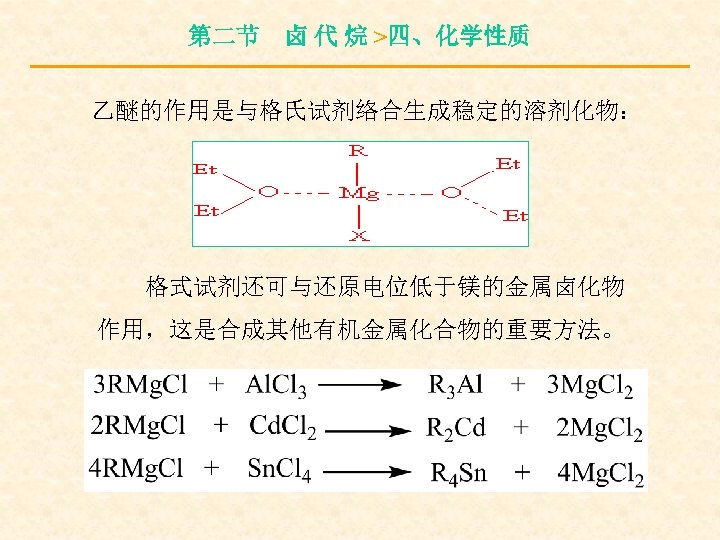
第二节 卤 代 烷 >四、化学性质 乙醚的作用是与格氏试剂络合生成稳定的溶剂化物: 格式试剂还可与还原电位低于镁的金属卤化物 作用,这是合成其他有机金属化合物的重要方法。

第二节 卤 代 烷 >四、化学性质 ⑵与金属锂反应
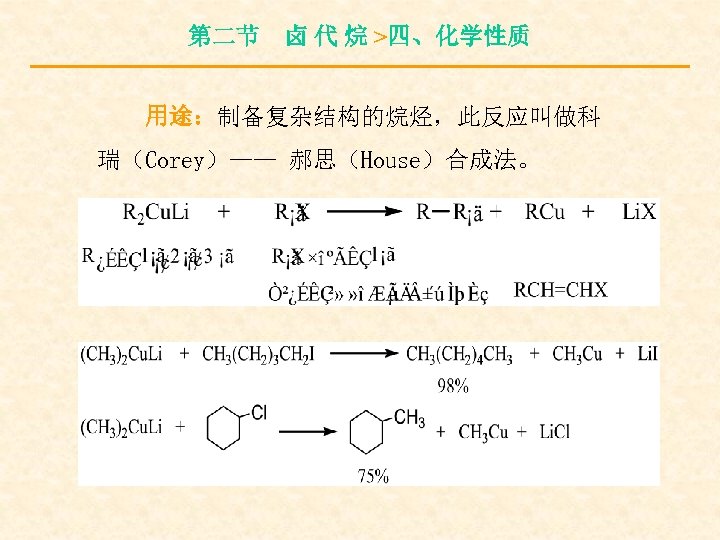
第二节 卤 代 烷 >四、化学性质 用途:制备复杂结构的烷烃,此反应叫做科 瑞(Corey)—— 郝思(House)合成法。
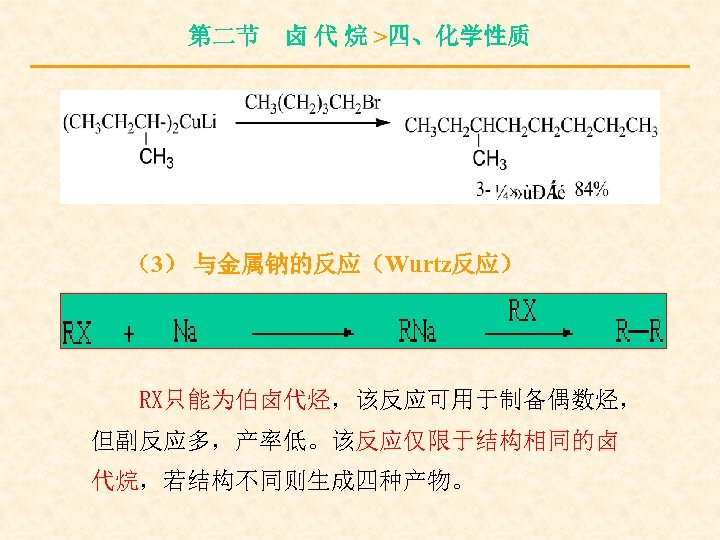
第二节 卤 代 烷 >四、化学性质 (3) 与金属钠的反应(Wurtz反应) RX只能为伯卤代烃,该反应可用于制备偶数烃, 但副反应多,产率低。该反应仅限于结构相同的卤 代烷,若结构不同则生成四种产物。
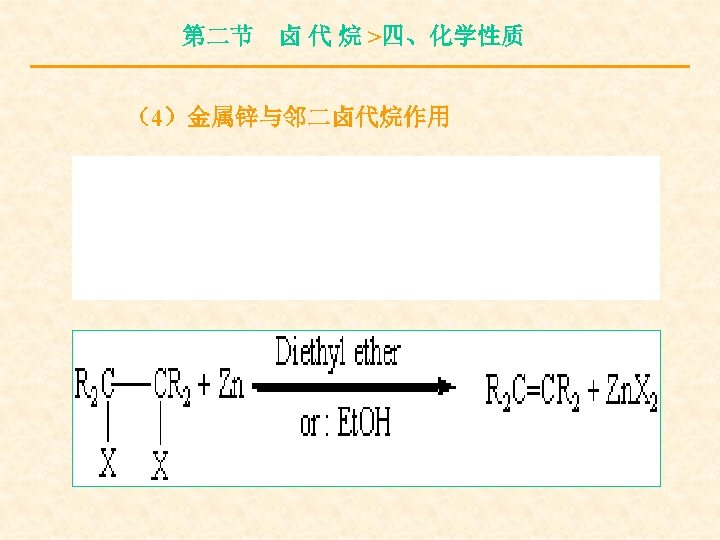
第二节 卤 代 烷 >四、化学性质 (4)金属锌与邻二卤代烷作用
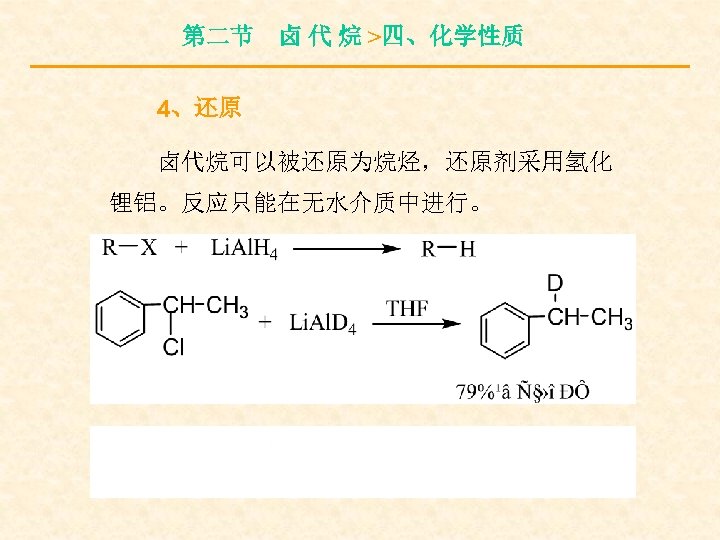
第二节 卤 代 烷 >四、化学性质 4、还原 卤代烷可以被还原为烷烃,还原剂采用氢化 锂铝。反应只能在无水介质中进行。

第二节 卤 代 烷 >五、多卤代烷的性质 多卤代烃通常分为两类: 一类是两个或两个以上的卤原子分别连在 不同的碳原子上,例如,Cl. CH 2 Cl、 Br. CH 2 CH 2 Cl等,它们的性质与卤烷相似。 另一类是多个卤原子连在同一个碳原子上, 例如CHCl 3、CCl 4、CCl 2 F 2等,其性质比较特殊。

第二节 卤 代 烷 >五、多卤代烷的性质 一般地说,同一个碳原子上堆集卤素时,由于 卤素吸电子的相互影响,使C-X键极性减少,活性明 显降低。这种卤代烷一般很稳定。例如水解反应时, 氯原子的活泼性有如下次序:CH 3 Cl > CH 2 Cl 2 > CHCl 3 > CCl 4。 烷烃溴代物的化学活性次序为:CH 3 Br〉CH 2 Br 2 〉CHBr 3 〉CBr 4。正因为多卤代烃的化学惰性和热稳 定性,可用作冷冻剂、 业溶剂、烟雾剂、灭火剂等。

第三节 亲核取代反应历程 一、双分子亲核取代反应(SN 2反应) 二、单分子亲核取代反应(SN 1反应) 三、影响亲核取代反应的因素

第三节 亲核取代反应历程 根据化学动力学的研究及许多实验表明, 卤代烷的亲核取代反应是按两种历程进行的。 即双分子亲核取代反应(SN 2反应)和单分子 亲核取代反应(SN 1反应)。

第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应) 实验证明:伯卤代烷的水解反应为SN 2历程。 因为RCH 2 Br的水解速率与RCH 2 Br和OH -的浓度有 关,所以叫做双分子亲核取代反应(SN 2反应)。
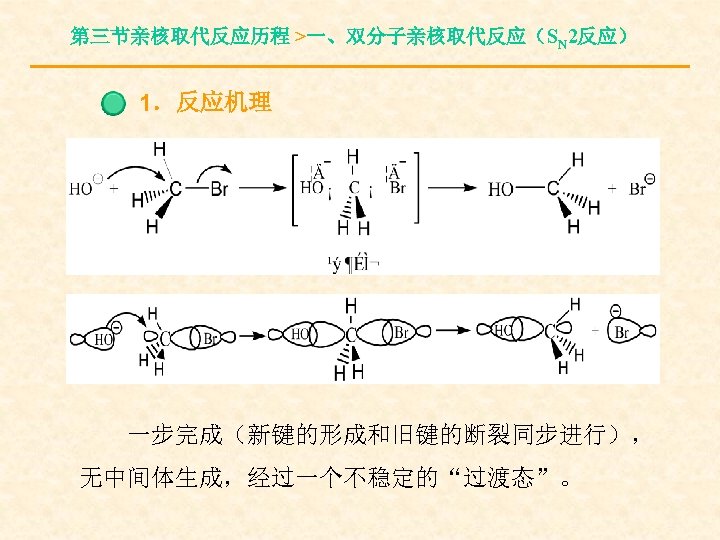
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应) 1.反应机理 一步完成(新键的形成和旧键的断裂同步进行), 无中间体生成,经过一个不稳定的“过渡态”。
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应)

第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应) 2.SN 2反应的能量变化
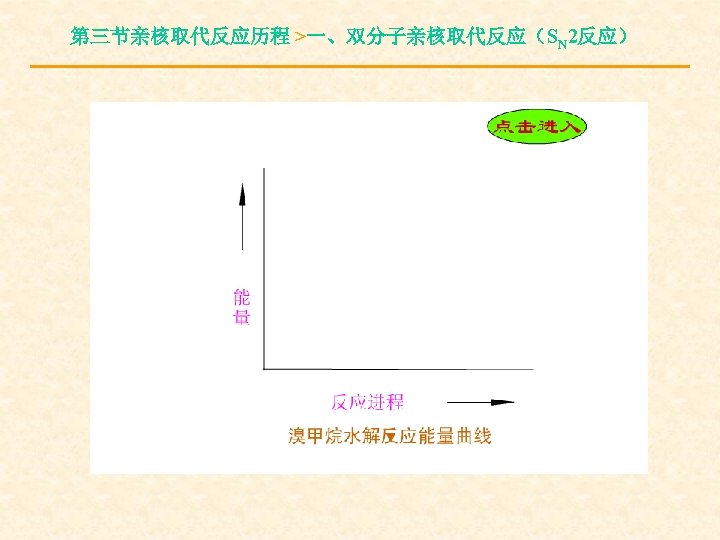
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应)
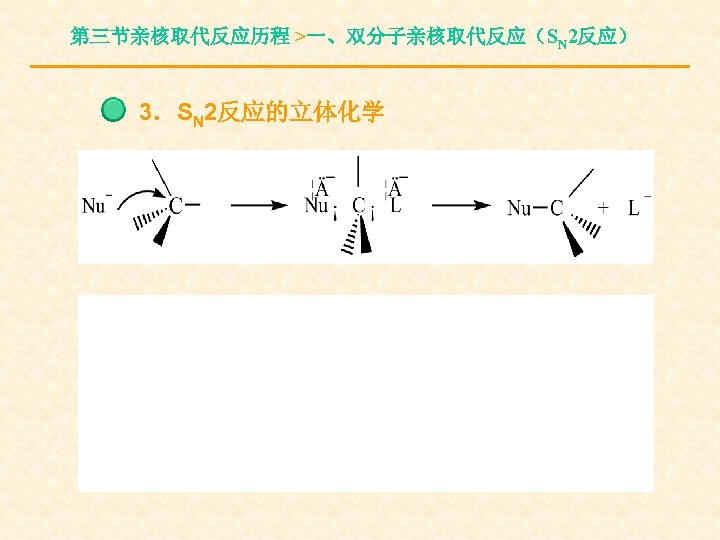
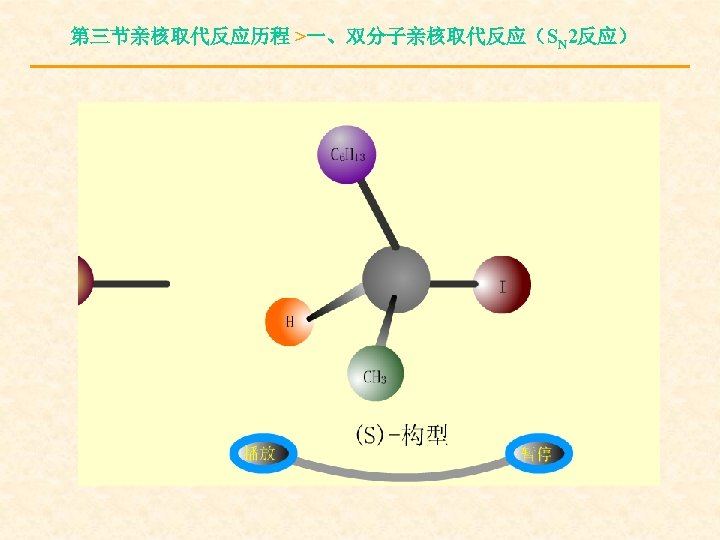
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应) 3.SN 2反应的立体化学

第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应) 构型翻转(产物的构型与底物的构型相反— —瓦尔登Walden转化)。完全的构型转化往往可 作为双分子亲核取代反应的标志。
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应)
第三节亲核取代反应历程 >一、双分子亲核取代反应(SN 2反应)

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 实验证明: 3°RX 、CH 2=CHCH 2 X 、苄卤的 水解是按SN 1历程进行的。 因其水解反应速度仅与反应物卤代烷的浓度 有关,而与亲核试剂的浓度无关,所以称为单分 子亲核取代反应(SN 1反应)。
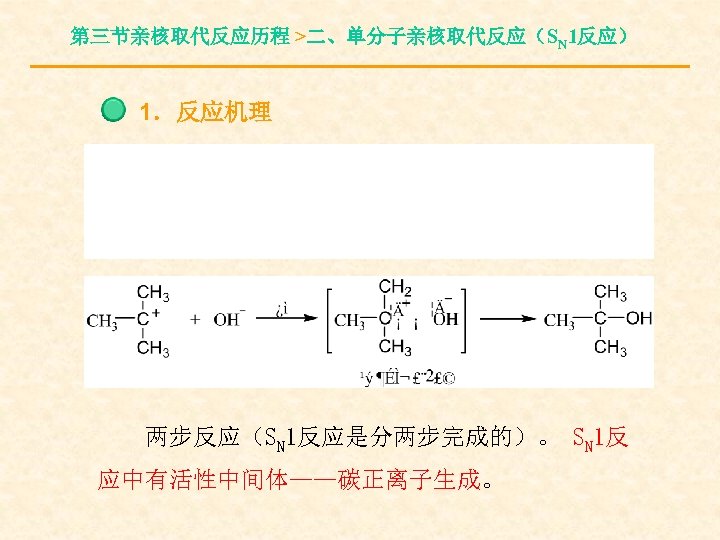
第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 1.反应机理 两步反应(SN 1反应是分两步完成的)。 SN 1反 应中有活性中间体——碳正离子生成。

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 2.SN 1反应的能量变化
第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应)

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 3.SN 1反应的立体化学 (1)外消旋化(构型翻转 + 构型保持) 碳正离子为平面构型(正电荷碳原子为sp 2杂化的 )。第二步亲核试剂向平面任何一面进攻几率相等。
第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应)

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) (2)部分外消旋化(构型翻转 > 构型保持) SN 1反应在有些情况下,往往不能完全外消旋 化,而是其构型翻转 > 构型保持,因而其反应产 物具有旋光性。

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 左旋2 -溴辛烷在SN 1条件下水解,得到 67%构型 翻转的右旋2 -辛醇,33%构型保持的左旋2 -辛醇,其 中有33%构型翻转的右旋2 -辛醇与左旋2 -辛醇组成外 消旋体,还剩下34%的右旋2 -辛醇,所以,其水解产 物有旋光性。 理论解释——离子对历程 :
第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应)

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) (3)构型完全保持 理论解释——邻近基团的参与

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 在有机化学反应中,有很多与次类似的邻近基 团参与的亲核取代反应,若反应物分子内中心碳原 子邻近有-COO-、-OR、-NR 2、-X、碳负离子等基 团存在,且空间距离适当时,这些基团就可以借助 它们的负电荷或孤电子对参与分子内的亲核取代反 应。反应结果除得到亲核取代产物外,还常常导致 环状化合物的形成。

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) 4、SN 1反应的特征——有重排产物生成

第三节亲核取代反应历程 >二、单分子亲核取代反应(SN 1反应) SN 1反应与SN 2反应的区别 SN 1 SN 2 单分子反应 双分子反应 V = K [ R-X ] V = K [R-X] [ Nu:] 两步反应 一步反应 有中间体碳正离子生成 构型翻转 + 构型保持 有重排产物 形成过渡态 构型翻转(瓦尔登转化) 无重排产物

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 1.烃基结构 (1) 对SN 1的影响 SN 1反应决定于碳正离子的形成及稳定性。碳正 离子的稳定性是: SN 1反应的速度是:

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 (2) 对SN 2反应的影响 SN 2反应决定于过渡态形成的难易。当反应中心 碳原子(α- C)上连接的烃基多时,过渡态难于 形成,SN 2反应就难于进行。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 当伯卤代烷的β位上有侧链时,取代反应速率 明显下降。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 原因: α- C原子或β- C原子上连接的烃基越多 或基团越大时,产生的空间阻碍越大,阻碍了 亲核试剂从离去基团背面进攻α- C(接近反 应中心)。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 归纳普通卤代烃的SN反应: 对SN 1反应是 3°RX > 2°RX > 1°RX > CH 3 X 对SN 2反应是 CH 3 X > 1°RX > 2°RX > 3°RX 叔卤代烷主要进行SN 1反应,伯卤代烷SN 2反应,仲卤 代烷两种历程都可,由反应条件而定。 烯丙基型卤代烃既易进行SN 1反应,也易进行SN 2反应。 桥头卤代的桥环卤代烃既难进行SN 1反应,也难进行SN 2 反应。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 2.离去基团的性质 无论是SN 1还是SN 2都是:离去基团的碱性越弱, 越易离取。 对卤素是, R-I > R-Br > R-Cl 。 碱性很强的基团(如 R 3 C -、R 2 N -、RO-、HO-等) 不能作为离去基团进行亲核取代反应,象R-OH、 ROR等,就不能直接进行亲核取代反应,只有在H+ 性条件下形成RO+H 2和RO+R后才能离去。
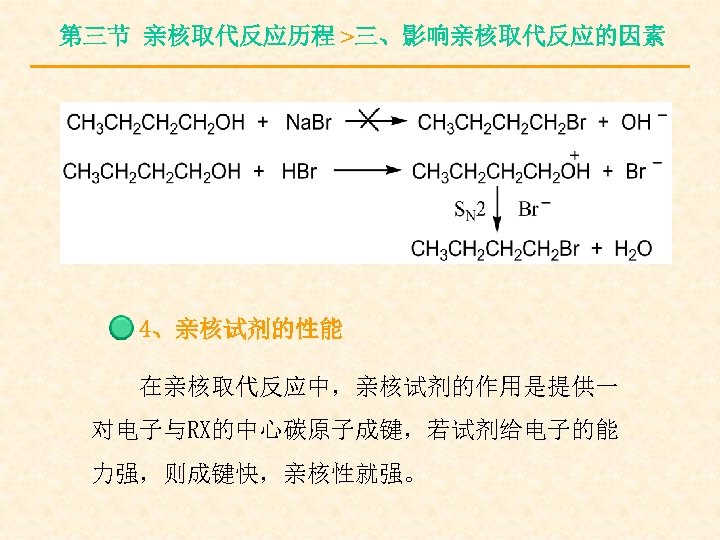
第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 4、亲核试剂的性能 在亲核取代反应中,亲核试剂的作用是提供一 对电子与RX的中心碳原子成键,若试剂给电子的能 力强,则成键快,亲核性就强。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 亲核试剂的强弱和浓度的大小对SN 1反应无明显的 影响。 亲核试剂的浓度愈大,亲核能力愈强,有利于SN 2 反应的进行。 试剂的亲核性与下列因素有关: (1)试剂所带电荷的性质 带负电荷的亲核试剂比呈中性的试剂的亲核能力 强。例如,OH - > H 2 O;RO- > ROH等。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 (2)试剂的碱性(与质子结合的能力)愈强, 亲核性(与碳原子结合的能力)也愈强。 C 2 H 5 O- > HO- > C 6 H 5 - > CH 3 COO- 同周期的:R 3 C- > R 2 N- > RO- > F- (电负 性越大,碱性越弱,越不易提供电子对)

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 (3)试剂的可极化性 碱性相近的亲核试剂,其可极化性愈大, 则亲核能力愈强。 原子半径大的原子的可极化度大。 试剂 OH-与SH– 的可极化度是 OH- < SH– , 则其亲核性是 OH- < SH– 。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 (4)溶剂化作用 ①.在醇和水这样的质子溶剂中,亲核 试剂与溶剂之间可以形成氢键,即能发生溶剂 化作用。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 ②.在非质子溶剂(DMSO, DMF)中 亲核性为: F- > Cl- > Br- > I这是因为负电荷裸露在外,正电荷被掩蔽, 它易溶剂化正离子,而不易溶剂化亲核试剂负 离子。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 5、溶剂的影响 极性溶剂:水,醇,酸,丙酮,二甲基甲酰胺, 二甲亚砜。 非极性溶剂:苯,CCl 4,烷烃类 SN 1反应,极性大有利于离解,形成正碳离子; 一般在极性溶剂中反应加快的即为SN 1反应。
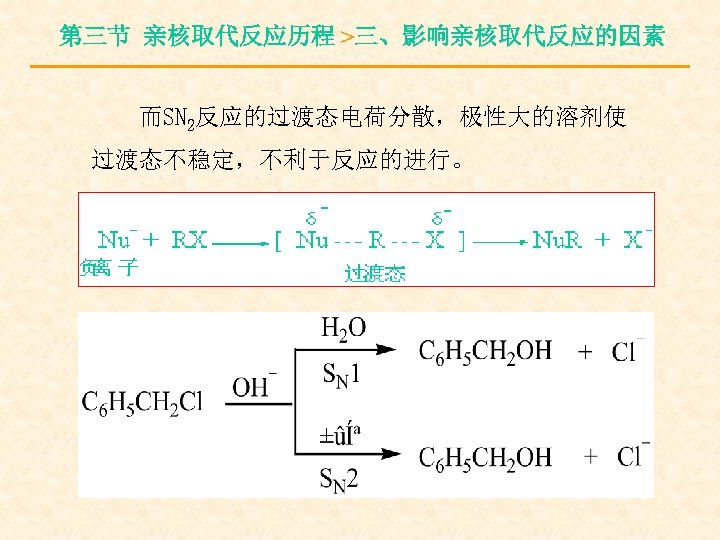
第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 而SN 2反应的过渡态电荷分散,极性大的溶剂使 过渡态不稳定,不利于反应的进行。

第三节 亲核取代反应历程 >三、影响亲核取代反应的因素 SN反应类型的判断: 常见的用来判断SN 1或SN 2反应类型的规律归纳如下: * 叔卤代烃,SN 1;伯卤代烃,SN 2 * 反应试剂为Ag. NO 3/C 2 H 5 OH ,SN 1; Na. I? 丙酮 ,SN 2 * 产物为外消旋体的,SN 1;构型改变的,SN 2 * 溶剂极性增大反应速度加快,SN 1;碱浓度增加反应速 度加快的,SN 2
第四节 一卤代烯烃和一卤代芳烃 一、分类 二、物理性质 三、化学性质
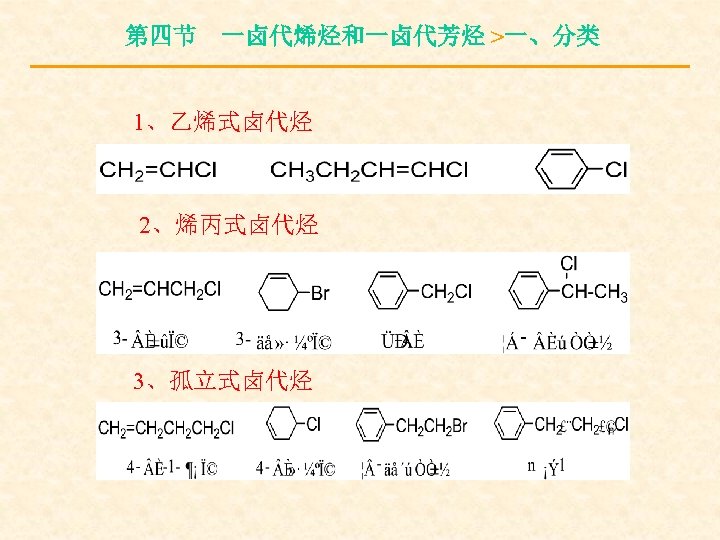
第四节 一卤代烯烃和一卤代芳烃 >一、分类 1、乙烯式卤代烃 2、烯丙式卤代烃 3、孤立式卤代烃

第四节 一卤代烯烃和一卤代芳烃 >二、物理性质 1.化学反应活性 决定于两个因素: (1)烃基的结构:烯丙式 > 孤立式 > 乙烯式 (2)卤素的性质:R-I > R-Br > R-Cl 可用不同烃基的卤代烃与Ag. NO 3 -醇溶液反应, 根据生成卤化银沉淀的快慢来测得其活性次序。

第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 综合考虑,卤代烃的化学活性为: 对烃基结构 CH 2=CHCH 2 -X > R 2 CH-X > CH 2=CH-X 3°R-X 对卤素性质 R-I > > 2°R-X R-Br > 1°R-X > R-Cl
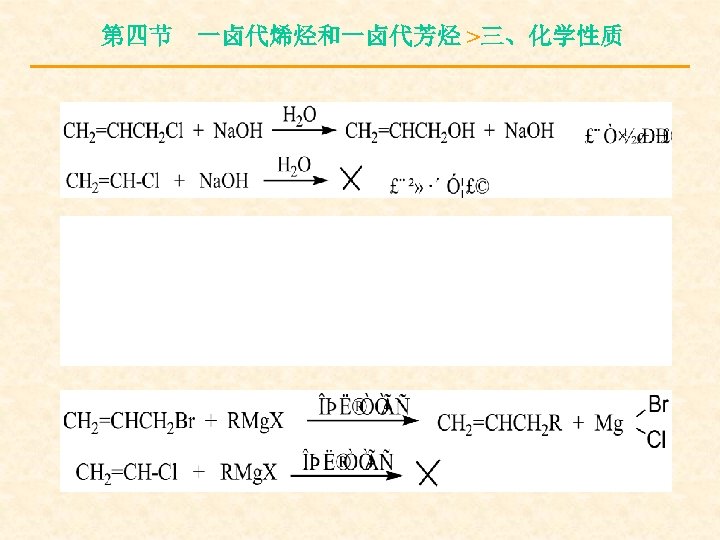
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质

第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 2.活性差异的原因: (1)乙烯式不活泼的原因 卤原子上的未共用电子对与双键的π电子云 形成了P-π共轭体系(富电子P-π共轭)。
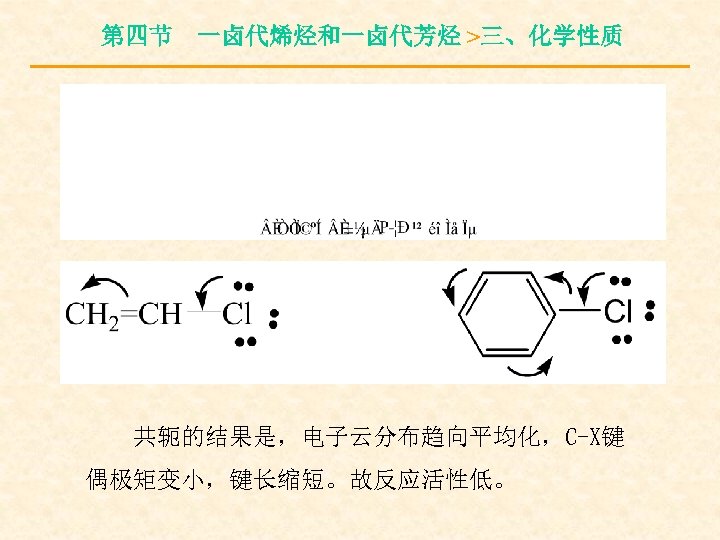
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 共轭的结果是,电子云分布趋向平均化,C-X键 偶极矩变小,键长缩短。故反应活性低。
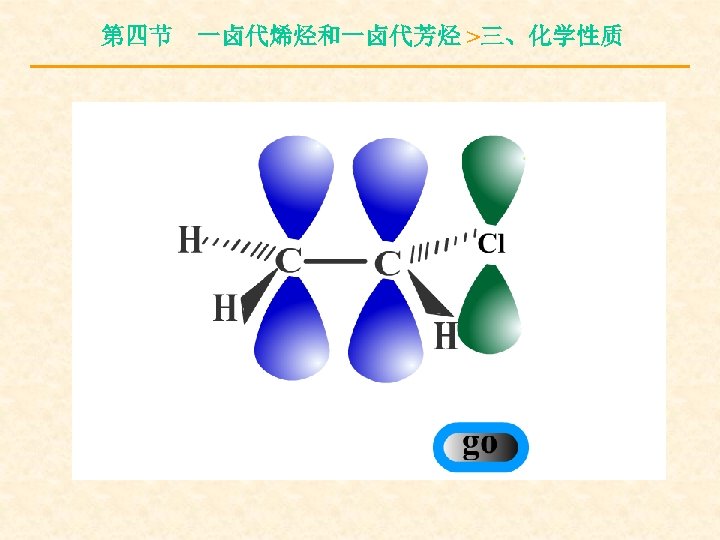
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质
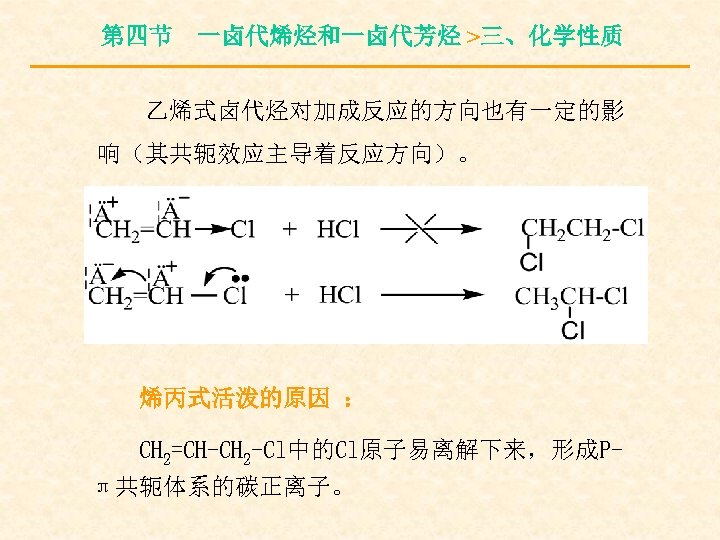
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 乙烯式卤代烃对加成反应的方向也有一定的影 响(其共轭效应主导着反应方向)。 烯丙式活泼的原因 : CH 2=CH-CH 2 -Cl中的Cl原子易离解下来,形成Pπ共轭体系的碳正离子。

第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 由于形成P-π共轭体系,正电荷得到分散(不在集 中在一个碳原子上),使体系趋于稳定,因此有利于SN 1 的进行。 当烯丙式卤代烃按SN 2历程发生反应时,由于α-碳 相邻π键的存在,可以和过渡态电子云交盖,使过渡态 能量降低,因而也有利于SN 2反应的进行。
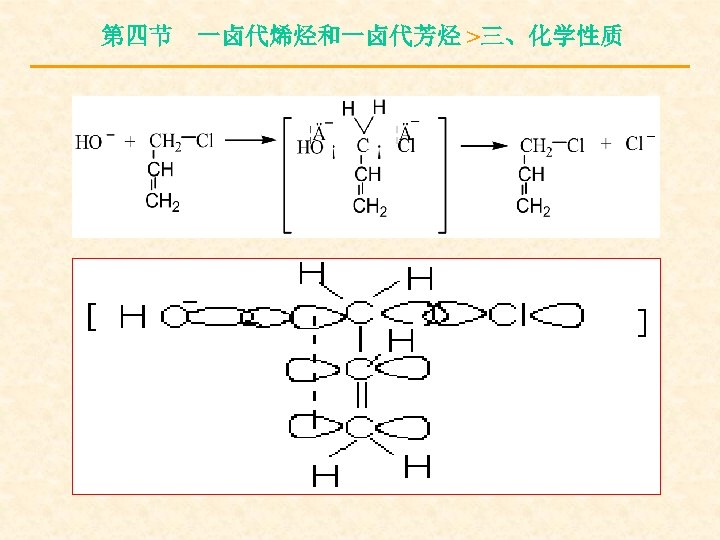
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质

第四节 一卤代烯烃和一卤代芳烃 >三、化学性质
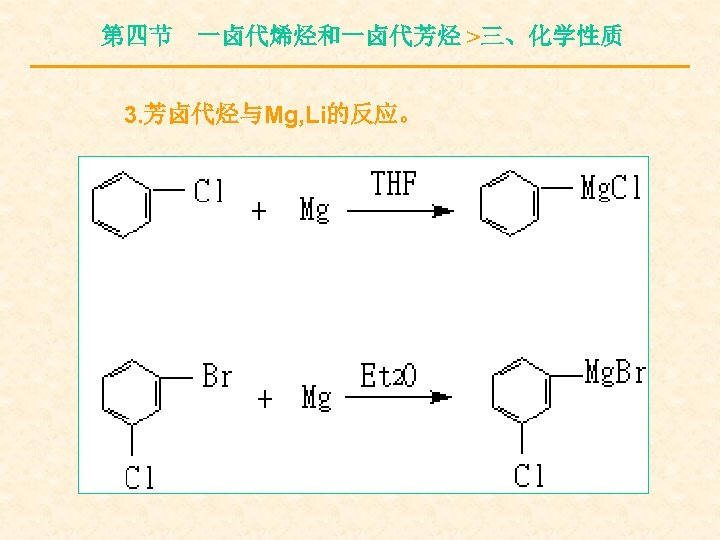
第四节 一卤代烯烃和一卤代芳烃 >三、化学性质 3. 芳卤代烃与Mg, Li的反应。
第五节 卤代烃的制法 一、由烃制备 二、由醇制备 三、卤代烷的互换

第五节 卤代烃的制法 >一、由烃制备 以前已讲过的方法有: 1.烷烃、芳烃侧链的光卤代(Cl、Br); 2. 烯烃α-H的高温卤代; 3.芳烃的卤代(Fe催化),亲电取代; 4.烯、炔加HX、X,亲电加成; 再讲几种特殊制法:
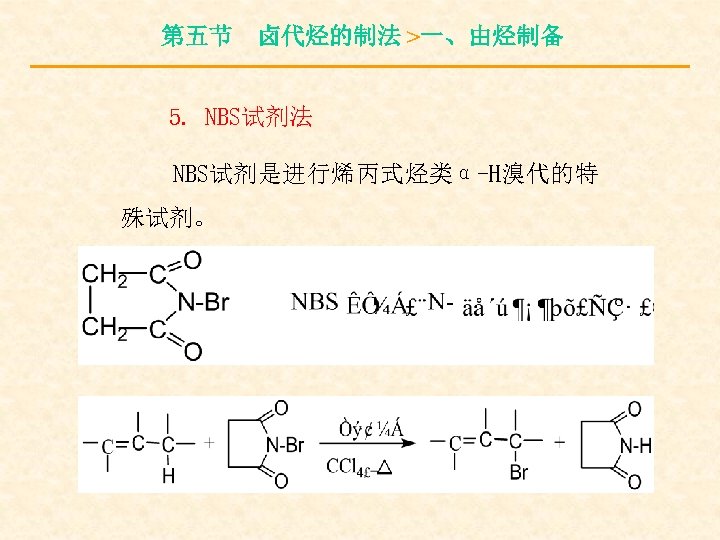
第五节 卤代烃的制法 >一、由烃制备 5. NBS试剂法 NBS试剂是进行烯丙式烃类α-H溴代的特 殊试剂。
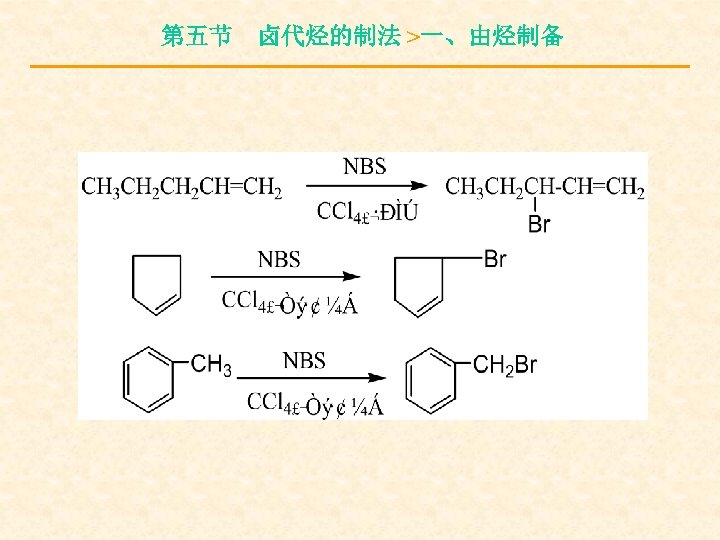
第五节 卤代烃的制法 >一、由烃制备

第五节 卤代烃的制法 >一、由烃制备 反应有两个特点: (1) 反应条件低,低温即可。 (2) 产物纯度高,付反应少。 取代话性: 3°H > 2°H > 1°H
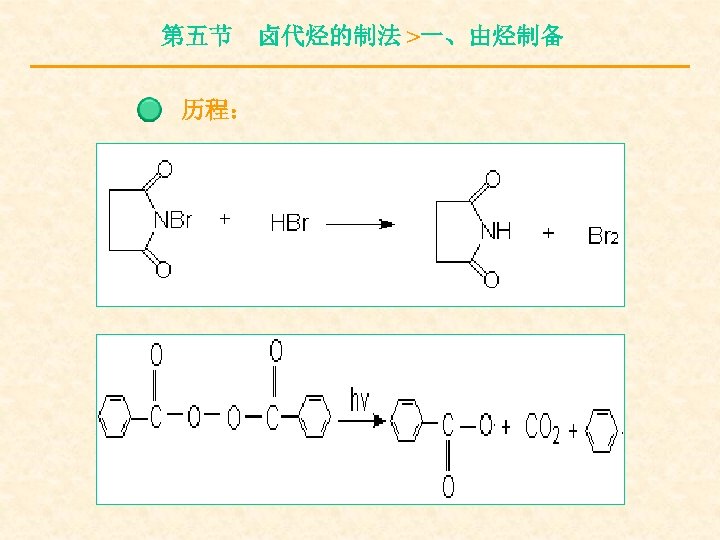
第五节 卤代烃的制法 >一、由烃制备 历程:
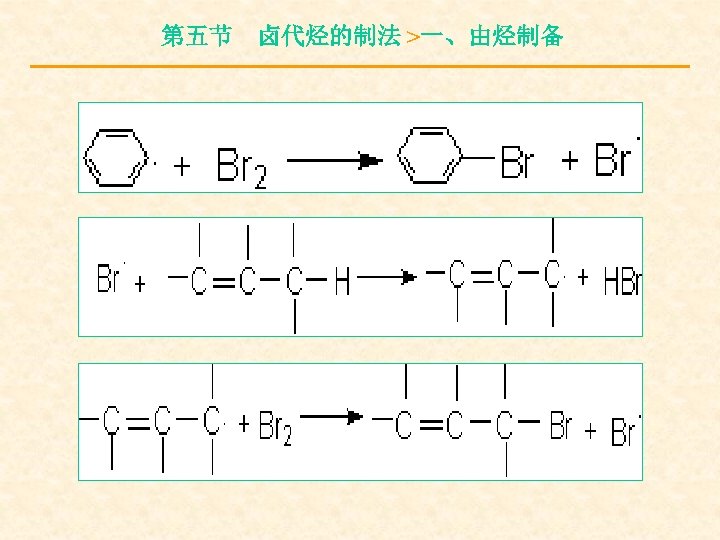
第五节 卤代烃的制法 >一、由烃制备
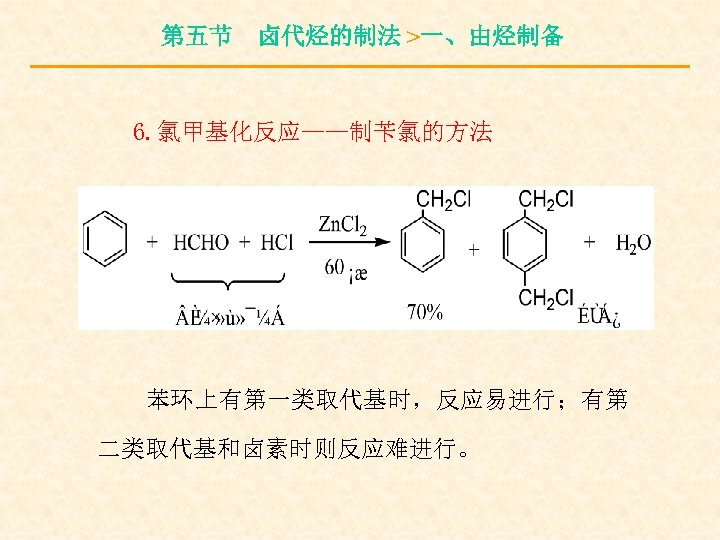
第五节 卤代烃的制法 >一、由烃制备 6. 氯甲基化反应——制苄氯的方法 苯环上有第一类取代基时,反应易进行;有第 二类取代基和卤素时则反应难进行。

第五节 卤代烃的制法 >二、由醇制备 1.醇与HX作用 2.醇与卤化磷作用
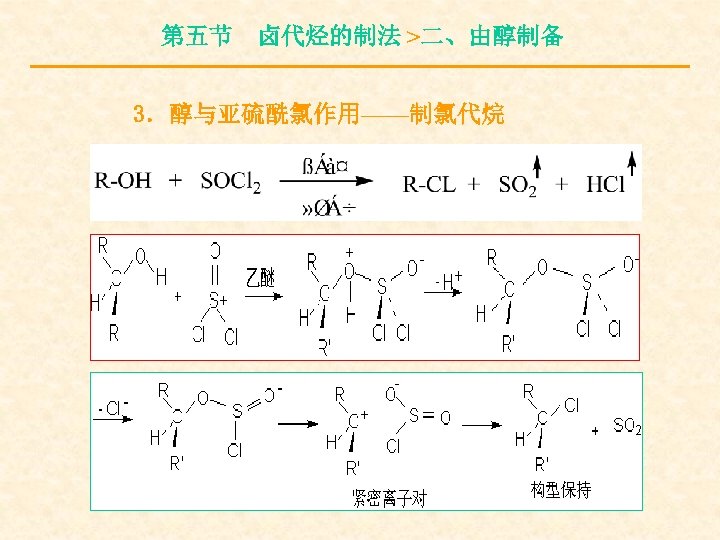
第五节 卤代烃的制法 >二、由醇制备 3.醇与亚硫酰氯作用——制氯代烷
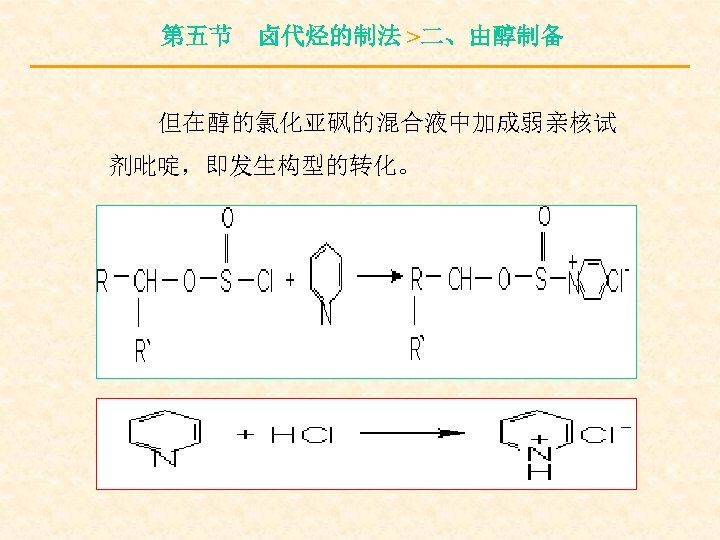
第五节 卤代烃的制法 >二、由醇制备 但在醇的氯化亚砜的混合液中加成弱亲核试 剂吡啶,即发生构型的转化。
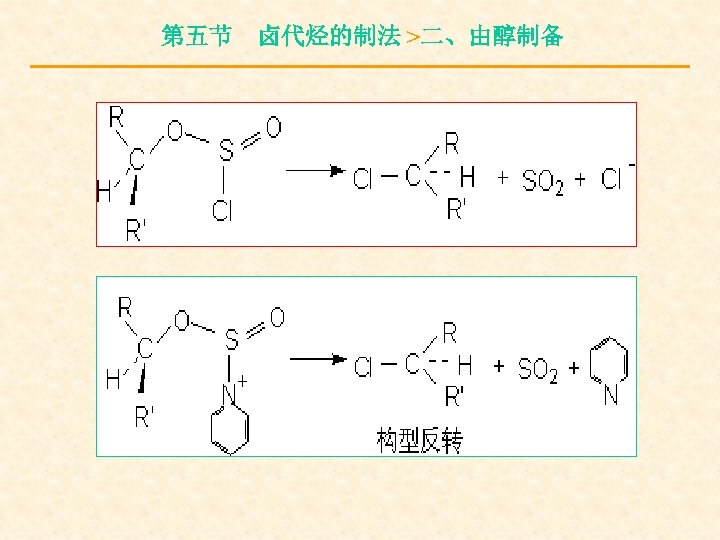
第五节 卤代烃的制法 >二、由醇制备

第五节 卤代烃的制法 >三、卤代烷的互换 这是一个可逆反应,通常将氯代烷或溴代烷 的丙酮溶液与碘化钠共热,由于碘化钠(碘化钾) 溶于丙酮后反应生成的 Na. Cl, Na. Br, KCl, KBr 的溶解度很小,这样可使平衡向右移动促使反应 继续进行。
第六节 重要的卤代烃 一、三氯甲烷 二、四氯化碳 三、氯苯 四、氯乙烯
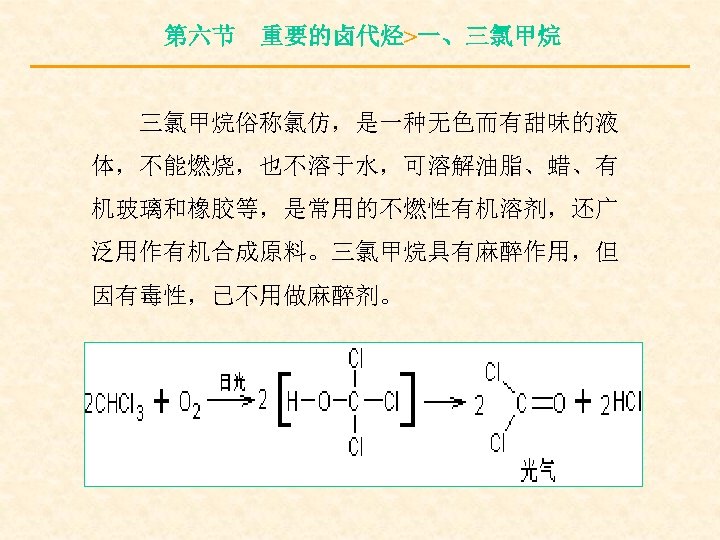
第六节 重要的卤代烃>一、三氯甲烷俗称氯仿,是一种无色而有甜味的液 体,不能燃烧,也不溶于水,可溶解油脂、蜡、有 机玻璃和橡胶等,是常用的不燃性有机溶剂,还广 泛用作有机合成原料。三氯甲烷具有麻醉作用,但 因有毒性,已不用做麻醉剂。
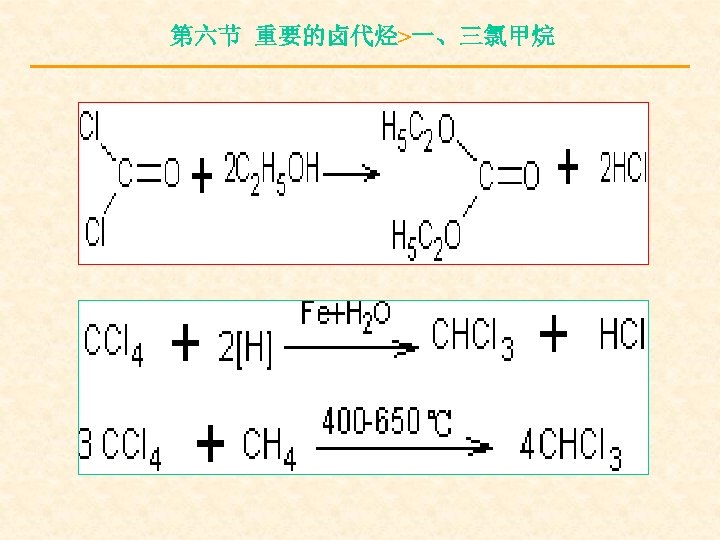
第六节 重要的卤代烃>一、三氯甲烷
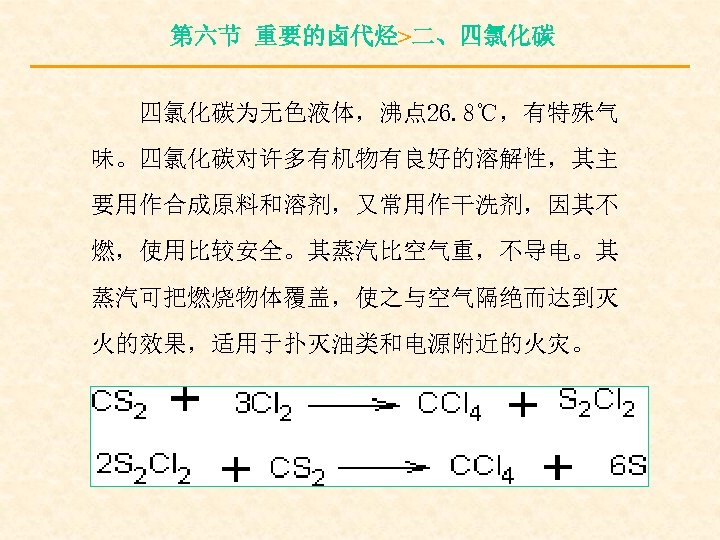
第六节 重要的卤代烃>二、四氯化碳为无色液体,沸点 26. 8℃,有特殊气 味。四氯化碳对许多有机物有良好的溶解性,其主 要用作合成原料和溶剂,又常用作干洗剂,因其不 燃,使用比较安全。其蒸汽比空气重,不导电。其 蒸汽可把燃烧物体覆盖,使之与空气隔绝而达到灭 火的效果,适用于扑灭油类和电源附近的火灾。
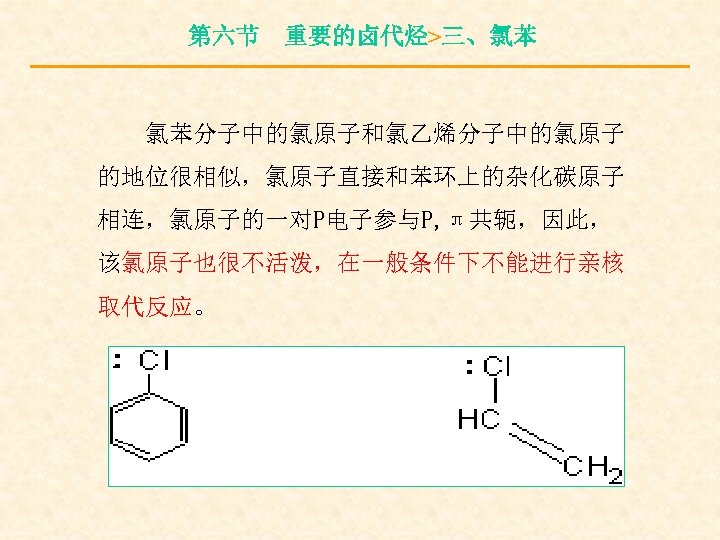
第六节 重要的卤代烃>三、氯苯 氯苯分子中的氯原子和氯乙烯分子中的氯原子 的地位很相似,氯原子直接和苯环上的杂化碳原子 相连,氯原子的一对P电子参与P, π共轭,因此, 该氯原子也很不活泼,在一般条件下不能进行亲核 取代反应。
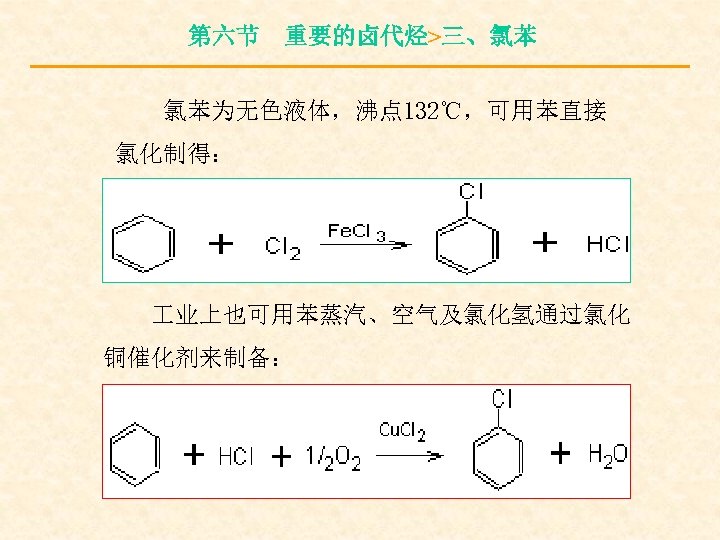
第六节 重要的卤代烃>三、氯苯 氯苯为无色液体,沸点 132℃,可用苯直接 氯化制得: 业上也可用苯蒸汽、空气及氯化氢通过氯化 铜催化剂来制备:
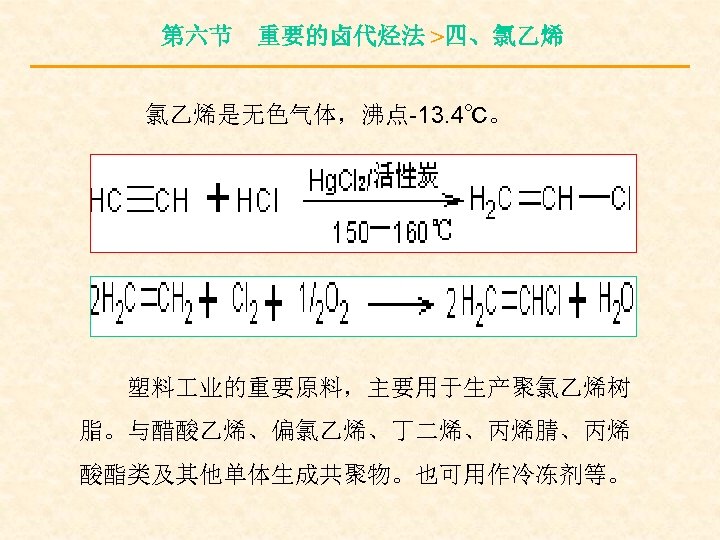
第六节 重要的卤代烃法 >四、氯乙烯 氯乙烯是无色气体,沸点-13. 4℃。 塑料 业的重要原料,主要用于生产聚氯乙烯树 脂。与醋酸乙烯、偏氯乙烯、丁二烯、丙烯腈、丙烯 酸酯类及其他单体生成共聚物。也可用作冷冻剂等。
第七节 有机氟化物 一、有机氟化物的特性 二、氟化合物
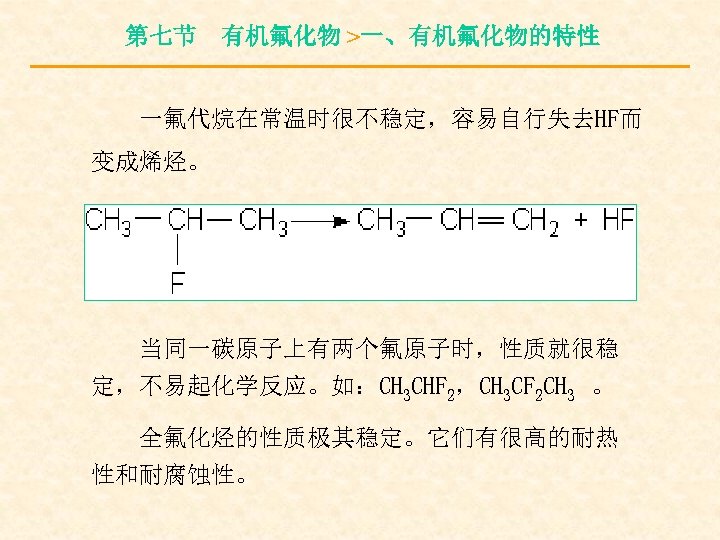
第七节 有机氟化物 >一、有机氟化物的特性 一氟代烷在常温时很不稳定,容易自行失去HF而 变成烯烃。 当同一碳原子上有两个氟原子时,性质就很稳 定,不易起化学反应。如:CH 3 CHF 2,CH 3 CF 2 CH 3 。 全氟化烃的性质极其稳定。它们有很高的耐热 性和耐腐蚀性。

第七节 有机氟化物 >二、氟化合物 1、二氟二氯甲烷是无色、无臭、无毒、无腐蚀性, 化学性质稳定的气体。沸点-29. 8℃,易压缩成不燃烧 性液体,商品名称氟里昂-12或F 12。因被压缩成液体 的二氟二氯甲烷解压后又立刻气化,同时吸收大量的 热,因此被广泛用作致冷剂、喷雾剂和灭火剂等。
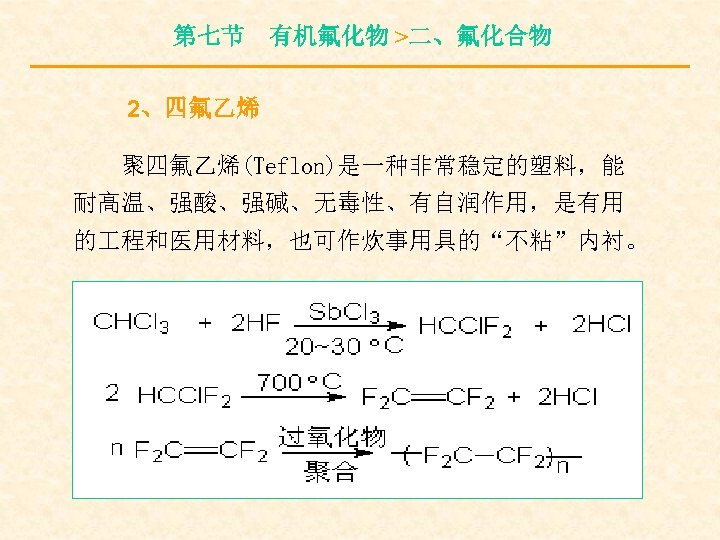
第七节 有机氟化物 >二、氟化合物 2、四氟乙烯 聚四氟乙烯(Teflon)是一种非常稳定的塑料,能 耐高温、强酸、强碱、无毒性、有自润作用,是有用 的 程和医用材料,也可作炊事用具的“不粘”内衬。

第七节 有机氟化物 >二、氟化合物 作喷雾剂推进剂或制冷剂的氯氟烃对地球周围 的臭氧有破坏作用,臭氧层能虑除致皮肤癌的太阳 紫外线,对人体健康有重要作用。有些国家也开始 禁止使用含氯氟烃作为推进剂的喷雾剂。 FXXX代号表示,F表示它是一个氟代烃。F右下角 的数字,个位氟原子,十位氢原子数加一,百位数 碳原子数减一。如:F— 12(CCl 2 F 2)
47304fc9d7a6eaae2f255fa2d058cf5b.ppt