Опухолевые заболевания.ppt
- Количество слайдов: 71
 Злокачественные опухоли – это результат перерождения клеток, характеризующийся утратой нормальной регуляции роста, что проявляется бесконтрольным размножением клеток, отсутствием их дифференцировки, способностью к инвазии тканей и метастазированию
Злокачественные опухоли – это результат перерождения клеток, характеризующийся утратой нормальной регуляции роста, что проявляется бесконтрольным размножением клеток, отсутствием их дифференцировки, способностью к инвазии тканей и метастазированию
 Механизмы возникновения опухолей § Опухолевая трансформация связана с единичными или множественными мутациями ДНК в хромосомах, что проявляется в виде § делеции § транслокации, § дупликации § точечных мутаций отдельных генов § В результате трансформированная клетка получает пролиферативное преимущество и создает опухолевый клон
Механизмы возникновения опухолей § Опухолевая трансформация связана с единичными или множественными мутациями ДНК в хромосомах, что проявляется в виде § делеции § транслокации, § дупликации § точечных мутаций отдельных генов § В результате трансформированная клетка получает пролиферативное преимущество и создает опухолевый клон
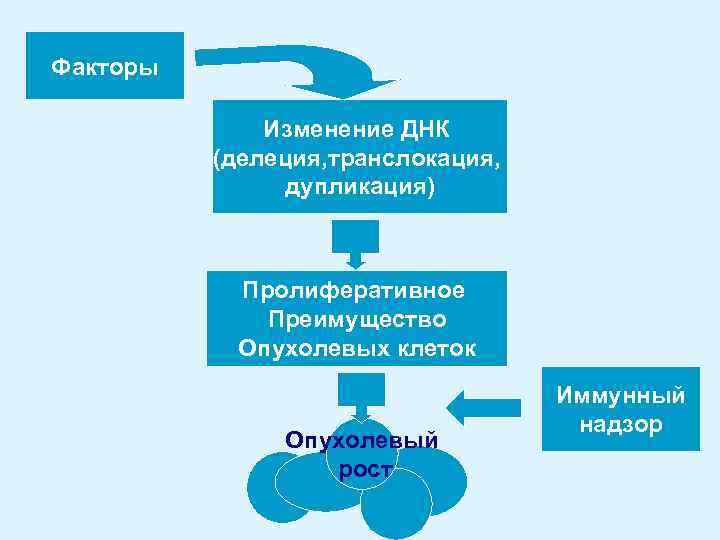 Факторы Изменение ДНК (делеция, транслокация, дупликация) Пролиферативное Преимущество Опухолевых клеток Опухолевый рост Иммунный надзор
Факторы Изменение ДНК (делеция, транслокация, дупликация) Пролиферативное Преимущество Опухолевых клеток Опухолевый рост Иммунный надзор
 К опухолевой трансформации приводят мутации не случайных генов, а тех, нарушение которых дает пролиферативное преимущество трансформированной клетке Существует определенная последовательность генетических изменений при возникновении опухоли и опухолевой прогрессии
К опухолевой трансформации приводят мутации не случайных генов, а тех, нарушение которых дает пролиферативное преимущество трансформированной клетке Существует определенная последовательность генетических изменений при возникновении опухоли и опухолевой прогрессии
 Фазы опухолевой трансформации 1. Фаза иммортализации. Появление мутаций, обеспечивающих повышенную выживаемость клеток 2. Фаза индукции опухолевого роста. Включаются механизмы аутокринного поддержания клеточного роста 3. Фаза генетических изменений. Отражает эволюцию опухолевых клеток
Фазы опухолевой трансформации 1. Фаза иммортализации. Появление мутаций, обеспечивающих повышенную выживаемость клеток 2. Фаза индукции опухолевого роста. Включаются механизмы аутокринного поддержания клеточного роста 3. Фаза генетических изменений. Отражает эволюцию опухолевых клеток
 Контролирующие гены § 1 группа генов ответственна за первичные трансформирующие события. § 2 группа генов обеспечивает гиперпродукцию аутокринных факторов роста § 3 группа генов отражает эволюцию опухолевого клона
Контролирующие гены § 1 группа генов ответственна за первичные трансформирующие события. § 2 группа генов обеспечивает гиперпродукцию аутокринных факторов роста § 3 группа генов отражает эволюцию опухолевого клона
 Регуляция клеточного цикла Циклинзависимые киназы (циклины) § обеспечивают позитивную регуляцию клеточного цикла, т. е. пролиферацию клеток § активируют гены, ответственные за ингибицию апотоза Ингибиторы циклинзависимых киназ § подавляют деление клеток § активируют гены, опосредующие апоптоз § активируют геныингибиторы опухолевого роста (р53, Rb)
Регуляция клеточного цикла Циклинзависимые киназы (циклины) § обеспечивают позитивную регуляцию клеточного цикла, т. е. пролиферацию клеток § активируют гены, ответственные за ингибицию апотоза Ингибиторы циклинзависимых киназ § подавляют деление клеток § активируют гены, опосредующие апоптоз § активируют геныингибиторы опухолевого роста (р53, Rb)
 Трансформация генов при опухолях Нозологическая форма Лимфомы мантиевой зоны Злокачественные лимфомы (80%) Повышенная активность Утрата Циклин D 1/bcl-1 (t 11, 14) Bcl-2 (t 14, 18) Колоректальный рак, рак молочной железы, легких, остеосаркома CDKN 2/p 16, p 53, RB 1 - делеции, точ. мутации в 17, 18 хромосомах p 53, RB 1 - делеция аллелей 17 p, 18 q Опухоли мозга, саркома, глиобластома CDK 4 (t 12 q, 13) Колоректальный рак Циклин D 2( t 2 p, 13)
Трансформация генов при опухолях Нозологическая форма Лимфомы мантиевой зоны Злокачественные лимфомы (80%) Повышенная активность Утрата Циклин D 1/bcl-1 (t 11, 14) Bcl-2 (t 14, 18) Колоректальный рак, рак молочной железы, легких, остеосаркома CDKN 2/p 16, p 53, RB 1 - делеции, точ. мутации в 17, 18 хромосомах p 53, RB 1 - делеция аллелей 17 p, 18 q Опухоли мозга, саркома, глиобластома CDK 4 (t 12 q, 13) Колоректальный рак Циклин D 2( t 2 p, 13)
 ФАКТОРЫ, ИНДУЦИРУЮЩИЕ МУТАЦИИ ГЕНОВ Вирус ные Агенты Содержат онгоген, Вирус папиломы (рак который встраиваясь шейки матки), в геном человека, цитомегаловирус приводит к изменению (саркома Капоши), активности вирус Эпштейн-Барра регуляторных генов. (лимфома Беркита, Белковые продукты рак носоглотки) встроенного гена Ретровирусы (Тспособствуют клеточные лимфомы) выживанию трансформированной клетки через подавление иммунитета
ФАКТОРЫ, ИНДУЦИРУЮЩИЕ МУТАЦИИ ГЕНОВ Вирус ные Агенты Содержат онгоген, Вирус папиломы (рак который встраиваясь шейки матки), в геном человека, цитомегаловирус приводит к изменению (саркома Капоши), активности вирус Эпштейн-Барра регуляторных генов. (лимфома Беркита, Белковые продукты рак носоглотки) встроенного гена Ретровирусы (Тспособствуют клеточные лимфомы) выживанию трансформированной клетки через подавление иммунитета
 ФАКТОРЫ, ИНДУЦИРУЮЩИЕ МУТАЦИИ ГЕНОВ § Химические канцерогены § УФО и ионизирующее излучение § Способны вызывать генетическую трансформацию клетки. Вещества окружающей среды (мышьяк, асбест, бензол, соли хромовой кислоты, алкоголь, табак и др. ) § Вызывают нестабильность генома (атомные взрывы в Японии, авария в Чернобыле)
ФАКТОРЫ, ИНДУЦИРУЮЩИЕ МУТАЦИИ ГЕНОВ § Химические канцерогены § УФО и ионизирующее излучение § Способны вызывать генетическую трансформацию клетки. Вещества окружающей среды (мышьяк, асбест, бензол, соли хромовой кислоты, алкоголь, табак и др. ) § Вызывают нестабильность генома (атомные взрывы в Японии, авария в Чернобыле)
 Опухолевые антигены § Опухолеассоциированные антигены (ОАА) – антигены, ассоциированные с опухолевыми клетками, но могут присутствовать в небольших количествах и на нормальных клетках § Опухолеспецифические антигены (ОСА) – антигены, присутствующие исключительно на трансформированных клетках и отсутствующие на нормальных клетках
Опухолевые антигены § Опухолеассоциированные антигены (ОАА) – антигены, ассоциированные с опухолевыми клетками, но могут присутствовать в небольших количествах и на нормальных клетках § Опухолеспецифические антигены (ОСА) – антигены, присутствующие исключительно на трансформированных клетках и отсутствующие на нормальных клетках
 Основные типы опухолевых антигенов § Поверхностные опухолевые трансплантационные антигены (TSTA) § Вирусспецифические и вирусиндуцированные антигены § Раковоэмбриональные антигены (альфафетопротеин, альфа-фетоглобулин, гликопротеин) § Утрата или появление антигенов, свойственных нормальным клеткам, но другой органной или тканевой специфичности
Основные типы опухолевых антигенов § Поверхностные опухолевые трансплантационные антигены (TSTA) § Вирусспецифические и вирусиндуцированные антигены § Раковоэмбриональные антигены (альфафетопротеин, альфа-фетоглобулин, гликопротеин) § Утрата или появление антигенов, свойственных нормальным клеткам, но другой органной или тканевой специфичности
 Опухолевая трансформация антигенов § антигенное упрощение – выключение изоантигенов, определяющих антигенный профиль нормальной ткани § антигенная дивергенция – замена одного антигенного профиля нормальной ткани на антигенный профиль, свойственный другой ткани § реверсия антигенов – появление генов, определяемых только в эмбриональном состоянии
Опухолевая трансформация антигенов § антигенное упрощение – выключение изоантигенов, определяющих антигенный профиль нормальной ткани § антигенная дивергенция – замена одного антигенного профиля нормальной ткани на антигенный профиль, свойственный другой ткани § реверсия антигенов – появление генов, определяемых только в эмбриональном состоянии
 Иммунодиагностика § В экспериментах на животных четко доказан иммунный ответ на спонтанные и индуцированные опухоли § У человека ОА выявлены при лимфоме Беркита, нейробластоме, меланоме, остеосаркоме и ряде опухолей желудочнокишечного тракта § Опухолевые клетки выделяют в кровоток антигенные молекулы, которые можно обнаружить методами иммунодиагностики
Иммунодиагностика § В экспериментах на животных четко доказан иммунный ответ на спонтанные и индуцированные опухоли § У человека ОА выявлены при лимфоме Беркита, нейробластоме, меланоме, остеосаркоме и ряде опухолей желудочнокишечного тракта § Опухолевые клетки выделяют в кровоток антигенные молекулы, которые можно обнаружить методами иммунодиагностики
 В клинической практике определяют §Карцино-эмбриональный антиген (рак толстой кишки) §α-фетопротеин (опухоли печени, яичек и яичников) §β-субъединица хорионического гонадотропина (хорионэпителиома, пузырный занос) §Антиген простаты – гликопротеин предстательной железы (рак предстательной железы, иногда - при аденоме простаты)
В клинической практике определяют §Карцино-эмбриональный антиген (рак толстой кишки) §α-фетопротеин (опухоли печени, яичек и яичников) §β-субъединица хорионического гонадотропина (хорионэпителиома, пузырный занос) §Антиген простаты – гликопротеин предстательной железы (рак предстательной железы, иногда - при аденоме простаты)
 Опухолевый диагностический маркер должен - присутствовать только в опухолевой ткани - выявляться на ранних этапах опухолевого роста - коррелировать с размерами опухолевой ткани - присутствовать у всех больных с данным заболеванием !!!
Опухолевый диагностический маркер должен - присутствовать только в опухолевой ткани - выявляться на ранних этапах опухолевого роста - коррелировать с размерами опухолевой ткани - присутствовать у всех больных с данным заболеванием !!!
 Реакция организма на опухоль Возникновение опухоли является нарушением антигенного гомеостаза и вызывает ответную реакцию, направленную на элиминацию трансформированных опухолевых клеток и восстановление антигенного постоянства Противоопухолевый иммунитет реализуется с участием реакций врожденного и приобретенного иммунитета , опосредуется как клеточными, так и гуморальными факторами. При этом ведущим механизмом противоопухолевой защиты является цитотоксическая активность.
Реакция организма на опухоль Возникновение опухоли является нарушением антигенного гомеостаза и вызывает ответную реакцию, направленную на элиминацию трансформированных опухолевых клеток и восстановление антигенного постоянства Противоопухолевый иммунитет реализуется с участием реакций врожденного и приобретенного иммунитета , опосредуется как клеточными, так и гуморальными факторами. При этом ведущим механизмом противоопухолевой защиты является цитотоксическая активность.
 Механизмы противоопухолевой защиты Клеточный иммунитет 1. Врожденный (неспецифический) иммунитет § натуральные киллерные клетки (НК) § моноциты/макрофаги 2. Приобретенный(специфический) иммунитет § цитотоксические лимфоциты (ЦТЛ) § эффекторы ГЗТ Гуморальный иммунитет § Опухолеспецифические антитела
Механизмы противоопухолевой защиты Клеточный иммунитет 1. Врожденный (неспецифический) иммунитет § натуральные киллерные клетки (НК) § моноциты/макрофаги 2. Приобретенный(специфический) иммунитет § цитотоксические лимфоциты (ЦТЛ) § эффекторы ГЗТ Гуморальный иммунитет § Опухолеспецифические антитела
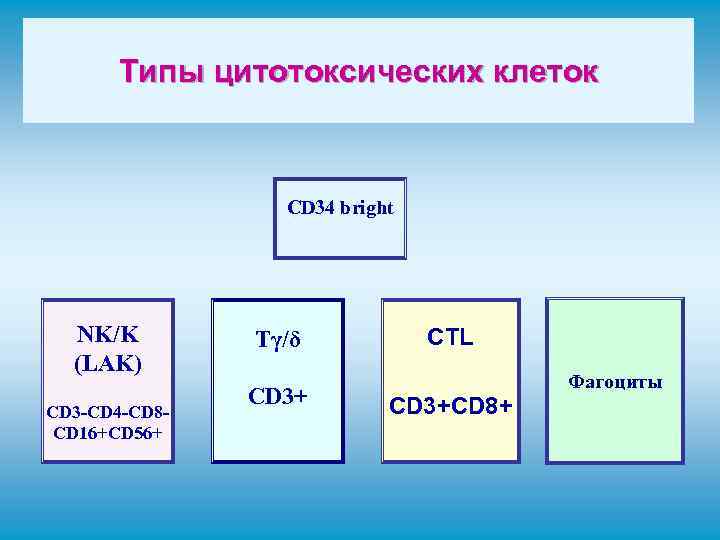 Типы цитотоксических клеток CD 34 bright NK/K (LAK) CD 3 -CD 4 -CD 8 CD 16+CD 56+ Tγ/δ CD 3+ CTL CD 3+CD 8+ Фагоциты
Типы цитотоксических клеток CD 34 bright NK/K (LAK) CD 3 -CD 4 -CD 8 CD 16+CD 56+ Tγ/δ CD 3+ CTL CD 3+CD 8+ Фагоциты
 Роль цитотоксических клеток 1. Противоопухолевая защита 2. (лизис трансформированных опухолевых клеток) 3. 2. Противоинфекционный иммунитет (разрушение 4. вирус-инфицированных клеток) 5. 3. Иммунорегуляторная функция 6. 4. Регуляция гомеостаза (участие в индукции 7. толерантности при беременности)
Роль цитотоксических клеток 1. Противоопухолевая защита 2. (лизис трансформированных опухолевых клеток) 3. 2. Противоинфекционный иммунитет (разрушение 4. вирус-инфицированных клеток) 5. 3. Иммунорегуляторная функция 6. 4. Регуляция гомеостаза (участие в индукции 7. толерантности при беременности)
 НКК § НК несут эмбриональную конфигурацию δ-цепи Тклеточного рецептора (подтверждено в экспериментах по клонированию НКК) § Морфологически представляют большие гранулярные лимфоциты (БГЛ) с азурофильной зернистостью § Обладают неристриктированной по ГКГС цитотоксической активностью § Лизируют широкий спектр клеток-мишеней, включая не только опухолевые, но и некоторые нормальные клетки § Способность к лизису без предварительной сенсибилизации и без наличия антител § Кратковременность экспозиции НКК с клеткамимишенями
НКК § НК несут эмбриональную конфигурацию δ-цепи Тклеточного рецептора (подтверждено в экспериментах по клонированию НКК) § Морфологически представляют большие гранулярные лимфоциты (БГЛ) с азурофильной зернистостью § Обладают неристриктированной по ГКГС цитотоксической активностью § Лизируют широкий спектр клеток-мишеней, включая не только опухолевые, но и некоторые нормальные клетки § Способность к лизису без предварительной сенсибилизации и без наличия антител § Кратковременность экспозиции НКК с клеткамимишенями
 q. Наивысшая НК-активность выявлена у лимфоцитов в периферической крови. Далее - у клеток грудного протока, лимфоузлов, селезенки, миндалин. q. В периферической крови насчитывается около 10 -15% НКК, которые морфологически представлены большими гранулярными лимфоцитами (CD 3 -CD 56+). Среди МНК около 5% клеток коэкспрессируют CD 3 и CD 56 молекулы. Это цитотоксические Т-лимфоциты с натуральной киллерной активностью. q. НКК описаны у всех млекопитающих, птиц, рыб и даже у простейших: морские звезды, земляные черви.
q. Наивысшая НК-активность выявлена у лимфоцитов в периферической крови. Далее - у клеток грудного протока, лимфоузлов, селезенки, миндалин. q. В периферической крови насчитывается около 10 -15% НКК, которые морфологически представлены большими гранулярными лимфоцитами (CD 3 -CD 56+). Среди МНК около 5% клеток коэкспрессируют CD 3 и CD 56 молекулы. Это цитотоксические Т-лимфоциты с натуральной киллерной активностью. q. НКК описаны у всех млекопитающих, птиц, рыб и даже у простейших: морские звезды, земляные черви.
 Генетическая регуляция НКК
Генетическая регуляция НКК
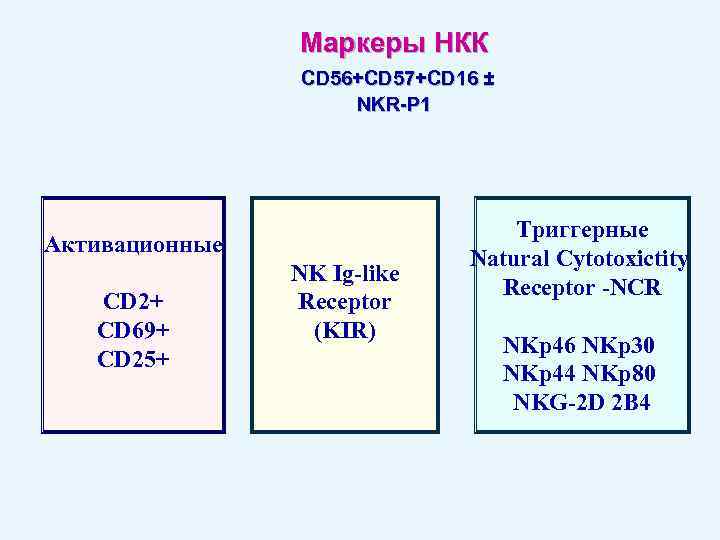 Маркеры НКК CD 56+CD 57+CD 16 ± NKR-P 1 Активационные CD 2+ CD 69+ CD 25+ NK Ig-like Receptor (KIR) Триггерные Natural Cytotoxictity Receptor -NCR NKp 46 NKp 30 NKp 44 NKp 80 NKG-2 D 2 B 4
Маркеры НКК CD 56+CD 57+CD 16 ± NKR-P 1 Активационные CD 2+ CD 69+ CD 25+ NK Ig-like Receptor (KIR) Триггерные Natural Cytotoxictity Receptor -NCR NKp 46 NKp 30 NKp 44 NKp 80 NKG-2 D 2 B 4
 Рецепторы НКК KIR Распознают клетки с отсутствием или низкой экспрессией молекул 1 класса HLA(HLA-A, -B, -C) На основе принципа “missing self” NCR Распознают не связанные с НLA молекулы, возможно, посредством FcγRIII рецепторов. Появляются на более ранних этапах дифференцировки НК (раньше KIR)
Рецепторы НКК KIR Распознают клетки с отсутствием или низкой экспрессией молекул 1 класса HLA(HLA-A, -B, -C) На основе принципа “missing self” NCR Распознают не связанные с НLA молекулы, возможно, посредством FcγRIII рецепторов. Появляются на более ранних этапах дифференцировки НК (раньше KIR)
 q. Этапы литического процесса q Образование коньюгатов между клеткой-мишенью и эффекторной клеткой(ЭК). Участвуют CD 11/CD 18, LFA-1, CD 2 молекулы. LFA 1 взаимодействует с молекулами адгезии ICAM(1, 2, 3), после чего экспрессируется передающий сигнал полипептид(zeta-цепь). q Секреция в НК азурофильных гранул, которые содержат TNFb (лимфотоксин), гранзимы(протеазы) и фрагментины. В результате экзоцитоза гранул освобождаются перфорины, образующие цилиндрические поры в мембранах клеток- мишеней. НКК также синтезируют цитотоксический фактор –НКЦФ(12 к. D) и TNFα. q Гранзимы проникают через перфориновые поры и запускают процесс деградации ДНК и индукцию апоптоза клеток-мишеней. q На этом этапе наступает независимая от киллерной клетки фаза лизиса.
q. Этапы литического процесса q Образование коньюгатов между клеткой-мишенью и эффекторной клеткой(ЭК). Участвуют CD 11/CD 18, LFA-1, CD 2 молекулы. LFA 1 взаимодействует с молекулами адгезии ICAM(1, 2, 3), после чего экспрессируется передающий сигнал полипептид(zeta-цепь). q Секреция в НК азурофильных гранул, которые содержат TNFb (лимфотоксин), гранзимы(протеазы) и фрагментины. В результате экзоцитоза гранул освобождаются перфорины, образующие цилиндрические поры в мембранах клеток- мишеней. НКК также синтезируют цитотоксический фактор –НКЦФ(12 к. D) и TNFα. q Гранзимы проникают через перфориновые поры и запускают процесс деградации ДНК и индукцию апоптоза клеток-мишеней. q На этом этапе наступает независимая от киллерной клетки фаза лизиса.
 q. Этапы литического процесса q. Необратимые изменения в клетках-мишенях усиливаются действием лимфотоксинов, которые в дополнение к своей цитолитической функции, повышают адгезивные свойства ЭК, способствуя трансмембранной миграции гранзимов. q. Фрагментины завершают процесс деградации клетки. q. В гранулах содержится хондроэтин сульфат А, предохраняющий НК от аутолиза собственными летальными агентами.
q. Этапы литического процесса q. Необратимые изменения в клетках-мишенях усиливаются действием лимфотоксинов, которые в дополнение к своей цитолитической функции, повышают адгезивные свойства ЭК, способствуя трансмембранной миграции гранзимов. q. Фрагментины завершают процесс деградации клетки. q. В гранулах содержится хондроэтин сульфат А, предохраняющий НК от аутолиза собственными летальными агентами.
 Регуляторная функция НКК q. НКК-основные продуценты IFNγ и IL-12, участвующих в аутокринной (НК) и паракринной (Тh 1 -клетки) регуляции q Синтезируют IFNγ, TNFα, IL-2, IL-3, IL-15, G-CSF, TGFβ(? ) q. В малых соотношениях НКК являются добавочными клетками для Т-хелперов, продуцирующих IL-2 q. Влияют на созревание и дифференцировку тимоцитов в Т-лимфоциты q. Оказывают супрессорное действие на Влимфоциты малой плотности q. Подавляют пролиферацию Т-клеток в СКЛ (исследуется роль НК при аллогенной трансплантации)
Регуляторная функция НКК q. НКК-основные продуценты IFNγ и IL-12, участвующих в аутокринной (НК) и паракринной (Тh 1 -клетки) регуляции q Синтезируют IFNγ, TNFα, IL-2, IL-3, IL-15, G-CSF, TGFβ(? ) q. В малых соотношениях НКК являются добавочными клетками для Т-хелперов, продуцирующих IL-2 q. Влияют на созревание и дифференцировку тимоцитов в Т-лимфоциты q. Оказывают супрессорное действие на Влимфоциты малой плотности q. Подавляют пролиферацию Т-клеток в СКЛ (исследуется роль НК при аллогенной трансплантации)
 Факторы, ингибирующие действие НК § ИЛ-10 ингибирует IFNγ продукцию НКК § Простогландин Е 2(ПГЕ 2) – универсальный супрессорный фактор § Моноциты/макрофаги ингибируют транскрипцию гена цитокинов, вследствие чего НКК становятся резистентными к действию IL 2, IFN и подвергаются апоптозу § TGFβ угнетает цитолитическую функцию НК (может продуцироваться самими опухолевыми клетками) § CD 8+ клетки-супрессоры опосредованно регулируют активность НК, подавляя продукцию ИЛ-2 Т-клетками
Факторы, ингибирующие действие НК § ИЛ-10 ингибирует IFNγ продукцию НКК § Простогландин Е 2(ПГЕ 2) – универсальный супрессорный фактор § Моноциты/макрофаги ингибируют транскрипцию гена цитокинов, вследствие чего НКК становятся резистентными к действию IL 2, IFN и подвергаются апоптозу § TGFβ угнетает цитолитическую функцию НК (может продуцироваться самими опухолевыми клетками) § CD 8+ клетки-супрессоры опосредованно регулируют активность НК, подавляя продукцию ИЛ-2 Т-клетками
 Факторы, ингибирующие действие НК § Медленно растущие первичные опухоли подавляют НК активность, Тклеточную пролиферацию, снижают продукцию Th 1 цитокинов (IFNγ TNFα). При этом существенно изменена δцепь Т-клеточного рецептора Тлимфоцитов и НК-клеток. § Повышен апоптоз CTL(CD 8+).
Факторы, ингибирующие действие НК § Медленно растущие первичные опухоли подавляют НК активность, Тклеточную пролиферацию, снижают продукцию Th 1 цитокинов (IFNγ TNFα). При этом существенно изменена δцепь Т-клеточного рецептора Тлимфоцитов и НК-клеток. § Повышен апоптоз CTL(CD 8+).
 Факторы, стимулирующие активность НК IFN § Все типы IFN стимулируют созревание НКК в зрелые эффекторные клетки. Действие IFN проявляется через 46 часов и требует синтеза РНК, таким образом, стимулируя синтез белковых продуктов (НКЦФ). § IFNγ меняет кинетику лизиса, сокращая время лизиса от 6 часов до 30 минут. § IFNγ увеличивает рециклирующую способность НКК (способность лизировать большее число клеток-мишеней)
Факторы, стимулирующие активность НК IFN § Все типы IFN стимулируют созревание НКК в зрелые эффекторные клетки. Действие IFN проявляется через 46 часов и требует синтеза РНК, таким образом, стимулируя синтез белковых продуктов (НКЦФ). § IFNγ меняет кинетику лизиса, сокращая время лизиса от 6 часов до 30 минут. § IFNγ увеличивает рециклирующую способность НКК (способность лизировать большее число клеток-мишеней)
 Факторы, стимулирующие активность НК IL-2 § IL-2 повышает цитолитическую активность НКК. § Усиливает рециклирующую способность НКК § Усиливает действие IFN. § Индцуцирует образование LAK, лизирующих широкий спектр клетокмишеней, в том числе и НК-резистентных § Большинство НКК экспрессируют рецептор к IL-2 с промежуточной аффинностью (р75) и требуют большого количества IL-2
Факторы, стимулирующие активность НК IL-2 § IL-2 повышает цитолитическую активность НКК. § Усиливает рециклирующую способность НКК § Усиливает действие IFN. § Индцуцирует образование LAK, лизирующих широкий спектр клетокмишеней, в том числе и НК-резистентных § Большинство НКК экспрессируют рецептор к IL-2 с промежуточной аффинностью (р75) и требуют большого количества IL-2
 Факторы, стимулирующие активность НК IL-12 § IL-12 повышает цитолитическую активность НКК. § Стимулирует синтез IFNγ. § Усиливает продукцию IL-2 IL-15 § IL-15 повышает цитолитическую активность НКК. § Предохраняет от апоптоза, блокируя Fasрецепторы § Стимулирует синтез IFNγ. §
Факторы, стимулирующие активность НК IL-12 § IL-12 повышает цитолитическую активность НКК. § Стимулирует синтез IFNγ. § Усиливает продукцию IL-2 IL-15 § IL-15 повышает цитолитическую активность НКК. § Предохраняет от апоптоза, блокируя Fasрецепторы § Стимулирует синтез IFNγ. §
 Антиген-специфические цитотоксические Т-клетки (CD 3+CD 8+) § ЦТЛ распознают опухолевые антигены в ассоциации с HLA-антигенами 1 класса и требуют этапа сенсибилизации § Преобладание ЦТЛ над другими типами клеток в опухолевом субстрате явяляется благоприятным прогностичеким признаком § Если опухолевые клетки не экспрессируют HLAантигены 1 класса, то ЦТЛ не генерируются § В отличие от животных большинство опухолей человека обладают низкой иммуногенностью и слабо индуцирует иммунный ответ
Антиген-специфические цитотоксические Т-клетки (CD 3+CD 8+) § ЦТЛ распознают опухолевые антигены в ассоциации с HLA-антигенами 1 класса и требуют этапа сенсибилизации § Преобладание ЦТЛ над другими типами клеток в опухолевом субстрате явяляется благоприятным прогностичеким признаком § Если опухолевые клетки не экспрессируют HLAантигены 1 класса, то ЦТЛ не генерируются § В отличие от животных большинство опухолей человека обладают низкой иммуногенностью и слабо индуцирует иммунный ответ
 Цитокины § Низкомолекулярные гликопротеиды (<100 k. D) § Обладают полифункциональной активностью § Имеют специфические рецепторы практически на всех органах и тканях § Являются коммуникационными молекулами межсистемных взаимодействий
Цитокины § Низкомолекулярные гликопротеиды (<100 k. D) § Обладают полифункциональной активностью § Имеют специфические рецепторы практически на всех органах и тканях § Являются коммуникационными молекулами межсистемных взаимодействий
 Цитокины § Интерфероны § Интерлейкины § Колониестимулирующие факторы § Факторы некроза опухоли § Хемокины § Ростовые факторы
Цитокины § Интерфероны § Интерлейкины § Колониестимулирующие факторы § Факторы некроза опухоли § Хемокины § Ростовые факторы
 Механизмы противоопухолевой активности цитокинов 1. Цитостатический эффект – подавление пролиферации опухолевых клеток (TNFα, IFNγ) 2. Цитотоксический эффект – лизис трансформированных клеток (TNFα) 3. Стимуляция противоопухолевого иммунитета посредством активации ЦТЛ и НК (IL-1, IL-2, IFNγ, GM-CSF ) 4. Нарушение питания и васкуляризации клеток через систему гемоcтаза (TNFα, IFNγ) 5. Стимуляция гемопоэза как плацдарма для накопления и созревания ИКК(GM-CSF, IL-3) 6. Повышение иммуногенности опухоли за счет усиления экспрессии HLA-антигенов и костимуляторных молекул на опухолевых клетках (IL-1, IL-6, IL-7, IFNγ, TNFα, G-CSF, GMCSF) 7. Предотвращение развития анергии ЦТЛ при неадекватном распознавании опухолевого антигена (IL-2, IL-4, IL-7, IL-15)
Механизмы противоопухолевой активности цитокинов 1. Цитостатический эффект – подавление пролиферации опухолевых клеток (TNFα, IFNγ) 2. Цитотоксический эффект – лизис трансформированных клеток (TNFα) 3. Стимуляция противоопухолевого иммунитета посредством активации ЦТЛ и НК (IL-1, IL-2, IFNγ, GM-CSF ) 4. Нарушение питания и васкуляризации клеток через систему гемоcтаза (TNFα, IFNγ) 5. Стимуляция гемопоэза как плацдарма для накопления и созревания ИКК(GM-CSF, IL-3) 6. Повышение иммуногенности опухоли за счет усиления экспрессии HLA-антигенов и костимуляторных молекул на опухолевых клетках (IL-1, IL-6, IL-7, IFNγ, TNFα, G-CSF, GMCSF) 7. Предотвращение развития анергии ЦТЛ при неадекватном распознавании опухолевого антигена (IL-2, IL-4, IL-7, IL-15)
 Цитокины Тh 1/провоспалительные цитокины § IL-1α/β § IL-2 § IL-8 § IL-12 § IFNγ § TNF α/β § CM-CSF Тh 2/противовоспалитель ные цитокины § IL-4 § IL-10 § IL-13 § TGF β § PGE 2 § MIP 1α § Супрессорный фактор лейкозных В-клеток
Цитокины Тh 1/провоспалительные цитокины § IL-1α/β § IL-2 § IL-8 § IL-12 § IFNγ § TNF α/β § CM-CSF Тh 2/противовоспалитель ные цитокины § IL-4 § IL-10 § IL-13 § TGF β § PGE 2 § MIP 1α § Супрессорный фактор лейкозных В-клеток
 Механизмы действия провоспалительных цитокинов § Генерация антигенспецифических цитотоксических Т- лимфоцитов § индукция созревания лимфокинактивированных киллерных клеток (ЛАК) § активация CD 4 -хелперов, запускающих иммунный ответ
Механизмы действия провоспалительных цитокинов § Генерация антигенспецифических цитотоксических Т- лимфоцитов § индукция созревания лимфокинактивированных киллерных клеток (ЛАК) § активация CD 4 -хелперов, запускающих иммунный ответ
 Механизмы действия иммуносупрессорных цитокинов § подавление антигенспецифических цитотоксических Т- лимфоцитов § супрессия естественных киллерных клеток § подавление активности CD 4 -хелперов, обеспечивающих созревание предшественников киллерных клеток
Механизмы действия иммуносупрессорных цитокинов § подавление антигенспецифических цитотоксических Т- лимфоцитов § супрессия естественных киллерных клеток § подавление активности CD 4 -хелперов, обеспечивающих созревание предшественников киллерных клеток
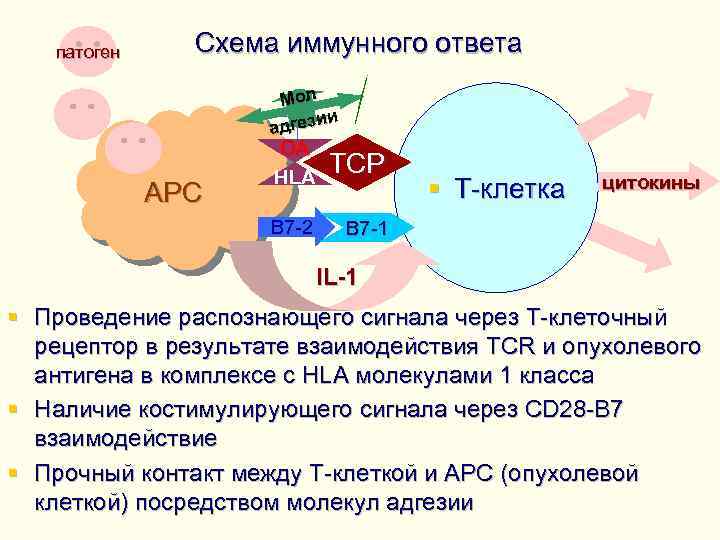 патоген Схема иммунного ответа АРС Мол ии адгез OA HLA ТСР В 7 -2 В 7 -1 § Т-клетка цитокины IL-1 § Проведение распознающего сигнала через Т-клеточный рецептор в результате взаимодействия TCR и опухолевого антигена в комплексе с HLA молекулами 1 класса § Наличие костимулирующего сигнала через CD 28 -B 7 взаимодействие § Прочный контакт между Т-клеткой и АРС (опухолевой клеткой) посредством молекул адгезии
патоген Схема иммунного ответа АРС Мол ии адгез OA HLA ТСР В 7 -2 В 7 -1 § Т-клетка цитокины IL-1 § Проведение распознающего сигнала через Т-клеточный рецептор в результате взаимодействия TCR и опухолевого антигена в комплексе с HLA молекулами 1 класса § Наличие костимулирующего сигнала через CD 28 -B 7 взаимодействие § Прочный контакт между Т-клеткой и АРС (опухолевой клеткой) посредством молекул адгезии
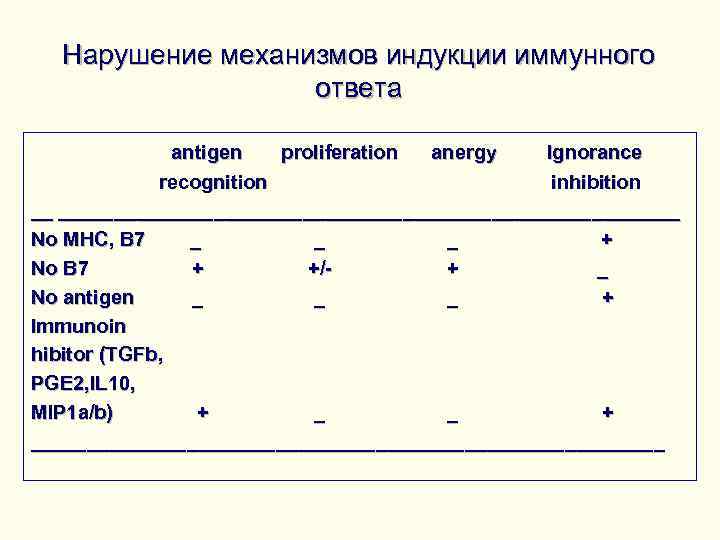 Нарушение механизмов индукции иммунного ответа antigen proliferation anergy Ignorance recognition inhibition __ ________________________________________________________ No MHC, B 7 _ _ + No B 7 + +/ + _ No antigen _ _ + Immunoin hibitor (TGFb, PGE 2, IL 10, MIP 1 a/b) + _ _ + _____________________________
Нарушение механизмов индукции иммунного ответа antigen proliferation anergy Ignorance recognition inhibition __ ________________________________________________________ No MHC, B 7 _ _ + No B 7 + +/ + _ No antigen _ _ + Immunoin hibitor (TGFb, PGE 2, IL 10, MIP 1 a/b) + _ _ + _____________________________
 Причины иммунодефицита при опухолевом росте § физиологический иммунодефицит в пожилом возрасте § иммунодепрессивная терапия(ТКМ) § врожденные и приобретенные иммунодефициты § иммунодепрессивное действие канцерогенов (онковирусы, химические и физические агенты) § Наличие иммунодепрессии определяет неадекватный ответ иммунной системы на появление опухолевых клеток, которые способствуют углублению иммунодепрессии
Причины иммунодефицита при опухолевом росте § физиологический иммунодефицит в пожилом возрасте § иммунодепрессивная терапия(ТКМ) § врожденные и приобретенные иммунодефициты § иммунодепрессивное действие канцерогенов (онковирусы, химические и физические агенты) § Наличие иммунодепрессии определяет неадекватный ответ иммунной системы на появление опухолевых клеток, которые способствуют углублению иммунодепрессии
 Причины ускользания опухоли от иммунного надзора 1. Принадлежность большинства ОАА к аутоантигенам, по отношению к которым иммунная система толерантна 2. Низкая экспрессия ОАА и МНС-антигенов на опухолевых клетках, потеря антигенов в процессе опухолевой трансформации или их экранирование блокирующими антителами, что затрудняет распознавание опухолевых клеток цитотоксическими лимфоцитами 3. Дефектность АПК в силу продукции опухолевыми клетками иммуносупрессивных факторов, которые угнетают экспрессию костимуляторных молекул на макрофагах и ингибируют созревание дендритных клеток
Причины ускользания опухоли от иммунного надзора 1. Принадлежность большинства ОАА к аутоантигенам, по отношению к которым иммунная система толерантна 2. Низкая экспрессия ОАА и МНС-антигенов на опухолевых клетках, потеря антигенов в процессе опухолевой трансформации или их экранирование блокирующими антителами, что затрудняет распознавание опухолевых клеток цитотоксическими лимфоцитами 3. Дефектность АПК в силу продукции опухолевыми клетками иммуносупрессивных факторов, которые угнетают экспрессию костимуляторных молекул на макрофагах и ингибируют созревание дендритных клеток
 Причины ускользания опухоли от иммунного надзора 4. Низкая стимуляция продукции цитокинов, необходимых для взаимодействия АПК и Т-клеток 5. Угнетение функции ЦТЛ под действием супрессорных факторов, продуцируемых ИКК или опухолевыми клетками 6. Вследствие дефектности АПК развитие негативного исхода Т-клеточной активации в виде анергии и апоптоза реактивных Т-клеток , а также генерации регуляторных клеток с супрессорной активностью.
Причины ускользания опухоли от иммунного надзора 4. Низкая стимуляция продукции цитокинов, необходимых для взаимодействия АПК и Т-клеток 5. Угнетение функции ЦТЛ под действием супрессорных факторов, продуцируемых ИКК или опухолевыми клетками 6. Вследствие дефектности АПК развитие негативного исхода Т-клеточной активации в виде анергии и апоптоза реактивных Т-клеток , а также генерации регуляторных клеток с супрессорной активностью.
 Иммунотерапия злокачественных опухолей 1. Активная ИТ направлена на запуск иммунного ответа в организме опухоленосителя § специфическая (опухолевые клетки или антигены) § неспецифическая/адьювантная (модификаторы биологического ответа –тимомиметики, цитокины, продукты бакт. происхождения(БЦЖ, ОК 432, пирогенал) 2. Адоптивная ИТ направлена на усиление эффекторного звена противоопухолевого ответа за счет введения цитотоксических клеток § специфическая (опухольинфильтрирующие лимфоциты, антиген-специфические ЦТЛ) § неспецифическая (ЛАК)
Иммунотерапия злокачественных опухолей 1. Активная ИТ направлена на запуск иммунного ответа в организме опухоленосителя § специфическая (опухолевые клетки или антигены) § неспецифическая/адьювантная (модификаторы биологического ответа –тимомиметики, цитокины, продукты бакт. происхождения(БЦЖ, ОК 432, пирогенал) 2. Адоптивная ИТ направлена на усиление эффекторного звена противоопухолевого ответа за счет введения цитотоксических клеток § специфическая (опухольинфильтрирующие лимфоциты, антиген-специфические ЦТЛ) § неспецифическая (ЛАК)
 Иммунотерапия злокачественных опухолей 3. Пассивная ИТ основана на использовании антител, коньюгированных с цитотоксическими агентами (специфические антитела, коньюгированные с гаммаизотопами, токсинами, цитостатиками; биспецифические антитела: CD 3 -CD 19, CD 3 -CD 22) 4. Деблокирующая ИТ направлена на связывание или элиминацию блокирующих антител (Ig сыворотки против блокирующих факторов, aфетопротеин)
Иммунотерапия злокачественных опухолей 3. Пассивная ИТ основана на использовании антител, коньюгированных с цитотоксическими агентами (специфические антитела, коньюгированные с гаммаизотопами, токсинами, цитостатиками; биспецифические антитела: CD 3 -CD 19, CD 3 -CD 22) 4. Деблокирующая ИТ направлена на связывание или элиминацию блокирующих антител (Ig сыворотки против блокирующих факторов, aфетопротеин)
 Неспецифическая иммунотерапия §Прямой цитотоксический и цитостатический эффект на опухолевые клетки (TNFa, IFNg), нарушение питания и васкуляризации опухоли (TNFa, IFNg) §Активация функций АПК (GM-CSF, IL-4, IFNa, TNFa, Flt-3) §Повышение иммуногенности опухолевых клеток (IFNa, IL 1, GM-CSF) §Активация ЦТЛ (IL-1, IL-2, TNFa, GM-CSF) §Ослабление опухоль-индуцированной супрессии за счет преодаление анергии ЦТЛ и нивелирование эффекта супрессорных CD 4 CD 25(Trn) Эффективна при раке почки, меланоме(25%) ! Недостаток – стоимость лечения и побочные эффекты в виде цитокиновых реакций, а также опасность использования цитокинов опухолевыми клетками для стимуляции роста
Неспецифическая иммунотерапия §Прямой цитотоксический и цитостатический эффект на опухолевые клетки (TNFa, IFNg), нарушение питания и васкуляризации опухоли (TNFa, IFNg) §Активация функций АПК (GM-CSF, IL-4, IFNa, TNFa, Flt-3) §Повышение иммуногенности опухолевых клеток (IFNa, IL 1, GM-CSF) §Активация ЦТЛ (IL-1, IL-2, TNFa, GM-CSF) §Ослабление опухоль-индуцированной супрессии за счет преодаление анергии ЦТЛ и нивелирование эффекта супрессорных CD 4 CD 25(Trn) Эффективна при раке почки, меланоме(25%) ! Недостаток – стоимость лечения и побочные эффекты в виде цитокиновых реакций, а также опасность использования цитокинов опухолевыми клетками для стимуляции роста
 Специфическая иммунотерапия §Главным преимуществом противоопухолевых вакцин является то, что генерируемый иммунный ответ направлен только против опухолевых клеток §Выделяют 5 типов ОАА, распознаваемых Т-клетками - дифференцировочные тканеспецифические антигены (присутствуют на нормальных тканях и гиперэксп- рессированы на опухолях) - опухолево-яичковые антигены (в эмбриогенезе) - вирус-специфические антигены с высокой иммуногенностью - истинные опухолевые антигены - карбогидраты с измененными боковыми цепями Наилучшими кандидатами для вакцин являются антигены первых 3 -х групп
Специфическая иммунотерапия §Главным преимуществом противоопухолевых вакцин является то, что генерируемый иммунный ответ направлен только против опухолевых клеток §Выделяют 5 типов ОАА, распознаваемых Т-клетками - дифференцировочные тканеспецифические антигены (присутствуют на нормальных тканях и гиперэксп- рессированы на опухолях) - опухолево-яичковые антигены (в эмбриогенезе) - вирус-специфические антигены с высокой иммуногенностью - истинные опухолевые антигены - карбогидраты с измененными боковыми цепями Наилучшими кандидатами для вакцин являются антигены первых 3 -х групп
 Вакцины на основе пептидов § Пептидные вакцины индуцируют специфический ЦТЛ ответ, который направлен на опухолевые клетки § Более выраженный эффект полиэпитопных вакцин по сравнению с моноэпитопными § Показана эффективность при сочетании вакцин с адьювантами (gp 100 имеет сродство с HLA-молекулами 1 класса) Достоинства вакцин: простота использования и отсутствие побочных эффектов Недостатки: МНС-рестрикция опухолевых пептидов, ограниченное число опухолей с известными пептидами, низкая иммуногенность ОАА, толерантность к ОАА как к аутоантигенам, изменение спектра ОАА в процессе опухолевой прогрессии Будущее вакцин связано с генной или химической модификацией пептидов и повышение иммуногенности ОАА(использование дендритных клеток, рекомбинантных белков и ксеноантигенов
Вакцины на основе пептидов § Пептидные вакцины индуцируют специфический ЦТЛ ответ, который направлен на опухолевые клетки § Более выраженный эффект полиэпитопных вакцин по сравнению с моноэпитопными § Показана эффективность при сочетании вакцин с адьювантами (gp 100 имеет сродство с HLA-молекулами 1 класса) Достоинства вакцин: простота использования и отсутствие побочных эффектов Недостатки: МНС-рестрикция опухолевых пептидов, ограниченное число опухолей с известными пептидами, низкая иммуногенность ОАА, толерантность к ОАА как к аутоантигенам, изменение спектра ОАА в процессе опухолевой прогрессии Будущее вакцин связано с генной или химической модификацией пептидов и повышение иммуногенности ОАА(использование дендритных клеток, рекомбинантных белков и ксеноантигенов
 Вакцины на основе дендритных клеток § ДК являются профессиональными АПК и играют ключевую роль в запуске иммунного ответа § ДК высоко экспрессируют молекулы I и II класса ГКС, костимуляторные молекулы и цитокины, активирующие Т-клетки (в том числе и наивные) § Нагруженные опухолевым антигеном ДК стимулируют мощный ЦТЛ ответ § ДК способны преодолевать состояние толерантности к опухолевым антигенам и активировать CD 4 и CD 8 Т-л § Описано прямое цитотоксическое действие ДК на опухоль Позитивный эффект: хорошая переносимость и высокая специфичность Нерешенные вопросы: оптимальный источник ДК, технологии нагрузки опухолевыми антигенами, эффективные протоколы вакцинации, пути введения ДК, использование цитокинов в качестве адьювантов
Вакцины на основе дендритных клеток § ДК являются профессиональными АПК и играют ключевую роль в запуске иммунного ответа § ДК высоко экспрессируют молекулы I и II класса ГКС, костимуляторные молекулы и цитокины, активирующие Т-клетки (в том числе и наивные) § Нагруженные опухолевым антигеном ДК стимулируют мощный ЦТЛ ответ § ДК способны преодолевать состояние толерантности к опухолевым антигенам и активировать CD 4 и CD 8 Т-л § Описано прямое цитотоксическое действие ДК на опухоль Позитивный эффект: хорошая переносимость и высокая специфичность Нерешенные вопросы: оптимальный источник ДК, технологии нагрузки опухолевыми антигенами, эффективные протоколы вакцинации, пути введения ДК, использование цитокинов в качестве адьювантов
 Вакцины на основе гибридов опухолевых и дендритных клеток Данные вакцины получают путем технологий слияния с помощью полиэтиленгликоля или методом электростимуляции. Гибридные клетки несут весь набор опухолевых антигенов и при этом обладают антигенпрезентирующей способностью ДК.
Вакцины на основе гибридов опухолевых и дендритных клеток Данные вакцины получают путем технологий слияния с помощью полиэтиленгликоля или методом электростимуляции. Гибридные клетки несут весь набор опухолевых антигенов и при этом обладают антигенпрезентирующей способностью ДК.
 Перспективы развития методов иммунотерапии § Локорегиональный подход § Сочетание специфического и неспецифического компонентов § Контрсупрессия § Повышение иммуногеннности опухолей
Перспективы развития методов иммунотерапии § Локорегиональный подход § Сочетание специфического и неспецифического компонентов § Контрсупрессия § Повышение иммуногеннности опухолей
 Вакцины на основе дендритных клеток Одна из главных причин неэффективного иммунного ответа при опухолях различного генеза – изменение процесса презентации. § Супрессия опухолевыми клетками созревания и активации ДК. § Снижение экспрессии адгезивных и костимулирующих молекул, а также критическое снижение экспрессии HLAмолекул. § Презентация неадекватного количества опухолевых АГ ДК.
Вакцины на основе дендритных клеток Одна из главных причин неэффективного иммунного ответа при опухолях различного генеза – изменение процесса презентации. § Супрессия опухолевыми клетками созревания и активации ДК. § Снижение экспрессии адгезивных и костимулирующих молекул, а также критическое снижение экспрессии HLAмолекул. § Презентация неадекватного количества опухолевых АГ ДК.
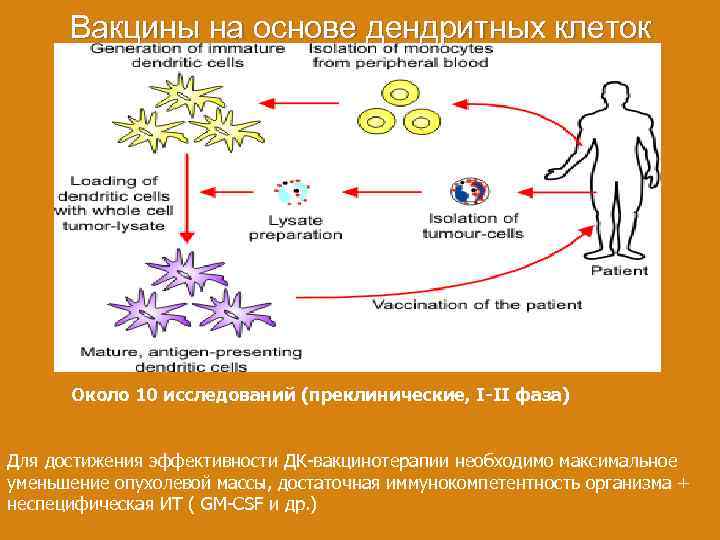 Вакцины на основе дендритных клеток Около 10 исследований (преклинические, I-II фаза) Для достижения эффективности ДК-вакцинотерапии необходимо максимальное уменьшение опухолевой массы, достаточная иммунокомпетентность организма + неспецифическая ИТ ( GM-CSF и др. )
Вакцины на основе дендритных клеток Около 10 исследований (преклинические, I-II фаза) Для достижения эффективности ДК-вакцинотерапии необходимо максимальное уменьшение опухолевой массы, достаточная иммунокомпетентность организма + неспецифическая ИТ ( GM-CSF и др. )
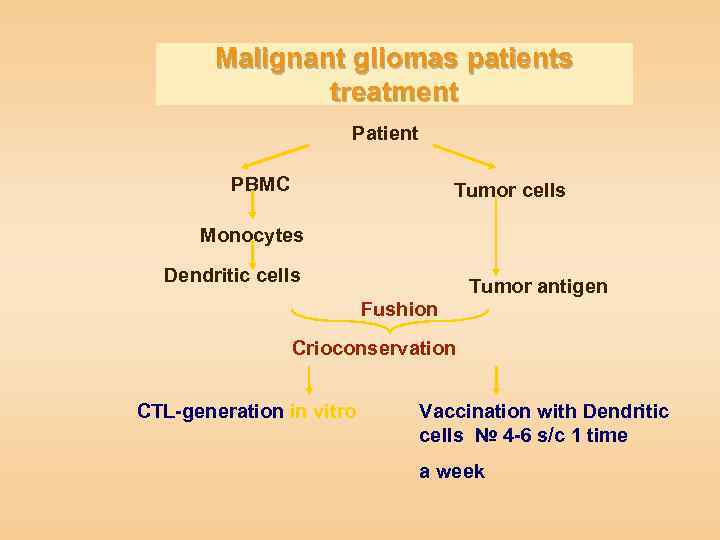 Malignant gliomas patients treatment Patient PBMC Tumor cells Моnocytes Dendritic cells Tumor antigen Fushion Crioconservation CTL-generation in vitro Vaccination with Dendritic cells № 4 -6 s/c 1 time a week
Malignant gliomas patients treatment Patient PBMC Tumor cells Моnocytes Dendritic cells Tumor antigen Fushion Crioconservation CTL-generation in vitro Vaccination with Dendritic cells № 4 -6 s/c 1 time a week
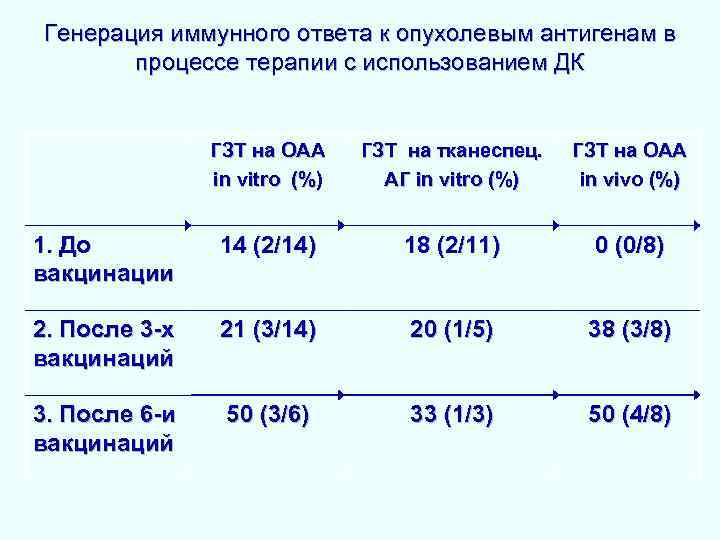 Генерация иммунного ответа к опухолевым антигенам в процессе терапии с использованием ДК ГЗТ на ОАА in vitro (%) ГЗТ на тканеспец. АГ in vitro (%) ГЗТ на ОАА in vivo (%) 1. До вакцинации 14 (2/14) 18 (2/11) 0 (0/8) 2. После 3 -х вакцинаций 21 (3/14) 20 (1/5) 38 (3/8) 33 (1/3) 50 (4/8) 3. После 6 -и 50 (3/6) вакцинаций
Генерация иммунного ответа к опухолевым антигенам в процессе терапии с использованием ДК ГЗТ на ОАА in vitro (%) ГЗТ на тканеспец. АГ in vitro (%) ГЗТ на ОАА in vivo (%) 1. До вакцинации 14 (2/14) 18 (2/11) 0 (0/8) 2. После 3 -х вакцинаций 21 (3/14) 20 (1/5) 38 (3/8) 33 (1/3) 50 (4/8) 3. После 6 -и 50 (3/6) вакцинаций
 Проблемы ДК-вакцинотерапии § Возможность индукции толерантности к опухоли в случае использования ДК с толерогенными свойствами (при использовании клеток недостаточной степени зрелости). § Методы изготовления ДК-вакцин. § Выбор опухолевого АГ, наиболее эффективных протоколов применения с учетом режимов и способов введения. § Актуален поиск методов мониторинга проводимой ДК-вакцинотерапии.
Проблемы ДК-вакцинотерапии § Возможность индукции толерантности к опухоли в случае использования ДК с толерогенными свойствами (при использовании клеток недостаточной степени зрелости). § Методы изготовления ДК-вакцин. § Выбор опухолевого АГ, наиболее эффективных протоколов применения с учетом режимов и способов введения. § Актуален поиск методов мониторинга проводимой ДК-вакцинотерапии.
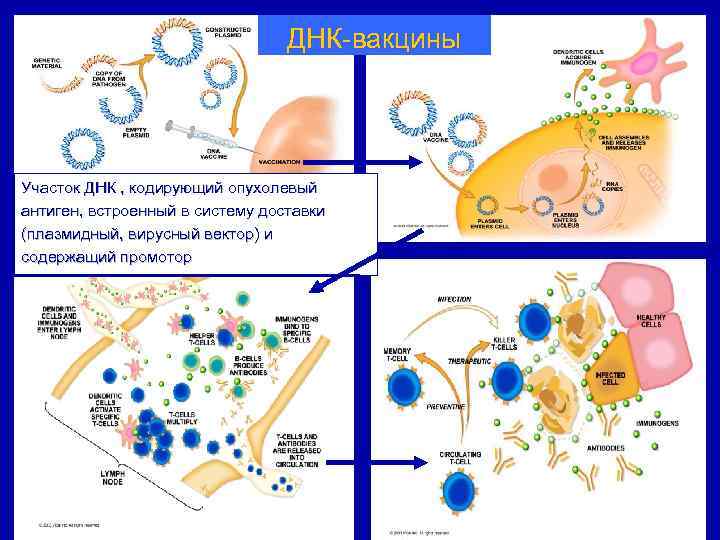 ДНК-вакцины Участок ДНК , кодирующий опухолевый антиген, встроенный в систему доставки (плазмидный, вирусный вектор) и содержащий промотор
ДНК-вакцины Участок ДНК , кодирующий опухолевый антиген, встроенный в систему доставки (плазмидный, вирусный вектор) и содержащий промотор
 ДНК-вакцины Исследования по использованию ДНК-вакцины, кодирующей Id антиген клонального Ig ( ММ, В-НХЛ ); внедрение гена Id в геном ДК ( ММ ). Стратегии усиления эффективности полинуклеотидных противоопухолевых терапевтических вакцин Характеристика вакцины Вмешательство Тип доставки нуклеиновой кислоты - Модификация антигена для обеспечения его поглощения АПК - слияние антигена с CD 40 L, Flt-3 L, CTLA 4 Модификация антигена с целью повышения его иммуногенности липосомы микрочастицы ПЛГ электропорация гидродинамическая доставка - изменение процессинга антигена - внедрение иммуногенных эпитопов - использование антигена другого вида - оптимизация кодона Кодо н (кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты Модификация микроокружения - одновременное введение цитокинов - одновременное введение хемокинов
ДНК-вакцины Исследования по использованию ДНК-вакцины, кодирующей Id антиген клонального Ig ( ММ, В-НХЛ ); внедрение гена Id в геном ДК ( ММ ). Стратегии усиления эффективности полинуклеотидных противоопухолевых терапевтических вакцин Характеристика вакцины Вмешательство Тип доставки нуклеиновой кислоты - Модификация антигена для обеспечения его поглощения АПК - слияние антигена с CD 40 L, Flt-3 L, CTLA 4 Модификация антигена с целью повышения его иммуногенности липосомы микрочастицы ПЛГ электропорация гидродинамическая доставка - изменение процессинга антигена - внедрение иммуногенных эпитопов - использование антигена другого вида - оптимизация кодона Кодо н (кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты Модификация микроокружения - одновременное введение цитокинов - одновременное введение хемокинов
 ГЕННАЯ ТЕРАПИЯ ОПУХОЛЕЙ §Увеличение иммуногенности опухолевых клеток за счет трансгенеза генов, кодирующих иммуногенные белки. §Введение в опухолевые клетки генов костимулирующих молекул. §Суицидная терапия – ген р53, гены, кодирующие токсины под промоторами, экспрессирующимися только в опухолевых клетках. §Внутриклеточная иммунизация - введение генов, кодирующих АТ против продуктов онкогенов, рецепторов для ростовых факторов. §Введение соответствующих антисенс ДНК и РНК §Активация клеток иммунной системы за счет введения в них генов цитокинов.
ГЕННАЯ ТЕРАПИЯ ОПУХОЛЕЙ §Увеличение иммуногенности опухолевых клеток за счет трансгенеза генов, кодирующих иммуногенные белки. §Введение в опухолевые клетки генов костимулирующих молекул. §Суицидная терапия – ген р53, гены, кодирующие токсины под промоторами, экспрессирующимися только в опухолевых клетках. §Внутриклеточная иммунизация - введение генов, кодирующих АТ против продуктов онкогенов, рецепторов для ростовых факторов. §Введение соответствующих антисенс ДНК и РНК §Активация клеток иммунной системы за счет введения в них генов цитокинов.
 Моноклональные антитела в терапии лимфопролиферативных заболеваний.
Моноклональные антитела в терапии лимфопролиферативных заболеваний.
 Допущенные до клинического применения: ► Ритуксимаб (Mabthera) ( Анти. CD 20 ) ► Алемтузумаб (CAMPATH-1 H) ( Анти. CD 52 ) ► Ибритумаб тиуксетан ( Zevalin ) 90 ( Анти. CD 20 + Y ) 131 ► Тозитумаб (Bexxar ) ( Анти. CD 20 + I ) ► Гемтузумаб озогамицин (Mylotarg) ( Анти. CD 33 + калихеамицин )
Допущенные до клинического применения: ► Ритуксимаб (Mabthera) ( Анти. CD 20 ) ► Алемтузумаб (CAMPATH-1 H) ( Анти. CD 52 ) ► Ибритумаб тиуксетан ( Zevalin ) 90 ( Анти. CD 20 + Y ) 131 ► Тозитумаб (Bexxar ) ( Анти. CD 20 + I ) ► Гемтузумаб озогамицин (Mylotarg) ( Анти. CD 33 + калихеамицин )
 Ритуксимаб (мабтера) § 1 -е разрешенное для клинического применения химерное мышино-человеческое МАТ против трансмембранного антигена CD 20+ В-лимфоцитов. § Показания: – Рефрактерные, рецидивирующие неходжскинские лимфомы низкой степени злокачественности. – В комбинации со схемой CHOPP- неходжскинские лимфомы высокой степени злокачественности и экстранодальные неходжскинские лимфомы MALT-типа. § Доза: в/в кап. 375 мг/м 1 р. /нед. -4 нед. § Результаты исследований: 2 – – – Частота ответа при монотерапии 35 -75% Частота полного ответа 10 -40% В сочетании с ХТ эффект в 100%, полная ремиссия 58% Не влияет на токсичность ХТ 5 - летняя полная ремиссия >60%. (при ХТ 28 -50%) § Осложнения: аллергические реакции, миалгии, артралгии, угнетение В - лф.
Ритуксимаб (мабтера) § 1 -е разрешенное для клинического применения химерное мышино-человеческое МАТ против трансмембранного антигена CD 20+ В-лимфоцитов. § Показания: – Рефрактерные, рецидивирующие неходжскинские лимфомы низкой степени злокачественности. – В комбинации со схемой CHOPP- неходжскинские лимфомы высокой степени злокачественности и экстранодальные неходжскинские лимфомы MALT-типа. § Доза: в/в кап. 375 мг/м 1 р. /нед. -4 нед. § Результаты исследований: 2 – – – Частота ответа при монотерапии 35 -75% Частота полного ответа 10 -40% В сочетании с ХТ эффект в 100%, полная ремиссия 58% Не влияет на токсичность ХТ 5 - летняя полная ремиссия >60%. (при ХТ 28 -50%) § Осложнения: аллергические реакции, миалгии, артралгии, угнетение В - лф.
 Алемтузумаб (кэмпас, CAMPATH -1 H) § Гуманизированное антитело(Ig G) против антигена CD 52. Этот антиген широко экспрессирован на нормальных (В– и Т–лимфоцитах, тимоцитах, моноцитах и макрофагах) и злокачественных клетках. § Показания: – Т-/В- клеточные лимфомы, полная ремиссия была достигнута в 30% случаев (время до прогрессирования составило более 9 мес. ). – рефрактерные к ХТ хр. лимфолейкоз и Т- пролимфоцитарный лейкоз (30 и 60% полных ремиссий соответственно), § Дозы: 30 мг в/в или п/к 3 р/нед. в течение до 12 -18 нед. § Осложнения: – – – нейтропения 85% (III–IV степень – у 64%), тромбоцитопении – 72% (III–IV степень обнаружена у 50% больных). длительные иммуносупрессивные состояния до 18 мес. Частота инфекционных осложнений составила 56% (в трети случаев тяжелые), при этом летальность от инфекционных осложнений – 20%. – анемия – инфузионные реакции (80% случаев), повышение температуры, озноб, анафилактический шок, сыпь (40%), гипотония (32%, III–IV степени – в 20% случаев) и др.
Алемтузумаб (кэмпас, CAMPATH -1 H) § Гуманизированное антитело(Ig G) против антигена CD 52. Этот антиген широко экспрессирован на нормальных (В– и Т–лимфоцитах, тимоцитах, моноцитах и макрофагах) и злокачественных клетках. § Показания: – Т-/В- клеточные лимфомы, полная ремиссия была достигнута в 30% случаев (время до прогрессирования составило более 9 мес. ). – рефрактерные к ХТ хр. лимфолейкоз и Т- пролимфоцитарный лейкоз (30 и 60% полных ремиссий соответственно), § Дозы: 30 мг в/в или п/к 3 р/нед. в течение до 12 -18 нед. § Осложнения: – – – нейтропения 85% (III–IV степень – у 64%), тромбоцитопении – 72% (III–IV степень обнаружена у 50% больных). длительные иммуносупрессивные состояния до 18 мес. Частота инфекционных осложнений составила 56% (в трети случаев тяжелые), при этом летальность от инфекционных осложнений – 20%. – анемия – инфузионные реакции (80% случаев), повышение температуры, озноб, анафилактический шок, сыпь (40%), гипотония (32%, III–IV степени – в 20% случаев) и др.
 Ибритумомаб тиуксетан (зевалин) § коньюгат Мабтеры с радиоактивным изотопом иттрия-90 ( Y). § Показания: рецидивирующие и рефрактерные лимфомы низкой и промежуточной степени злокачественности, в том числе при резистентности к Мабтере (46%). § Побочные эффекты: – лейко-/тромбоцитопения (57%, 61% соответственно) – Инфекционные осложнения III–IV степени 5%. – миелодиспластический синдром или острый миелолейкоз (все больные прежде получали различную химиотерапию) - 5%. – тошнота, рвота, боль в животе, диарея, одышка, боль в суставах. 90
Ибритумомаб тиуксетан (зевалин) § коньюгат Мабтеры с радиоактивным изотопом иттрия-90 ( Y). § Показания: рецидивирующие и рефрактерные лимфомы низкой и промежуточной степени злокачественности, в том числе при резистентности к Мабтере (46%). § Побочные эффекты: – лейко-/тромбоцитопения (57%, 61% соответственно) – Инфекционные осложнения III–IV степени 5%. – миелодиспластический синдром или острый миелолейкоз (все больные прежде получали различную химиотерапию) - 5%. – тошнота, рвота, боль в животе, диарея, одышка, боль в суставах. 90
 Сравнительная характеристика: Препарат: мабтера зевалин ремиссия: 56% 80% Полная ремиссия: 20% 34% Время до прогрессирования: 10. 1 мес 11. 2 мес
Сравнительная характеристика: Препарат: мабтера зевалин ремиссия: 56% 80% Полная ремиссия: 20% 34% Время до прогрессирования: 10. 1 мес 11. 2 мес
 Бексар (J 131 Tositumomab, Bexxar) § Мышиное 131 моноклональное анти-CD 20 -антитело, конъюгированное с изотопом I § Показание: резистентная В-клеточная лимфома низкой степени злокачественности § эффективен во всех подгруппах больных неходжкинской CD 20+ лимфомой (пожилой возраст, прогрессирование в короткий срок после Мабтеры, значительные проявления болезни, прогрессирование после лучевой терапии, вовлечение костного мозга, рефрактерность к предшествующей химиотерапии). § При рефрактерной неходжкинской В–клеточной CD 20+ лимфоме низкой степени злокачественности лечебный эффект наблюдался уже через 3 мес после лечения. частота эффекта составила 57 -71% (полная ремиссия – в 32 -34% случаев). Среднее время до прогрессирования составило 12 мес, (при полной ремиссии – 20, 3 мес). § При повторном использовании Бексара у этих больных частота эффекта составила 67% (полная ремиссия 37%), среднее время до прогрессирования после повторного лечения – 10, 6 мес. § в I линии лечения ремиссия достигнута в 97% случаев (полная ремиссия
Бексар (J 131 Tositumomab, Bexxar) § Мышиное 131 моноклональное анти-CD 20 -антитело, конъюгированное с изотопом I § Показание: резистентная В-клеточная лимфома низкой степени злокачественности § эффективен во всех подгруппах больных неходжкинской CD 20+ лимфомой (пожилой возраст, прогрессирование в короткий срок после Мабтеры, значительные проявления болезни, прогрессирование после лучевой терапии, вовлечение костного мозга, рефрактерность к предшествующей химиотерапии). § При рефрактерной неходжкинской В–клеточной CD 20+ лимфоме низкой степени злокачественности лечебный эффект наблюдался уже через 3 мес после лечения. частота эффекта составила 57 -71% (полная ремиссия – в 32 -34% случаев). Среднее время до прогрессирования составило 12 мес, (при полной ремиссии – 20, 3 мес). § При повторном использовании Бексара у этих больных частота эффекта составила 67% (полная ремиссия 37%), среднее время до прогрессирования после повторного лечения – 10, 6 мес. § в I линии лечения ремиссия достигнута в 97% случаев (полная ремиссия
 Mylotarg (гемтузумаб озогамицин) § моноклональные антитела, связанные с цитотоксическим веществом калихеамицином. Препарат относится к новому классу противоопухолевых средств, предназначенных для «прицельной антитело - химиотерапии» , § Показание: рецидивы ОМЛ.
Mylotarg (гемтузумаб озогамицин) § моноклональные антитела, связанные с цитотоксическим веществом калихеамицином. Препарат относится к новому классу противоопухолевых средств, предназначенных для «прицельной антитело - химиотерапии» , § Показание: рецидивы ОМЛ.
 HLA-фенотип Рак желудка – B 13/18, B 18/27, Dr 1/DR 7 A 2/B 41, A 3/B 51, A 9/B 41, A 10/B 5, A 10/B 51, A 1/DR 1, A 2/DR 7 Рак молочной железы – B 40/A 1, B 40/A 9, B 40/DR 6, DR 6/A 2, DR 6/B 40
HLA-фенотип Рак желудка – B 13/18, B 18/27, Dr 1/DR 7 A 2/B 41, A 3/B 51, A 9/B 41, A 10/B 5, A 10/B 51, A 1/DR 1, A 2/DR 7 Рак молочной железы – B 40/A 1, B 40/A 9, B 40/DR 6, DR 6/A 2, DR 6/B 40



