b02fd7e3a8ab44797983f78dc416196b.ppt
- Количество слайдов: 23
 ЖЕЛЕЗО
ЖЕЛЕЗО
 ПЛАН: I. II. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА. IV. ХИМИЧЕСКИЕ СВОЙСТВА
ПЛАН: I. II. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА. IV. ХИМИЧЕСКИЕ СВОЙСТВА
 I. КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. Периодической системы Д. И. Менделеева. Атомный номер 26, атомная масса 55. 847.
I. КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. Периодической системы Д. И. Менделеева. Атомный номер 26, атомная масса 55. 847.
 II. НАХОЖДЕНИЕ В ПРИРОДЕ В земной коре железо распространено достаточно широко. На его долю приходится: q q Около 4, 1% массы земной коры (4 -е место среди всех элементов, 2 -е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире. В морской воде 1· 10– 5 — 1· 10– 8% железа.
II. НАХОЖДЕНИЕ В ПРИРОДЕ В земной коре железо распространено достаточно широко. На его долю приходится: q q Около 4, 1% массы земной коры (4 -е место среди всех элементов, 2 -е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире. В морской воде 1· 10– 5 — 1· 10– 8% железа.
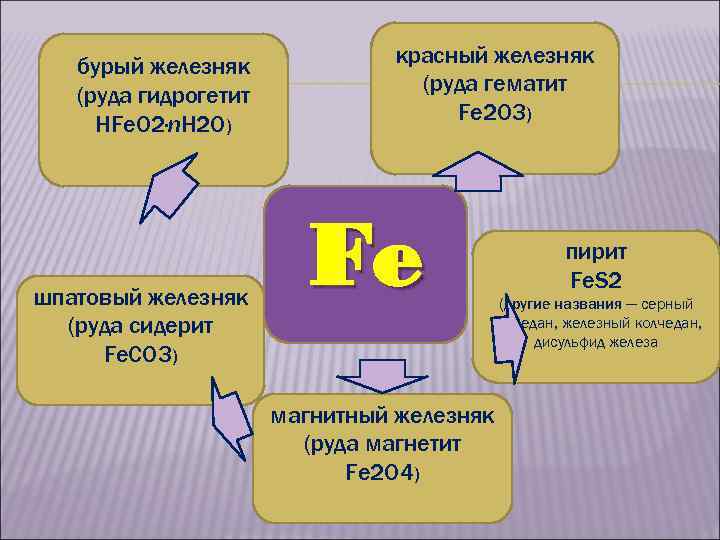 бурый железняк (руда гидрогетит НFe. O 2·n. H 2 O) шпатовый железняк (руда сидерит Fe. СO 3) красный железняк (руда гематит Fe 2 O 3) Fe пирит Fe. S 2 (другие названия — серный колчедан, железный колчедан, дисульфид железа магнитный железняк (руда магнетит Fe 2 O 4)
бурый железняк (руда гидрогетит НFe. O 2·n. H 2 O) шпатовый железняк (руда сидерит Fe. СO 3) красный железняк (руда гематит Fe 2 O 3) Fe пирит Fe. S 2 (другие названия — серный колчедан, железный колчедан, дисульфид железа магнитный железняк (руда магнетит Fe 2 O 4)
 БУРЫЙ ЖЕЛЕЗНЯК (РУДА ГИДРОГЕТИТ НFEO 2 · NH 2 O) КРАСНЫЙ ЖЕЛЕЗНЯК (РУДА ГЕМАТИТ Fe 2 O 3)
БУРЫЙ ЖЕЛЕЗНЯК (РУДА ГИДРОГЕТИТ НFEO 2 · NH 2 O) КРАСНЫЙ ЖЕЛЕЗНЯК (РУДА ГЕМАТИТ Fe 2 O 3)
 ШПАТОВЫЙ ЖЕЛЕЗНЯК (РУДА СИДЕРИТ Fe. СO 3) магнитный железняк (руда магнетит Fe 2 O 4)
ШПАТОВЫЙ ЖЕЛЕЗНЯК (РУДА СИДЕРИТ Fe. СO 3) магнитный железняк (руда магнетит Fe 2 O 4)
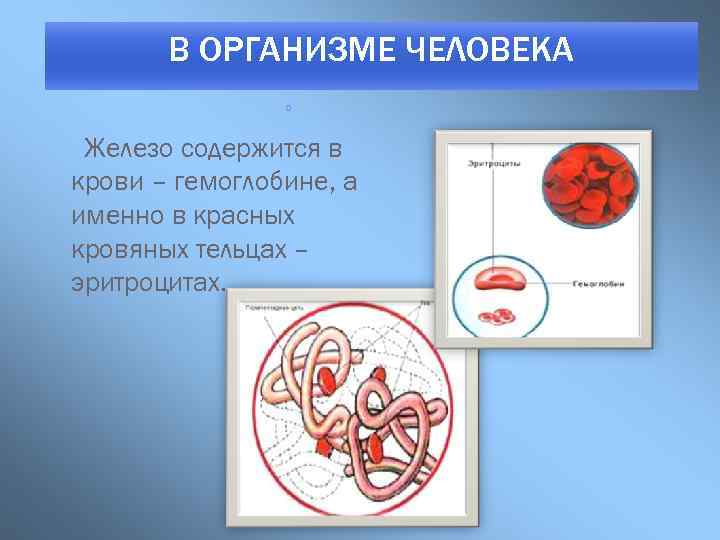 В ОРГАНИЗМЕ ЧЕЛОВЕКА о Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах.
В ОРГАНИЗМЕ ЧЕЛОВЕКА о Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах.
 В РАСТЕНИЯХ Железо влияет на процесс фотосинтеза.
В РАСТЕНИЯХ Железо влияет на процесс фотосинтеза.
 В БЫТУ ЧЕЛОВЕКА Из железа изготавливают различные виды транспорта
В БЫТУ ЧЕЛОВЕКА Из железа изготавливают различные виды транспорта
 В ВОЕННОЙ ПРОМЫШЛЕННОСТИ
В ВОЕННОЙ ПРОМЫШЛЕННОСТИ
 ЖЕЛЕЗО В ИСТОРИИ В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т. д.
ЖЕЛЕЗО В ИСТОРИИ В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т. д.
 III. ФИЗИЧЕСКИЕ СЫВОЙСТВА q q q Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
III. ФИЗИЧЕСКИЕ СЫВОЙСТВА q q q Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
 IV. ХИМИЧЕСКИЕ СВОЙСТВА Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2 e=Fe+2 Fe-3 e=Fe+3 Электронные структуры 3 d- и 4 s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так:
IV. ХИМИЧЕСКИЕ СВОЙСТВА Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2 e=Fe+2 Fe-3 e=Fe+3 Электронные структуры 3 d- и 4 s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так:
 1. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (Феррит железа) 2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3
1. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (Феррит железа) 2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3
 3. Взаимодействие с простыми веществами: 3. 1 Горит в кислороде 3 Fe + 2 O 2 =Fe 3 O 4 3. 2 Реагирует с хлором 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 3. 3 Взаимодействует с серой Fe + S = Fe. S
3. Взаимодействие с простыми веществами: 3. 1 Горит в кислороде 3 Fe + 2 O 2 =Fe 3 O 4 3. 2 Реагирует с хлором 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 3. 3 Взаимодействует с серой Fe + S = Fe. S
 4. Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + Cu. SO 4 = Fe. SO 4 + Cu 5. При высокой температуре (700 -900°С) железо реагирует с парами воды: 3 Fe+4 Н 2 O=Fe 3 O 4+4 Н 2
4. Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + Cu. SO 4 = Fe. SO 4 + Cu 5. При высокой температуре (700 -900°С) железо реагирует с парами воды: 3 Fe+4 Н 2 O=Fe 3 O 4+4 Н 2
 6. С КИСЛОТАМИ: q С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4 = Fe. SO 4 + H 2 q С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции. Растворяется железо в разбавленной азотной кислоте. 8 Fe+30 HNO 3=8 Fe(NO 3)3+3 NH 4 NO 3+9 H 2 O
6. С КИСЛОТАМИ: q С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4 = Fe. SO 4 + H 2 q С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции. Растворяется железо в разбавленной азотной кислоте. 8 Fe+30 HNO 3=8 Fe(NO 3)3+3 NH 4 NO 3+9 H 2 O
 7. ОКИСЛЕНИЕ ЖЕЛЕЗА При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4 Fe. Cl 2 + O 2 + 2 H 2 O = 4 Fe(OH)Cl 2 8. Соединения железа (III) в растворах восстанавливаются металлическим железом: Fe + 2 Fe. Cl 3 = 3 Fe. Cl 2
7. ОКИСЛЕНИЕ ЖЕЛЕЗА При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4 Fe. Cl 2 + O 2 + 2 H 2 O = 4 Fe(OH)Cl 2 8. Соединения железа (III) в растворах восстанавливаются металлическим железом: Fe + 2 Fe. Cl 3 = 3 Fe. Cl 2
 ОКСИД ЖЕЛЕЗА 1. Проявляет основные свойства, взаимодействуя с кислотами: Fe. O+H 2 SO 4 = Fe. SO 4 + H 2 O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: Мn. O + Fe 2 O 3 =Mn (Fe. O 2)2
ОКСИД ЖЕЛЕЗА 1. Проявляет основные свойства, взаимодействуя с кислотами: Fe. O+H 2 SO 4 = Fe. SO 4 + H 2 O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: Мn. O + Fe 2 O 3 =Mn (Fe. O 2)2
 КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ИОНЫ FE 2+ И FE 3+. Fe. SO 4 + K 3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] красная кровяная соль Fe. CI 3 + K 4 [Fe(CN)6 ] желтая кровяная соль Fe. CI 3 + 3 KCNS = + K 2 SO 4 турнбулева синь KFe+3 [Fe +2(CN)6 ] +3 KCI берлинская лазурь = Fe(CNS )3 +3 KCI кроваво-красный
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ИОНЫ FE 2+ И FE 3+. Fe. SO 4 + K 3 [Fe(CN)6 ] = KFe +2 [Fe +3(CN)6 ] красная кровяная соль Fe. CI 3 + K 4 [Fe(CN)6 ] желтая кровяная соль Fe. CI 3 + 3 KCNS = + K 2 SO 4 турнбулева синь KFe+3 [Fe +2(CN)6 ] +3 KCI берлинская лазурь = Fe(CNS )3 +3 KCI кроваво-красный
 Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.
Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.
 1. http: //images. yandex. ru/yandsearch? text=пирит фото&rpt=simage&img_url=vibrate. files. wordpress. com%2 F 2007%2 Fpyrite. j pg%3 Fw%3 D 556%26 h%3 D 411&spsite=vibrate. wordpress. com&p 2. http: //images. yandex. ru/yandsearch? rpt=simage&img_url=morethinking. files. wordpr ess. com%2 F 2009%2 F 08%2 Fpyrite-foolsgold. jpg%3 Fw%3 D 400%26 h%3 D 334&text=%D 0%BF%D 0%B 8%D 1%80%D 0%B 8%D 1%82%20%D 1%84%D 0%BE%D 1%82%D 0%BE&spsite=morethinking. wordpress. co m&p=3 3. http: //ru. wikipedia. org/wiki/Fe 4. http: //all-met. narod. ru/fe. html 5. http: //www. chem 100. ru/elem. php? n=26 6. http: //images. yandex. ru/yandsearch? ed=1&rpt=simage&text=%D 1%85%D 0%B 8%D 0 %BC%D 0%B 8%D 1%87%D 0%B 5%D 1%81%D 0%BA%D 0%B 8%D 0%B 5%20%D 1%81% D 0%B 2%D 0%BE%D 0%B 9%D 1%81%D 1%82%D 0%B 0%20%D 0%B 6%D 0%B 5%D 0%BB%D 0%B 5%D 0%B 7%D 0%B 0&img_url=www. o 8 ode. ru%2 Fimage%2 Farticle %2 F 0001%2 F 20090509081505. jpg&spsite=fake-006 -9684324. ru&p=0 7. http: //images. yandex. ru/yandsearch? ed=1&rpt=simage&text=%D 1%85%D 0%B 8%D 0 %BC%D 0%B 8%D 1%87%D 0%B 5%D 1%81%D 0%BA%D 0%B 8%D 0%B 5%20%D 1%81% D 0%B 2%D 0%BE%D 0%B 9%D 1%81%D 1%82%D 0%B 0%20%D 0%B 6%D 0%B 5%D 0%BB%D 0%B 5%D 0%B 7%D 0%B 0&img_url=www. catalogmineralov. ru%2 Fpic%2 F 200842131005. jpg&spsite=fake-056 -11462585. ru&p=53
1. http: //images. yandex. ru/yandsearch? text=пирит фото&rpt=simage&img_url=vibrate. files. wordpress. com%2 F 2007%2 Fpyrite. j pg%3 Fw%3 D 556%26 h%3 D 411&spsite=vibrate. wordpress. com&p 2. http: //images. yandex. ru/yandsearch? rpt=simage&img_url=morethinking. files. wordpr ess. com%2 F 2009%2 F 08%2 Fpyrite-foolsgold. jpg%3 Fw%3 D 400%26 h%3 D 334&text=%D 0%BF%D 0%B 8%D 1%80%D 0%B 8%D 1%82%20%D 1%84%D 0%BE%D 1%82%D 0%BE&spsite=morethinking. wordpress. co m&p=3 3. http: //ru. wikipedia. org/wiki/Fe 4. http: //all-met. narod. ru/fe. html 5. http: //www. chem 100. ru/elem. php? n=26 6. http: //images. yandex. ru/yandsearch? ed=1&rpt=simage&text=%D 1%85%D 0%B 8%D 0 %BC%D 0%B 8%D 1%87%D 0%B 5%D 1%81%D 0%BA%D 0%B 8%D 0%B 5%20%D 1%81% D 0%B 2%D 0%BE%D 0%B 9%D 1%81%D 1%82%D 0%B 0%20%D 0%B 6%D 0%B 5%D 0%BB%D 0%B 5%D 0%B 7%D 0%B 0&img_url=www. o 8 ode. ru%2 Fimage%2 Farticle %2 F 0001%2 F 20090509081505. jpg&spsite=fake-006 -9684324. ru&p=0 7. http: //images. yandex. ru/yandsearch? ed=1&rpt=simage&text=%D 1%85%D 0%B 8%D 0 %BC%D 0%B 8%D 1%87%D 0%B 5%D 1%81%D 0%BA%D 0%B 8%D 0%B 5%20%D 1%81% D 0%B 2%D 0%BE%D 0%B 9%D 1%81%D 1%82%D 0%B 0%20%D 0%B 6%D 0%B 5%D 0%BB%D 0%B 5%D 0%B 7%D 0%B 0&img_url=www. catalogmineralov. ru%2 Fpic%2 F 200842131005. jpg&spsite=fake-056 -11462585. ru&p=53


