Лекция 9 Железо, кобальт, никель.ppt
- Количество слайдов: 45

Железо, кобальт, никель

VIII группа содержит 9 d-элементов Fe Co Ni Триада Fe Rn Rh Pd Триада Pd Os Ir Pt Триада Pd и Pt часто объединяют в семейство платиновых металлов.

Железо 56 Fe 3 d 64 s 2 26 электронная конфигурация Железо – металл серого цвета, довольно мягкий, ковкий и тягучий, хорошо поддающийся различным способам механической обработки.

• Железо – один из распространенных элементов в земной коре (4, 1% массы земной коры).

Железосодержащие руды: • красные железняки (руда гематит, Fe 2 O 3 ; содержит до 70% Fe), • магнитные железняки (руда магнетит, Fe 3 О 4; содержит 72, 4% Fe), • бурые железняки (руда гидрогетит НFe. O 2·n. H 2 O), • шпатовые железняки (руда сидерит, карбонат железа, Fe. СО 3; содержит около 48% Fe). • также встречаются большие месторождения пирита Fe. S 2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие)
![Степени окисления железа Ст. ок. Пример -2 Na 2[Fe(CO)4] 0 Fe(CO)5 +2 Fe. Cl Степени окисления железа Ст. ок. Пример -2 Na 2[Fe(CO)4] 0 Fe(CO)5 +2 Fe. Cl](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-6.jpg)
Степени окисления железа Ст. ок. Пример -2 Na 2[Fe(CO)4] 0 Fe(CO)5 +2 Fe. Cl 2 +3 Fe(OH)3 +4 Ca. Fe. O 3 +6 K 2 Fe. O 4

Соединения железа • Твердые растворы (Fe + Si, С, N, B, P, H) • Металлоподобные соединения (Fe 3 C, Fe 3 N) • Соли и солеподобные соединения (Fe. Cl 3, Fe. S)

Металлоподобные соединения и твердые растворы • Железо используется главным образом в сплавах, прежде всего в сплавах с углеродом — различных чугунах и сталях: • чугун содержит С — 2 -4%, • сталь – до 2 %, • мягкая сталь – менее 0, 3%.

Получение чугуна • Процесс проходит в доменной печи. Fe 2 O 3 + 3 C = 2 Fe + 3 CO; Fe 2 O 3 + 3 CО = 2 Fe + 3 CO 2.

Получение стали • Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.

• Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
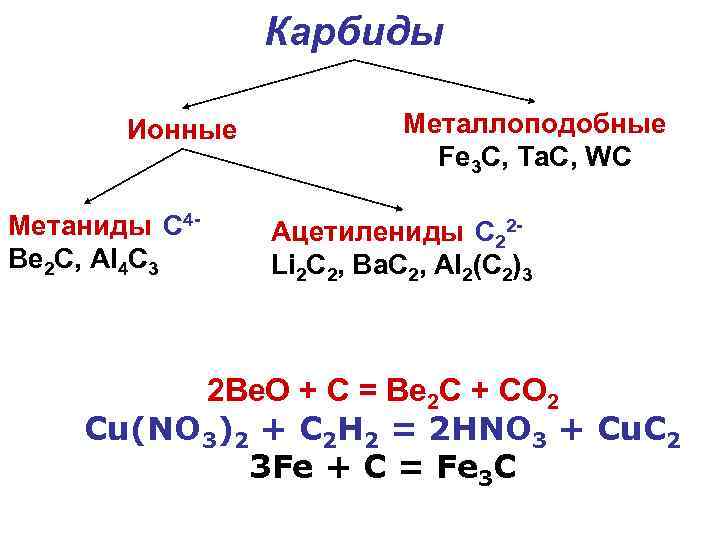
Карбиды Ионные Метаниды C 4 Ве 2 С, Al 4 С 3 Металлоподобные Fe 3 C, Ta. C, WC Ацетилениды C 22 Li 2 С 2, Ba. C 2, Al 2(C 2)3 2 Be. O + C = Be 2 C + CO 2 Cu(NO 3)2 + C 2 H 2 = 2 HNO 3 + Cu. C 2 3 Fe + C = Fe 3 C

Соли и солеподобные соединения Степень окисления 0, -2 200° Fe + CO → Fe(CO)5 2· 107 Па желтая летучая жидкость Донорно-акцепторное взаимодействие: • Донорно-акцепторная связь CO: → Fe (σ – связь) • Обратно-дативная связь Fe → CO (π– связь)
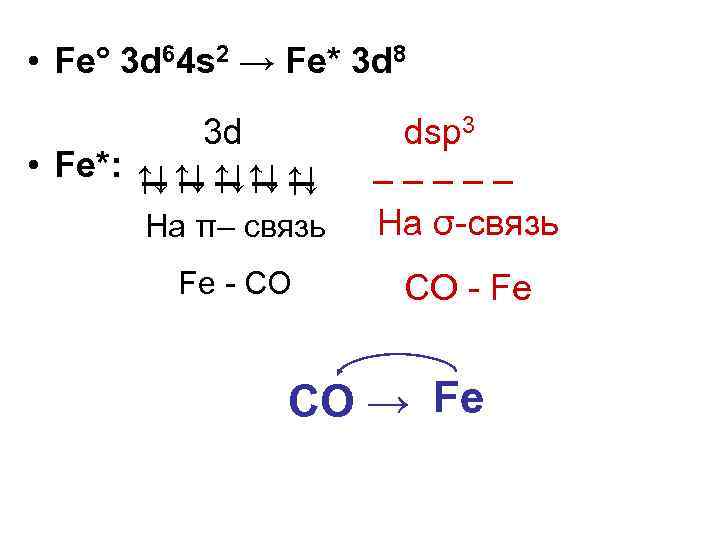
• Fe° 3 d 64 s 2 → Fe* 3 d 8 3 d dsp 3 • Fe*: ↑↓ ↑↓ ↑↓ _ _ _ _ _ На π– связь На σ-связь Fe - CO СO - Fe СO → Fe

• При нагревании карбонилы разлагаются. Это используется для получения высокочистых металлов: CO 250° Fe(неочищ) → Fe(CO)5 → Fe(чист) 200° - CO
![• Карбонилы могут восстанавливаться: Fe°(CO)5 + 2 Na → Na 2[Fe-2(CO)4] + CO • Карбонилы могут восстанавливаться: Fe°(CO)5 + 2 Na → Na 2[Fe-2(CO)4] + CO](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-16.jpg)
• Карбонилы могут восстанавливаться: Fe°(CO)5 + 2 Na → Na 2[Fe-2(CO)4] + CO Fe°(CO)5 + 4 KOH → K 2[Fe-2(CO)4] + K 2 CO 3 + 2 H 2 O • И окисляться: Fe°(CO)5 + J 2 → [Fe 2+(CO)4]J 2 + CO

Степень окисления +2 Координационное число 6 Fe 2+ + H 2 O → [Fe(H 2 O)6]2+ Ион устойчив в кислой среде. В нейтральной или щелочной - переходит в гидратированный ион Fe 3+ 4 Fe(OH)2 + O 2 + 2 H 2 O → 4 Fe(OH)3 [Fe(H 2 O)6]2+→ [Fe(H 2 O)6]3+ Бледно-зеленый бледно-фиолет

+3 + e- = Fe+2 Fe P°=0. 77 B Fe+2 легко окисляется кислородом воздуха: 4 Fe. S 2 + O 2 + 10 H 2 O → 4 Fe(OH)3 + 4 H 2 S
![Ферраты(II) M 2[Fe. Cl 4] Наиболее устойчив цианидный комплекс Fe(II) [Fe(CN)6]46 KCN + Fe. Ферраты(II) M 2[Fe. Cl 4] Наиболее устойчив цианидный комплекс Fe(II) [Fe(CN)6]46 KCN + Fe.](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-19.jpg)
Ферраты(II) M 2[Fe. Cl 4] Наиболее устойчив цианидный комплекс Fe(II) [Fe(CN)6]46 KCN + Fe. SO 4= K 4[Fe(CN)6] + K 2 SO 4 Желтая кровяная соль является реактивом на Fe(III): Fe. Cl 3 + K 4[Fe(CN)6] = KFe+3[Fe+2(CN)6] + 3 KCl Берлинская лазурь

Степень окисления +3 Координационные числа 6 и 4 Водные растворы содержат ионы [Fe(H 2 O)6]3+
![В нейтральных растворах соли Fe(III) гидролизуются: [Fe(H 2 O)6]3+ + H 2 O [Fe(H В нейтральных растворах соли Fe(III) гидролизуются: [Fe(H 2 O)6]3+ + H 2 O [Fe(H](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-21.jpg)
В нейтральных растворах соли Fe(III) гидролизуются: [Fe(H 2 O)6]3+ + H 2 O [Fe(H 2 O)5 OH]2+ + H+ Бледно-фиолет желтый
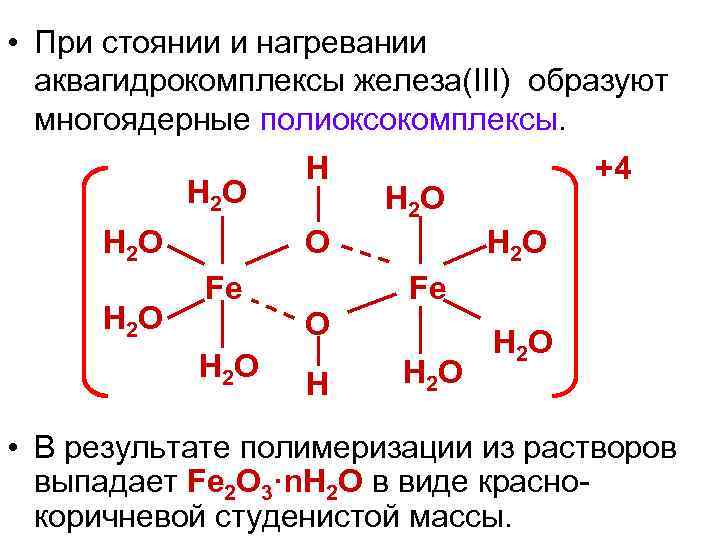
• При стоянии и нагревании аквагидрокомплексы железа(III) образуют многоядерные полиоксокомплексы. H 2 O H H 2 O O Fe H 2 O Fe O H 2 O +4 H H 2 O • В результате полимеризации из растворов выпадает Fe 2 O 3·n. H 2 O в виде краснокоричневой студенистой массы.
![Ферраты(III) M 3[Fe. Cl 4] Устойчивей ферратов(II) и легче образуются: 3 KOH + Fe(OH)3= Ферраты(III) M 3[Fe. Cl 4] Устойчивей ферратов(II) и легче образуются: 3 KOH + Fe(OH)3=](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-23.jpg)
Ферраты(III) M 3[Fe. Cl 4] Устойчивей ферратов(II) и легче образуются: 3 KOH + Fe(OH)3= K 3[Fe(OH)6]

Ферриты • Образуются при сплавлении Fe 2 O 3 или Fe(OH)3 со щелочами или карбонатами щелочных металлов: Na 2 CO 3 + Fe 2 O 3= 2 Na. Fe. O 2 + CO 2
![• Красная кровяная соль. Получают окислением соответствующего гексацианоферрата(II) калия: 2 K 4[Fe(CN)6] + • Красная кровяная соль. Получают окислением соответствующего гексацианоферрата(II) калия: 2 K 4[Fe(CN)6] +](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-25.jpg)
• Красная кровяная соль. Получают окислением соответствующего гексацианоферрата(II) калия: 2 K 4[Fe(CN)6] + Сl 2 = 2 K 3[Fe(CN)6] + 2 KCl • Является реактивом на Fe(II): Fe. Cl 2 + K 3[Fe(CN)6] = KFe+2[Fe+3(CN)6] + 3 KCl Турнбулева синь

• Соединения Fe(III) проявляют окислительные свойства; сульфид, йодид и цианид Fe(III) неустойчивы и при попытке получить их в растворе идет ок. -восст. процесс: 2 Fe. Cl 3 + 6 KJ = 2 Fe. J 2 + 6 KCl

Степень окисления +4, +6 Оксоферраты, сильные окислители: • M+2 Fe+4 O 3 • M 2+1 Fe+4 O 3 +2 Fe+6 O • M 4

Некоторые реакции оксоферратов: Fe. O 42 - + 8 H+ + 3 e- = Fe 3+ + 2 H 2 O, 2 Fe. O 42 - + 2 Cr 3+ + 2 H+ = 2 Fe 3+ + Cr 2 O 72 - + H 2 O
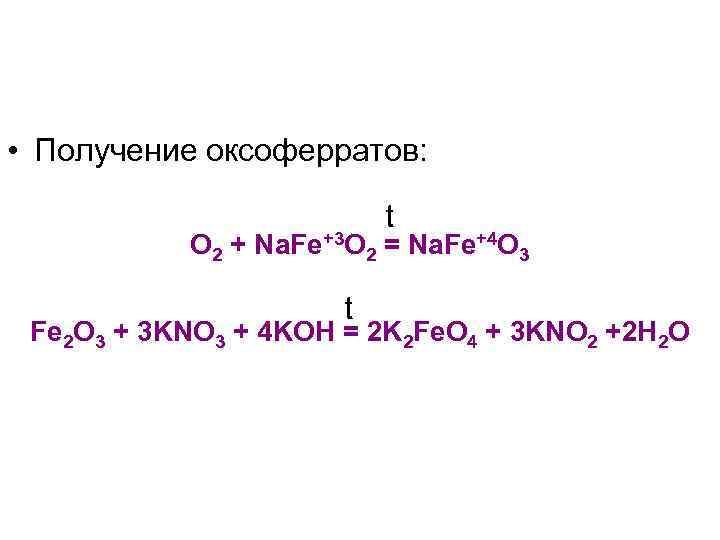
• Получение оксоферратов: t O 2 + Na. Fe+3 O 2 = Na. Fe+4 O 3 t Fe 2 O 3 + 3 KNO 3 + 4 KOH = 2 K 2 Fe. O 4 + 3 KNO 2 +2 H 2 O

Kобальт 57 27 Со 3 d 74 s 2 - электронная конфигурация Кобальт – твердый голубоватобелый металл, менее реакционноспособный чем железо.

Степень окисления +2, +3 • В водном растворе образует устойчивый комплекс розового цвета: [Со(H 2 O)6]2+

• При добавлении Na. OH или аммиачного раствора к раствору, содержащему ионы [Со(H 2 O)6]2+ , образуется синий осадок гидроксида кобальта(II), который растворяется в избытке аммиака с образованием комплекса гексамминокобальта(II): 6 NH 3 вод + [Со(H 2 O)6]2+ = [Co (NH 3)6]2+ + 6 H 2 O бледно-желт.
![• Кобальт входит в ряд тетраэдрических анионных комплексов: [Со. Сl 4]2 • Плучение: • Кобальт входит в ряд тетраэдрических анионных комплексов: [Со. Сl 4]2 • Плучение:](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-33.jpg)
• Кобальт входит в ряд тетраэдрических анионных комплексов: [Со. Сl 4]2 • Плучение: [Со(H 2 O)6]2+ + 4 Cl- = [Со. Сl 4]2 - + 6 H 2 O
![• Гидратированный ион кобальта(III) является сильным окислителем: [Со(H 2 O)6]3+ + 2 H • Гидратированный ион кобальта(III) является сильным окислителем: [Со(H 2 O)6]3+ + 2 H](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-34.jpg)
• Гидратированный ион кобальта(III) является сильным окислителем: [Со(H 2 O)6]3+ + 2 H 2 O = [Со(H 2 O)6]2+ + 4 Н+ + О 2
![• Ион кобальта(III) может стабилизироваться в присутствии сильных лигандных комплексообразователей: [Со(H 2 O)6]2+ • Ион кобальта(III) может стабилизироваться в присутствии сильных лигандных комплексообразователей: [Со(H 2 O)6]2+](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-35.jpg)
• Ион кобальта(III) может стабилизироваться в присутствии сильных лигандных комплексообразователей: [Со(H 2 O)6]2+ + 6 NH 3 = [Со(NH 3)6]3+ + 6 H 2 О + e-

Никель 58 28 Ni 3 d 84 s 2 - электронная конфигурация Никель – серебристо-белый металл, ковкий и пластичный.

Степень окисления +2 • Не обнаруживается в других состояниях окисления. • Подобно другим переходным металлам образует комплексы.
![• В водном растворе образует устойчивый комплекс гексаакваникеля: [Ni(H 2 O)6]2+ + OH- • В водном растворе образует устойчивый комплекс гексаакваникеля: [Ni(H 2 O)6]2+ + OH-](https://present5.com/presentation/3/126659746_100833385.pdf-img/126659746_100833385.pdf-38.jpg)
• В водном растворе образует устойчивый комплекс гексаакваникеля: [Ni(H 2 O)6]2+ + OH- = Ni(OH)2↓+ H 2 O зеленый

• Никель образует комплексы с тетраэдрической и плоской квадратной структурой.

• Характерна реакция ионов 2+ с диметилглиоксимом, Ni приводящая к образованию розово-красного диметилглиоксимата никеля.
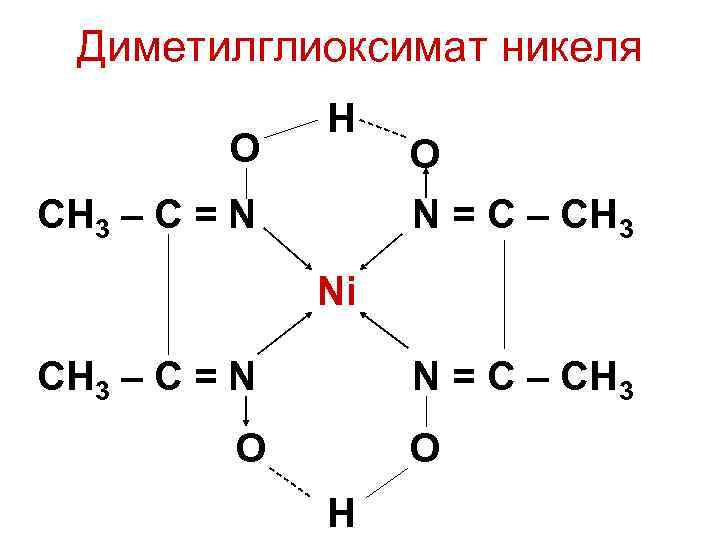
Диметилглиоксимат никеля O H O СH 3 – C = N N = C – CH 3 Ni СH 3 – C = N N = C – CH 3 O O H

• Эту реакцию используют при количественном определении никеля, а продукт реакции — как пигмент косметических материалов и для других целей.

Применение железа • Его используют при изготовлении сердечников электромагнитов, • катализатор химических процессов, • сплавы железа — чугун и сталь — составляют основу современной техники, • сульфат железа(III) используют при водоподготовке, • оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.

Применение кобальта • Основная доля получаемого кобальта расходуется на приготовление различных сплавов. • Магнитные сплавы на основе кобальта используют при изготовлении сердечников электромоторов, • Для изготовления головок магнитной записи применяют кобальтовые магнитомягкие сплавы. • Кобальт и некоторые его соединения служат катализаторами. • Соединения кобальта используют как пигменты многих красителей.

Применение никеля • Основная доля выплавляемого никеля расходуется на приготовление различных сплавов. • Из никелевых сплавов чеканятся монеты. • Тонкие никелевые слои используются для защиты различных металлов от коррозии путем их никелирования. • Никель широко используют при изготовлении различной химической аппаратуры, в кораблестроении, в электротехнике, при изготовлении щелочных аккумуляторов. • Никель Ренея находит широкое применение как катализатор самых разных химических реакций. Оксиды и некоторые соли служат катализаторами различных процессов.
Лекция 9 Железо, кобальт, никель.ppt