Fe_Co_Ni_-_FKh-12_2.ppt
- Количество слайдов: 40

Железо, кобальт, никель Подготовил Белов Сергей ФХ-12
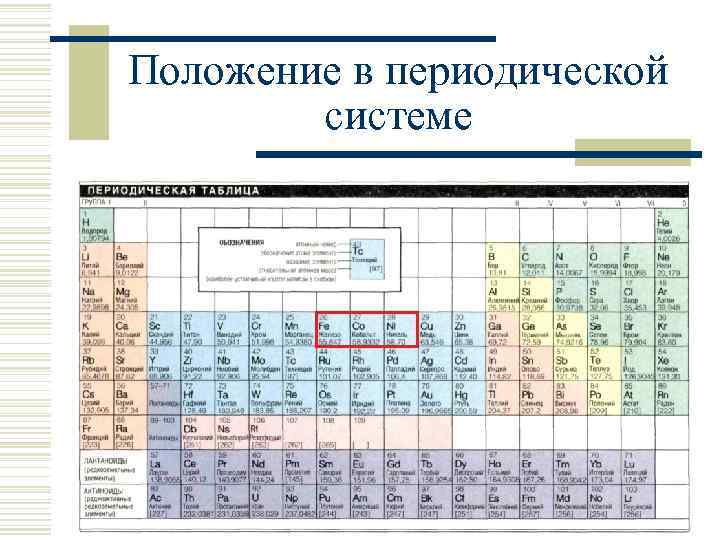
Положение в периодической системе

w Fe (лат. Ferrum) 4 -3 тыс. до н. э. Хетты w Co (лат. Cobaltum) 1735 г. Г. Брандт w Ni (лат. Niccolum) 1751 г. А. Ф. Кронстедт Георг Брандт Аксель Фредрик Кронстедт

Распространение в природе и важнейшие минералы w 4. Fe – 4, 70% w 22. Ni – 0, 015% w 30. Co – 0, 0037% Лимонит Гематит Железо самородное w. Гематит Fe 2 O 3 w. Магнетит (Fe. IIFe 2 III)O 4 w. Гётит Fe. O(OH) w. Сидерит Fe. CO 3 w. Лимонит Fe 2 O 3. n. H 2 O Сидерит Гётит

Халькогениды Пирит Пирротин w. Пирротин Fe 0, 877 S w. Пирит Fe(S 2) w. Смальтин (Ni, Co, Fe)As 2 w. Кобальтин Co. As. S w. Арсенопирит Ni. As. S w. Никелин Ni. As w. Хлоантит (Co, Ni)As 2 w. Пентландит (Fe, Ni)9 S 8 Пентландит Хлоантит Эритрин w Эритрин Co 3(As. O 4)2. 8 H 2 O w Гарниерит Ni 6(Si 4 O 10)(OH)8 Гарниерит Арсенопирит Никелин
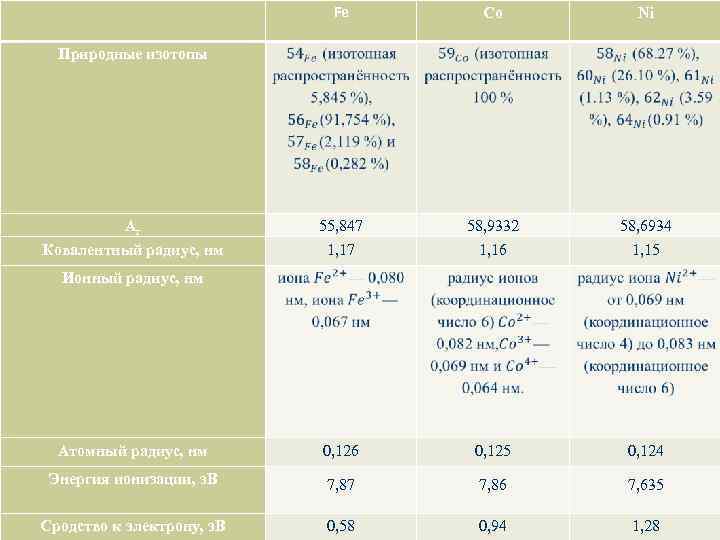
Fe Co Ni 55, 847 1, 17 58, 9332 1, 16 58, 6934 1, 15 Атомный радиус, нм 0, 126 0, 125 0, 124 Энергия ионизации, э. В 7, 87 7, 86 7, 635 Сродство к электрону, э. В 0, 58 0, 94 1, 28 Природные изотопы Ar Ковалентный радиус, нм Ионный радиус, нм
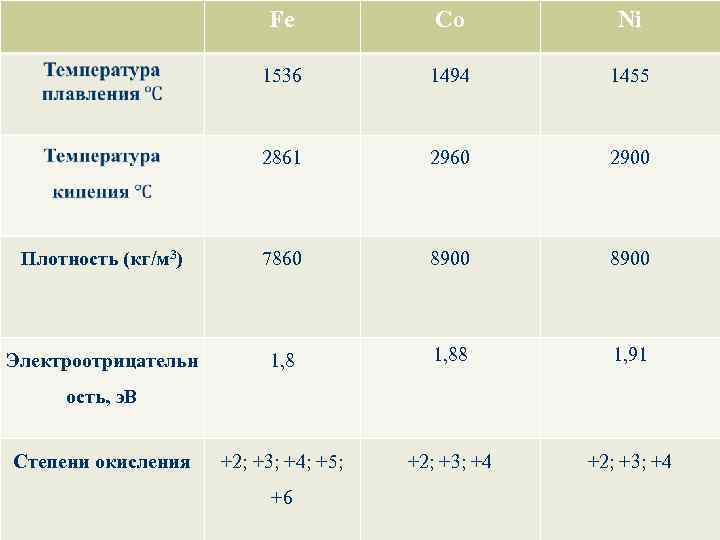
Fe Co Ni 1536 1494 1455 2861 2960 2900 Плотность (кг/м 3) 7860 8900 Электроотрицательн 1, 88 1, 91 +2; +3; +4; +5; +2; +3; +4 ость, э. В Степени окисления +6

Простые вещества Fe Co Ni Семейство железа Железо Кобальт Никель

Получение железа w
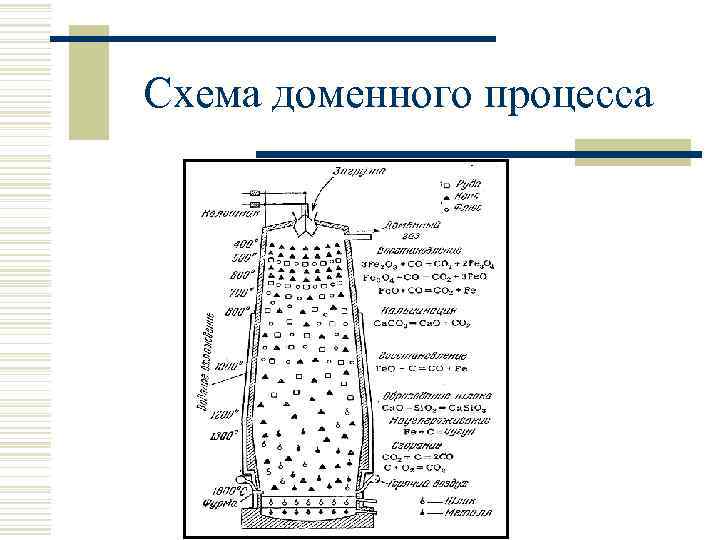
Схема доменного процесса

Получение кобальта w
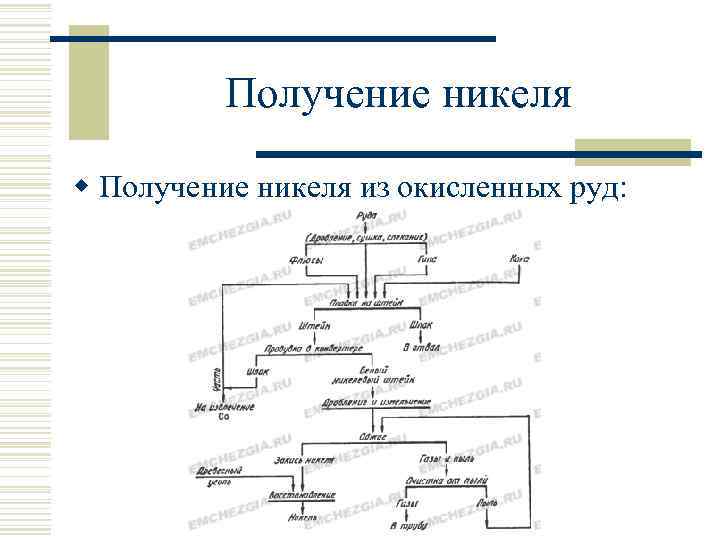
Получение никеля w Получение никеля из окисленных руд:

w

Химические свойства Fe w

3. Взаимодействие с простыми веществами: w

w

6. с кислотами: w
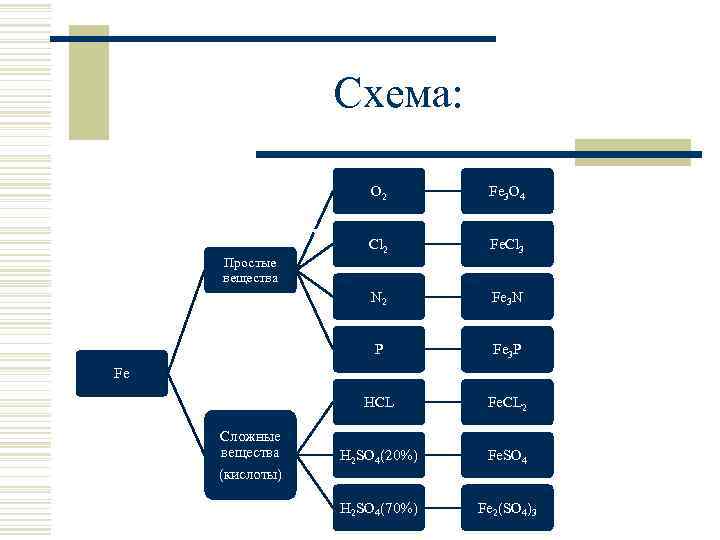
Схема: О 2 Fe 3 O 4 Cl 2 Fe. Cl 3 N 2 Fe 3 N P Fe 3 P HCL Fe. CL 2 H 2 SO 4(20%) Fe. SO 4 H 2 SO 4(70%) Fe 2(SO 4)3 Простые вещества Fe Сложные вещества (кислоты)

Химические свойства Co w

w

w
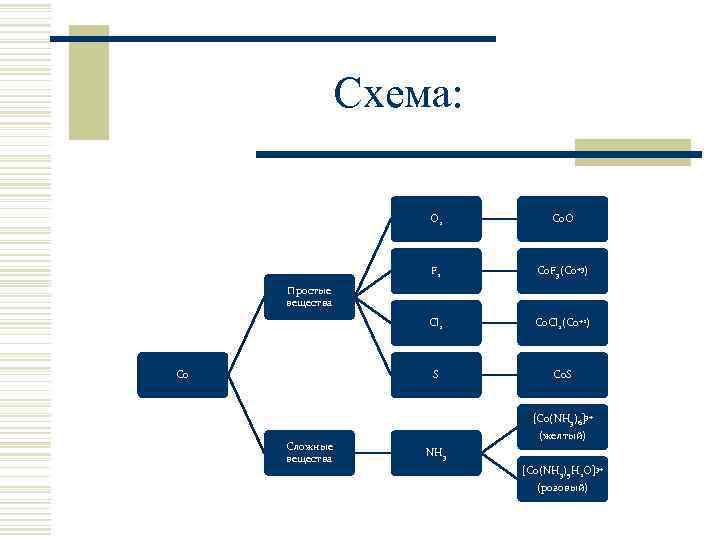
Схема: O 2 Co. O F 2 Co. F 3(Co+3) Cl 2 Co. Cl 2(Co+2) S Co. S Простые вещества Co Сложные вещества [Co(NH 3)6]3+ (желтый) NH 3 [Co(NH 3)5 H 2 O]3+ (розовый)

Химические свойства Ni w

w
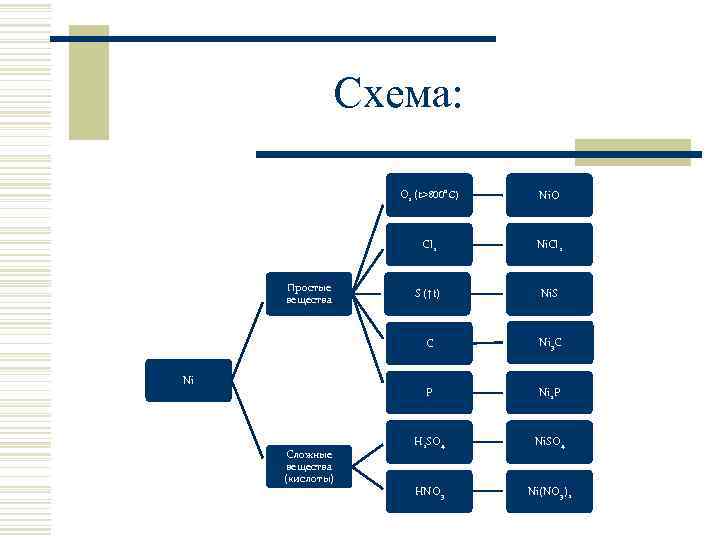
Схема: O 2 (t>800˚C) Cl 2 Сложные вещества (кислоты) S (↑t) Ni. S Ni 3 C P Ni Ni. Cl 2 C Простые вещества Ni. O Ni 2 P H 2 SO 4 Ni. SO 4 HNO 3 Ni(NO 3)2
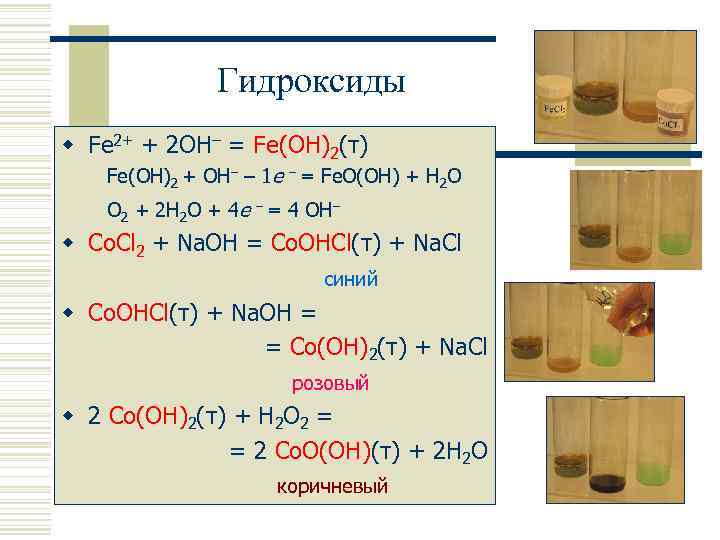
Гидроксиды w Fe 2+ + 2 OH– = Fe(OH)2(т) Fe(OH)2 + OH– – 1 e – = Fe. O(OH) + H 2 O O 2 + 2 H 2 O + 4 e – = 4 OH– w Co. Cl 2 + Na. OH = Co. OHCl(т) + Na. Cl синий w Co. OHCl(т) + Na. OH = = Co(OH)2(т) + Na. Cl розовый w 2 Co(OH)2(т) + H 2 O 2 = = 2 Co. O(OH)(т) + 2 H 2 O коричневый

Гидроксиды никеля w Ni(OH)2 уст. на воздухе w 4 Ni(NO 3)2. 6 H 2 O = = 4 Ni. O(OH) + 8 NO 2 + 22 H 2 O w 4 Ni. O(OH) = 4 Ni. O + O 2 + 2 H 2 O w 2 Ni(OH)2(т) + Br 2 + 2 Na. OH = зеленый = 2 Ni. O(OH)(т) + 2 Na. Br + 2 H 2 O черный w Ni. O(OH)/Ni(OH)2 = 0, 78 В w Br 2/Br– = 1, 09 В

Окислительные свойства w 2 Ni. O(OH)(т) + 6 HCl = = 2 Ni. Cl 2 + 4 H 2 O Ni. O(OH) + 3 H+ + 1 e– = Ni 2+ + 2 H 2 O 2 Cl– – 2 e – = Cl 2 w Ni. O(OH)/Ni 2+ = +2, 25 В w Cl 2/Cl– = 1, 34 В w 4 Ni. IIIO(OH)(т) + 4 H 2 SO 4 = = O 2 + 4 Ni. SO 4 + 6 H 2 O Ni. O(OH) + 3 H+ + 1 e – = Ni 2+ + 2 H 2 O – 4 e – = O 2 + 4 H+ O 2/H 2 O= 1, 23 В
![Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2 Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2](https://present5.com/presentation/71561867_164259190/image-29.jpg)
Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 7 w [Co(Н 2 О)6]2+ + H 2 O [Co(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 9 w [Ni(Н 2 О)6]2+ + H 2 O [Ni(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 11 Fe. II Co. II Ni. II рост основных свойств w[Fe(Н 2 О)6]3+ + H 2 O [Fe(Н 2 О)5 OH]2+ + H 3 O+ ; Kк 10– 3 Kк Fe 2+·H 2 O/Fe. OH+ << Kк Fe 3+·H 2 O/Fe. OH 2+ Влияние ст. окисл. : рост кислотных св-в с ростом ст. ок.
![Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H](https://present5.com/presentation/71561867_164259190/image-30.jpg)
Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H 2 O + H 2 O; Kк 10– 3 OH]2+ р. Н [Fe(H 2 O)5 2 3 + H 2 O; Kк 10– 4 [Fe(H 2 O)4(OH)2]+ H 2 O OH Fe H 2 O OH 2 Fe OH OH 2 + H 2 O [(H 2 O)4 Fe(OH)2 Fe(H 2 O)4]4+ (многоядерный компл. ; желт. ) + H 2 O Fe. O(OH)(т) р. Н > 3
![Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х + Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х +](https://present5.com/presentation/71561867_164259190/image-31.jpg)
Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х + x. H 2 O; смесь комплексов 4 -х видов β 3 105 [Fe(Н 2 О)6 -х(NCS)х]3−х + 4 F− [Fe(H 2 O)2 F 4]− + x. NCS− + (4−x)H 2 O; β 4 1015 Получение и разрушение тиоцианатного к-са Fe(III)
![[Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ + [Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ +](https://present5.com/presentation/71561867_164259190/image-32.jpg)
[Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ + H 3 PO 4 [Fe(HPO 4)3]3– H 2 PO 4– Kк 10– 3 бидент. HPO 42– Kк 10– 8 [Fe(PO 4)3]6– PO 43– Kк 10– 13 бидент. Fe 2+ + [Fe. III(CN)6]3– + K+ Fe 3+ + [Fe. II(CN) 6 ]4– + K(Fe. III, Fe. II )[(Fe. II, Fe. III)(CN)6] K+ синий осадок (берлинская лазурь, турнбуллева синь) KFe. II[Fe. III(NC)6]; яд (дисс. c выдел. CN–) KFe. III[Fe. II (CN)6]; β 6 1037
![Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca. Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca.](https://present5.com/presentation/71561867_164259190/image-33.jpg)
Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca. Cl 2 w [Co(H 2 O)4]2+ sp 3 фиолет. + Ca. Cl 2 w [Co(H 2 O)2 Cl 2] sp 3 синий + Ca. Cl 2 w [Co. Cl 4]2– sp 3 темно-синий w При нагревании Co[Co. Cl 4] [Co(H 2 O)6]2+ + 4 NCS (к) +эфир [Co(NCS)4]2 + 6 H 2 O синий, sp 3, β 4 102
![Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6 Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6](https://present5.com/presentation/71561867_164259190/image-34.jpg)
Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6 105 < β 6 1036 w 2 Co. IICl 2 + 12 NH 3·H 2 O + H 2 O 2 = = 2[Co. III(NH 3)6](OH)Cl 2 + 12 H 2 O Co 2+ + 6 NH 3·H 2 O – 1 e – = [Co. III(NH 3)6]3+ + 6 H 2 O H 2 O 2 + 2 e – = 2 OH– w Побочные продукты: красный [Co(NH 3)5 Cl]2+, коричневый [(NH 3)5 Co(O 22 )Co(NH 3)5]4+, фиолетовый цис-[Со(NH 3)4 Cl 2]+, зеленый транс-[Co(NH 3)4 Cl 2]+, красный [Co(H 2 O)(NH 3)5]3+.

Комплексы кобальта и никеля • Co. IICl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3[Co. III(NO 2)6] + NO + 2 KCl + 2 CH 3 COOK + H 2 O Co 2+ + 6 NO 2– + 3 K+ – 1 e – = K 3[Co. III(NO 2)6] NO 2– + 2 CH 3 COOH + 1 e – = NO + 2 CH 3 COO– + H 2 O w Ni. Cl 2 + 6 NH 3·H 2 O = [Ni(NH 3)6]Cl 2 + 6 H 2 O β 6 109 w Ni. Cl 2 + 2 NH 3·H 2 O + 2 H 2 L = = [Ni(HL)2] + 2 NH 4 Cl + 2 H 2 O H 2 L – диметилглиоксим (CH 3)2 C 2(NOH)2 (см. «Компл. соединения. Хелаты» )

Окислительно-восстановительные свойства Fe. VI – сильный окислитель w р. Н < 7: 4 Fe. O 42– + 20 H 3 O+ = 4 [Fe(H 2 O)6]3+ + 3 O 2 + 6 H 2 O Fe. O 42–/Fe 3+ = +1, 9 В w р. Н > 7: 4 Fe. O 42– + 3 S 2– + 4 H 2 O = Fe. S + 2 S + 8 OH– Fe. O 42–/Fe(OH)2 = +0, 34 В Fe. III – мягкий окислитель w 2 Fe. Cl 3 + 2 KI = 2 Fe. Cl 2 + I 2(т) + 2 KCl w 2 Fe. Cl 3 + H 2 S = 2 Fe. Cl 2 + S(т) + 2 HCl w Fe 3+/Fe 2+ = +0, 77 В

Применение Fe Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. w Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. w Железо может входить в состав сплавов на основе других металлов — например, никелевых. w Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. w Ультрадисперсный порошок магнетита используется во многих черно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса. w Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. w Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. w Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. w Железо применяется в качестве анода в железо-никелевых аккумуляторах, железовоздушных аккумуляторах. w Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.

Применение Co w

Применение Ni Сплавы Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок. w монель-металл (65 — 67 % Ni + 30 — 32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив; w белое золото (например 585 пробы содержит 58, 5 % золота и сплав (лигатуру) из серебра и никеля (или палладия)); w нихром, сплав никеля и хрома (60 % Ni + 40 % Cr); w пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис; w инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании; w Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина

Медицина w Применяется при изготовлении брекет-систем (никелид титана). w Протезирование Монетное дело Никель широко применяется при производстве монет во многих странах. В США монета достоинством в 5 центов носит разговорное название «никель» . Теплоизоляторы Чистый никель ввиду очень низкой теплопроводности иногда применяется для изготовления разного рода держателей нагретых предметов, сочетая хорошую теплоизоляцию с высокой прочностью и достаточной электропроводностью. В частности, из никеля делаются держатели и проводники для кварцевых горелок дуговых ртутных ламп. Музыкальная промышленность Также никель используется для производства обмотки струн музыкальных инструментов.
Fe_Co_Ni_-_FKh-12_2.ppt