 ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. периодической системы Менделеева. Атомный номер 26, атомная масса 55. 847.
ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. периодической системы Менделеева. Атомный номер 26, атомная масса 55. 847.
 Нахождение в природе Метеоритное железо
Нахождение в природе Метеоритное железо
 железный или серный колчедан) (пирит) Fe. S 2 Fe 2 O 3 (красный железняк) Fe Бурый железняк Лимонит 2 Fe 2 O 3 • 3 H 2 O Fe 3 O 4 (магнитны й железняк)
железный или серный колчедан) (пирит) Fe. S 2 Fe 2 O 3 (красный железняк) Fe Бурый железняк Лимонит 2 Fe 2 O 3 • 3 H 2 O Fe 3 O 4 (магнитны й железняк)
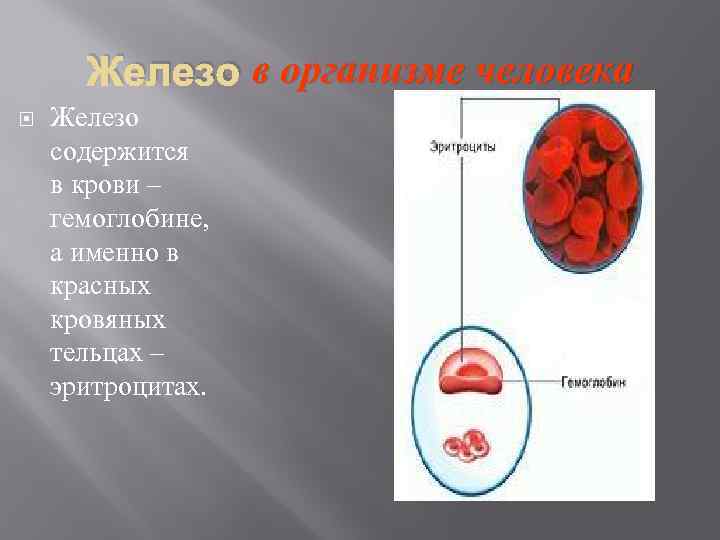 Железо в организме человека Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах.
Железо в организме человека Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах.
 Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде.
Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде.
 Железо в растениях. Железо влияет на процесс фотосинтеза.
Железо в растениях. Железо влияет на процесс фотосинтеза.
 Железо в быту человека. Из железа изготавливают различные виды транспорта
Железо в быту человека. Из железа изготавливают различные виды транспорта
 Железо в военной промышленности
Железо в военной промышленности
 Химические свойства: Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2 e=Fe+2 Fe-3 e=Fe+3
Химические свойства: Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3. Fe-2 e=Fe+2 Fe-3 e=Fe+3
 1) 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (Феррит железа 2) 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3 3)Fe + Cu. SO 4 = Fe. SO 4 + Cu 4)3 Fe+4 Н 2 O=Fe 3 O 4+4 Н 2
1) 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (Феррит железа 2) 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3 3)Fe + Cu. SO 4 = Fe. SO 4 + Cu 4)3 Fe+4 Н 2 O=Fe 3 O 4+4 Н 2
 Взаимодействие железа с кислородом: 3 Fe + 2 O 2 =Fe 3 O 4 (Fe. O*Fe 2 O 3)
Взаимодействие железа с кислородом: 3 Fe + 2 O 2 =Fe 3 O 4 (Fe. O*Fe 2 O 3)
 Взаимодействие железа с хлором: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3
Взаимодействие железа с хлором: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3
 Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4 = Fe. SO 4 + H 2
Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4 = Fe. SO 4 + H 2
 Физические свойства: Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
Физические свойства: Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0 С Температура кипения около 2800 0 С При температуре ниже 770 0 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается» .
 Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.
Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но пользуются железом до сих пор, и в настоящее время железо не заменимо в промышленности и труде.