Железо.pptx
- Количество слайдов: 11
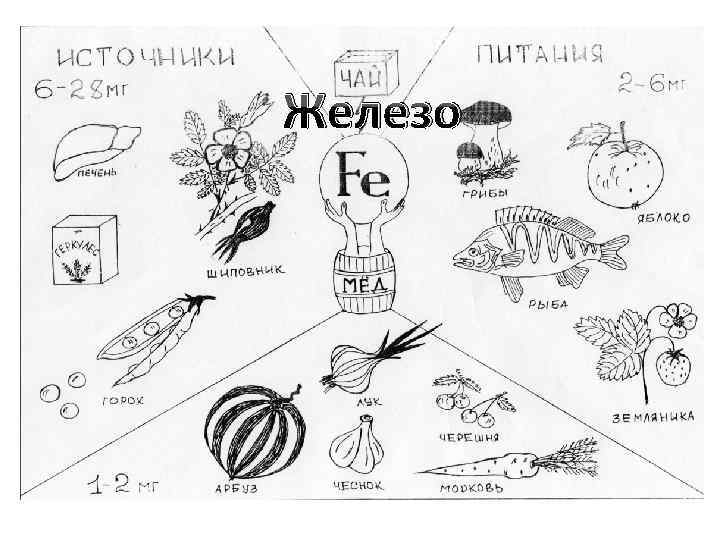 Железо (Fe, прикиньте ну)
Железо (Fe, прикиньте ну)
 Физические свойства При хранении на воздухе при температуре до 200°C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe 2 О 3·x. Н 2 О. С кислородом (O) железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe 2 О 3, при сгорании в чистом кислороде — оксид Fe 3 О 4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид Fe. О. При нагревании порошка серы (S)и железа образуется сульфид, приближенную формулу которого можно записать как Fe. S. Железо при нагревании реагирует с галогенами. Так как Fe. F 3 нелетуч, железо устойчиво к действию фтора (F) до температуры 200 -300°C. При хлорировании железа (при температуре около 200°C) образуется летучий Fe. Сl 3. Если взаимодействие железа и брома (Br) протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется Fe. Br 3. При нагревании Fe. Сl 3 и, особенно, Fe. Br 3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода (I) образуется иодид Fe 3 I 8. При нагревании железо реагирует с азотом (N), образуя нитрид железа Fe 3 N, с фосфором (P), образуя фосфиды Fe. P, Fe 2 P и Fe 3 P, с углеродом (C), образуя карбид Fe 3 C, с кремнием (Si), образуя несколько силицидов, например, Fe. Si. Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
Физические свойства При хранении на воздухе при температуре до 200°C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe 2 О 3·x. Н 2 О. С кислородом (O) железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe 2 О 3, при сгорании в чистом кислороде — оксид Fe 3 О 4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид Fe. О. При нагревании порошка серы (S)и железа образуется сульфид, приближенную формулу которого можно записать как Fe. S. Железо при нагревании реагирует с галогенами. Так как Fe. F 3 нелетуч, железо устойчиво к действию фтора (F) до температуры 200 -300°C. При хлорировании железа (при температуре около 200°C) образуется летучий Fe. Сl 3. Если взаимодействие железа и брома (Br) протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется Fe. Br 3. При нагревании Fe. Сl 3 и, особенно, Fe. Br 3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода (I) образуется иодид Fe 3 I 8. При нагревании железо реагирует с азотом (N), образуя нитрид железа Fe 3 N, с фосфором (P), образуя фосфиды Fe. P, Fe 2 P и Fe 3 P, с углеродом (C), образуя карбид Fe 3 C, с кремнием (Si), образуя несколько силицидов, например, Fe. Si. Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
 Химические свойства На воздухе железо легко окисляется в присутствии влаги (ржавление): 4 Fe + 3 O 2 + 6 H 2 O = 4 Fe(OH)3 Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II, III): 3 Fe + 2 O 2 = Fe 3 O 4 При высокой температуре (700– 9000 C) железо реагирует с парами воды: 3 Fe + 4 H 2 O = Fe 3 O 4 + 4 H 2 Железо реагирует с неметаллами при нагревании: 2 Fe + 3 Br 2 = 2 Fe. Br 3 Fe + S = Fe. S Железо легко растворяется в соляной и разбавленной серной кислотах: Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4(разб. ) = Fe. SO 4 + H 2 В концентрированных кислотах–окислителях железо растворяется только при нагревании 2 Fe + 6 H 2 SO 4(конц. ) = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O Fe + 6 HNO 3(конц. ) = Fe(NO 3)3 + 3 NO 2 + 3 H 2 O (на холоде концентрированные азотная и серная кислоты пассивируют железо). Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей. Fe + Cu. SO 4 = Fe. SO 4 + Cu
Химические свойства На воздухе железо легко окисляется в присутствии влаги (ржавление): 4 Fe + 3 O 2 + 6 H 2 O = 4 Fe(OH)3 Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II, III): 3 Fe + 2 O 2 = Fe 3 O 4 При высокой температуре (700– 9000 C) железо реагирует с парами воды: 3 Fe + 4 H 2 O = Fe 3 O 4 + 4 H 2 Железо реагирует с неметаллами при нагревании: 2 Fe + 3 Br 2 = 2 Fe. Br 3 Fe + S = Fe. S Железо легко растворяется в соляной и разбавленной серной кислотах: Fe + 2 HCl = Fe. Cl 2 + H 2 Fe + H 2 SO 4(разб. ) = Fe. SO 4 + H 2 В концентрированных кислотах–окислителях железо растворяется только при нагревании 2 Fe + 6 H 2 SO 4(конц. ) = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O Fe + 6 HNO 3(конц. ) = Fe(NO 3)3 + 3 NO 2 + 3 H 2 O (на холоде концентрированные азотная и серная кислоты пассивируют железо). Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей. Fe + Cu. SO 4 = Fe. SO 4 + Cu
 Качественные реакции на железо (II) 1. Качественная реакция на ион железа (II) – реакция с красной кровяной солью. • Добавим красную кровяную соль ‑ гексацианоферрат калия K 3[Fe(CN)6]. (Для определения железа (III) используют желтую кровяную соль. K 4[Fe(CN)6]). В присутствии ионов железа (II) образуется темно-синий осадок. Это - турнбуллева синь ‑ комплексная соль железа. KFe[Fe(CN)6]). • Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II). 2 К 3[Fe(CN)6 ] +3 Fe SO 4 = KFe[Fe(CN)6])↓ + 3 K 2 SO 4 • Турнбуллева синь очень похожа по свойствам на берлинскую лазурь и тоже служила красителем. Названа по имени одного из основателей шотландской фирмы по производству красителей «Артур и Турнбуль» . 2. Качественная реакция на ион железа (II) – реакция со щелочью. • Реакция со щелочью – еще один способ обнаружения ионов железа (II). Гидроксид железа (II) Fe(OH)2 - серо-зеленого цвета, гидроксид железа (III) Fe(OH)3 - бурый. Добавим щелочь (Na. OH) в колбу с солью железа - образуется серо-зеленый осадок. Значит, в растворе присутствуют ионы железа (II). Образовавшийся осадок – гидроксид железа (II) Fe(OH)2. • Fe SO 4 +2 Na. OH = Fe(OH)2 ↓ + Na 2 SO 4
Качественные реакции на железо (II) 1. Качественная реакция на ион железа (II) – реакция с красной кровяной солью. • Добавим красную кровяную соль ‑ гексацианоферрат калия K 3[Fe(CN)6]. (Для определения железа (III) используют желтую кровяную соль. K 4[Fe(CN)6]). В присутствии ионов железа (II) образуется темно-синий осадок. Это - турнбуллева синь ‑ комплексная соль железа. KFe[Fe(CN)6]). • Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II). 2 К 3[Fe(CN)6 ] +3 Fe SO 4 = KFe[Fe(CN)6])↓ + 3 K 2 SO 4 • Турнбуллева синь очень похожа по свойствам на берлинскую лазурь и тоже служила красителем. Названа по имени одного из основателей шотландской фирмы по производству красителей «Артур и Турнбуль» . 2. Качественная реакция на ион железа (II) – реакция со щелочью. • Реакция со щелочью – еще один способ обнаружения ионов железа (II). Гидроксид железа (II) Fe(OH)2 - серо-зеленого цвета, гидроксид железа (III) Fe(OH)3 - бурый. Добавим щелочь (Na. OH) в колбу с солью железа - образуется серо-зеленый осадок. Значит, в растворе присутствуют ионы железа (II). Образовавшийся осадок – гидроксид железа (II) Fe(OH)2. • Fe SO 4 +2 Na. OH = Fe(OH)2 ↓ + Na 2 SO 4
 Качественные реакции на железо (III) 1. Качественная реакция на ион железа (III)– реакция со щелочью. • Если в растворе есть ионы железа (III), образуется гидроксид железа (III) Fe(OH) 3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа (II) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа (III). Fe. Cl 3 + 3 Na. OH = Fe(OH)3 ↓+ 3 Na. Cl 2. Качественная реакция на ион железа (III) – реакция с желтой кровяной солью. • Желтая кровяная соль – это гексацианоферрат калия K 4[Fe(CN)6]. (Для определения железа (II) используют красную кровяную соль K 3[Fe(CN)6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа. 3 К 4[Fe(CN)6 ] +4 Fe. Cl 3 = KFe[Fe(CN)6])↓ + 12 KCl 3. Качественная реакция на ион железа (III) – реакция с роданидом калия. • Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа (III) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа (III). Роданид от греческого "родеос" - красный. Fe. Cl 3 + 3 КCNS = Fe(CNS)3 + 3 KCl • Берлинская лазурь была получена случайно в начале 18 века в Берлине красильных дел мастером Дисбахом. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей: яркой, устойчивой и недорогой. Вскоре стал известен и рецепт получения краски: поташ сплавляли с высушенной кровью животных и железными опилками. Выщелачиванием такого сплава получали желтую кровяную соль. Сейчас берлинскую лазурь используют для получения печатной краски и подкрашивания полимеров.
Качественные реакции на железо (III) 1. Качественная реакция на ион железа (III)– реакция со щелочью. • Если в растворе есть ионы железа (III), образуется гидроксид железа (III) Fe(OH) 3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа (II) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа (III). Fe. Cl 3 + 3 Na. OH = Fe(OH)3 ↓+ 3 Na. Cl 2. Качественная реакция на ион железа (III) – реакция с желтой кровяной солью. • Желтая кровяная соль – это гексацианоферрат калия K 4[Fe(CN)6]. (Для определения железа (II) используют красную кровяную соль K 3[Fe(CN)6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа. 3 К 4[Fe(CN)6 ] +4 Fe. Cl 3 = KFe[Fe(CN)6])↓ + 12 KCl 3. Качественная реакция на ион железа (III) – реакция с роданидом калия. • Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа (III) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа (III). Роданид от греческого "родеос" - красный. Fe. Cl 3 + 3 КCNS = Fe(CNS)3 + 3 KCl • Берлинская лазурь была получена случайно в начале 18 века в Берлине красильных дел мастером Дисбахом. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей: яркой, устойчивой и недорогой. Вскоре стал известен и рецепт получения краски: поташ сплавляли с высушенной кровью животных и железными опилками. Выщелачиванием такого сплава получали желтую кровяную соль. Сейчас берлинскую лазурь используют для получения печатной краски и подкрашивания полимеров.
 Оксид железа(II, III) — неорганическое соединение, двойной оксид металла железа с формулой Fe 3 O 4 или Fe. O • Fe 2 O 3, чёрные кристаллы, не растворимые в воде, образует кристаллогидрат. Получение • В природе встречаются большие залежи минерала магнетита — Fe 3 O 4 с различными примесями. Сжигание порошкообразного железа на воздухе: • Действие перегретого пара на железо: • Осторожное восстановление оксида железа(III) водородом: •
Оксид железа(II, III) — неорганическое соединение, двойной оксид металла железа с формулой Fe 3 O 4 или Fe. O • Fe 2 O 3, чёрные кристаллы, не растворимые в воде, образует кристаллогидрат. Получение • В природе встречаются большие залежи минерала магнетита — Fe 3 O 4 с различными примесями. Сжигание порошкообразного железа на воздухе: • Действие перегретого пара на железо: • Осторожное восстановление оксида железа(III) водородом: •
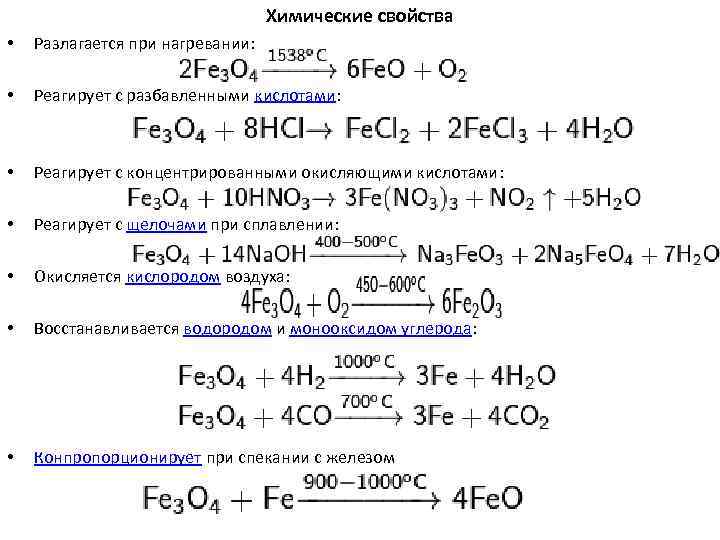 Химические свойства • Разлагается при нагревании: • Реагирует с разбавленными кислотами: • Реагирует с концентрированными окисляющими кислотами: • Реагирует с щелочами при сплавлении: • Окисляется кислородом воздуха: • Восстанавливается водородом и монооксидом углерода: • Конпропорционирует при спекании с железом
Химические свойства • Разлагается при нагревании: • Реагирует с разбавленными кислотами: • Реагирует с концентрированными окисляющими кислотами: • Реагирует с щелочами при сплавлении: • Окисляется кислородом воздуха: • Восстанавливается водородом и монооксидом углерода: • Конпропорционирует при спекании с железом
 • • • Гидроксид железа (II) Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха: Fe. Cl + 2 KOH 2 KCl + Fе(OH)2 Fe(OH)2 - слабое основание, растворимо в сильных кислотах: Fe(OH)2 + H 2 SO 4 Fe. SO 4 + 2 H 2 O При прокаливании Fe(OH)2 без доступа воздуха образуется оксид железа (II) Fe. O: Fe(OH)2 Fe. O + H 2 O В присутствии кислорода воздуха белый осадок Fe(OH)2, окисляясь, буреет – образуя гидроксид железа (III) Fe(OH)3: 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3 Соединения железа (II) обладают восстановительными свойствами, они легко превращаются в соединения железа (III) под действием окислителей: 10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 5 Fe 2(SO 4)3 + K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O 6 Fe. SO 4 + 2 HNO 3 + 3 H 2 SO 4 3 Fe 2(SO 4)3 + 2 NO + 4 H 2 O Соединения железа склонны к комплексообразованию (координационное число=6): Fe. Cl 2 + 6 NH 3[Fe(NH 3)6]Cl 2 Fe(CN)2 + 4 KCN K 4[Fe(CN)6](жёлтая кровяная соль)
• • • Гидроксид железа (II) Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха: Fe. Cl + 2 KOH 2 KCl + Fе(OH)2 Fe(OH)2 - слабое основание, растворимо в сильных кислотах: Fe(OH)2 + H 2 SO 4 Fe. SO 4 + 2 H 2 O При прокаливании Fe(OH)2 без доступа воздуха образуется оксид железа (II) Fe. O: Fe(OH)2 Fe. O + H 2 O В присутствии кислорода воздуха белый осадок Fe(OH)2, окисляясь, буреет – образуя гидроксид железа (III) Fe(OH)3: 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3 Соединения железа (II) обладают восстановительными свойствами, они легко превращаются в соединения железа (III) под действием окислителей: 10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 5 Fe 2(SO 4)3 + K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O 6 Fe. SO 4 + 2 HNO 3 + 3 H 2 SO 4 3 Fe 2(SO 4)3 + 2 NO + 4 H 2 O Соединения железа склонны к комплексообразованию (координационное число=6): Fe. Cl 2 + 6 NH 3[Fe(NH 3)6]Cl 2 Fe(CN)2 + 4 KCN K 4[Fe(CN)6](жёлтая кровяная соль)
 • • • Гидроксид железа (III) Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка Fe(NO 3)3 + 3 KOH Fe(OH)3+ 3 KNO 3 Fe(OH)3 – более слабое основание, чем гидроксид железа (II). Это объясняется тем, что у Fe 2+ меньше заряд иона и больше его радиус, чем у Fe 3+, а поэтому, Fe 2+ слабее удерживает гидроксид-ионы, т. е. Fe(OH)2 более легко диссоциирует. В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) - очень сильно. Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe 3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу: Fe 3+ + H 2 O [Fe(OH)]2+ + H+ [Fe(OH)]2+ + H 2 O [Fe(OH)2]+ + H+ [Fe(OH)2]+ + H 2 O Fe(OH)3 + H+ При нагревании окраска темнеет, а прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей: Fe(OH)3 + 3 HCl Fe. Cl 3 + 3 H 2 O Fe(OH)3 + Na. OH Na[Fe(OH)3] • Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями: 2 Fe. Cl 3 + H 2 S S + 2 Fe. Cl 2 + 2 HCl
• • • Гидроксид железа (III) Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка Fe(NO 3)3 + 3 KOH Fe(OH)3+ 3 KNO 3 Fe(OH)3 – более слабое основание, чем гидроксид железа (II). Это объясняется тем, что у Fe 2+ меньше заряд иона и больше его радиус, чем у Fe 3+, а поэтому, Fe 2+ слабее удерживает гидроксид-ионы, т. е. Fe(OH)2 более легко диссоциирует. В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) - очень сильно. Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe 3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу: Fe 3+ + H 2 O [Fe(OH)]2+ + H+ [Fe(OH)]2+ + H 2 O [Fe(OH)2]+ + H+ [Fe(OH)2]+ + H 2 O Fe(OH)3 + H+ При нагревании окраска темнеет, а прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей: Fe(OH)3 + 3 HCl Fe. Cl 3 + 3 H 2 O Fe(OH)3 + Na. OH Na[Fe(OH)3] • Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями: 2 Fe. Cl 3 + H 2 S S + 2 Fe. Cl 2 + 2 HCl
 Сплавы железа с углеродом железо используется главным образом в сплавах, прежде всего в сплавах с углеродом (C) — различных чугунах и сталях. В чугуне содержание углерода выше 2, 14 % по массе (обычно — на уровне 3, 5 -4%), в сталях содержание углерода более низкое (обычно на уровне 0. 8 -1 %). Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30 -40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию — нагреванию при температуре около 1000°C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей — шлака. Снизу в домну подают дутье (чистый кислород (O) или воздух, обогащенныйкислородом (O)). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200 -1300°C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО: Fe 2 O 3 + 3 C = 2 Fe + 3 CO; Fe 2 O 3 + 3 CО = 2 Fe + 3 CO 2 возникает металлическое железо, которое насыщается углеродом (C) и стекает вниз.
Сплавы железа с углеродом железо используется главным образом в сплавах, прежде всего в сплавах с углеродом (C) — различных чугунах и сталях. В чугуне содержание углерода выше 2, 14 % по массе (обычно — на уровне 3, 5 -4%), в сталях содержание углерода более низкое (обычно на уровне 0. 8 -1 %). Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30 -40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию — нагреванию при температуре около 1000°C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей — шлака. Снизу в домну подают дутье (чистый кислород (O) или воздух, обогащенныйкислородом (O)). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200 -1300°C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО: Fe 2 O 3 + 3 C = 2 Fe + 3 CO; Fe 2 O 3 + 3 CО = 2 Fe + 3 CO 2 возникает металлическое железо, которое насыщается углеродом (C) и стекает вниз.
 Этот расплав периодически выпускают из домны через специальное отверстие — клетку — и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун — это твердый раствор углерода (C) в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге. Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб. Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Если содержание углерода (C) в чугуне снизить до 1, 0 -1, 5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома (Cr), никеля (Ni), молибдена (Mo), кобальта (Co) и других металлов, улучшающие механические и иные свойства стали). Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода (C) в сплаве до требуемого уровня, как говорят, избыточный углерод (C) выгорает. Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Этот расплав периодически выпускают из домны через специальное отверстие — клетку — и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун — это твердый раствор углерода (C) в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге. Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб. Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Если содержание углерода (C) в чугуне снизить до 1, 0 -1, 5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома (Cr), никеля (Ni), молибдена (Mo), кобальта (Co) и других металлов, улучшающие механические и иные свойства стали). Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода (C) в сплаве до требуемого уровня, как говорят, избыточный углерод (C) выгорает. Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.


