ФИЗИЧЕСКАЯ ХИМИЯ.pptx
- Количество слайдов: 45
 ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ XV-XVI в. в. ЯВЛЕНИЯ ПРИРОДЫ ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ
ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ XV-XVI в. в. ЯВЛЕНИЯ ПРИРОДЫ ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ
 ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ XVII-XVIII в. в. ЯВЛЕНИЯ ПРИРОДЫ ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ ФИЗИКОХИМИЧЕСКИЕ
ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ XVII-XVIII в. в. ЯВЛЕНИЯ ПРИРОДЫ ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ ФИЗИКОХИМИЧЕСКИЕ
 ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ «Химик без знания физики подобен человеку, который всего должен искать ощупом. И сии две науки так едины между собой, что одна без другой в совершенстве быть не могут» . Физическая химия наука, «объясняющая на основании опытов физических причину того, что происходит через химические процессы в сложных телах» .
ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ «Химик без знания физики подобен человеку, который всего должен искать ощупом. И сии две науки так едины между собой, что одна без другой в совершенстве быть не могут» . Физическая химия наука, «объясняющая на основании опытов физических причину того, что происходит через химические процессы в сложных телах» .
 ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ В 1863 г. Н. Н. Бекетов организовал в Харьковском университете отделение физической химии и начал читать студентам курс лекций по этой дисциплине, определив ее как науку, которая занимается «соотношением физических и химических свойств. . . Хотя мы и различаем физические и химические свойства тел, тем не менее и те и другие суть выражение строения и свойств мельчайших частиц. . . В природе эти два условия существования материи, конечно, не разделены» . БЕКЕТОВ Николай Николаевич (1827 -1911)
ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ В 1863 г. Н. Н. Бекетов организовал в Харьковском университете отделение физической химии и начал читать студентам курс лекций по этой дисциплине, определив ее как науку, которая занимается «соотношением физических и химических свойств. . . Хотя мы и различаем физические и химические свойства тел, тем не менее и те и другие суть выражение строения и свойств мельчайших частиц. . . В природе эти два условия существования материи, конечно, не разделены» . БЕКЕТОВ Николай Николаевич (1827 -1911)
 ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ Физическая химия – наука, объясняющая химические явления и устанавливающая их закономерности на основе общих принципов физики. Общая задача физической химии – предсказание временного хода химического процесса и конечного результата на основании данных о строении и свойствах молекул. Применительно к технологии бетона – получение бетонов с заданными свойствами.
ЗАРОЖДЕНИЕ ФИЗИЧЕСКОЙ ХИМИИ Физическая химия – наука, объясняющая химические явления и устанавливающая их закономерности на основе общих принципов физики. Общая задача физической химии – предсказание временного хода химического процесса и конечного результата на основании данных о строении и свойствах молекул. Применительно к технологии бетона – получение бетонов с заданными свойствами.
 РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ o o • • o o o Строение вещества; Химическая термодинамика; Термохимия; Фазовые равновесия; Теория растворов; Электрохимия; Химическая кинетика; Поверхностные явления; Коллоидная химия; Химический катализ
РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ o o • • o o o Строение вещества; Химическая термодинамика; Термохимия; Фазовые равновесия; Теория растворов; Электрохимия; Химическая кинетика; Поверхностные явления; Коллоидная химия; Химический катализ
 ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
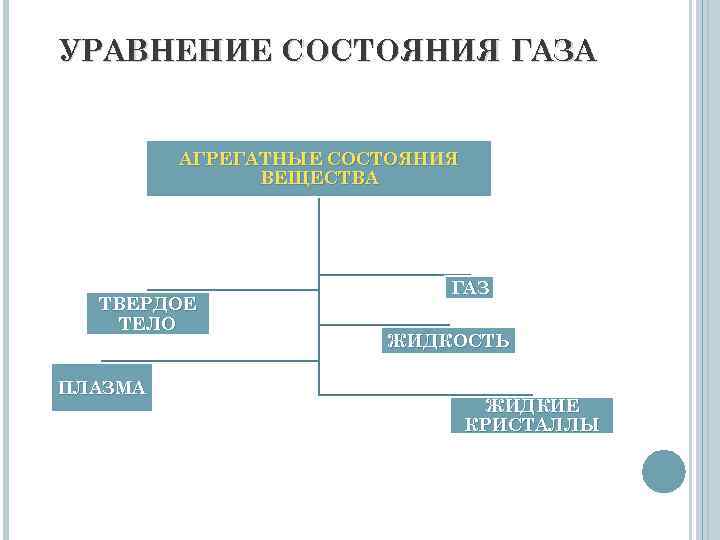 УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА ТВЕРДОЕ ТЕЛО ПЛАЗМА ГАЗ ЖИДКОСТЬ ЖИДКИЕ КРИСТАЛЛЫ
УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА ТВЕРДОЕ ТЕЛО ПЛАЗМА ГАЗ ЖИДКОСТЬ ЖИДКИЕ КРИСТАЛЛЫ
 УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА Состояние газа достаточно полно описывается тремя параметрами: объем, давление, температура. Б. Клапейрон: PV = BT, где коэффициент В зависит от вида газа и его массы. Д. И. Менделеев придал этому уравнению более простой вид, записав его не для массы, а для единицы количества вещества, т. е. 1 кмоля. PV = RT, где R – универсальная газовая постоянная.
УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА Состояние газа достаточно полно описывается тремя параметрами: объем, давление, температура. Б. Клапейрон: PV = BT, где коэффициент В зависит от вида газа и его массы. Д. И. Менделеев придал этому уравнению более простой вид, записав его не для массы, а для единицы количества вещества, т. е. 1 кмоля. PV = RT, где R – универсальная газовая постоянная.
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Термодинамика представляет собой научную дисциплину, которая изучает: а) переходы энергии из одной формы в другую, от одной системы (части системы) к другой; б) энергетические эффекты, сопровождающие различные физические или химические процессы; в) возможность, направление и пределы самопроизвольного течения процессов в заданных условиях.
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Термодинамика представляет собой научную дисциплину, которая изучает: а) переходы энергии из одной формы в другую, от одной системы (части системы) к другой; б) энергетические эффекты, сопровождающие различные физические или химические процессы; в) возможность, направление и пределы самопроизвольного течения процессов в заданных условиях.
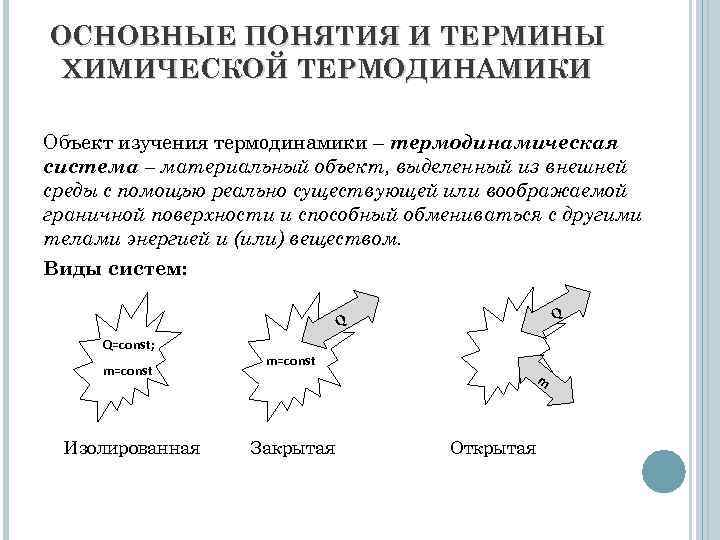 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Объект изучения термодинамики – термодинамическая система – материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой граничной поверхности и способный обмениваться с другими телами энергией и (или) веществом. Виды систем: Q Q Q=const; m=const Изолированная m=const Закрытая m Открытая
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Объект изучения термодинамики – термодинамическая система – материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой граничной поверхности и способный обмениваться с другими телами энергией и (или) веществом. Виды систем: Q Q Q=const; m=const Изолированная m=const Закрытая m Открытая
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Гомогенная Гетерогенная Система
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Гомогенная Гетерогенная Система
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Все виды термодинамических взаимодействий сводятся к двум принципиально различным способам: 1) совершение работы; 2) теплообмен Передача энергии в результате упорядоченного макроскопического движения называется работой. Все виды работы могут полностью превращаться друг в друга. Передача энергии в результате обмена хаотическим движением микрочастиц называется теплообменом. Количество передаваемой при этом энергии называется теплотой.
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Все виды термодинамических взаимодействий сводятся к двум принципиально различным способам: 1) совершение работы; 2) теплообмен Передача энергии в результате упорядоченного макроскопического движения называется работой. Все виды работы могут полностью превращаться друг в друга. Передача энергии в результате обмена хаотическим движением микрочастиц называется теплообменом. Количество передаваемой при этом энергии называется теплотой.
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры термодинамической системы – характеристики, которые фиксированы условиями существования системы и не могут изменяться в пределах рассматриваемой задачи • внешние, которые определяются свойствами и координатами тел в окружающей среде и зависят от контактов системы с окружением (T, p, V); • внутренние, которые зависят только от свойств самой системы, например, плотность ρ, внутренняя энергия U; в отличие от внешних переменных, число таких свойств неограниченно; • экстенсивные, которые прямо пропорциональны массе системы или числу частиц (объем, масса, энтропия и т. д. ); • интенсивные, которые не зависят от массы системы или числа частиц (температура, химический потенциал и т. д. ).
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры термодинамической системы – характеристики, которые фиксированы условиями существования системы и не могут изменяться в пределах рассматриваемой задачи • внешние, которые определяются свойствами и координатами тел в окружающей среде и зависят от контактов системы с окружением (T, p, V); • внутренние, которые зависят только от свойств самой системы, например, плотность ρ, внутренняя энергия U; в отличие от внешних переменных, число таких свойств неограниченно; • экстенсивные, которые прямо пропорциональны массе системы или числу частиц (объем, масса, энтропия и т. д. ); • интенсивные, которые не зависят от массы системы или числа частиц (температура, химический потенциал и т. д. ).
![ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры состояния Объем, V [м 3/кг] Давление, р ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры состояния Объем, V [м 3/кг] Давление, р](https://present5.com/presentation/141372674_328758543/image-15.jpg) ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры состояния Объем, V [м 3/кг] Давление, р [Па] Температура, Т [К] Уравнение состояния F(р, Т, V)=0 Состояние системы, при котором параметры состояния во всех ее точках одинаковы, называется равновесным.
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Параметры состояния Объем, V [м 3/кг] Давление, р [Па] Температура, Т [К] Уравнение состояния F(р, Т, V)=0 Состояние системы, при котором параметры состояния во всех ее точках одинаковы, называется равновесным.
![ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния Внутренняя энергия, U [Дж] Энтропия, S ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния Внутренняя энергия, U [Дж] Энтропия, S](https://present5.com/presentation/141372674_328758543/image-16.jpg) ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния Внутренняя энергия, U [Дж] Энтропия, S [Дж/К] Энтальпия, Н [Дж]
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния Внутренняя энергия, U [Дж] Энтропия, S [Дж/К] Энтальпия, Н [Дж]
![ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции процесса Работа, W [Дж] Теплота, Q [Дж] ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции процесса Работа, W [Дж] Теплота, Q [Дж]](https://present5.com/presentation/141372674_328758543/image-17.jpg) ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции процесса Работа, W [Дж] Теплота, Q [Дж]
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции процесса Работа, W [Дж] Теплота, Q [Дж]
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния это так же характеристики состояния системы, но характеристики, которые не определяют состояние системы (как, например, температура и объем), а сами зависят от состояния системы. То, что определяет состояние системы, назвали параметрами состояния, а то, чем характеризуется состояние системы, назвали функциями состояния.
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Функции состояния это так же характеристики состояния системы, но характеристики, которые не определяют состояние системы (как, например, температура и объем), а сами зависят от состояния системы. То, что определяет состояние системы, назвали параметрами состояния, а то, чем характеризуется состояние системы, назвали функциями состояния.
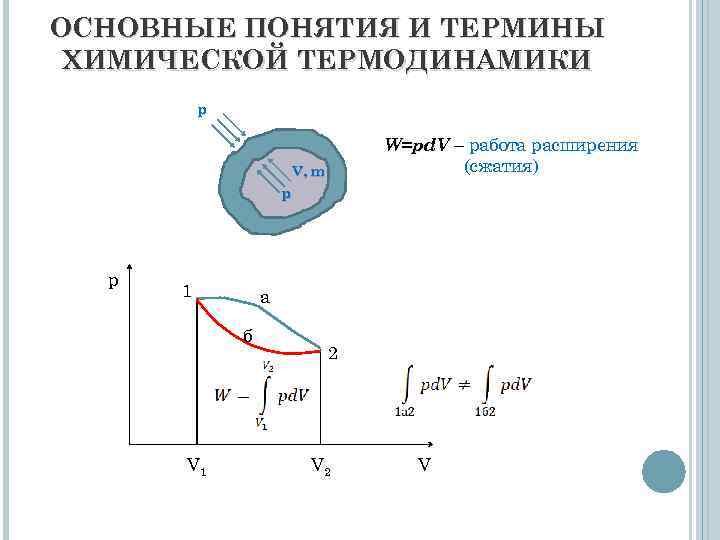 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ р W=pd. V – работа расширения (сжатия) V, m р р 1 а б V 1 2 V
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ р W=pd. V – работа расширения (сжатия) V, m р р 1 а б V 1 2 V
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Процесс – изменение состояния термодинамической системы • самопроизвольные; • несамопроизвольные; • обратимые (W 1=W 2); • квазистатические, или равновесные; • необратимые, или неравновесные (W 1
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Процесс – изменение состояния термодинамической системы • самопроизвольные; • несамопроизвольные; • обратимые (W 1=W 2); • квазистатические, или равновесные; • необратимые, или неравновесные (W 1
![ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Теплоемкость [Дж/К]- истинная теплоемкость; [Дж/К]- средняя теплоемкость; [Дж/кг·К]- ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Теплоемкость [Дж/К]- истинная теплоемкость; [Дж/К]- средняя теплоемкость; [Дж/кг·К]-](https://present5.com/presentation/141372674_328758543/image-21.jpg) ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Теплоемкость [Дж/К]- истинная теплоемкость; [Дж/К]- средняя теплоемкость; [Дж/кг·К]- удельная теплоемкость;
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Теплоемкость [Дж/К]- истинная теплоемкость; [Дж/К]- средняя теплоемкость; [Дж/кг·К]- удельная теплоемкость;
 ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ • Термодинамика применима только для систем состоящих из огромного числа частиц; • Термодинамика имеет дело только с равновесными состояниями; • Состояние называется равновесным, если система проводит в нем подавляющую часть времени; • Термодинамическое описание основано на использовании функции распределения энергии.
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ • Термодинамика применима только для систем состоящих из огромного числа частиц; • Термодинамика имеет дело только с равновесными состояниями; • Состояние называется равновесным, если система проводит в нем подавляющую часть времени; • Термодинамическое описание основано на использовании функции распределения энергии.
 1 ЗАКОН ТЕРМОДИНАМИКИ
1 ЗАКОН ТЕРМОДИНАМИКИ
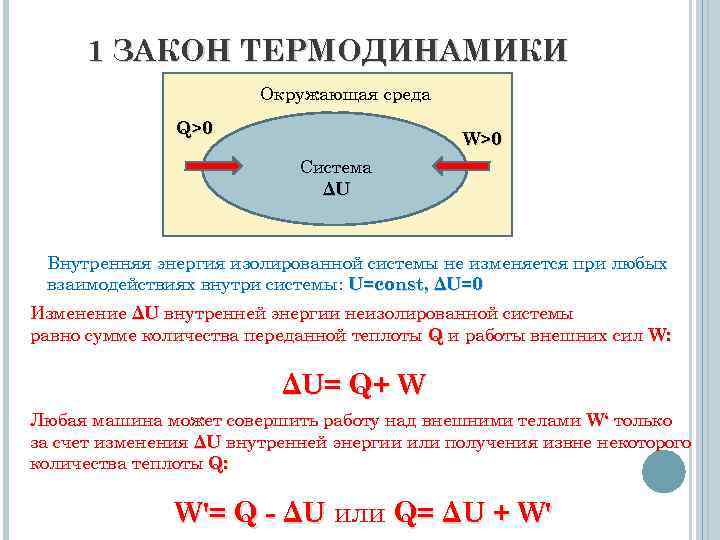 1 ЗАКОН ТЕРМОДИНАМИКИ Окружающая среда Q>0 Система ΔU W>0 Внутренняя энергия изолированной системы не изменяется при любых взаимодействиях внутри системы: U=соnst, ΔU=0 Изменение ΔU внутренней энергии неизолированной системы равно сумме количества переданной теплоты Q и работы внешних сил W: Δ U= Q + W Любая машина может совершить работу над внешними телами W‘ только за счет изменения ΔU внутренней энергии или получения извне некоторого количества теплоты Q: W'= Q - ΔU или Q= ΔU + W'
1 ЗАКОН ТЕРМОДИНАМИКИ Окружающая среда Q>0 Система ΔU W>0 Внутренняя энергия изолированной системы не изменяется при любых взаимодействиях внутри системы: U=соnst, ΔU=0 Изменение ΔU внутренней энергии неизолированной системы равно сумме количества переданной теплоты Q и работы внешних сил W: Δ U= Q + W Любая машина может совершить работу над внешними телами W‘ только за счет изменения ΔU внутренней энергии или получения извне некоторого количества теплоты Q: W'= Q - ΔU или Q= ΔU + W'
 1 ЗАКОН ТЕРМОДИНАМИКИ В дифференциальной форме d. U= δQ + δW δW'= δQ - d. U или δQ= d. U + δW‘ = d. U + pd. V
1 ЗАКОН ТЕРМОДИНАМИКИ В дифференциальной форме d. U= δQ + δW δW'= δQ - d. U или δQ= d. U + δW‘ = d. U + pd. V
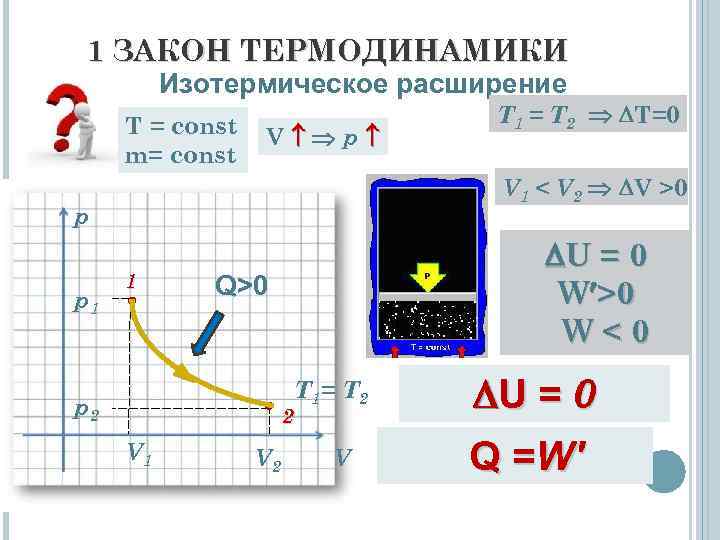 1 ЗАКОН ТЕРМОДИНАМИКИ Изотермическое расширение T = const m= const V p V 1 < V 2 V >0 p p 1 T 1 = T 2 T=0 1 U = 0 W >0 W<0 Q>0 T 1= T 2 p 2 2 V 1 V 2 V U = 0 Q =W'
1 ЗАКОН ТЕРМОДИНАМИКИ Изотермическое расширение T = const m= const V p V 1 < V 2 V >0 p p 1 T 1 = T 2 T=0 1 U = 0 W >0 W<0 Q>0 T 1= T 2 p 2 2 V 1 V 2 V U = 0 Q =W'
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изотермически расширяющейся, не изменяется за счёт совершения этой системой работы вследствие поглощения теплоты из окружающей среды. Q =W' = рd. V U = 0
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изотермически расширяющейся, не изменяется за счёт совершения этой системой работы вследствие поглощения теплоты из окружающей среды. Q =W' = рd. V U = 0
 1 ЗАКОН ТЕРМОДИНАМИКИ Изотермическое сжатие T = const m= const T 1 = T 2 T=0 V 1 > V 2 V <0 U = 0 W <0 W>0 U = 0 Q + W =0
1 ЗАКОН ТЕРМОДИНАМИКИ Изотермическое сжатие T = const m= const T 1 = T 2 T=0 V 1 > V 2 V <0 U = 0 W <0 W>0 U = 0 Q + W =0
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изотермически сжимающейся под действием внешних сил, не изменяется за счёт выделения этой системой теплоты в окружающую среду. Q+W=0 U = 0
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изотермически сжимающейся под действием внешних сил, не изменяется за счёт выделения этой системой теплоты в окружающую среду. Q+W=0 U = 0
 1 ЗАКОН ТЕРМОДИНАМИКИ Изобарное нагревание p = const m= const T V T 2 >T 1 T>0 V 2 > V 1 V >0 p p 1=p 2 U > 0 W<0 Q>0 1 2 T 1> T 2 V 1 V 2 V H = U + p. V Q = U +W Q = H
1 ЗАКОН ТЕРМОДИНАМИКИ Изобарное нагревание p = const m= const T V T 2 >T 1 T>0 V 2 > V 1 V >0 p p 1=p 2 U > 0 W<0 Q>0 1 2 T 1> T 2 V 1 V 2 V H = U + p. V Q = U +W Q = H
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При изобарном нагревании (расширении) переданное системе количество теплоты идёт на увеличение энтальпии системы. Q = U +W Q = H
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При изобарном нагревании (расширении) переданное системе количество теплоты идёт на увеличение энтальпии системы. Q = U +W Q = H
 1 ЗАКОН ТЕРМОДИНАМИКИ Изобарное охлаждение p = const m= const T V T 2
1 ЗАКОН ТЕРМОДИНАМИКИ Изобарное охлаждение p = const m= const T V T 2
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При изобарном охлаждении (сжатии) над газом совершается работа, при этом газ выделяет тепло во внешнюю среду, а его внутренняя уменьшается. U = -Q+W
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При изобарном охлаждении (сжатии) над газом совершается работа, при этом газ выделяет тепло во внешнюю среду, а его внутренняя уменьшается. U = -Q+W
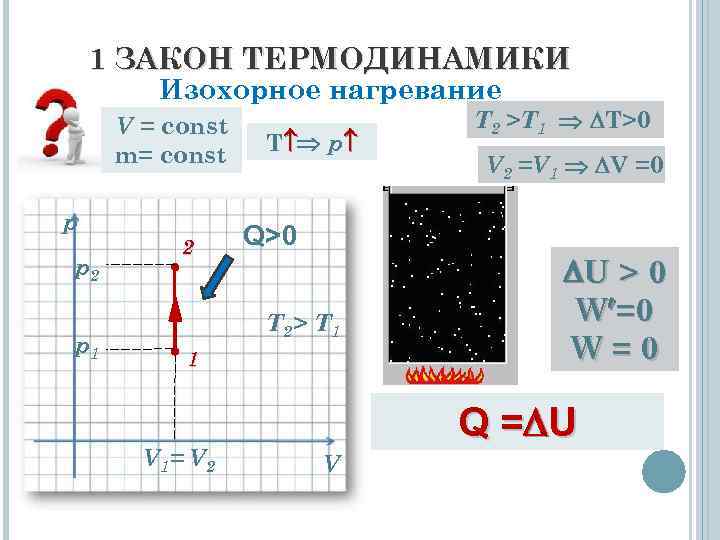 1 ЗАКОН ТЕРМОДИНАМИКИ Изохорное нагревание V = const m= const p p 2 p 1 2 T p Q>0 T 2> T 1 1 V 1= V 2 T 2 >T 1 T>0 V 2 =V 1 V =0 U > 0 W =0 W=0 Q = U V
1 ЗАКОН ТЕРМОДИНАМИКИ Изохорное нагревание V = const m= const p p 2 p 1 2 T p Q>0 T 2> T 1 1 V 1= V 2 T 2 >T 1 T>0 V 2 =V 1 V =0 U > 0 W =0 W=0 Q = U V
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изохорно нагревающейся системы увеличивается только за счёт теплоты, полученной из окружающей среды. Q = U
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изохорно нагревающейся системы увеличивается только за счёт теплоты, полученной из окружающей среды. Q = U
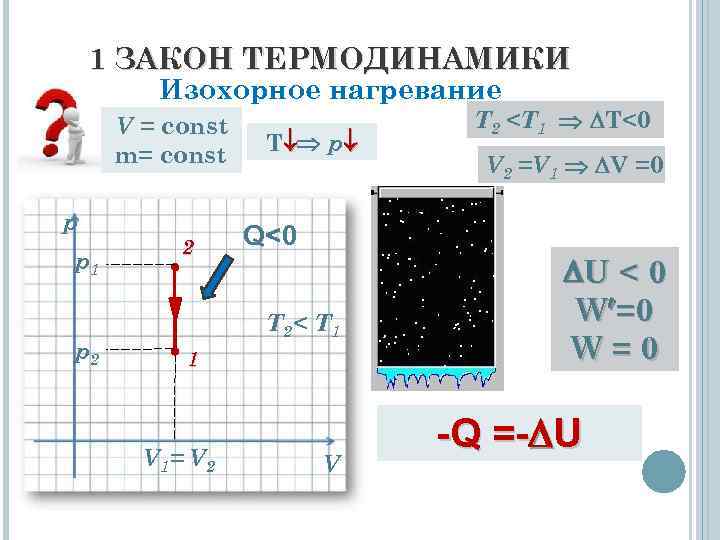 1 ЗАКОН ТЕРМОДИНАМИКИ Изохорное нагревание V = const m= const p p 1 p 2 2 T p Q<0 T 2< T 1 1 V 1= V 2 V T 2
1 ЗАКОН ТЕРМОДИНАМИКИ Изохорное нагревание V = const m= const p p 1 p 2 2 T p Q<0 T 2< T 1 1 V 1= V 2 V T 2
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изохорно охлаждающейся системы уменьшается только за счёт выделения этой системой теплоты в окружающую среду. -Q = - U
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: Внутренняя энергия системы, изохорно охлаждающейся системы уменьшается только за счёт выделения этой системой теплоты в окружающую среду. -Q = - U
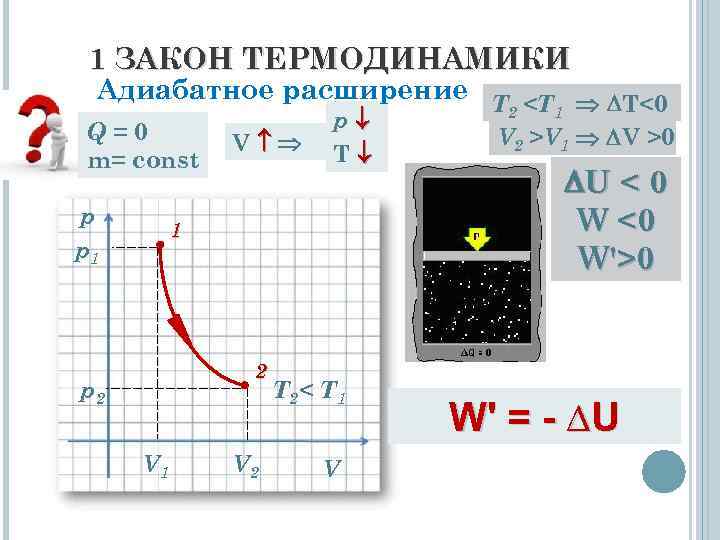 1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатное расширение T
1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатное расширение T
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При адибатном расширении система совершает механическую работу только за счёт уменьшения внутреннней энергии системы. W' = - ∆U
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При адибатном расширении система совершает механическую работу только за счёт уменьшения внутреннней энергии системы. W' = - ∆U
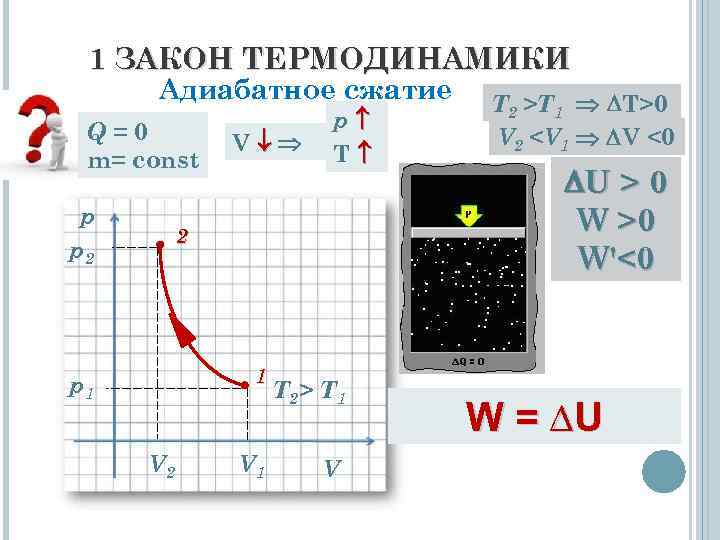 1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатное сжатие Q=0 m= const p p 2 V p T 2 1 p 1 V 2 V 1 T 2> T 1 V T 2 >T 1 T>0 V 2
1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатное сжатие Q=0 m= const p p 2 V p T 2 1 p 1 V 2 V 1 T 2> T 1 V T 2 >T 1 T>0 V 2
 1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При адибатном сжатии над системой совершается работа, при этом внутренняя энергия системы увеличивается. W = ∆U
1 ЗАКОН ТЕРМОДИНАМИКИ Вывод: При адибатном сжатии над системой совершается работа, при этом внутренняя энергия системы увеличивается. W = ∆U
 1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатный процесс На явлении разогрева газа при его адиабатическом сжатии основано явление пневматического огнива, которое находит применение в дизелях, где воспламенение горючей смеси осуществляется путём адиабатического сжатия.
1 ЗАКОН ТЕРМОДИНАМИКИ Адиабатный процесс На явлении разогрева газа при его адиабатическом сжатии основано явление пневматического огнива, которое находит применение в дизелях, где воспламенение горючей смеси осуществляется путём адиабатического сжатия.
 1 ЗАКОН ТЕРМОДИНАМИКИ
1 ЗАКОН ТЕРМОДИНАМИКИ
 1 ЗАКОН ТЕРМОДИНАМИКИ
1 ЗАКОН ТЕРМОДИНАМИКИ
 1 ЗАКОН ТЕРМОДИНАМИКИ Эта игрушка – самый лучший пример действия законов термодинамики. Каждый раз, когда голова птички касается воды, она наклоняется, и создаётся впечатление, что птичка пьёт из чашки, помещённой перед ней. Такое «поведение» объясняется испарением воды: «верхушка» охлаждается, в ней понижается давление газа. Жидкость внутри птички поднимается от её хвоста к голове, заставляя корпус наклоняться и создавать видимость, будто птичка и в самом деле пьёт. По мере того, как птичка окунается в воду, жидкость возвращается обратно в хвост, и весь процесс начинается заново.
1 ЗАКОН ТЕРМОДИНАМИКИ Эта игрушка – самый лучший пример действия законов термодинамики. Каждый раз, когда голова птички касается воды, она наклоняется, и создаётся впечатление, что птичка пьёт из чашки, помещённой перед ней. Такое «поведение» объясняется испарением воды: «верхушка» охлаждается, в ней понижается давление газа. Жидкость внутри птички поднимается от её хвоста к голове, заставляя корпус наклоняться и создавать видимость, будто птичка и в самом деле пьёт. По мере того, как птичка окунается в воду, жидкость возвращается обратно в хвост, и весь процесс начинается заново.


