_Экзамен_Химия_Соли.ppt
- Количество слайдов: 65

Западное управление образования ГОУ ЦО № 1941 Экзаменационная работа по химии на тему «Соли» Ученицы 9 класса «Б» Тереховой Александры Руководитель проекта: Учитель по химии Шушляпина Ю. П. Москва 2011 г.

Цель работы:

Содержание Классификация солей n Нахождение солей в природе n Получение солей n Химические свойства солей n Применение важнейших солей n Практическая часть n Тест n
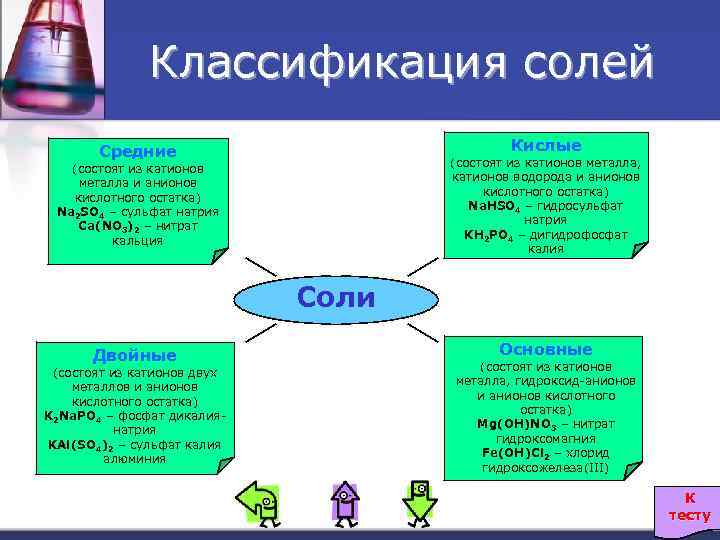
Классификация солей Кислые Средние (состоят из катионов металла, катионов водорода и анионов кислотного остатка) Na. HSO 4 – гидросульфат натрия KH 2 PO 4 – дигидрофосфат калия (состоят из катионов металла и анионов кислотного остатка) Na 2 SO 4 – сульфат натрия Ca(NO 3)2 – нитрат кальция Соли Двойные (состоят из катионов двух металлов и анионов кислотного остатка) K 2 Na. PO 4 – фосфат дикалиянатрия KAl(SO 4)2 – сульфат калия алюминия Основные (состоят из катионов металла, гидроксид-анионов и анионов кислотного остатка) Mg(OH)NO 3 – нитрат гидроксомагния Fe(OH)Cl 2 – хлорид гидроксожелеза(III) К тесту
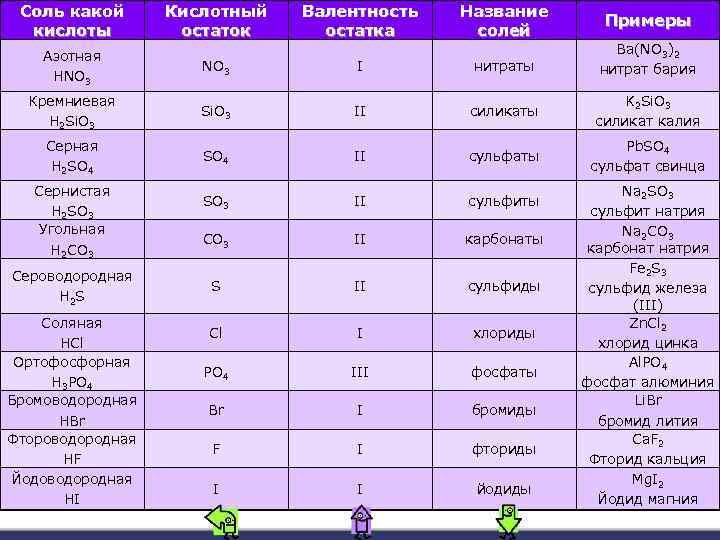
Соль какой кислоты Кислотный остаток Валентность остатка Название солей Примеры Азотная HNO 3 I нитраты Ba(NO 3)2 нитрат бария Кремниевая H 2 Si. O 3 II силикаты K 2 Si. O 3 силикат калия Серная H 2 SO 4 II сульфаты Pb. SO 4 сульфат свинца SO 3 II сульфиты CO 3 II карбонаты S II сульфиды Cl I хлориды PO 4 III фосфаты Br I бромиды F I фториды I I йодиды Сернистая H 2 SO 3 Угольная H 2 CO 3 Сероводородная H 2 S Соляная HCl Ортофосфорная H 3 PO 4 Бромоводородная HBr Фтороводородная HF Йодоводородная HI Na 2 SO 3 сульфит натрия Na 2 CO 3 карбонат натрия Fe 2 S 3 сульфид железа (III) Zn. Cl 2 хлорид цинка Al. PO 4 фосфат алюминия Li. Br бромид лития Ca. F 2 Фторид кальция Mg. I 2 Йодид магния

Нахождение солей в природе Na. Cl - галит Fe. SO 4 KCl - сильвин Si. C – карбид Ca. F 2 - флюорит Ca. CO 3 - мел
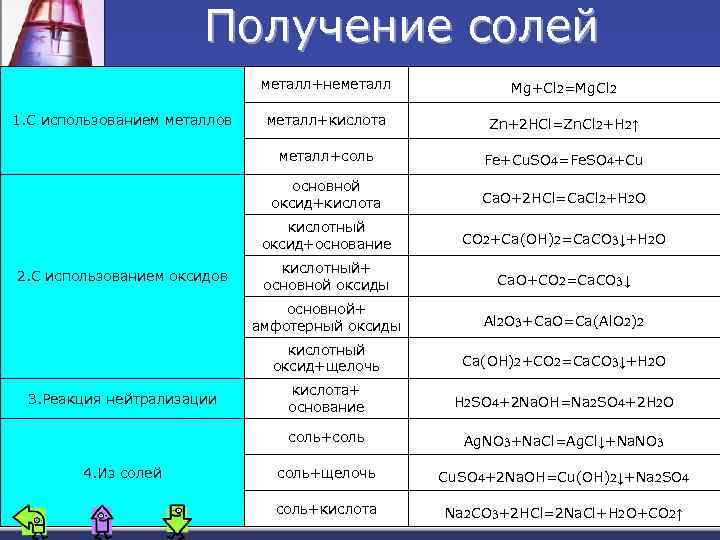
Получение солей ₂ ₂ металл+неметалл Ca. O+2 HCl=Ca. Cl +H O кислотный оксид+основание CO +Ca(OH) =Ca. CO ↓+H O кислотный+ основной оксиды Ca. O+CO =Ca. CO ↓ основной+ амфотерный оксиды Al O +Ca. O=Ca(Al. O ) кислотный оксид+щелочь 3. Реакция нейтрализации ₂ ₂ Fe+Cu. SO₄=Fe. SO₄+Cu основной оксид+кислота 2. С использованием оксидов металл+кислота металл+соль 1. С использованием металлов Mg+Cl =Mg. Cl Ca(OH) +CO =Ca. CO ↓+H O кислота+ основание H SO +2 Na. OH=Na SO +2 H O соль+соль 4. Из солей соль+щелочь соль+кислота Zn+2 HCl=Zn. Cl +H ↑ ₂ ₂ ₃ ₂ ₃ ₂ ₂ ₄ ₂ ₂₂ ₂ ₃ ₂ ₄ ₃ ₂ ₂ ₃ Cu. SO₄+2 Na. OH=Cu(OH)₂↓+Na₂SO₄ Na₂CO₃+2 HCl=2 Na. Cl+H₂O+CO₂↑ Ag. NO +Na. Cl=Ag. Cl↓+Na. NO

Получение солей n Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты): Na. OH+H 2 SO 4 = Na. HSO 4+H 2 O n Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи): Zn. Cl 2+Na. OH = Zn. OHCl↓+Na. Cl
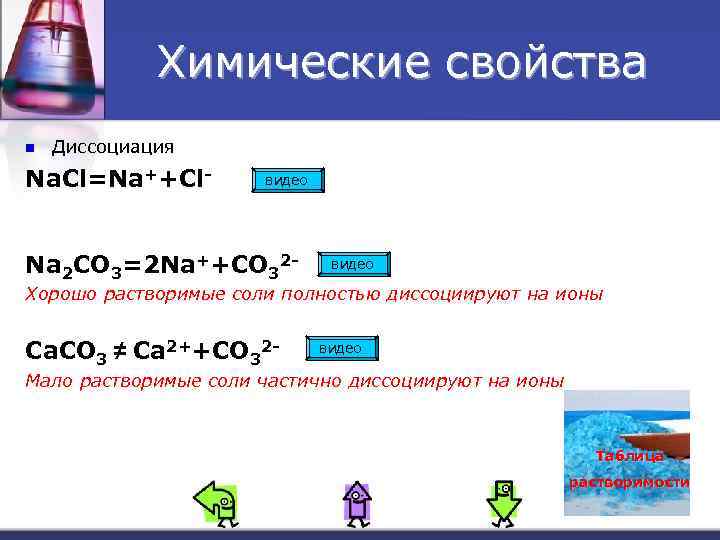
Химические свойства n Диссоциация Na. Cl=Na++Cl- видео Na 2 CO 3=2 Na++CO 32 - видео Хорошо растворимые соли полностью диссоциируют на ионы Ca. CO 3 ≠ Ca 2++CO 32 - видео Мало растворимые соли частично диссоциируют на ионы Таблица растворимости

Химические свойства n С кислотами Na 2 CO 3+2 HCl=2 Na. Cl+H 2 O+CO 2↑ видео Ca. CO 3+2 HCl =Ca. Cl 2+H 2 O+CO 2↑ Ca 2++CO 32 -+2 H++2 Cl-= Ca 2++2 Cl-+H 2 O+CO 2↑ CO 32 -+ 2 H+=H 2 O+CO 2↑ H 2 SO 4+Ba. Cl 2=Ba. SO 4+2 HCl видео
Химические свойства n С щелочами Cu. Cl 2+2 Na. OH=Cu(OH)2↓+2 Na. Cl видео n C солями Cu. Cl 2+2 Ag. NO 3=Cu(NO 3)2+2 Ag. Cl↓ видео Ag. NO 3+KI=KNO 3+Ag. I↓ видео n Разложение Ca. CO 3=Ca. O+CO 2
Химические свойства n С металлами Sn. Cl 2+Zn=Zn. Cl 2+Sn Cu. Cl 2+Zn=Zn. Cl 2+Cu видео 3 Cu. Cl 2+2 Al=2 Al. Cl 3+3 Cu Cu+2 Cl 2+Fe 0=Fe+2 Cl 2+Cu 0 видео Cu. Cl 2+Au≠ Более активный металл вытесняет менее активный из раствора соли Cu+2+2ē=Cu 0 – процесс восстановления окислитель Fe 0 -2ē=Fe+2 – процесс окисления восстановитель

Применение важнейших солей - n В хозяйстве (Na 2 CO 3 n Как пищевые продукты (Na. HCO 3 питьевая сода, Na. Cl – поваренная соль) В медицине (Mg. SO 4, Na 2 SO 4) n n n сода) В строительстве (Ca. CO 3 - мел, известняк, мрамор, Ca. SO 4· 2 H 2 O - гипс) В производстве удобрений (Na. NO 3, KNO 3, Ca. NO 3, NH 4 NO 3 - селитры) В качестве сырья (Ca. CO 3, Na 2 CO 3) Минеральные соли в организме человека На заметку

Практическая работа Цель работы: 1. 2. Показать, что в растворах растворимых солей содержатся катионы, которые можно определить с помощью качественных реакций. Определить катионы металлов в растворах различными способами. Оборудование: Пробирки, химические стаканы.

Реактивы 1. 2. 3. 4. 5. 6. 7. 8. раствор гидроксида натрия Na. OH раствор сульфата железа(II) Fe. SO 4 раствор хлорида меди(II) Cu. Cl 2 раствор хлорида железа(III) Fe. Cl 3 раствор хлорида алюминия Al. Cl 3 раствор роданида калия KCNS раствор гексацианоферрата калия(III) красная кровяная соль K 3[Fe(CN)6] раствор гексацианоферроата калия желтая кровяная соль K 4[Fe(CN)6]

Задание Определить ионы в растворах Fe 2+, Fe 3+, Cu 2+, Al 3+
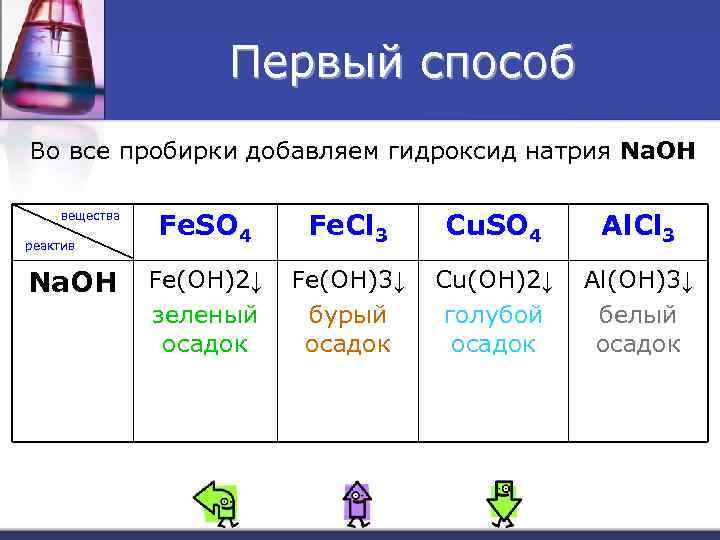
Первый способ Во все пробирки добавляем гидроксид натрия Na. OH вещества реактив Na. OH Fe. SO 4 Fe. Cl 3 Cu. SO 4 Al. Cl 3 Fe(OH)2↓ зеленый осадок Fe(OH)3↓ бурый осадок Cu(OH)2↓ голубой осадок Al(OH)3↓ белый осадок

Уравнения n Fe. SO 4+2 Na. OH=Fe(OH)2+Na 2 SO 4 n Fe. Cl 3+3 Na. OH=Fe(OH)3+3 Na. Cl n Cu. SO 4+2 Na. OH=Cu(OH)2+Na 2 SO 4 n n видео Al. Cl 3+3 Na. OH=Al(OH)3+3 Na. Cl Al(OH)3+Na. OH=Na[Al(OH)4] Al(OH)3 растворяется в избытке щелочи, т. к. он проявляет амфотерные свойства

Второй способ Во все пробирки добавляем раствор роданида калия вещества реактив KCNS Fe. SO 4 Fe. Cl 3 Cu. SO 4 Al. Cl 3 красный цвет красный осадок зеленый цвет _

Уравнения n Fe. SO 4+2 KCNS=Fe(CNS)2+K 2 SO 4 n Fe. Cl 3+3 KCNS=Fe(CNS)3↓+3 KCl n Cu. SO 4+2 KCNS=Cu(CNS)2+K 2 SO 4 видео

Качественные реакции на ионы Fe 2+ и Fe 3+ n Во все четыре пробирки добавляем красную кровяную соль K 3[Fe(CN)6]. В растворе Fe. SO 4 выпадает синий осадок. n В раствор Fe. Cl 3 добавляем желтую кровяную соль K 4[Fe(CN)6], выпадает синий осадок. видео
![Уравнения n 3 Fe 2++ 2 [Fe(CN)6]3 - =Fe 3[Fe(CN)6]2 ↓ синий осадок турнбулева Уравнения n 3 Fe 2++ 2 [Fe(CN)6]3 - =Fe 3[Fe(CN)6]2 ↓ синий осадок турнбулева](https://present5.com/presentation/18043767_42766/image-23.jpg)
Уравнения n 3 Fe 2++ 2 [Fe(CN)6]3 - =Fe 3[Fe(CN)6]2 ↓ синий осадок турнбулева синь n 4 Fe 3++3[Fe(CN)6]4 -=Fe 4[Fe(CN)6]3 ↓ темно-синий осадок берлинская лазурь

Вывод Растворы солей содержат ионы металлов, поэтому в этой практической работе я использовала качественные реакции на ионы металлов в растворах.
Тест 1. Среди формул веществ солью является: K 2 CO 3 n KOH n H 2 CO 3 n C 2 H 6 n


Тест 2. Вещество, формула которого Al(NO 3)3, называется: сульфатом алюминия n нитритом алюминия n фосфатом алюминия n нитратом алюминия n

Тест 3. Карбонаты – это соли кислоты: азотистой n сернистой n угольной n кремниевой n

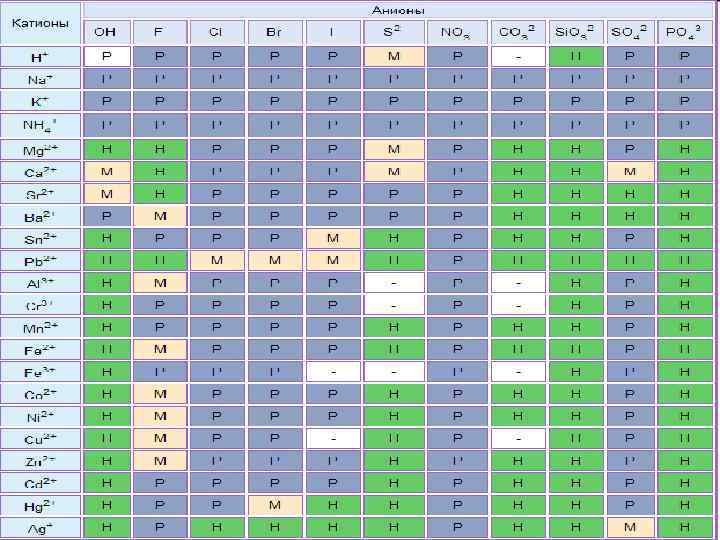

Тест 4. Какая из солей нерастворима в воде: нитрат меди(II) n карбонат калия n хлорид бария n ортофосфат кальция n Таблица растворимости


Тест 5. Вещество, формула которого Fe. Cl 3, называется: нитратом железа(III) n сульфатом железа(II) n хлоридом железа(III) n

Тест 6. Нитраты – это соли: n n азотной кислоты азотистой кислоты сернистой кислоты сероводородной кислоты


Тест 7. Какая соль является основной составной частью мрамора и известняка, горных пород, используемых в строительстве, отделочных работах и др. : n n хлорид натрия фосфат кальция карбонат кальция сульфат кальция


Тест 8. Соль, формула которого Mg(OH)Cl, относится к … солям.

Тест Mg(OH)Cl относится к основным солям


Тест 9. Необратимая химическая реакция протекает при сливании растворов: Zn. SO 4 и HCl n Mg. Cl 2 и HNO 3 n Zn. SO 4 и KOH n KOH и Na. Cl n Таблица растворимости

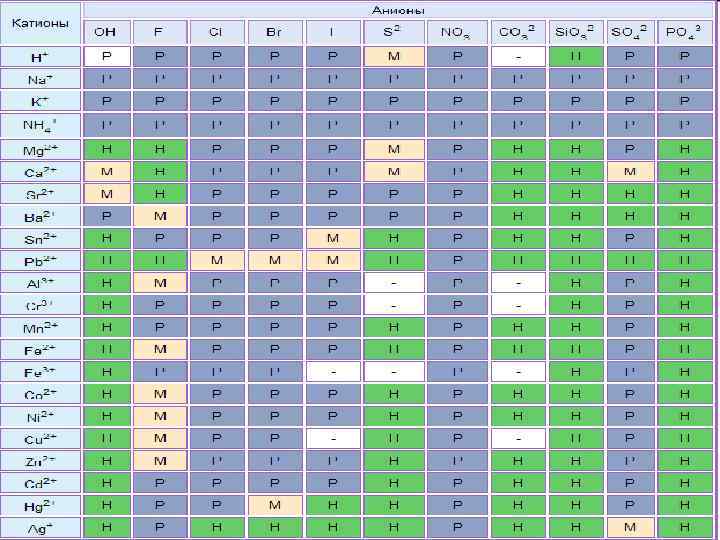

Тест 10. Необратимая химическая реакция протекает при сливании растворов: Ag. NO 3 и Ba. Cl 2 n Na. Cl и KOH n K 2 SO 4 и HCl n KNO 3 и Na. Cl n Таблица растворимости

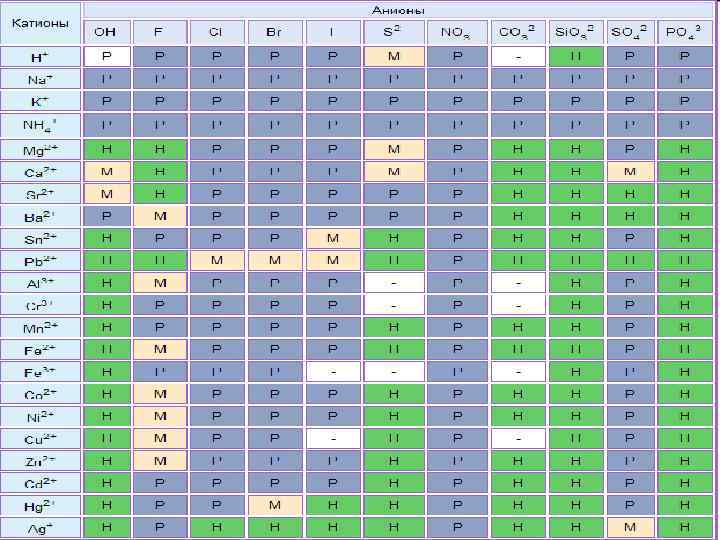

Тест 11. Одновременно в растворе не может находиться пара ионов: Na+ и OHn Ca 2+ и CO 32 n H+ и NO 3 n Cu 2+ и SO 42 n Таблица растворимости

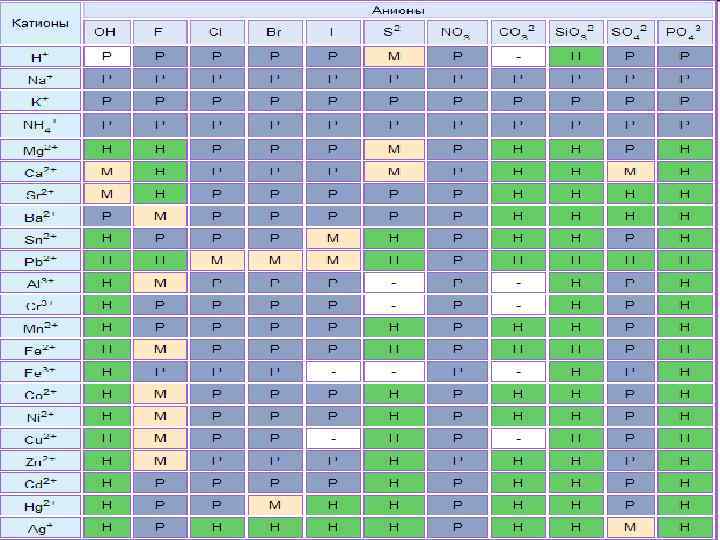

Тест 12. Одновременно в растворе могут присутствовать ионы: Ag+ и PO 43 n Na+ и CO 32 n Pb 2+ и S 2 n Ba 2+ и SO 42 n Таблица растворимости


_Экзамен_Химия_Соли.ppt