
Занятие 5 Введение в обмен веществ 1

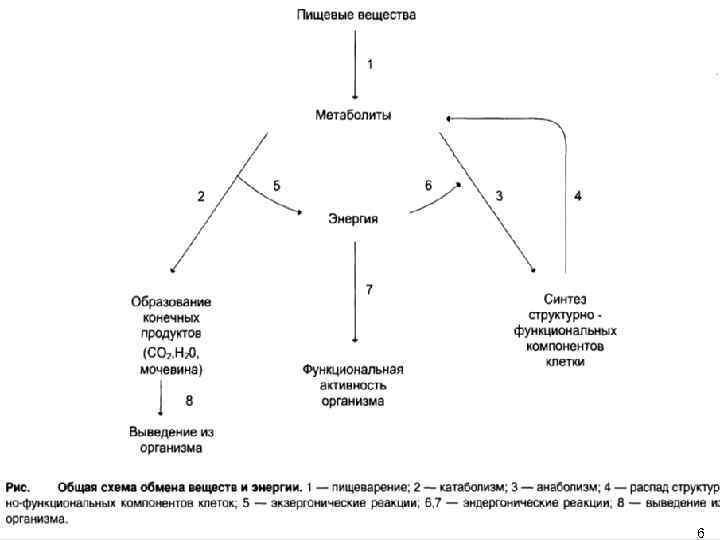
• Обмен веществ и энергии — совокупность процессов превращения веществ и энергии, происходящих в живых организмах, и обмен веществами и энергией между организмом и окружающей средой. • Обмен веществ и энергии является основой жизнедеятельности организмов и принадлежит к числу важнейших специфических признаков живой материи, отличающих живое от неживого. В обмене веществ, или метаболизме, обеспеченном сложнейшей регуляцией на разных уровнях, участвует множество ферментных систем. • В процессе обмена поступившие в организм вещества превращаются в собственные вещества тканей и в конечные продукты, выводящиеся из организма. При этих превращениях освобождается и поглощается энергия. 2

Метаболизм Метаболические пути 3

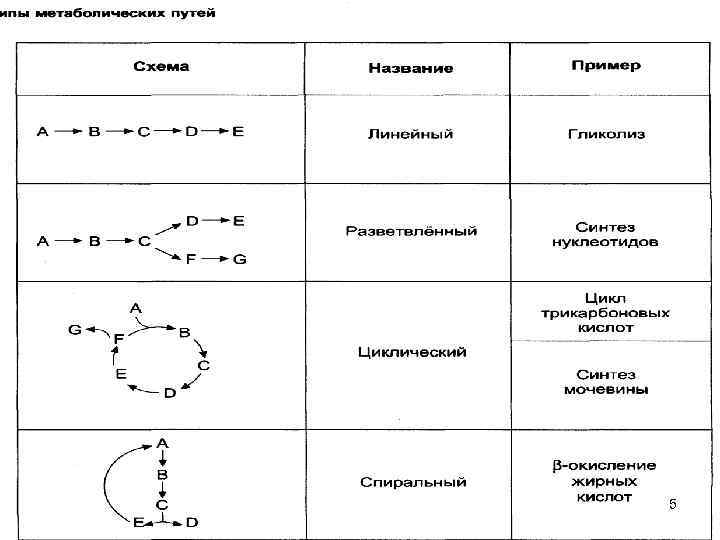
Метаболизм — совокупность химических реакций, протекающих в клетках организм с момента поступления пищевых веществ в организм до образования конечных продуктов обмена. Функции метаболизма: ▪cнабжение клеток химической энергией; ▪превращение молекул пищи в строительные блоки; ▪сборка из этих блоков компонентов клетки (белки, липиды, нуклеиновые кислоты); ▪синтез и разрушение специализированных биологических молекул (гем, холин). Метаболический путь — последовательность химических превращений вещества. Метаболические пути многоэтапны, взаимосвязаны, регулируемы, скоординированы в пространстве. Они бывают линейными (распад и синтез гликогена, гликолиз и др. ) и циклическими (цикл трикарбоновых кислот, орнитиновый цикл). Метаболические пути делятся на: 1. катаболические, которые включают реакции расщепления биомолекул (гидролиза, окисления и др. ); 2. анаболические, которые состоят из реакций синтеза сложных соединений (белков, полисахаридов, нуклеиновых кислот); 3. амфиболические; метаболиты этих процессов могут превращаться как в катаболических, так и в анаболических процессах. Примером является цикл трикарбоновых кислот. 4
5
6

Специфические и общие пути катаболизма В катаболических процессах можно выделить два звена: • - специфические пути катаболизма, разные для различных классов соединений (белков, жиров, углеводов и др. ) К специфическим путям катаболизма относятся реакции гидролиза белков, углеводов, липидов происходящие в ЖКТ или в тканях, реакции разрушения моносахаридов, аминокислот, жирных кислот, спиртов, происходящие в клетках и, в конце концов, завершающиеся образованием пировиноградной кислоты или ацетильным радикалом в форме ацетил-Ко. А • - общие пути катаболизма - единые пути катаболизма для различных классов веществ, являющиеся продолжением специфических путей. С общими путями катаболизма, в основном, связаны главные биоэнергетические процессы, сопряженные с 7 высвобождением и накоплением энергии в клетке.
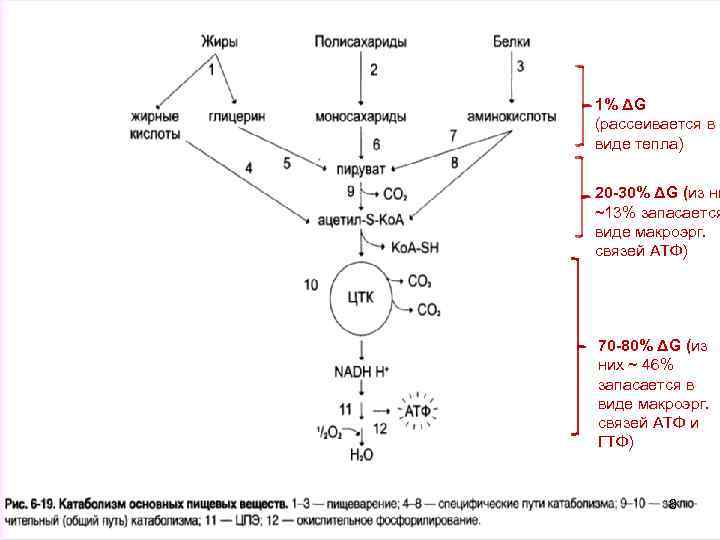
1% ΔG (рассеивается в виде тепла) 20 -30% ΔG (из ни ~13% запасается виде макроэрг. связей АТФ) 70 -80% ΔG (из них ~ 46% запасается в виде макроэрг. связей АТФ и ГТФ) 8

• Катаболизм и анаболизм происходят в клетках одновременно и неразрывно связаны друг с другом. По существу, их следует рассматривать не как два отдельных процесса, а как две стороны одного общего процесса — метаболизма, в котором превращения веществ теснейшим образом переплетены с превращениями энергии. • Процессы анаболизма и катаболизма находятся в организме в состоянии динамического равновесия. • Преобладание анаболических процессов над катаболическими приводит к росту, накоплению массы тканей, а преобладание катаболических процессов ведет к частичному разрушению тканевых структур. • Состояние равновесного или неравновесного соотношения анаболизма и катаболизма зависит от возраста (в детском возрасте преобладает анаболизм, у взрослых обычно наблюдается равновесие, в старческом возрасте преобладает катаболизм), состояния здоровья, выполняемой организмом физической или 9 психоэмоциональной нагрузки.
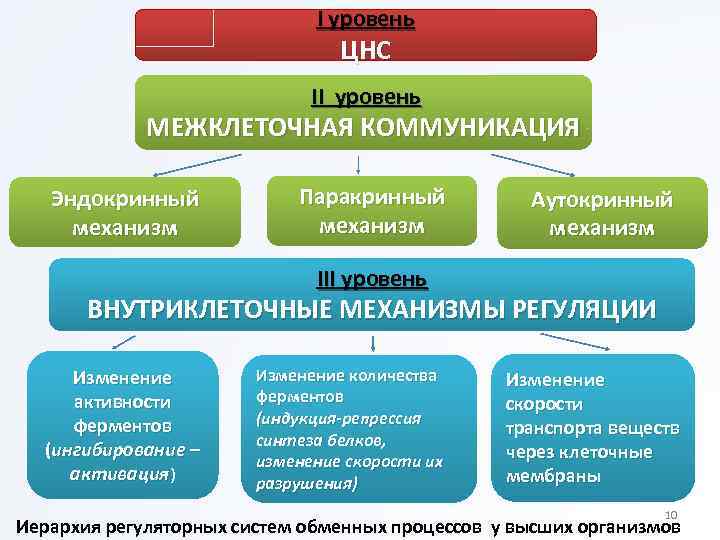
I уровень ЦНС II уровень МЕЖКЛЕТОЧНАЯ КОММУНИКАЦИЯ Эндокринный механизм Паракринный механизм Аутокринный механизм III уровень ВНУТРИКЛЕТОЧНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ Изменение активности ферментов (ингибирование – активация) Изменение количества ферментов (индукция-репрессия синтеза белков, изменение скорости их разрушения) Изменение скорости транспорта веществ через клеточные мембраны 10 Иерархия регуляторных систем обменных процессов у высших организмов

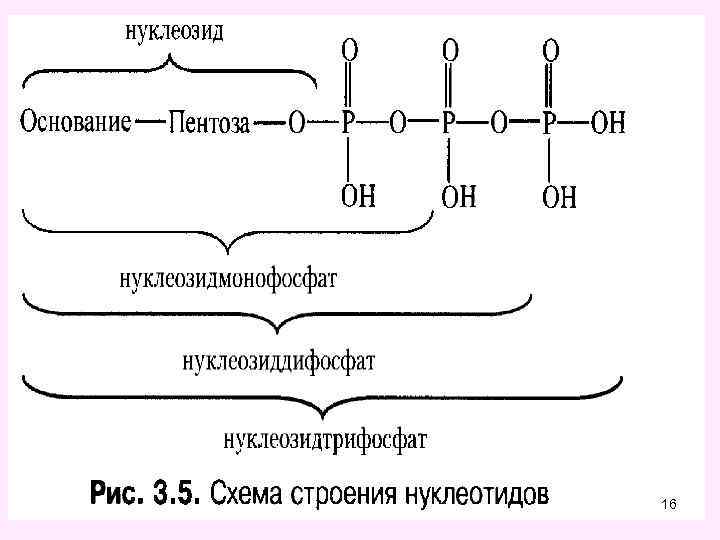
Макроэргические соединения 11

• К энергетическим субстратам для клеток животного организма относятся углеводы, липиды и аминокислоты. Удельная калорийность углеводов равна 4, 1 ккал/г, липидов - 9, 3 ккал/г и белков (аминокислот) - 4, 1 ккал/г. • Высвобождение свободной энергии из основных энергетических субстратов идет в катаболических процессах. При этом свободная энергия может накапливаться в макроэргической связи некоторых фосфорорганических соединений, в маркоэргах. • К макроэргическим соединениям относятся АТФ и другие нуклеотид-5`-трифосфаты (ГТФ, УТФ, ЦТФ), креатинфосфат, 1, 3 -дифосфоглицерат, фосфоенол 12 пируват.
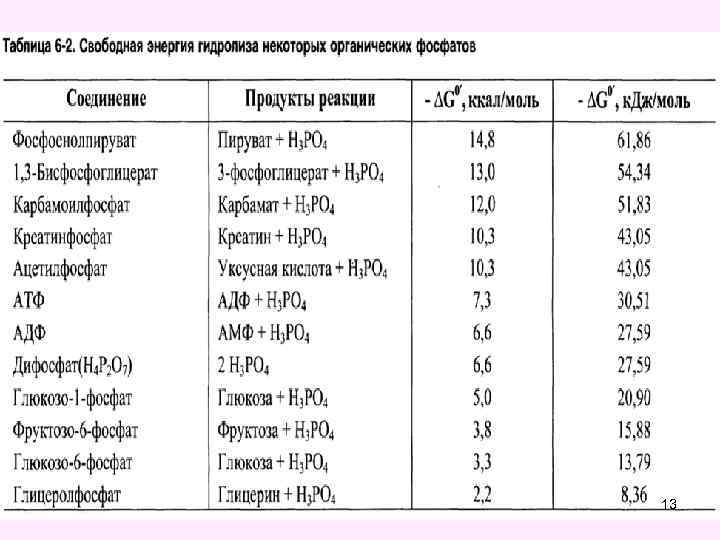
13

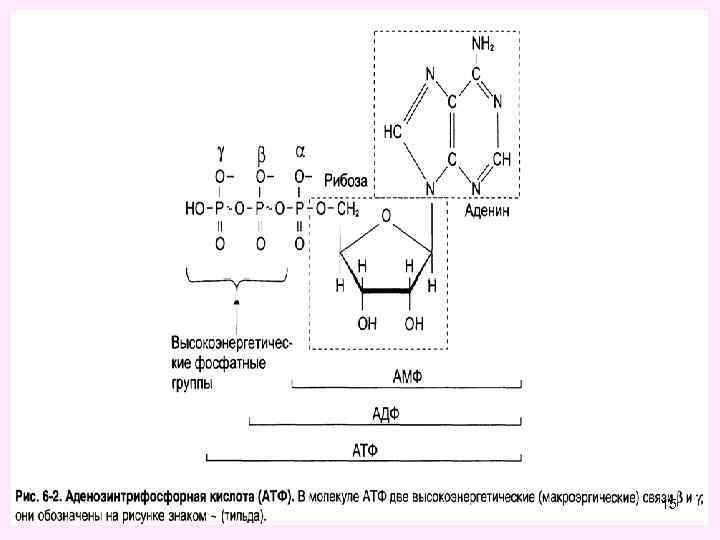
ü Из всех макроэргов АТФ - главный химический посредник клетки, связывающий между собой процессы идущие с выделением и поглощением энергии (катаболизма и анаболизма), служит общим промежуточным продуктом в реакциях переноса энергии с фосфатными группами. ü Будучи макроэргическим соединением, АТФ выполняет функцию аккумулирования биологической энергии и ее последующего использования для выполнения клеточных функций. ü «Макроэргичность» АТФ объясняется рядом особенностей его молекулы. Это прежде всего высокая плотность зарядов, сконцентрированная в «хвосте» молекулы, обеспечивающая легкость диссоциации терминального фосфата при водном гидролизе. Продукты этого гидролиза представляют собой АДФ и неорганический фосфат и далее – АМФ и неорганический фосфат. Это обеспечивает высокую величину свободной энергии гидролиза терминального фосфата АТФ в водной среде. NB! В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч. 14
15
16
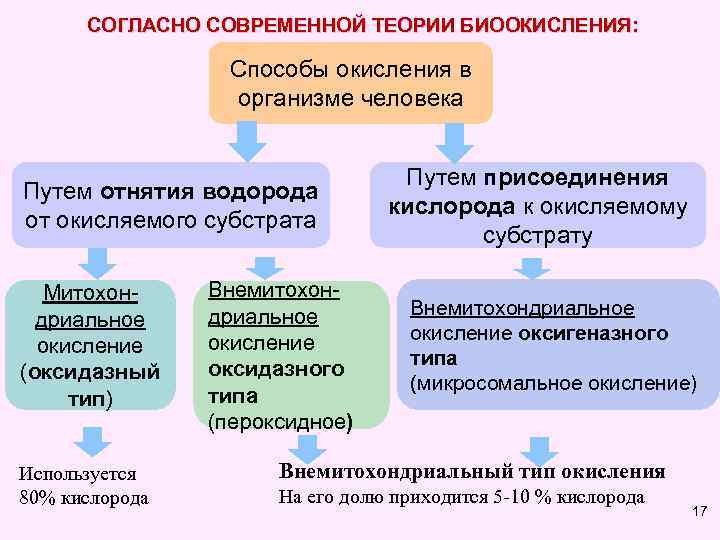
СОГЛАСНО СОВРЕМЕННОЙ ТЕОРИИ БИООКИСЛЕНИЯ: Способы окисления в организме человека Путем отнятия водорода от окисляемого субстрата Митохондриальное окисление (оксидазный тип) Используется 80% кислорода Внемитохондриальное окисление оксидазного типа (пероксидное) Путем присоединения кислорода к окисляемому субстрату Внемитохондриальное окисление оксигеназного типа (микросомальное окисление) Внемитохондриальный тип окисления На его долю приходится 5 -10 % кислорода 17
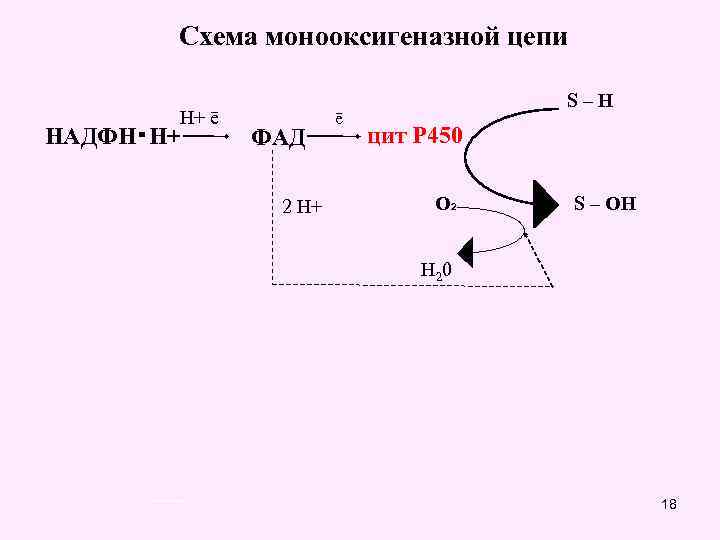
Схема монооксигеназной цепи Н+ ē НАДФН・Н+ ФАД 2 Н+ ē S–H цит Р 450 О 2 S – ОН Н 2 0 18

Тканевое дыхание и биологическое окисление 19

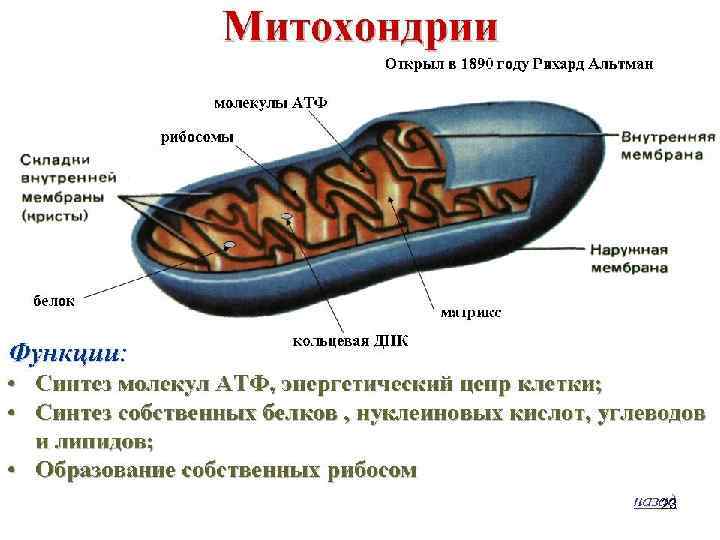
Тканевое дыхание, клеточное дыхание – процесс поглощения кислорода (О 2) тканями при окислении органического субстрата с выделением углекислого газа (СО 2) и воды (Н 2 О). Тканевое дыхание – совокупность ферментативных процессов, протекающих при участии кислорода воздуха в клетках органов и тканей, в результате чего продукты расщепления углеводов, жиров, белков окисляются до углекислого газа и воды. При этом часть освобождающейся энергии запасается в форме макроэргических соединений. Многие ферменты, катализирующие эти реакции, находятся в особых клеточных органоидах — митохондриях. [Тканевое дыхание отличают от внешнего дыхания — совокупности физиологических процессов, обеспечивающих поступление в организм кислорода и выведение из него углекислого газа. ] Биологическое окисление — это процесс окисления биологических веществ с выделением энергии. Биологическое окисление — совокупность окислительно-восстановительных реакций катаболизма органических соединений, сопряженных с высвобождением свободной энергии, катализируемых локализованными в митохондриях ферментами класса оксидоредуктаз. 20

• При биологическом окислении от органической молекулы под действием соответствующего фермента отщепляются два атома водорода. • Дальнейшая судьба водорода может быть различной. При анаэробном окислении он переносится на некоторые органические молекулы. При аэробном окислении водород передаётся на кислород с образованием воды. Основная часть цепи переноса водорода расположена в мембранах митохондрий. При этом из АДФ и неорганического фосфата образуется АТФ. • Аэробное окисление намного эффективнее анаэробного. В первом случае, где глюкоза "сжигается" до CO 2 и воды, из 1 молекулы глюкозы образуется 36 молекул АТФ, а во втором — 2. Это и объясняет широкое распространение и бурную эволюцию аэробных организмов. 21

Механизм биологического окисления § Основной функцией этого процесса является обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ). • Основным топливом при биологическом окислении является ВОДОРОД. • Известно, что реакция окисления водорода кислородом в газовой среде сопровождается выделением большого количества энергии, сопровождаемым взрывом и пламенем. Эволюция живых организмов привела к тому, что реакция окисления водорода до воды оказалась разделенной на отдельные этапы, что обеспечивает постепенное высвобождение энергии в процессе биологического окисления. При этом часть полученной энергии рассеивается в виде тепла (около 60%) а другая часть (около 40%) аккумулируется в молекулах АТФ.
23

• Основной функцией биологического окисления является обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ). • В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1. Пиридинзависимые анаэробные дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ 2. Флавинзависимые аэробные дегидрогеназы, у которых коферментом является ФАД или ФМН; 3. Убихинон (коэнзим Q) и белки, содержащие негемовое железо 4. Цитохромы, содержащие в качестве коферментов используются железопорфирины (гем и его производные). 24 • • •

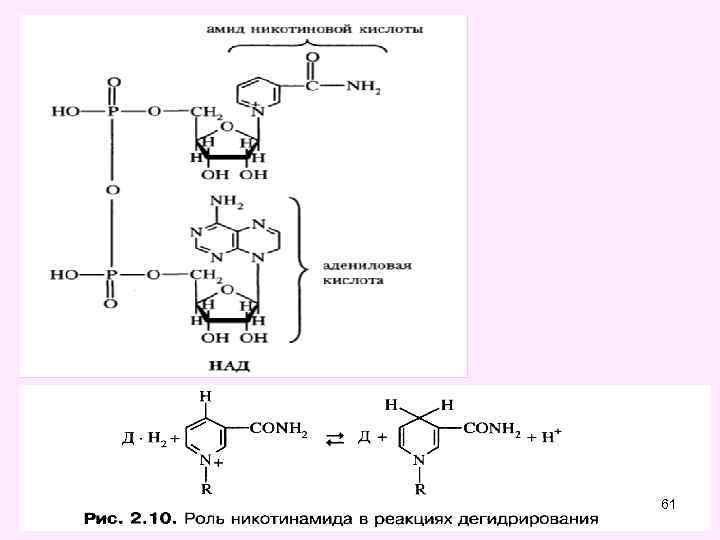
Пиридинзависимые анаэробные дегидрогеназы • Эти ферменты катализируют реакции переноса атомов водорода (протоны и электроны) на любой акцептор кроме кислорода Представители: • Пируват дегидрогеназа • Альфа-кетоглутаратдегидрогеназа • Изоцитрат дегидрогеназа • Малат дегидрогеназа • Коферментом этих ферментов являются НАД, НАДФпроизводные витамина РР ( В 5 - никотиновая кислота) 25
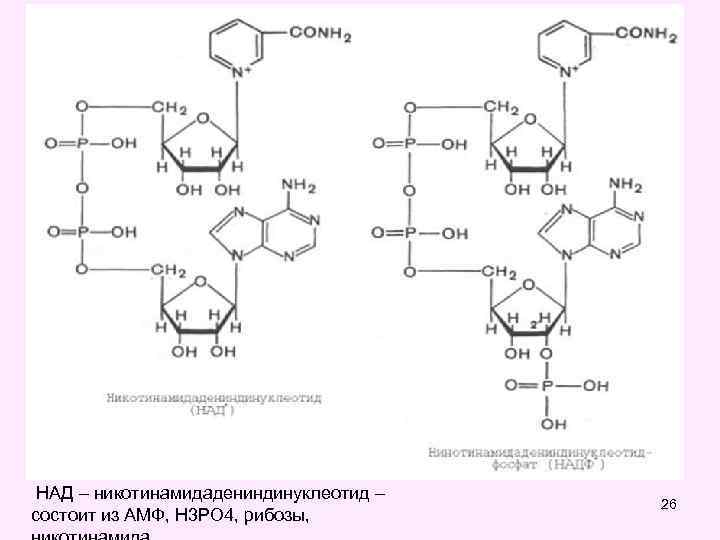
НАД – никотинамидадениндинуклеотид – состоит из АМФ, Н 3 РО 4, рибозы, 26
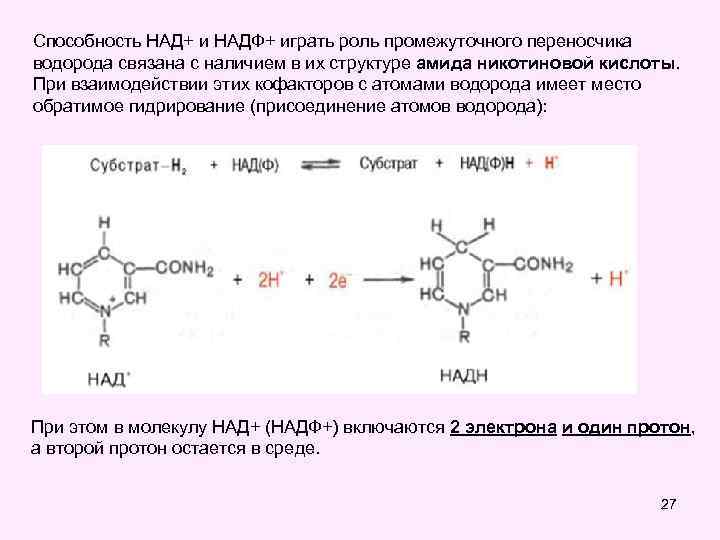
Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода): При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде. 27

АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ • Эти ферменты катализируют реакции переноса атомов водорода (протоны и электроны) на любой акцептор, в том числе и на кислород • • Представители: сукцинатдегидродгеназа глицерофосфатдегидрогеназа ацил-Ко. А-дегидрогеназа • Коферментами этих ферментов являются ФАД, ФМНпроизводные витамина В 2 ( рибофлавин) 28
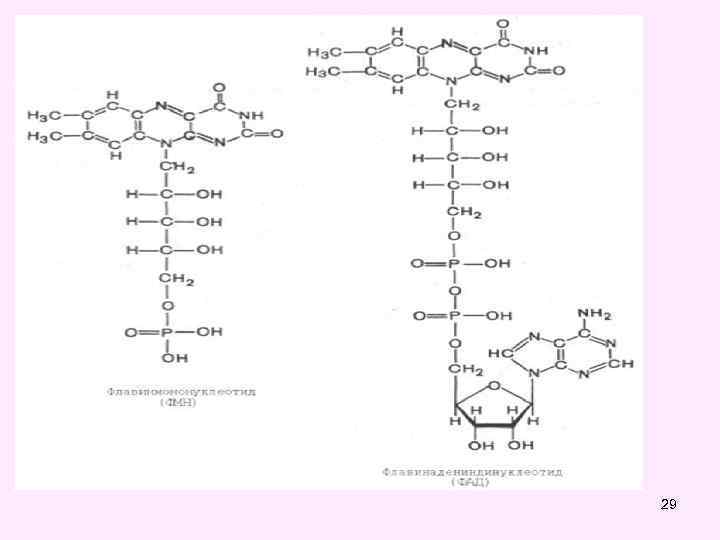
29
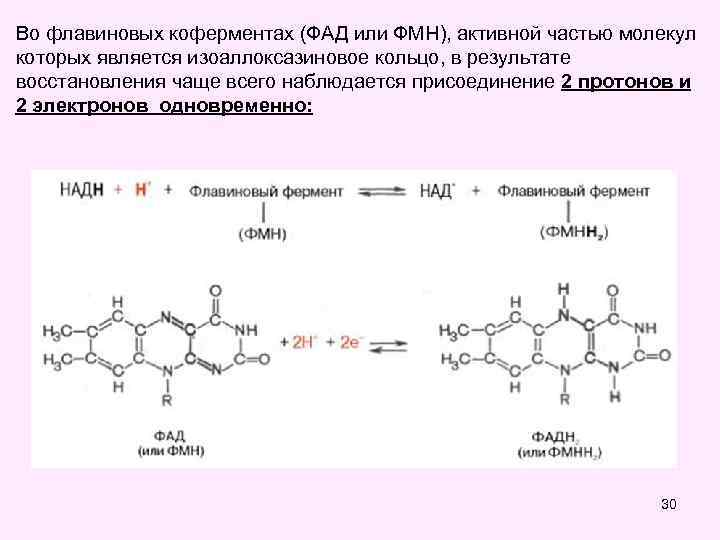
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно: 30
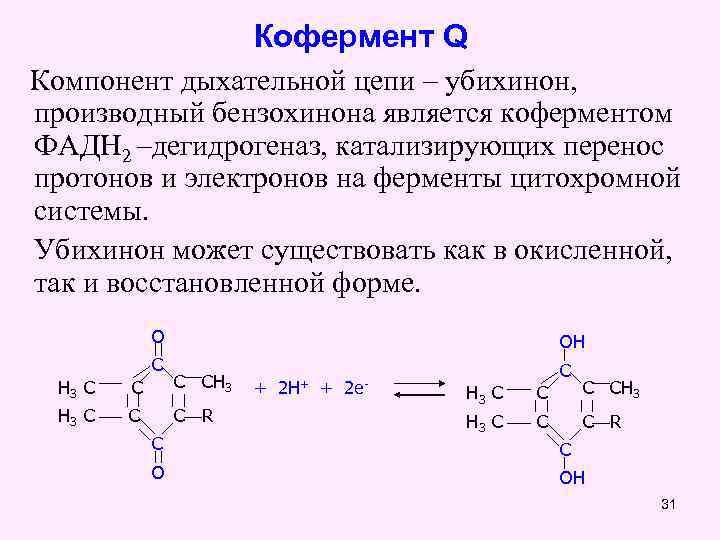
Кофермент Q Компонент дыхательной цепи – убихинон, производный бензохинона является коферментом ФАДН 2 –дегидрогеназ, катализирующих перенос протонов и электронов на ферменты цитохромной системы. Убихинон может существовать как в окисленной, так и восстановленной форме. О С ОH H 3 С СН 3 H 3 С С С R С O + 2 H+ + 2 е- С H 3 С СН 3 H 3 С С С R С OH 31
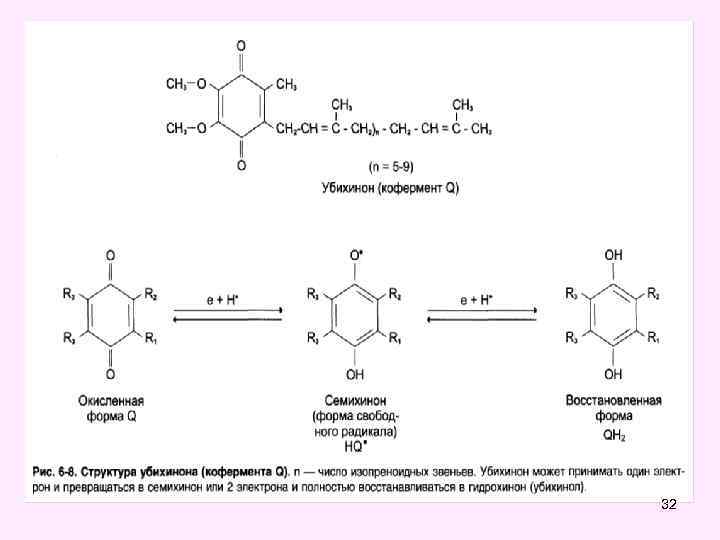
32

ЦИТОХРОМЫ Дальнейший перенос электронов от убихинона на кислород осуществляет система цитохромов: b, c 1, c, a- a 3. Все они имеют в качестве кофермента геминовую группу. В ходе каталитического процесса валентность содержащегося в цитохромах железа обратимо изменяется: Fe+++ Величины окислительно-восстановительного потенциала у разных цитохромов неодинаковы. В цепи окисления они располагаются между убихиноном и кислородом : b С 1 С aa 3 Цитохромы b, c 1, c выполняют функцию промежуточных переносчиков электронов, а цитохром аа 3 является терминальным дыхательным ферментом, непосредственно взаимодействующим с кислородом. ü Представители цитохромов: аскорбат ДГ, адреналин ДГ, норадреналин ДГ. 33

СТРУКТУРА ДЫХАТЕЛЬНОЙ ЦЕПИ • Перенос электронов и протонов в митохондриальной дыхательной цепи происходит по градиенту их окислительно-восстановительного потенциала (редокс-потенциал), который отражает величину свободной энергии в соответствии с редокс-системой. • Каждый фермент дыхательной цепи имеет свою величину редокс-потенциала. Его величина возрастает от НАД (0, 32 в) до О 2(+0, 82 в) и общая разность редокс-потенциала между ними равна 1, 14 Вольт. • Такое количество энергии, освобождаемой при окислении 1 молекулы субстрата НАДН 2 –дегидрогеназами, достаточно для синтеза трех молекул АТФ. • В дыхательной цепи имеются 3 участка, в которых энергии разности редокс-потенциалов достаточно для фосфорилирования (присоединения фосфорной кислоты) 334 х молекул АДФ, с образованием 3 молекул АТФ
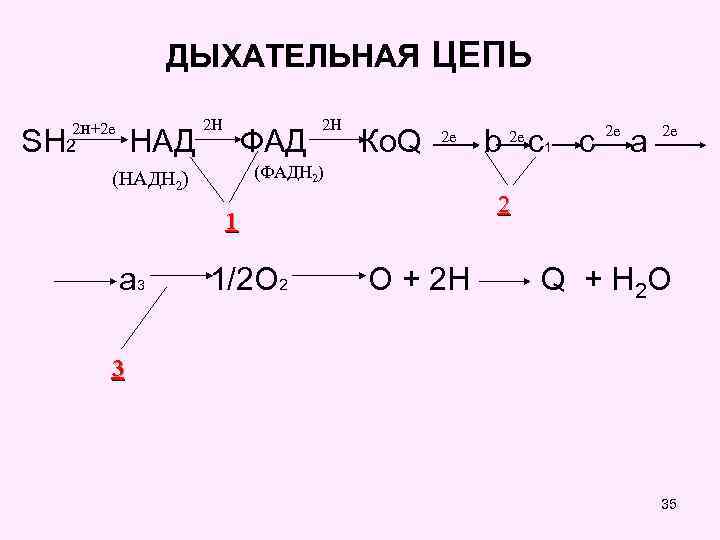
ДЫХАТЕЛЬНАЯ ЦЕПЬ 2 н+2 е 2 Н 2 Н 2 е 2 е SH 2 НАД ФАД Ко. Q b c 1 c a (НАДН 2) 2 е 2 е (ФАДН 2) 2 1 a 3 1/2 O 2 O + 2 H Q + H 2 O 3 35

ДЫХАТЕЛЬНАЯ ЦЕПЬ И РЕДОКС ПОТЕНЦИАЛ 36

ПУНКТЫ ФОСФОРИЛИРОВАНИЯ Первый пункт фосфорилирования находится между ферментами НАД и ФАД, где разность их потенциала равна 0, 246 АДФ + Н 3 РО 4 АТФ Второй пункт – между цитохромами В и С 1, где разность их потенциала равна 0, 19 АДФ + Н 3 РО 4 АТФ Третий пункт - между цитохромами аа 3 и 1/2 О 2, где разность их потенциала равна 0, 30 Вольт. АДФ + Н 3 РО 4 АТФ 37
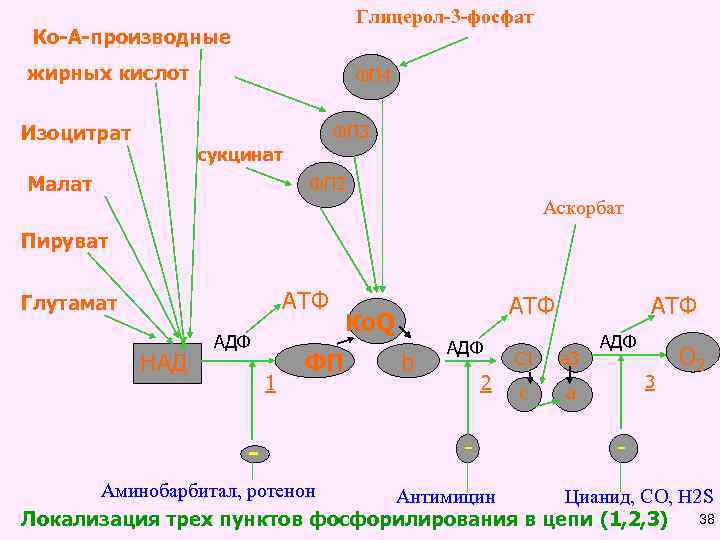
Глицерол-3 -фосфат Ко-А-производные жирных кислот Изоцитрат ФП 4 ФП 3 сукцинат Малат ФП 2 Аскорбат Пируват АТФ Глутамат НАД АДФ 1 - ФП АТФ Ко. Q b АДФ 2 - АТФ C 1 a 3 c АДФ a 3 О 2 - Аминобарбитал, ротенон Антимицин Цианид, СО, Н 2 S 38 Локализация трех пунктов фосфорилирования в цепи (1, 2, 3)

Окислительное фосфорилирование • При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одной до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ. • Это процесс - процесс синтеза АТФ в реакциях биологического окисления субстратов получил название - окислительное фосфорилирование. • Для его количественной оценки был введен показатель окислительного фосфорилирования - коэффициент Р/О. • Коэффициент Р/О (АДФ/О) - это есть отношение количества молекул фосфорной кислоты (АДФ) к количеству атомов кислорода, использованных митохондриями при окислении какого-либо субстрата. 39
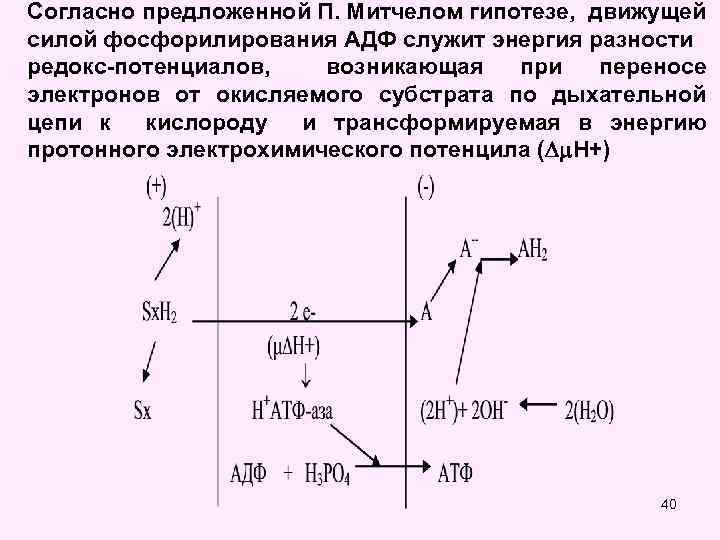
Согласно предложенной П. Митчелом гипотезе, движущей силой фосфорилирования АДФ служит энергия разности редокс-потенциалов, возникающая при переносе электронов от окисляемого субстрата по дыхательной цепи к кислороду и трансформируемая в энергию протонного электрохимического потенцила ( H+) 40

Основные постулаты хемиоосмотической Митчелла (Нобелевская премия 1978 г. ). теории ▪внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов, в частности для Н+ и ОН-; ▪за счет энергии транспорта электронов через I, III и IV комплексы дыхательной цепи из матрикса выкачиваются протоны; ▪возникающий на мембране электрохимический потенциал (ЭХП) и есть промежуточная форма запасания энергии; ▪возвращение (транслокация) протонов в матрикс митохондрии через протонный канал протонной АТФсинтазы за счет ЭХП является движущей силой синтеза 41 АТФ.

• Таким образом, тканевой дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее. • Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой образования АТФ и других видов полезной биологической энергии. 42

Протонный (трансмембранный ) электрохимический потенциал ( H+) • Трансмембранный электрохимический потенциал, возникающий на мембране за счет Н+-градиента, является универсальной формой энергии в клетке и может быть использован: • - для синтеза АТФ • - для транспорта ионов Са и других ионов • - для транспорта фосфатов • - для транспорта АДФ и АТФ • - для теплообразования • - для сократительной и двигательной активности 43

Дыхательный контроль • Окислительное фосфорилировние контролирует скорость биологического окисления, осуществляя так называемый дыхательный контроль. • Дыхательный контроль – это свойство неповрежденных митохондрий. При наличии всех компонентов биологического окисления, но при отсутствии АДФ скорость биологического окисления замедляется. При большом количестве АДФ и малом содержании АТФ скорость биологического окисления увеличивается. 44

Дыхательный контроль – это прямое влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т. е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ и АДФ, количественная сумма которых в клетке практически постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ. Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т. е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН 2 на I и II комплексах и замедление катаболизма в клетке. Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т. е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+. При этом градиент, естественно, снижается, поток электронов возрастает, в результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН 2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как 45 итог – активируются реакции катаболизма углеводов и жиров.

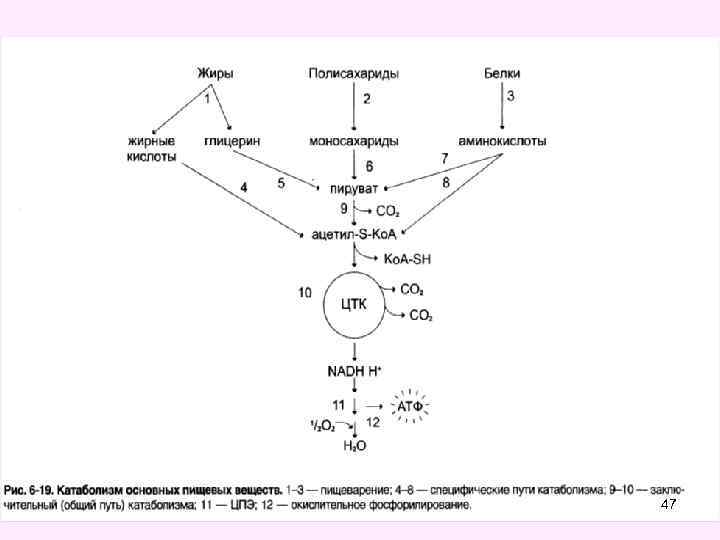
Общие пути катаболизма 46
47

• Пировиноградная кислота (пируват) и ацетил. Ко. А являются теми метаболитами, которые, включаясь в общие пути катаболизма, разрушаются до углекислого газа и воды, поставляют энергию для синтеза АТФ в митохондриях. • К общим путям катаболизма относятся следующие метаболические процессы (оба эти процесса локализованы в митохондриях): • - окислительное декарбоксилирование пировиноградной кислоты • - превращение ацетил-Ко. А в цикле трикарбоновых кислот Кребса (Ц Т К ). 48

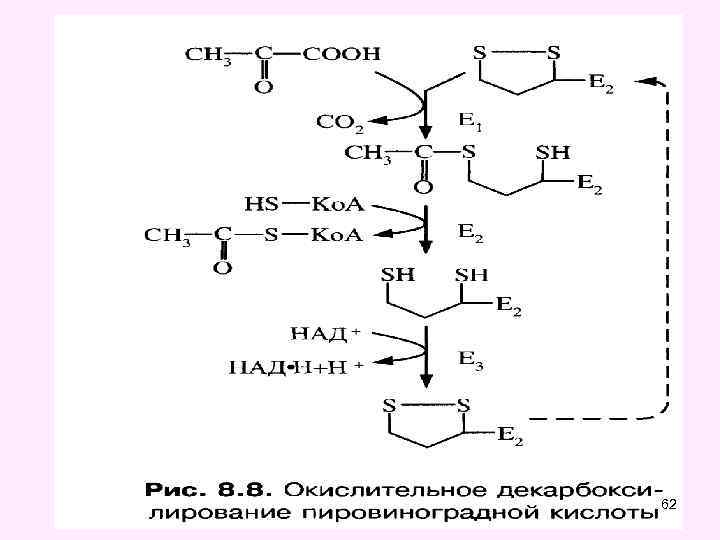
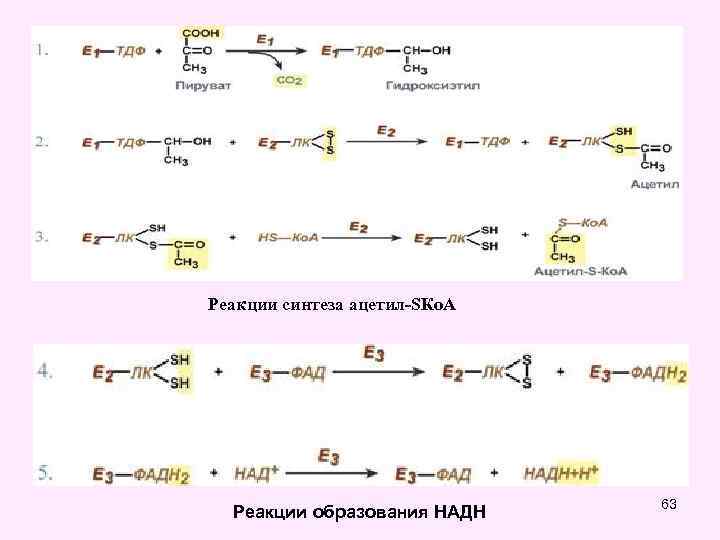
Окислительное декарбоксилирование пировиноградной кислоты • Окислительное декарбоксилирование пирувата катализируется мультиэнзимным пируватдегидрогеназным комплексом, локализованным на внутренней мембране митохондрий со стороны матрикса. • Пируват-дегидрогеназный комплекс (окислительная декарбоксилаза пировиноградной кислоты) состоит из трех ферментов (Е 1, Е 2, Е 3): • Е 1 -пируватдекарбоксилаза с коферментом ТПФ (тиаминпирофосфат), • • Е 2 -дигидролипоил-трансацетилаза с коферментом липоевая кислота (ЛК) и кофактором - НS-Ко. А, • • Е 3 -дигидролипоил-дегидрогеназа с коферментом ФАД и кофактор - НАД 49
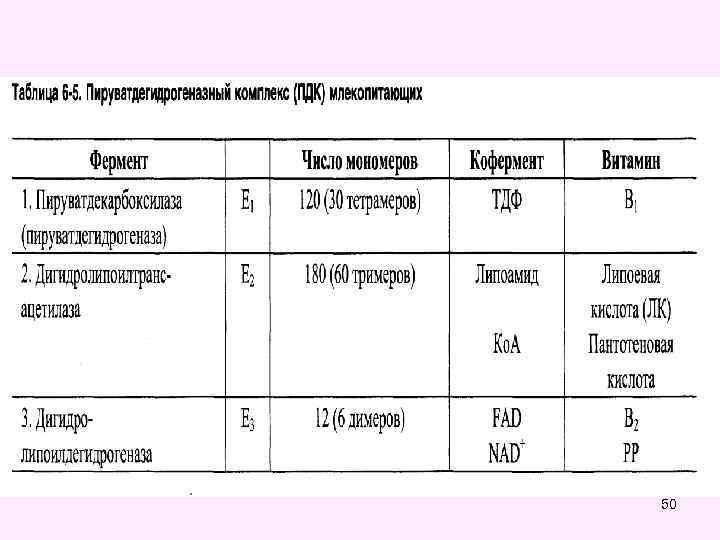
50
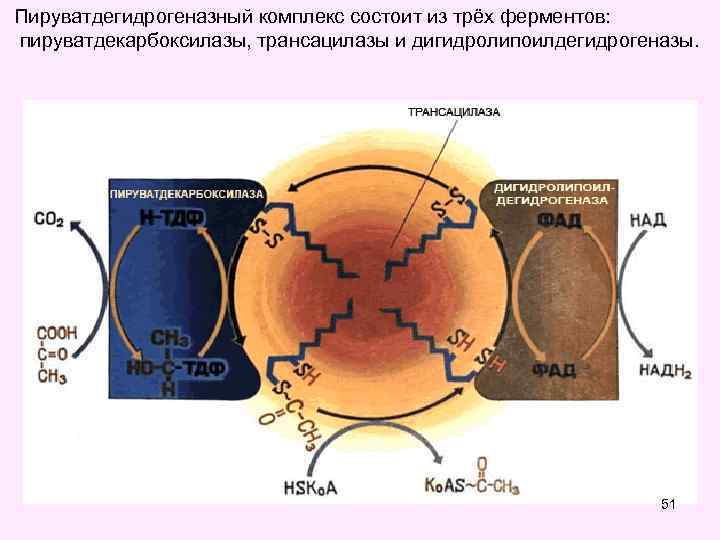
Пируватдегидрогеназный комплекс состоит из трёх ферментов: пируватдекарбоксилазы, трансацилазы и дигидролипоилдегидрогеназы. 51
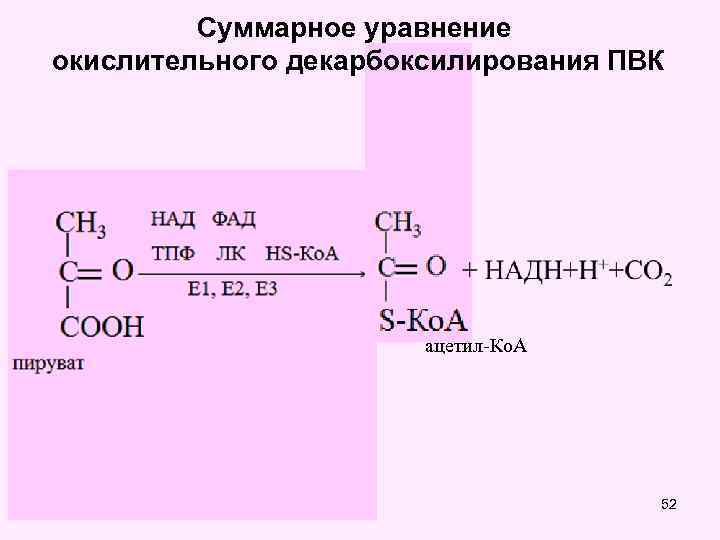
Суммарное уравнение окислительного декарбоксилирования ПВК ацетил-Ко. А 52
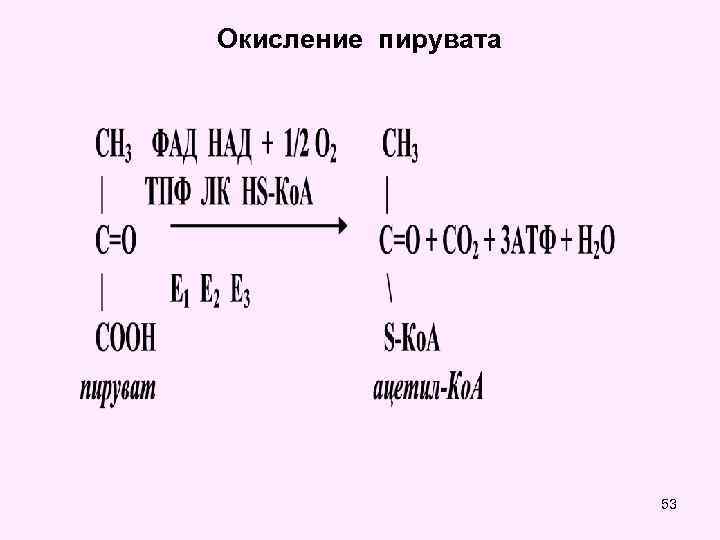
Окисление пирувата 53

Стадия 1 ацетилдигидролипоевая кислота в составе Е 2 54
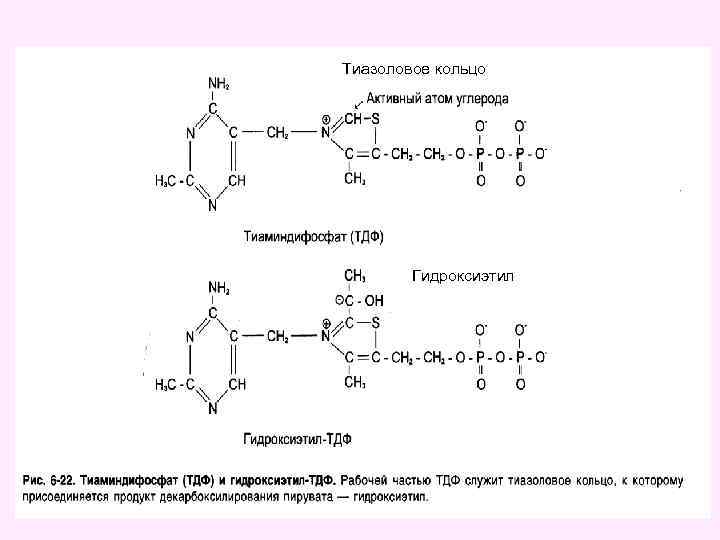
Тиазоловое кольцо Гидроксиэтил
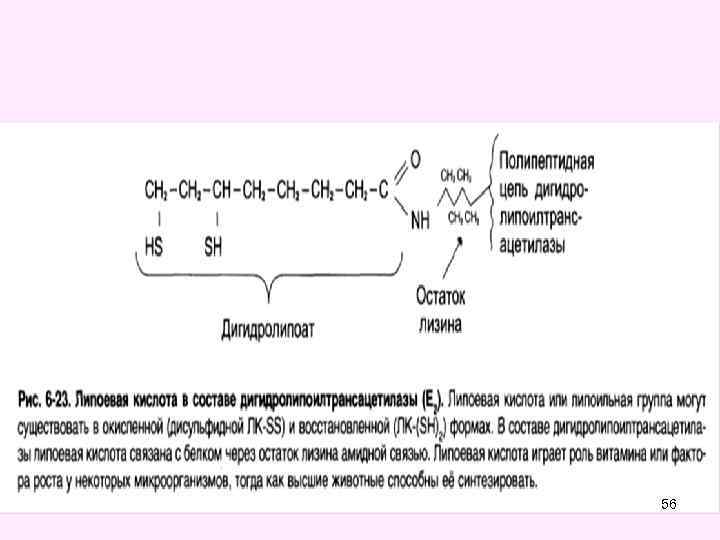
56

Стадия 2 57
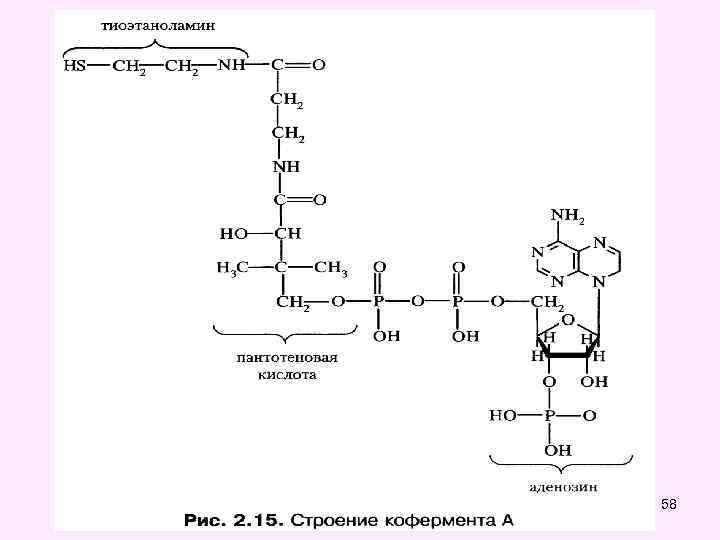
58

Стадия 3 59
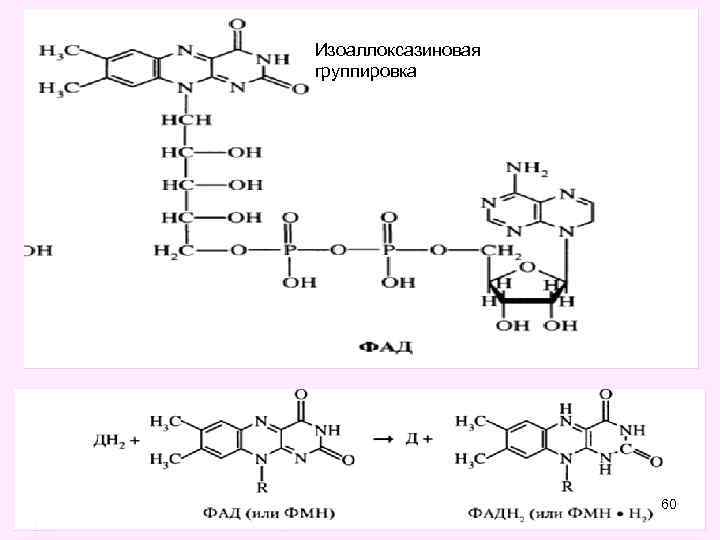
Изоаллоксазиновая группировка 60
61
62
Реакции синтеза ацетил-SКо. А Реакции образования НАДН 63

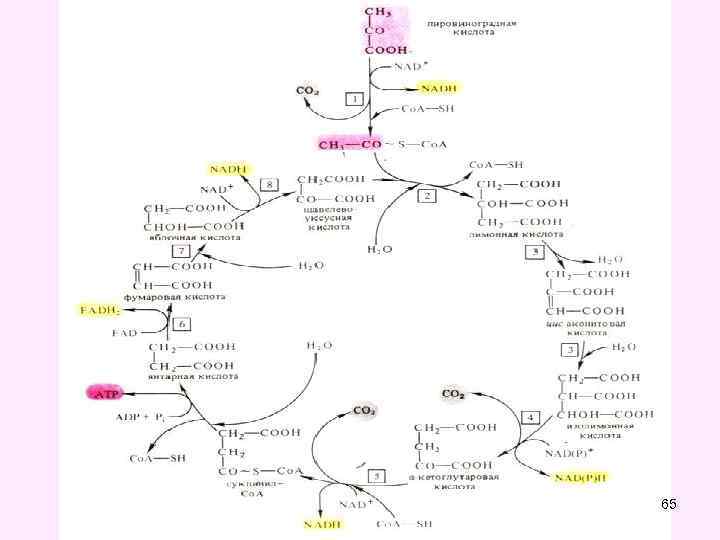
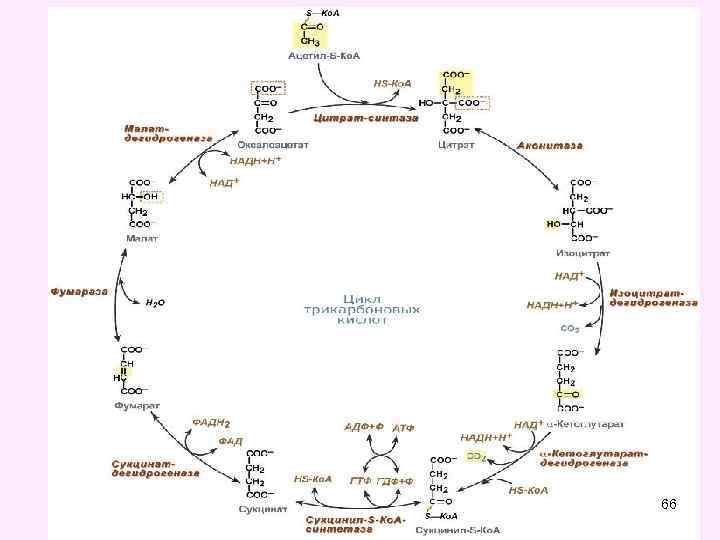
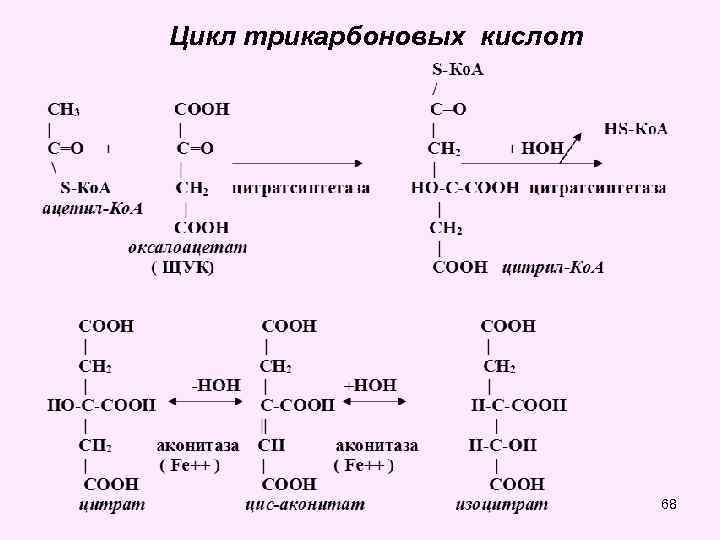
• Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-Ко. А), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль ≪клеточного углеводов, жирных топлива≫: кислот и аминокислот. • За это выдающееся открытие Г. Кребс получил Нобелевскую премию в 1953 г. (совместно с Ф. Липманом). Цикл трикарбоновых кислот часто называют его именем – цикл Кребса (цикл лимонной кислоты Кребса). 64
65
66

67
Цикл трикарбоновых кислот 68

69

70

• В цикле трикарбоновых кислот Кребса имеет место четыре реакции дегидрирования субстратов соответствующими дегидрогеназами: • • изоцитратдегидрогеназа, кофермент НАД, альфа-кетоглутаратдегидрогеназа, кофактор НАД сукцинатдегидрогеназа, кофермент ФАД, малатдегидрогеназа, кофермент НАД. • Выход энергии при окислении 1 молекулы ацетил-Ко. А в ЦТК - 12 АТФ • Во всех реакциях общих путей катаболизма 1 молекулы глюкозы синтезируется 15 молекул АТФ 71
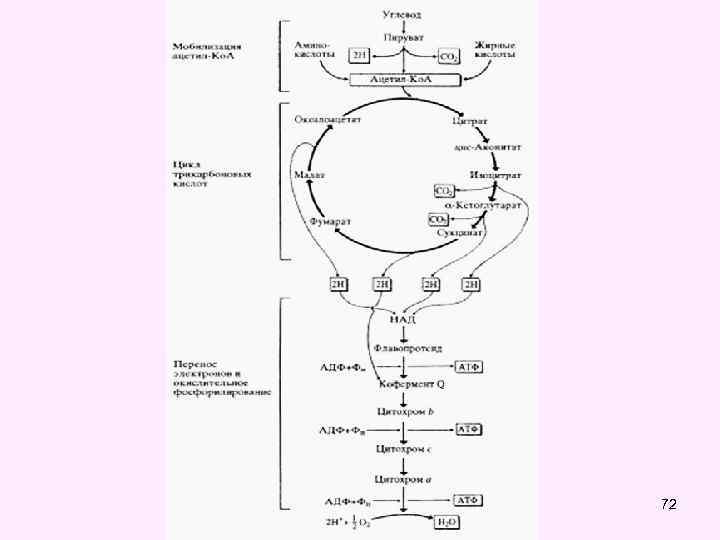
72
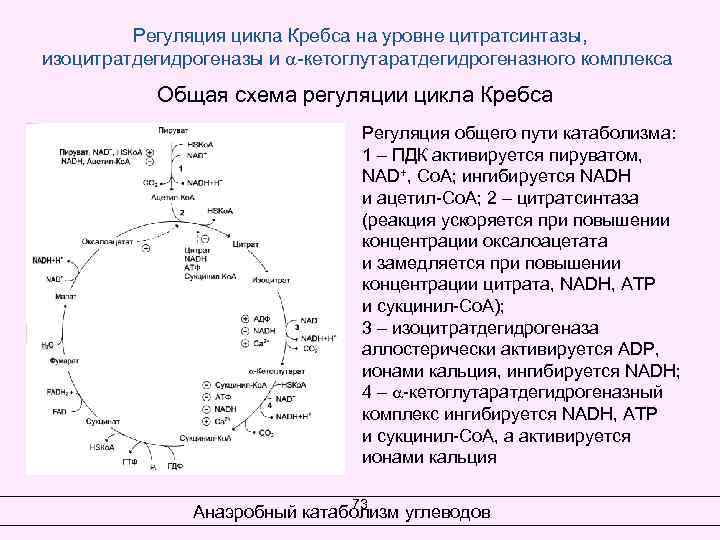
Регуляция цикла Кребса на уровне цитратсинтазы, изоцитратдегидрогеназы и -кетоглутаратдегидрогеназного комплекса Общая схема регуляции цикла Кребса Регуляция общего пути катаболизма: 1 – ПДК активируется пируватом, NAD+, Со. А; ингибируется NADН и ацетил-Со. А; 2 – цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADН, АТР и сукцинил-Со. А); 3 – изоцитратдегидрогеназа аллостерически активируется АDР, ионами кальция, ингибируется NADН; 4 – -кетоглутаратдегидрогеназный комплекс ингибируется NADН, АТР и сукцинил-Со. А, а активируется ионами кальция 73 Анаэробный катаболизм углеводов
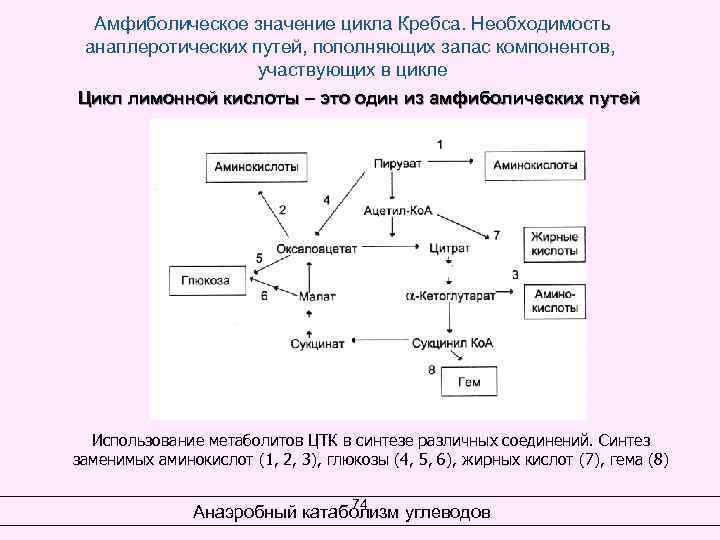
Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле Цикл лимонной кислоты – это один из амфиболических путей Использование метаболитов ЦТК в синтезе различных соединений. Синтез заменимых аминокислот (1, 2, 3), глюкозы (4, 5, 6), жирных кислот (7), гема (8) 74 Анаэробный катаболизм углеводов
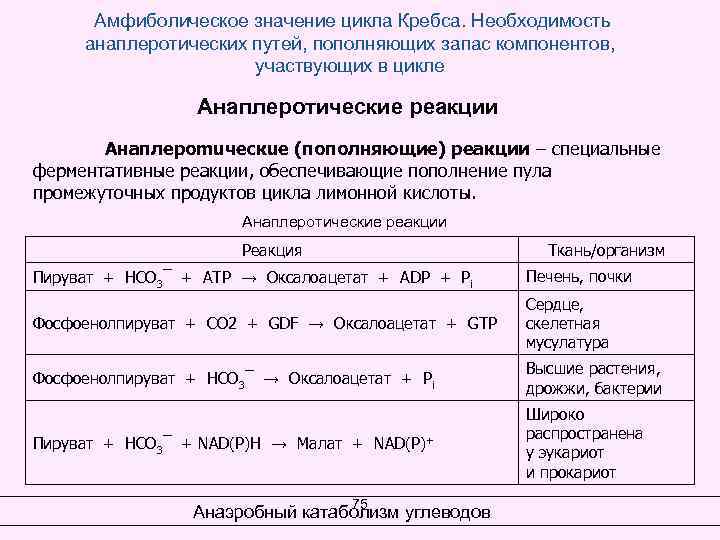
Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле Анаплеротические реакции Анаплероmuческuе (пополняющие) реакции – специальные ферментативные реакции, обеспечивающие пополнение пула промежуточных продуктов цикла лимонной кислоты. Анаплеротические реакции Реакция Ткань/организм Пируват + НСО 3¯ + АТР → Оксалоацетат + АDР + Pi Печень, почки Фосфоенолпируват + СО 2 + GDF → Оксалоацетат + GTР Сердце, скелетная мусулатура Фосфоенолпируват + НСО 3¯ → Оксалоацетат + Рi Высшие растения, дрожжи, бактерии Пируват + НСО 3¯ + NAD(P)H → Малат + NAD(P)+ Широко распространена у эукариот и прокариот 75 Анаэробный катаболизм углеводов