biochem lecture 2.ppt
- Количество слайдов: 40
 Занятие 2 Кислоты и основания. Основы органической химии
Занятие 2 Кислоты и основания. Основы органической химии
 Кислота и основание То, что нам говорили в школе Кислота HA H+ + А - Основание BOH B+ + OH-
Кислота и основание То, что нам говорили в школе Кислота HA H+ + А - Основание BOH B+ + OH-
 Теории кислот и оснований
Теории кислот и оснований
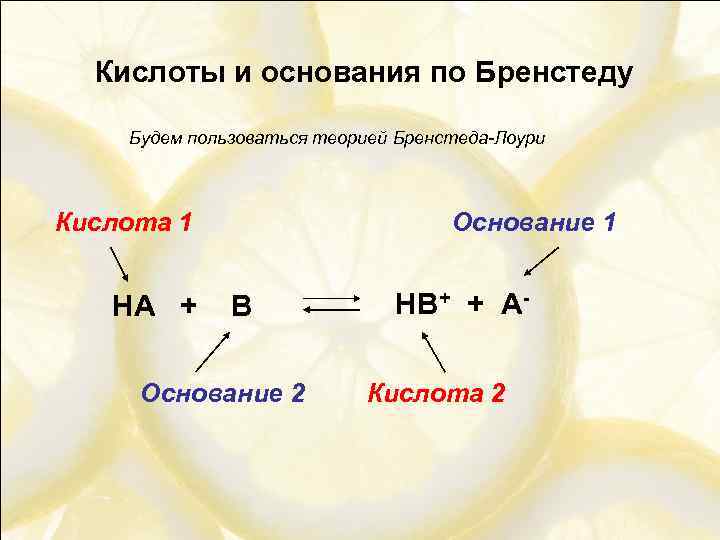 Кислоты и основания по Бренстеду Будем пользоваться теорией Бренстеда-Лоури Кислота 1 HA + Основание 1 B Основание 2 HB+ + АКислота 2
Кислоты и основания по Бренстеду Будем пользоваться теорией Бренстеда-Лоури Кислота 1 HA + Основание 1 B Основание 2 HB+ + АКислота 2
 Кислоты и основания по Бренстеду ПРАВИЛО: Чем сильнее кислота, тем слабее сопряжённое ей основание и наоборот
Кислоты и основания по Бренстеду ПРАВИЛО: Чем сильнее кислота, тем слабее сопряжённое ей основание и наоборот
 Кислоты и основания по Бренстеду Что такое сильная (слабая) кислота?
Кислоты и основания по Бренстеду Что такое сильная (слабая) кислота?
 Способы выражения концентрации растворов 1) Молярная концентрация, М (моль/л) Число молей растворённого вещества, Объём раствора 1 Моль=6, 02*1023 штук молекул 2) Массовая процентная концентрация Масса растворённого вещества Общая масса раствора
Способы выражения концентрации растворов 1) Молярная концентрация, М (моль/л) Число молей растворённого вещества, Объём раствора 1 Моль=6, 02*1023 штук молекул 2) Массовая процентная концентрация Масса растворённого вещества Общая масса раствора
![Химическое равновесие v 1 v 2 Равновесие: v 1=v 2 [A] –равновесная концентрация вещества Химическое равновесие v 1 v 2 Равновесие: v 1=v 2 [A] –равновесная концентрация вещества](https://present5.com/presentation/-12822276_227424226/image-8.jpg) Химическое равновесие v 1 v 2 Равновесие: v 1=v 2 [A] –равновесная концентрация вещества А, моль/л
Химическое равновесие v 1 v 2 Равновесие: v 1=v 2 [A] –равновесная концентрация вещества А, моль/л
![Водородный показатель (р. Н) p. H=-lg[H+] Водородный показатель (р. Н) p. H=-lg[H+]](https://present5.com/presentation/-12822276_227424226/image-9.jpg) Водородный показатель (р. Н) p. H=-lg[H+]
Водородный показатель (р. Н) p. H=-lg[H+]
 Сила кислот и оснований Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя. Сила основания – характеристика основания, показывающая, насколько прочно основание связывает протоны, оторванные от молекул данного растворителя.
Сила кислот и оснований Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя. Сила основания – характеристика основания, показывающая, насколько прочно основание связывает протоны, оторванные от молекул данного растворителя.
 Сила кислот и оснований Сильная кислота – кислота, реагирующая с избытком воды необратимо. Слабая кислота – кислота, реагирующая с избытком воды обратимо и, как правило, незначительно. Сильное основание – основание, реагирующее с избытком воды необратимо. Слабое основание – основание, реагирующее с избытком воды обратимо и, как правило, незначительно
Сила кислот и оснований Сильная кислота – кислота, реагирующая с избытком воды необратимо. Слабая кислота – кислота, реагирующая с избытком воды обратимо и, как правило, незначительно. Сильное основание – основание, реагирующее с избытком воды необратимо. Слабое основание – основание, реагирующее с избытком воды обратимо и, как правило, незначительно
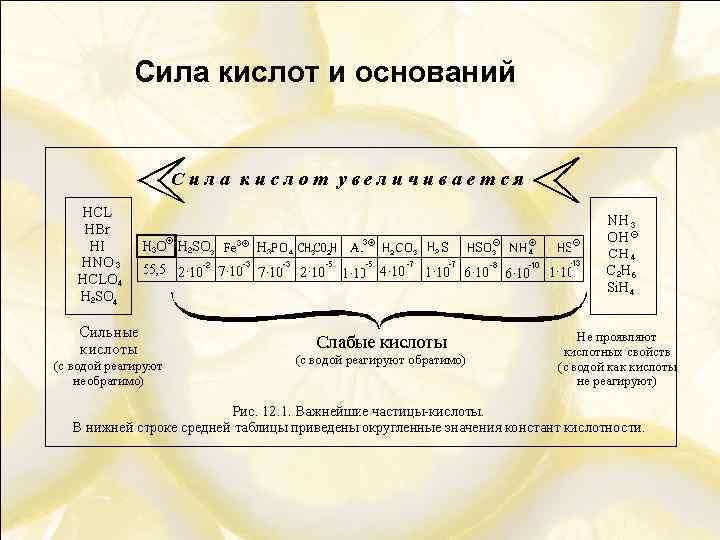 Сила кислот и оснований
Сила кислот и оснований
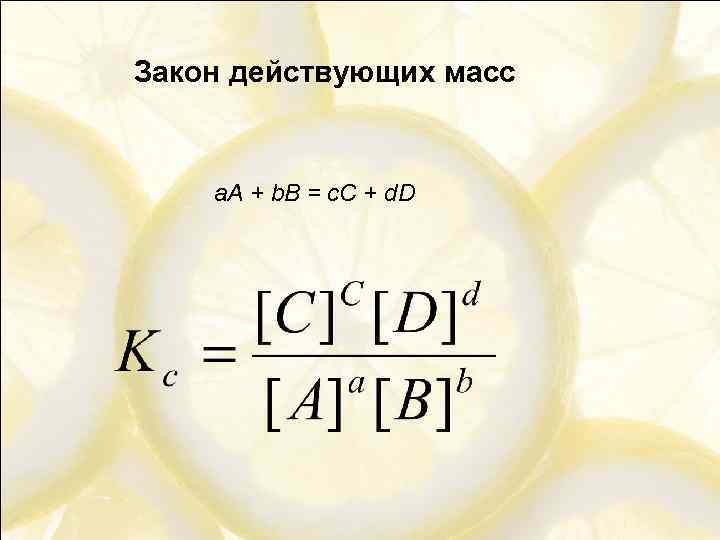 Закон действующих масс а. A + b. B = c. C + d. D
Закон действующих масс а. A + b. B = c. C + d. D
 Константа кислотности p. Ka=-lg. Ka
Константа кислотности p. Ka=-lg. Ka
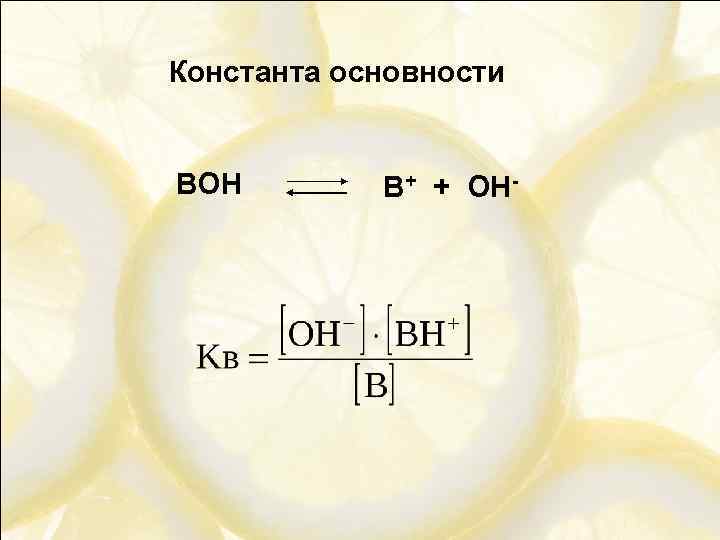 Константа основности BOH B+ + OH-
Константа основности BOH B+ + OH-
 Ионное произведение воды H 20 = H+ + OH- Kw=10 -14
Ионное произведение воды H 20 = H+ + OH- Kw=10 -14
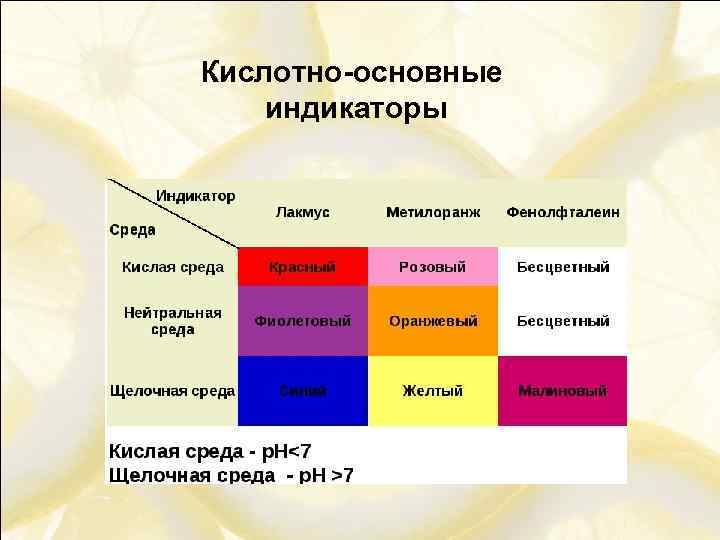 Кислотно-основные индикаторы
Кислотно-основные индикаторы
 Кислотно-основные индикаторы
Кислотно-основные индикаторы
 Прибор для измерения р. Н-метр
Прибор для измерения р. Н-метр
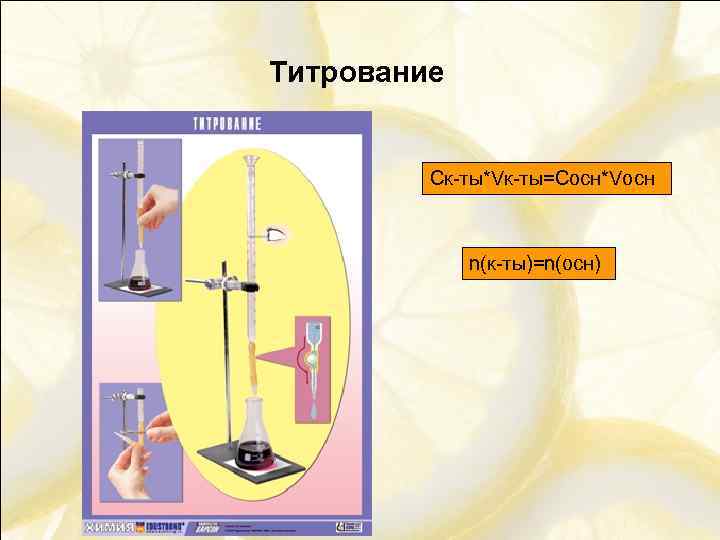 Титрование Ск-ты*Vк-ты=Сосн*Vосн n(к-ты)=n(осн)
Титрование Ск-ты*Vк-ты=Сосн*Vосн n(к-ты)=n(осн)
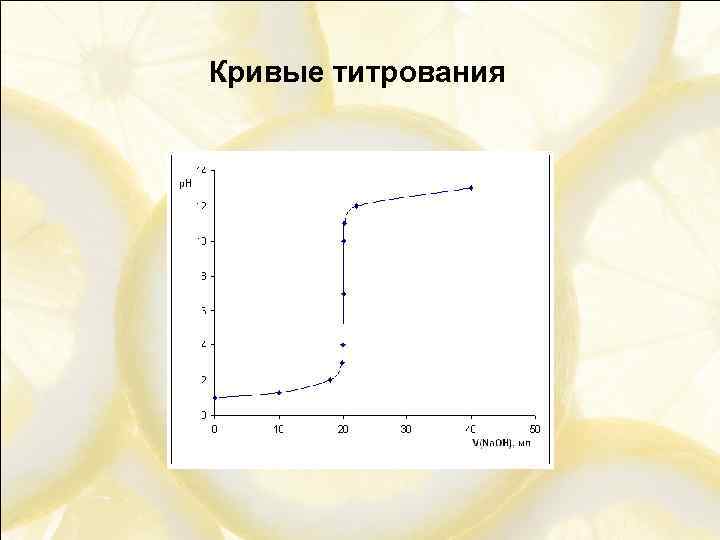 Кривые титрования
Кривые титрования
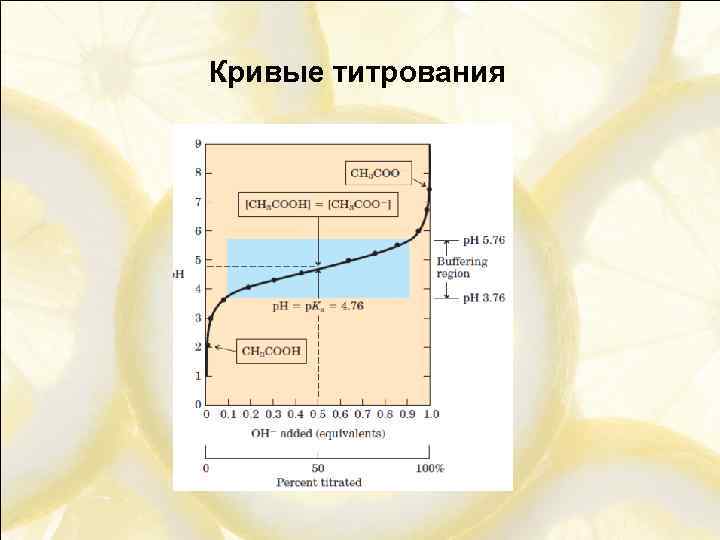 Кривые титрования
Кривые титрования
 Буферные растворы Кислотно-основные буферные растворы – растворы, способные противодействовать изменению р. Н при добавлении к ним небольших количеств кислоты или основания, а также при разведении. Буферный раствор – смесь слабой кислоты и сопряжённого основания
Буферные растворы Кислотно-основные буферные растворы – растворы, способные противодействовать изменению р. Н при добавлении к ним небольших количеств кислоты или основания, а также при разведении. Буферный раствор – смесь слабой кислоты и сопряжённого основания
![Буферные растворы Уравнение Хендерсона-Хассельбаха С(буф)=[HA]+[A-] Буферная ёмкость – количество молей сильной кислоты или сильного Буферные растворы Уравнение Хендерсона-Хассельбаха С(буф)=[HA]+[A-] Буферная ёмкость – количество молей сильной кислоты или сильного](https://present5.com/presentation/-12822276_227424226/image-24.jpg) Буферные растворы Уравнение Хендерсона-Хассельбаха С(буф)=[HA]+[A-] Буферная ёмкость – количество молей сильной кислоты или сильного основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его р. Н на единицу.
Буферные растворы Уравнение Хендерсона-Хассельбаха С(буф)=[HA]+[A-] Буферная ёмкость – количество молей сильной кислоты или сильного основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его р. Н на единицу.
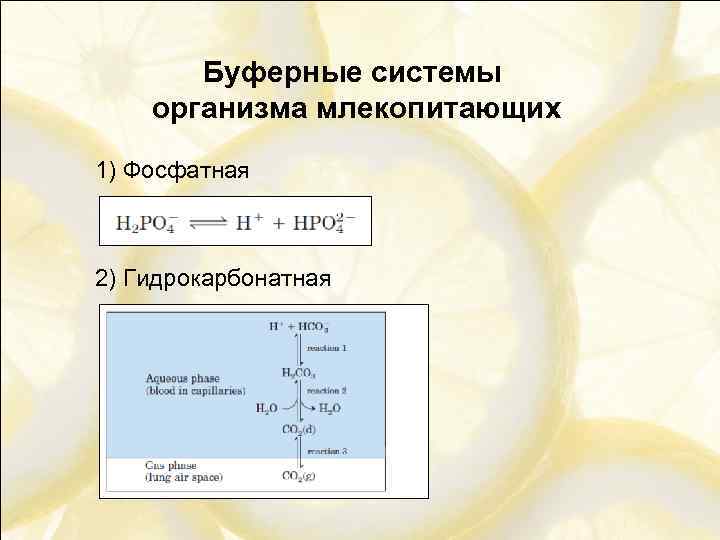 Буферные системы организма млекопитающих 1) Фосфатная 2) Гидрокарбонатная
Буферные системы организма млекопитающих 1) Фосфатная 2) Гидрокарбонатная
 С 02, океан и кораллы
С 02, океан и кораллы
 С 02, океан и кораллы
С 02, океан и кораллы
 Основы органической химии
Основы органической химии
 Органическая химия - Химия соединений углерода
Органическая химия - Химия соединений углерода
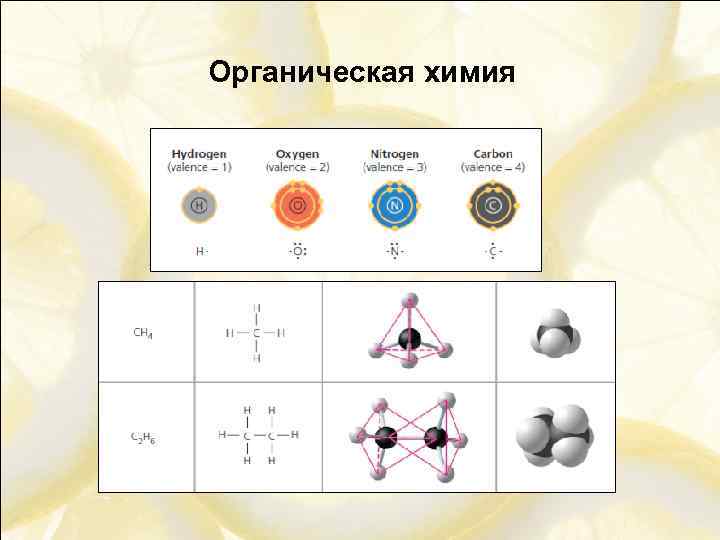 Органическая химия
Органическая химия
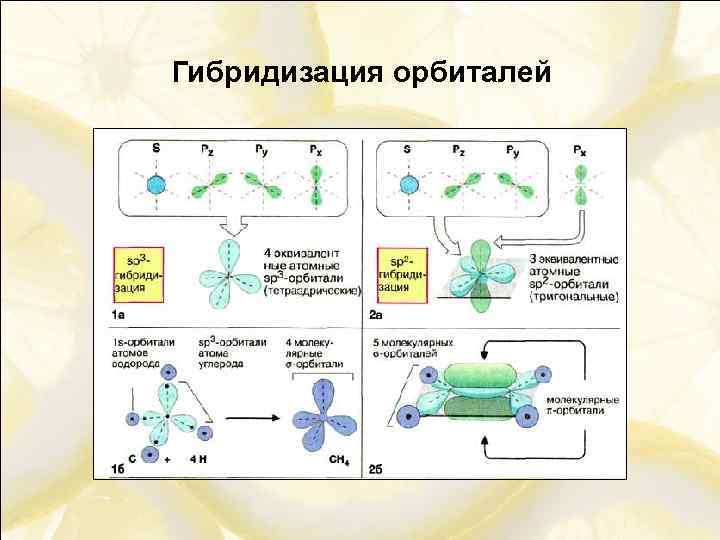 Гибридизация орбиталей
Гибридизация орбиталей
 Органическая химия
Органическая химия
 Органическая химия
Органическая химия
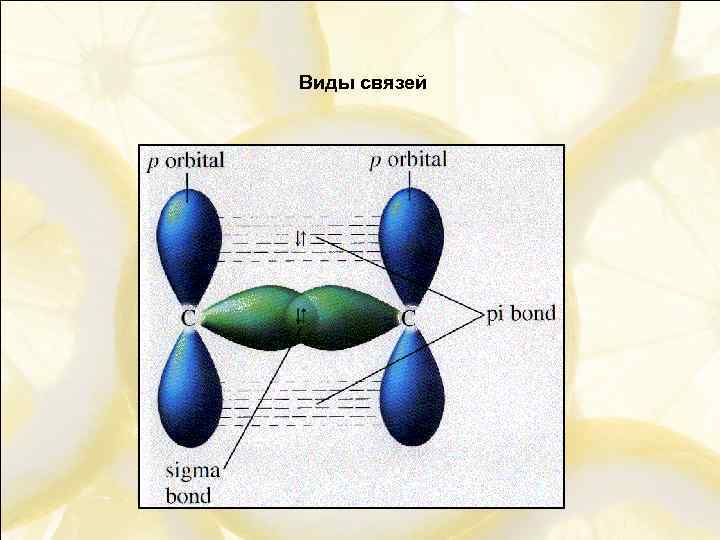 Виды связей
Виды связей
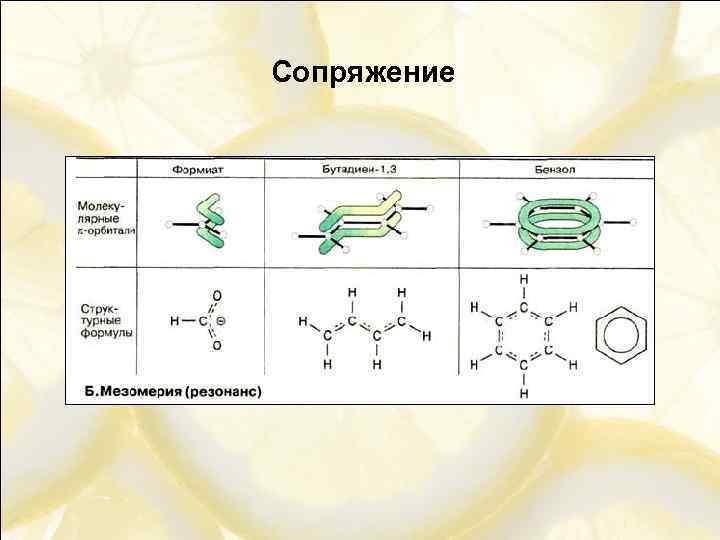 Сопряжение
Сопряжение
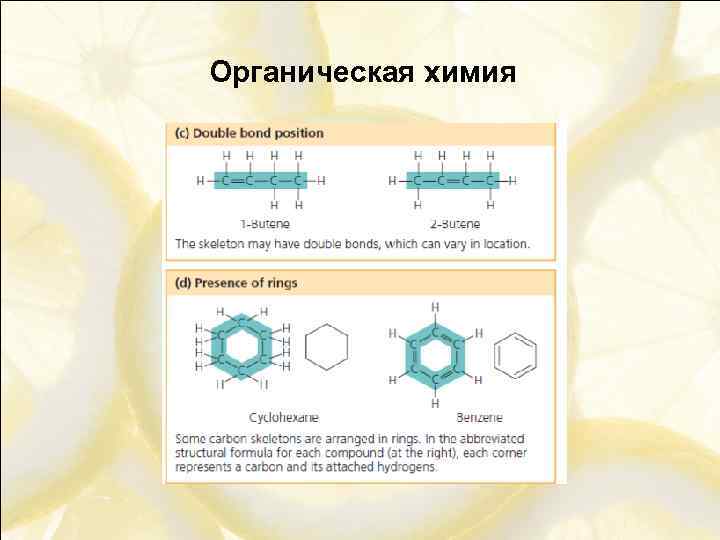
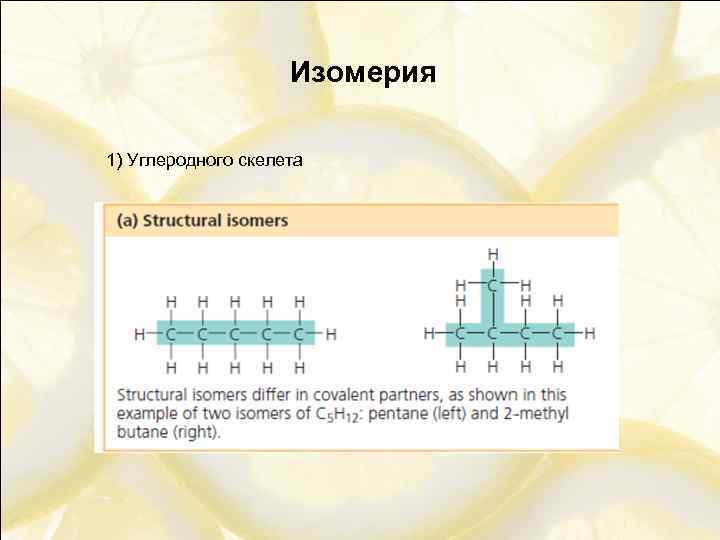 Изомерия 1) Углеродного скелета
Изомерия 1) Углеродного скелета
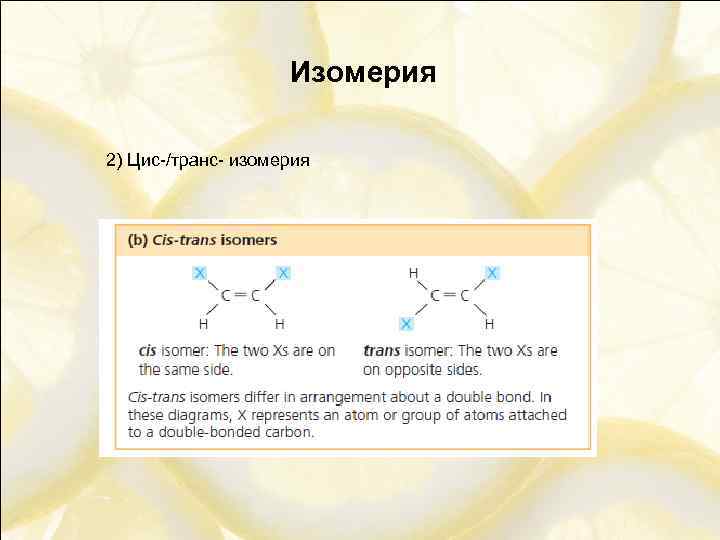 Изомерия 2) Цис-/транс- изомерия
Изомерия 2) Цис-/транс- изомерия
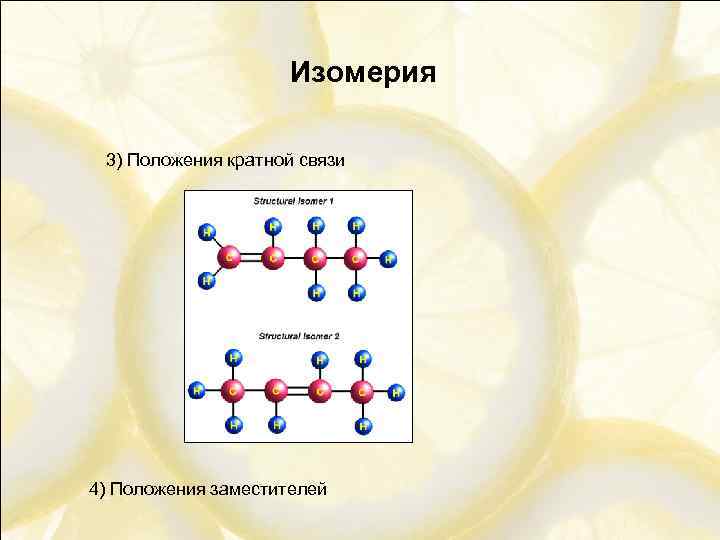 Изомерия 3) Положения кратной связи 4) Положения заместителей
Изомерия 3) Положения кратной связи 4) Положения заместителей
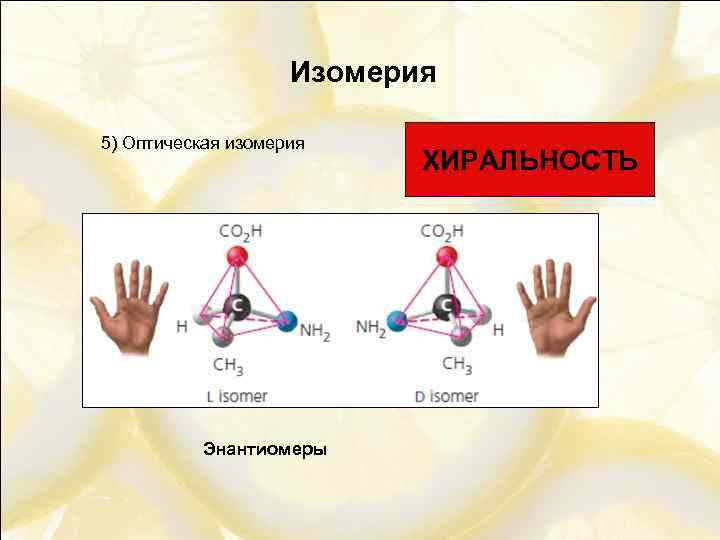 Изомерия 5) Оптическая изомерия Энантиомеры ХИРАЛЬНОСТЬ
Изомерия 5) Оптическая изомерия Энантиомеры ХИРАЛЬНОСТЬ



