
Занятие 2 Белки

Белки n n n Определение Ф. Энгельса "Жизнь есть способ существования белковых тел" до сих пор, по прошествии почти полутора веков, не потеряло своей правильности и актуальности. В основе структуры любого организма и всех протекающих в нем жизненных реакций лежат белки. Любые нарушения в этих белках приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций. Белки - высокомолекулярные, полимерные соединения, состоящие из аминокислот.

Функции белков Структурная Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении мембран и цитоскелета К данной функции можно отнести участие в создании органелл – рибосомы. n Ферментативная Все ферменты являются белками. Гормональная (инсулин и глюкагон). n n n

Функции белков Рецепторная Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. n Резервная В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. n n

Транспортная Только белки осуществляют перенос веществ в крови, например, Ø липопротеины (перенос жира), Ø гемоглобин (транспорт кислорода), Ø трансферрин (транспорт железа) Ø через мембраны - Na+, К+-АТФаза n

Функции белка Сократительная Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). n Защитная Защитной функцией при инфекциях обладают иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны. n n n

Как формируется молекула белка? n n n Белок – это последовательность аминокислот, связанных друг с другом пептидными связями. Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. n Выделяют Пептид – до 10 аминокислот полипептид если от 10 до 40 аминокислот Белок - если в цепи более 40 аминокислот
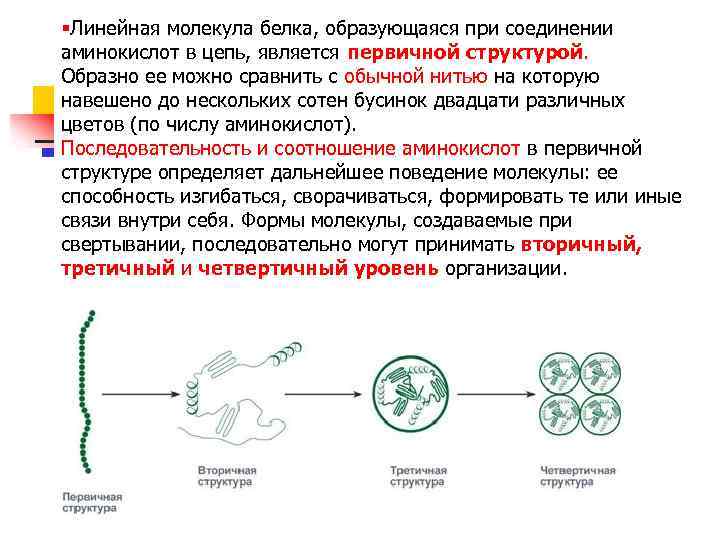
§Линейная молекула белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот). Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровень организации.
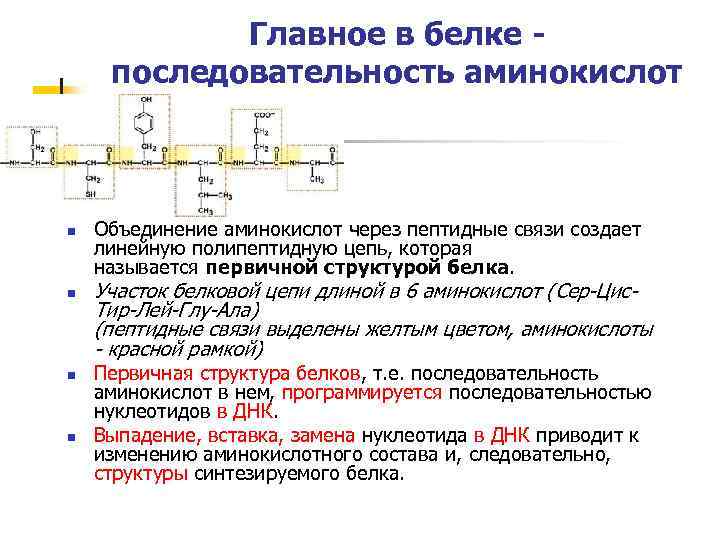
Главное в белке - последовательность аминокислот n n Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка. Участок белковой цепи длиной в 6 аминокислот (Сер-Цис. Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой) Первичная структура белков, т. е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.

Изменение в последовательности АК – это заболевание n n n Например, при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (Hb. S) – такого гемоглобина, который полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу. Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.

n n n На уровне вторичной структуры белковые "бусы" способны укладываться в виде спирали (подобно дверной пружине) и в виде складчатого слоя, когда "бусы" уложены змейкой и удаленные части бус оказываются рядом. Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка. Некоторые белковые глобулы существуют и выполняют свою функцию
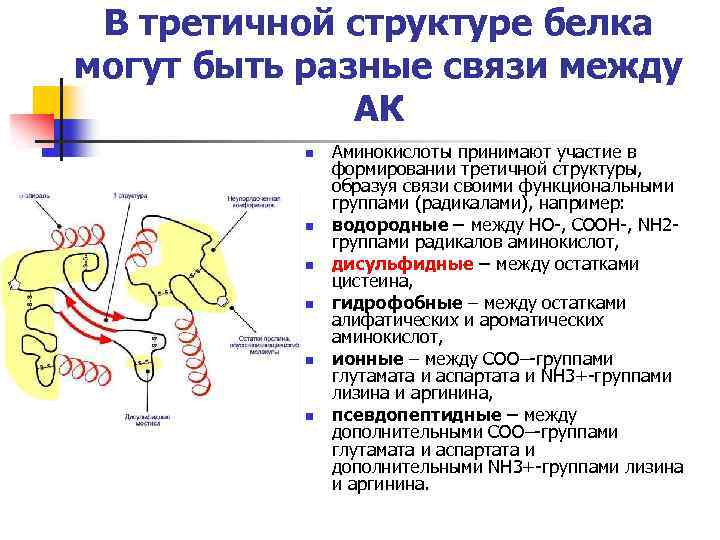
В третичной структуре белка могут быть разные связи между АК n n n Аминокислоты принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например: водородные – между НО-, СООН-, NH 2 группами радикалов аминокислот, дисульфидные – между остатками цистеина, гидрофобные – между остатками алифатических и ароматических аминокислот, ионные – между СОО–-группами глутамата и аспартата и NH 3+-группами лизина и аргинина, псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH 3+-группами лизина и аргинина.

Часть белков имеют четвертичный уровень организации n n n Они называются олигомерами и состоят из индивидуальных цепей – протомеры (мономеры, субъединицы). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т. д.

Белки олигомеры n n Строение тетрамера гемоглобина взрослых Белок гемоглобина –тетрамер Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы при мышечном сокращении, также включает 4 субъединицы Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т. е. их поверхность подходит другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).

Свойства белков следуют из их строения Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH 3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении р. Н, и отрицательно при его увеличении. Если р. Н раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных р. Н заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне р. Н 4, 8 -5, 4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот n n n n

Свойства белков амфотерность n n n Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных р. Н заряд положительный Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т. е. способность поддерживать неизменным р. Н крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) Или использовать изменение величины р. Н раствора для осаждения какого-либо известного белка

Растворимость n n n Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: наличием заряда и взаимоотталкиванием заряженных молекул белка, наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка.

Растворы белков - коллоидные растворы n Свойства белковых растворов определяются большими размерами молекул, т. е. белки являются коллоидными частицами и образуют коллоидные растворы.

Свойства коллоидных растворов n n n Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция Белковые растворы в отличие от истинных обладают малой скоростью диффузии Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней

Белки можно удалить из раствора n n Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка и потере его функций, но при этом сохраняется первичная структура белка Денатурация – это необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.

Денатурация n n n n 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация n Зависит от природы денатурирующего реагента: кислоты и щелочи образуют водородные связи с пептидными группами, органические растворители образуют водородные связи и вызывают дегидратацию, алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. ,

Высаливание n n n Высаливание – это добавление к раствору белка нейтральных солей (Na 2 SO 4, (NH 4)2 SO 4). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Например, подобным образом раньше определяли соотношение альбумины/глобулины в плазме крови

Классификация белков по функции n n n n структурные белки (коллаген, кератин), ферментативные (пепсин, амилаза), транспортные (трансферрин, альбумин, гемоглобин), пищевые (белки яйца, злаков), сократительные и двигательные (актин, миозин, тубулин), защитные (иммуноглобулины, тромбин, фибриноген), регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).

Классификация белков по строению n n n В глобулярные белки характеризуются компактной трехмерной укладкой полипептидных цепей (инсулин, альбумин, глобулины плазмы крови). Фибриллярные белки состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген.

По химическому составу n n n белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты (нуклеопротеины, фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины).

Альбумины n n Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 к. Да, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических р. Н. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот.

Глобулины n n n Группа разнообразных белков плазмы крови с молекулярной массой до 100 к. Да, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая). Часто содержат углеводные компоненты.
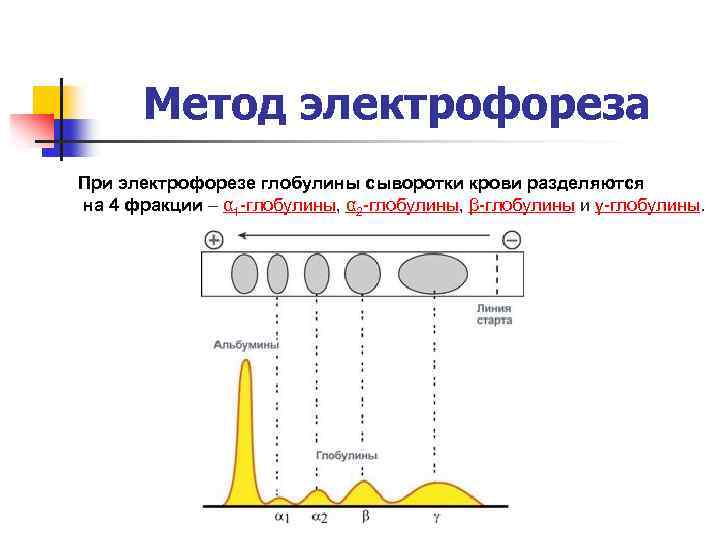
Метод электрофореза При электрофорезе глобулины сыворотки крови разделяются на 4 фракции – α 1 -глобулины, α 2 -глобулины, β-глобулины и γ-глобулины.

Функции глобулинов n n Так как глобулины включают в себя разнообразные белки, то их функции многочисленны. Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения, например, α 1 антитрипсин, α 1 -антихимотрипсин, α 2 макроглобулин. Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносит ионы железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина), γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.

Гистоны n n Гистоны – внутриядерные белки массой около 24 к. Да. Обладают выраженными основными свойствами, поэтому при физиологических значениях р. Н заряжены положительно и связываются с дезоксирибонуклеиновой кислотой (ДНК), образуя дезоксирибонуклеопротеины.
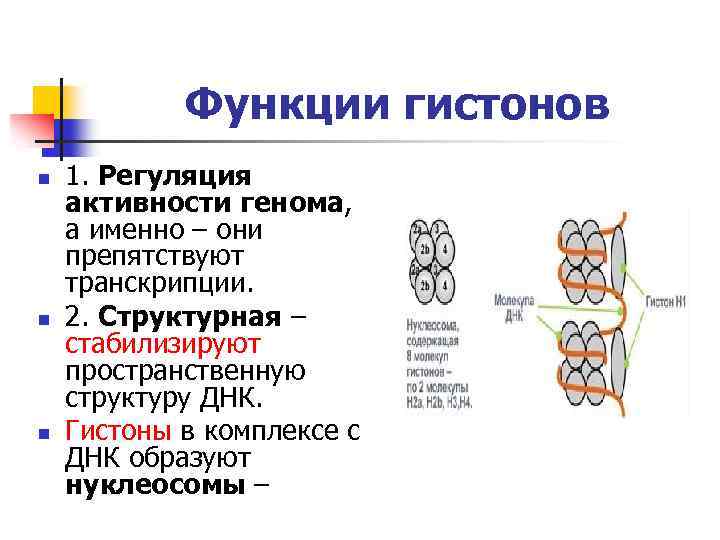
Функции гистонов n n n 1. Регуляция активности генома, а именно – они препятствуют транскрипции. 2. Структурная – стабилизируют пространственную структуру ДНК. Гистоны в комплексе с ДНК образуют нуклеосомы –

Протамины n n Это белки массой от 4 к. Да до 12 к. Да, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная.

Коллаген n n n Фибриллярный белок, составляет основу межклеточного вещества его много в соединительной ткани сухожилий, кости, хряща, кожи Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [Гли-А-В], где А и В – любые, кроме глицина, аминокислоты. В основном это аланин, его доля составляет 11% и пролин – 21%.

Эластин n n По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 к. Да и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина.

У сложных белков есть лиганды (дополнительная небелковая группа ) n n В роли лиганда могут выступать любые молекулы: молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах переносимые белками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине

Функции лиганда n n n изменяет свойства белков (заряд, растворимость, термолабильность), например, фосфорная кислота в фосфопротеинах или остатки моносахаридов в гликопротеинах, защищает белок от протеолиза вне и внутри клетки, например углеводная часть в гликопротеинах, в виде лиганда обеспечивается транспорт нерастворимых в воде соединений, например, перенос жиров липопротеинами, придает биологическую активность и определяет функцию белка, например, нуклеиновая кислота в нуклеопротеинах, гем в гемоглобине, углевод в рецепторных белках, влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков.

Нуклеопротеины n n Это белки, связанные с нуклеиновыми кислотами. Они составляют существенную часть рибосом, хроматина, вирусов. В рибосомах (РНК) связывается со специфическими рибосомальными белками. В хроматине ДНК связываются гистоны и негистоновые белки.

Отличия между РНК и ДНК: n n n количество цепей: в РНК одна цепь, в ДНК две цепи, размеры: ДНК намного крупнее, локализация в клетке: ДНК находится в ядре, почти все РНК – вне ядра, вид моносахарида: в ДНК – дезоксирибоза, в РНК – рибоза, азотистые основания: в ДНК имеется тимин, в РНК – урацил. функция: ДНК отвечает за хранение наследственной информации, РНК – за ее реализацию.

Фосфопротеины n n Фосфопротеины – это белки (чаще ферменты), в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т. е. тех аминокислот, которые содержат ОН-группу. Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. Функциональная - повышают функциональную активность белка-фермента

Металлопротеины n n n n Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеины. медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ, железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов кальций – α-амилаза, селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы,

Липопротеины n n имеют огромное клиническое значение белки, содержащие ковалентно связанные с липидами Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. Функцией липопротеинов является перенос в крови триацилглицеролов и холестерола и его эфиров.

Выделяют четыре основных класса липопротеинов n n n липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности (ЛПОНП), хиломикроны (ХМ). Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз.

Типы липопротеинов По направлению сверху вниз происходят изменения состава Хиломикроны (до 90% липидов) ЛПОНП ЛПВП (до 80% белков) Увеличение количества белка Увеличение количества фосфолипидов Уменьшение количества триацилглицеролов

Гликопротеинов n n n Класс под названием гликопротеины или, более корректно, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе. n Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия

Отличия протеогликанов и гликопротеинов Гликопротеины Протеогликаны доля углеводов 15 -20%, не содержат уроновых кислот, углеводные цепи содержат не более 15 звеньев, углевод имеет нерегулярное строение. доля углеводов 80 -85%, имеются уроновые кислоты, углеводные цепи крайне велики, углевод имеет регулярное строение.
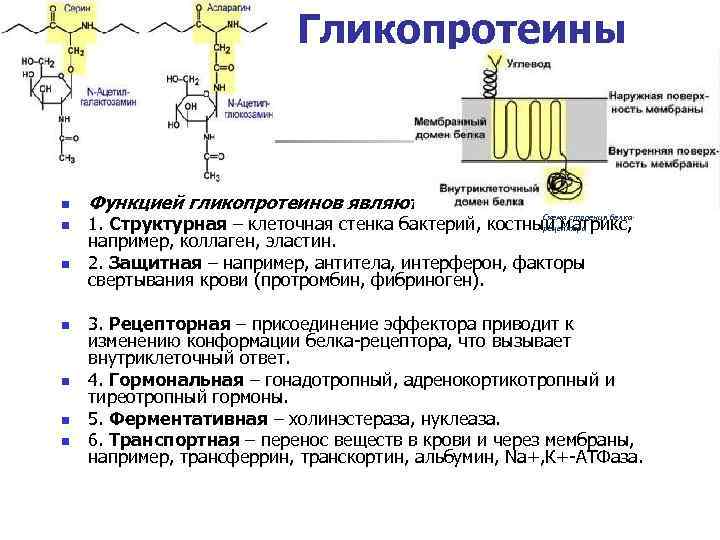
Гликопротеины n n n n Функцией гликопротеинов являются: Схема строения белка- 1. Структурная – клеточная стенка бактерий, костный матрикс, рецептора например, коллаген, эластин. 2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+, К+-АТФаза.

Протеогликаны n n Другая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков. Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны
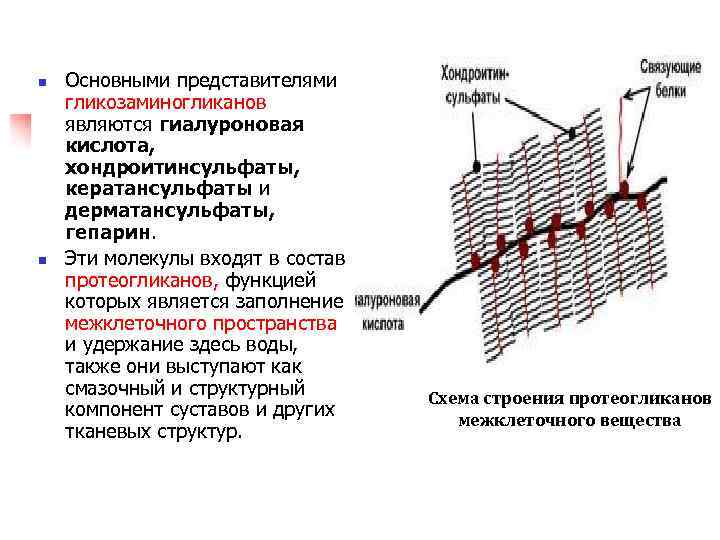
n n Основными представителями гликозаминогликанов являются гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты, гепарин. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур. Схема строения протеогликанов межклеточного вещества

Хромопротеины n n n Хромопротеины содержат окрашенные простетические группы. К этим белкам относят гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В 2), кобамидпротеины (содержат витамин В 12).
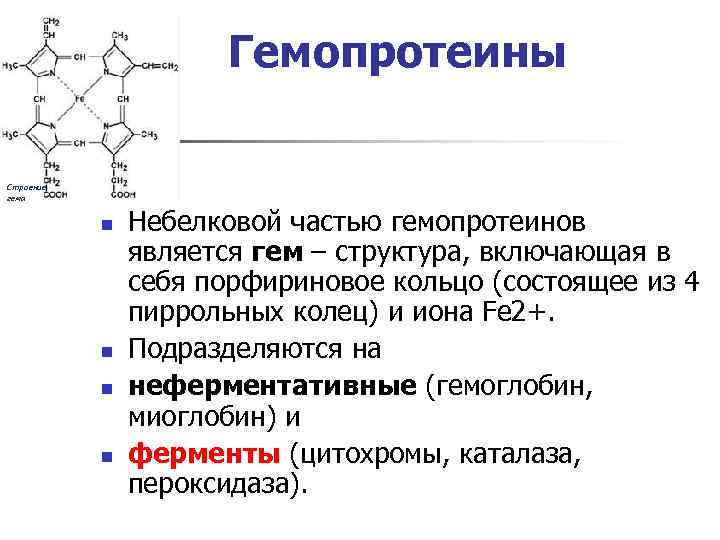
Гемопротеины Строение гема n n Небелковой частью гемопротеинов является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe 2+. Подразделяются на неферментативные (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза).

Цитохромы n n n Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они не способны связывать кислород, кроме цитохрома а 3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления.

Флавопротеины n n n Являются ферментами окислительновосстановительных реакций, содержат производные витамина В 2 флавинмононуклеотид (ФМН) флавинадениндинуклеотид (ФАД).

Количество белка в пище необходимо просчитывать n n n Во всех клетках организма постоянно идут процессы анаболизма и катаболизма. Также как и любые другие молекулы, белковые молекулы в организме непрерывно распадаются и синтезируются, т. е. идет процесс самообновления белков. В здоровом организме мужчины массой 70 кг величина скорости распада соответствует скорости синтеза и равна 500 г белка в сутки.

Азотистый баланс n n n Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие, или, по другому, это состояние, когда количество выводимого азота равно количеству получаемого (Vпоступ= Vвывод). положительный азотистый баланс. наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, спортсменов при наборе формы, т. е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках. отрицательный азотистый баланс отмечается у больных и голодающих.

БЕЛКИ Качество белка определяется наличием в нем полного набора незаменимых аминокислот. 1 г белка при окислении в организме дает 4 ккал. Физиологическая потребность в белке для взрослого населения 65 – до 117 г/сутки для мужчин и 58 – до 87 г/сутки для женщин. Физиологические потребности в белке для детей до 1 года 2, 2 – 2, 9 г/кг массы тела, дети старше 1 года от 36 – до 87 г/сутки.

Идеальный белок? n n Существует понятие оптимального по всем параметрам идеального белка, к нему наиболее близок белок куриного яйца. Растительные белки считаются неполноценными, так как в их составе мало незаменимых аминокислот и доля тех или иных аминокислот в растительном белке резко отличается от таковой животного белка.

Белок животного происхождения Источниками полноценного белка являются продуктами животного происхождения (молоко – молочные продукты, яйца, мясо и мясопродукты, рыба и море продукты). Белки животного происхождения усваиваются организмом на 93 – 96 %. Потребность для взрослого человека в суточном рационе БЖП – 50%. Для детей – 60%.

Белок растительного происхождения В белках растительного происхождения (злаковые, овощи, фрукты) имеется дефицит незаменимых аминокислот. В составе бобовых содержатся ингибиторы протэиназ, что снижает усвоение белка из них. Белок из продуктов растительного происхождения усваивается организмом на 62 -80%. Белок из высших грибов усваивается на уровне 2040%.

Критерии качества белка n n n соотношение заменимых и незаменимых аминокислот – в белке должно быть не менее 32% незаменимых аминокислот, близость аминокислотного состава белка к аминокислотному составу усредненного белка тела человека, легкость переваривания в ЖКТ.

Дефицит белка n n У детей при недостатке белка в пище задерживается рост, отстает физическое и умственное развитие, изменяется состав костной ткани, снижается активность иммунной системы и сопротивляемость к заболеваниям, тормозится деятельность эндокринных желез. Выраженным нарушением потребления белков является квашиоркор – нехватка белков, особенно животных, в пище. В результате возникает дисбаланс аминокислотного состава пищи и недостаток незаменимых аминокислот. У больных наблюдается истощение, остановка роста, отечность, анемия, нарушение интеллекта и памяти, умственная отсталость, гипопротеинемия и аминоацидурия

Переваривание белков начинается в желудке n n n Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры. . В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом р. Н, которые упрощенно называют пепсин и гастриксин.
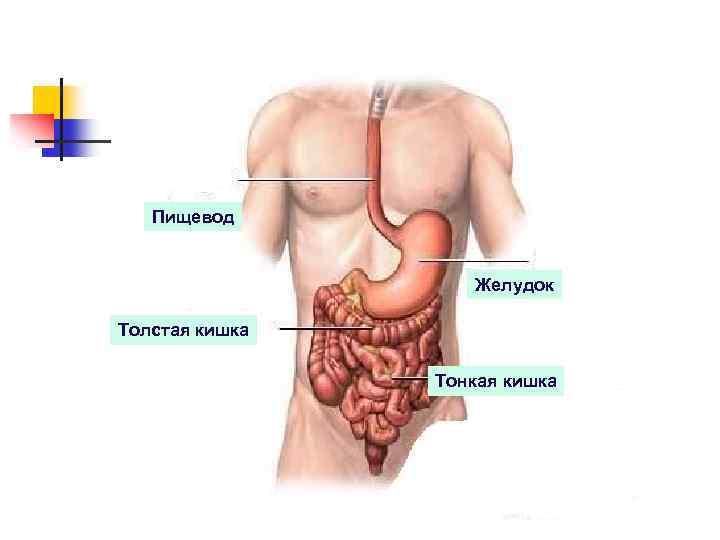
Пищевод Желудок Толстая кишка Тонкая кишка
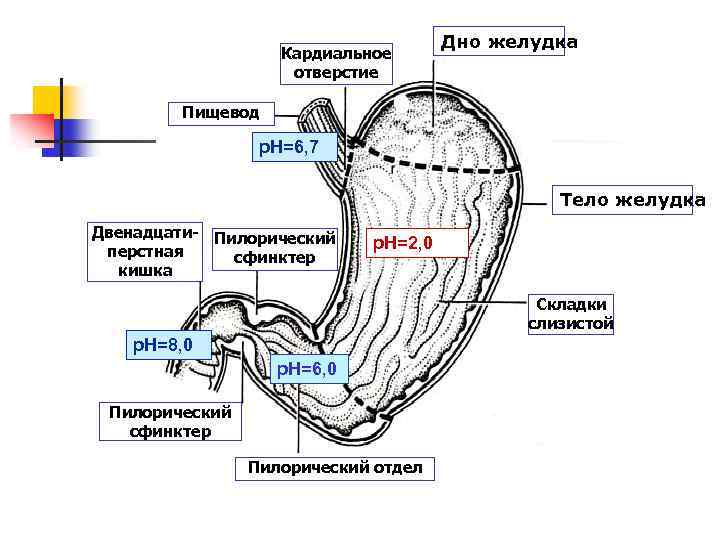
Кардиальное отверстие Дно желудка Пищевод p. H=6, 7 Тело желудка Двенадцати- Пилорический перстная сфинктер кишка p. H=2, 0 Складки слизистой p. H=8, 0 р. Н=6, 0 Пилорический сфинктер Пилорический отдел

Регуляция желудочного пищеварения n n Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он обеспечивает секрецию гистамина.

Гастрин n n Гастрин выделяется специфичными Gклетками: в ответ на раздражение механорецепторов, в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков), под влиянием n. vagus.

n n Гистамин, образующийся фундальными железам слизистой оболочки желудка, взаимодействует с Н 2 -рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты. Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока.
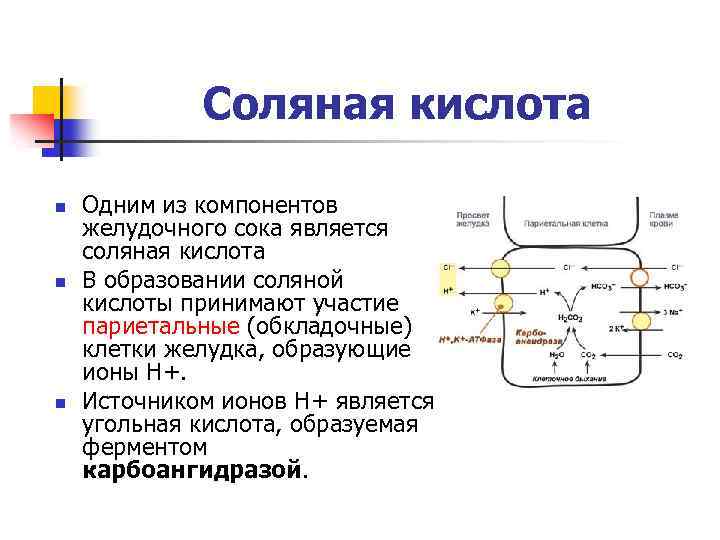
Соляная кислота n n n Одним из компонентов желудочного сока является соляная кислота В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой.
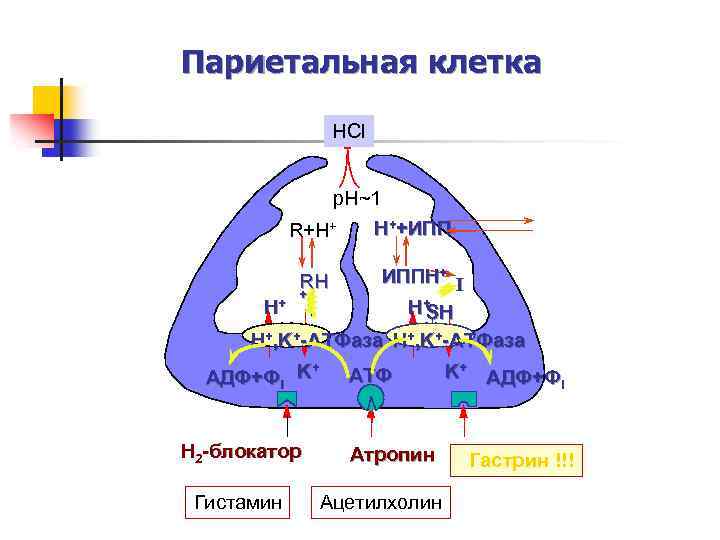
Париетальная клетка HCl p. H~1 H++ИПП R+H+ ИППH+ I + + H H+ SH H+, K+-ATФaза RH + AДФ+Фi K H 2 -блокатор Гистамин ATФ Атропин Ацетилхолин K+ AДФ+Ф i Гастрин !!!

Функции соляной кислоты n n n денатурация белков пищи, бактерицидное действие, высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания, превращение неактивного пепсиногена в активный пепсин, снижение р. Н желудочного содержимого до 1, 5 -2, 5 и создание оптимума р. Н для работы пепсина, после перехода в 12 -перстную кишку – стимуляция секреции панкреатического сока.

Пепсин n n Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (Nконцевой фрагмент), т. е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.

Пепсин n n Оптимум р. Н для пепсина 1, 5 -2, 0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т. д. .

Гастриксин n n n Его оптимум р. Н соответствует 3, 2 -3, 5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.

Переваривание белков n n Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи. Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются (ограниченный протеолиз) до трипсина, химотрипсина, карбоксипептидаз и эластазы. Указанные ферменты осуществляют основную работу по перевариванию белков.
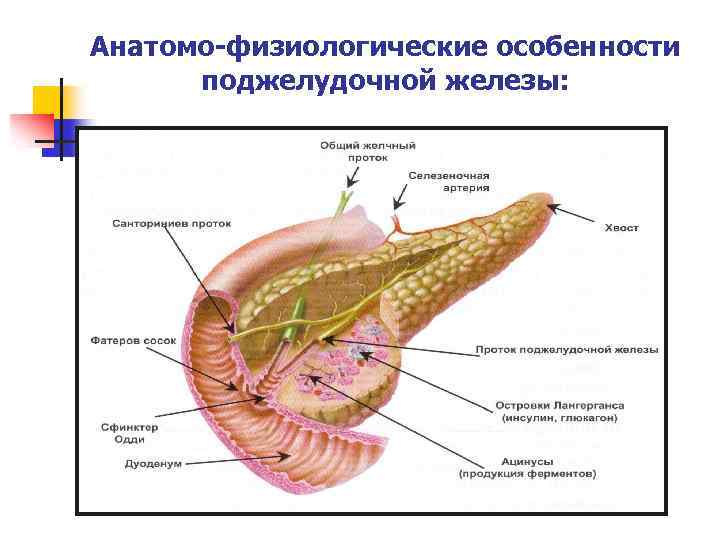
Анатомо-физиологические особенности поджелудочной железы:
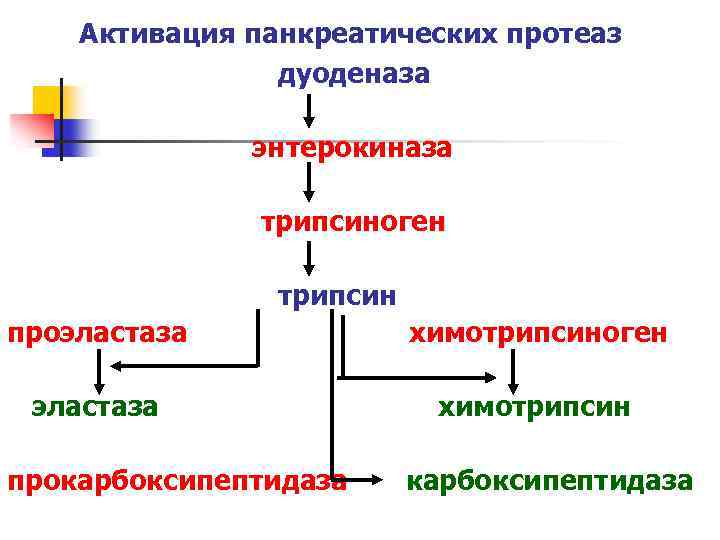
Активация панкреатических протеаз дуоденаза энтерокиназа трипсиноген трипсин проэластаза химотрипсиноген эластаза химотрипсин прокарбоксипептидаза

Ферменты поджелудочной железы Амилаза, рибонуклеаза, дезоксирибонуклеаза - ферменты, синтезируемые сразу в активной форме. Липолитические ферменты (панкреати ческая липаза, фосфолипазы) активируются в просвете ДПК желчными кислотами, поступающими туда с желчью. Кроме того, желчные кислоты предварительно эмульгируют жиры, облегчая воздействие на них липаз.

Оптимум действия панкреатических ферментов n Амилаза – p. H=6, 7 -7, 0 n Липаза – p. H=7, 0 -8, 6 n Трипсин – p. H=5 -7

Регуляция кишечного пищеварения n n В кишечнике под влиянием соляной кислоты, поступающей из желудка в составе пищевого комка, начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонатионами (HCO 3–). В результате р. Н химуса повышается до 7, 07, 5.

Гуморальная стимуляция экзокринной функции поджелудочной железы Осуществляется гастроинтестинальными гормонами: секретин стимулирует продукцию жидкой чассекретин ти секрета, прежде всего, бикарбонатов, холецистокинин (панкреозимин) – ферментов. Секреция секретина и панкреозимина, в свою очередь, стимулируется рилизинг-пептидами, продуцируемыми в ДПК: для секретина - при снижение p. H, для секретина для панкреозимина - при наличии в просвете кишки непереваренных пептидов.

n n Благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина-панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи. Нейтрализация кислого химуса в двенадцатиперстной кишке происходит также при участии желчи. Формирование желчи (холерез) идет непрерывно, не прекращаясь даже при голодании.

Эластаза n n Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.

Карбоксипептидазы являются экзопептидазами, т. е. гидролизуют пептидные связи с С-конца пептидной цепи. n Аминопептидазы Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. n n

Дипептидазы n n n Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов. Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами. При заболеваниях ЖКТ и нарушении переваривания, при диете с избытком белков часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами – развивается гниение белков в кишечнике.

Проблемы ЖКТ влияют на весь организм n Уменьшение переваривания белков из-за низкой протеолитической активности в желудке (пониженная кислотность) или в кишечнике (хронические панкреатиты), нарушение целостности стенки кишечного тракта вследствие гельминтозов или неполной нейтрализации соляной кислоты (гиперацидный гастрит, нарушение желчевыделения) приводит к последствиям, которые отражаются на деятельности всего организма.

Пищевые аллергии n n n В раннем постнатальном периоде (у новорожденных и до 2 -3 месяцев) проницаемость стенки кишечника у детей даже в норме повышена. Такая особенность обеспечивает проникновение антител молозива и материнского молока в кровь ребенка и создает младенцу пассивный иммунитет. Молозиво также содержит ингибитор трипсина, предохраняющий иммуноглобулины от быстрого гидролиза.

При патологии n n Однако при наличии неблагоприятных обстоятельств (гиповитаминозы, индивидуальные особенности, неправильное питание) проницаемость кишечной стенки возрастает и создается повышенный поток в кровь младенца пептидов коровьего молока, яиц и других веществ – развивается пищевая аллергия. Аналогичная ситуация может наблюдаться у старших детей и взрослых при нарушениях желчевыделения, при гельминтозах, дисбактериозах, поражении слизистой оболочки кишечника токсинами и т. п.

Превращение аминокислот в толстом кишечнике В некоторых ситуациях, а именно: при ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез, при снижении перистальтики кишечника (запоры) аминокислоты и недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. n n n

Гниение белков в кишечнике n n При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород, метилмеркаптан (СН 3 SН) и другие), так и нейромедиаторы (серотонин, гистамин, октопамин, тирамин). Всасываясь в кровь, эти вещества вызывают общую интоксикацию, колебания артериального давления, головные боли, понижение аппетита, понижение болевой чувствительности, анемии, в тяжелых случаях возможны угнетение дыхания, сердечной деятельности и кома.

Целиакия n n Целиакия – наследственное прогрессирующее заболевание, приводящее к изменениям в тощей кишке: воспалению и сглаживанию слизистой оболочки, исчезновению ворсинок и атрофии щеточной каемки, к появлению кубовидных энтероцитов. Причиной является врожденная непереносимость белка клейковины злаков глютена, или точнее – его растворимой фракции глиадина.

Целиакия n n Заболевание проявляется после введения в рацион младенца глиадинсодержащих продуктов, в первую очередь манной каши. Патогенез заболевания до сих пор не выяснен, имеются гипотеза о прямом токсическом воздействии на стенку кишечника и гипотеза иммунного ответа на белок в стенке кишки

Теории патогенеза целиакии n Вирусная n Дипептидазная n Рецепторная n Иммунологическая

Дипептидазная теория Генетически детерминированный дефект дипептидаз в щеточной кайме энтероцита → нарушение отщепления от молекулы глиадина аминокислоты пролина → повреждение слизистой тонкой кишки За: установлен фрагмент А-глиадина с определенной последовательностью аминокислот, вызывающий в слизистой тонкой кишки больных целиакией характерные изменения

Рецепторная теория Генетически детерминированные особенности рецепторного аппарата эпителиоцитов → аномальное связывание глиадина → повреждение энтероцитов Генетически детерминированные аномалии рецепторов на поверхности макрофагов, Тлимфоцитов → взаимодействие с глютеном → иммунологические реакции → повреждение эпителиоцитов

Морфологические визуальные признаки целиакии 1 2 3 тонкий кишечник: 1. нормальная слизистая 2. активный период целиакии: гиперрегенераторная атрофия слизистой, углубление крипт 3. субатрофия слизистой 4. период ремиссии целиакии: восстановление слизистой 4
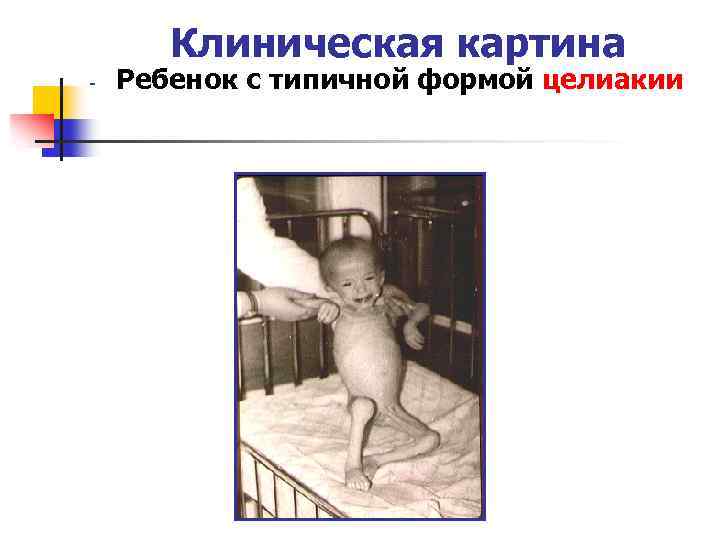
Клиническая картина - Ребенок с типичной формой целиакии

Безглютеновые продукты

10 октября n n Лабораторное занятие Денатурация белка