bc84252aaf6cb7accf63664712ec1978.ppt
- Количество слайдов: 26
 Закономерности химических реакций 1. Принципы классификации химических реакций Пора чудес прошла, и нам Подыскивать приходится причины Всему, что совершается на свете. Вильям Шекспир
Закономерности химических реакций 1. Принципы классификации химических реакций Пора чудес прошла, и нам Подыскивать приходится причины Всему, что совершается на свете. Вильям Шекспир

 2. Скорость химических реакций Мощь и сила науки – во множестве фактов; цель – в обобщении этого множества. Д. И. Менделеев
2. Скорость химических реакций Мощь и сила науки – во множестве фактов; цель – в обобщении этого множества. Д. И. Менделеев

 Zn + 2 HCl = Zn. Cl 2 + H 2↑ Как определить практически скорость данной химической реакции?
Zn + 2 HCl = Zn. Cl 2 + H 2↑ Как определить практически скорость данной химической реакции?
 Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции
 концентрация реагирующих веществ: чем больше концентрация реагирующих веществ, тем больше скорость химической реакции Закон действующих масс (Н. И. Бекетов) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ 2 А + 3 В = 2 С v = k·CА 2·СВ 3 , k – константа скорости
концентрация реагирующих веществ: чем больше концентрация реагирующих веществ, тем больше скорость химической реакции Закон действующих масс (Н. И. Бекетов) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ 2 А + 3 В = 2 С v = k·CА 2·СВ 3 , k – константа скорости
 Горение фосфора на воздухе
Горение фосфора на воздухе
 Горение фосфора в чистом кислороде
Горение фосфора в чистом кислороде

 Скорость реакции зависит от концентрации жидких и газообразных веществ
Скорость реакции зависит от концентрации жидких и газообразных веществ
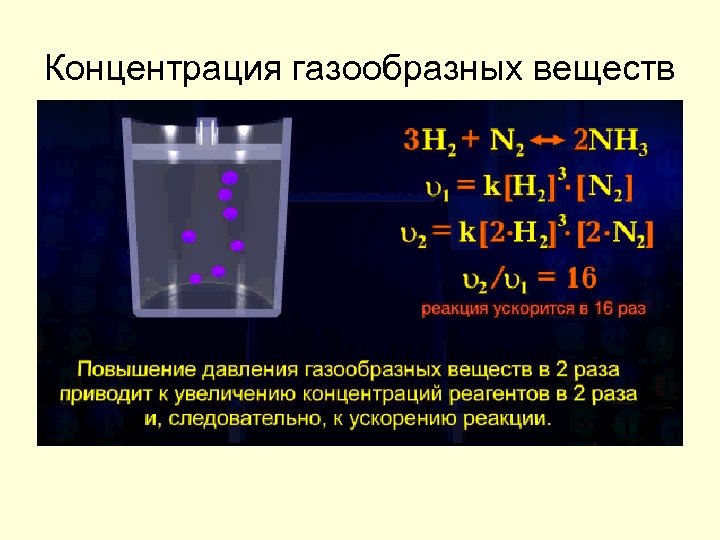 Концентрация газообразных веществ
Концентрация газообразных веществ
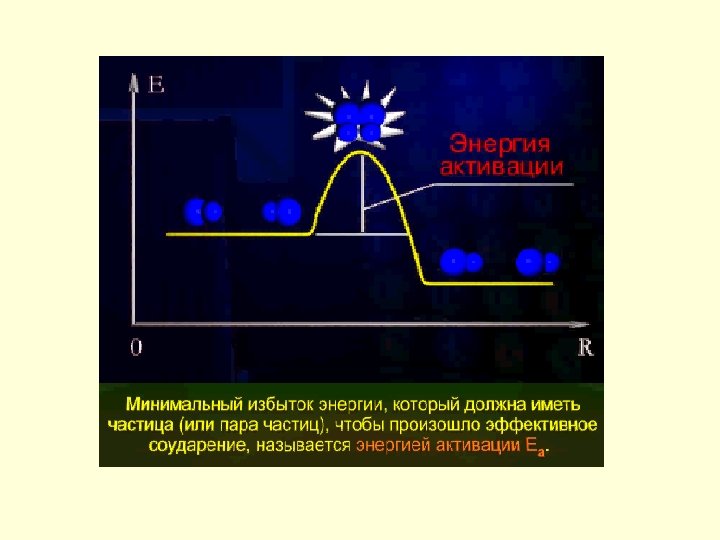
 • температура Чем выше температура, тем больше кинетическая энергия частиц, следовательно, больше вероятность их взаимодействия Правило Вант-Гоффа (голландский химик): При повышении температуры на каждые 10 С скорость реакции возрастает в 2 -4 раза
• температура Чем выше температура, тем больше кинетическая энергия частиц, следовательно, больше вероятность их взаимодействия Правило Вант-Гоффа (голландский химик): При повышении температуры на каждые 10 С скорость реакции возрастает в 2 -4 раза

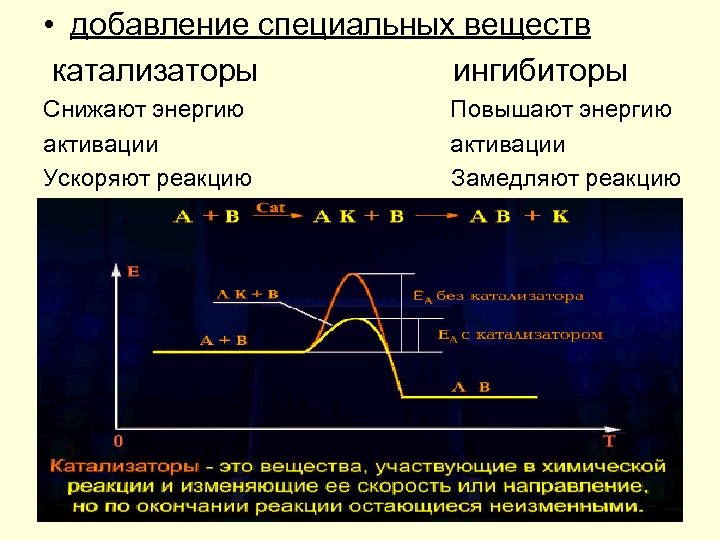 • добавление специальных веществ катализаторы ингибиторы Снижают энергию активации Ускоряют реакцию Повышают энергию активации Замедляют реакцию
• добавление специальных веществ катализаторы ингибиторы Снижают энергию активации Ускоряют реакцию Повышают энергию активации Замедляют реакцию


 • природа реагирующих веществ Zn + 2 HCl = Zn. Cl 2 + H 2↑ Pb + 2 HCl = Pb. Cl 2 + H 2↑ Первая реакция протекает быстрее, т. к. цинк более активный металл и легче окисляется, чем свинец
• природа реагирующих веществ Zn + 2 HCl = Zn. Cl 2 + H 2↑ Pb + 2 HCl = Pb. Cl 2 + H 2↑ Первая реакция протекает быстрее, т. к. цинк более активный металл и легче окисляется, чем свинец

 • площадь соприкосновения веществ: Чем меньше размер поверхности твердых частиц, тем больше площадь соприкосновения реагирующих веществ, тем больше скорость реакции Увеличение площади поверхности соприкосновения достигается: - измельчением веществ; - растворением веществ; - подачей веществ противотоком.
• площадь соприкосновения веществ: Чем меньше размер поверхности твердых частиц, тем больше площадь соприкосновения реагирующих веществ, тем больше скорость реакции Увеличение площади поверхности соприкосновения достигается: - измельчением веществ; - растворением веществ; - подачей веществ противотоком.

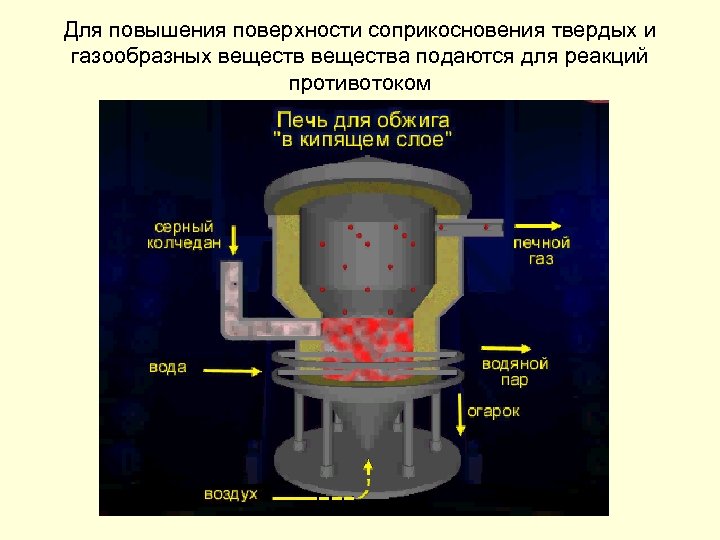 Для повышения поверхности соприкосновения твердых и газообразных вещества подаются для реакций противотоком
Для повышения поверхности соприкосновения твердых и газообразных вещества подаются для реакций противотоком
 Скорость химических реакций в гомогенной среде определяется изменением концентрации реагирующих веществ в единицу времени: С 1 – начальная концентрация; С 2 - конечная концентрация; t 2 – конечное время; t 1 -начальное время. • Скорость химических реакций в гетерогенной среде определяется изменением химического количества вещества в единицу времени, происходящим на поверхности твердого вещества: n 1 – начальное химическое количество; n 2 - конечное химическое количество ; t 2 –начальное время; t 1 - конечное время; S – площадь поверхности твердого вещества
Скорость химических реакций в гомогенной среде определяется изменением концентрации реагирующих веществ в единицу времени: С 1 – начальная концентрация; С 2 - конечная концентрация; t 2 – конечное время; t 1 -начальное время. • Скорость химических реакций в гетерогенной среде определяется изменением химического количества вещества в единицу времени, происходящим на поверхности твердого вещества: n 1 – начальное химическое количество; n 2 - конечное химическое количество ; t 2 –начальное время; t 1 - конечное время; S – площадь поверхности твердого вещества
 Домашнее задание • Изучить параграф 21 • Выполнить упражнения 6 -10 на стр. 139 • Опорный конспект темы и задачи для самоконтроля Рабочий стол. Папка «Химия» . Сайт гимназии: http: //gim 1. grodno. unibel. by Кафедра естественно- математических наук. Кабинет химии.
Домашнее задание • Изучить параграф 21 • Выполнить упражнения 6 -10 на стр. 139 • Опорный конспект темы и задачи для самоконтроля Рабочий стол. Папка «Химия» . Сайт гимназии: http: //gim 1. grodno. unibel. by Кафедра естественно- математических наук. Кабинет химии.
 • Задачи для самоконтроля 1. В растворе протекает реакция А + В = С. Определите скорость химической реакции в тот момент, когда в растворе объемом 0, 2 л содержалось 0, 1 моль а и 0, 2 моль В. Константа скорости реакции равна 10 л/моль с. Ответ: 5 моль/л с. В растворе протекает реакция А + В = С. Во сколько раз возрастет скорость реакции, если концентрацию А увеличить в 2 раза, а концентрацию В – в 1, 5 раза? Ответ: в 3 раза. Во сколько раз возрастет скорость реакции между газообразными веществами 2 А + 3 В = С, если увеличить давление в 3 раза? Ответ: в 243 раза Рассчитайте температурный коэффициент скорости реакции (во сколько раз возрастет скорость реакции при увеличении температуры на 10 С), если известно, что при 80 С скорость реакции равна 2 моль/л с, а при 110 C – 54 моль/л с. Ответ: 3. Скорость химической реакции при 40 С равна 2 моль/л с. Рассчитайте скорость химической реакции при 80 С, если известно, что при увеличении температуры на 10 С скорость реакции возрастет в 2 раза (температурный коэффициент скорости реакции равен 2). Ответ: 32 моль/л с. 2. 3. 4. 5.
• Задачи для самоконтроля 1. В растворе протекает реакция А + В = С. Определите скорость химической реакции в тот момент, когда в растворе объемом 0, 2 л содержалось 0, 1 моль а и 0, 2 моль В. Константа скорости реакции равна 10 л/моль с. Ответ: 5 моль/л с. В растворе протекает реакция А + В = С. Во сколько раз возрастет скорость реакции, если концентрацию А увеличить в 2 раза, а концентрацию В – в 1, 5 раза? Ответ: в 3 раза. Во сколько раз возрастет скорость реакции между газообразными веществами 2 А + 3 В = С, если увеличить давление в 3 раза? Ответ: в 243 раза Рассчитайте температурный коэффициент скорости реакции (во сколько раз возрастет скорость реакции при увеличении температуры на 10 С), если известно, что при 80 С скорость реакции равна 2 моль/л с, а при 110 C – 54 моль/л с. Ответ: 3. Скорость химической реакции при 40 С равна 2 моль/л с. Рассчитайте скорость химической реакции при 80 С, если известно, что при увеличении температуры на 10 С скорость реакции возрастет в 2 раза (температурный коэффициент скорости реакции равен 2). Ответ: 32 моль/л с. 2. 3. 4. 5.


