 Загадки На огне котёл стоит, А в котле вода кипит. Жидкость стала убывать. Что же стало прибывать? Есть невидимка: В дом не просится, А прежде людей бежит.
Загадки На огне котёл стоит, А в котле вода кипит. Жидкость стала убывать. Что же стало прибывать? Есть невидимка: В дом не просится, А прежде людей бежит.
 Газообразное состояние вещества
Газообразное состояние вещества
 Газообразное состояние вещества Цель урока: систематизировать сведения о газообразном состоянии вещества.
Газообразное состояние вещества Цель урока: систематизировать сведения о газообразном состоянии вещества.
 Задачи урока: Рассмотреть особенности газообразных веществ. Выделить важнейшие природные смеси газов. Обозначить основные экологические проблемы атмосферы. Систематизировать знания об изученных газах.
Задачи урока: Рассмотреть особенности газообразных веществ. Выделить важнейшие природные смеси газов. Обозначить основные экологические проблемы атмосферы. Систематизировать знания об изученных газах.
 Чем характеризуется газообразное состояние вещества?
Чем характеризуется газообразное состояние вещества?
 Особенности газообразного состояния вещества: Расстояния между частицами Большое Взаимодействие частиц Слабое Движение частиц Хаотичное Быстрое Упорядоченность структуры Отсутствует Наличие формы Не имеют собственной формы и объёма Свойства Легко сжимаются Сжижаются под давлением Смешиваются друг с другом в любых соотношениях
Особенности газообразного состояния вещества: Расстояния между частицами Большое Взаимодействие частиц Слабое Движение частиц Хаотичное Быстрое Упорядоченность структуры Отсутствует Наличие формы Не имеют собственной формы и объёма Свойства Легко сжимаются Сжижаются под давлением Смешиваются друг с другом в любых соотношениях
 Закон А. Авогадро В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. § NA=6, 02∙ 1023 моль-1(постоянная Авогадро) §
Закон А. Авогадро В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. § NA=6, 02∙ 1023 моль-1(постоянная Авогадро) §
 Следствие из закона Авогадро: 1 моль любого газа при н. у. (760 мм рт. ст. и 00 C) занимает объём 22, 4 л. Vm = 22, 4 л/моль – молярный объём газов
Следствие из закона Авогадро: 1 моль любого газа при н. у. (760 мм рт. ст. и 00 C) занимает объём 22, 4 л. Vm = 22, 4 л/моль – молярный объём газов
 Решите задачи Сколько молекул содержится в 11, 2 л аммиака? Какой объём займут 8 г кислорода?
Решите задачи Сколько молекул содержится в 11, 2 л аммиака? Какой объём займут 8 г кислорода?
 Проверка решения № 1 n(NH 3)=11, 2 л : 22, 4 л/моль =0, 5 моль n=V: Vm N= n∙ NA N(NH 3)=0, 5 моль ∙ 6, 02∙ 1023 моль-1=3, 01∙ 1023 № 2 n=m: M V=n∙Vm N(O 2)=8 г : 32 г/моль = 0, 25 моль V(O 2)=0, 25 моль ∙ 22, 4 л/моль =5, 6 л
Проверка решения № 1 n(NH 3)=11, 2 л : 22, 4 л/моль =0, 5 моль n=V: Vm N= n∙ NA N(NH 3)=0, 5 моль ∙ 6, 02∙ 1023 моль-1=3, 01∙ 1023 № 2 n=m: M V=n∙Vm N(O 2)=8 г : 32 г/моль = 0, 25 моль V(O 2)=0, 25 моль ∙ 22, 4 л/моль =5, 6 л
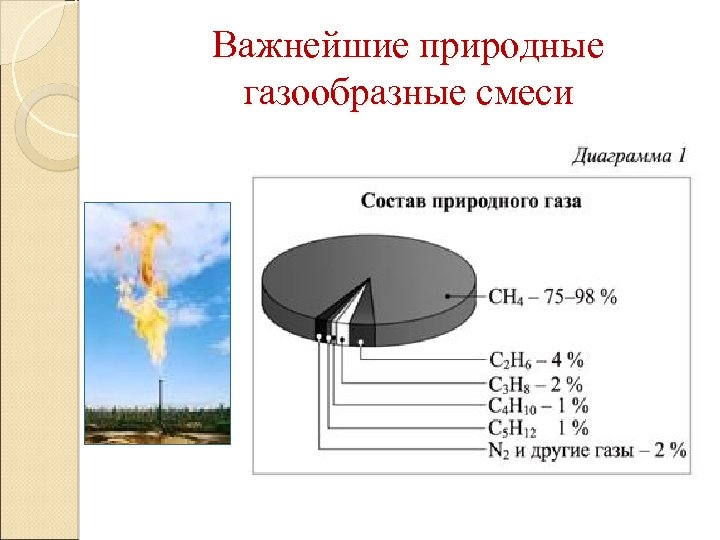 Важнейшие природные газообразные смеси
Важнейшие природные газообразные смеси
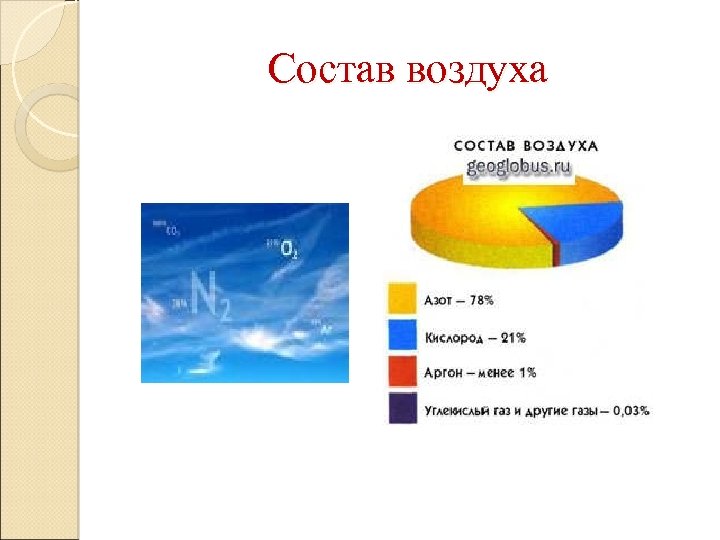 Состав воздуха
Состав воздуха
 Какие вещества непосредственно участвуют в газообмене? газы Вдыхаемый Выдыхаемый воздух Азот 79, 03% Кислород 20, 94% Углекислый 0, 03% газ 79, 7% 16, 3% 4%
Какие вещества непосредственно участвуют в газообмене? газы Вдыхаемый Выдыхаемый воздух Азот 79, 03% Кислород 20, 94% Углекислый 0, 03% газ 79, 7% 16, 3% 4%
 Глобальные экологические проблемы атмосферы Парниковый эффект Озоновые дыры Кислотные дожди
Глобальные экологические проблемы атмосферы Парниковый эффект Озоновые дыры Кислотные дожди
 Для газов, формулы которых H 2, O 2, CO 2, NH 3, C 2 H 4, а Определите, каким прибором можно получить каждый из газов: б в Определите, как распознать каждый газ: 1) тлеющей лучинкой 2) горящей лучинкой 3) по запаху 4) влажной индикаторной бумагой 5) пропусканием через бромную воду 6) палочкой, смоченной соляной кислотой 7) известковой водой 8) поджиганием небольшого количества газа
Для газов, формулы которых H 2, O 2, CO 2, NH 3, C 2 H 4, а Определите, каким прибором можно получить каждый из газов: б в Определите, как распознать каждый газ: 1) тлеющей лучинкой 2) горящей лучинкой 3) по запаху 4) влажной индикаторной бумагой 5) пропусканием через бромную воду 6) палочкой, смоченной соляной кислотой 7) известковой водой 8) поджиганием небольшого количества газа
 Лабораторные способы получения газов + 2 HCl = H 2↑ + Zn. Cl 2 t 2 KMn. O 4= O 2 ↑ + Mn. O 2+ K 2 Mn. O 4 2 NH 4 Cl + Ca(OH)2 = 2 NH 3↑+ Ca Cl 2 + 2 H 2 O Ca. CO 3 + 2 HCl= CO 2↑ + Ca. Cl 2 + H 2 O H SO C 2 H 5 OH → C 2 H 4 + H 2 O Zn o 2 4
Лабораторные способы получения газов + 2 HCl = H 2↑ + Zn. Cl 2 t 2 KMn. O 4= O 2 ↑ + Mn. O 2+ K 2 Mn. O 4 2 NH 4 Cl + Ca(OH)2 = 2 NH 3↑+ Ca Cl 2 + 2 H 2 O Ca. CO 3 + 2 HCl= CO 2↑ + Ca. Cl 2 + H 2 O H SO C 2 H 5 OH → C 2 H 4 + H 2 O Zn o 2 4
 Ответьте на вопросы: Ø Чем характеризуется газообразное состояние вещества? Ø В чём смысл закона Авогадро? Ø Почему природный газ не является веществом? Ø Что обозначено символами: NA , N, n, Vm ?
Ответьте на вопросы: Ø Чем характеризуется газообразное состояние вещества? Ø В чём смысл закона Авогадро? Ø Почему природный газ не является веществом? Ø Что обозначено символами: NA , N, n, Vm ?
 Домашнее задание § 8, № 3, 4 с. 79 Изучить конспект по теме. Вычислите объём кислорода, который можно получить из 450 м 3 воздуха.
Домашнее задание § 8, № 3, 4 с. 79 Изучить конспект по теме. Вычислите объём кислорода, который можно получить из 450 м 3 воздуха.