777.ppt
- Количество слайдов: 12

Южная Казахстанская Фармацевтическая Академия Министерство Здравохранение Республики Казахстана Технология лекарственных производств Управление качеством на фармацевтическом предприятии Служба качества фармацевтических компаний Выполнил: Килыбаев Е. Гр. 401 “Б” ТФП Приняла: Бакытжанова А

• Система менеджмента качества предприятия фармацевтического профиля необходимо считать комплексом процессов (наиболее часто классифицируемых на основные, управленческие и обеспечивающие), с грамотно документированным определением их взаимосвязей и взаимодействия, формулированием показателей результативности и методов их мониторинга, условий анализа и политикой постоянного улучшения. Каждый из процессов этой системы должен управляться с учетом современных принципов менеджмента качества, а также быть согласованным с соответствующими требованиями правил GMP и отвечать действующим нормативным и законодательным требованиям. Один из главных концептуальных вопросов в этом направлении — создание рационального алгоритма выполнения всех описанных выше требований. Исходя из этого, представляется интересным разработать методологию формирования ИСМ в фармацевтической индустрии и изучить возможность и рациональность внедрения таких систем на отечественных предприятиях. Актуальность такой работы может быть подтверждена серьезной значимостью возникшей проблемы адаптации производителей лекарственных средств развивающихся стран к общепринятым в современном мире законам, нормативам, стандартам, а также желанием сформировать систему качественного производства и контроля лекарств в соответствии с требованиями GMP.
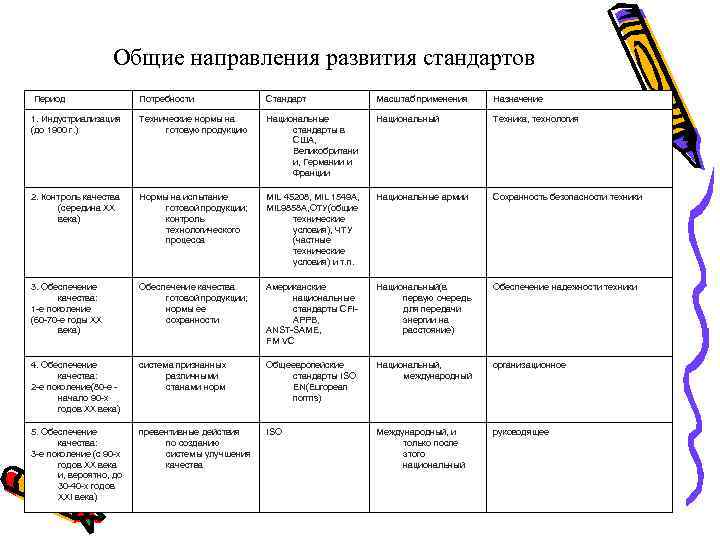
Общие направления развития стандартов Период Потребности Стандарт Масштаб применения Назначение 1. Индустриализация (до 1900 г. ) Технические нормы на готовую продукцию Национальные стандарты в США, Великобритани и, Германии и Франции Национальный Техника, технология 2. Контроль качества (середина ХХ века) Нормы на испытание готовой продукции; контроль технологического процесса MIL 45208, MIL 1549 A, MIL 9858 A, ОТУ(общие технические условия), ЧТУ (частные технические условия) и т. п. Национальные армии Сохранность безопасности техники 3. Обеспечение качества: 1 -е поколение (60 -70 -е годы ХХ века) Обеспечение качества готовой продукции; нормы ее сохранности Американские национальные стандарты CFIAPPB, ANST-SAME, FM VC Национальный(в первую очередь для передачи энергии на расстояние) Обеспечение надежности техники 4. Обеспечение качества: 2 -е поколение(80 -е - начало 90 -х годов ХХ века) система признанных различными станами норм Общеевропейские стандарты ISO EN(European norms) Национальный, международный организационное 5. Обеспечение качества: 3 -е поколение (с 90 -х годов ХХ века и, вероятно, до 30 -40 -х годов ХХI века) превентивные действия по созданию системы улучшения качества ISO Международный, и только после этого национальный руководящее

• В настоящее время в развитии фармацевтического производства нашей страны наступил критический момент, характеризующийся разнонаправленными тенденциями и, прежде всего, снижением конкурентоспособности большинства устаревших отечественных предприятий. • Понятия «качество» и «безопасность» должны стать девизом предприятий фармацевтической промышленности. Фармацевтический рынок мира динамично развивается, что приводит к повышению конкуренции и требовании к организации управления фармацевтическими предприятиями. В этих условиях определение основных направлений повышения конкурентоспособности является важной стратегической задачей фармацевтического предприятия. • Проведенный анализ фармацевтических предприятий стран – лидеров мировой экономики показывает, что достижения стратегической цели в управлении обеспечивается интегрированных систем использования европейских методов менеджмента качества, сертификация систем в соответствии с ISO 9000, GMP, GLP, GCP, GDP, т. д. [1]

• Система менеджмента качества (СМК) – это система внутрифирменного управления, направленная на достижение определенных критериев качества выпускаемой продукции, созданная в организации для формирования политики в области качества и достижения поставленных задач. СМК позволяет создать на предприятии порядок, при котором ответственность персонала точно распределена и документирована. Особенностью современных подходов к менеджменту качества является то, что требования предъявляются не к качеству продукции напрямую, а к системе менеджмента, которая в свою очередь призвана обеспечивать предсказуемый и стабильный уровень качества продукции, процесса производства и деятельности организации в целом. СМК фармацевтического предприятия – это управляющая система, направляющая и контролирующая деятельность предприятия, связанную с качеством лекарственных средств. При этом непосредственными объектами управления являются факторы и ус ловия, влияющие на качество лекарственных средств, а также процессы формирования качества лекарственных средств на разных стадиях и этапах производства. [2]

• Система обеспечения качества при производстве лекарственных средств должна гарантировать, что: • Продукция разработана с учетом всех требовании и стандартов; • На все операции по производству и контролю составлена четкая документация в соответствии с правилами стандарта; • Ответственность и полномочия строго определены; • Выполняются мероприятия по производству, поставке и использованию надлежащего исходного сырья и упаковочного материала; • Проводиться контроль промежуточной продукции и технологического процесса, а также валидация; • Контроль и проверка готовой продукции проводиться в соответствии с требованиями стандарта и законодательства; • Выполняется процедура проведения самоинспекции и/или аудита качества, по которой регулярно оценивают эффективность и пригодность системы обеспечения качества.

• • Необходимо отметить, что внедрение стандартов ИСО серии 9000 на предприятии является добровольным решением руководства и направлено, прежде всего, на повышение конкурентоспособности предприятия. В отличие от этого, внедрение стандарта GMP в медицинской промышленности РК с 2014 года при производстве готовых лекарственных средств является обязательным. В то же время становится все более очевидным, что осуществить такой переход невозможно без разработки и внедрения на предприятиях интегрированных систем менеджмента качества (ИСМ). Под интегрированной системой менеджмента понимается система, отвечающая требованиям двух и более международных стандартов, функционирующая как единое целое. Для фармацевтических предприятий наиболее характерно создание интегрированной системы менеджмента, которая соответствует требованиям стандартов ИСО серии 9000 и правилам GMP. В связи с этим совершенствования деятельности на фармацевтическом предприятии необходимо внедрение интегрированных систем менеджмента, отвечающих требованиям международных стандартов и обобщающих мировой опыт системного управления. Количество фармацевтических предприятий с интегрированной системой менеджмента качества увеличивается с каждым годом. (табл. 2).
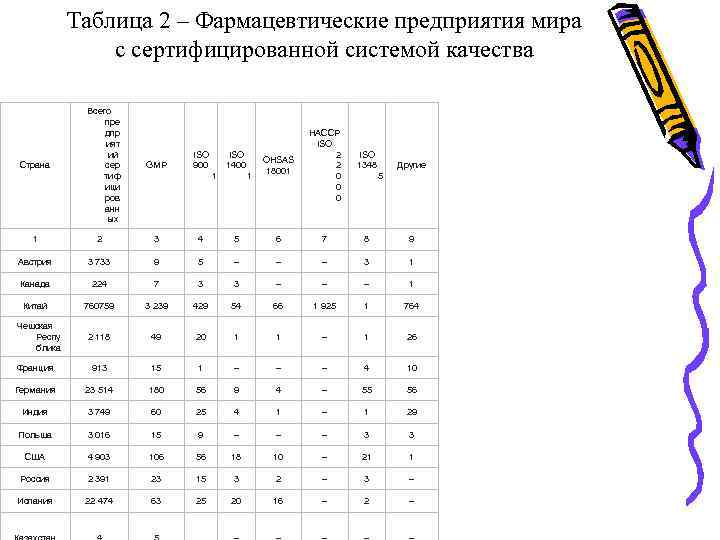
Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества Страна Всего пре дпр ият ий сер тиф ици ров анн ых GMP ISO 900 ISO 1400 1 1 OHSAS 18001 HACCP ISO 2 2 0 0 0 ISO 1348 Другие 5 1 2 3 4 5 6 7 8 9 Австрия 3 733 9 5 – – – 3 1 Канада 224 7 3 3 – – – 1 Китай 760759 3 239 429 54 66 1 925 1 764 2 118 49 20 1 1 – 1 26 Франция 913 15 1 – – – 4 10 Германия 23 514 180 56 9 4 – 55 56 Индия 3 749 60 25 4 1 – 1 29 Польша 3 016 15 9 – – – 3 3 США 4 903 106 56 18 10 – 21 1 Россия 2 391 23 15 3 2 – 3 – Испания 22 474 63 25 20 16 – 2 – Чешская Респу блика

• 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Основными преимуществами внедрения интегрированной системы менеджмента являются: Изменение подхода к обеспечению качества и безопасности лекарственных средств, что снижает потери от возникновения брака и отзыва продукции; Четкое определение ответственности за обеспечение безопасности лекарственных средств; Документальное подтверждение уверенности в безопасности лекарственных средств, что особо важно при работе с потребителем, в т. ч. при судебных разбирательствах. Обеспечение системного подхода, включающего все параметры безопасности лекарственных средств – от сырья до потребителя; Более экономное использование ресурсов для управления безопасностью; Снижение финансовых издержек, связанных с выпуском некачественной продукции; Повышение доверия потребителя к качеству выпускаемых лекарственных средств; Обеспечение деятельности предприятия в целом и оптимального режима работы систем контроля и верификации в частности; Увеличение возможностей выхода на новые рынки сбыта и расширение существующих; Повышение готовности у зарубежных инвесторов идти на капиталовложение; обеспечение репутации производителя качественных и безопасных лекарственных средств.

• • • Систему обеспечения качества фармацевтического предприятия нужно рассматривать, как интегрированную систему, в основе которой лежат стандарты (базовые и дополнительные). Базовые стандарты: Серии ИСО 9000, описывающие организационную структуру управления качеством; Стандарты GMP, которые содержат требования к производству и контролю качества лекарственных средств для человека и животных (СТ РК 1617 2006). [5] Дополнительные стандарты: Стандарты, устанавливающие требования к системе экологического менеджмента (ISO 14001: 2004); Стандарты, устанавливающие требования к системе менеджмента безопасности продукции (ИСО 22000 2007, Управление рисками по качеству ICH Q 9, ISO 31000: 2009); 1. Стандарты ИСО Стандарты, устанавливающие требования к информационной безопасности (ISO/IEC 27001: 2005); Стандарты, устанавливающие требования в области охраны здоровья и безопасности труда (OHSAS 18001: 2007); Стандарты, помогающие предприятию разработать и внедрить эффективную систему управления, направленную на повышение уровня условий труда и жизненного уровня сотрудников компании (SA 8000; ISO 26000: 2010).

• «На сегодня из 42 производителя лекарственных средств 4 производственных участков двух производителей АО «Химфарм» и АО «Нобел АФФ» имеют заключения о соответствии стандарту GMP» . • 18 производителей также планируют получить сертификаты GMP. Сейчас они делают для этого все возможное: строят новые здания, проводят реконструкцию старых зданий, обучают инженер технологов и. т. д. Продолжается подготовка национального инспектората с привлечением международных специалистов. Всего по стране обучено свыше 200 специалистов государственного органа. • Проводится работа по вступлению Казахстана в международную систему сотрудничества фармацевтических инспекций (PIC/S). В марте 2015 Казахстан получил статус заявителя на присоединение к PIC/S. • PIC/S международная организация, объединяющая фармацевтические инспекционные органы для обеспечения активного сотрудничества в области GMP.

• Спасибо за внимание!!!!!!!
777.ppt