Явлен.переноса, рекальные газы_2014.ppt
- Количество слайдов: 18
 ЯВЛЕНИЯ ПЕРЕНОСА
ЯВЛЕНИЯ ПЕРЕНОСА
 o Явлениями переноса называются процессы, возникающие в системе (газе) при наличии неоднородности плотности, скоростей направленного движения отдельных слоёв газа относительно друга, температуры. Это соответственно: диффузия, внутреннее трение (вязкость), теплопроводность. Тепловое движение молекул стремится выровнять существующие неоднородности, поэтому явления переноса сопровождаются направленным переносом массы, импульса, внутренней энергии.
o Явлениями переноса называются процессы, возникающие в системе (газе) при наличии неоднородности плотности, скоростей направленного движения отдельных слоёв газа относительно друга, температуры. Это соответственно: диффузия, внутреннее трение (вязкость), теплопроводность. Тепловое движение молекул стремится выровнять существующие неоднородности, поэтому явления переноса сопровождаются направленным переносом массы, импульса, внутренней энергии.
 Длина свободного пробега o Под длиной свободного пробега (λ) понимают путь, проходимый молекулой между двумя последовательными столкновениями: , где < υ > - средняя скорость молекулы,
Длина свободного пробега o Под длиной свободного пробега (λ) понимают путь, проходимый молекулой между двумя последовательными столкновениями: , где < υ > - средняя скорость молекулы,
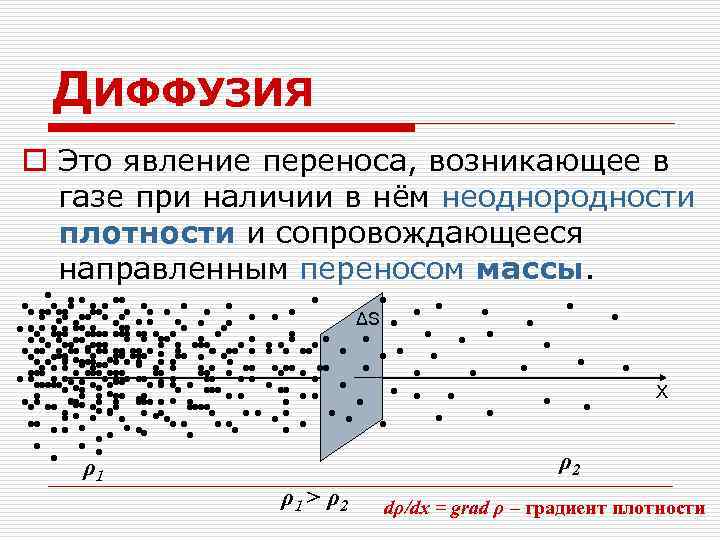 ДИФФУЗИЯ o Это явление переноса, возникающее в газе при наличии в нём неоднородности плотности и сопровождающееся направленным переносом массы. • • • • • • • • • • • • • • ΔS • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • Х • • • • • • • • • • • • • • • • • • • • • • • • • • ρ2 ρ1 ρ1 > ρ2 dρ/dx = grad ρ – градиент плотности
ДИФФУЗИЯ o Это явление переноса, возникающее в газе при наличии в нём неоднородности плотности и сопровождающееся направленным переносом массы. • • • • • • • • • • • • • • ΔS • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • Х • • • • • • • • • • • • • • • • • • • • • • • • • • ρ2 ρ1 ρ1 > ρ2 dρ/dx = grad ρ – градиент плотности
 - уравнение диффузии или закон Фика или: D – коэффициент диффузии <υ> <λ>. <υ> средняя скорость теплового движения < λ> - средняя длина свободного пробега молекулы j. M = d. M / (d. S dt) – удельный поток массы – масса, переносимая в единицу времени через единицу площади - закон Фика
- уравнение диффузии или закон Фика или: D – коэффициент диффузии <υ> <λ>. <υ> средняя скорость теплового движения < λ> - средняя длина свободного пробега молекулы j. M = d. M / (d. S dt) – удельный поток массы – масса, переносимая в единицу времени через единицу площади - закон Фика
 Внутреннее трение явление переноса, вызванное неоднородностью скоростей направленного движения различных слоёв газа и сопровождающееся направленным переносом импульса. Х dи/dx = grad и х и 2 и ΔS dx 0 и 1 > и 2 и 1
Внутреннее трение явление переноса, вызванное неоднородностью скоростей направленного движения различных слоёв газа и сопровождающееся направленным переносом импульса. Х dи/dx = grad и х и 2 и ΔS dx 0 и 1 > и 2 и 1
 - уравнение вязкости η – динамическая вязкость (коэффициент внутреннего трения), η = ρ <υ>< λ>, где ρ – плотность газа Так как - закон Ньютона dp/dt = F, то F – сила вязкого трения; X и 1 F jp= F/d. S = dp/(d. Sdt) – напряжение трения или плотность потока импульса закон Ньютона - или уравнение вязкости и 2 Y Z jр = η grad и
- уравнение вязкости η – динамическая вязкость (коэффициент внутреннего трения), η = ρ <υ>< λ>, где ρ – плотность газа Так как - закон Ньютона dp/dt = F, то F – сила вязкого трения; X и 1 F jp= F/d. S = dp/(d. Sdt) – напряжение трения или плотность потока импульса закон Ньютона - или уравнение вязкости и 2 Y Z jр = η grad и
 Теплопроводность это явление переноса, вызванное неоднородностью температуры в объёме газа и сопровождающееся переносом энергии в форме теплоты. Т 1 ΔЅ Т 2 X Т 1 > Т 2 d. Т/dx = grad. T
Теплопроводность это явление переноса, вызванное неоднородностью температуры в объёме газа и сопровождающееся переносом энергии в форме теплоты. Т 1 ΔЅ Т 2 X Т 1 > Т 2 d. Т/dx = grad. T
 δQ = - χ d. S dt - уравнение теплопроводности (закон Фурье) χ коэффициент теплопроводности сv ρ <υ> <λ> сv – удельная теплоёмкость при постоянном объёме - плотность теплового потока - уравнение теплопроводности (закон Фурье) j. Е = χ grad T
δQ = - χ d. S dt - уравнение теплопроводности (закон Фурье) χ коэффициент теплопроводности сv ρ <υ> <λ> сv – удельная теплоёмкость при постоянном объёме - плотность теплового потока - уравнение теплопроводности (закон Фурье) j. Е = χ grad T
 Анализ коэффициентов переноса ; р = nok. T; <υ> <λ>. η = ρ <υ>< λ>. сv ρ <υ> <λ>. ; <υ>~T 1/2, <λ> ~ no 1 ~ p 1; D ~ T 1/2; D ~ 1/p. <υ>~T 1/2, <λ> ~ 1/no ~ 1/p; ρ ~ no; ρ<λ> ≠ f (p); η ~ T 1/2; η ≠ f (p) cv ≠ f (T, p); ρ<λ> ≠ f (р); <υ> ~ Т 1/2; χ ~ T 1/2; χ ≠ f (p).
Анализ коэффициентов переноса ; р = nok. T; <υ> <λ>. η = ρ <υ>< λ>. сv ρ <υ> <λ>. ; <υ>~T 1/2, <λ> ~ no 1 ~ p 1; D ~ T 1/2; D ~ 1/p. <υ>~T 1/2, <λ> ~ 1/no ~ 1/p; ρ ~ no; ρ<λ> ≠ f (p); η ~ T 1/2; η ≠ f (p) cv ≠ f (T, p); ρ<λ> ≠ f (р); <υ> ~ Т 1/2; χ ~ T 1/2; χ ≠ f (p).
 Таблица явлений переноса Явление Переносимая физи – ческая величина Диффузия Масса Основной закон явления Коэффициент явления переноса <υ> λ>. (ρ ≠ const) Внутреннее трение (и ≠ const ) Импульс Теплопроводность (Т ≠ const ) Внутренняя энергия ρ<υ><λ> δQ = - χ d. S dt сv ρ <υ><λ>
Таблица явлений переноса Явление Переносимая физи – ческая величина Диффузия Масса Основной закон явления Коэффициент явления переноса <υ> λ>. (ρ ≠ const) Внутреннее трение (и ≠ const ) Импульс Теплопроводность (Т ≠ const ) Внутренняя энергия ρ<υ><λ> δQ = - χ d. S dt сv ρ <υ><λ>
 Реальные газы
Реальные газы
 Силы и энергия взаимодействия молекул Уравнение состояния идеального газа для 1 моль: р. V 0=RT; (Т=const), при p→∞ V→ 0, что невозможно! Радиус молекулы r~10 -10 м. Объём молекулы v=4∕ 3 π r 3 ≈ 4. 10 -30 м-3 При нормальных условиях концентрация молекул no=3· 1025 м-3, их объём V’ =no. v ≈ 10 -4 м-3. При р=5000 атм V ≈ 2. 10 -4 м-3 , V’ = 0, 5 V объём молекул необходимо учитывать!
Силы и энергия взаимодействия молекул Уравнение состояния идеального газа для 1 моль: р. V 0=RT; (Т=const), при p→∞ V→ 0, что невозможно! Радиус молекулы r~10 -10 м. Объём молекулы v=4∕ 3 π r 3 ≈ 4. 10 -30 м-3 При нормальных условиях концентрация молекул no=3· 1025 м-3, их объём V’ =no. v ≈ 10 -4 м-3. При р=5000 атм V ≈ 2. 10 -4 м-3 , V’ = 0, 5 V объём молекул необходимо учитывать!
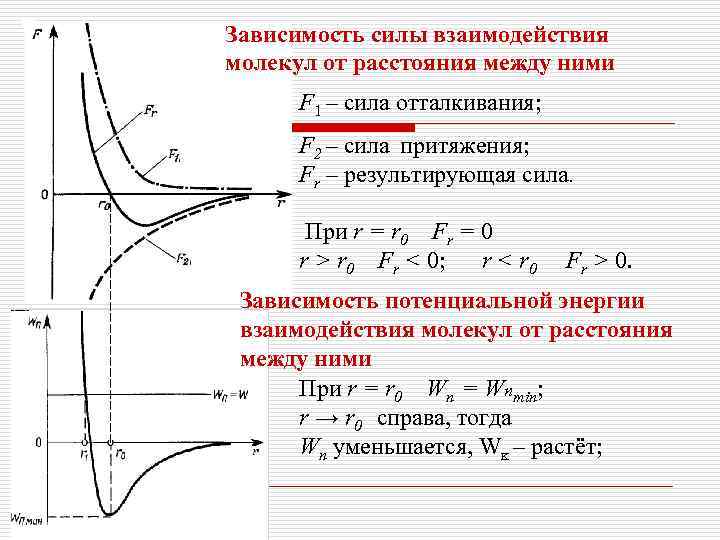 Зависимость силы взаимодействия молекул от расстояния между ними F 1 – сила отталкивания; F 2 – сила притяжения; Fr – результирующая сила. При r = r 0 Fr = 0 r > r 0 Fr < 0; r < r 0 Fr > 0. Зависимость потенциальной энергии взаимодействия молекул от расстояния между ними При r = r 0 Wn = Wnmin; r → r 0 справа, тогда Wn уменьшается, Wĸ – растёт;
Зависимость силы взаимодействия молекул от расстояния между ними F 1 – сила отталкивания; F 2 – сила притяжения; Fr – результирующая сила. При r = r 0 Fr = 0 r > r 0 Fr < 0; r < r 0 Fr > 0. Зависимость потенциальной энергии взаимодействия молекул от расстояния между ними При r = r 0 Wn = Wnmin; r → r 0 справа, тогда Wn уменьшается, Wĸ – растёт;
 Уравнение Ван-дер-Ваальса o p. V 0=RT; для учёта объёма, занятого молекулами, произведена замена: V 0 → (V 0 - b) b – поправка Ван-дер-Ваальса на объём, занятый молекулами. Согласно расчётам, собственный объём молекул Vo'= ¼ b o Для учёта взаимодействия молекул введено понятие «внутреннее давление» : pi = а / V 0² а - поправка Ван-дер-Ваальса на взаимодействие молекул. o Общее давление: р + рi = р + а / V 0²
Уравнение Ван-дер-Ваальса o p. V 0=RT; для учёта объёма, занятого молекулами, произведена замена: V 0 → (V 0 - b) b – поправка Ван-дер-Ваальса на объём, занятый молекулами. Согласно расчётам, собственный объём молекул Vo'= ¼ b o Для учёта взаимодействия молекул введено понятие «внутреннее давление» : pi = а / V 0² а - поправка Ван-дер-Ваальса на взаимодействие молекул. o Общее давление: р + рi = р + а / V 0²
 (р + а/V 0²)(V 0 - b) = RT - уравнение Ван -дер -Ваальса или уравнение состояния для одного моля реального газа o Для произвольной массы газа заменим: V = (m / μ) V 0 = ν V 0, получим: или: уравнение Ван - -дер -Ваальса или уравнение состояния реального газа
(р + а/V 0²)(V 0 - b) = RT - уравнение Ван -дер -Ваальса или уравнение состояния для одного моля реального газа o Для произвольной массы газа заменим: V = (m / μ) V 0 = ν V 0, получим: или: уравнение Ван - -дер -Ваальса или уравнение состояния реального газа
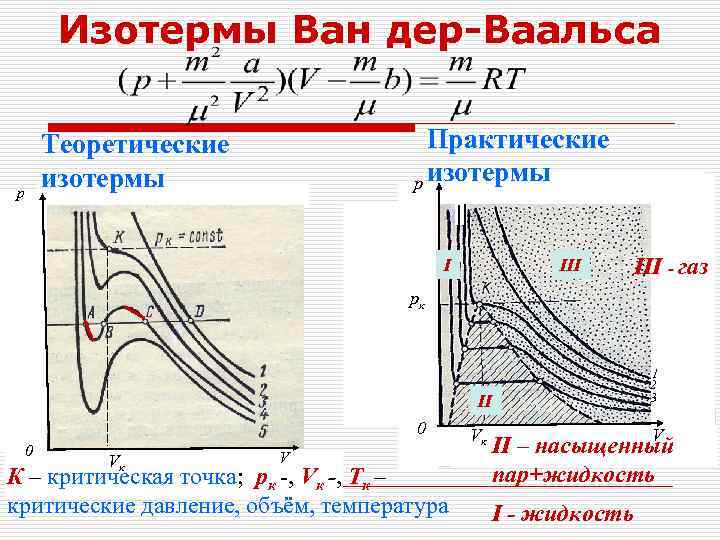 Изотермы Ван дер-Ваальса р Практические p изотермы Теоретические изотермы I III ·· · · ·· · III газ pк 1 2 3 II 0 0 Vк V К – критическая точка; рк -, Vк , Тк – критические давление, объём, температура Vĸ V II – насыщенный пар+жидкость I жидкость
Изотермы Ван дер-Ваальса р Практические p изотермы Теоретические изотермы I III ·· · · ·· · III газ pк 1 2 3 II 0 0 Vк V К – критическая точка; рк -, Vк , Тк – критические давление, объём, температура Vĸ V II – насыщенный пар+жидкость I жидкость
 Внутренняя энергия реального газа Для 1 моля идеального газа имели: U = Wк= RT. ¨ Для реального газа: ¨Работа, затрачиваемая на преодоление сил притяжения А = d. Wp = ріd. V = (а/V 02) d. V Для 1 моля При V → ∞ Wn→ 0, следовательно const = 0. Т. об. для 1 моля реального газа внутренняя энергия равна U p. г. =
Внутренняя энергия реального газа Для 1 моля идеального газа имели: U = Wк= RT. ¨ Для реального газа: ¨Работа, затрачиваемая на преодоление сил притяжения А = d. Wp = ріd. V = (а/V 02) d. V Для 1 моля При V → ∞ Wn→ 0, следовательно const = 0. Т. об. для 1 моля реального газа внутренняя энергия равна U p. г. =


