 Яковлев Иван, 11 «А» , гимназия № 1 Для НОХ ХРОМ МОЛИБДЕН ВОЛЬФРАМ УРАН Без сиборгия
Яковлев Иван, 11 «А» , гимназия № 1 Для НОХ ХРОМ МОЛИБДЕН ВОЛЬФРАМ УРАН Без сиборгия
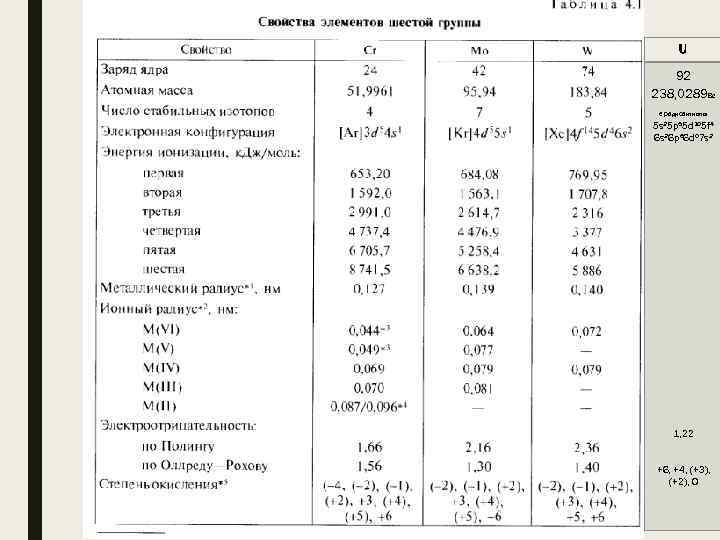 U 92 238, 0289 Вс е радиоактивны 5 s 25 p 65 d 105 f 4 6 s 26 p 66 d 07 s 2 1, 22 +6, +4, (+3), (+2), 0
U 92 238, 0289 Вс е радиоактивны 5 s 25 p 65 d 105 f 4 6 s 26 p 66 d 07 s 2 1, 22 +6, +4, (+3), (+2), 0
 Важнейшие минералы ■ Cr – хромистый железняк(Fe. Cr 2 O 4), крокоит(Pb. Cr. O 4), хромовая охра(Cr 2 O 3). ■ Mo – молибденит(Mo. S 2), вульфенит(Pb. Mo. O 4), повеллит(Ca. Mn. O 4). ■ Wo - шеелит(Ca. WO 4), вольфрамит((Fe, Mn)WO 4). ■ U –урановая смоляная руда(U 3 O 8).
Важнейшие минералы ■ Cr – хромистый железняк(Fe. Cr 2 O 4), крокоит(Pb. Cr. O 4), хромовая охра(Cr 2 O 3). ■ Mo – молибденит(Mo. S 2), вульфенит(Pb. Mo. O 4), повеллит(Ca. Mn. O 4). ■ Wo - шеелит(Ca. WO 4), вольфрамит((Fe, Mn)WO 4). ■ U –урановая смоляная руда(U 3 O 8).
 Получение ■ Хром встречается в природе в основном в виде хромистого железняка Fe(Cr. O 2)2 из него получают хром восстановлением в электропечах углеродом: ■ Металлический хром получают восстановлением Cr 2 O 3 алюминием или кремнием. Наиболее чистый Cr(99%) получают электролизом Cr 2(SO 4)3 на алюминиевом катоде: ■ Для получения Cr 2 O 3 хромистый железняк подвергают окислительному плавлению в щелочной среде:
Получение ■ Хром встречается в природе в основном в виде хромистого железняка Fe(Cr. O 2)2 из него получают хром восстановлением в электропечах углеродом: ■ Металлический хром получают восстановлением Cr 2 O 3 алюминием или кремнием. Наиболее чистый Cr(99%) получают электролизом Cr 2(SO 4)3 на алюминиевом катоде: ■ Для получения Cr 2 O 3 хромистый железняк подвергают окислительному плавлению в щелочной среде:
 ■ Затем образовавшийся Na 2 Cr. O 4 обрабатывают серной кислотой или проводят реакцию в автоклавах под давлением 7 -15 атмосфер: ■ Затем выкристаллизовавшийся бихромат натрия обезвоживают и восстанавливают серой или углем: ■ Молибден получают обжигая Mn. S 2 , затем получившийся оксид растворяют в растворе аммиака для дополнительной очистки и вновь разлагают на воздухе до оксида. Порошок метала получают восстановлением оксида водородом.
■ Затем образовавшийся Na 2 Cr. O 4 обрабатывают серной кислотой или проводят реакцию в автоклавах под давлением 7 -15 атмосфер: ■ Затем выкристаллизовавшийся бихромат натрия обезвоживают и восстанавливают серой или углем: ■ Молибден получают обжигая Mn. S 2 , затем получившийся оксид растворяют в растворе аммиака для дополнительной очистки и вновь разлагают на воздухе до оксида. Порошок метала получают восстановлением оксида водородом.
 ■ Получение вольфрама:
■ Получение вольфрама:
 Химические свойства Cr ■ На воздухе пассивируется(!антикоррозийные свойства), не реагирует с амиаком, водой, щелочами, HNO 3(к). ■ !Реагирует с неокисляющими кислотами с переходом в Cr+2 Cr + 2 HCl = Cr. Cl 2(голубой) + H 2 ■ Однако на воздухе быстро окисляется(! Намек на хром на олимпиаде) 4 Cr. Cl + O + HCl – 4 Cr. Cl (зеленый) + 2 H O 2 2 3 ■ Окисляющие кислоты переводят хром в Cr+3 2 2 Cr + H 2 SO 4 = Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O ■ При нагревании хром реагирует как с простыми так и со сложными веществами. 1)При температуре 600 о. С реагирует с водой с образованием Cr 2 O 3 2)При 400 о. С окисляется кислородом с образованием Cr 2 O 3 3)В парах серы горит, превращаясь в Cr 2 S 3 4)В токе хлора образует Cr. Cl 3 5)Нитриды и карбиды Cr относятся к так называемым фазам внедрения –это соединения с нетривиальным валентным отношением, которые можно представить как нестехиометрический продукт проникновения атомов одного элемента в пустоты кристаллической решетки другого. (Cr 7 C 3)
Химические свойства Cr ■ На воздухе пассивируется(!антикоррозийные свойства), не реагирует с амиаком, водой, щелочами, HNO 3(к). ■ !Реагирует с неокисляющими кислотами с переходом в Cr+2 Cr + 2 HCl = Cr. Cl 2(голубой) + H 2 ■ Однако на воздухе быстро окисляется(! Намек на хром на олимпиаде) 4 Cr. Cl + O + HCl – 4 Cr. Cl (зеленый) + 2 H O 2 2 3 ■ Окисляющие кислоты переводят хром в Cr+3 2 2 Cr + H 2 SO 4 = Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O ■ При нагревании хром реагирует как с простыми так и со сложными веществами. 1)При температуре 600 о. С реагирует с водой с образованием Cr 2 O 3 2)При 400 о. С окисляется кислородом с образованием Cr 2 O 3 3)В парах серы горит, превращаясь в Cr 2 S 3 4)В токе хлора образует Cr. Cl 3 5)Нитриды и карбиды Cr относятся к так называемым фазам внедрения –это соединения с нетривиальным валентным отношением, которые можно представить как нестехиометрический продукт проникновения атомов одного элемента в пустоты кристаллической решетки другого. (Cr 7 C 3)
 Химические свойства W и Mo ■ W и Mo химически очень инертны. Это связано с меньшим ОВП чем у хрома, что делает переход W – W+3 термодинамически менее выгодным. Так же это связано с образованием сверхпрочной оксидной пленки. ■ H 2 SO 4 и HCl практически не реагируют, HNO 3 пассивирует металлы. Только смесь концентрированных HNO 3 + HCl быстро переводит их в раствор. W + 8 HF + 2 HNO 3 = H 2 WF 8 + 2 NO + 4 H 2 O ■ С водными растворами щелочей не реагируют, но под действием расплава Na. OH + KNO 3 переходят соответсвенно в молибдат и вольфрамат. Э + 2 KNO 3 + 2 Na. OH = Na 2 ЭO 4 + 3 KNO 2 + H 2 O ■ С кислородом реагируют при 600 о. С образуя ЭО 3. С серой образуют ЭS 2 , с углеродом карбиды ЭC(очень прочные). С различными металлами образуют интерметалиды, которые обуславливают уникальные свойства сплавов.
Химические свойства W и Mo ■ W и Mo химически очень инертны. Это связано с меньшим ОВП чем у хрома, что делает переход W – W+3 термодинамически менее выгодным. Так же это связано с образованием сверхпрочной оксидной пленки. ■ H 2 SO 4 и HCl практически не реагируют, HNO 3 пассивирует металлы. Только смесь концентрированных HNO 3 + HCl быстро переводит их в раствор. W + 8 HF + 2 HNO 3 = H 2 WF 8 + 2 NO + 4 H 2 O ■ С водными растворами щелочей не реагируют, но под действием расплава Na. OH + KNO 3 переходят соответсвенно в молибдат и вольфрамат. Э + 2 KNO 3 + 2 Na. OH = Na 2 ЭO 4 + 3 KNO 2 + H 2 O ■ С кислородом реагируют при 600 о. С образуя ЭО 3. С серой образуют ЭS 2 , с углеродом карбиды ЭC(очень прочные). С различными металлами образуют интерметалиды, которые обуславливают уникальные свойства сплавов.
 Химические свойства Cr. O 3(хромовый ангидрид) ■ Разлагается при 450 о. С 4 Cr. O 3 = 2 Cr 2 O 3 + 3 O 2 ■ Синтез : K 2 Cr 2 O 7 + 2 H 2 SO 4 = 2 Cr. O 3 +2 KHSO 4 + H 2 O ■ В водном растворе образует хромовую кислоту средней силы(Ka =10 -1): Cr. O 3 + H 2 O = H 2 Cr. O 4 ■ В водных растворах идет образование изополисоеднинений при уменьшении p. H с увеличением интенсивности окраски. 2 K 2 Cr. O 4 + 2 H 2 SO 4 = K 2 Cr 2 O 7 + 2 KHSO 4 + H 2 O Процесс идет через стадию протонизации хромат-ионов: Cr. O 42 - + H+ = HCr. O 4 - 2 HCr. O 4 - = Cr 2 O 72 - +H 2 O ■ В щелочной среде происходит обратный процесс: Cr 2 O 72 - + 2 OH- = 2 Cr. O 42 - + H 2 O
Химические свойства Cr. O 3(хромовый ангидрид) ■ Разлагается при 450 о. С 4 Cr. O 3 = 2 Cr 2 O 3 + 3 O 2 ■ Синтез : K 2 Cr 2 O 7 + 2 H 2 SO 4 = 2 Cr. O 3 +2 KHSO 4 + H 2 O ■ В водном растворе образует хромовую кислоту средней силы(Ka =10 -1): Cr. O 3 + H 2 O = H 2 Cr. O 4 ■ В водных растворах идет образование изополисоеднинений при уменьшении p. H с увеличением интенсивности окраски. 2 K 2 Cr. O 4 + 2 H 2 SO 4 = K 2 Cr 2 O 7 + 2 KHSO 4 + H 2 O Процесс идет через стадию протонизации хромат-ионов: Cr. O 42 - + H+ = HCr. O 4 - 2 HCr. O 4 - = Cr 2 O 72 - +H 2 O ■ В щелочной среде происходит обратный процесс: Cr 2 O 72 - + 2 OH- = 2 Cr. O 42 - + H 2 O
 ■ Равновесие 2 Cr. O 42 - + 2 H+ = Cr 2 O 72 - + H 2 O смещается влево не только в результате изменения p. H, но и при добавлении растворимых солей Ba 2+, Pb 2+, Ag+ 2 KCr 2 O 7 + H 2 O + Ba. Cl 2 = Ba. Cr. O 4(н) + 2 KCl + H 2 Cr. O 4 ■ Возможна дальнейшая полимеризация при подкислении до Cr 4 O 132 -, а затем образуется кристаллический Cr. O 3.
■ Равновесие 2 Cr. O 42 - + 2 H+ = Cr 2 O 72 - + H 2 O смещается влево не только в результате изменения p. H, но и при добавлении растворимых солей Ba 2+, Pb 2+, Ag+ 2 KCr 2 O 7 + H 2 O + Ba. Cl 2 = Ba. Cr. O 4(н) + 2 KCl + H 2 Cr. O 4 ■ Возможна дальнейшая полимеризация при подкислении до Cr 4 O 132 -, а затем образуется кристаллический Cr. O 3.
 Окислительная способность Сr 6+ ■ Cr. O 3 поджигает спирт. ■ Смесь 2 объемов K 2 Cr 2 O 7(нас. ) и одного объема H 2 SO 4 – хромпик, хромовая смесь. Применяется для очистки хим. посуды от органики. !очень опасна, работать в перчатках с осторожностью. ■ Ваш любимый вулкан –внутримолекулярное окислениевосстановление: (NH 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4 H 2 O ■ ! K 2 Cr 2 O 7 + 14 HCl = 3 Cl 2 + 2 Cr. Cl 3 + 7 H 2 O + 2 KCl нужен нагрев и сильнокислая среда ■ При действии на соли хромовой и дихромовой кислот восстановителями(H 2 S, Me 2 S(Me = ЩЭ, NH 4+), SO 2, Na. SO 3, Fe. SO 4, KI) то реакция идет и кислой и в щелочной среде. Продукты реакции зависят от среды и природы восстановителя, однако хром всегда переходит в Cr 3+. ■ K 2 Cr 2 O 7 используется в аналитической химии для опеределения концентрации раствора восстановителя(дихроматометрия).
Окислительная способность Сr 6+ ■ Cr. O 3 поджигает спирт. ■ Смесь 2 объемов K 2 Cr 2 O 7(нас. ) и одного объема H 2 SO 4 – хромпик, хромовая смесь. Применяется для очистки хим. посуды от органики. !очень опасна, работать в перчатках с осторожностью. ■ Ваш любимый вулкан –внутримолекулярное окислениевосстановление: (NH 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4 H 2 O ■ ! K 2 Cr 2 O 7 + 14 HCl = 3 Cl 2 + 2 Cr. Cl 3 + 7 H 2 O + 2 KCl нужен нагрев и сильнокислая среда ■ При действии на соли хромовой и дихромовой кислот восстановителями(H 2 S, Me 2 S(Me = ЩЭ, NH 4+), SO 2, Na. SO 3, Fe. SO 4, KI) то реакция идет и кислой и в щелочной среде. Продукты реакции зависят от среды и природы восстановителя, однако хром всегда переходит в Cr 3+. ■ K 2 Cr 2 O 7 используется в аналитической химии для опеределения концентрации раствора восстановителя(дихроматометрия).
 Cr 2 O 3 ■ !Наиболее устойчивая степень окисления. ■ Амфотерный оксид. Может быть переведён окислителями в Cr+6 , а восстановителями в Cr 2+ : Cr 2(SO 4)3 +Zn = 2 Cr. SO 4 + Zn. SO 4. ■ Тпл 2275 –о. С, структура корунда(а-Al 2 O 3) ■ В воде и кислотах не растворим, для перевода в растворимые соединения обычно испольщуют окислительное сплавление: Cr 2 O 3 + 3 Na. NO 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 3 Na. NO 2 + 2 CO 2 ■ Сплавление с карбонатами или гидроксидами ЩЭ приводит к образованию хроматов(3) (ЩЭ)Cr. O 2: Cr 2 O 3 + Na 2 CO 3 = 2 Na. Cr. O 2 + CO 2 ■ При растворении в воде они образуют гидроксокомплексы (ЩЭ)n[Cr(OH)3+n] (обычно n=3). Но если при сплавлении нет избытка щелочного реагента –гидролиз до Cr(OH)3.
Cr 2 O 3 ■ !Наиболее устойчивая степень окисления. ■ Амфотерный оксид. Может быть переведён окислителями в Cr+6 , а восстановителями в Cr 2+ : Cr 2(SO 4)3 +Zn = 2 Cr. SO 4 + Zn. SO 4. ■ Тпл 2275 –о. С, структура корунда(а-Al 2 O 3) ■ В воде и кислотах не растворим, для перевода в растворимые соединения обычно испольщуют окислительное сплавление: Cr 2 O 3 + 3 Na. NO 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 3 Na. NO 2 + 2 CO 2 ■ Сплавление с карбонатами или гидроксидами ЩЭ приводит к образованию хроматов(3) (ЩЭ)Cr. O 2: Cr 2 O 3 + Na 2 CO 3 = 2 Na. Cr. O 2 + CO 2 ■ При растворении в воде они образуют гидроксокомплексы (ЩЭ)n[Cr(OH)3+n] (обычно n=3). Но если при сплавлении нет избытка щелочного реагента –гидролиз до Cr(OH)3.

 Cr(OH)3 ■ Получение –действие на соли растворы солей Cr 3+ раствором аммиака или щелочи. ■ Cr(OH)3 + n. KOH = Kn[Cr(OH)3+n] – гидроксокомплекс, n до 3. ■ Правильно –КЧ Cr+3 – 6, поэтому правильнее изображать растворимые гидроксокомплексы - [Cr(OH)4(H 2 O)m]n-n (олигомер). При подщелачивании вода заменяется на ОНвплоть до [Cr(OH)6]3 -. ■ Гидроксокомплексы окрашены в зеленый цвет, слабо устойчивы и при нагревании разлагаются с выделением гидроксида хрома. ■ Тут мне стало лень, есть еще смешанные оксиды хрома и его соли(несколько интересных моментов), но если интересно почитайте сами.
Cr(OH)3 ■ Получение –действие на соли растворы солей Cr 3+ раствором аммиака или щелочи. ■ Cr(OH)3 + n. KOH = Kn[Cr(OH)3+n] – гидроксокомплекс, n до 3. ■ Правильно –КЧ Cr+3 – 6, поэтому правильнее изображать растворимые гидроксокомплексы - [Cr(OH)4(H 2 O)m]n-n (олигомер). При подщелачивании вода заменяется на ОНвплоть до [Cr(OH)6]3 -. ■ Гидроксокомплексы окрашены в зеленый цвет, слабо устойчивы и при нагревании разлагаются с выделением гидроксида хрома. ■ Тут мне стало лень, есть еще смешанные оксиды хрома и его соли(несколько интересных моментов), но если интересно почитайте сами.

 Оксид хрома (II) Cr. O Твёрдое вещество черного или красного цвета Проявляет свойства характерные основным оксидам ■ Сложно получить индивидуально – 2 Сr + O 2 = 2 Cr. O (в Hg) ■ При 700 о. С диспорпорционирует: 3 Cr. O = Cr 2 O 3 + Cr ■ Растворяется только в кислотах = основные свойства. 4 Cr. O + O 2 = 2 Cr 2 O 3 Cr. O + H 2 = Cr + H 2 O при 1000°С Cr. O + C = Сr + CO
Оксид хрома (II) Cr. O Твёрдое вещество черного или красного цвета Проявляет свойства характерные основным оксидам ■ Сложно получить индивидуально – 2 Сr + O 2 = 2 Cr. O (в Hg) ■ При 700 о. С диспорпорционирует: 3 Cr. O = Cr 2 O 3 + Cr ■ Растворяется только в кислотах = основные свойства. 4 Cr. O + O 2 = 2 Cr 2 O 3 Cr. O + H 2 = Cr + H 2 O при 1000°С Cr. O + C = Сr + CO
 Cr(OH)2 ■ Желтый, сильный восстановитель в щелочной среде. ■ Очень сложно получить чистым из-за примечи хрома в высших степенях окисления. ■ Обладает основными свойствами, растворяется только в кислотах, образует один ряд солей с катионом Cr 2+. ■ Можно получить обрабатывая металлический хром неокисляющей кислотой(HCl и др. ). ■ Другой пусть состоит в восстановлении соединений хрома, например: Cr 2(SO 4)3 + Zn = 2 Cr. SO 4 +Zn. SO 4. ■ !Проблема – соли окисляются кислородом воздуха или водой. 4 Cr. SO 4 + O 2 + 2 H 2 SO 4 = 2 Cr 2(SO 4)3 + H 2 O 2 Cr. SO 4 + 2 H 2 O = 2 Cr(OH)(SO 4)3 + H 2
Cr(OH)2 ■ Желтый, сильный восстановитель в щелочной среде. ■ Очень сложно получить чистым из-за примечи хрома в высших степенях окисления. ■ Обладает основными свойствами, растворяется только в кислотах, образует один ряд солей с катионом Cr 2+. ■ Можно получить обрабатывая металлический хром неокисляющей кислотой(HCl и др. ). ■ Другой пусть состоит в восстановлении соединений хрома, например: Cr 2(SO 4)3 + Zn = 2 Cr. SO 4 +Zn. SO 4. ■ !Проблема – соли окисляются кислородом воздуха или водой. 4 Cr. SO 4 + O 2 + 2 H 2 SO 4 = 2 Cr 2(SO 4)3 + H 2 O 2 Cr. SO 4 + 2 H 2 O = 2 Cr(OH)(SO 4)3 + H 2
 Применение ■ Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. ■ Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Применение ■ Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. ■ Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
 Спасибо за внимание O|O/
Спасибо за внимание O|O/


