Ядерный матрикс.pptx
- Количество слайдов: 12
 ЯДЕРНЫЙ МАТРИКС слева — схема строения ядер до экстракции; справа — после экстракции; 1 — примембранный белковый слой (ламина) и поровые комплексы; 2 — межхроматиновая белковая сеть матрикса; 3 — белковый матрикс ядрышка
ЯДЕРНЫЙ МАТРИКС слева — схема строения ядер до экстракции; справа — после экстракции; 1 — примембранный белковый слой (ламина) и поровые комплексы; 2 — межхроматиновая белковая сеть матрикса; 3 — белковый матрикс ядрышка
 Ядерный матрикс: определение Эухроматин и гетерохроматин ассоциированы внутри ядра с сетью нехроматиновых фибриллярных и гранулярных структур. Еще 50 лет назад было показано существование фракции ядерных белков, образующей в ядре фибриллярную сеть нуклеопротеинов. Термин ядерный матрикс (nuclear matrix) был предложен для этой структуры Berezney и Coffey (1974 ). В связи с тем, что понятие ядерного матрикса является операционно определяемым, разные авторы включают в его состав различные структуры. Так, в большинстве случаев считается, что ядерный матрикс (остов, scaffold) - это внутриядерная сеть фибриллярных и гранулярных компонентов, периферическая ламина с поровыми комплексами и остаточное ядрышко, участвующие в процессах функционирования генома (инициации синтеза и репликации ДНК, а также в синтезе, процессинге и транспорте РНК), его поддержании и расположении хромосом в ядре.
Ядерный матрикс: определение Эухроматин и гетерохроматин ассоциированы внутри ядра с сетью нехроматиновых фибриллярных и гранулярных структур. Еще 50 лет назад было показано существование фракции ядерных белков, образующей в ядре фибриллярную сеть нуклеопротеинов. Термин ядерный матрикс (nuclear matrix) был предложен для этой структуры Berezney и Coffey (1974 ). В связи с тем, что понятие ядерного матрикса является операционно определяемым, разные авторы включают в его состав различные структуры. Так, в большинстве случаев считается, что ядерный матрикс (остов, scaffold) - это внутриядерная сеть фибриллярных и гранулярных компонентов, периферическая ламина с поровыми комплексами и остаточное ядрышко, участвующие в процессах функционирования генома (инициации синтеза и репликации ДНК, а также в синтезе, процессинге и транспорте РНК), его поддержании и расположении хромосом в ядре.
 Матрикс ядерный: структура • Белки • ДНК • РНК • Фосфолипиды Некоторые исследования заставляют предположить, что структурное единство ядерного матрикса обусловлено металло-протеиновыми взаимодействиями , подобными имеющим место во время выделения матрикса по методикам, базирующимся на включении ионов кальция или меди, а также магния.
Матрикс ядерный: структура • Белки • ДНК • РНК • Фосфолипиды Некоторые исследования заставляют предположить, что структурное единство ядерного матрикса обусловлено металло-протеиновыми взаимодействиями , подобными имеющим место во время выделения матрикса по методикам, базирующимся на включении ионов кальция или меди, а также магния.
 Белковый состав ядерного матрикса очень сильно зависит от способов и условий его выделения. Лишь некоторые из множества матриксных белков выделены и охарактеризованы: • Структурные белки - ламин А , ламин В 1, В 2 и ламин С , нуклеопротеин В-23 и белки остаточных hn. RNP-частиц, матрины; • Регуляторные белки - негистоновые хромосомные белки, ядерные кислые белки, группа ядерных протеинов с высокой подвижностью ( HMG ), различные факторы транскрипции и ферменты метаболизма нуклеиновых кислот. Из них особо надо отметить топоизомеразу II , которая также является одним из компонентов матрикса (и метафазных хромосом ) и присутствует там в достаточно больших количествах, определяя топологический статус хромосомной ДНК. Последовательность одинаково ориентированных ламинов А, В и С (мол. масса 65 -70 к. Д) образуют ядерную ламину (жесткая структура, подстилающая ядерную мембрану, причастная к организации хроматина). Ядерная ламина контактирует с хроматином и ядерными РНК. В результате ассоциации трех главных полипептидов, путем димерного взаимодействия происходит их укладка в 10 -нм структуры, присоединяющиеся к специфическим белкам ядерной мембраны через С-ламин. Вламин, видимо, связан с определенными участками хромосом. Ламин А осуществляет связь между С и В ламинами. Важной функцией полипептидов ядерного матрикса является дезинтеграция ядерной оболочки в процессе митоза. Матринам (matrins) отводится роль основных структурных белков матрикса в узком смысле. Это матрин 3 (12 k. D, обладает слабо кислыми свойствами), матрин 4 (105 k. D, основной), матрин D-G (60 -75 k. D, основной) и матрин 12 и 13 (42 -48 k. D, обладают кислыми свойствами).
Белковый состав ядерного матрикса очень сильно зависит от способов и условий его выделения. Лишь некоторые из множества матриксных белков выделены и охарактеризованы: • Структурные белки - ламин А , ламин В 1, В 2 и ламин С , нуклеопротеин В-23 и белки остаточных hn. RNP-частиц, матрины; • Регуляторные белки - негистоновые хромосомные белки, ядерные кислые белки, группа ядерных протеинов с высокой подвижностью ( HMG ), различные факторы транскрипции и ферменты метаболизма нуклеиновых кислот. Из них особо надо отметить топоизомеразу II , которая также является одним из компонентов матрикса (и метафазных хромосом ) и присутствует там в достаточно больших количествах, определяя топологический статус хромосомной ДНК. Последовательность одинаково ориентированных ламинов А, В и С (мол. масса 65 -70 к. Д) образуют ядерную ламину (жесткая структура, подстилающая ядерную мембрану, причастная к организации хроматина). Ядерная ламина контактирует с хроматином и ядерными РНК. В результате ассоциации трех главных полипептидов, путем димерного взаимодействия происходит их укладка в 10 -нм структуры, присоединяющиеся к специфическим белкам ядерной мембраны через С-ламин. Вламин, видимо, связан с определенными участками хромосом. Ламин А осуществляет связь между С и В ламинами. Важной функцией полипептидов ядерного матрикса является дезинтеграция ядерной оболочки в процессе митоза. Матринам (matrins) отводится роль основных структурных белков матрикса в узком смысле. Это матрин 3 (12 k. D, обладает слабо кислыми свойствами), матрин 4 (105 k. D, основной), матрин D-G (60 -75 k. D, основной) и матрин 12 и 13 (42 -48 k. D, обладают кислыми свойствами).
 Ядерный матрикс: взаимодействие с ДНК Участки ДНК, специфически связывающиеся с ядерным матриксом , принимают, повидимому важное участие в процессах регуляции активности генов , а также в процессах репликации , сплайсинга РНК и ее переноса из ядра в цитоплазму. Ламины, топоизомеразы II, специальные AT-богатые последовательности связывающие белок 1 (SATB 1) и матрикс свзязывающий фактор-B 1 (SAFB 1), являются ключевыми игроками в фундаментальных ядерных процессах. В эукариотических организмах хроматин прикрепляется к ядерной матрице короткими последовательностями ДНК около 100 -2000 п. о. , это так называемый матрикс связывающий регион (MARs). Сильное взаимодействие между MARs и нерастворимыми белками ядерного матрикса защищает эти последовательности от ионного буфера и нуклеаз. Как правило, MAR/SARпоследовательности фланкируют гены, однако в ряде случаев их обнаруживают и внутри генов, но в составе интронов, а также вблизи энхансеров. Взаимодействия ДНК с ядерным матриксом делятся на: • перманентные (то есть присутствующие и в неактивном ядре) • функционально-зависимые (временные, динамические) Высшие структуры хроматина интерфазных и метафазных хромосом, вероятно, будут поддерживаться перманентными MARs. Динамические временные объединения MARs будут вовлечены в геномные функции, так как они соотносятся с транскрипцией или репликацией генетического локуса, с которыми они связаны.
Ядерный матрикс: взаимодействие с ДНК Участки ДНК, специфически связывающиеся с ядерным матриксом , принимают, повидимому важное участие в процессах регуляции активности генов , а также в процессах репликации , сплайсинга РНК и ее переноса из ядра в цитоплазму. Ламины, топоизомеразы II, специальные AT-богатые последовательности связывающие белок 1 (SATB 1) и матрикс свзязывающий фактор-B 1 (SAFB 1), являются ключевыми игроками в фундаментальных ядерных процессах. В эукариотических организмах хроматин прикрепляется к ядерной матрице короткими последовательностями ДНК около 100 -2000 п. о. , это так называемый матрикс связывающий регион (MARs). Сильное взаимодействие между MARs и нерастворимыми белками ядерного матрикса защищает эти последовательности от ионного буфера и нуклеаз. Как правило, MAR/SARпоследовательности фланкируют гены, однако в ряде случаев их обнаруживают и внутри генов, но в составе интронов, а также вблизи энхансеров. Взаимодействия ДНК с ядерным матриксом делятся на: • перманентные (то есть присутствующие и в неактивном ядре) • функционально-зависимые (временные, динамические) Высшие структуры хроматина интерфазных и метафазных хромосом, вероятно, будут поддерживаться перманентными MARs. Динамические временные объединения MARs будут вовлечены в геномные функции, так как они соотносятся с транскрипцией или репликацией генетического локуса, с которыми они связаны.
 MARs и регуляция транскрипции Опишем регуляцию транскрипции на примере Т-клеточной дифференцировки. После стимуляции антигеном, наивный помощник CD 4 T-лимфоцит дифференцируется в эффекторные Th 1 и Th 2 клетки. У мышей, IFNG (ген цитокинов интерферона-γ) будет молчать в наивных Т-лимф-х, но транскрибируется в активированных Th 1 клеток. В наивных Т-лимф-х IFNG существует в линейной конформации, но в Th 1 клетки он присутствует в виде петель, связанных с ядерной матрицей с помощью MARs 7 кб с одной стороны и 14 кб с др. стороны от локуса. Отсутствие селективной привязанности ДНК к ядерной матрице в наивных Тклетках показывает, что динамические связи ДНК с матрицей формируют петли, способствующие экспрессии IFNG локуса. Молекулярные механизмы перманентной связи можно показать на примере локуса, в котором содержится кластер согласованно регулируемых генов IL 4 , IL 13 и IL 5. Эти гены экспрессируются в клетках Th 2, но молчат в наивных Т-лимф-х. После активации Th 2, экспрессия гена SATB 1(специальная AT-богатой последовательностью -связывающий белок-1) быстро индуцируется, и MARs образует мелкие петли, способствующие экспрессии гена. Down-регуляция экспрессии SATB 1 РНКинтерференцией предотвращает как формирование этой петлевой структуры, так и активацию транскрипции локуса. В SATB 1 -null тимоцитах экспрессия многих генов нарушена и Т-клеточное развития в SATB 1 -дефицитных мышей преждевременно блокируется. Эти результаты показывают, что связывание SATB 1 на MARs регулирует экспрессию генов Т-кл дифференцировки по реорганизации хроматина высшего порядка.
MARs и регуляция транскрипции Опишем регуляцию транскрипции на примере Т-клеточной дифференцировки. После стимуляции антигеном, наивный помощник CD 4 T-лимфоцит дифференцируется в эффекторные Th 1 и Th 2 клетки. У мышей, IFNG (ген цитокинов интерферона-γ) будет молчать в наивных Т-лимф-х, но транскрибируется в активированных Th 1 клеток. В наивных Т-лимф-х IFNG существует в линейной конформации, но в Th 1 клетки он присутствует в виде петель, связанных с ядерной матрицей с помощью MARs 7 кб с одной стороны и 14 кб с др. стороны от локуса. Отсутствие селективной привязанности ДНК к ядерной матрице в наивных Тклетках показывает, что динамические связи ДНК с матрицей формируют петли, способствующие экспрессии IFNG локуса. Молекулярные механизмы перманентной связи можно показать на примере локуса, в котором содержится кластер согласованно регулируемых генов IL 4 , IL 13 и IL 5. Эти гены экспрессируются в клетках Th 2, но молчат в наивных Т-лимф-х. После активации Th 2, экспрессия гена SATB 1(специальная AT-богатой последовательностью -связывающий белок-1) быстро индуцируется, и MARs образует мелкие петли, способствующие экспрессии гена. Down-регуляция экспрессии SATB 1 РНКинтерференцией предотвращает как формирование этой петлевой структуры, так и активацию транскрипции локуса. В SATB 1 -null тимоцитах экспрессия многих генов нарушена и Т-клеточное развития в SATB 1 -дефицитных мышей преждевременно блокируется. Эти результаты показывают, что связывание SATB 1 на MARs регулирует экспрессию генов Т-кл дифференцировки по реорганизации хроматина высшего порядка.
 Транскрипция в эукариотических клетках В эукариотических клеток синтез м. РНК сосредоточен в очагах внутри ядра, которые содержат РНК-полимеразы, РНК-транскриптазы, факторы транскрипции м. РНК и факторы обработки. Сохранение РНКполимеразы II и общих факторов транскрипции в ядрах после экстракции растворимых белков и нуклеазы, говорит о том, что транскрипционные факторы собрались на ядерном матриксе. Предполагают, что динамические взаимодействия между MARs и матриксом объединяет проксимальные и дистальные регуляторные последовательности и собирает их близко к факторам транскрипции, тем самым способствуя эффективной регуляции экспрессии генов. Связь MARs и ядерного матрикса топологически ограничивает ДНК в петлю структур, защищая промежуточные ДНК от влияния цисрегуляторных элементов. Таким образом, можно говорить, что MARs выполняет такие функции, как платформа для широкого спектра матричных протеинов Такие взаимодействия образуют сложные нуклеопротеидные структуры, которые: • изолируют домены хроматина • регулируют экспрессию генов
Транскрипция в эукариотических клетках В эукариотических клеток синтез м. РНК сосредоточен в очагах внутри ядра, которые содержат РНК-полимеразы, РНК-транскриптазы, факторы транскрипции м. РНК и факторы обработки. Сохранение РНКполимеразы II и общих факторов транскрипции в ядрах после экстракции растворимых белков и нуклеазы, говорит о том, что транскрипционные факторы собрались на ядерном матриксе. Предполагают, что динамические взаимодействия между MARs и матриксом объединяет проксимальные и дистальные регуляторные последовательности и собирает их близко к факторам транскрипции, тем самым способствуя эффективной регуляции экспрессии генов. Связь MARs и ядерного матрикса топологически ограничивает ДНК в петлю структур, защищая промежуточные ДНК от влияния цисрегуляторных элементов. Таким образом, можно говорить, что MARs выполняет такие функции, как платформа для широкого спектра матричных протеинов Такие взаимодействия образуют сложные нуклеопротеидные структуры, которые: • изолируют домены хроматина • регулируют экспрессию генов
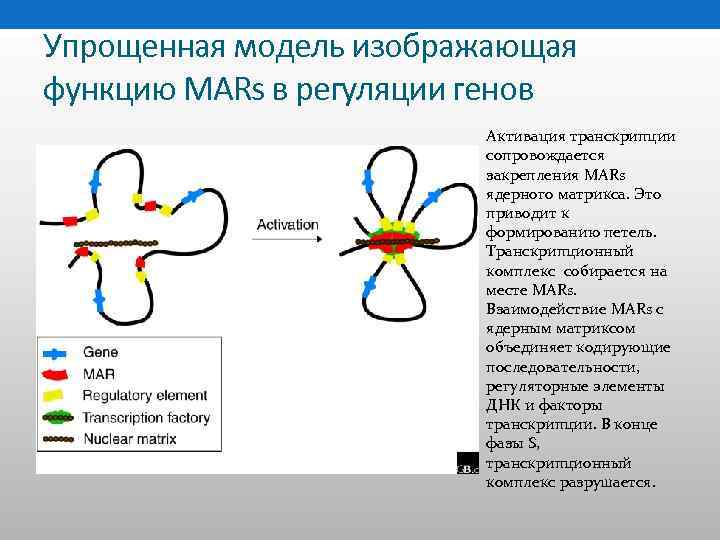 Упрощенная модель изображающая функцию MARs в регуляции генов Активация транскрипции сопровождается закрепления MARs ядерного матрикса. Это приводит к формированию петель. Транскрипционный комплекс собирается на месте MARs. Взаимодействие MARs с ядерным матриксом объединяет кодирующие последовательности, регуляторные элементы ДНК и факторы транскрипции. В конце фазы S, транскрипционный комплекс разрушается.
Упрощенная модель изображающая функцию MARs в регуляции генов Активация транскрипции сопровождается закрепления MARs ядерного матрикса. Это приводит к формированию петель. Транскрипционный комплекс собирается на месте MARs. Взаимодействие MARs с ядерным матриксом объединяет кодирующие последовательности, регуляторные элементы ДНК и факторы транскрипции. В конце фазы S, транскрипционный комплекс разрушается.
 MARs и репликация Чтобы убедиться, что геном копируется точно, и только один раз за клеточный цикл, эукариоты развили сложные механизмы регулирования репликации ДНК. В очаге репликации, ядерный матрикс содержит факторы, необходимые для репликации ДНК: • ДНК-полимеразы • ядерный антиген пролиферирующих клеток (PCNA) • однонитевой связывающий белок (RPA) Считается, что выбор и размер репликона определяется в ранней G 1 фазе. MCM 2 (фактор лицензирования ДНК репликации), ORC 1, 2 (origin recognition complex) загружаются в репликативный комплекс постепенно, но быстро исключаются в S фазу. Это соответствует модели, в которой MARs стабильно закрепляет концы репликона, а во время G 1 происходит присоединение Oris к ядерной матрице, где матрице накапливаются факторы для формирования предварительного репликативного комплекса. Впоследствии, как число Oris увеличивается в фазе S, определенные белковые факторы отсоединяются от хроматина и проходят протеолиз - как часть механизма управления, чтобы предотвратить повторную репликацию - таким образом освобождая Oris от ядерного матрикса. На концах репликона, MARs может выступать в качестве барьеров между соседними репликонами, предотвращая накопление суперспирализованной структуры ДНК, обеспечивая при этом сайты связывания для топоизомеразы II, которая может разрешить репликацию промежуточных продуктов.
MARs и репликация Чтобы убедиться, что геном копируется точно, и только один раз за клеточный цикл, эукариоты развили сложные механизмы регулирования репликации ДНК. В очаге репликации, ядерный матрикс содержит факторы, необходимые для репликации ДНК: • ДНК-полимеразы • ядерный антиген пролиферирующих клеток (PCNA) • однонитевой связывающий белок (RPA) Считается, что выбор и размер репликона определяется в ранней G 1 фазе. MCM 2 (фактор лицензирования ДНК репликации), ORC 1, 2 (origin recognition complex) загружаются в репликативный комплекс постепенно, но быстро исключаются в S фазу. Это соответствует модели, в которой MARs стабильно закрепляет концы репликона, а во время G 1 происходит присоединение Oris к ядерной матрице, где матрице накапливаются факторы для формирования предварительного репликативного комплекса. Впоследствии, как число Oris увеличивается в фазе S, определенные белковые факторы отсоединяются от хроматина и проходят протеолиз - как часть механизма управления, чтобы предотвратить повторную репликацию - таким образом освобождая Oris от ядерного матрикса. На концах репликона, MARs может выступать в качестве барьеров между соседними репликонами, предотвращая накопление суперспирализованной структуры ДНК, обеспечивая при этом сайты связывания для топоизомеразы II, которая может разрешить репликацию промежуточных продуктов.
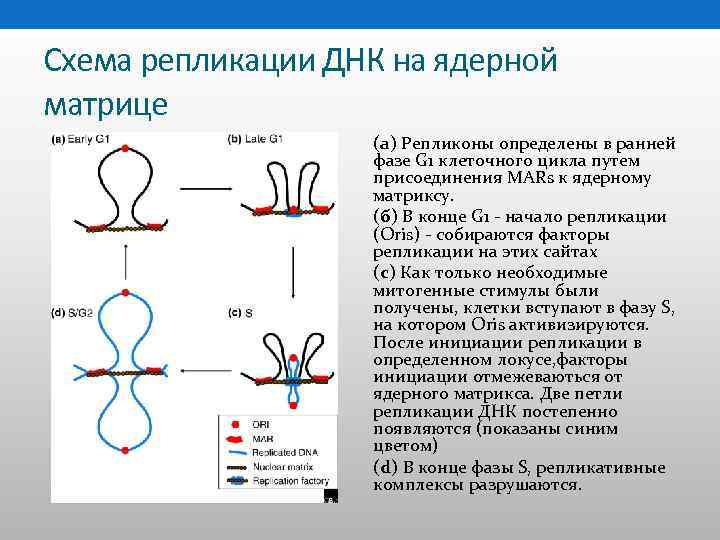 Схема репликации ДНК на ядерной матрице (а) Репликоны определены в ранней фазе G 1 клеточного цикла путем присоединения MARs к ядерному матриксу. (б) В конце G 1 - начало репликации (Oris) - собираются факторы репликации на этих сайтах (с) Как только необходимые митогенные стимулы были получены, клетки вступают в фазу S, на котором Oris активизируются. После инициации репликации в определенном локусе, факторы инициации отмежеваються от ядерного матрикса. Две петли репликации ДНК постепенно появляются (показаны синим цветом) (d) В конце фазы S, репликативные комплексы разрушаются.
Схема репликации ДНК на ядерной матрице (а) Репликоны определены в ранней фазе G 1 клеточного цикла путем присоединения MARs к ядерному матриксу. (б) В конце G 1 - начало репликации (Oris) - собираются факторы репликации на этих сайтах (с) Как только необходимые митогенные стимулы были получены, клетки вступают в фазу S, на котором Oris активизируются. После инициации репликации в определенном локусе, факторы инициации отмежеваються от ядерного матрикса. Две петли репликации ДНК постепенно появляются (показаны синим цветом) (d) В конце фазы S, репликативные комплексы разрушаются.
 Липиды ядерного матрикса • Фосфолипиды ( сфингомиелин – обычно преобладает, ФХ, ФЭ, кардиолипин (у крыс)); • Нейтральные липиды (свободный холестерин, много триглицеридов и свободных жирных кислот, мало эфиров холестерина, а диглицериды вообще отсутствуют (у крыс)). Предполагают два типа контактов петель ДНК с ядерным матриксом: Øдинамичный - функциональный, за счет фосфолипидов , возможно, кардиолипина и сфингомиелина , через его сфингозиновую группу (участие сфингомиелина в точках инициации репликации ДНК на матриксе, тем более, что сфингомиелин оказывает сильный дестабилизирующий эффект на вторичную структуру ДНК); Øстабильный - прочный за счет нейтральных липидов (регуляции синтеза нуклеиновых кислот как на уровне модификации активности протеинкиназы С, так и в результате взаимодействия с матрицей ДНК ( жирные кислоты , холестерин)).
Липиды ядерного матрикса • Фосфолипиды ( сфингомиелин – обычно преобладает, ФХ, ФЭ, кардиолипин (у крыс)); • Нейтральные липиды (свободный холестерин, много триглицеридов и свободных жирных кислот, мало эфиров холестерина, а диглицериды вообще отсутствуют (у крыс)). Предполагают два типа контактов петель ДНК с ядерным матриксом: Øдинамичный - функциональный, за счет фосфолипидов , возможно, кардиолипина и сфингомиелина , через его сфингозиновую группу (участие сфингомиелина в точках инициации репликации ДНК на матриксе, тем более, что сфингомиелин оказывает сильный дестабилизирующий эффект на вторичную структуру ДНК); Øстабильный - прочный за счет нейтральных липидов (регуляции синтеза нуклеиновых кислот как на уровне модификации активности протеинкиназы С, так и в результате взаимодействия с матрицей ДНК ( жирные кислоты , холестерин)).
 СПАСИБО ЗА ВНИМАНИЕ
СПАСИБО ЗА ВНИМАНИЕ


