 Я И П О К С О Р Т К Е У П -С Ф Выполнили: студентки гр. ГГР-2 -2008 Гущина Т. И. Белкина М. А. Проверила: Кузнецова Е. А.
Я И П О К С О Р Т К Е У П -С Ф Выполнили: студентки гр. ГГР-2 -2008 Гущина Т. И. Белкина М. А. Проверила: Кузнецова Е. А.
 Одна из задач, стоящих перед химиками – определение структуры вещества. Для этой цели наиболее часто используют такие инструментальные методы, как электронная, или ультрафиолетовая ( УФ ) спектроскопия , инфракрасная (ИК) спектроскопия , спектроскопия ядерного магнитного резонанса (ЯМР спектроскопия) и масс спектрометрия. Эти методы можно использовать по отдельности, хотя чаще они используются в комплексе, дополняя друга.
Одна из задач, стоящих перед химиками – определение структуры вещества. Для этой цели наиболее часто используют такие инструментальные методы, как электронная, или ультрафиолетовая ( УФ ) спектроскопия , инфракрасная (ИК) спектроскопия , спектроскопия ядерного магнитного резонанса (ЯМР спектроскопия) и масс спектрометрия. Эти методы можно использовать по отдельности, хотя чаще они используются в комплексе, дополняя друга.
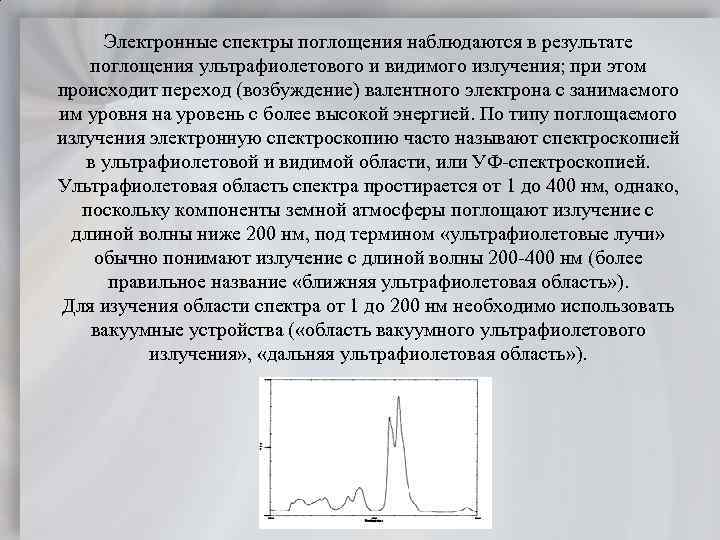 Электронные спектры поглощения наблюдаются в результате поглощения ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентного электрона с занимаемого им уровня на уровень с более высокой энергией. По типу поглощаемого излучения электронную спектроскопию часто называют спектроскопией в ультрафиолетовой и видимой области, или УФ спектроскопией. Ультрафиолетовая область спектра простирается от 1 до 400 нм, однако, поскольку компоненты земной атмосферы поглощают излучение с длиной волны ниже 200 нм, под термином «ультрафиолетовые лучи» обычно понимают излучение с длиной волны 200 400 нм (более правильное название «ближняя ультрафиолетовая область» ). Для изучения области спектра от 1 до 200 нм необходимо использовать вакуумные устройства ( «область вакуумного ультрафиолетового излучения» , «дальняя ультрафиолетовая область» ).
Электронные спектры поглощения наблюдаются в результате поглощения ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентного электрона с занимаемого им уровня на уровень с более высокой энергией. По типу поглощаемого излучения электронную спектроскопию часто называют спектроскопией в ультрафиолетовой и видимой области, или УФ спектроскопией. Ультрафиолетовая область спектра простирается от 1 до 400 нм, однако, поскольку компоненты земной атмосферы поглощают излучение с длиной волны ниже 200 нм, под термином «ультрафиолетовые лучи» обычно понимают излучение с длиной волны 200 400 нм (более правильное название «ближняя ультрафиолетовая область» ). Для изучения области спектра от 1 до 200 нм необходимо использовать вакуумные устройства ( «область вакуумного ультрафиолетового излучения» , «дальняя ультрафиолетовая область» ).
 При поглощении энергии в ультрафиолетовой области электромагнитного спектра электроны связывающих или орбиталей, а также несвязывающих орбиталей (n электроны) могут перейти на различные разрыхляющие орбитали. Таковы переходы n * , и n *, где первая буква означает основное состояние, а вторая – возбужденное. Для перехода * требуется больше энергии, чем для указанных выше, и такой переход можно наблюдать лишь в коротковолновой области вакуумного ультрафиолета. Относительные энергии всех переходов указаны на рис. 1. Рис. 1. Относительные энергии электронных переходов
При поглощении энергии в ультрафиолетовой области электромагнитного спектра электроны связывающих или орбиталей, а также несвязывающих орбиталей (n электроны) могут перейти на различные разрыхляющие орбитали. Таковы переходы n * , и n *, где первая буква означает основное состояние, а вторая – возбужденное. Для перехода * требуется больше энергии, чем для указанных выше, и такой переход можно наблюдать лишь в коротковолновой области вакуумного ультрафиолета. Относительные энергии всех переходов указаны на рис. 1. Рис. 1. Относительные энергии электронных переходов
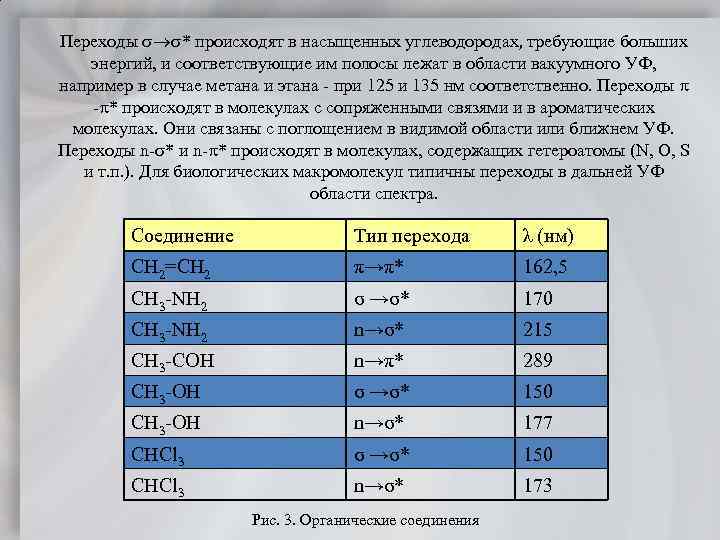 Переходы * происходят в насыщенных углеводородах, требующие больших энергий, и соответствующие им полосы лежат в области вакуумного УФ, например в случае метана и этана при 125 и 135 нм соответственно. Переходы * происходят в молекулах с сопряженными связями и в ароматических молекулах. Они связаны с поглощением в видимой области или ближнем УФ. Переходы n * и n * происходят в молекулах, содержащих гетероатомы (N, O, S и т. п. ). Для биологических макромолекул типичны переходы в дальней УФ области спектра. Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 3 NH 2 σ →σ* 170 CH 3 NH 2 n→σ* 215 CH 3 COH n→π* 289 CH 3 OH σ →σ* 150 CH 3 OH n→σ* 177 CHCl 3 σ →σ* 150 CHCl 3 n→σ* 173 Рис. 3. Органические соединения
Переходы * происходят в насыщенных углеводородах, требующие больших энергий, и соответствующие им полосы лежат в области вакуумного УФ, например в случае метана и этана при 125 и 135 нм соответственно. Переходы * происходят в молекулах с сопряженными связями и в ароматических молекулах. Они связаны с поглощением в видимой области или ближнем УФ. Переходы n * и n * происходят в молекулах, содержащих гетероатомы (N, O, S и т. п. ). Для биологических макромолекул типичны переходы в дальней УФ области спектра. Соединение Тип перехода λ (нм) CH 2=CH 2 π→π* 162, 5 CH 3 NH 2 σ →σ* 170 CH 3 NH 2 n→σ* 215 CH 3 COH n→π* 289 CH 3 OH σ →σ* 150 CH 3 OH n→σ* 177 CHCl 3 σ →σ* 150 CHCl 3 n→σ* 173 Рис. 3. Органические соединения
 Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней УФ области, называется хромофором. Хромофоры – это функциональные группы, которые поглощают электромагнитное излучение независимо от того, возникает при этом окраска или нет. Хромофоры – группировки атомов, содержащие электроны или свободные электронные пары гетероатомов, которые дают свои, характеристические линии поглощения в УФ области спектра (см. табл. 1) Ауксохромы – это функциональные группы, например, –ОН, –ОR, –NH 2, и другие, которые, вступая в сопряжение с хромофором за счет своих неподеленных электронов, становятся частью нового, более протяженного хромофора. В некоторых случаях на интенсивность и положение полосы поглощения влияет природа растворителя или окружение хромофора, причем в результате полоса может сдвигаться как в длинноволновую, так и в коротковолновую область.
Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней УФ области, называется хромофором. Хромофоры – это функциональные группы, которые поглощают электромагнитное излучение независимо от того, возникает при этом окраска или нет. Хромофоры – группировки атомов, содержащие электроны или свободные электронные пары гетероатомов, которые дают свои, характеристические линии поглощения в УФ области спектра (см. табл. 1) Ауксохромы – это функциональные группы, например, –ОН, –ОR, –NH 2, и другие, которые, вступая в сопряжение с хромофором за счет своих неподеленных электронов, становятся частью нового, более протяженного хромофора. В некоторых случаях на интенсивность и положение полосы поглощения влияет природа растворителя или окружение хромофора, причем в результате полоса может сдвигаться как в длинноволновую, так и в коротковолновую область.
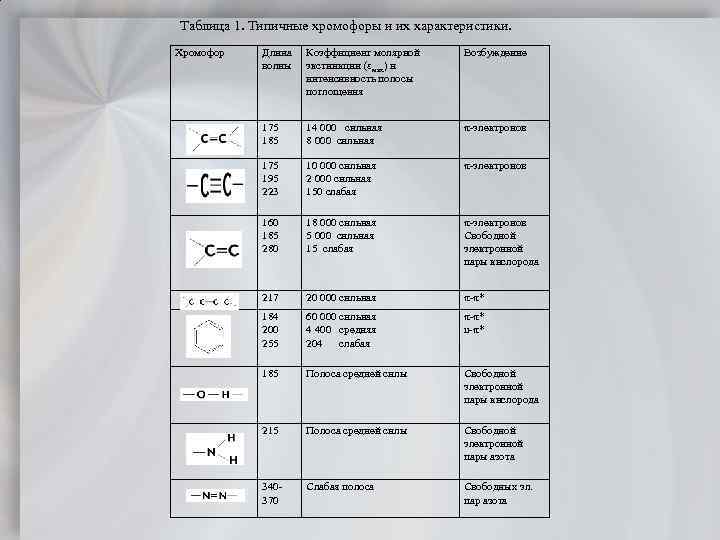 Таблица 1. Типичные хромофоры и их характеристики. Хромофор Коэффициент молярной экстинкции ( мах) и интенсивность полосы поглощения Возбуждение 175 185 Длина волны 14 000 сильная 8 000 сильная электронов 175 195 223 10 000 сильная 2 000 сильная 150 слабая электронов 160 185 280 18 000 сильная 5 000 сильная 15 слабая электронов Свободной электронной пары кислорода 217 20 000 сильная * 184 200 255 60 000 сильная 4 400 средняя 204 слабая * n * 185 Полоса средней силы Свободной электронной пары кислорода 215 Полоса средней силы Свободной электронной пары азота 340 370 Слабая полоса Свободных эл. пар азота
Таблица 1. Типичные хромофоры и их характеристики. Хромофор Коэффициент молярной экстинкции ( мах) и интенсивность полосы поглощения Возбуждение 175 185 Длина волны 14 000 сильная 8 000 сильная электронов 175 195 223 10 000 сильная 2 000 сильная 150 слабая электронов 160 185 280 18 000 сильная 5 000 сильная 15 слабая электронов Свободной электронной пары кислорода 217 20 000 сильная * 184 200 255 60 000 сильная 4 400 средняя 204 слабая * n * 185 Полоса средней силы Свободной электронной пары кислорода 215 Полоса средней силы Свободной электронной пары азота 340 370 Слабая полоса Свободных эл. пар азота
 Количественный анализ в УФ и ВИ спектроскопии Количественный анализ в спектрофотометрической практике основан на использовании закона Ламберта Бера: где I 0 – интенсивность падающего света (квант с 1); I – интенсивность света, прошедшего через раствор или пленку образца; D – поглощение раствора (безразмерная величина) или оптическая плотность или экстинкция, коэффициент молярной экстинкции, отнесенной к единице толщины поглощающего слоя (1 см) и единице концентрации исследуемого раствора С=1 моль/л; l толщина поглощающего слоя. Коэффициент экстинкции является постоянной величиной для данного соединения при данной длине волны. При больших значениях удобно пользоваться его логарифмом lg . Между поглощением (D) и пропусканием (Т) существует следующая зависимость:
Количественный анализ в УФ и ВИ спектроскопии Количественный анализ в спектрофотометрической практике основан на использовании закона Ламберта Бера: где I 0 – интенсивность падающего света (квант с 1); I – интенсивность света, прошедшего через раствор или пленку образца; D – поглощение раствора (безразмерная величина) или оптическая плотность или экстинкция, коэффициент молярной экстинкции, отнесенной к единице толщины поглощающего слоя (1 см) и единице концентрации исследуемого раствора С=1 моль/л; l толщина поглощающего слоя. Коэффициент экстинкции является постоянной величиной для данного соединения при данной длине волны. При больших значениях удобно пользоваться его логарифмом lg . Между поглощением (D) и пропусканием (Т) существует следующая зависимость:
 Современные двухлучевые спектрометры позволяют непосредственно записывать поглощение или пропускание. Спектры поглощения строятся так, что на ординате откладывается поглощение (D) (или lg ) или пропускание (T), а на оси абсцисс – длина волны . В спектрофотометрии также используются такие показатели, как: Если известны коэффициенты молярной экстинкции ( ), толщина кюветы (l), и поглощение (D), то концентрацию хромофорного вещества можно найти количественно, используя закон Ламберта Бера. В некоторых случаях, если концентрация велика, становится функцией С и тогда можно сказать, что закон Бера нарушается. Это может быть результатом рассеяния света или структурных изменений (например, димеризации, агрегации или химических изменений) при высоких концентрациях (рис. 3)
Современные двухлучевые спектрометры позволяют непосредственно записывать поглощение или пропускание. Спектры поглощения строятся так, что на ординате откладывается поглощение (D) (или lg ) или пропускание (T), а на оси абсцисс – длина волны . В спектрофотометрии также используются такие показатели, как: Если известны коэффициенты молярной экстинкции ( ), толщина кюветы (l), и поглощение (D), то концентрацию хромофорного вещества можно найти количественно, используя закон Ламберта Бера. В некоторых случаях, если концентрация велика, становится функцией С и тогда можно сказать, что закон Бера нарушается. Это может быть результатом рассеяния света или структурных изменений (например, димеризации, агрегации или химических изменений) при высоких концентрациях (рис. 3)
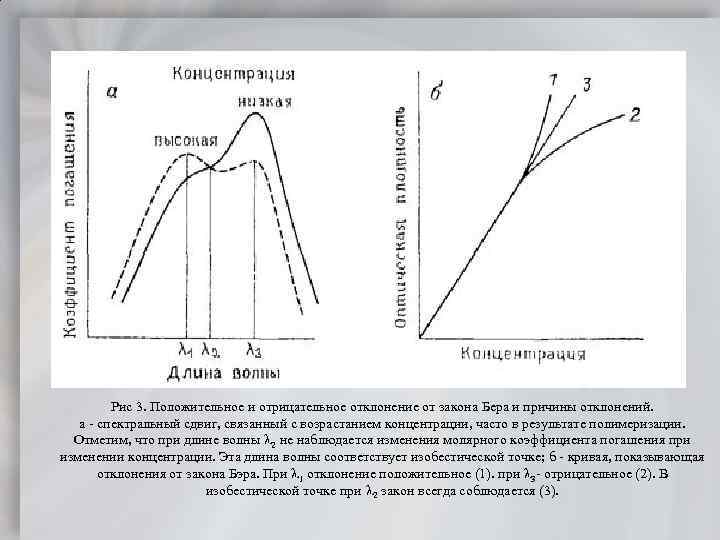 Рис 3. Положительное и отрицательное отклонение от закона Бера и причины отклонений. а спектральный сдвиг, связанный с возрастанием концентрации, часто в результате полимеризации. Отметим, что при длине волны 2 не наблюдается изменения молярного коэффициента погашения при изменении концентрации. Эта длина волны соответствует изобестической точке; б кривая, показывающая отклонения от закона Бэра. При 1 отклонение положительное (1). при 3 отрицательное (2). В изобестической точке при 2 закон всегда соблюдается (3).
Рис 3. Положительное и отрицательное отклонение от закона Бера и причины отклонений. а спектральный сдвиг, связанный с возрастанием концентрации, часто в результате полимеризации. Отметим, что при длине волны 2 не наблюдается изменения молярного коэффициента погашения при изменении концентрации. Эта длина волны соответствует изобестической точке; б кривая, показывающая отклонения от закона Бэра. При 1 отклонение положительное (1). при 3 отрицательное (2). В изобестической точке при 2 закон всегда соблюдается (3).
 Техника измерения УФ спектров Измерение поглощения осуществляют с помощью спектрофотометра. (При описании биохимических образцов почти всегда имеются в виду растворы этих образцов). Несмотря на различия в конструкции, все спектрофотометры состоят из источника света, монохроматора (для выделения определенной длины волны), прозрачной кюветы, куда помещается образец, детектора света и измерительного прибора или самописца для регистрации вы ходного сигнала детектора (рис 2). В спектральных приборах для УФС применяют кварцевые детали (реже флюоритовые или сапфировые), которые не поглощают УФ излучение. Для отражения УФ излучения используют алюминиевые покрытия. Приемниками служат обычные или маложелатиновые фотоматериалы, а также фотоэлектрич. приборы, главным образим фотоэлектронные умножители, счетчики фотонов, фотодиоды, ионизационные камеры. Для увеличения чувствительности при использовании фотоматериалов иногда регистрируют флуоресценцию, вызванную исследуемым УФ излучением. Рис 2. Схематическое устройство спектрофотометра. Свет от лампы 1 проходит через монохроматор 2 для выделения пучка света с определённой длиной волны. Образец 3 и растворитель 4 содержатся в двух кюветах, помещённых в держатель кювет 5. Свет проходит через кювету и падает на фотоэлемент 6, выходной сигнал которого регистрируется измерительным прибором 7. Держатель кюветы находится на направляющих 8, так что каждая кювета может быть независимо помещена в пучок лучей.
Техника измерения УФ спектров Измерение поглощения осуществляют с помощью спектрофотометра. (При описании биохимических образцов почти всегда имеются в виду растворы этих образцов). Несмотря на различия в конструкции, все спектрофотометры состоят из источника света, монохроматора (для выделения определенной длины волны), прозрачной кюветы, куда помещается образец, детектора света и измерительного прибора или самописца для регистрации вы ходного сигнала детектора (рис 2). В спектральных приборах для УФС применяют кварцевые детали (реже флюоритовые или сапфировые), которые не поглощают УФ излучение. Для отражения УФ излучения используют алюминиевые покрытия. Приемниками служат обычные или маложелатиновые фотоматериалы, а также фотоэлектрич. приборы, главным образим фотоэлектронные умножители, счетчики фотонов, фотодиоды, ионизационные камеры. Для увеличения чувствительности при использовании фотоматериалов иногда регистрируют флуоресценцию, вызванную исследуемым УФ излучением. Рис 2. Схематическое устройство спектрофотометра. Свет от лампы 1 проходит через монохроматор 2 для выделения пучка света с определённой длиной волны. Образец 3 и растворитель 4 содержатся в двух кюветах, помещённых в держатель кювет 5. Свет проходит через кювету и падает на фотоэлемент 6, выходной сигнал которого регистрируется измерительным прибором 7. Держатель кюветы находится на направляющих 8, так что каждая кювета может быть независимо помещена в пучок лучей.
 Для возбуждения УФ спектров испускания атомов и молекул служат пламя, дуга постоянного или переменного тока, низко и высоковольтные искры, ВЧ и СВЧ разряд (в т. ч. безэлектродный), плазмотроны, разряд в полом катоде, лазерное излучение и др. УФ спектры поглощения и отражения получают в основном с использованием таких источников излучения, как дейтериевые (водородные), ртутные, ксеноновые и др. газоразрядные лампы. Источниками линейчатых спектров служат спектральные лампы различных конструкций (напр. , с полым катодом). Применяют также лазеры, излучающие в УФ области (водородный лазер).
Для возбуждения УФ спектров испускания атомов и молекул служат пламя, дуга постоянного или переменного тока, низко и высоковольтные искры, ВЧ и СВЧ разряд (в т. ч. безэлектродный), плазмотроны, разряд в полом катоде, лазерное излучение и др. УФ спектры поглощения и отражения получают в основном с использованием таких источников излучения, как дейтериевые (водородные), ртутные, ксеноновые и др. газоразрядные лампы. Источниками линейчатых спектров служат спектральные лампы различных конструкций (напр. , с полым катодом). Применяют также лазеры, излучающие в УФ области (водородный лазер).
 Применение УФ-спектроскопии для количественного определения органических веществ Использование метода УФ спектроскопии эффективно как в случае изучения кинетики реакции, так и при определении примесей в образце органического вещества. Соединения, поглощающие в УФ области с большой интенсивностью, часто могут быть определены даже при низкой концентрации, если они присутствуют в качестве примесей в образцах веществ, имеющих слабое поглощение в области max примеси. Классическим примером является определение бензола, присутствующего в низкой концентрации в качестве примеси в этиловом спирте. Чтобы провести количественное определение вещества спектрофотометрическим методом, необходимо на основании снятого спектра измерить интенсивность поглощения света этим веществом при выбранной длине волны. Однако это возможно лишь в тех случаях, когда установлено, что в интервале возможных концентраций поглощение подчиняется основному закону светопоглощения.
Применение УФ-спектроскопии для количественного определения органических веществ Использование метода УФ спектроскопии эффективно как в случае изучения кинетики реакции, так и при определении примесей в образце органического вещества. Соединения, поглощающие в УФ области с большой интенсивностью, часто могут быть определены даже при низкой концентрации, если они присутствуют в качестве примесей в образцах веществ, имеющих слабое поглощение в области max примеси. Классическим примером является определение бензола, присутствующего в низкой концентрации в качестве примеси в этиловом спирте. Чтобы провести количественное определение вещества спектрофотометрическим методом, необходимо на основании снятого спектра измерить интенсивность поглощения света этим веществом при выбранной длине волны. Однако это возможно лишь в тех случаях, когда установлено, что в интервале возможных концентраций поглощение подчиняется основному закону светопоглощения.
 В то же время следует подчеркнуть, что минимальная ошибка определения получается при тех длинах волн, которые отвечают следующим требованиям: 1) выбранная полоса должна быть по возможности свободна от наложения полос поглощения других компонентов анализируемой системы; 2) выбранная полоса должна обладать достаточно высоким коэффициентом поглощения для индивидуального соединения. Такие полосы называются аналитическими. При анализе используют максимум или минимум полосы поглощения и не следует производить измерения на участках крутого спада или подъема кривой. В ряде случаев для идентификации и количественного определения веществ методом спектрофотометрии требуется сравнение с химическими стандартными образцами. Для проверки пропускания шкалы спектрофотометров используют стандартный образец бихромата калия. Ниже приводятся допустимые значения оптической плотности раствора стандартного образца бихромата калия, содержащего 60, 06 мг в 1000 мл раствора серной кислоты (0, 005 моль/л), при толщине слоя 10 мм: Длина волны λ, нм 235 257 313 350 Оптическая плотность 0, 748 0, 292 0, 640 Определение концентрации вещества в анализируемом растворе проводят одним из следующих методов: 1) по молярному или удельному коэффициентам поглощения; 2) по калибровочному графику.
В то же время следует подчеркнуть, что минимальная ошибка определения получается при тех длинах волн, которые отвечают следующим требованиям: 1) выбранная полоса должна быть по возможности свободна от наложения полос поглощения других компонентов анализируемой системы; 2) выбранная полоса должна обладать достаточно высоким коэффициентом поглощения для индивидуального соединения. Такие полосы называются аналитическими. При анализе используют максимум или минимум полосы поглощения и не следует производить измерения на участках крутого спада или подъема кривой. В ряде случаев для идентификации и количественного определения веществ методом спектрофотометрии требуется сравнение с химическими стандартными образцами. Для проверки пропускания шкалы спектрофотометров используют стандартный образец бихромата калия. Ниже приводятся допустимые значения оптической плотности раствора стандартного образца бихромата калия, содержащего 60, 06 мг в 1000 мл раствора серной кислоты (0, 005 моль/л), при толщине слоя 10 мм: Длина волны λ, нм 235 257 313 350 Оптическая плотность 0, 748 0, 292 0, 640 Определение концентрации вещества в анализируемом растворе проводят одним из следующих методов: 1) по молярному или удельному коэффициентам поглощения; 2) по калибровочному графику.
 Применение УФ-спектроскопии Метод УФ спектроскопии используют для определения содержания в полимерах различных примесей следов веществ, дающих характеристические линии поглощения в исследуемой области УФ спектра. УФС применяют также для изучения кинетики химических и фотохимических реакций, исследования люминесценции, уровней энергии и вероятностей квантовых переходов в твердых телах и т. д. Особое значение имеет УФС для установления состава космических объектов и изучения протекающих на них процессов.
Применение УФ-спектроскопии Метод УФ спектроскопии используют для определения содержания в полимерах различных примесей следов веществ, дающих характеристические линии поглощения в исследуемой области УФ спектра. УФС применяют также для изучения кинетики химических и фотохимических реакций, исследования люминесценции, уровней энергии и вероятностей квантовых переходов в твердых телах и т. д. Особое значение имеет УФС для установления состава космических объектов и изучения протекающих на них процессов.
 вн за о б си а п С м и н а ! е и
вн за о б си а п С м и н а ! е и


