04. подяпольская канцеропревенция, 12.10.16.ppt
- Количество слайдов: 27

Хроническое воспаление слизистой оболочки желудка и Helicobacter pylori, как основа развития рака желудка Подъяпольская И. А. к. м. н. зав. отделением гастроэнтерологии НУЗ ОКБ ст. Барнаул 12. 10. 2016 г.

• • Оценочные стандартизированный по возрасту заболеваемость и смертность: Мужчины Женщины Рак желудка занимает 5 -е место среди самых распространенных онкологических заболеваний и 3 -е место в структуре смертности от ЗНО в мире
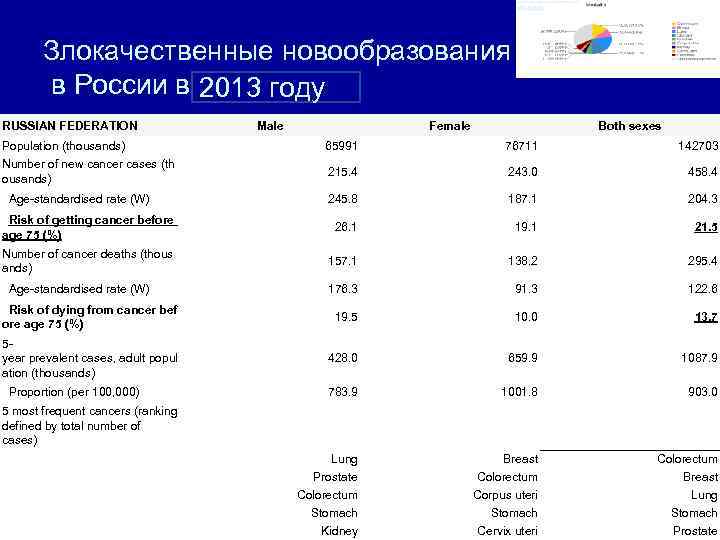
Злокачественные новообразования в России в 2012 году 2013 году RUSSIAN FEDERATION Male Female Both sexes Population (thousands) 65991 76711 142703 Number of new cancer cases (th ousands) 215. 4 243. 0 458. 4 Age-standardised rate (W) 245. 8 187. 1 204. 3 Risk of getting cancer before age 75 (%) 26. 1 19. 1 21. 5 Number of cancer deaths (thous ands) 157. 1 138. 2 295. 4 Age-standardised rate (W) 176. 3 91. 3 122. 6 Risk of dying from cancer bef ore age 75 (%) 19. 5 10. 0 13. 7 5 year prevalent cases, adult popul ation (thousands) 428. 0 659. 9 1087. 9 Proportion (per 100, 000) 783. 9 1001. 8 903. 0 5 most frequent cancers (ranking defined by total number of cases) Lung Breast Colorectum В структуре заболеваемости ЗНО рак желудка занимал 4 -е ранговое место у Prostate Colorectum Breast мужчин и женщин. Colorectum Corpus uteri Lung В структуре смертности от ЗНО рак желудка занимал в 2012 году 4 -е ранговое Stomach Kidney Cervix uteri Prostate место.

Рак желудка в России • Пик заболеваемости раком желудка приходится на возраст 66 лет (максимум заболеваемости в возрасте 60 -64 гг. ). • Кумулятивный риск развития рака желудка составляет 2, 37%. • Доля лиц, у которых рак желудка выявлен при профилактических обследовании – 0, 2%. • В России рак желудка I стадии опухолевого процесса диагностируется менее чем в 10%, в Европе – в 21%, в Японии – в 57% случаев. А. Д. Каприн, В. В. Старинский, 2015, 2016 SEER US Registry, 2014

Распространенность инфекции H. pylori в случаях некардиогенного рака желудка Int J Cancer. 2015 Jan 15; 136(2): 487 -90. doi: 10. 1002/ijc. 28999. Epub 2014 Jun 11. Global burden of gastric cancer attributable to Helicobacter pylori. Plummer M 1, Franceschi S, Vignat J, Forman D, de Martel C. Author information Abstract We previously estimated that 660, 000 cases of cancer in the year 2008 were attributable to the bacterium Helicobacter pylori (H. pylori), corresponding to 5. 2% of the 12. 7 million total cancer cases that occurred worldwide. In recent years, evidence has accumulated that immunoblot (western blot) is more sensitive for detection of anti-H. pylori antibodies than ELISA, the detection method used in our previous analysis. The purpose of this short report is to update the attributable fraction (AF) estimate for H. pylori after briefly Некардиогенный рак желудка связан с инфекцией H. pylori в 89% случаев. reviewing new evidence, and to reassess the global burden of cancer attributable to H. pylori. We therefore reviewed the literature for studies comparing the risk of developing non-cardia gastric cancer (NCGC) in cases and controls, using both ELISA and multiple antigen immunoblot for detection of H. pylori. The results from prospective studies were combined, and the new pooled estimates were applied to the calculation of the AF for H. pylori in NCGC, then to the burden of infection-related cancers worldwide. Using the immunoblot-based data, the worldwide AF for H. pylori in NCGC increased from 74. 7% to 89. 0%. This implies approximately 120, 000 additional cases of NCGC attributable to H. pylori infection for a total of around 780, 000 cases (6. 2% instead of 5. 2% of all cancers). These updated estimates reinforce the role of H. pylori as a major cause of cancer.

Факторы вирулентности и патогенности H. pylori • • • Имеет жгутики Липополисахариды и белки способствуют адгезии к оболочке клеточных мембран Секретирует оксидазу, каталазу, уреазу – фермент, расщепляющий мочевину до аммиака → нейтрализация соляной кислоты → повышение р. Н + химическое раздражение СО аммиаком Секретирует ферменты: муциназа, протеаза, липаза – растворяет защитный слой желудочной слизи Способна формировать биопленки, способствующие невосприимчимости к антибактериальным препаратам и защищающие от иммунитета Способна превращаться в кокковые формы –устойчивость к неблагоприятным факторам внешней среды.

Факторы канцерогенности H. pylori • • Вырабатывает экзотоксин (ген vac. A), образующий вакуоли и повреждающий клетки СО желудка. «Инжекторная система» позволяет «впрыскивать» в клетки эффекторные белки (кодируются геном cag. A (+) штаммы), вызывающие: – Воспаление – Повышение продукции интерлейкина-В – Угнетение апоптоза – Избыточный рост определенного вида клеток (пролиферация, резистентная к сигналам апоптоза) Активация медиаторов активного воспаления Активация ростовых факторов

Механизм развития рака желудка. Каскад Корреа. 1, 2 Нормальная слизистая оболочка желудка Поверхностный гастрит 1. Способна ли эрадикация H. pylori предотвратить рак желудка? гастрит Атрофический 2. Когда наиболее оптимально проводить эрадикационную терапию? Кишечная метаплазия Дисплазия Аденокарцинома желудка 1. Steisenger and Fordtran’s gastrointestinal and liver disease: pathophysiology, diagnosis, management/edited by Mark Feldman, Lawrence S Friedman, Lawrence J Brandt. – 9 th ed. ISBN: 978 -1 -4160 -6189 -2, page 889, 2010 2. Correa P. , Is gastric cancer preventable? Gut. 2004 Sep; 53 (9): 1217 -9

Метанализ исследований по изучению влияния эрадикационной терапии на заболеваемость раком желудка • Метанализ 6 рандомизированных контролированных исследований (Япония, Китай, Колумбия) • Время наблюдения 4 -14, 7 лет; NNT от 15 (Китай) до 245 (США) Эрадикация H. pylori достоверно снижает заболеваемость рака желудка на 34% среди бессимптомного населения по сравнению с контрольной группой Ford AC, Forman D, Hunt RH, Yuan Y, Moayyedi P. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials. BMJ. 2014; 348: g 3174.
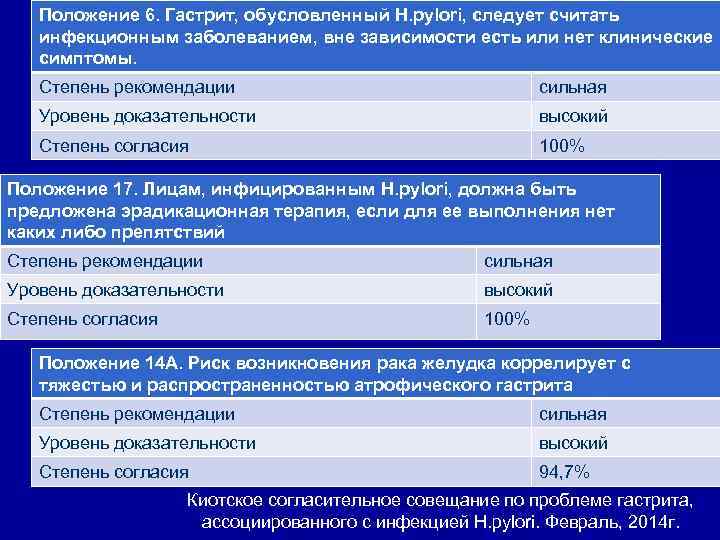
Положение 6. Гастрит, обусловленный H. pylori, следует считать инфекционным заболеванием, вне зависимости есть или нет клинические симптомы. Степень рекомендации сильная Уровень доказательности высокий Степень согласия 100% Положение 17. Лицам, инфицированным H. pylori, должна быть предложена эрадикационная терапия, если для ее выполнения нет каких либо препятствий Степень рекомендации сильная Уровень доказательности высокий Степень согласия 100% Положение 14 А. Риск возникновения рака желудка коррелирует с тяжестью и распространенностью атрофического гастрита Степень рекомендации сильная Уровень доказательности высокий Степень согласия 94, 7% Киотское согласительное совещание по проблеме гастрита, ассоциированного с инфекцией H. pylori. Февраль, 2014 г.

Положение 20. Эрадикация инфекции H. pylori снижает риск развития рака желудка. Степень снижения риска зависит от: • наличия, выраженности и распространения атрофических изменений в желудке • времени эрадикационной терапии Степень рекомендации сильная Уровень доказательности высокий Степень согласия 100% Положение 18. Максимальный эффект эрадикационной терапии достигается, когда она проводится до возникновения атрофических изменений слизистой оболочки Степень рекомендации сильная Уровень доказательности высокий Степень согласия 100% Киотское согласительное совещание по проблеме гастрита, ассоциированного с инфекцией H. pylori. Февраль, 2014 г.

Изменения слизистой оболочки после эрадикационной терапии 2013 May; 62(5): 676 -82. doi: 10. 1136/gutjnl-2012 -302240. Epub 2012 Jun 14. The benefit of mass eradication of Helicobacter pylori infection: a community-based study of gastric cancer prevention. Lee YC 1, Chen TH, Chiu HM, Shun CT, Chiang H, Liu TY, Wu MS, Lin JT. OBJECTIVE: To evaluate the benefit of mass eradication of Helicobacter pylori infection in reducing premalignant gastric lesions. DESIGN: Mass eradication of H pylori infection was started from 2004 for a Taiwanese population with prevalent H pylori infection, who were >30 years of age. Participants positive for the (13)C-urea breath test underwent endoscopic screening and 1 -week clarithromycin-based triple therapy. For subjects whose initial treatment failed, 10 -day levofloxacin-based triple therapy was administered. The main outcome measures were changes in the prevalence of H pylori infection and premalignant gastric lesions, and changes in the incidence of premalignant gastric lesions and gastric cancer before (1995 -2003) and after (2004 -2008) chemoprevention using various comparators. RESULTS: The reduction in H pylori infection was 78. 7% (95% CI 76. 8% to 80. 7%), and the estimated incidence of reinfection/recrudescence was 1% (95% CI 0. 6% to 1. 4%) person-year. The effectiveness of reducing the incidence of gastric atrophy resulting from chemoprevention was significant at 77. 2% (95% CI 72. 3% to 81. 2%), while the reduction in intestinal metaplasia was not significant. Compared with the 5 -year period before chemoprevention and in the absence of endoscopic screening, the effectiveness in reducing gastric cancer incidence during the chemoprevention period was 25% (rate ratio 0. 753, 95% CI 0. 372 to 1. 524). The reduction in peptic ulcer disease was 67. 4% (95% CI 52. 2% to 77. 8%), while the incidence of oesophagitis was 6% (95% CI 5. 1% to 6. 9%) after treatment. CONCLUSIONS: Population-based eradication of H pylori infection has led to a significant reduction in gastric atrophy at the expense of increased oesophagitis. The ultimate benefit in reducing gastric cancer incidence and its mortality should be validated by a further long-term follow-up. Эрадикационная терапия оказывает положительный эффект на остановку прогрессирования предраковых состояний желудка: отмечается регресс атрофии в антральном отделе желудка и тела желудка и кишечной метаплазии в антральном отделе желудка, однако регрессии кишечной метаплазии в теле желудка отмечено не было.

Методы диагностики инфекции H. pylori Инвазивные Неинвазивные требуют проведения ФГДС не требуют проведения и биопсии ФГДС и биопсии • Культуральный метод • ИФА крови (Ig G) • • Гистологический метод • Быстрый уреазный тест • • ПЦР исследование биоптата ИФА/ИХА кала Уреазный дыхательный тест (13 С)

Факторы, снижающие чувствительность в диагностики H. pylori Фактор Потенциальные механизмы Выраженная атрофия СОЖ Низкая секреция соляной кислоты; повреждение СОЖ, рост уреазаположительных бактерий Выраженная кишечная метаплазия СОЖ Низкая секреция соляной кислоты, рост уреаза-положительных бактерий MALT-лимфома желудка Диффузное поражение СОЖ Использование антибиотиков Прямой антибактериальный эффект, снижение бактериальной плотности Использование ИПП или Н 2 блокаторов Образование кокковых форм, снижение выработки уреазы

Стратегия “endoscope and treat” Концепция «тестируй и лечи» подходит только для стран с низкой распространенности инфицирования населения H. pylori и низкой заболеваемостью рака желудка В Российской Федерации следует применять концепцию «назначь эндоскопическое обследование и лечи» “endoscope and treat” применяется у групп пациентов с высоким риском рака желудка с учетом: • Возраста или • Семейного анамнеза или • Наличия симптомов «тревоги» : потеря веса, дисфагия, признаки кровотечения, наличие объемных образований в брюшной полости, железодефицитной анемии, онкологических заболеваний других локализаций.

Порядок назначения схем эрадикации H. pylori Выбор Название схемы эрадикационной схемы 1 -я линия Препараты ИПП в стандартной дозе 2 раза/сутки + ТЕТ 500 мг 4 раза/сутки + МЕТ 500 мг 3 раза/сутки + ВТД (Де-Нол)120 мг 4 раза/сутки Длительность терапии 10 дней Квадротерапия с препаратом висмута ИПП в стандартной дозе 2 раза/сутки + ТЕТ 500 мг 4 раза/сутки + МЕТ 500 мг 3 раза/сутки + ВТД (Де-Нол)120 мг 4 раза/сутки Длительность терапии 10 дней Тройная терапия с левофлоксацином 3 -я линия ИПП в стандартной дозе 2 раза/сутки + КЛА 500 мг 2 раза/сутки + АМО 1000 мг 2 раза/сутки (или МЕТ 500 мг 2 раза/сутки. Длительность терапии 7 или 10 -14 дней Квадротерапия с препаратом висмута 2 -я линия Стандартная тройная схема ИПП в стандартной дозе 2 раза/сутки + ЛЕВ 500 мг 2 раза/сутки + АМО 1000 мг 2 раза/сутки Длительность терапии 10 дней Основана на определении антибиотикорезистентности H. pylori. Сокращения: ИПП - ингибитор протонной помпы; КЛА - кларитромицин; АМО - амоксициллин; МЕТ - метронидазол; ТЕТ - тетрациклин; ВТД - висмута трикалия дицитрат (Де-Нол); ЛЕВ - левофлоксацин. Ивашкин В. Т. , Маев И. В. , Лапина Т. Л. , Шептулин А. А. и комитет экспертов. Рекомендации Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых // Рос. журн. гастроэнт. , гепатол. , колопроктол. 2012, № 1, С. 87 -89


Тройная терапия + висмута трикалия дицитрат (Де-нол) Автор Год Схемы Тройная +ВТД Разница Sun Q. 2010 ИПП + КЛА +АМО ИПП +КЛА +АМО +ВТД 72% 97% ↑ 22% Ghadir M. R. 2011 ИПП + ФУР + АМО + ВТД 61% 85% ↑ 24% Ciccaglione A. F. 2012 ИПП + МОКСИ + АМО + ВТД 78% 93% ↑ 15% Лазебник Л. Б. 2010 ИПП + КЛА +АМО ИПП +КЛА +АМО +ВТД 73% 93% ↑ 20% Маев И. В. 2012 ИПП + КЛА +АМО ИПП +КЛА +АМО +ВТД 73% 95% ↑ 23% Ergul B. 2013 ИПП + КЛА +АМО ИПП +КЛА +АМО +ВТД 61% 90% ↑ 29%

Положение 21. Контроль эрадикации должен проводиться во всех случаях, при чем желательно неинвазивным методом Степень рекомендации сильная Уровень доказательности высокий Степень согласия 100% Положение 22. Эрадикация H. pylori может не полностью устранять риск развития рака желудка. Пациенты с выраженной атрофией СО, ЯБ Ж, с уровнем пепсиногена I менее 70 нг/м, отношение пепсиноген I/пепсиноген II – менее 3, а так же пациентам, имеющим высокий риск развития дисплазии и раннего рака желудка подлежат в дальнейшем динамическому наблюдению с эндоскопическим и гистологическим контролем Степень рекомендации сильная Уровень доказательности высокий Степень согласия 97, 3% Киотское согласительное совещание по проблеме гастрита, ассоциированного с инфекцией H. pylori. Февраль, 2014 г.

Назначение висмута трикалия дицитрата Антихеликобактерное действие: повышение эффективности эрадикационной терапии (как в схемах квадротерапии, так и в период долечивания) Bi H. pylori Профилактика риска Bi Bi развития рака желудка üАнтиоксидантное действие Первичная üЦитопротективное профилактика действие Вторичная профилактика Bi Третичная профилактика



Резюме: 1. 2. 3. 4. 5. 6. 7. 8. H. pylori – канцероген первого порядка для кишечного типа рака желудка. В Российской Федерации применять концепцию «назначь эндоскопическое обследование и лечи» (endoscope and treat). Первичная профилактика рака желудка кишечного типа – эрадикация H. pylori (еще до появления признаков атрофии СОЖ). Вторичная профилактика рака желудка – выявление пациентов группы риска его развития (больные с «предраковыми» заболеваниями желудка, отягощенной наследственностью, наличием симптомов «тревоги» , больные со злокачественными опухолями другой локализации, в том числе и вылеченные). Эрадикация H. pylori может прервать каскад предраковых заболеваний каскада Корреа на этапе неатрофического гастрита, в ряде случаев мультифокального атрофического гастрита. С целью увеличения эффективности эрадикации необходимо назначать эрадикационную терапию не менее чем на 10 дней, с использованием оригинальных антибактериальных препаратов, двойных доз ИПП, добавлением в схему лечения висмута трикалия дицитрата (Де-Нол). Необходимо использовать в качестве вторичной и третичной профилактики рака желудка висмута трикалия дицитрат (Де-Нол). Убедительных доказательств, что эрадикация НР ведет к регрессии кишечной метаплазии, пока не получено.

Хороший геликобактер – мертвый хеликобактер


Хроническое воспаление слизистой оболочки желудка и Helicobacter pylori, как основа развития рака желудка Подъяпольская И. А. к. м. н. зав. отделением гастроэнтерологии НУЗ ОКБ ст. Барнаул т. (3852) 20 -12 -83.
04. подяпольская канцеропревенция, 12.10.16.ppt