ХЛЛ Орел.pptx
- Количество слайдов: 180
 Хронический лимфолейкоз Стадник Елена Александровна Орел, 7 июня 2013 года
Хронический лимфолейкоз Стадник Елена Александровна Орел, 7 июня 2013 года
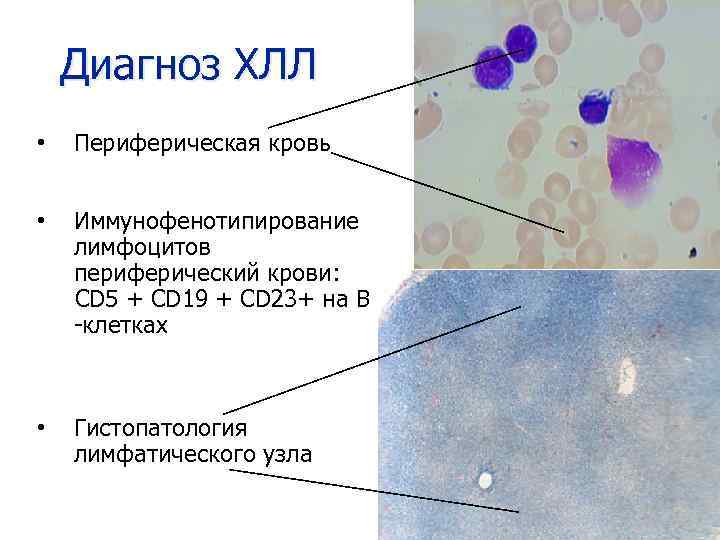 Диагноз ХЛЛ • Периферическая кровь • Иммунофенотипирование лимфоцитов периферический крови: CD 5 + CD 19 + CD 23+ на B -клетках • Гистопатология лимфатического узла
Диагноз ХЛЛ • Периферическая кровь • Иммунофенотипирование лимфоцитов периферический крови: CD 5 + CD 19 + CD 23+ на B -клетках • Гистопатология лимфатического узла
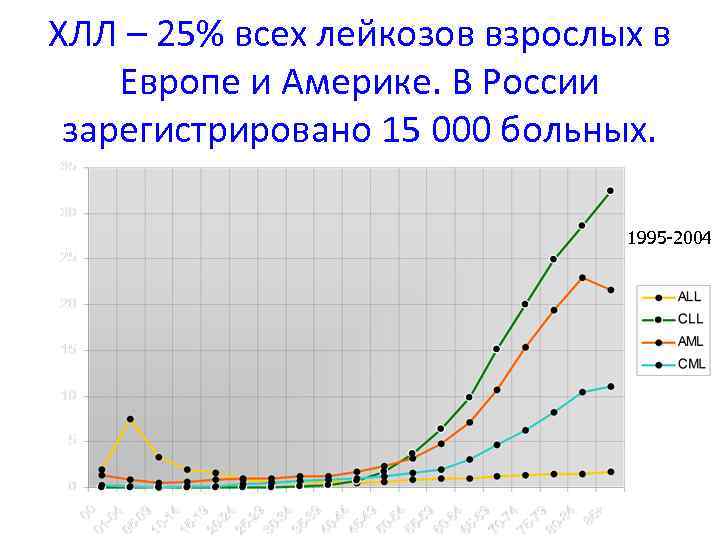 ХЛЛ – 25% всех лейкозов взрослых в Европе и Америке. В России зарегистрировано 15 000 больных. 1995 -2004
ХЛЛ – 25% всех лейкозов взрослых в Европе и Америке. В России зарегистрировано 15 000 больных. 1995 -2004
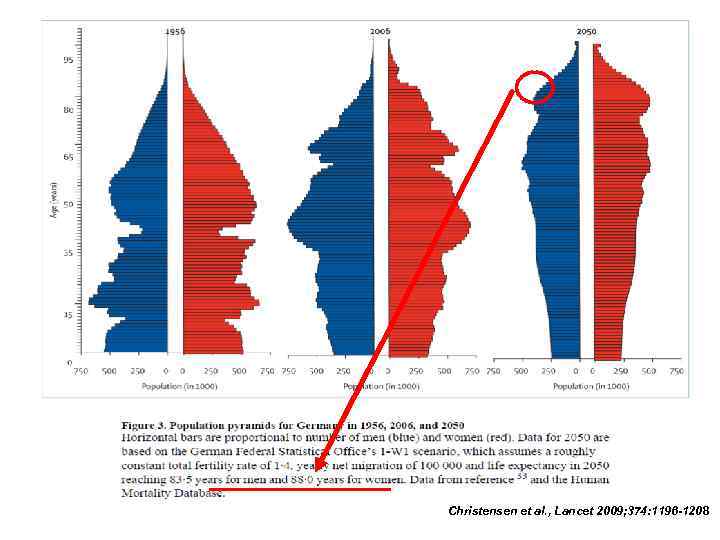 Christensen et al. , Lancet 2009; 374: 1196 -1208
Christensen et al. , Lancet 2009; 374: 1196 -1208
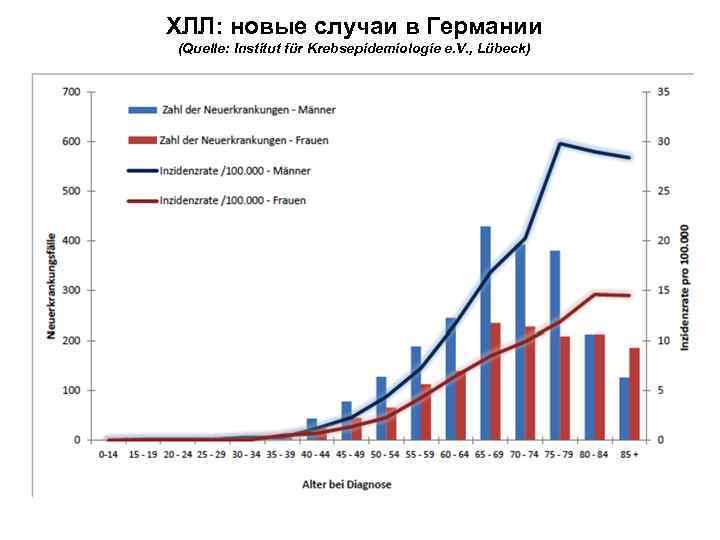 ХЛЛ: новые случаи в Германии (Quelle: Institut für Krebsepidemiologie e. V. , Lübeck)
ХЛЛ: новые случаи в Германии (Quelle: Institut für Krebsepidemiologie e. V. , Lübeck)
 Наследственная предрасположенность к развитию ХЛЛ Наличие случаев ХЛЛ в семье — наиболее важный фактор риска развития заболевания ХЛЛ наследуется вдвое чаще, чем рак толстой кишки или рак молочной железы У 8 -10% пациентов в семейном анамнезе есть указания на случаи ХЛЛ Относительный риск развития ХЛЛ при наличии больного родственника первой степени - от 7 до 8, 5 Первый локус, связь которого с наследственным ХЛЛ убедительно доказана - 2 q 12. 2
Наследственная предрасположенность к развитию ХЛЛ Наличие случаев ХЛЛ в семье — наиболее важный фактор риска развития заболевания ХЛЛ наследуется вдвое чаще, чем рак толстой кишки или рак молочной железы У 8 -10% пациентов в семейном анамнезе есть указания на случаи ХЛЛ Относительный риск развития ХЛЛ при наличии больного родственника первой степени - от 7 до 8, 5 Первый локус, связь которого с наследственным ХЛЛ убедительно доказана - 2 q 12. 2
 Что изменилось? • С появлением иммунофенотипирования ХЛЛ четко выделен из группы лимфопролиферативнх заболеваний • Течение заболевания гетерогенно, большинство пациентов умирают от осложнений ХЛЛ • При одинаковой морфологии и иммунофенотипе клетки ХЛЛ имеют разные биологические характеристики • Появились новые маркеры прогноза • Изменились подходы к терапии, появились новые препараты и комбинации
Что изменилось? • С появлением иммунофенотипирования ХЛЛ четко выделен из группы лимфопролиферативнх заболеваний • Течение заболевания гетерогенно, большинство пациентов умирают от осложнений ХЛЛ • При одинаковой морфологии и иммунофенотипе клетки ХЛЛ имеют разные биологические характеристики • Появились новые маркеры прогноза • Изменились подходы к терапии, появились новые препараты и комбинации
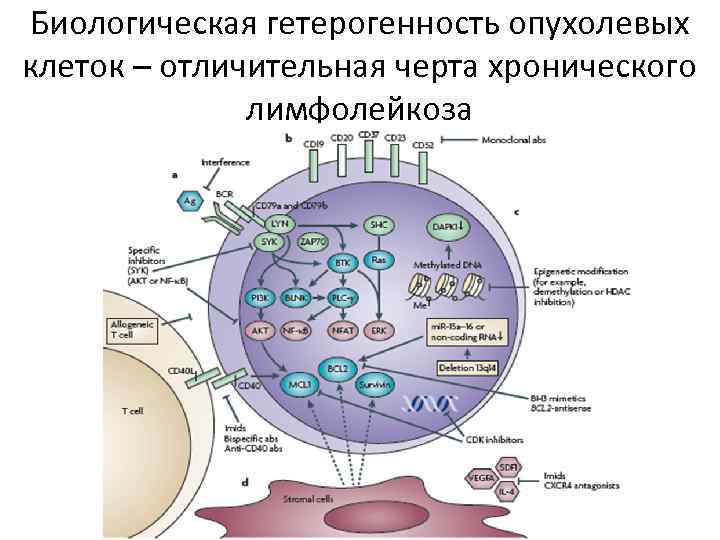 Биологическая гетерогенность опухолевых клеток – отличительная черта хронического лимфолейкоза
Биологическая гетерогенность опухолевых клеток – отличительная черта хронического лимфолейкоза
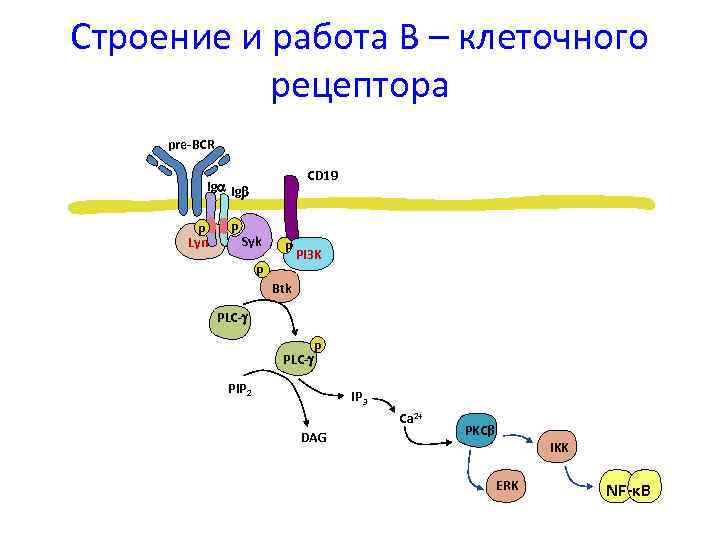 Строение и работа В – клеточного рецептора pre-BCR CD 19 Ig Ig P Lyn P Syk P P PI 3 K Btk PLC- PIP 2 IP 3 Ca 2+ DAG PKCβ IKK ERK NF-κB
Строение и работа В – клеточного рецептора pre-BCR CD 19 Ig Ig P Lyn P Syk P P PI 3 K Btk PLC- PIP 2 IP 3 Ca 2+ DAG PKCβ IKK ERK NF-κB
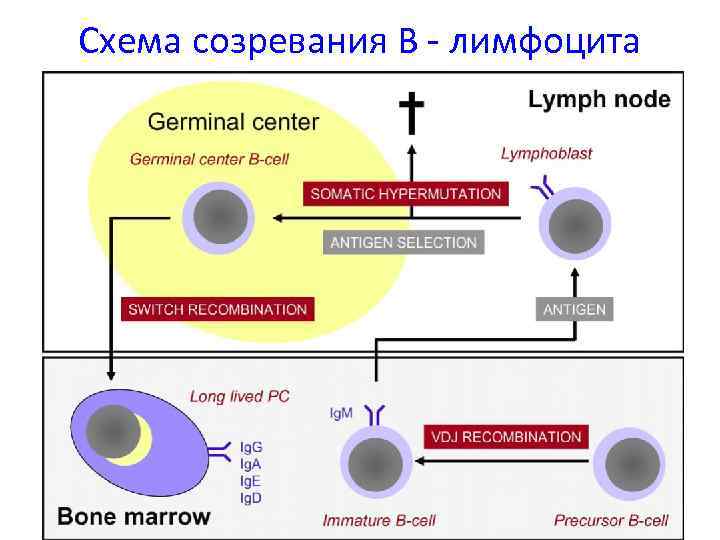 Схема созревания В - лимфоцита
Схема созревания В - лимфоцита
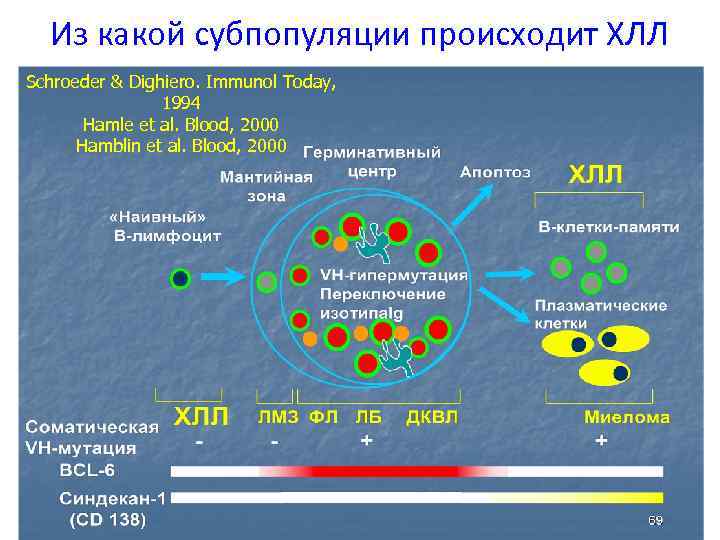 Из какой субпопуляции происходит ХЛЛ Schroeder & Dighiero. Immunol Today, 1994 Hamle et al. Blood, 2000 Hamblin et al. Blood, 2000
Из какой субпопуляции происходит ХЛЛ Schroeder & Dighiero. Immunol Today, 1994 Hamle et al. Blood, 2000 Hamblin et al. Blood, 2000
 Разное биологическое происхождение клеток при хроническом лимфолейкозе
Разное биологическое происхождение клеток при хроническом лимфолейкозе
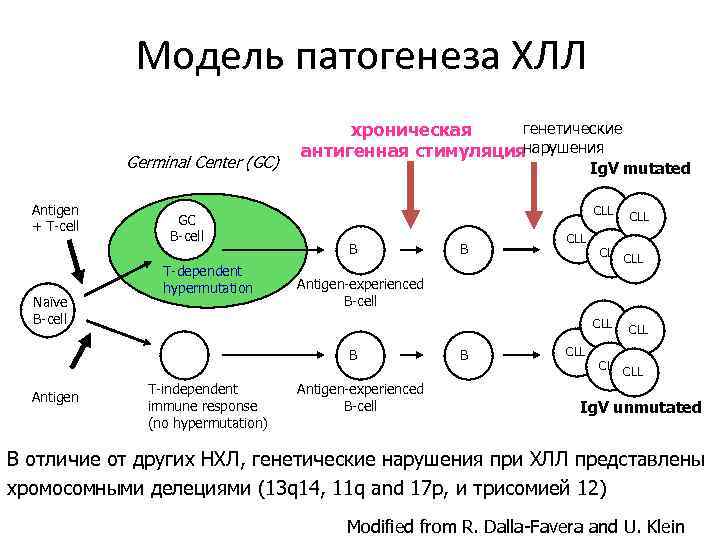 Модель патогенеза ХЛЛ Germinal Center (GC) Antigen + T-cell Naïve B-cell GC B-cell T-dependent hypermutation генетические хроническая антигенная стимуляциянарушения Ig. V mutated CLL B CLL CLL Antigen-experienced B-cell CLL B Antigen B T-independent immune response (no hypermutation) CLL Antigen-experienced B-cell B CLL CLL Ig. V unmutated В отличие от других НХЛ, генетические нарушения при ХЛЛ представлены хромосомными делециями (13 q 14, 11 q and 17 p, и трисомией 12) Modified from R. Dalla-Favera and U. Klein
Модель патогенеза ХЛЛ Germinal Center (GC) Antigen + T-cell Naïve B-cell GC B-cell T-dependent hypermutation генетические хроническая антигенная стимуляциянарушения Ig. V mutated CLL B CLL CLL Antigen-experienced B-cell CLL B Antigen B T-independent immune response (no hypermutation) CLL Antigen-experienced B-cell B CLL CLL Ig. V unmutated В отличие от других НХЛ, генетические нарушения при ХЛЛ представлены хромосомными делециями (13 q 14, 11 q and 17 p, и трисомией 12) Modified from R. Dalla-Favera and U. Klein
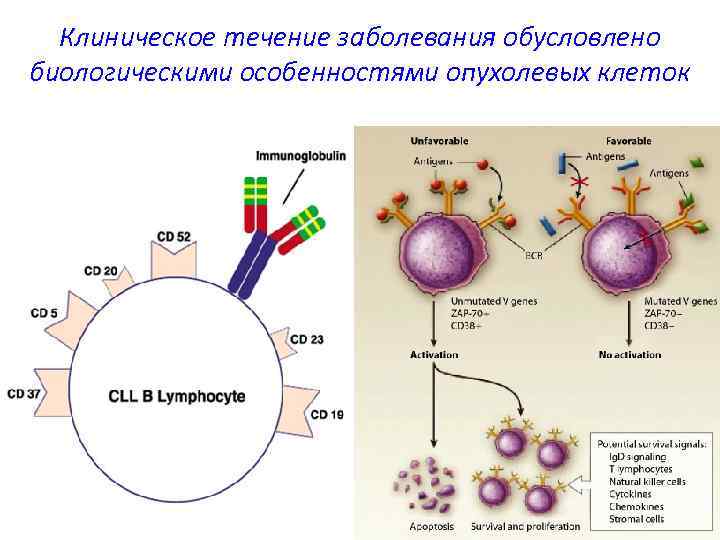 Клиническое течение заболевания обусловлено биологическими особенностями опухолевых клеток
Клиническое течение заболевания обусловлено биологическими особенностями опухолевых клеток
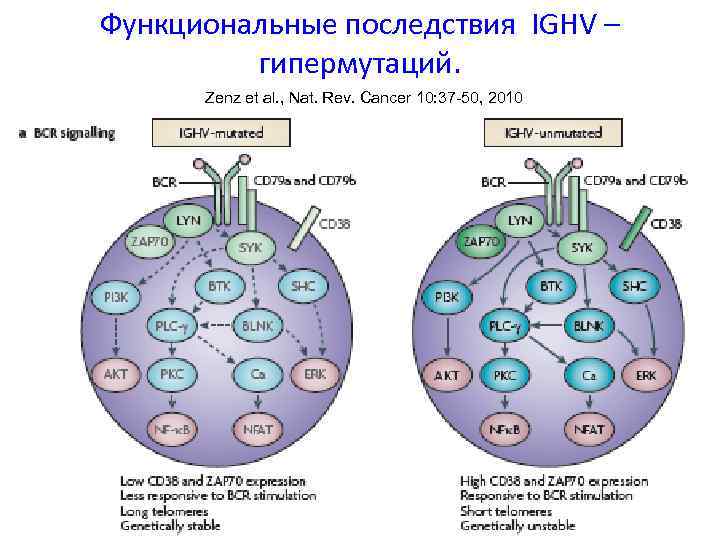 Функциональные последствия IGHV – гипермутаций. Zenz et al. , Nat. Rev. Cancer 10: 37 -50, 2010
Функциональные последствия IGHV – гипермутаций. Zenz et al. , Nat. Rev. Cancer 10: 37 -50, 2010
 Традиционное представление о развитии рака • Появление генетических аномалий (онкогенез). • Автономная пролиферация клеток • Появление опухолевого клона • В целом «поведение» опухоли определяется индивидуальными особенностями опухолевой клетки
Традиционное представление о развитии рака • Появление генетических аномалий (онкогенез). • Автономная пролиферация клеток • Появление опухолевого клона • В целом «поведение» опухоли определяется индивидуальными особенностями опухолевой клетки
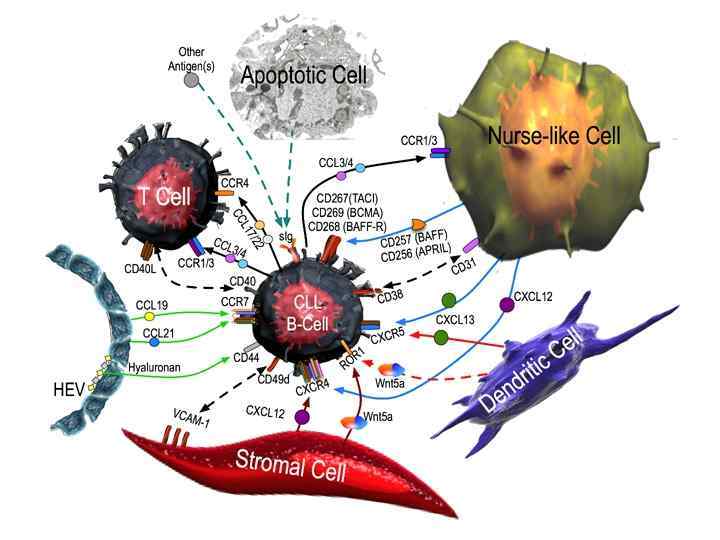
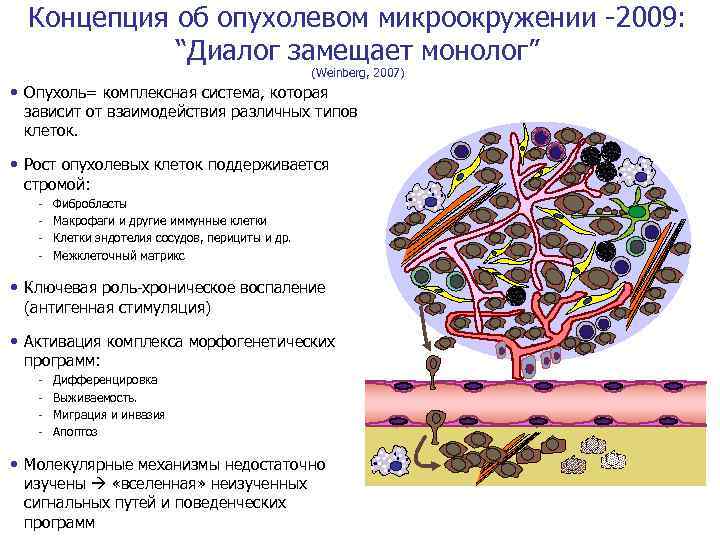 Концепция об опухолевом микроокружении -2009: “Диалог замещает монолог” (Weinberg, 2007) • Опухоль= комплексная система, которая зависит от взаимодействия различных типов клеток. • Рост опухолевых клеток поддерживается стромой: - Фибробласты Макрофаги и другие иммунные клетки Клетки эндотелия сосудов, перициты и др. Межклеточный матрикс • Ключевая роль-хроническое воспаление (антигенная стимуляция) • Активация комплекса морфогенетических программ: - Дифференцировка Выживаемость. Миграция и инвазия Апоптоз • Молекулярные механизмы недостаточно изучены «вселенная» неизученных сигнальных путей и поведенческих программ
Концепция об опухолевом микроокружении -2009: “Диалог замещает монолог” (Weinberg, 2007) • Опухоль= комплексная система, которая зависит от взаимодействия различных типов клеток. • Рост опухолевых клеток поддерживается стромой: - Фибробласты Макрофаги и другие иммунные клетки Клетки эндотелия сосудов, перициты и др. Межклеточный матрикс • Ключевая роль-хроническое воспаление (антигенная стимуляция) • Активация комплекса морфогенетических программ: - Дифференцировка Выживаемость. Миграция и инвазия Апоптоз • Молекулярные механизмы недостаточно изучены «вселенная» неизученных сигнальных путей и поведенческих программ
 Пролиферация клеток ХЛЛ Долгое время считалось, что при ХЛЛ происходит в основном пассивное накопление опухолевых клеток за счёт нарушенного апоптоза В экспериментах in vivo с применением дейтериевой тяжёлой воды было показано, что при ХЛЛ идёт активная пролиферация клеток, ежедневно «рождается» количество клеток от 0, 1% до более 1% общей численности клона (более миллиарда новых клеток в день), при этом доля новообразованных клеток более 0, 35% в сутки ассоциируется с более агрессивным, прогрессирующим заболеванием (Messmer et al, 2005)
Пролиферация клеток ХЛЛ Долгое время считалось, что при ХЛЛ происходит в основном пассивное накопление опухолевых клеток за счёт нарушенного апоптоза В экспериментах in vivo с применением дейтериевой тяжёлой воды было показано, что при ХЛЛ идёт активная пролиферация клеток, ежедневно «рождается» количество клеток от 0, 1% до более 1% общей численности клона (более миллиарда новых клеток в день), при этом доля новообразованных клеток более 0, 35% в сутки ассоциируется с более агрессивным, прогрессирующим заболеванием (Messmer et al, 2005)
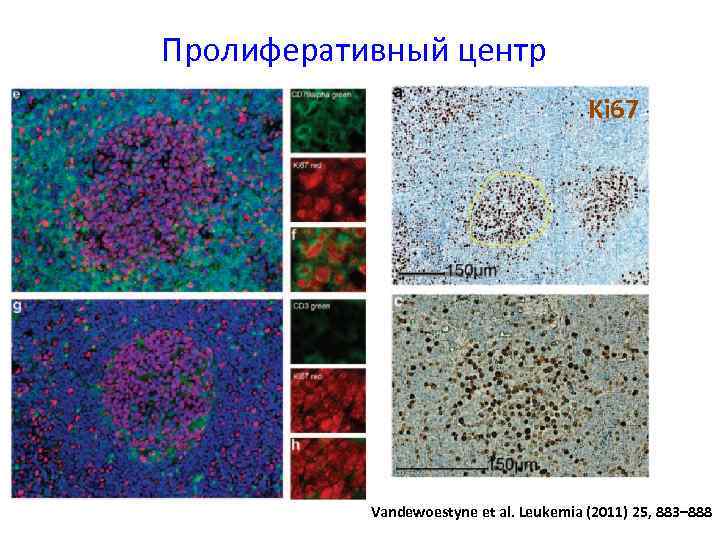 Пролиферативный центр Ki 67 Vandewoestyne et al. Leukemia (2011) 25, 883– 888
Пролиферативный центр Ki 67 Vandewoestyne et al. Leukemia (2011) 25, 883– 888
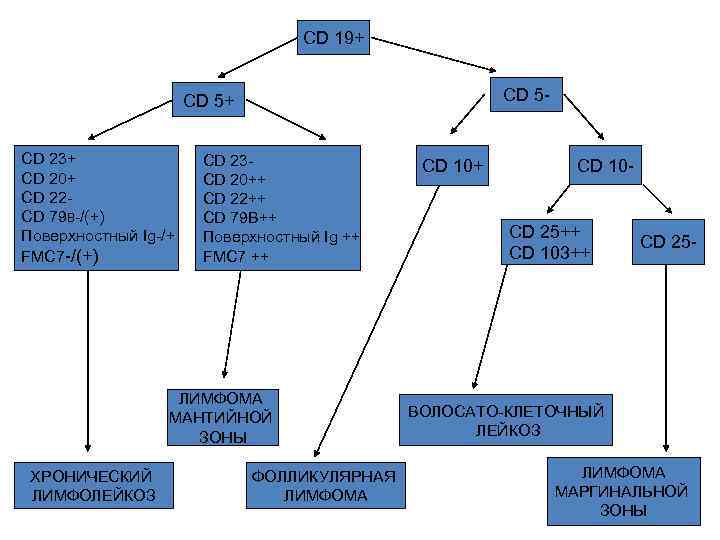 CD 19+ CD 5 - CD 5+ CD 23+ CD 20+ CD 22 CD 79 B-/(+) Поверхностный Ig-/+ FMC 7 -/(+) CD 23 CD 20++ CD 22++ CD 79 B++ Поверхностный Ig ++ FMC 7 ++ ЛИМФОМА МАНТИЙНОЙ ЗОНЫ ХРОНИЧЕСКИЙ ЛИМФОЛЕЙКОЗ ФОЛЛИКУЛЯРНАЯ ЛИМФОМА CD 10+ CD 10 - CD 25++ CD 103++ CD 25 - ВОЛОСАТО-КЛЕТОЧНЫЙ ЛЕЙКОЗ ЛИМФОМА МАРГИНАЛЬНОЙ ЗОНЫ
CD 19+ CD 5 - CD 5+ CD 23+ CD 20+ CD 22 CD 79 B-/(+) Поверхностный Ig-/+ FMC 7 -/(+) CD 23 CD 20++ CD 22++ CD 79 B++ Поверхностный Ig ++ FMC 7 ++ ЛИМФОМА МАНТИЙНОЙ ЗОНЫ ХРОНИЧЕСКИЙ ЛИМФОЛЕЙКОЗ ФОЛЛИКУЛЯРНАЯ ЛИМФОМА CD 10+ CD 10 - CD 25++ CD 103++ CD 25 - ВОЛОСАТО-КЛЕТОЧНЫЙ ЛЕЙКОЗ ЛИМФОМА МАРГИНАЛЬНОЙ ЗОНЫ
 Дифференциальный диагноз В- ХЛЛ Фенотип Лимфома мантийной зоны Фолликулярная лимфома В-ХЛЛ CD 19 + + + CD 5 + – + CD 10 – + – CD 23 – – + CD 20 ++ ++ + Лямбда> каппа Каппа > лямбда + – – Легкие цепи Cyclin D 1
Дифференциальный диагноз В- ХЛЛ Фенотип Лимфома мантийной зоны Фолликулярная лимфома В-ХЛЛ CD 19 + + + CD 5 + – + CD 10 – + – CD 23 – – + CD 20 ++ ++ + Лямбда> каппа Каппа > лямбда + – – Легкие цепи Cyclin D 1
 Новое в диагностике: CD 200 • ХЛЛ ЛМЗ p < 0. 0001 • CD 200 (OX 2) – гликопротеин Ig-суперсемейства, играет роль в иммуносупрессии • Экспрессия при ХЛЛ – 100%. Лимфома зоны мантии – dim в 3/14 (4%, 7%, 16%) 1 J Immunol 2007; 178: 5595– 605 2 Leukemia Research 33 (2009) 1212– 1216
Новое в диагностике: CD 200 • ХЛЛ ЛМЗ p < 0. 0001 • CD 200 (OX 2) – гликопротеин Ig-суперсемейства, играет роль в иммуносупрессии • Экспрессия при ХЛЛ – 100%. Лимфома зоны мантии – dim в 3/14 (4%, 7%, 16%) 1 J Immunol 2007; 178: 5595– 605 2 Leukemia Research 33 (2009) 1212– 1216
 Клинические проявления поражения лимфоидной ткани и других органов • • • Периферические лимфоузлы Легкие Печень Почки Общие симптомы(лихорадка, потеря веса) Анемия и тромбоцитопения
Клинические проявления поражения лимфоидной ткани и других органов • • • Периферические лимфоузлы Легкие Печень Почки Общие симптомы(лихорадка, потеря веса) Анемия и тромбоцитопения
 Осложнения • Инфекция • Аутоиммунные нарушения • Трансформация: - В – клеточная крупноклеточная лимфома (синдром Рихтера). Устанавливается только морфологически! - Пролимфоцитарный лейкоз
Осложнения • Инфекция • Аутоиммунные нарушения • Трансформация: - В – клеточная крупноклеточная лимфома (синдром Рихтера). Устанавливается только морфологически! - Пролимфоцитарный лейкоз
 ХЛЛ: факторы прогноза
ХЛЛ: факторы прогноза
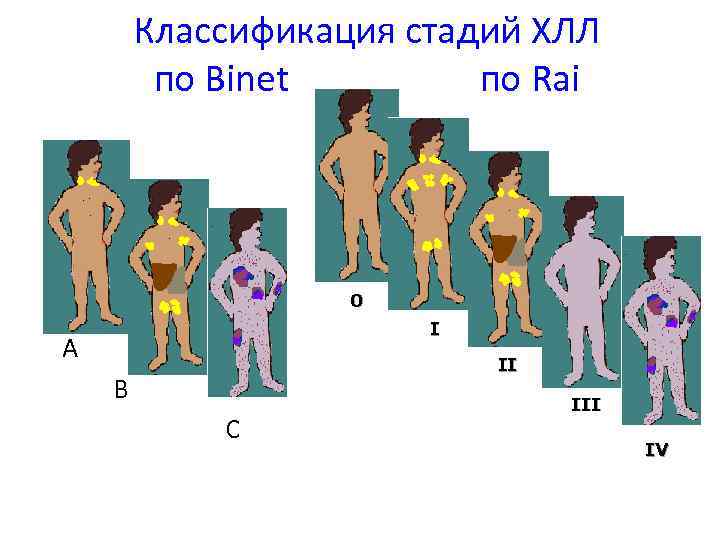 Классификация стадий ХЛЛ по Binet по Rai 0 I A II B C III IV
Классификация стадий ХЛЛ по Binet по Rai 0 I A II B C III IV
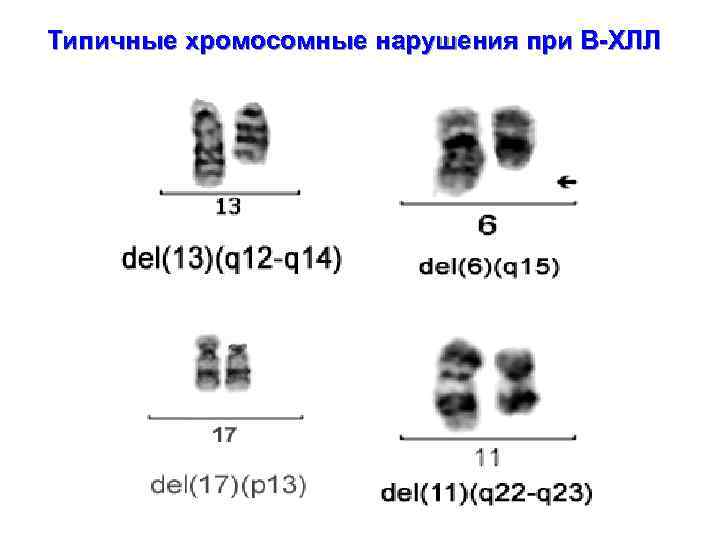 Типичные хромосомные нарушения при В-ХЛЛ
Типичные хромосомные нарушения при В-ХЛЛ
 FISH Fluoreszenz In Situ Hybridisierung
FISH Fluoreszenz In Situ Hybridisierung
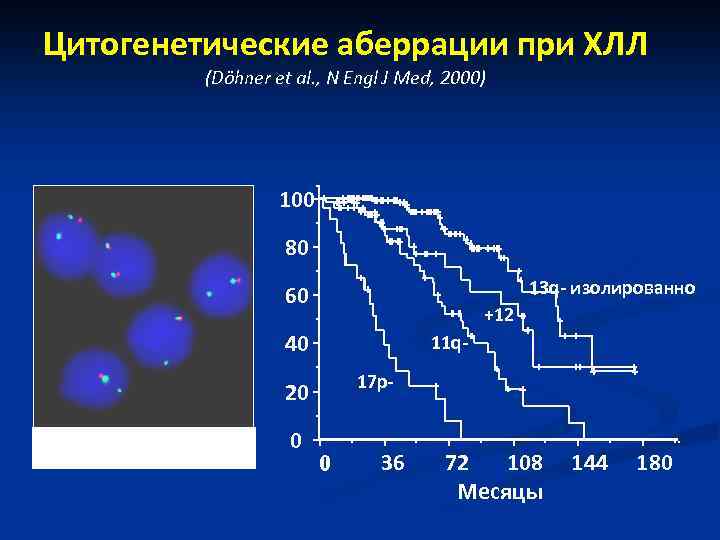 Цитогенетические аберрации при ХЛЛ (Döhner et al. , N Engl J Med, 2000) 100 80 13 q- изолированно 60 +12 40 11 q 17 p- 20 > 80% случаев 0 0 36 72 108 Месяцы 144 180
Цитогенетические аберрации при ХЛЛ (Döhner et al. , N Engl J Med, 2000) 100 80 13 q- изолированно 60 +12 40 11 q 17 p- 20 > 80% случаев 0 0 36 72 108 Месяцы 144 180
 Делеция 17 p • Повреждение тумор-супрессорного гена TP 53. • Ген TP 53 кодирует белок р 53. Это транскрипционный фактор, который активируется при повреждениях ДНК или ошибках в процессе репликации. • Следствие-блок остановки клеточного цикла, поврежденные клетки не подвергаются апоптозу.
Делеция 17 p • Повреждение тумор-супрессорного гена TP 53. • Ген TP 53 кодирует белок р 53. Это транскрипционный фактор, который активируется при повреждениях ДНК или ошибках в процессе репликации. • Следствие-блок остановки клеточного цикла, поврежденные клетки не подвергаются апоптозу.
 Делеция 11 q • Утрачиваемый район содержит 6 генов: ATM, RDX, FDX 1, ACAT 1, NPAT, DDX 10. • Ген ATM относится к тумор-супрессорным генам при ХЛЛ и не экспрессируется при В-ХЛЛ с del 11 q. • Ген ATM кодирует протеин - киназу, которая регулирует активность белка p 53, в результате чего снижается его активность.
Делеция 11 q • Утрачиваемый район содержит 6 генов: ATM, RDX, FDX 1, ACAT 1, NPAT, DDX 10. • Ген ATM относится к тумор-супрессорным генам при ХЛЛ и не экспрессируется при В-ХЛЛ с del 11 q. • Ген ATM кодирует протеин - киназу, которая регулирует активность белка p 53, в результате чего снижается его активность.
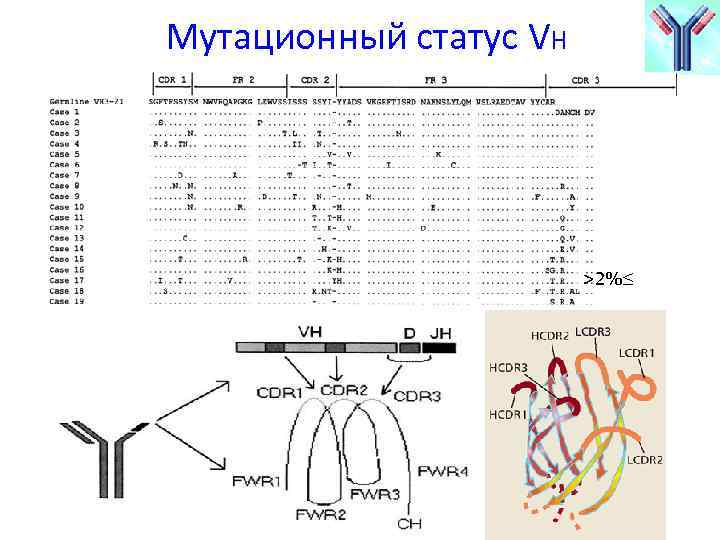 Мутационный статус VH >2%≤
Мутационный статус VH >2%≤
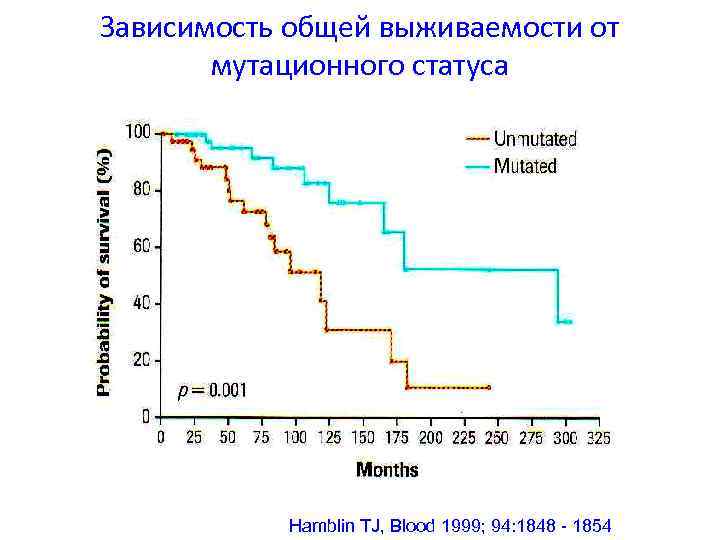 Зависимость общей выживаемости от мутационного статуса Hamblin TJ, Blood 1999; 94: 1848 - 1854
Зависимость общей выживаемости от мутационного статуса Hamblin TJ, Blood 1999; 94: 1848 - 1854
 CD 38 трансмембранный гликопротеин Экспрессируется: На клетках предшественниках костного мозга На клетках зародышевого центра На плазматических клетках
CD 38 трансмембранный гликопротеин Экспрессируется: На клетках предшественниках костного мозга На клетках зародышевого центра На плазматических клетках
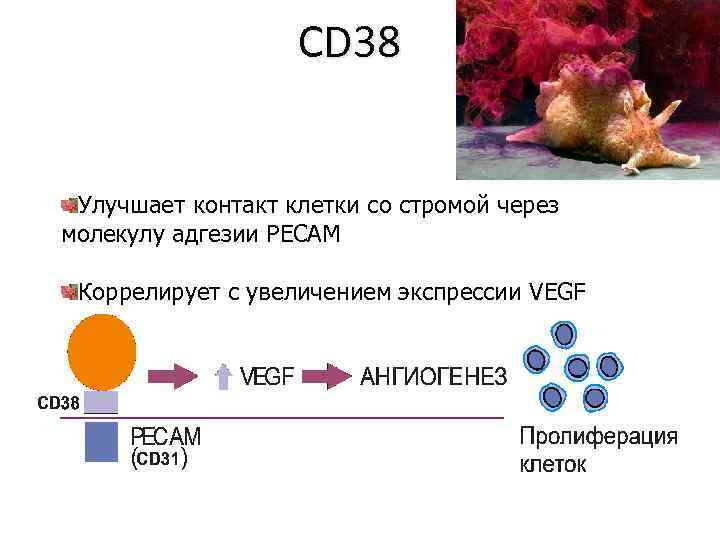 CD 38 Улучшает контакт клетки со стромой через молекулу адгезии PECAM Коррелирует с увеличением экспрессии VEGF
CD 38 Улучшает контакт клетки со стромой через молекулу адгезии PECAM Коррелирует с увеличением экспрессии VEGF
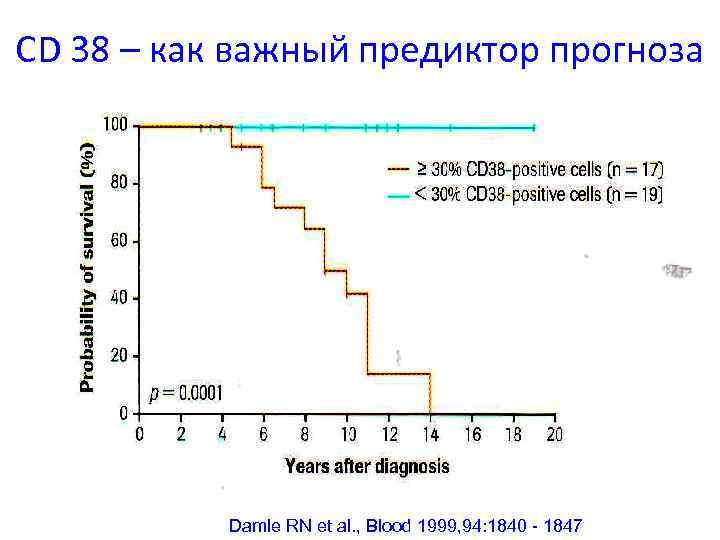 CD 38 – как важный предиктор прогноза Damle RN et al. , Blood 1999, 94: 1840 - 1847
CD 38 – как важный предиктор прогноза Damle RN et al. , Blood 1999, 94: 1840 - 1847
 Влияют ли молекулярно – биологические прогностические факторы на выбор терапевтической тактики в первой линии терапии? Del 17 p ? ? ?
Влияют ли молекулярно – биологические прогностические факторы на выбор терапевтической тактики в первой линии терапии? Del 17 p ? ? ?
 Показания к началу терапии • Развитие или прогрессивное нарастание анемии и/или тромбоцитопении • Массивная или симптоматичная спленомегалия и/или лимфоаденопатия • Прогрессивное нарастание лимфоцитоза, время удвоения лимфоцитов менее 6 месяцев. • Аутоиммунная анемия/или тромбоцитопения, плохо отвечающая на стандартную терапию. • Наличие хотя бы одного из конституциональных симптомов: - необъяснимая потеря массы тела (не менее 10% за 6 месяцев) - ночная потливость в течение более 1 месяца без признаков инфекции - фебрильная лихорадка в течение более двух недель без признаков инфекции IWCLL, Hallek, 2008
Показания к началу терапии • Развитие или прогрессивное нарастание анемии и/или тромбоцитопении • Массивная или симптоматичная спленомегалия и/или лимфоаденопатия • Прогрессивное нарастание лимфоцитоза, время удвоения лимфоцитов менее 6 месяцев. • Аутоиммунная анемия/или тромбоцитопения, плохо отвечающая на стандартную терапию. • Наличие хотя бы одного из конституциональных симптомов: - необъяснимая потеря массы тела (не менее 10% за 6 месяцев) - ночная потливость в течение более 1 месяца без признаков инфекции - фебрильная лихорадка в течение более двух недель без признаков инфекции IWCLL, Hallek, 2008
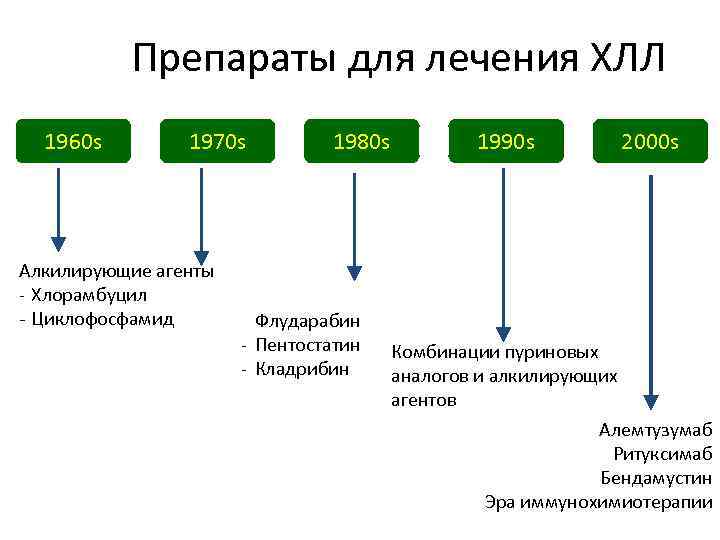 Препараты для лечения ХЛЛ 1960 s 1970 s Алкилирующие агенты - Хлорамбуцил - Циклофосфамид 1980 s 1990 s 2000 s Пуриновые аналоги - Флударабин - Пентостатин Комбинации пуриновых - Кладрибин аналогов и алкилирующих агентов Алемтузумаб Ритуксимаб Бендамустин Эра иммунохимиотерапии
Препараты для лечения ХЛЛ 1960 s 1970 s Алкилирующие агенты - Хлорамбуцил - Циклофосфамид 1980 s 1990 s 2000 s Пуриновые аналоги - Флударабин - Пентостатин Комбинации пуриновых - Кладрибин аналогов и алкилирующих агентов Алемтузумаб Ритуксимаб Бендамустин Эра иммунохимиотерапии
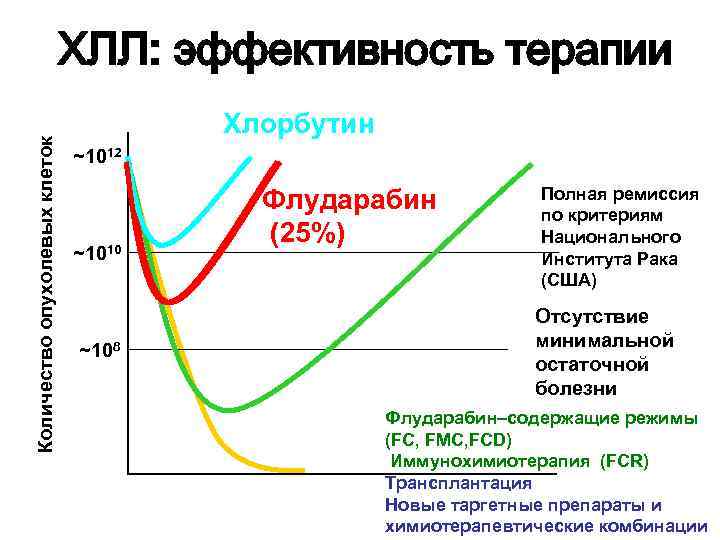 Количество опухолевых клеток ХЛЛ: эффективность терапии Хлорбутин ~1012 ~1010 ~108 Флударабин (25%) Полная ремиссия по критериям Национального Института Рака (США) Отсутствие минимальной остаточной болезни Флударабин–содержащие режимы (FC, FMC, FCD) Иммунохимиотерапия (FCR) Трансплантация Новые таргетные препараты и химиотерапевтические комбинации
Количество опухолевых клеток ХЛЛ: эффективность терапии Хлорбутин ~1012 ~1010 ~108 Флударабин (25%) Полная ремиссия по критериям Национального Института Рака (США) Отсутствие минимальной остаточной болезни Флударабин–содержащие режимы (FC, FMC, FCD) Иммунохимиотерапия (FCR) Трансплантация Новые таргетные препараты и химиотерапевтические комбинации
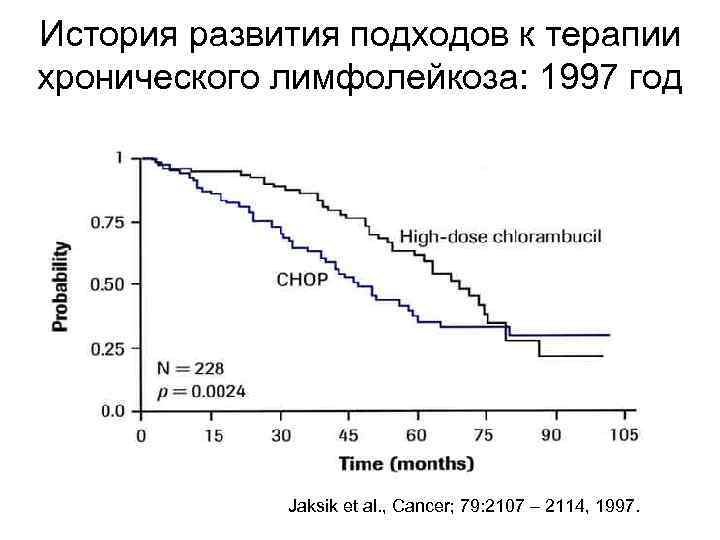 История развития подходов к терапии хронического лимфолейкоза: 1997 год Jaksik et al. , Cancer; 79: 2107 – 2114, 1997.
История развития подходов к терапии хронического лимфолейкоза: 1997 год Jaksik et al. , Cancer; 79: 2107 – 2114, 1997.
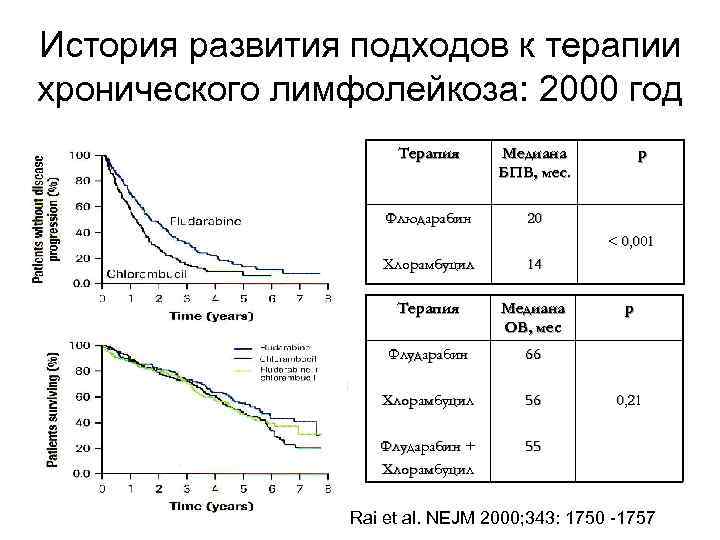 История развития подходов к терапии хронического лимфолейкоза: 2000 год Терапия Медиана БПВ, мес. Флюдарабин р 20 < 0, 001 Хлорамбуцил 14 Терапия Медиана ОВ, мес Флударабин 66 Хлорамбуцил 56 Флударабин + Хлорамбуцил 55 р 0, 21 Rai et al. NEJM 2000; 343: 1750 -1757
История развития подходов к терапии хронического лимфолейкоза: 2000 год Терапия Медиана БПВ, мес. Флюдарабин р 20 < 0, 001 Хлорамбуцил 14 Терапия Медиана ОВ, мес Флударабин 66 Хлорамбуцил 56 Флударабин + Хлорамбуцил 55 р 0, 21 Rai et al. NEJM 2000; 343: 1750 -1757
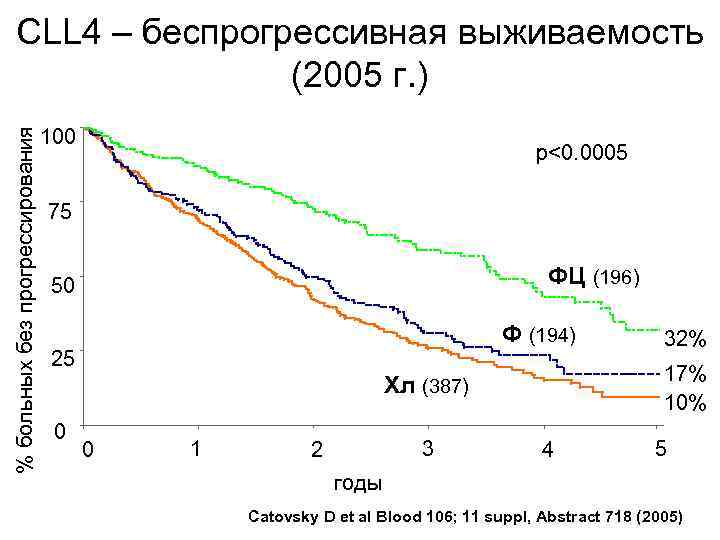 % больных без прогрессирования CLL 4 – беспрогрессивная выживаемость (2005 г. ) 100 p<0. 0005 75 ФЦ (196) 50 Ф (194) 25 17% 10% Хл (387) 0 0 1 3 2 32% 4 5 годы Catovsky D et al Blood 106; 11 suppl, Abstract 718 (2005)
% больных без прогрессирования CLL 4 – беспрогрессивная выживаемость (2005 г. ) 100 p<0. 0005 75 ФЦ (196) 50 Ф (194) 25 17% 10% Хл (387) 0 0 1 3 2 32% 4 5 годы Catovsky D et al Blood 106; 11 suppl, Abstract 718 (2005)
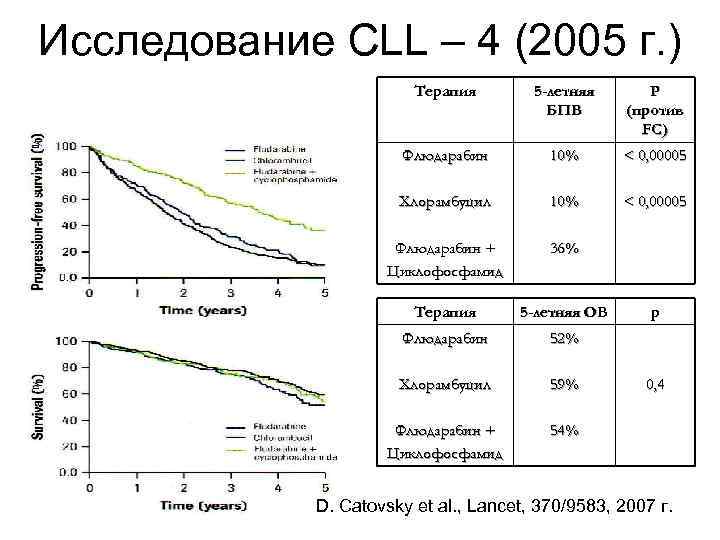 Исследование CLL – 4 (2005 г. ) Терапия 5 -летняя БПВ Р (против FC) Флюдарабин 10% < 0, 00005 Хлорамбуцил 10% < 0, 00005 Флюдарабин + Циклофосфамид 36% Терапия 5 -летняя ОВ Флюдарабин 52% Хлорамбуцил 59% Флюдарабин + Циклофосфамид 54% р 0, 4 D. Catovsky et al. , Lancet, 370/9583, 2007 г.
Исследование CLL – 4 (2005 г. ) Терапия 5 -летняя БПВ Р (против FC) Флюдарабин 10% < 0, 00005 Хлорамбуцил 10% < 0, 00005 Флюдарабин + Циклофосфамид 36% Терапия 5 -летняя ОВ Флюдарабин 52% Хлорамбуцил 59% Флюдарабин + Циклофосфамид 54% р 0, 4 D. Catovsky et al. , Lancet, 370/9583, 2007 г.
 Первый химиотерапевтический режим, продливший жизнь пациентам ХЛЛ F C CLL 8 R
Первый химиотерапевтический режим, продливший жизнь пациентам ХЛЛ F C CLL 8 R
 Клеточная линия Karpas 422: Ритуксимаб + антрациклины/ цисплатин / таксол = аддитивный эффект Ритуксимаб + флударабин = синергичный эффект (увеличение лизиса опухоли с 10% до 70%)
Клеточная линия Karpas 422: Ритуксимаб + антрациклины/ цисплатин / таксол = аддитивный эффект Ритуксимаб + флударабин = синергичный эффект (увеличение лизиса опухоли с 10% до 70%)
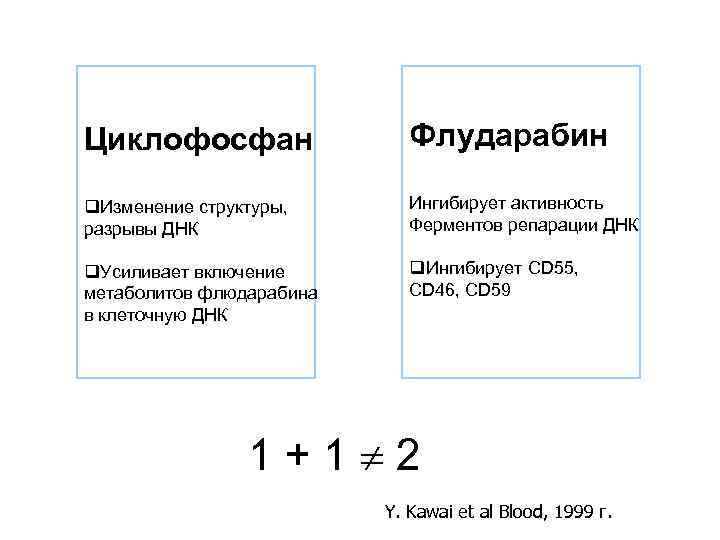 Циклофосфан Флударабин q. Изменение структуры, разрывы ДНК Ингибирует активность Ферментов репарации ДНК q. Усиливает включение метаболитов флюдарабина в клеточную ДНК q. Ингибирует СD 55, CD 46, CD 59 1 + 1 2 Y. Kawai et al Blood, 1999 г.
Циклофосфан Флударабин q. Изменение структуры, разрывы ДНК Ингибирует активность Ферментов репарации ДНК q. Усиливает включение метаболитов флюдарабина в клеточную ДНК q. Ингибирует СD 55, CD 46, CD 59 1 + 1 2 Y. Kawai et al Blood, 1999 г.
 СD 55, CD 46, CD 59 Присутствуют на поверхности всех лимфоцитов. Семейство белков, которые защищает клетки от повреждающего действия комплемента
СD 55, CD 46, CD 59 Присутствуют на поверхности всех лимфоцитов. Семейство белков, которые защищает клетки от повреждающего действия комплемента
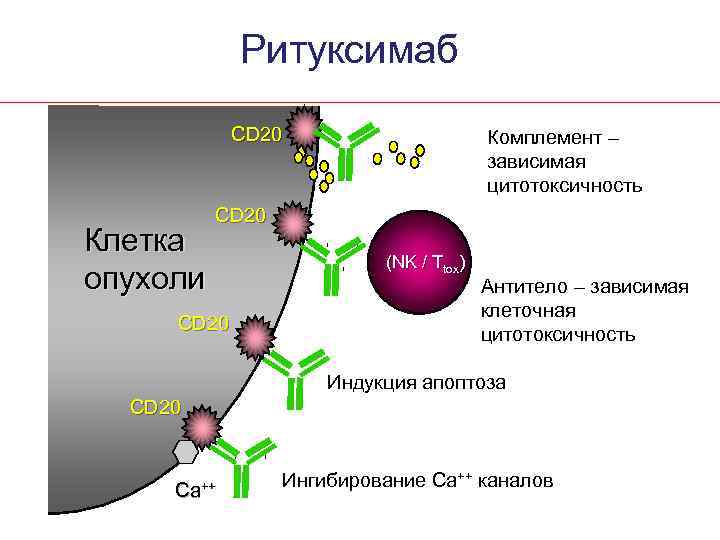 Ритуксимаб CD 20 Клетка опухоли Комплемент – зависимая цитотоксичность CD 20 (NK / Ttox) Антитело – зависимая клеточная цитотоксичность Индукция апоптоза CD 20 Ca++ Ингибирование Са++ каналов
Ритуксимаб CD 20 Клетка опухоли Комплемент – зависимая цитотоксичность CD 20 (NK / Ttox) Антитело – зависимая клеточная цитотоксичность Индукция апоптоза CD 20 Ca++ Ингибирование Са++ каналов
 Слабые и сильные стороны Ритуксимаба при ХЛЛ • Низкая плотность CD 20 антигена на клетках ХЛЛ – ~40, 000 молекул на клетках ХЛЛ против 200, 000 на клетках фолликулярной лимфомы • У больных В-ХЛЛ период полувыведения ритуксимаба меньше – Растворимая форма CD 20 • Слабый эффект в дозе 375 мг/м 2 • Низкая токсичность (нет миелосупрессии) • Высокая активность в комбинированой терапии 1. Manshouri T, et al. Blood 2003; 101: 2507– 2513.
Слабые и сильные стороны Ритуксимаба при ХЛЛ • Низкая плотность CD 20 антигена на клетках ХЛЛ – ~40, 000 молекул на клетках ХЛЛ против 200, 000 на клетках фолликулярной лимфомы • У больных В-ХЛЛ период полувыведения ритуксимаба меньше – Растворимая форма CD 20 • Слабый эффект в дозе 375 мг/м 2 • Низкая токсичность (нет миелосупрессии) • Высокая активность в комбинированой терапии 1. Manshouri T, et al. Blood 2003; 101: 2507– 2513.
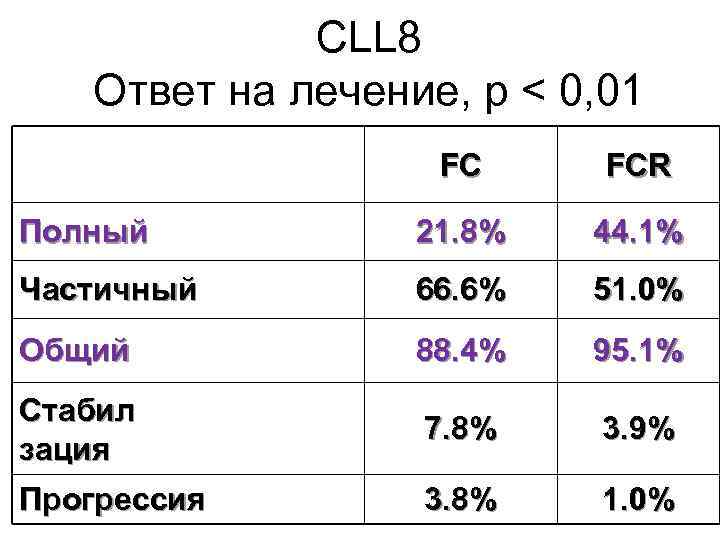 CLL 8 Ответ на лечение, р < 0, 01 FC FCR Полный 21. 8% 44. 1% Частичный 66. 6% 51. 0% Общий 88. 4% 95. 1% Стабил зация 7. 8% 3. 9% Прогрессия 3. 8% 1. 0%
CLL 8 Ответ на лечение, р < 0, 01 FC FCR Полный 21. 8% 44. 1% Частичный 66. 6% 51. 0% Общий 88. 4% 95. 1% Стабил зация 7. 8% 3. 9% Прогрессия 3. 8% 1. 0%
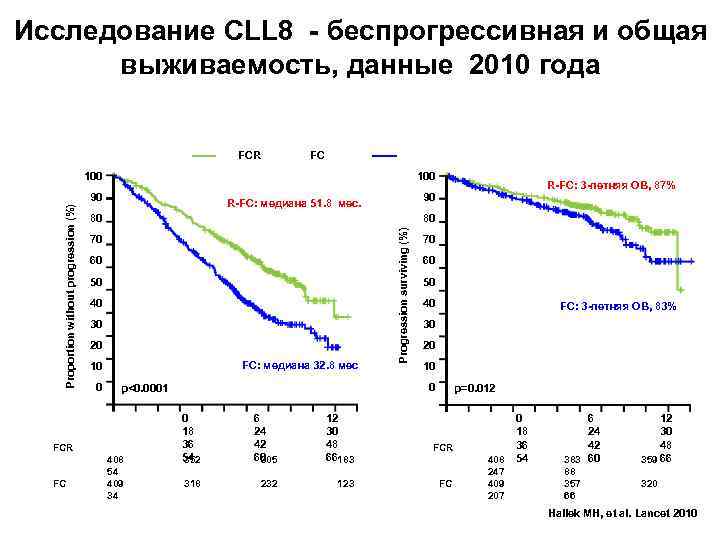 Исследование CLL 8 - беспрогрессивная и общая выживаемость, данные 2010 года FCR FC 100 90 90 R-FC: медиана 51. 8 мес. 80 70 60 50 40 30 20 FC: медиана 32. 8 мес 10 0 408 54 409 34 70 60 50 40 0 18 36 54 352 6 24 42 60 305 12 30 48 66183 318 232 123 FC: 3 -летняя OВ, 83% 30 20 10 0 p<0. 0001 FCR FC R-FC: 3 -летняя ОВ, 87% 80 Progression surviving (%) Proportion without progression (%) 100 p=0. 012 FCR FC 408 247 409 207 0 18 36 54 6 24 42 383 60 12 30 48 359 66 88 357 66 320 Hallek MH, et al. Lancet 2010
Исследование CLL 8 - беспрогрессивная и общая выживаемость, данные 2010 года FCR FC 100 90 90 R-FC: медиана 51. 8 мес. 80 70 60 50 40 30 20 FC: медиана 32. 8 мес 10 0 408 54 409 34 70 60 50 40 0 18 36 54 352 6 24 42 60 305 12 30 48 66183 318 232 123 FC: 3 -летняя OВ, 83% 30 20 10 0 p<0. 0001 FCR FC R-FC: 3 -летняя ОВ, 87% 80 Progression surviving (%) Proportion without progression (%) 100 p=0. 012 FCR FC 408 247 409 207 0 18 36 54 6 24 42 383 60 12 30 48 359 66 88 357 66 320 Hallek MH, et al. Lancet 2010
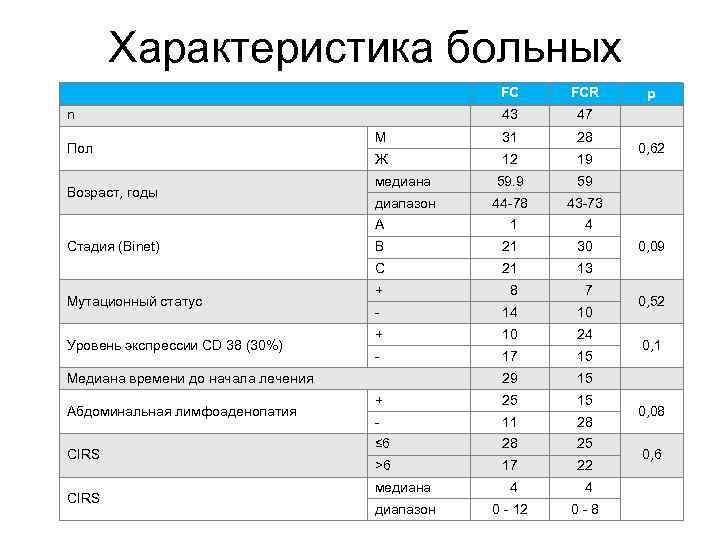 Характеристика больных FC FCR 43 47 М 31 28 Ж 12 19 медиана 59. 9 59 диапазон 44 -78 43 -73 A 1 4 B 21 30 C 21 13 + 8 7 - 14 10 + 10 24 - 17 15 29 15 + 25 15 - 11 28 ≤ 6 28 25 >6 17 22 медиана 4 4 диапазон 0 - 12 0 - 8 n Пол Возраст, годы Стадия (Binet) Мутационный статус Уровень экспрессии CD 38 (30%) Медиана времени до начала лечения Абдоминальная лимфоаденопатия CIRS p 0, 62 0, 09 0, 52 0, 1 0, 08 0, 6
Характеристика больных FC FCR 43 47 М 31 28 Ж 12 19 медиана 59. 9 59 диапазон 44 -78 43 -73 A 1 4 B 21 30 C 21 13 + 8 7 - 14 10 + 10 24 - 17 15 29 15 + 25 15 - 11 28 ≤ 6 28 25 >6 17 22 медиана 4 4 диапазон 0 - 12 0 - 8 n Пол Возраст, годы Стадия (Binet) Мутационный статус Уровень экспрессии CD 38 (30%) Медиана времени до начала лечения Абдоминальная лимфоаденопатия CIRS p 0, 62 0, 09 0, 52 0, 1 0, 08 0, 6
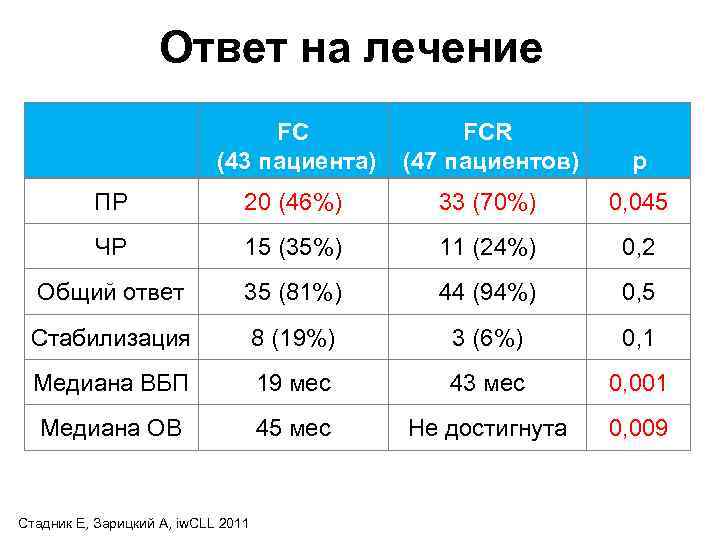 Ответ на лечение FC FCR (43 пациента) (47 пациентов) p ПР 20 (46%) 33 (70%) 0, 045 ЧР 15 (35%) 11 (24%) 0, 2 Общий ответ 35 (81%) 44 (94%) 0, 5 Стабилизация 8 (19%) 3 (6%) 0, 1 Медиана ВБП 19 мес 43 мес 0, 001 Медиана ОВ 45 мес Не достигнута 0, 009 Стадник Е, Зарицкий А, iw. CLL 2011
Ответ на лечение FC FCR (43 пациента) (47 пациентов) p ПР 20 (46%) 33 (70%) 0, 045 ЧР 15 (35%) 11 (24%) 0, 2 Общий ответ 35 (81%) 44 (94%) 0, 5 Стабилизация 8 (19%) 3 (6%) 0, 1 Медиана ВБП 19 мес 43 мес 0, 001 Медиана ОВ 45 мес Не достигнута 0, 009 Стадник Е, Зарицкий А, iw. CLL 2011
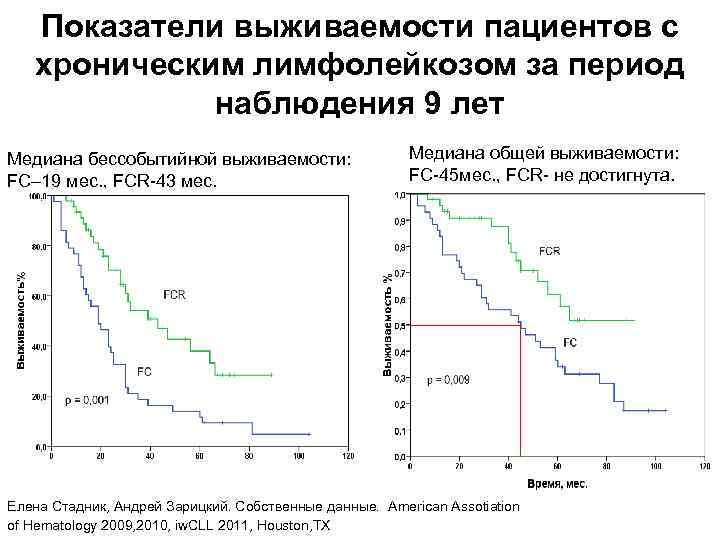 Показатели выживаемости пациентов с хроническим лимфолейкозом за период наблюдения 9 лет Медиана бессобытийной выживаемости: FC– 19 мес. , FCR-43 мес. Медиана общей выживаемости: FC-45 мес. , FCR- не достигнута. Елена Стадник, Андрей Зарицкий. Собственные данные. American Assotiation of Hematology 2009, 2010, iw. CLL 2011, Houston, TX
Показатели выживаемости пациентов с хроническим лимфолейкозом за период наблюдения 9 лет Медиана бессобытийной выживаемости: FC– 19 мес. , FCR-43 мес. Медиана общей выживаемости: FC-45 мес. , FCR- не достигнута. Елена Стадник, Андрей Зарицкий. Собственные данные. American Assotiation of Hematology 2009, 2010, iw. CLL 2011, Houston, TX
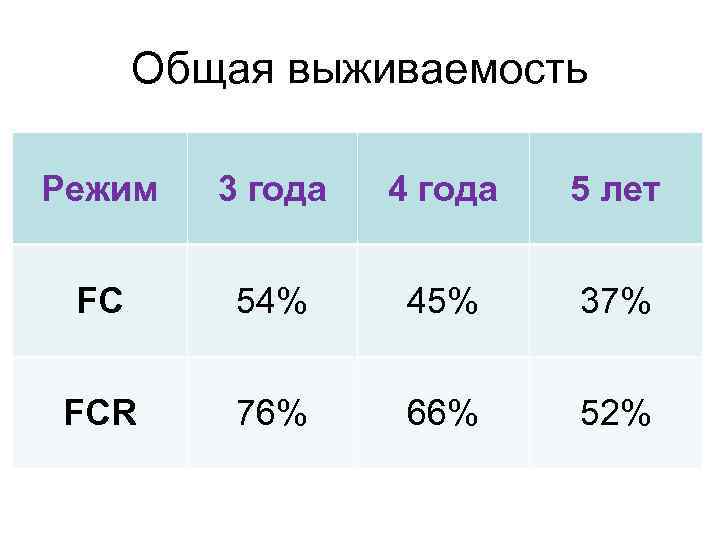 Общая выживаемость Режим 3 года 4 года 5 лет FC 54% 45% 37% FCR 76% 66% 52%
Общая выживаемость Режим 3 года 4 года 5 лет FC 54% 45% 37% FCR 76% 66% 52%
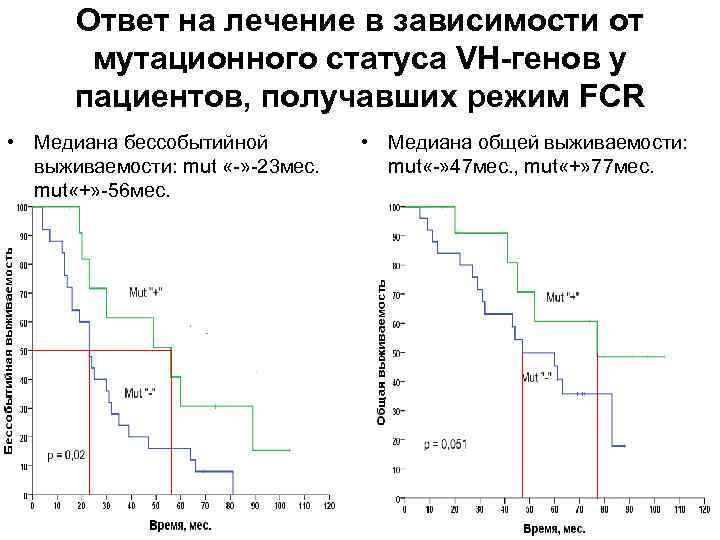 Ответ на лечение в зависимости от мутационного статуса VH-генов у пациентов, получавших режим FCR • Медиана бессобытийной выживаемости: mut «-» -23 мес. mut «+» -56 мес. • Медиана общей выживаемости: mut «-» 47 мес. , mut «+» 77 мес.
Ответ на лечение в зависимости от мутационного статуса VH-генов у пациентов, получавших режим FCR • Медиана бессобытийной выживаемости: mut «-» -23 мес. mut «+» -56 мес. • Медиана общей выживаемости: mut «-» 47 мес. , mut «+» 77 мес.
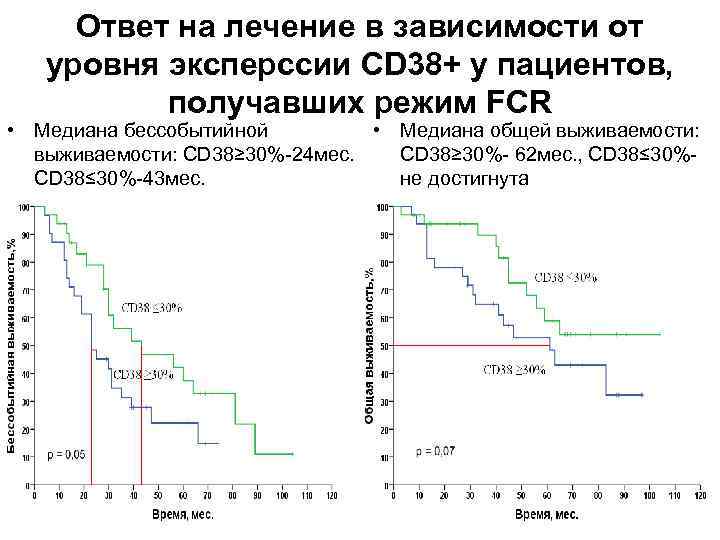 Ответ на лечение в зависимости от уровня эксперссии CD 38+ у пациентов, получавших режим FCR • Медиана бессобытийной • Медиана общей выживаемости: CD 38≥ 30%-24 мес. CD 38≥ 30%- 62 мес. , CD 38≤ 30%-43 мес. не достигнута
Ответ на лечение в зависимости от уровня эксперссии CD 38+ у пациентов, получавших режим FCR • Медиана бессобытийной • Медиана общей выживаемости: CD 38≥ 30%-24 мес. CD 38≥ 30%- 62 мес. , CD 38≤ 30%-43 мес. не достигнута
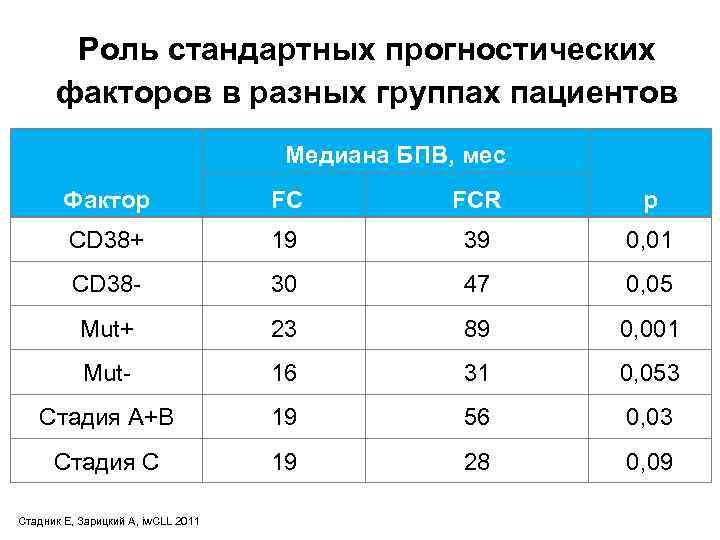 Роль стандартных прогностических факторов в разных группах пациентов Медиана БПВ, мес Фактор FC FCR p CD 38+ 19 39 0, 01 CD 38 - 30 47 0, 05 Mut+ 23 89 0, 001 Mut- 16 31 0, 053 Стадия A+B 19 56 0, 03 Стадия C 19 28 0, 09 Стадник Е, Зарицкий А, iw. CLL 2011
Роль стандартных прогностических факторов в разных группах пациентов Медиана БПВ, мес Фактор FC FCR p CD 38+ 19 39 0, 01 CD 38 - 30 47 0, 05 Mut+ 23 89 0, 001 Mut- 16 31 0, 053 Стадия A+B 19 56 0, 03 Стадия C 19 28 0, 09 Стадник Е, Зарицкий А, iw. CLL 2011
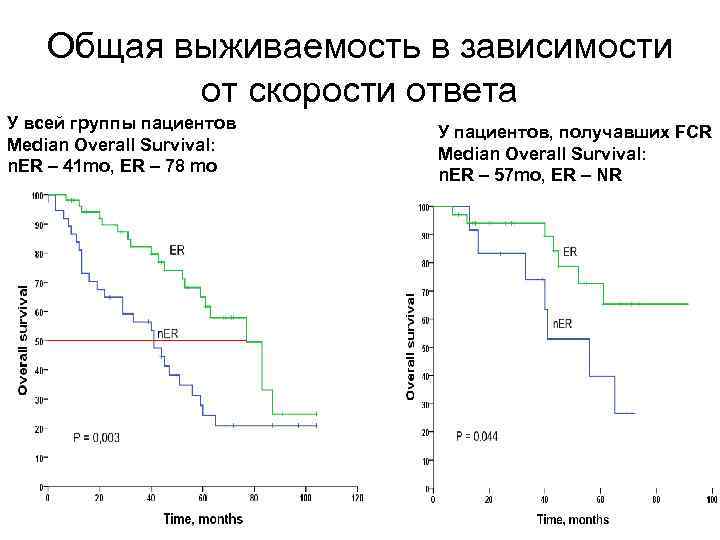 Общая выживаемость в зависимости от скорости ответа У всей группы пациентов Median Overall Survival: n. ER – 41 mo, ER – 78 mo У пациентов, получавших FCR Median Overall Survival: n. ER – 57 mo, ER – NR
Общая выживаемость в зависимости от скорости ответа У всей группы пациентов Median Overall Survival: n. ER – 41 mo, ER – 78 mo У пациентов, получавших FCR Median Overall Survival: n. ER – 57 mo, ER – NR
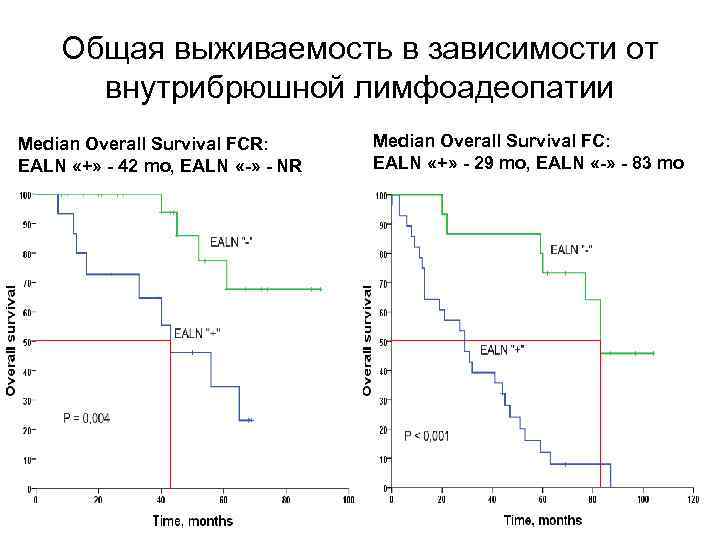 Общая выживаемость в зависимости от внутрибрюшной лимфоадеопатии Median Overall Survival FCR: EALN «+» - 42 mo, EALN «-» - NR Median Overall Survival FC: EALN «+» - 29 mo, EALN «-» - 83 mo
Общая выживаемость в зависимости от внутрибрюшной лимфоадеопатии Median Overall Survival FCR: EALN «+» - 42 mo, EALN «-» - NR Median Overall Survival FC: EALN «+» - 29 mo, EALN «-» - 83 mo
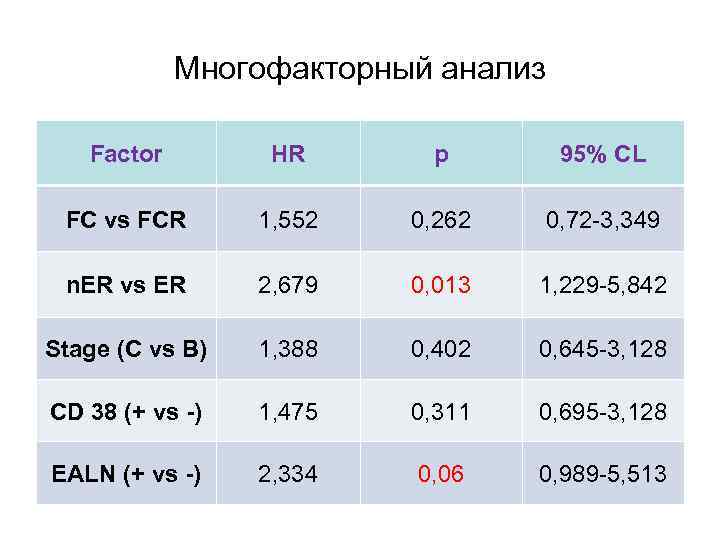 Многофакторный анализ Factor HR p 95% CL FC vs FCR 1, 552 0, 262 0, 72 -3, 349 n. ER vs ER 2, 679 0, 013 1, 229 -5, 842 Stage (C vs B) 1, 388 0, 402 0, 645 -3, 128 CD 38 (+ vs -) 1, 475 0, 311 0, 695 -3, 128 EALN (+ vs -) 2, 334 0, 06 0, 989 -5, 513
Многофакторный анализ Factor HR p 95% CL FC vs FCR 1, 552 0, 262 0, 72 -3, 349 n. ER vs ER 2, 679 0, 013 1, 229 -5, 842 Stage (C vs B) 1, 388 0, 402 0, 645 -3, 128 CD 38 (+ vs -) 1, 475 0, 311 0, 695 -3, 128 EALN (+ vs -) 2, 334 0, 06 0, 989 -5, 513
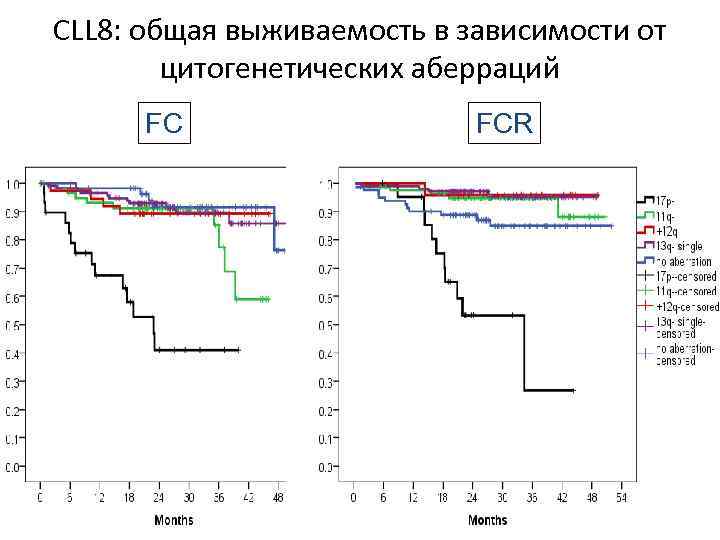 CLL 8: общая выживаемость в зависимости от цитогенетических аберраций FC FCR
CLL 8: общая выживаемость в зависимости от цитогенетических аберраций FC FCR
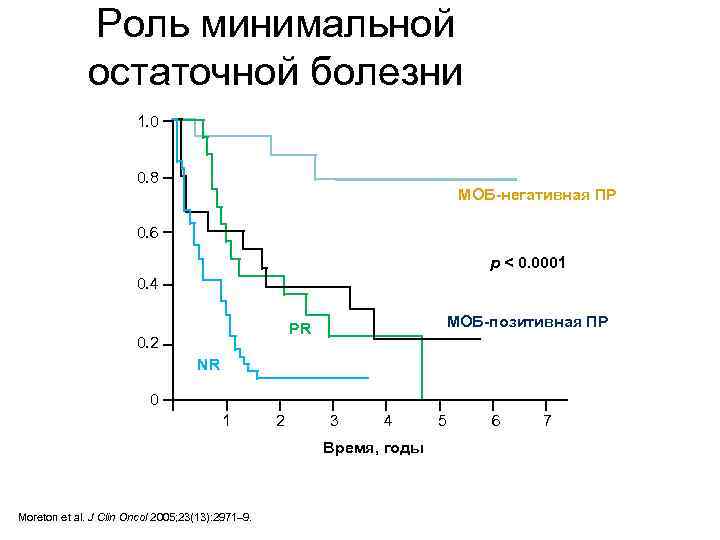 Роль минимальной остаточной болезни 1. 0 0. 8 МОБ-негативная ПР 0. 6 p < 0. 0001 0. 4 МОБ-позитивная ПР PR 0. 2 NR 0 1 2 3 4 Время, годы Moreton et al. J Clin Oncol 2005; 23(13): 2971– 9. 5 6 7
Роль минимальной остаточной болезни 1. 0 0. 8 МОБ-негативная ПР 0. 6 p < 0. 0001 0. 4 МОБ-позитивная ПР PR 0. 2 NR 0 1 2 3 4 Время, годы Moreton et al. J Clin Oncol 2005; 23(13): 2971– 9. 5 6 7
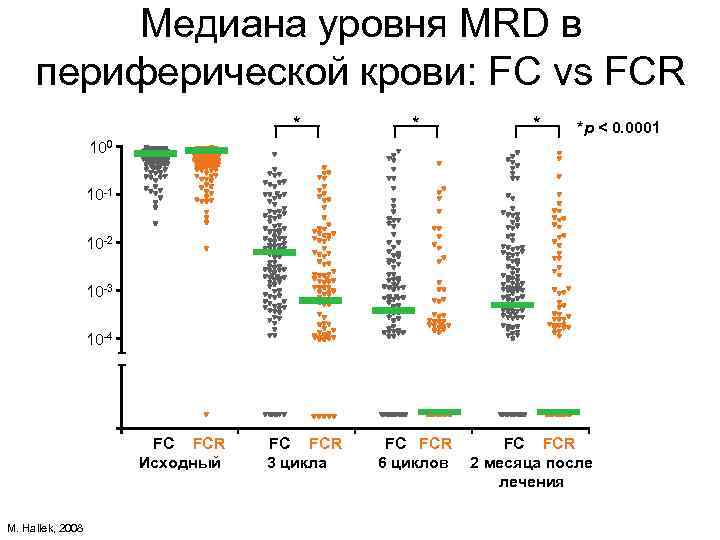 Медиана уровня MRD в периферической крови: FC vs FCR * * * FC FCR 6 циклов FC FCR 2 месяца после лечения *p < 0. 0001 100 10 -1 10 -2 10 -3 10 -4 FC FCR Исходный M. Hallek, 2008 FC FCR 3 цикла
Медиана уровня MRD в периферической крови: FC vs FCR * * * FC FCR 6 циклов FC FCR 2 месяца после лечения *p < 0. 0001 100 10 -1 10 -2 10 -3 10 -4 FC FCR Исходный M. Hallek, 2008 FC FCR 3 цикла
 Минимальная остаточная болезнь Эрадикация МОБ ОВ
Минимальная остаточная болезнь Эрадикация МОБ ОВ
 435 EXTENDED FOLLOW UP OF THE CLL 8 PROTOCOL, A RANDOMIZED PHASE-III TRIAL OF THE GERMAN CLL STUDY GROUP (GCLLSG) COMPARING FLUDARABINE AND CYCLOPHOSPHAMIDE (FC) TO FC PLUS RITUXIMAB (FCR) FOR PREVIOUSLY UNTREATED PATIENTS WITH CHRONIC LYMPHOCYTIC LEUKEMIA (CLL) Kirsten Fischer, MD, Jasmin Bahlo, Anna-Maria Fink, MD, Raymonde Busch, Sebastian Böttcher, MD, Jiri Mayer, MD, Peter Dreger, MD, Christian Maurer, Anja Engelke, Michael Kneba, MD, Ph. D, Hartmut Döhner, MD, Barbara F. Eichhorst, MD, Clemens-Martin Wendtner, MD, Stephan Stilgenbauer, MD, and Michael Hallek, MD 54 th Annual Meeting of the American Society of Hematology (ASH), Atlanta, December 10, 2012
435 EXTENDED FOLLOW UP OF THE CLL 8 PROTOCOL, A RANDOMIZED PHASE-III TRIAL OF THE GERMAN CLL STUDY GROUP (GCLLSG) COMPARING FLUDARABINE AND CYCLOPHOSPHAMIDE (FC) TO FC PLUS RITUXIMAB (FCR) FOR PREVIOUSLY UNTREATED PATIENTS WITH CHRONIC LYMPHOCYTIC LEUKEMIA (CLL) Kirsten Fischer, MD, Jasmin Bahlo, Anna-Maria Fink, MD, Raymonde Busch, Sebastian Böttcher, MD, Jiri Mayer, MD, Peter Dreger, MD, Christian Maurer, Anja Engelke, Michael Kneba, MD, Ph. D, Hartmut Döhner, MD, Barbara F. Eichhorst, MD, Clemens-Martin Wendtner, MD, Stephan Stilgenbauer, MD, and Michael Hallek, MD 54 th Annual Meeting of the American Society of Hematology (ASH), Atlanta, December 10, 2012
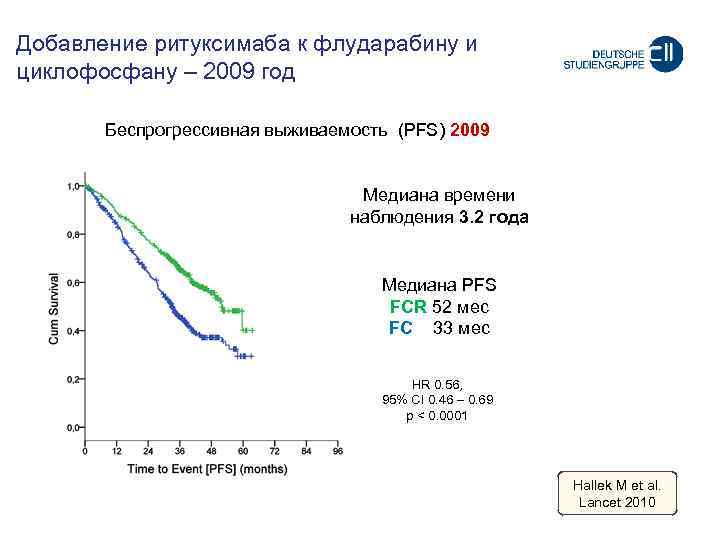 Добавление ритуксимаба к флударабину и циклофосфану – 2009 год Беспрогрессивная выживаемость (PFS) 2009 Mедиана времени наблюдения 3. 2 года Медиана PFS FCR 52 мес FC 33 мес HR 0. 56, 95% CI 0. 46 – 0. 69 p < 0. 0001 Hallek M et al. Lancet 2010
Добавление ритуксимаба к флударабину и циклофосфану – 2009 год Беспрогрессивная выживаемость (PFS) 2009 Mедиана времени наблюдения 3. 2 года Медиана PFS FCR 52 мес FC 33 мес HR 0. 56, 95% CI 0. 46 – 0. 69 p < 0. 0001 Hallek M et al. Lancet 2010
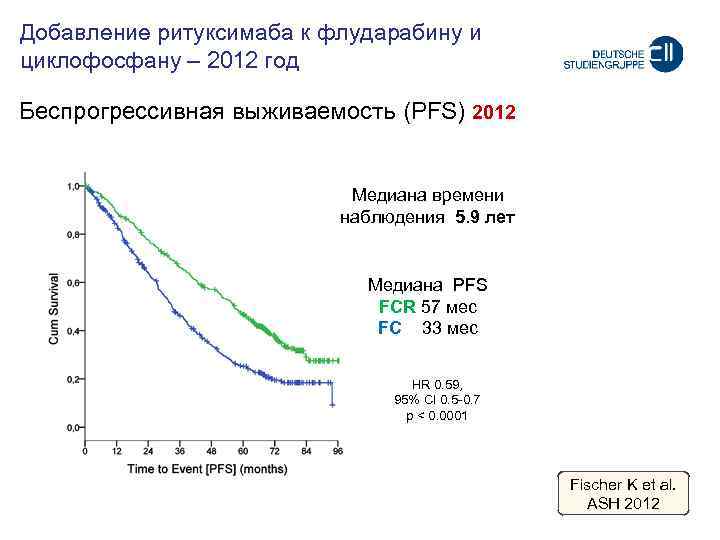 Добавление ритуксимаба к флударабину и циклофосфану – 2012 год Беспрогрессивная выживаемость (PFS) 2012 Meдиана времени наблюдения 5. 9 лет Meдиана PFS FCR 57 мес FC 33 мес HR 0. 59, 95% CI 0. 5 -0. 7 p < 0. 0001 Fischer K et al. ASH 2012
Добавление ритуксимаба к флударабину и циклофосфану – 2012 год Беспрогрессивная выживаемость (PFS) 2012 Meдиана времени наблюдения 5. 9 лет Meдиана PFS FCR 57 мес FC 33 мес HR 0. 59, 95% CI 0. 5 -0. 7 p < 0. 0001 Fischer K et al. ASH 2012
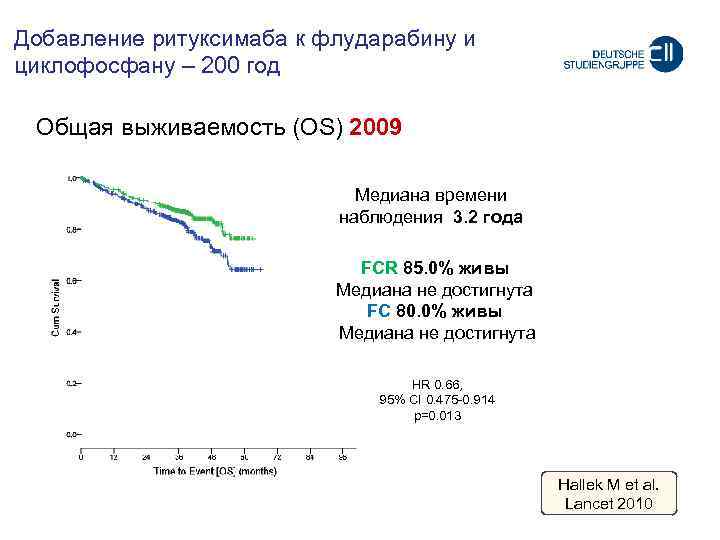 Добавление ритуксимаба к флударабину и циклофосфану – 200 год Oбщая выживаемость (OS) 2009 Meдиана времени наблюдения 3. 2 года FCR 85. 0% живы Meдиана не достигнута FC 80. 0% живы Meдиана не достигнута HR 0. 66, 95% CI 0. 475 -0. 914 p=0. 013 Hallek M et al. Lancet 2010
Добавление ритуксимаба к флударабину и циклофосфану – 200 год Oбщая выживаемость (OS) 2009 Meдиана времени наблюдения 3. 2 года FCR 85. 0% живы Meдиана не достигнута FC 80. 0% живы Meдиана не достигнута HR 0. 66, 95% CI 0. 475 -0. 914 p=0. 013 Hallek M et al. Lancet 2010
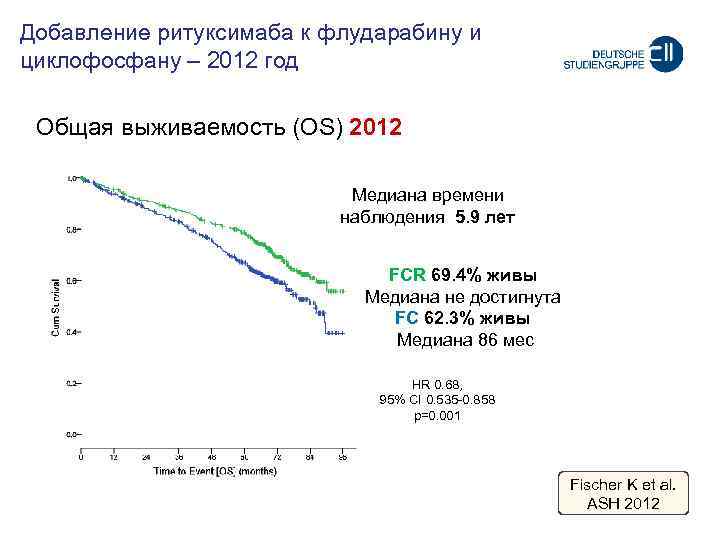 Добавление ритуксимаба к флударабину и циклофосфану – 2012 год Oбщая выживаемость (OS) 2012 Meдиана времени наблюдения 5. 9 лет FCR 69. 4% живы Meдиана не достигнута FC 62. 3% живы Meдиана 86 мес HR 0. 68, 95% CI 0. 535 -0. 858 p=0. 001 Fischer K et al. ASH 2012
Добавление ритуксимаба к флударабину и циклофосфану – 2012 год Oбщая выживаемость (OS) 2012 Meдиана времени наблюдения 5. 9 лет FCR 69. 4% живы Meдиана не достигнута FC 62. 3% живы Meдиана 86 мес HR 0. 68, 95% CI 0. 535 -0. 858 p=0. 001 Fischer K et al. ASH 2012
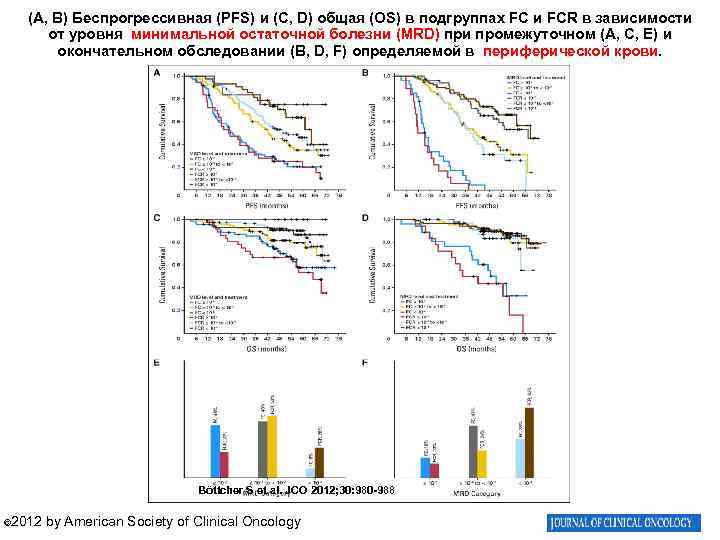 (A, B) Беспрогрессивная (PFS) и (C, D) общая (OS) в подгруппах FС и FCR в зависимости от уровня минимальной остаточной болезни (MRD) при промежуточном (A, C, E) и окончательном обследовании (B, D, F) определяемой в периферической крови. Böttcher S et al. JCO 2012; 30: 980 -988 © 2012 by American Society of Clinical Oncology
(A, B) Беспрогрессивная (PFS) и (C, D) общая (OS) в подгруппах FС и FCR в зависимости от уровня минимальной остаточной болезни (MRD) при промежуточном (A, C, E) и окончательном обследовании (B, D, F) определяемой в периферической крови. Böttcher S et al. JCO 2012; 30: 980 -988 © 2012 by American Society of Clinical Oncology
 Индивидуализация подходов – возраст и тяжесть сопутствующей патологии
Индивидуализация подходов – возраст и тяжесть сопутствующей патологии
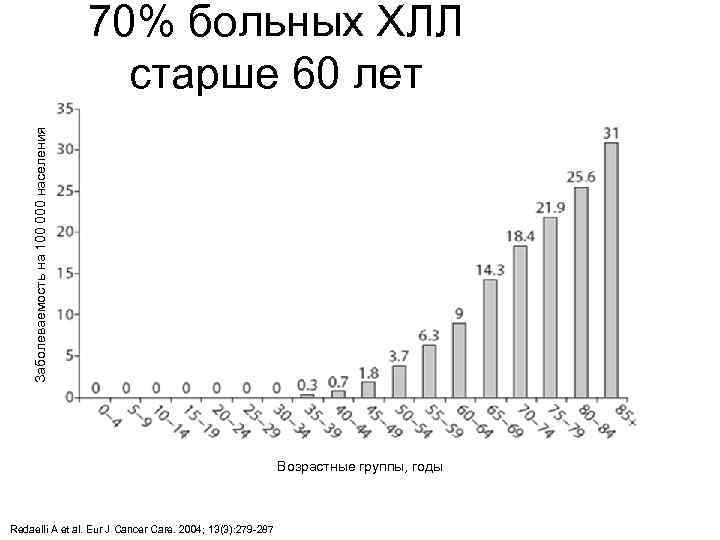 Заболеваемость на 100 000 населения 70% больных ХЛЛ старше 60 лет СПб. ГМУ им. И. П. Павлова Возрастные группы, годы Redaelli A et al. Eur J Cancer Care. 2004; 13(3): 279 -287
Заболеваемость на 100 000 населения 70% больных ХЛЛ старше 60 лет СПб. ГМУ им. И. П. Павлова Возрастные группы, годы Redaelli A et al. Eur J Cancer Care. 2004; 13(3): 279 -287
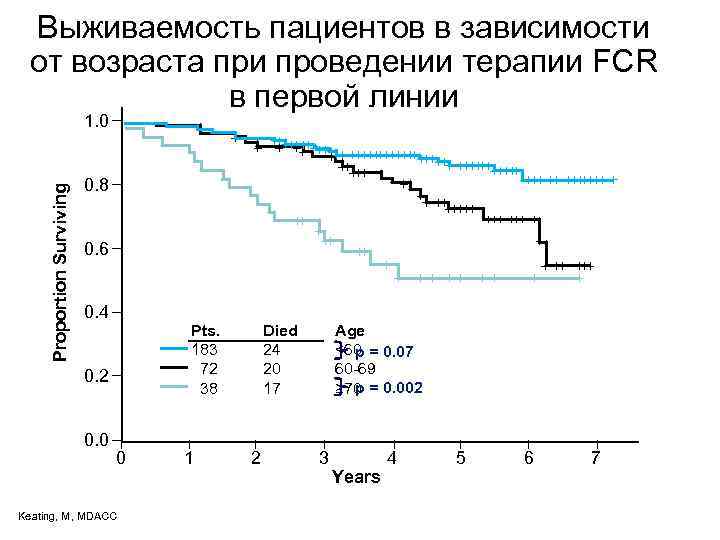 Выживаемость пациентов в зависимости от возраста при проведении терапии FCR в первой линии Proportion Surviving 1. 0 0. 8 0. 6 0. 4 Pts. 183 72 38 0. 2 0. 0 0 Keating, M, MDACC 1 Died 24 20 17 2 Age <60 p = 0. 07 60 -69 p = 0. 002 ≥ 70 3 Years 4 5 6 7
Выживаемость пациентов в зависимости от возраста при проведении терапии FCR в первой линии Proportion Surviving 1. 0 0. 8 0. 6 0. 4 Pts. 183 72 38 0. 2 0. 0 0 Keating, M, MDACC 1 Died 24 20 17 2 Age <60 p = 0. 07 60 -69 p = 0. 002 ≥ 70 3 Years 4 5 6 7
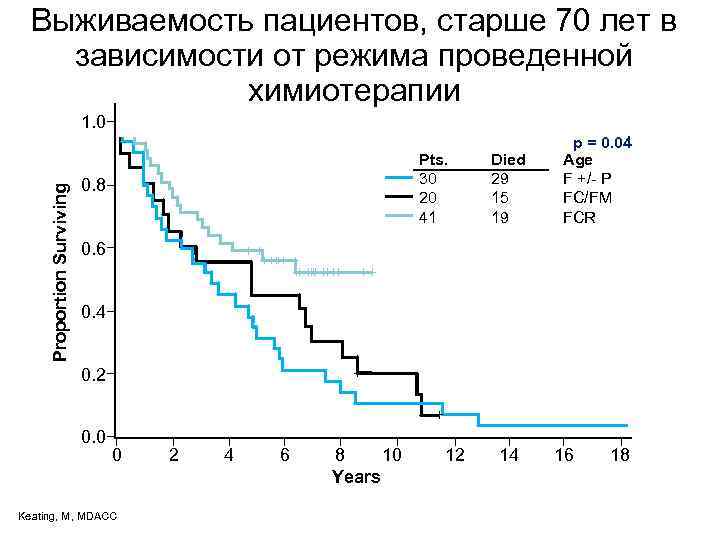 Выживаемость пациентов, старше 70 лет в зависимости от режима проведенной химиотерапии Proportion Surviving Proportion 1. 0 Pts. 30 20 41 0. 8 p=0. 04 p = 0. 04 Died 29 15 19 Age F +/- P FC/FM FCR 0. 6 0. 4 0. 2 0. 0 0 Keating, M, MDACC 2 4 6 8 10 Years 12 14 16 18
Выживаемость пациентов, старше 70 лет в зависимости от режима проведенной химиотерапии Proportion Surviving Proportion 1. 0 Pts. 30 20 41 0. 8 p=0. 04 p = 0. 04 Died 29 15 19 Age F +/- P FC/FM FCR 0. 6 0. 4 0. 2 0. 0 0 Keating, M, MDACC 2 4 6 8 10 Years 12 14 16 18
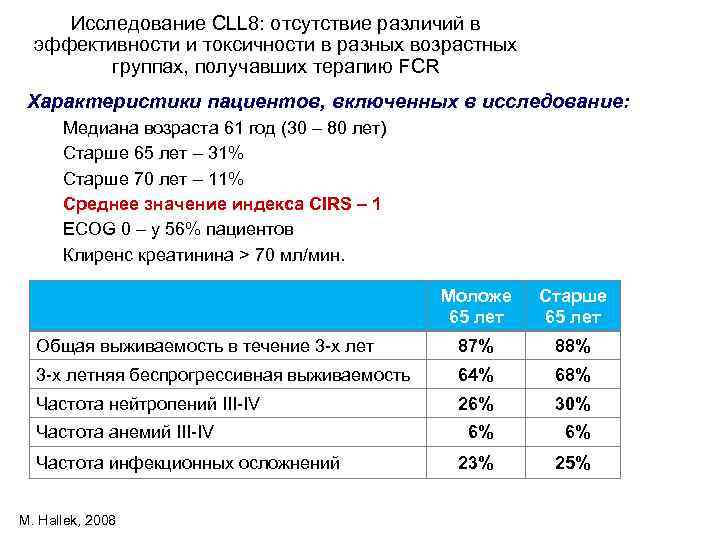 Исследование CLL 8: отсутствие различий в эффективности и токсичности в разных возрастных группах, получавших терапию FCR Характеристики пациентов, включенных в исследование: Медиана возраста 61 год (30 – 80 лет) Старше 65 лет – 31% Старше 70 лет – 11% Среднее значение индекса CIRS – 1 ECOG 0 – у 56% пациентов Клиренс креатинина > 70 мл/мин. Моложе 65 лет Старше 65 лет Общая выживаемость в течение 3 -х лет 87% 88% 3 -х летняя беспрогрессивная выживаемость 64% 68% Частота нейтропений III-IV 26% 30% Частота анемий III-IV 6% Частота инфекционных осложнений 23% 25% M. Hallek, 2008
Исследование CLL 8: отсутствие различий в эффективности и токсичности в разных возрастных группах, получавших терапию FCR Характеристики пациентов, включенных в исследование: Медиана возраста 61 год (30 – 80 лет) Старше 65 лет – 31% Старше 70 лет – 11% Среднее значение индекса CIRS – 1 ECOG 0 – у 56% пациентов Клиренс креатинина > 70 мл/мин. Моложе 65 лет Старше 65 лет Общая выживаемость в течение 3 -х лет 87% 88% 3 -х летняя беспрогрессивная выживаемость 64% 68% Частота нейтропений III-IV 26% 30% Частота анемий III-IV 6% Частота инфекционных осложнений 23% 25% M. Hallek, 2008
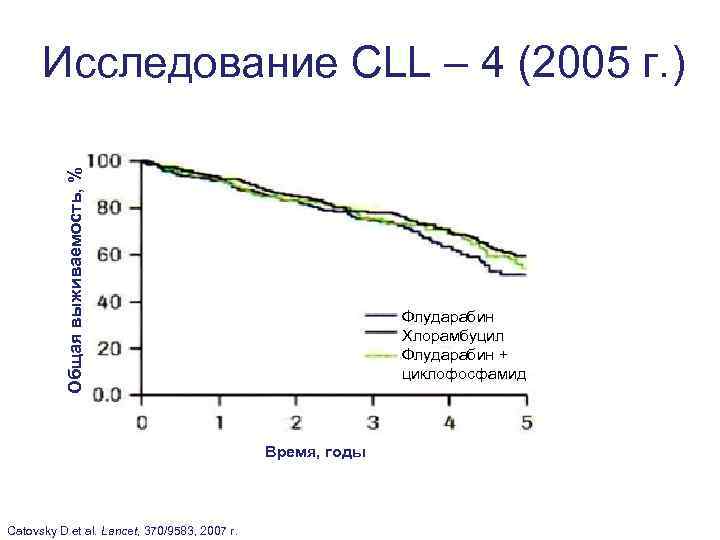 Общая выживаемость, % Исследование CLL – 4 (2005 г. ) Флударабин Хлорамбуцил Флударабин + циклофосфамид Время, годы Catovsky D et al. Lancet, 370/9583, 2007 г.
Общая выживаемость, % Исследование CLL – 4 (2005 г. ) Флударабин Хлорамбуцил Флударабин + циклофосфамид Время, годы Catovsky D et al. Lancet, 370/9583, 2007 г.
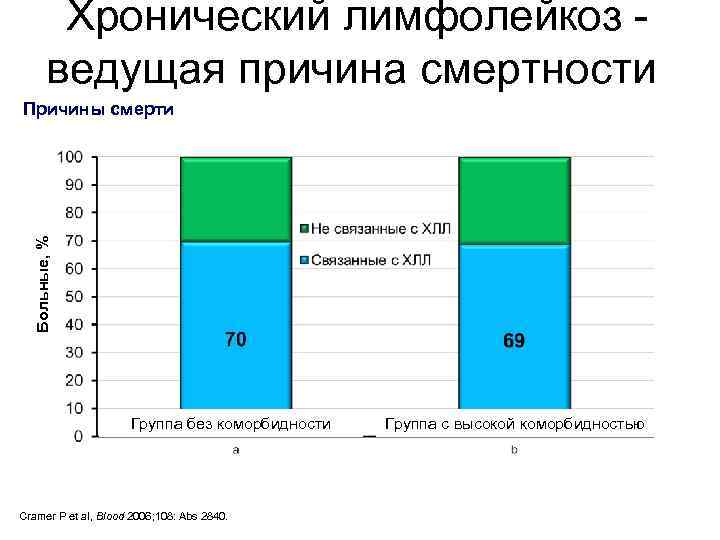 Хронический лимфолейкоз - ведущая причина смертности Больные, % Причины смерти Группа без коморбидности Cramer P et al, Blood 2006; 108: Abs 2840. Группа с высокой коморбидностью
Хронический лимфолейкоз - ведущая причина смертности Больные, % Причины смерти Группа без коморбидности Cramer P et al, Blood 2006; 108: Abs 2840. Группа с высокой коморбидностью
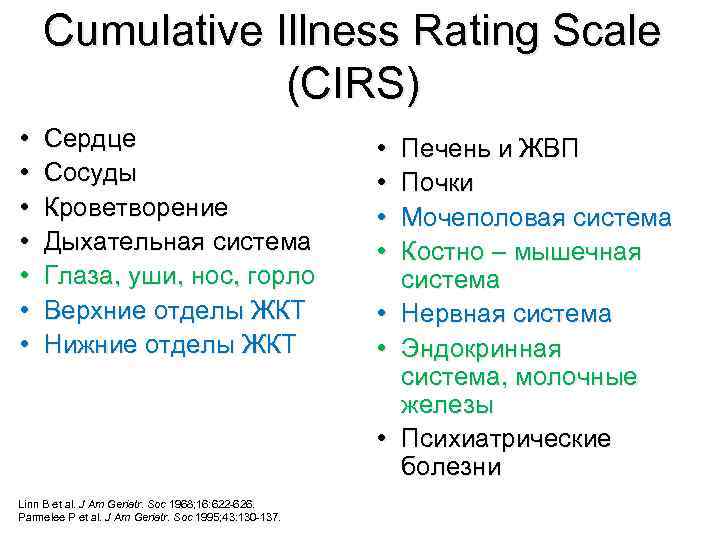 Cumulative Illness Rating Scale (CIRS) • • Ceрдце Сосуды Кроветворение Дыхательная система Глаза, уши, нос, горло Верхние отделы ЖКТ Нижние отделы ЖКТ • • Linn B et al. J Am Geriatr. Soc 1968; 16: 622 -626. Parmelee P et al. J Am Geriatr. Soc 1995; 43: 130 -137. Печень и ЖВП Почки Мочеполовая система Костно – мышечная система Нервная система Эндокринная система, молочные железы Психиатрические болезни
Cumulative Illness Rating Scale (CIRS) • • Ceрдце Сосуды Кроветворение Дыхательная система Глаза, уши, нос, горло Верхние отделы ЖКТ Нижние отделы ЖКТ • • Linn B et al. J Am Geriatr. Soc 1968; 16: 622 -626. Parmelee P et al. J Am Geriatr. Soc 1995; 43: 130 -137. Печень и ЖВП Почки Мочеполовая система Костно – мышечная система Нервная система Эндокринная система, молочные железы Психиатрические болезни
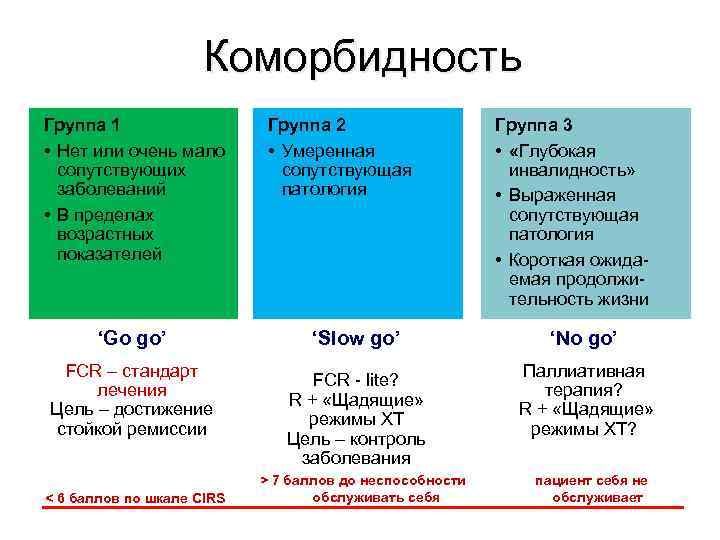 Коморбидность Группа 1 • Нет или очень мало сопутствующих заболеваний • В пределах возрастных показателей ‘Go go’ FCR – стандарт лечения Цель – достижение стойкой ремиссии < 6 баллов по шкале CIRS Группа 2 • Умеренная сопутствующая патология ‘Slow go’ FCR - lite? R + «Щадящие» режимы ХТ Цель – контроль заболевания > 7 баллов до неспособности обслуживать себя Группа 3 • «Глубокая инвалидность» • Выраженная сопутствующая патология • Короткая ожидаемая продолжительность жизни ‘No go’ Паллиативная терапия? R + «Щадящие» режимы ХТ? пациент себя не обслуживает
Коморбидность Группа 1 • Нет или очень мало сопутствующих заболеваний • В пределах возрастных показателей ‘Go go’ FCR – стандарт лечения Цель – достижение стойкой ремиссии < 6 баллов по шкале CIRS Группа 2 • Умеренная сопутствующая патология ‘Slow go’ FCR - lite? R + «Щадящие» режимы ХТ Цель – контроль заболевания > 7 баллов до неспособности обслуживать себя Группа 3 • «Глубокая инвалидность» • Выраженная сопутствующая патология • Короткая ожидаемая продолжительность жизни ‘No go’ Паллиативная терапия? R + «Щадящие» режимы ХТ? пациент себя не обслуживает
 Модель пациента «slow go – no go» (женщина) • Ожирение с ИМТ>30 (т. е. ожирение I ст. ) • Гистерэктомия 15 лет назад • Компрессионный перелом позвоночника 2 года назад из-за остеопороза, в настоящий момент не нарушающий жизнедеятельность. • Амбулаторное лечение депрессии 5 лет назад • Жалобы на изжогу с приемом лекарств при необходимости • Ежедневная антигипертензивная терапия • Гипертрофия левого желудочка Сумма баллов = 12
Модель пациента «slow go – no go» (женщина) • Ожирение с ИМТ>30 (т. е. ожирение I ст. ) • Гистерэктомия 15 лет назад • Компрессионный перелом позвоночника 2 года назад из-за остеопороза, в настоящий момент не нарушающий жизнедеятельность. • Амбулаторное лечение депрессии 5 лет назад • Жалобы на изжогу с приемом лекарств при необходимости • Ежедневная антигипертензивная терапия • Гипертрофия левого желудочка Сумма баллов = 12
 Могут ли и хотят ли жить дольше пациенты с: • состоянием после аорто – коронарного шунтирования (CIRS = 4) • функциональной слепотой (CIRS = 4) • функциональной глухотой (CIRS = 4) • артритами/артрозами, перенесшие протезирование суставов (CIRS = 4) Что такое тяжелая органная дисфункция?
Могут ли и хотят ли жить дольше пациенты с: • состоянием после аорто – коронарного шунтирования (CIRS = 4) • функциональной слепотой (CIRS = 4) • функциональной глухотой (CIRS = 4) • артритами/артрозами, перенесшие протезирование суставов (CIRS = 4) Что такое тяжелая органная дисфункция?
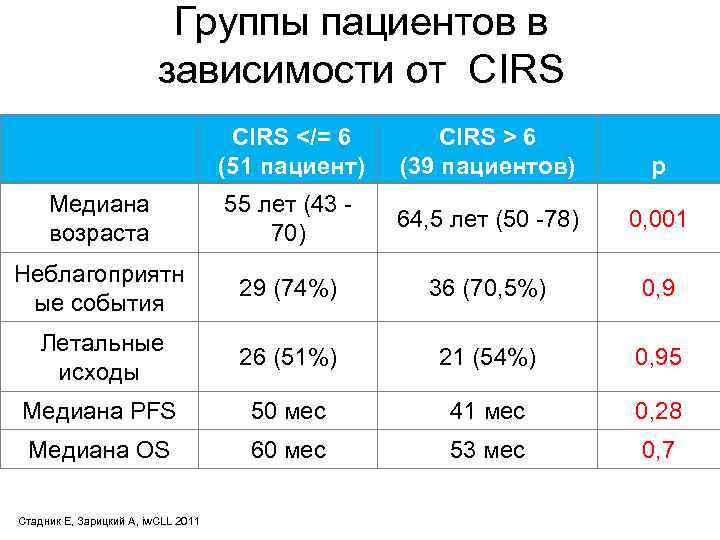 Группы пациентов в зависимости от СIRS CIRS 6 (39 пациентов) p Медиана возраста 55 лет (43 - 70) 64, 5 лет (50 -78) 0, 001 Неблагоприятн ые события 29 (74%) 36 (70, 5%) 0, 9 Летальные исходы 26 (51%) 21 (54%) 0, 95 Медиана PFS 50 мес 41 мес 0, 28 Медиана OS 60 мес 53 мес 0, 7 Стадник Е, Зарицкий А, iw. CLL 2011
Группы пациентов в зависимости от СIRS CIRS 6 (39 пациентов) p Медиана возраста 55 лет (43 - 70) 64, 5 лет (50 -78) 0, 001 Неблагоприятн ые события 29 (74%) 36 (70, 5%) 0, 9 Летальные исходы 26 (51%) 21 (54%) 0, 95 Медиана PFS 50 мес 41 мес 0, 28 Медиана OS 60 мес 53 мес 0, 7 Стадник Е, Зарицкий А, iw. CLL 2011
 Общая выживаемость в зависимости от индекса коморбидности в группах FC и FCR Медиана ОВ FCR – не достигнута Медиана ОВ FC: CIRS ≤ 6 – 44 мес. , CIRS > 6 – 46 мес.
Общая выживаемость в зависимости от индекса коморбидности в группах FC и FCR Медиана ОВ FCR – не достигнута Медиана ОВ FC: CIRS ≤ 6 – 44 мес. , CIRS > 6 – 46 мес.
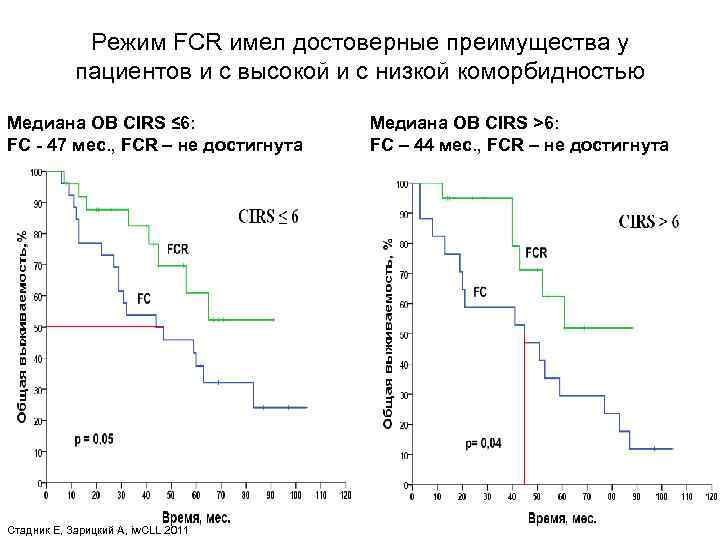 Режим FCR имел достоверные преимущества у пациентов и с высокой и с низкой коморбидностью Медиана ОВ CIRS ≤ 6: FC - 47 мес. , FCR – не достигнута Стадник Е, Зарицкий А, iw. CLL 2011 Медиана ОВ CIRS >6: FC – 44 мес. , FCR – не достигнута
Режим FCR имел достоверные преимущества у пациентов и с высокой и с низкой коморбидностью Медиана ОВ CIRS ≤ 6: FC - 47 мес. , FCR – не достигнута Стадник Е, Зарицкий А, iw. CLL 2011 Медиана ОВ CIRS >6: FC – 44 мес. , FCR – не достигнута
 Индивидуализация подходов – как минимизировать токсичность? ?
Индивидуализация подходов – как минимизировать токсичность? ?
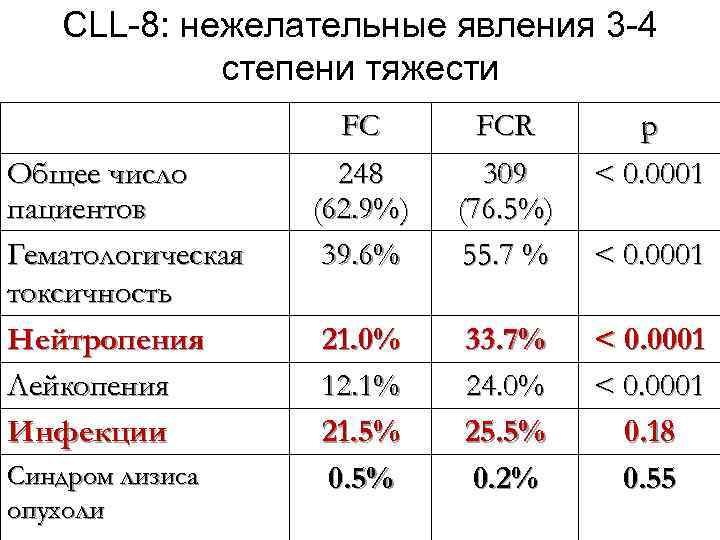 CLL-8: нежелательные явления 3 -4 степени тяжести Общее число пациентов Гематологическая токсичность Нейтропения Лейкопения Инфекции Синдром лизиса опухоли FC 248 (62. 9%) 39. 6% FCR 309 (76. 5%) 55. 7 % p < 0. 0001 21. 0% 12. 1% 21. 5% 0. 5% 33. 7% 24. 0% 25. 5% 0. 2% < 0. 0001 0. 18 0. 55 < 0. 0001
CLL-8: нежелательные явления 3 -4 степени тяжести Общее число пациентов Гематологическая токсичность Нейтропения Лейкопения Инфекции Синдром лизиса опухоли FC 248 (62. 9%) 39. 6% FCR 309 (76. 5%) 55. 7 % p < 0. 0001 21. 0% 12. 1% 21. 5% 0. 5% 33. 7% 24. 0% 25. 5% 0. 2% < 0. 0001 0. 18 0. 55 < 0. 0001
 Сравнение гематологической и негематологической токсичности режимов «FC» и «FCR» FC (240 циклов) FCR (199 циклов) P Нейтропения III-IV 29% 39% 0, 02 Тромбоцитопения III – IV 3, 8% 3% н. з. Анемия I – II 14, 7% 15% н. з. 28 (12%) 19 (9, 5%) н. з. Пневмония 10 (4%) 4 (2%) н. з. Герпетическая инфекция 10 (4%) 3 (1, 5%) 0, 09 Гемолиз 2 (0, 8%) - н. з. Сепсис 2 (0, 8%) 1 (0, 5%) н. з. Осложнения Лихорадка на нейтропении фоне Е. А. Стадник, Е. А. Никитин, А. Ю. Зарицкий // Онкогематология – 2008. - № 1 -2. -с. 39 -47
Сравнение гематологической и негематологической токсичности режимов «FC» и «FCR» FC (240 циклов) FCR (199 циклов) P Нейтропения III-IV 29% 39% 0, 02 Тромбоцитопения III – IV 3, 8% 3% н. з. Анемия I – II 14, 7% 15% н. з. 28 (12%) 19 (9, 5%) н. з. Пневмония 10 (4%) 4 (2%) н. з. Герпетическая инфекция 10 (4%) 3 (1, 5%) 0, 09 Гемолиз 2 (0, 8%) - н. з. Сепсис 2 (0, 8%) 1 (0, 5%) н. з. Осложнения Лихорадка на нейтропении фоне Е. А. Стадник, Е. А. Никитин, А. Ю. Зарицкий // Онкогематология – 2008. - № 1 -2. -с. 39 -47
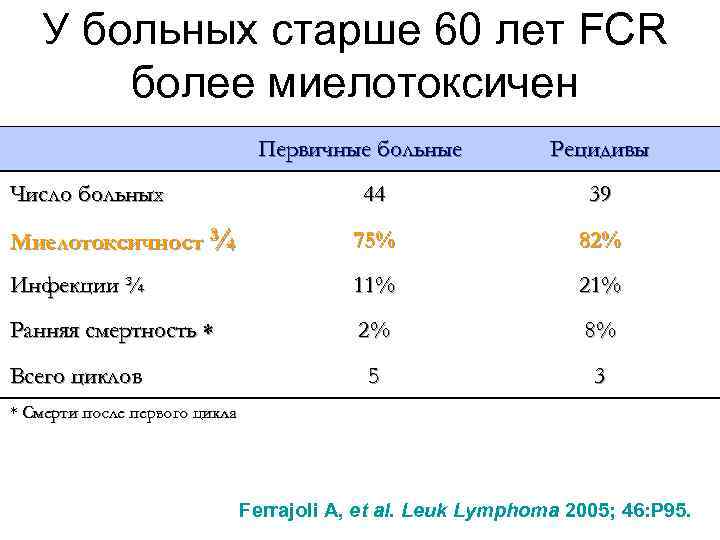 У больных старше 60 лет FCR более миелотоксичен Первичные больные Число больных Рецидивы 44 39 Миелотоксичност ¾ 75% 82% Инфекции ¾ 11% 21% Ранняя смертность 2% 8% 5 3 Всего циклов * Смерти после первого цикла Ferrajoli A, et al. Leuk Lymphoma 2005; 46: P 95.
У больных старше 60 лет FCR более миелотоксичен Первичные больные Число больных Рецидивы 44 39 Миелотоксичност ¾ 75% 82% Инфекции ¾ 11% 21% Ранняя смертность 2% 8% 5 3 Всего циклов * Смерти после первого цикла Ferrajoli A, et al. Leuk Lymphoma 2005; 46: P 95.
 Зависимость миелотокичности от возраста и скорости клубочковой фильтрации Нейтропения III-IV Анемия I – II Тромбоцитопения III-IV Нейтропения III-IV Анемия I – II Тромбоцитопения IIIIV >70 мл/мин 25, 7% 14% 3, 5% <70 мл/мин 48, 2% 18% 3, 4% <0, 001 0, 23 H. З. <60 лет 28% 15, 8% 3, 2% >60 лет 44% 15, 7% 3, 3% P <0, 001 0, 23 H. З. Cтадник Е, Никитин Е. , Зарицкий А Совр. Онкол, 2008 г. P
Зависимость миелотокичности от возраста и скорости клубочковой фильтрации Нейтропения III-IV Анемия I – II Тромбоцитопения III-IV Нейтропения III-IV Анемия I – II Тромбоцитопения IIIIV >70 мл/мин 25, 7% 14% 3, 5% <70 мл/мин 48, 2% 18% 3, 4% <0, 001 0, 23 H. З. <60 лет 28% 15, 8% 3, 2% >60 лет 44% 15, 7% 3, 3% P <0, 001 0, 23 H. З. Cтадник Е, Никитин Е. , Зарицкий А Совр. Онкол, 2008 г. P
 После 60 лет, практически у каждого можно выявить хроническую болезнь почек (ХБП) • 7, 6 млн. – 3 стадия ХБП и у 400 тыс. – 4 стадия (National Health and Nutrition Examination Survey 1988 -1994) • У 55. 2 млн. человек наблюдается ХБП 2 -й стадии с СКФ 60 -89 мл/мин/1. 73 м² • Более, чем у 50% людей в возрасте > 60 лет существует ХБП 2 стадии и выше • В США у 4, 7% населения, т. е. > 13 млн людей СКФ < 60 мл/мин/1. 73 м² Lederer E, Ouseph R, Am J Kid Dis, Vol 49, N 1, 2007: 162 -171
После 60 лет, практически у каждого можно выявить хроническую болезнь почек (ХБП) • 7, 6 млн. – 3 стадия ХБП и у 400 тыс. – 4 стадия (National Health and Nutrition Examination Survey 1988 -1994) • У 55. 2 млн. человек наблюдается ХБП 2 -й стадии с СКФ 60 -89 мл/мин/1. 73 м² • Более, чем у 50% людей в возрасте > 60 лет существует ХБП 2 стадии и выше • В США у 4, 7% населения, т. е. > 13 млн людей СКФ < 60 мл/мин/1. 73 м² Lederer E, Ouseph R, Am J Kid Dis, Vol 49, N 1, 2007: 162 -171
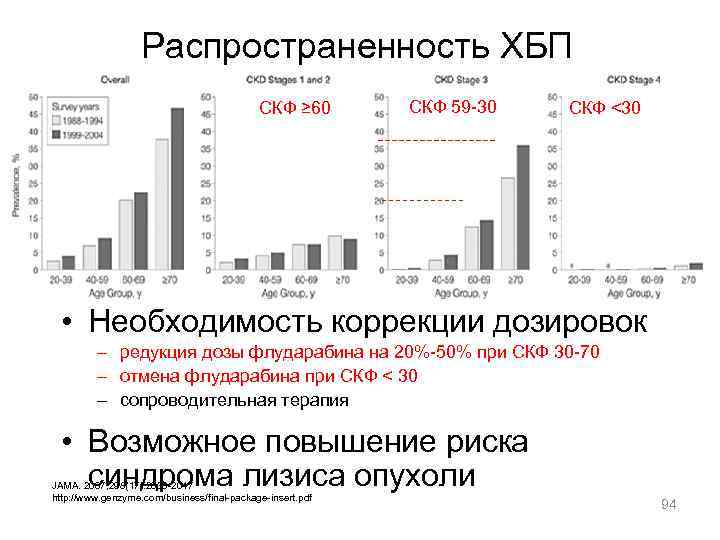 Распространенность ХБП СКФ ≥ 60 СКФ 59 -30 СКФ <30 • Необходимость коррекции дозировок – редукция дозы флударабина на 20%-50% при СКФ 30 -70 – отмена флударабина при СКФ < 30 – сопроводительная терапия • Возможное повышение риска синдрома лизиса опухоли JAMA. 2007; 298(17): 2038 -2047 http: //www. genzyme. com/business/final-package-insert. pdf 94
Распространенность ХБП СКФ ≥ 60 СКФ 59 -30 СКФ <30 • Необходимость коррекции дозировок – редукция дозы флударабина на 20%-50% при СКФ 30 -70 – отмена флударабина при СКФ < 30 – сопроводительная терапия • Возможное повышение риска синдрома лизиса опухоли JAMA. 2007; 298(17): 2038 -2047 http: //www. genzyme. com/business/final-package-insert. pdf 94
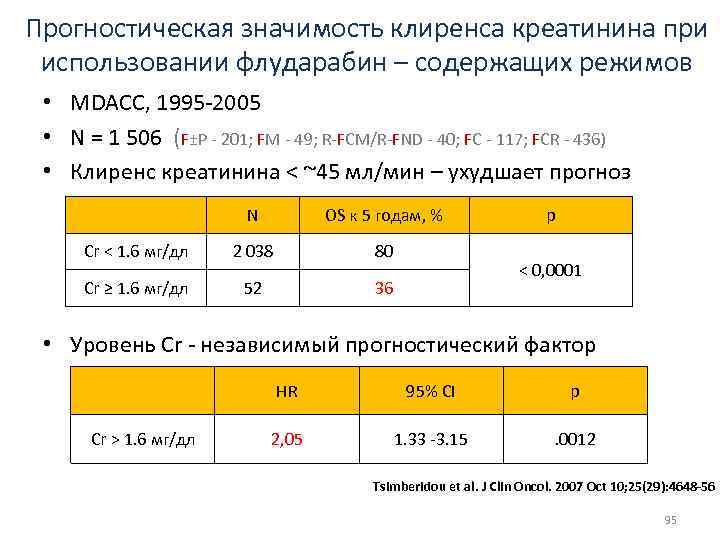 Прогностическая значимость клиренса креатинина при использовании флударабин – содержащих режимов • MDACC, 1995 -2005 • N = 1 506 (F±P - 201; FM - 49; R-FCM/R-FND - 40; FC - 117; FCR - 436) • Клиренс креатинина < ~45 мл/мин – ухудшает прогноз N OS к 5 годам, % Cr < 1. 6 мг/дл 2 038 80 Cr ≥ 1. 6 мг/дл 52 36 p < 0, 0001 • Уровень Cr - независимый прогностический фактор HR Cr > 1. 6 мг/дл 95% CI p 2, 05 1. 33 -3. 15 . 0012 Tsimberidou et al. J Clin Oncol. 2007 Oct 10; 25(29): 4648 -56 95
Прогностическая значимость клиренса креатинина при использовании флударабин – содержащих режимов • MDACC, 1995 -2005 • N = 1 506 (F±P - 201; FM - 49; R-FCM/R-FND - 40; FC - 117; FCR - 436) • Клиренс креатинина < ~45 мл/мин – ухудшает прогноз N OS к 5 годам, % Cr < 1. 6 мг/дл 2 038 80 Cr ≥ 1. 6 мг/дл 52 36 p < 0, 0001 • Уровень Cr - независимый прогностический фактор HR Cr > 1. 6 мг/дл 95% CI p 2, 05 1. 33 -3. 15 . 0012 Tsimberidou et al. J Clin Oncol. 2007 Oct 10; 25(29): 4648 -56 95
 FCR Флударабин § Гемолиз § Длительная глубокая Тклеточная деплеция, оппортун. инфекции § Повреждение стволовых клеток –цитопении, в т. ч. отсроченные Циклофосфамид § Иммуносупрессия § Вторичные опухоли § Тошнота 96
FCR Флударабин § Гемолиз § Длительная глубокая Тклеточная деплеция, оппортун. инфекции § Повреждение стволовых клеток –цитопении, в т. ч. отсроченные Циклофосфамид § Иммуносупрессия § Вторичные опухоли § Тошнота 96
 Отдаленная токсичность FCR • MDACC – 6 курсов FCR • … 19% больных - персистенция цитопении (АЧН < 1 x 109/л и/или TR < 50 x 109/л) в течение как минимум 3 месяцев • … 28% больных - эпизоды отсроченной цитопении п/е восстановления гемопоэза • … 8% эпизодов нейтропении ассоциированы с инфекциями • … риск инфекций 3 -4 степени в течение первого года – 10% • … оппортунистический характер части инфекций Pneumocystis, Legionella, Listeria, Aspergillus, микозы Tam et al. Blood 2008 112: 975 -980
Отдаленная токсичность FCR • MDACC – 6 курсов FCR • … 19% больных - персистенция цитопении (АЧН < 1 x 109/л и/или TR < 50 x 109/л) в течение как минимум 3 месяцев • … 28% больных - эпизоды отсроченной цитопении п/е восстановления гемопоэза • … 8% эпизодов нейтропении ассоциированы с инфекциями • … риск инфекций 3 -4 степени в течение первого года – 10% • … оппортунистический характер части инфекций Pneumocystis, Legionella, Listeria, Aspergillus, микозы Tam et al. Blood 2008 112: 975 -980
 Существующие в настоящее время альтернативные методы терапии I линии
Существующие в настоящее время альтернативные методы терапии I линии
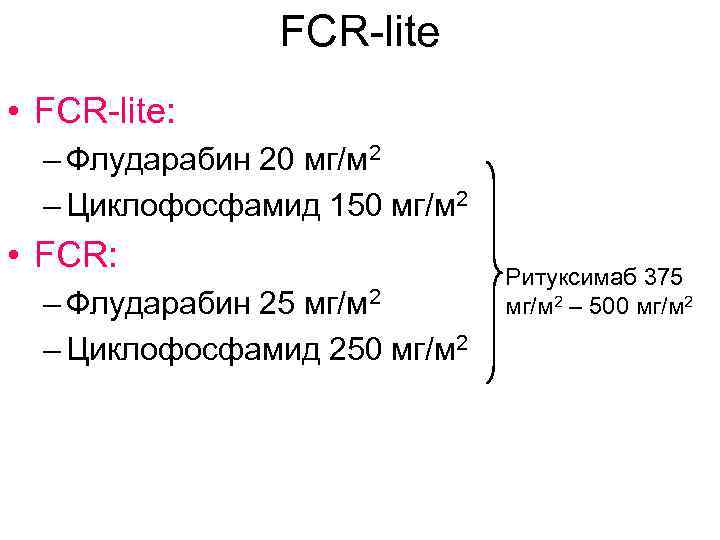 FCR-lite • FCR-lite: – Флударабин 20 мг/м 2 – Циклофосфамид 150 мг/м 2 • FCR: – Флударабин 25 мг/м 2 – Циклофосфамид 250 мг/м 2 Ритуксимаб 375 мг/м 2 – 500 мг/м 2
FCR-lite • FCR-lite: – Флударабин 20 мг/м 2 – Циклофосфамид 150 мг/м 2 • FCR: – Флударабин 25 мг/м 2 – Циклофосфамид 250 мг/м 2 Ритуксимаб 375 мг/м 2 – 500 мг/м 2
 FCR-lite: высокая эффективность и низкая токсичность • • 50 пациентов, медиана возраста – 58 лет (36 -85) Из 50 пац. 20 были на стадии I (Rai) и 22 на стадии II Медиана наблюдения – 27, 1 месяцев Ответ на терапию – Общий - 100%, полный - 77% – Медиана продолжительности ПО – 22, 3 месяца (5, 2 – 42, 3) Нежелательные явления 3 -4 степени – Нейтропения: 13% циклов – Тромбоцитопения: 3% циклов – Нейтропеническая лихорадка – 2 пациента – Один эпизод пневмонии – 1 пациент Foon KA, et al. J Clin Oncol 2009; 27: 498– 503.
FCR-lite: высокая эффективность и низкая токсичность • • 50 пациентов, медиана возраста – 58 лет (36 -85) Из 50 пац. 20 были на стадии I (Rai) и 22 на стадии II Медиана наблюдения – 27, 1 месяцев Ответ на терапию – Общий - 100%, полный - 77% – Медиана продолжительности ПО – 22, 3 месяца (5, 2 – 42, 3) Нежелательные явления 3 -4 степени – Нейтропения: 13% циклов – Тромбоцитопения: 3% циклов – Нейтропеническая лихорадка – 2 пациента – Один эпизод пневмонии – 1 пациент Foon KA, et al. J Clin Oncol 2009; 27: 498– 503.
 R-лейкеран в терапии первой линии ХЛЛ: дизайн • Окончательный анализ UK CLL 208 – Одна ветка, фаза II – Первичные больные (N = 100) • Основная цель: безопасность – Второстепенная цель: эффективность 500 мг/м 2 375 мг/м 2 7 дней Мабтера: 500 мг/м 2 (375 мг/м 2 cycle 1) Лейкеран: 10 мг/м 2/день for 7 дней 21 дней 7 дней 21 дней 7 дней Hillmen P, et al. Blood 2010; 116: Abstract 697.
R-лейкеран в терапии первой линии ХЛЛ: дизайн • Окончательный анализ UK CLL 208 – Одна ветка, фаза II – Первичные больные (N = 100) • Основная цель: безопасность – Второстепенная цель: эффективность 500 мг/м 2 375 мг/м 2 7 дней Мабтера: 500 мг/м 2 (375 мг/м 2 cycle 1) Лейкеран: 10 мг/м 2/день for 7 дней 21 дней 7 дней 21 дней 7 дней Hillmen P, et al. Blood 2010; 116: Abstract 697.
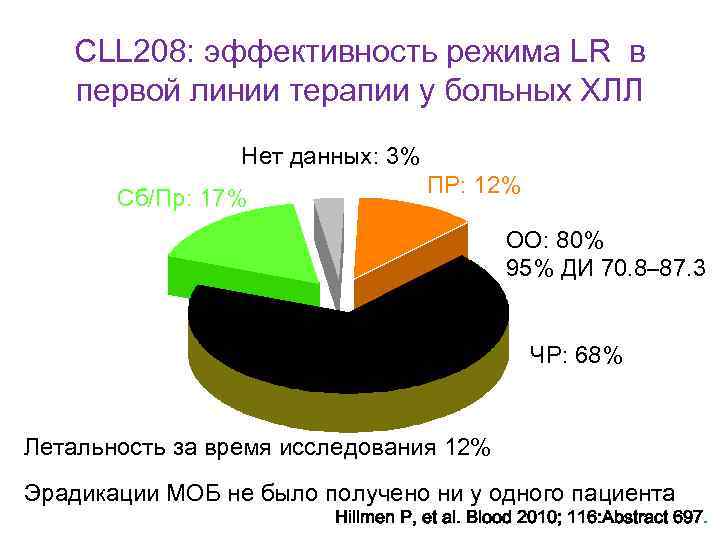 CLL 208: эффективность режима LR в первой линии терапии у больных ХЛЛ Нет данных: 3% Сб/Пр: 17% ПР: 12% ОО: 80% 95% ДИ 70. 8– 87. 3 ЧР: 68% Летальность за время исследования 12% Эрадикации МОБ не было получено ни у одного пациента Hillmen P, et al. Blood 2010; 116: Abstract 697.
CLL 208: эффективность режима LR в первой линии терапии у больных ХЛЛ Нет данных: 3% Сб/Пр: 17% ПР: 12% ОО: 80% 95% ДИ 70. 8– 87. 3 ЧР: 68% Летальность за время исследования 12% Эрадикации МОБ не было получено ни у одного пациента Hillmen P, et al. Blood 2010; 116: Abstract 697.
 Пути оптимизации выживаемости пациентов с ХЛЛ Proportion 1. Повышение эффективности p=0. 04 -Новые моноклональные антитела -Новые цитостатики 2. Снижение токсичности Годы Keating, M. , MDACC
Пути оптимизации выживаемости пациентов с ХЛЛ Proportion 1. Повышение эффективности p=0. 04 -Новые моноклональные антитела -Новые цитостатики 2. Снижение токсичности Годы Keating, M. , MDACC
 Бендамустин и ХЛЛ
Бендамустин и ХЛЛ
 Бендамустин ~ 1963 Иприт 1859 1954 1953
Бендамустин ~ 1963 Иприт 1859 1954 1953
 Бендамустин NCI-60 LUNG: NCI-H 23, NCI-H 522, A 549 -ATCC, EKVX, NCI-H 226, NCI-H 332 M, H 460, H 0 P 62, HOP 92 COLON: HT 29, HCC-2998, HCT 116, SW 620, COLO 205, HCT 15, KM 12 BREAST: MCF 7, MCF 7 ADRr, MDAMB 231, HS 578 T, MDAMB 435, MDN, BT 549, T 47 D OVARIAN: OVCAR 3, OVCAR 4, OVCAR 5, OVCAR 8, IGROV 1, SKOV 3 LEUKEMIA: CCRFCEM, K 562, MOLT 4, HL 60, RPMI 8266, SR RENAL: UO 31, SN 12 C, A 498, CAKI 1, RXF 393, 7860, ACHN, TK 10 MELANOMA: LOXIMVI, MALME 3 M, SKMEL 2, SKMEL 5, SKMEL 28, M 14, UACC 62, UACC 257 PROSTATE: PC 3, DU 145 107 CNS: SNB 19, SNB 75, Клинический разбор
Бендамустин NCI-60 LUNG: NCI-H 23, NCI-H 522, A 549 -ATCC, EKVX, NCI-H 226, NCI-H 332 M, H 460, H 0 P 62, HOP 92 COLON: HT 29, HCC-2998, HCT 116, SW 620, COLO 205, HCT 15, KM 12 BREAST: MCF 7, MCF 7 ADRr, MDAMB 231, HS 578 T, MDAMB 435, MDN, BT 549, T 47 D OVARIAN: OVCAR 3, OVCAR 4, OVCAR 5, OVCAR 8, IGROV 1, SKOV 3 LEUKEMIA: CCRFCEM, K 562, MOLT 4, HL 60, RPMI 8266, SR RENAL: UO 31, SN 12 C, A 498, CAKI 1, RXF 393, 7860, ACHN, TK 10 MELANOMA: LOXIMVI, MALME 3 M, SKMEL 2, SKMEL 5, SKMEL 28, M 14, UACC 62, UACC 257 PROSTATE: PC 3, DU 145 107 CNS: SNB 19, SNB 75, Клинический разбор
 Бендамустин Апоптоз Некроз Аутофагия Митотическая катастрофа 11. 02. 2018 Nature Reviews Molecular Cell Biology 12, 385 -392 (June 2011) Клинический разбор 108
Бендамустин Апоптоз Некроз Аутофагия Митотическая катастрофа 11. 02. 2018 Nature Reviews Molecular Cell Biology 12, 385 -392 (June 2011) Клинический разбор 108
 Сравнение Бендамустина с циклофосфамидом и хлорамбуцилом Циклофосфан и хлорбутин • Химически нестабильны • Обратимые повреждения даже при длительном воздействии • Быстрая репарация повреждений ДНК • Гибель клетки в основном за счет остановки клеточного цикла и апоптоза • Быстрое развитие устойчивости • • • Бендамустин Стабильная молекула, не требует активации Необратимые повреждения при коротком воздействии Стойкое повреждение ДНК Уникальные механизмы цитотоксичности Менее выраженная устойчивость Leoni LM et al. Clin Cancer Res 2008; 14: 309– 17
Сравнение Бендамустина с циклофосфамидом и хлорамбуцилом Циклофосфан и хлорбутин • Химически нестабильны • Обратимые повреждения даже при длительном воздействии • Быстрая репарация повреждений ДНК • Гибель клетки в основном за счет остановки клеточного цикла и апоптоза • Быстрое развитие устойчивости • • • Бендамустин Стабильная молекула, не требует активации Необратимые повреждения при коротком воздействии Стойкое повреждение ДНК Уникальные механизмы цитотоксичности Менее выраженная устойчивость Leoni LM et al. Clin Cancer Res 2008; 14: 309– 17
 Бендамустин и ХЛЛ Не выводится почками!!!
Бендамустин и ХЛЛ Не выводится почками!!!
 Ретроспективная оценка безопасности применения бендамустина у пациентов с почечной недостаточностью Пациенты с НХЛ и ХЛЛ, получившие как минимум 1 введение бендамустина, в том числе в комбинации с ритуксимабом Распределение пациентов по группам: Без нарушения функции почек (клиренс креатинина ≥ 40 или ≥ 60 мл/мин) С нарушением функции почек (клиренс креатинина ≤ 40 мл/мин) Пациенты, получавшие препараты с высокой нефротоксичностью (цисплатин, циклоспорин А и т. п. ), исключались из исследования Beth L. Nordstrom, James A. Sterchele et al J Clin Oncol 30, 2012 (suppl; abstr e 13081)
Ретроспективная оценка безопасности применения бендамустина у пациентов с почечной недостаточностью Пациенты с НХЛ и ХЛЛ, получившие как минимум 1 введение бендамустина, в том числе в комбинации с ритуксимабом Распределение пациентов по группам: Без нарушения функции почек (клиренс креатинина ≥ 40 или ≥ 60 мл/мин) С нарушением функции почек (клиренс креатинина ≤ 40 мл/мин) Пациенты, получавшие препараты с высокой нефротоксичностью (цисплатин, циклоспорин А и т. п. ), исключались из исследования Beth L. Nordstrom, James A. Sterchele et al J Clin Oncol 30, 2012 (suppl; abstr e 13081)
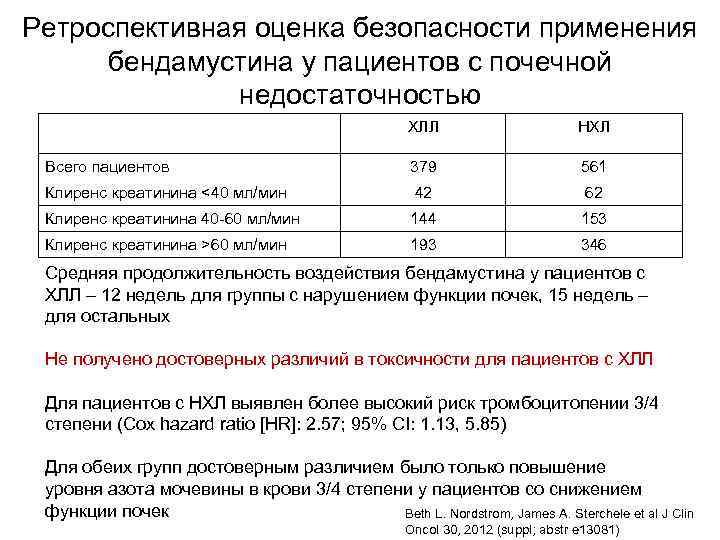 Ретроспективная оценка безопасности применения бендамустина у пациентов с почечной недостаточностью ХЛЛ НХЛ Всего пациентов 379 561 Клиренс креатинина <40 мл/мин 42 62 Клиренс креатинина 40 -60 мл/мин 144 153 Клиренс креатинина >60 мл/мин 193 346 Средняя продолжительность воздействия бендамустина у пациентов с ХЛЛ – 12 недель для группы с нарушением функции почек, 15 недель – для остальных Не получено достоверных различий в токсичности для пациентов с ХЛЛ Для пациентов с НХЛ выявлен более высокий риск тромбоцитопении 3/4 степени (Cox hazard ratio [HR]: 2. 57; 95% CI: 1. 13, 5. 85) Для обеих групп достоверным различием было только повышение уровня азота мочевины в крови 3/4 степени у пациентов со снижением функции почек Beth L. Nordstrom, James A. Sterchele et al J Clin Oncol 30, 2012 (suppl; abstr e 13081)
Ретроспективная оценка безопасности применения бендамустина у пациентов с почечной недостаточностью ХЛЛ НХЛ Всего пациентов 379 561 Клиренс креатинина <40 мл/мин 42 62 Клиренс креатинина 40 -60 мл/мин 144 153 Клиренс креатинина >60 мл/мин 193 346 Средняя продолжительность воздействия бендамустина у пациентов с ХЛЛ – 12 недель для группы с нарушением функции почек, 15 недель – для остальных Не получено достоверных различий в токсичности для пациентов с ХЛЛ Для пациентов с НХЛ выявлен более высокий риск тромбоцитопении 3/4 степени (Cox hazard ratio [HR]: 2. 57; 95% CI: 1. 13, 5. 85) Для обеих групп достоверным различием было только повышение уровня азота мочевины в крови 3/4 степени у пациентов со снижением функции почек Beth L. Nordstrom, James A. Sterchele et al J Clin Oncol 30, 2012 (suppl; abstr e 13081)
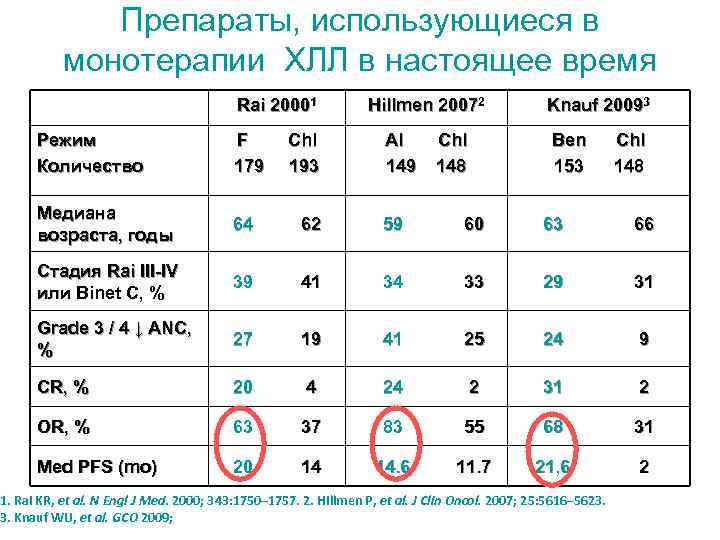 Препараты, использующиеся в монотерапии ХЛЛ в настоящее время Rai 20001 Hillmen 20072 Knauf 20093 Режим Количество F Chl 179 193 Al Chl 149 148 Ben Chl 153 148 Медиана возраста, годы 64 62 59 60 63 66 Стадия Rai III-IV или Binet C, % 39 41 34 33 29 31 Grade 3 / 4 ↓ ANC, % 27 19 41 25 24 9 CR, % 20 4 24 2 31 2 OR, % 63 37 83 55 68 31 Med PFS (mo) 20 14 14. 6 11. 7 21, 6 2 1. Rai KR, et al. N Engl J Med. 2000; 343: 1750– 1757. 2. Hillmen P, et al. J Clin Oncol. 2007; 25: 5616– 5623. 3. Knauf WU, et al. GCO 2009;
Препараты, использующиеся в монотерапии ХЛЛ в настоящее время Rai 20001 Hillmen 20072 Knauf 20093 Режим Количество F Chl 179 193 Al Chl 149 148 Ben Chl 153 148 Медиана возраста, годы 64 62 59 60 63 66 Стадия Rai III-IV или Binet C, % 39 41 34 33 29 31 Grade 3 / 4 ↓ ANC, % 27 19 41 25 24 9 CR, % 20 4 24 2 31 2 OR, % 63 37 83 55 68 31 Med PFS (mo) 20 14 14. 6 11. 7 21, 6 2 1. Rai KR, et al. N Engl J Med. 2000; 343: 1750– 1757. 2. Hillmen P, et al. J Clin Oncol. 2007; 25: 5616– 5623. 3. Knauf WU, et al. GCO 2009;
 Бендамустин и хлорамбуцил: Европейское межгрупповое исследование ХЛЛ III фазы Бендамустин ХЛЛ стадии В и С по Binet. Нелеченные больные моложе 75 лет 100 мг/м 2, дни 1 и 2, каждые 4 недели До 6 курсов Рандомизация в соотношении 1 : 1 (открытая) Хлорамбуцил 0, 8 мг/кг идеального веса, дни 1 и 15, до 6 курсов Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
Бендамустин и хлорамбуцил: Европейское межгрупповое исследование ХЛЛ III фазы Бендамустин ХЛЛ стадии В и С по Binet. Нелеченные больные моложе 75 лет 100 мг/м 2, дни 1 и 2, каждые 4 недели До 6 курсов Рандомизация в соотношении 1 : 1 (открытая) Хлорамбуцил 0, 8 мг/кг идеального веса, дни 1 и 15, до 6 курсов Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
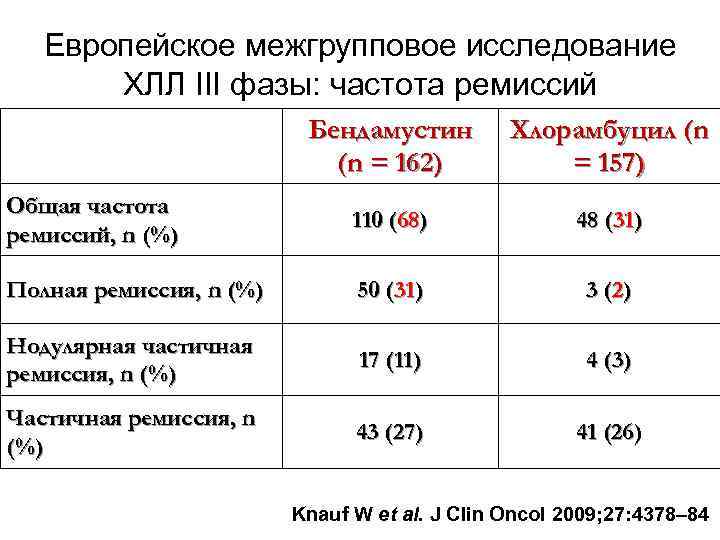 Европейское межгрупповое исследование ХЛЛ III фазы: частота ремиссий Бендамустин (n = 162) Хлорамбуцил (n = 157) Общая частота ремиссий, n (%) 110 (68) 48 (31) Полная ремиссия, n (%) 50 (31) 3 (2) Нодулярная частичная ремиссия, n (%) 17 (11) 4 (3) Частичная ремиссия, n (%) 43 (27) 41 (26) Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
Европейское межгрупповое исследование ХЛЛ III фазы: частота ремиссий Бендамустин (n = 162) Хлорамбуцил (n = 157) Общая частота ремиссий, n (%) 110 (68) 48 (31) Полная ремиссия, n (%) 50 (31) 3 (2) Нодулярная частичная ремиссия, n (%) 17 (11) 4 (3) Частичная ремиссия, n (%) 43 (27) 41 (26) Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
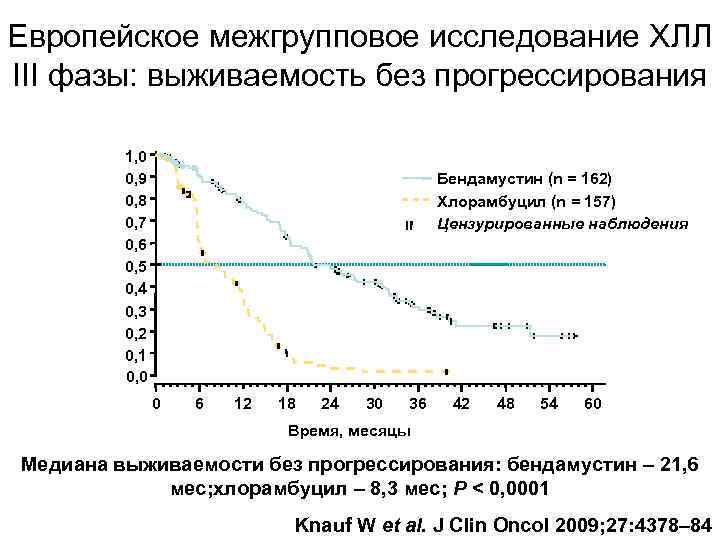 Европейское межгрупповое исследование ХЛЛ III фазы: выживаемость без прогрессирования 1, 0 0, 9 0, 8 0, 7 0, 6 0, 5 0, 4 0, 3 0, 2 0, 1 0, 0 Бендамустин (n = 162) Хлорамбуцил (n = 157) Цензурированные наблюдения 0 6 12 18 24 30 36 42 48 54 60 Время, месяцы Медиана выживаемости без прогрессирования: бендамустин – 21, 6 мес; хлорамбуцил – 8, 3 мес; P < 0, 0001 Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
Европейское межгрупповое исследование ХЛЛ III фазы: выживаемость без прогрессирования 1, 0 0, 9 0, 8 0, 7 0, 6 0, 5 0, 4 0, 3 0, 2 0, 1 0, 0 Бендамустин (n = 162) Хлорамбуцил (n = 157) Цензурированные наблюдения 0 6 12 18 24 30 36 42 48 54 60 Время, месяцы Медиана выживаемости без прогрессирования: бендамустин – 21, 6 мес; хлорамбуцил – 8, 3 мес; P < 0, 0001 Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
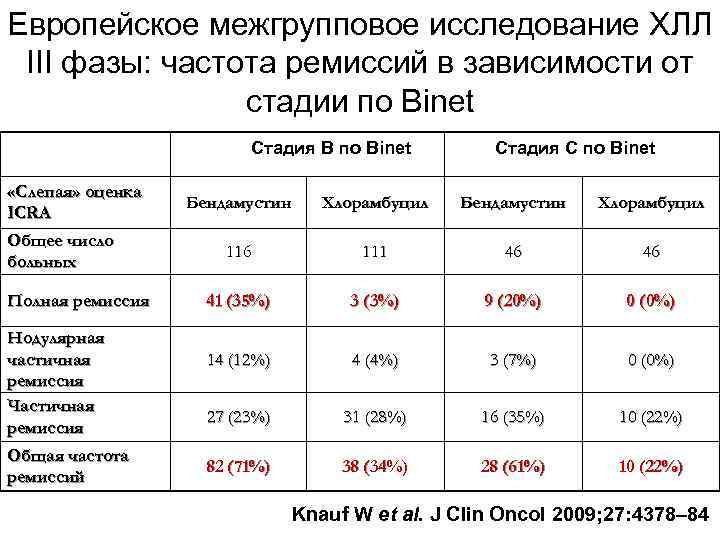 Европейское межгрупповое исследование ХЛЛ III фазы: частота ремиссий в зависимости от стадии по Binet Стадия B по Binet «Слепая» оценка ICRA Общее число больных Полная ремиссия Нодулярная частичная ремиссия Частичная ремиссия Общая частота ремиссий Стадия C по Binet Бендамустин Хлорамбуцил 116 111 46 46 41 (35%) 3 (3%) 9 (20%) 0 (0%) 14 (12%) 4 (4%) 3 (7%) 0 (0%) 27 (23%) 31 (28%) 16 (35%) 10 (22%) 82 (71%) 38 (34%) 28 (61%) 10 (22%) Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
Европейское межгрупповое исследование ХЛЛ III фазы: частота ремиссий в зависимости от стадии по Binet Стадия B по Binet «Слепая» оценка ICRA Общее число больных Полная ремиссия Нодулярная частичная ремиссия Частичная ремиссия Общая частота ремиссий Стадия C по Binet Бендамустин Хлорамбуцил 116 111 46 46 41 (35%) 3 (3%) 9 (20%) 0 (0%) 14 (12%) 4 (4%) 3 (7%) 0 (0%) 27 (23%) 31 (28%) 16 (35%) 10 (22%) 82 (71%) 38 (34%) 28 (61%) 10 (22%) Knauf W et al. J Clin Oncol 2009; 27: 4378– 84
 Европейское межгрупповое исследование ХЛЛ III фазы: анализ подгрупп по возрасту • Сходная частота ремиссий у больных < 65 лет и больных 65 лет: – Бендамустин: общая частота ремиссий 71, 6% (n = 88) против 63, 5 (n = 74; p > 0, 3). – Хлорамбуцил: общая частота ремиссий 28, 4% (n = 74) против 32, 5% (n = 83; p > 0, 6). Бендамустин в целом хорошо переносился, гематологические побочные эффекты были одинаковыми у больных < 65 лет и больных 65 лет. Knauf W et al. Blood 2009; 114: Abs 2376
Европейское межгрупповое исследование ХЛЛ III фазы: анализ подгрупп по возрасту • Сходная частота ремиссий у больных < 65 лет и больных 65 лет: – Бендамустин: общая частота ремиссий 71, 6% (n = 88) против 63, 5 (n = 74; p > 0, 3). – Хлорамбуцил: общая частота ремиссий 28, 4% (n = 74) против 32, 5% (n = 83; p > 0, 6). Бендамустин в целом хорошо переносился, гематологические побочные эффекты были одинаковыми у больных < 65 лет и больных 65 лет. Knauf W et al. Blood 2009; 114: Abs 2376
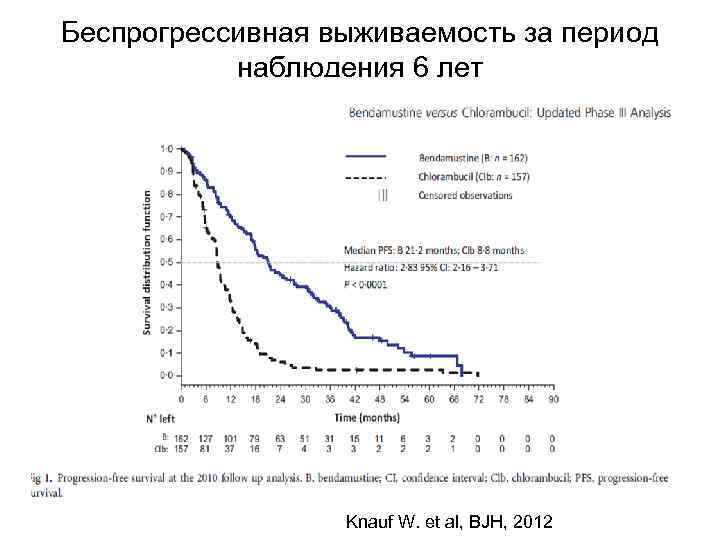 Беспрогрессивная выживаемость за период наблюдения 6 лет Knauf W. et al, BJH, 2012
Беспрогрессивная выживаемость за период наблюдения 6 лет Knauf W. et al, BJH, 2012
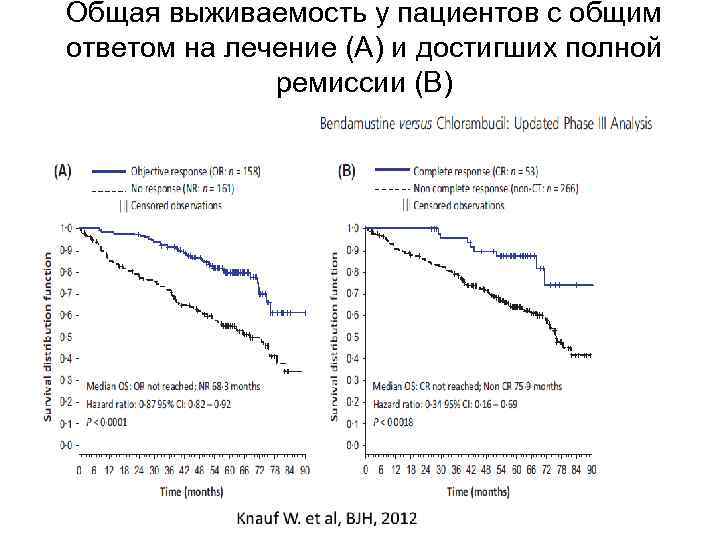 Общая выживаемость у пациентов с общим ответом на лечение (А) и достигших полной ремиссии (В)
Общая выживаемость у пациентов с общим ответом на лечение (А) и достигших полной ремиссии (В)
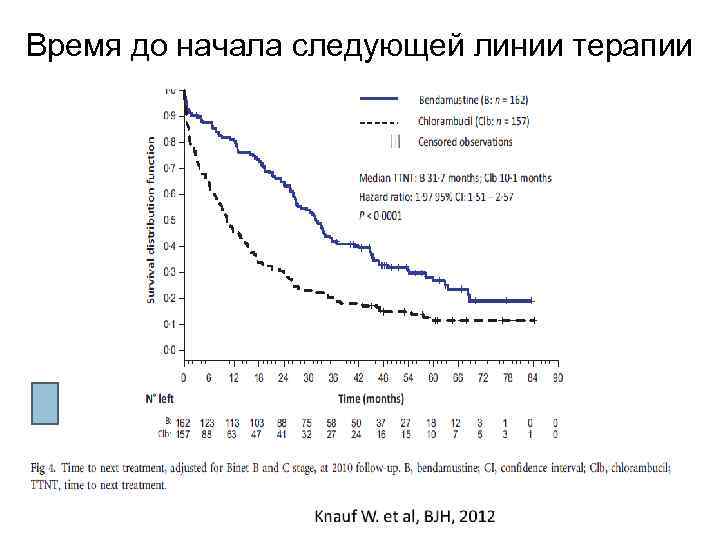 Время до начала следующей линии терапии
Время до начала следующей линии терапии
 Выводы: • При проведении монотерапии бендамустином по сравнению с хлорбутином получены достоверные преимущества по: - количеству общего ответа - продолжительности беспрогрессивной выживаемости - времени до следующей линии терапии • Общая выживаемость увеличивается у всех ответивших пациентов
Выводы: • При проведении монотерапии бендамустином по сравнению с хлорбутином получены достоверные преимущества по: - количеству общего ответа - продолжительности беспрогрессивной выживаемости - времени до следующей линии терапии • Общая выживаемость увеличивается у всех ответивших пациентов
 : Благоприятный токсический профиль препарата открыл перспективы возможности его использования в комбинации с другими цитостатиками и моноклональными антителами.
: Благоприятный токсический профиль препарата открыл перспективы возможности его использования в комбинации с другими цитостатиками и моноклональными антителами.
 Бендамустин + ритуксимаб в первой линии терапии хронического лимфолейкоза • Ритуксимаб 375 – 500 мг/м 2 Д 1 • Бендамустин 90 мг/м 2 Д 2, Д 3 • Всего проводится 6 курсов каждые 28 дней
Бендамустин + ритуксимаб в первой линии терапии хронического лимфолейкоза • Ритуксимаб 375 – 500 мг/м 2 Д 1 • Бендамустин 90 мг/м 2 Д 2, Д 3 • Всего проводится 6 курсов каждые 28 дней
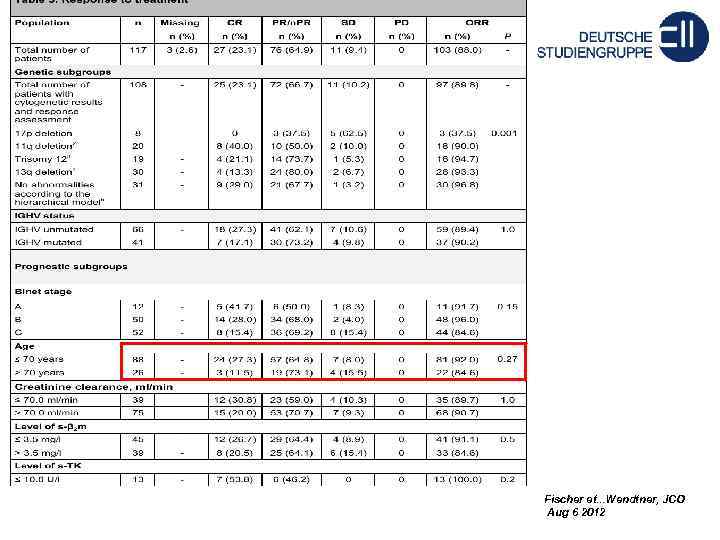
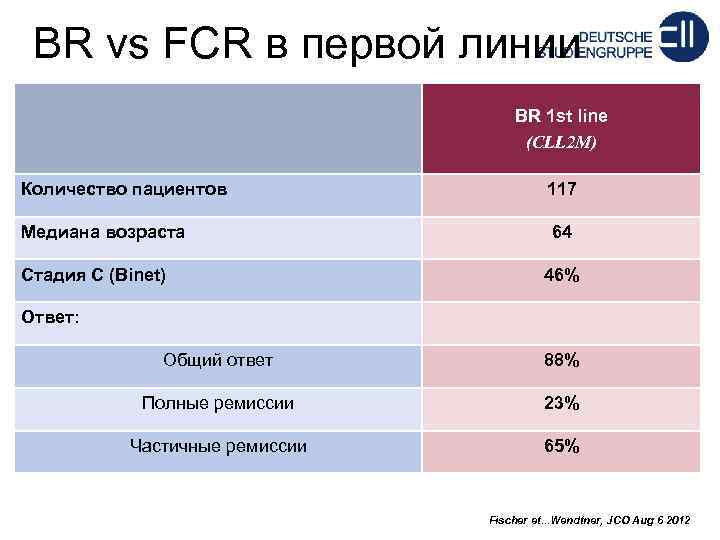 BR vs FCR в первой линии BR 1 st line (CLL 2 M) Количество пациентов 117 Meдиана возраста 64 Стадия C (Binet) 46% Ответ: Общий ответ 88% Полные ремиссии 23% Частичные ремиссии 65% Fischer et. . . Wendtner, JCO Aug 6 2012
BR vs FCR в первой линии BR 1 st line (CLL 2 M) Количество пациентов 117 Meдиана возраста 64 Стадия C (Binet) 46% Ответ: Общий ответ 88% Полные ремиссии 23% Частичные ремиссии 65% Fischer et. . . Wendtner, JCO Aug 6 2012
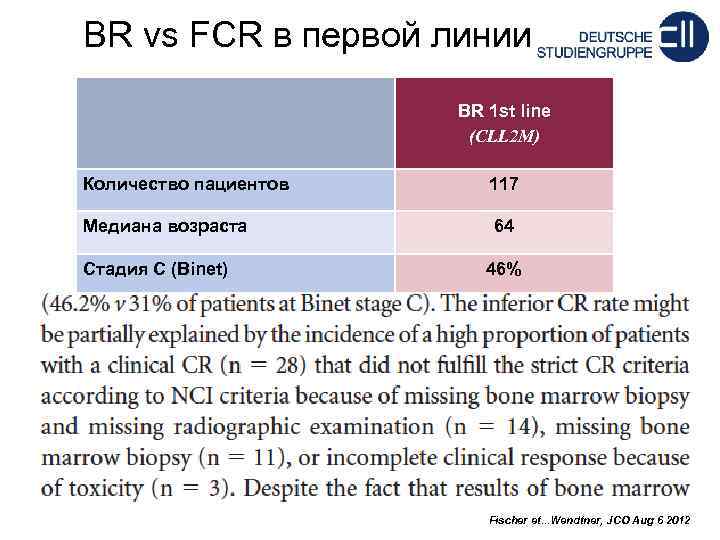 BR vs FCR в первой линии BR 1 st line (CLL 2 M) Количество пациентов 117 Медиана возраста 64 Стадия C (Binet) 46% Response: ORR 88% CR 23% PR 65% Fischer et. . . Wendtner, JCO Aug 6 2012
BR vs FCR в первой линии BR 1 st line (CLL 2 M) Количество пациентов 117 Медиана возраста 64 Стадия C (Binet) 46% Response: ORR 88% CR 23% PR 65% Fischer et. . . Wendtner, JCO Aug 6 2012
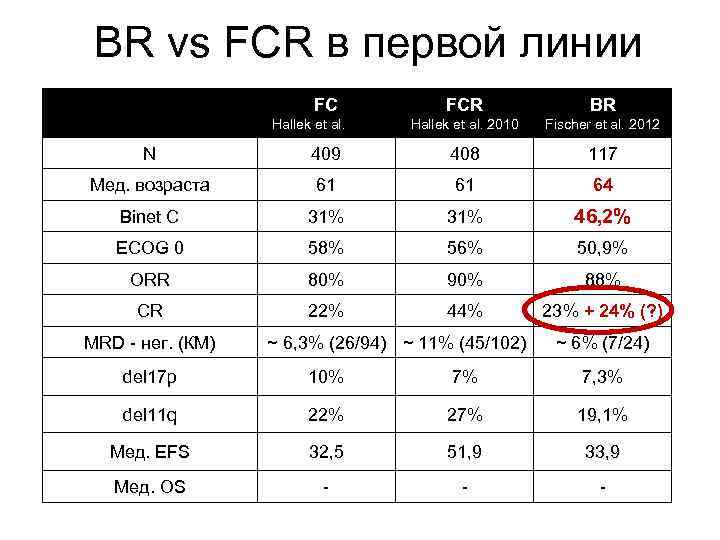 BR vs FCR в первой линии FC FCR BR Hallek et al. 2010 Fischer et al. 2012 N 409 408 117 Мед. возраста 61 61 64 Binet C 31% 46, 2% ECOG 0 58% 56% 50, 9% ORR 80% 90% 88% CR 22% 44% 23% + 24% (? ) MRD - нег. (КМ) ~ 6, 3% (26/94) ~ 11% (45/102) ~ 6% (7/24) del 17 p 10% 7% 7, 3% del 11 q 22% 27% 19, 1% Мед. EFS 32, 5 51, 9 33, 9 Мед. OS - - -
BR vs FCR в первой линии FC FCR BR Hallek et al. 2010 Fischer et al. 2012 N 409 408 117 Мед. возраста 61 61 64 Binet C 31% 46, 2% ECOG 0 58% 56% 50, 9% ORR 80% 90% 88% CR 22% 44% 23% + 24% (? ) MRD - нег. (КМ) ~ 6, 3% (26/94) ~ 11% (45/102) ~ 6% (7/24) del 17 p 10% 7% 7, 3% del 11 q 22% 27% 19, 1% Мед. EFS 32, 5 51, 9 33, 9 Мед. OS - - -
 35% пациентов имели скорость клубочковой фильтрации менее 70 мл/мин!!!
35% пациентов имели скорость клубочковой фильтрации менее 70 мл/мин!!!
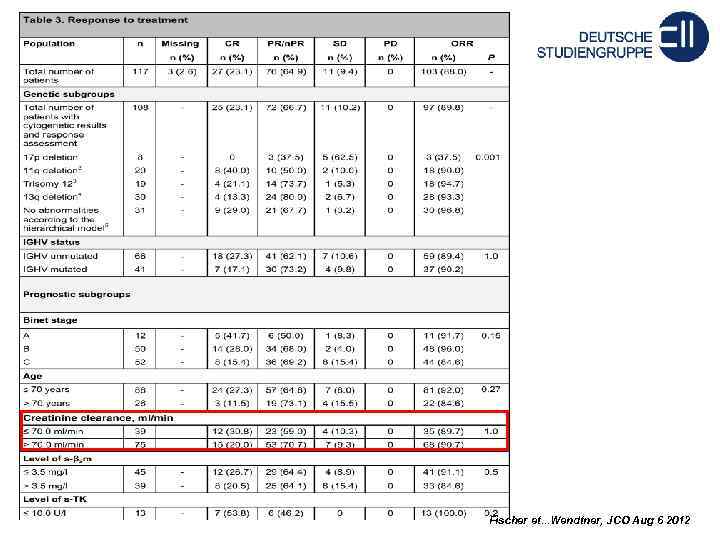 Fischer et. . . Wendtner, JCO Aug 6 2012
Fischer et. . . Wendtner, JCO Aug 6 2012
 Fischer et. . . Wendtner, JCO Aug 6 2012
Fischer et. . . Wendtner, JCO Aug 6 2012
 Сравнение токсичности BR FCR BR FCR Нейтропения IIIПо больным IV 19, 7 6 • 34 • 24 Тяжелая инфекция 7, 7 25 Тромбоцито пения III-IV 11 7 По курсам Fischer e. a. 2012 Hallek e. a. 2010
Сравнение токсичности BR FCR BR FCR Нейтропения IIIПо больным IV 19, 7 6 • 34 • 24 Тяжелая инфекция 7, 7 25 Тромбоцито пения III-IV 11 7 По курсам Fischer e. a. 2012 Hallek e. a. 2010
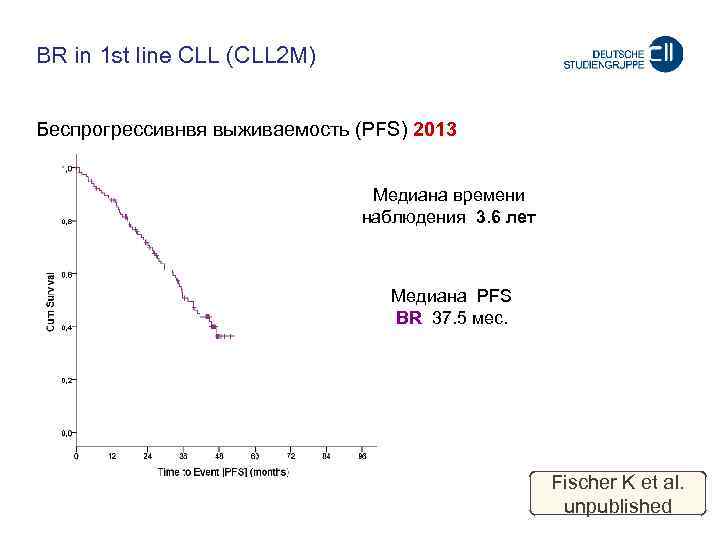 BR in 1 st line CLL (CLL 2 M) Беспрогрессивнвя выживаемость (PFS) 2013 Meдиана времени наблюдения 3. 6 лет Meдиана PFS BR 37. 5 мес. Fischer K et al. unpublished
BR in 1 st line CLL (CLL 2 M) Беспрогрессивнвя выживаемость (PFS) 2013 Meдиана времени наблюдения 3. 6 лет Meдиана PFS BR 37. 5 мес. Fischer K et al. unpublished
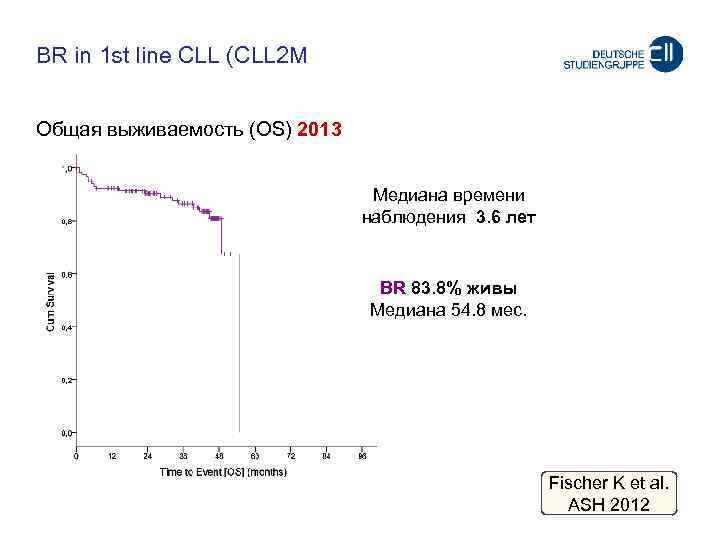 BR in 1 st line CLL (CLL 2 M Oбщая выживаемость (OS) 2013 Meдиана времени наблюдения 3. 6 лет BR 83. 8% живы Meдиана 54. 8 мес. Fischer K et al. ASH 2012
BR in 1 st line CLL (CLL 2 M Oбщая выживаемость (OS) 2013 Meдиана времени наблюдения 3. 6 лет BR 83. 8% живы Meдиана 54. 8 мес. Fischer K et al. ASH 2012
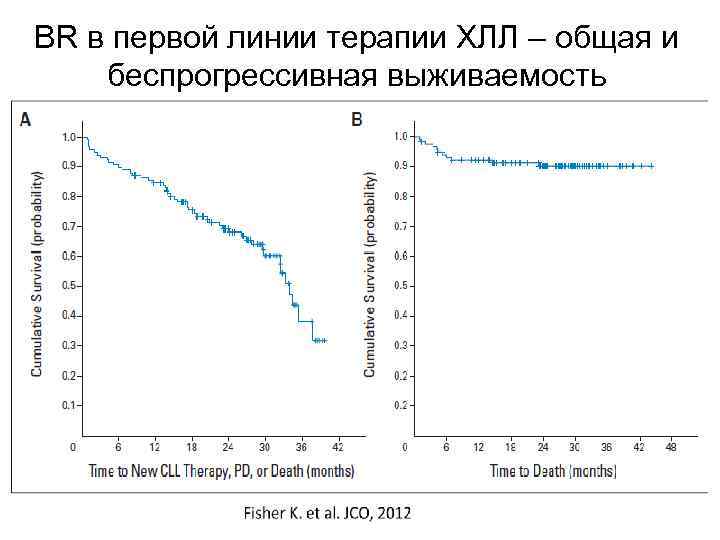 BR в первой линии терапии ХЛЛ – общая и беспрогрессивная выживаемость
BR в первой линии терапии ХЛЛ – общая и беспрогрессивная выживаемость
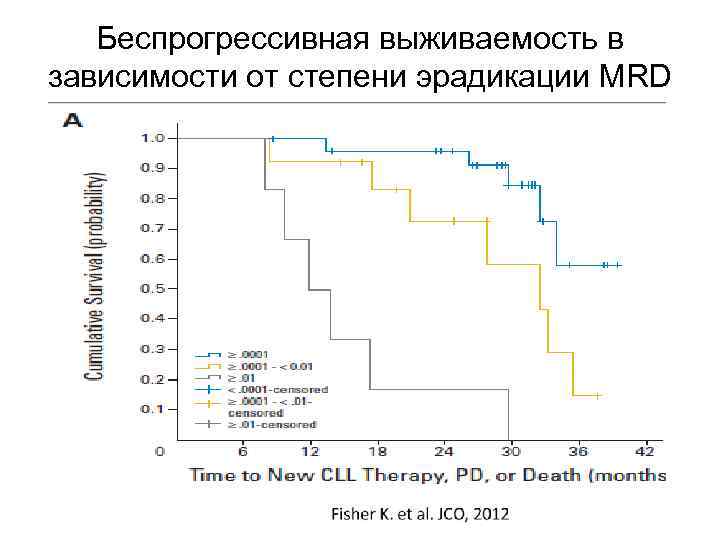 Беспрогрессивная выживаемость в зависимости от степени эрадикации MRD
Беспрогрессивная выживаемость в зависимости от степени эрадикации MRD
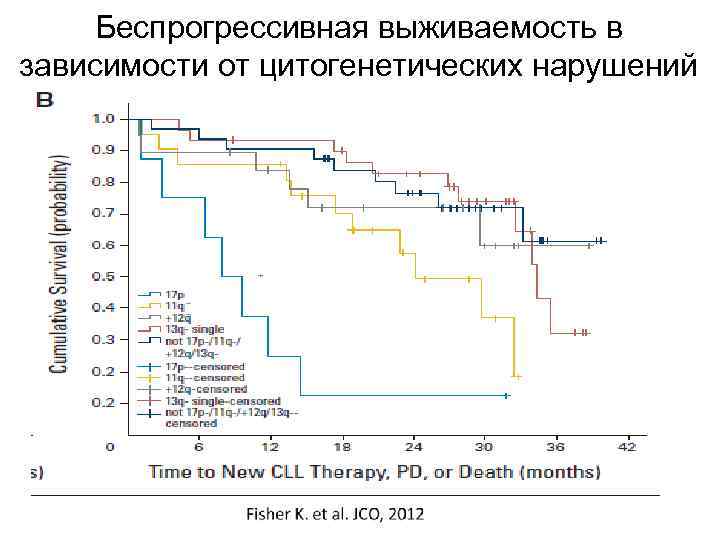 Беспрогрессивная выживаемость в зависимости от цитогенетических нарушений
Беспрогрессивная выживаемость в зависимости от цитогенетических нарушений
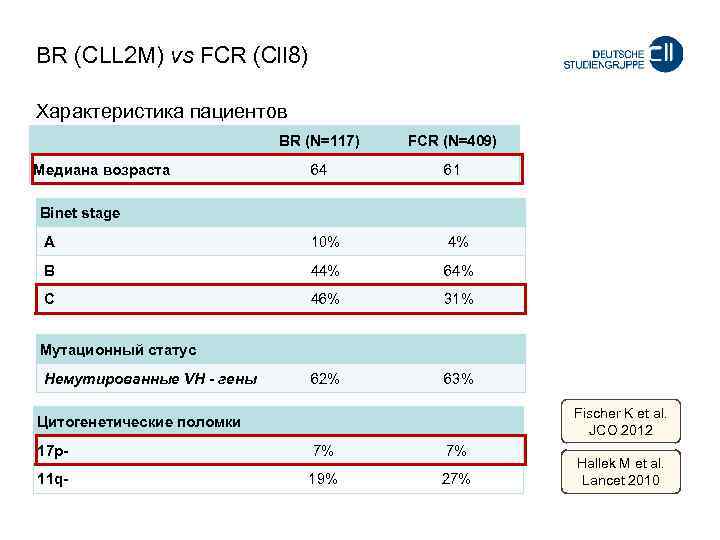 BR (CLL 2 M) vs FCR (Cll 8) Характеристика пациентов BR (N=117) FCR (N=409) 64 61 A 10% 4% B 44% 64% C 46% 31% 62% 63% Медиана возраста Binet stage Мутационный статус Немутированные VH - гены Fischer K et al. JCO 2012 Цитогенетические поломки 17 p- 7% 7% 11 q- 19% 27% Hallek M et al. Lancet 2010
BR (CLL 2 M) vs FCR (Cll 8) Характеристика пациентов BR (N=117) FCR (N=409) 64 61 A 10% 4% B 44% 64% C 46% 31% 62% 63% Медиана возраста Binet stage Мутационный статус Немутированные VH - гены Fischer K et al. JCO 2012 Цитогенетические поломки 17 p- 7% 7% 11 q- 19% 27% Hallek M et al. Lancet 2010
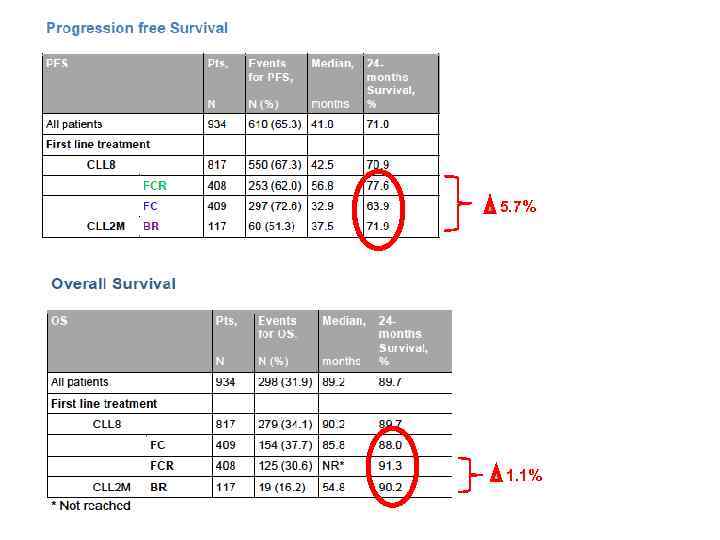 5. 7% 1. 1%
5. 7% 1. 1%
 Исследоание CLL 10 группы GLLSG Исследование III фазы результатов терапии первой линии соматически сохранных пациентов с ХЛЛ без del(17 p) Fludarabine Cyclophosphamid Rituximab (FCR) Fludarabine 25 mg/m² i. v. , days 1 -3 Cyclophosphamide 250 mg/m², days 1 -3, Rituximab: 375 mg/ m 2 i. v. on day 0, cycle 1 Rituximab: 500 mg/m² i. v. on day 1, cycle 2 -6 Bendamustine Rituximab (BR) Bendamustine 90 mg/m² day 1 -2 Rituximab 375 mg/m² day 0, cycyle 1 Rituximab 500 mg/m² day 1, cycyle 2 -6 R 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
Исследоание CLL 10 группы GLLSG Исследование III фазы результатов терапии первой линии соматически сохранных пациентов с ХЛЛ без del(17 p) Fludarabine Cyclophosphamid Rituximab (FCR) Fludarabine 25 mg/m² i. v. , days 1 -3 Cyclophosphamide 250 mg/m², days 1 -3, Rituximab: 375 mg/ m 2 i. v. on day 0, cycle 1 Rituximab: 500 mg/m² i. v. on day 1, cycle 2 -6 Bendamustine Rituximab (BR) Bendamustine 90 mg/m² day 1 -2 Rituximab 375 mg/m² day 0, cycyle 1 Rituximab 500 mg/m² day 1, cycyle 2 -6 R 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
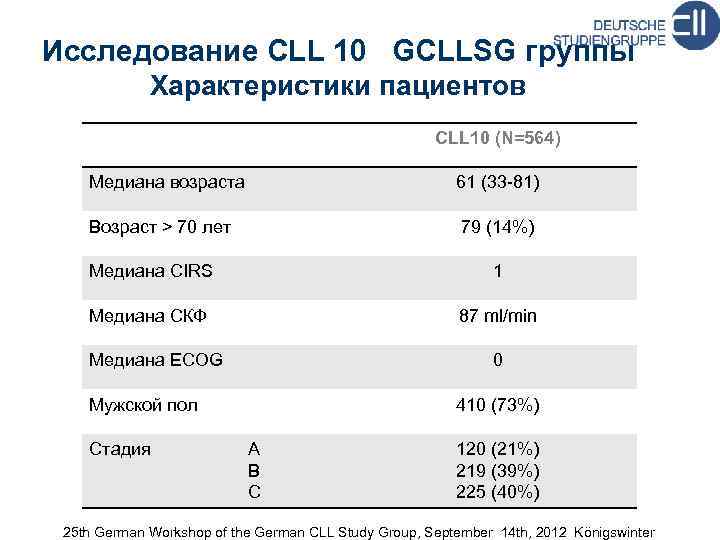 Исследование CLL 10 GCLLSG группы Характеристики пациентов CLL 10 (N=564) Медиана возраста 61 (33 -81) Возраст > 70 лет 79 (14%) Mедиана CIRS 1 Mедиана СКФ 87 ml/min Meдиана ECOG 0 Mужской пол Стадия 410 (73%) A B C 120 (21%) 219 (39%) 225 (40%) 25 th German Workshop of the German CLL Study Group, September 14 th, 2012 Königswinter
Исследование CLL 10 GCLLSG группы Характеристики пациентов CLL 10 (N=564) Медиана возраста 61 (33 -81) Возраст > 70 лет 79 (14%) Mедиана CIRS 1 Mедиана СКФ 87 ml/min Meдиана ECOG 0 Mужской пол Стадия 410 (73%) A B C 120 (21%) 219 (39%) 225 (40%) 25 th German Workshop of the German CLL Study Group, September 14 th, 2012 Königswinter
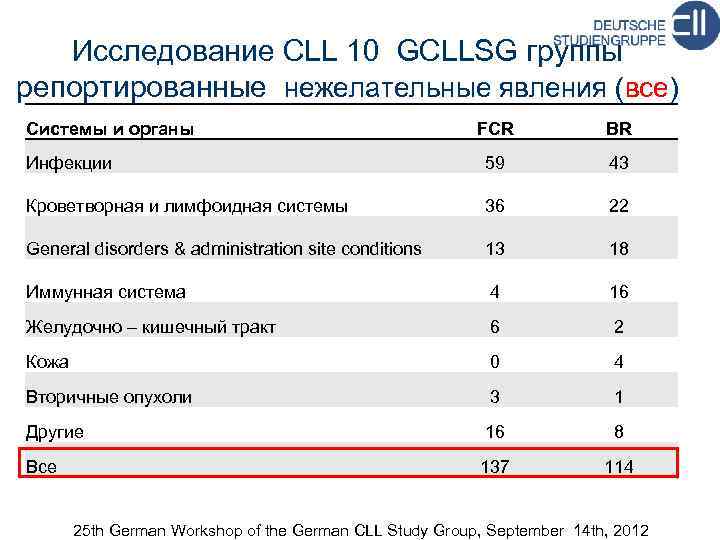 Исследование CLL 10 GCLLSG группы репортированные нежелательные явления (все) Системы и органы FCR BR Инфекции 59 43 Кроветворная и лимфоидная системы 36 22 General disorders & administration site conditions 13 18 Иммунная система 4 16 Желудочно – кишечный тракт 6 2 Кожа 0 4 Вторичные опухоли 3 1 Другие 16 8 Все 137 114 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
Исследование CLL 10 GCLLSG группы репортированные нежелательные явления (все) Системы и органы FCR BR Инфекции 59 43 Кроветворная и лимфоидная системы 36 22 General disorders & administration site conditions 13 18 Иммунная система 4 16 Желудочно – кишечный тракт 6 2 Кожа 0 4 Вторичные опухоли 3 1 Другие 16 8 Все 137 114 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
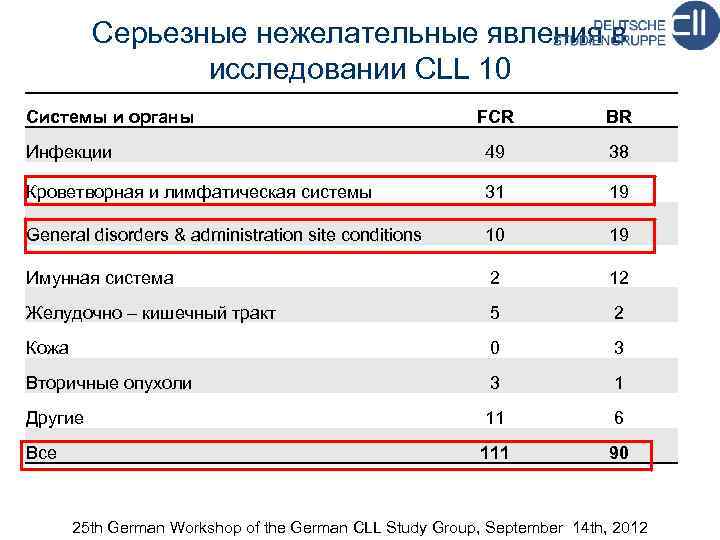 Серьезные нежелательные явления в исследовании CLL 10 Системы и органы FCR BR Инфекции 49 38 Кроветворная и лимфатическая системы 31 19 General disorders & administration site conditions 10 19 Имунная система 2 12 Желудочно – кишечный тракт 5 2 Кожа 0 3 Вторичные опухоли 3 1 Другие 11 6 Все 111 90 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
Серьезные нежелательные явления в исследовании CLL 10 Системы и органы FCR BR Инфекции 49 38 Кроветворная и лимфатическая системы 31 19 General disorders & administration site conditions 10 19 Имунная система 2 12 Желудочно – кишечный тракт 5 2 Кожа 0 3 Вторичные опухоли 3 1 Другие 11 6 Все 111 90 25 th German Workshop of the German CLL Study Group, September 14 th, 2012
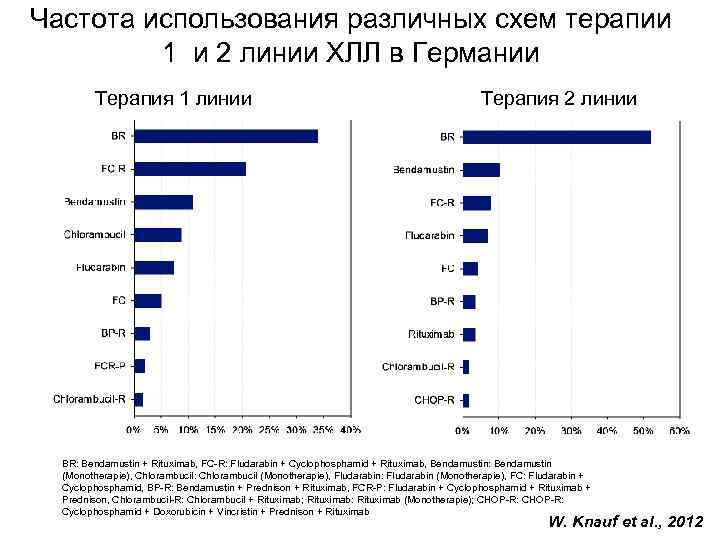 Частота использования различных схем терапии 1 и 2 линии ХЛЛ в Германии Терапия 1 линии Терапия 2 линии BR: Bendamustin + Rituximab, FC-R: Fludarabin + Cyclophosphamid + Rituximab, Bendamustin: Bendamustin (Monotherapie), Chlorambucil: Chlorambucil (Monotherapie), Fludarabin: Fludarabin (Monotherapie), FC: Fludarabin + Cyclophosphamid, BP-R: Bendamustin + Prednison + Rituximab, FCR-P: Fludarabin + Cyclophosphamid + Rituximab + Prednison, Chlorambucil-R: Chlorambucil + Rituximab; Rituximab: Rituximab (Monotherapie); CHOP-R: Cyclophosphamid + Doxorubicin + Vincristin + Prednison + Rituximab W. Knauf et al. , 2012
Частота использования различных схем терапии 1 и 2 линии ХЛЛ в Германии Терапия 1 линии Терапия 2 линии BR: Bendamustin + Rituximab, FC-R: Fludarabin + Cyclophosphamid + Rituximab, Bendamustin: Bendamustin (Monotherapie), Chlorambucil: Chlorambucil (Monotherapie), Fludarabin: Fludarabin (Monotherapie), FC: Fludarabin + Cyclophosphamid, BP-R: Bendamustin + Prednison + Rituximab, FCR-P: Fludarabin + Cyclophosphamid + Rituximab + Prednison, Chlorambucil-R: Chlorambucil + Rituximab; Rituximab: Rituximab (Monotherapie); CHOP-R: Cyclophosphamid + Doxorubicin + Vincristin + Prednison + Rituximab W. Knauf et al. , 2012
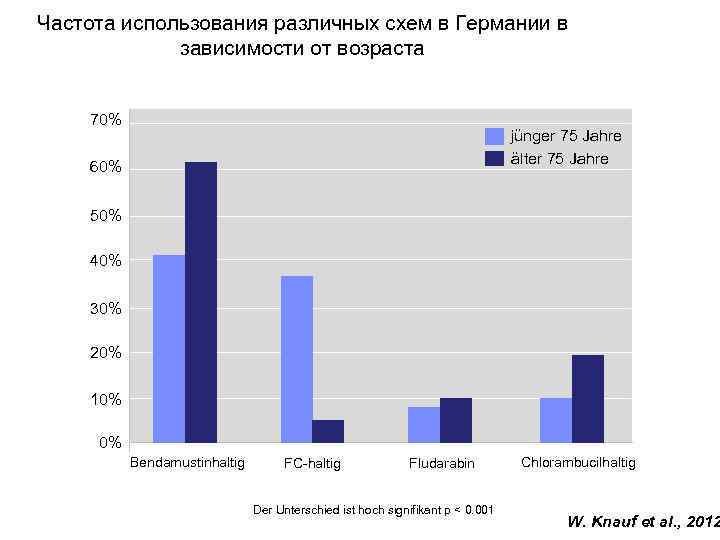 Частота использования различных схем в Германии в зависимости от возраста 70% jünger 75 Jahre älter 75 Jahre 60% 50% 40% 30% 20% 10% 0% Bendamustinhaltig FC-haltig Fludarabin Der Unterschied ist hoch signifikant p < 0. 001 Chlorambucilhaltig W. Knauf et al. , 2012
Частота использования различных схем в Германии в зависимости от возраста 70% jünger 75 Jahre älter 75 Jahre 60% 50% 40% 30% 20% 10% 0% Bendamustinhaltig FC-haltig Fludarabin Der Unterschied ist hoch signifikant p < 0. 001 Chlorambucilhaltig W. Knauf et al. , 2012
 Протокол BEN-001 “NORMA”
Протокол BEN-001 “NORMA”
 ОБЩИЕ ДАННЫЕ О НАБЛЮДАТЕЛЬНОЙ ПРОГРАММЕ BEN-001 (NORMA) Название ПРОСПЕКТИВНАЯ МНОГОЦЕНТРОВАЯ НАБЛЮДАТЕЛЬНАЯ ПРОГРАММА ОЦЕНКИ РУТИННОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ ТЕРАПИИ ПЕРВОЙ ЛИНИИ У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ С ВКЛЮЧЕНИЕМ РИБОМУСТИНА (NORMA) Планируемый набор 250 пациентов Планируемое количество центров 32 ЛПУ Координатор проекта Директор института гематологии ФЦСКЭ им. В. А. Алмазова профессор Андрей Юрьевич Зарицкий Контактные лица Астеллас Екатерина Михаевич, координатор Ирина Чебыкина, медицинский советник
ОБЩИЕ ДАННЫЕ О НАБЛЮДАТЕЛЬНОЙ ПРОГРАММЕ BEN-001 (NORMA) Название ПРОСПЕКТИВНАЯ МНОГОЦЕНТРОВАЯ НАБЛЮДАТЕЛЬНАЯ ПРОГРАММА ОЦЕНКИ РУТИННОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ ТЕРАПИИ ПЕРВОЙ ЛИНИИ У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ С ВКЛЮЧЕНИЕМ РИБОМУСТИНА (NORMA) Планируемый набор 250 пациентов Планируемое количество центров 32 ЛПУ Координатор проекта Директор института гематологии ФЦСКЭ им. В. А. Алмазова профессор Андрей Юрьевич Зарицкий Контактные лица Астеллас Екатерина Михаевич, координатор Ирина Чебыкина, медицинский советник
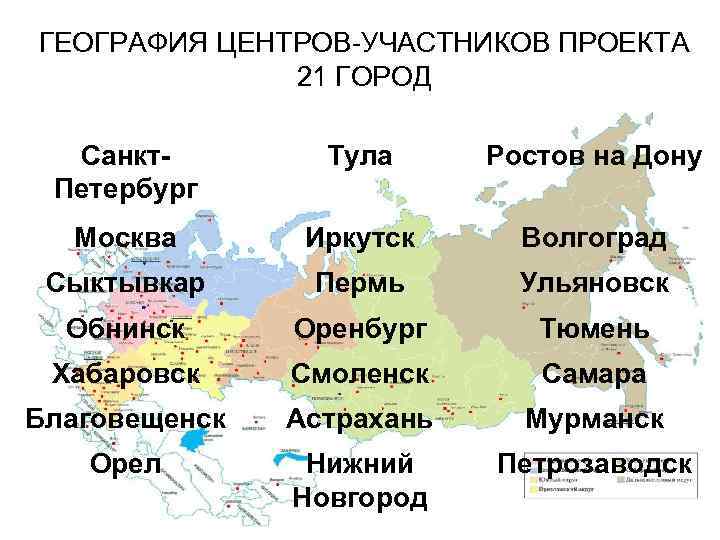 ГЕОГРАФИЯ ЦЕНТРОВ-УЧАСТНИКОВ ПРОЕКТА 21 ГОРОД Санкт. Петербург Тула Ростов на Дону Москва Иркутск Волгоград Сыктывкар Пермь Ульяновск Обнинск Оренбург Тюмень Хабаровск Смоленск Самара Благовещенск Астрахань Мурманск Орел Нижний Новгород Петрозаводск
ГЕОГРАФИЯ ЦЕНТРОВ-УЧАСТНИКОВ ПРОЕКТА 21 ГОРОД Санкт. Петербург Тула Ростов на Дону Москва Иркутск Волгоград Сыктывкар Пермь Ульяновск Обнинск Оренбург Тюмень Хабаровск Смоленск Самара Благовещенск Астрахань Мурманск Орел Нижний Новгород Петрозаводск
 Бендамустин + ритуксимаб в качестве первой линии терапии ХЛЛ: • Результаты исследования II фазы показывают, что комбинация бендамустина с ритуксимабом (схема BR): – Эффективна в качестве первой линии терапии ХЛЛ — общая частота ремиссий достигает 90, 9% – Обладает приемлемым профилем токсичности • Ведется исследование III фазы (CLL 10) по сравнению схем BR и FCR у ранее не леченных больных ХЛЛ. 1. Fischer K et al. Blood 2009; 114: Abs 205
Бендамустин + ритуксимаб в качестве первой линии терапии ХЛЛ: • Результаты исследования II фазы показывают, что комбинация бендамустина с ритуксимабом (схема BR): – Эффективна в качестве первой линии терапии ХЛЛ — общая частота ремиссий достигает 90, 9% – Обладает приемлемым профилем токсичности • Ведется исследование III фазы (CLL 10) по сравнению схем BR и FCR у ранее не леченных больных ХЛЛ. 1. Fischer K et al. Blood 2009; 114: Abs 205
 Рецидив хронического лимфолейкоза. . . ? ? ?
Рецидив хронического лимфолейкоза. . . ? ? ?
 Вторая линия лечения ? ? ? Показания к началу терапии не отличаются от таковых в первой линии. • Сроки рецидива? • Прогностические факторы? • Используемые ранее режимы химиотерапии и их количество?
Вторая линия лечения ? ? ? Показания к началу терапии не отличаются от таковых в первой линии. • Сроки рецидива? • Прогностические факторы? • Используемые ранее режимы химиотерапии и их количество?
 Бендамустин + ритуксимаб во второй линии терапии хронического лимфолейкоза • Ритуксимаб 375 – 500 мг/м 2 Д 1 • Бендамустин 70 мг/м 2 Д 2, Д 3 • Всего проводится 6 курсов каждые 28 дней
Бендамустин + ритуксимаб во второй линии терапии хронического лимфолейкоза • Ритуксимаб 375 – 500 мг/м 2 Д 1 • Бендамустин 70 мг/м 2 Д 2, Д 3 • Всего проводится 6 курсов каждые 28 дней
 Исследование CLL 2 M характеристика пациентов Всего включено 78 пациентов • Медиана возраста – 66, 5 лет (42 -86) • Медиана курсов предшествующей терапии – 2 (1 – 5) • Предлеченность пуриновыми аналогами – 80, 8%, 9% получали ранее ритуксимаб и 6, 4% - алемтузумаб, 2 чел. – ауто. ТКМ и 28, 2% - рефрактерны к флударабину Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
Исследование CLL 2 M характеристика пациентов Всего включено 78 пациентов • Медиана возраста – 66, 5 лет (42 -86) • Медиана курсов предшествующей терапии – 2 (1 – 5) • Предлеченность пуриновыми аналогами – 80, 8%, 9% получали ранее ритуксимаб и 6, 4% - алемтузумаб, 2 чел. – ауто. ТКМ и 28, 2% - рефрактерны к флударабину Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
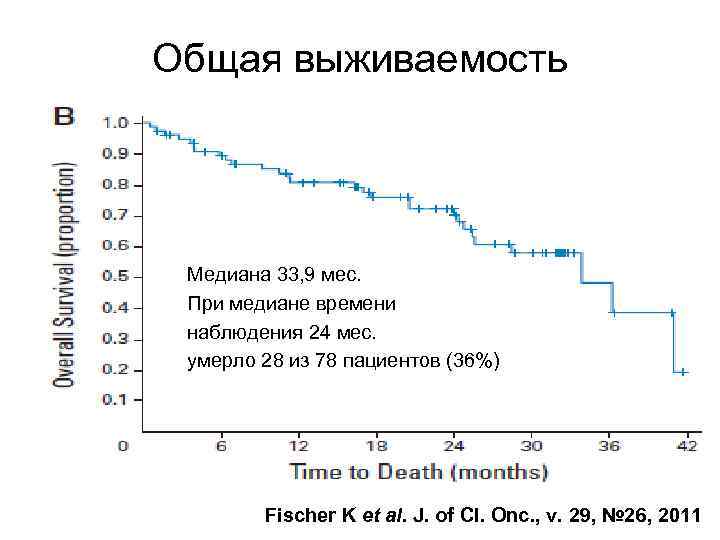 Общая выживаемость Медиана 33, 9 мес. При медиане времени наблюдения 24 мес. умерло 28 из 78 пациентов (36%) Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
Общая выживаемость Медиана 33, 9 мес. При медиане времени наблюдения 24 мес. умерло 28 из 78 пациентов (36%) Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
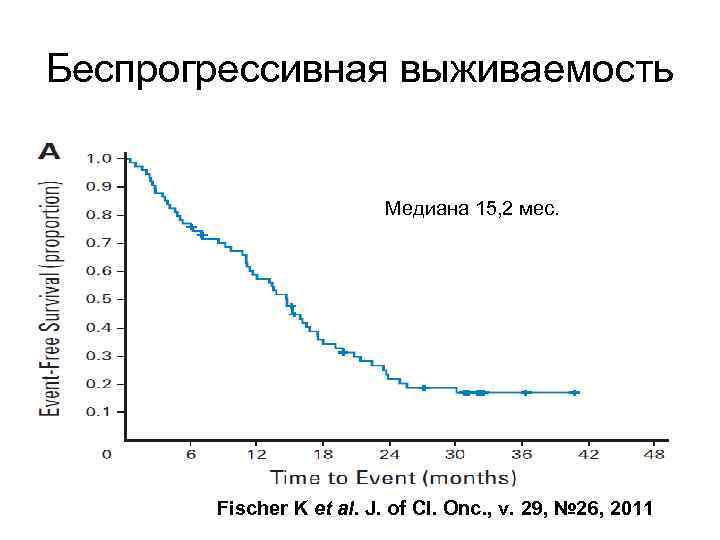 Беспрогрессивная выживаемость Медиана 15, 2 мес. Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
Беспрогрессивная выживаемость Медиана 15, 2 мес. Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011
 Ответ в неблагоприятных прогностических подгруппах • Del 17 р – 7, 1% (1 пациент из 14 достиг полного ответа) • Del 11 q – 92, 3% ответа (12 из 13 ответили, один из них полный ответ) • Unmut VH – гены – 58, 7% ответа (из них 2 полных) • Рефрактерные к флударабину – 45, 5% ответа, все частичные. • Нет достоверных отличий в частоте ответа в зависимости от количества линий предшествующей терапии, возраста и стадии Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011 заболевания
Ответ в неблагоприятных прогностических подгруппах • Del 17 р – 7, 1% (1 пациент из 14 достиг полного ответа) • Del 11 q – 92, 3% ответа (12 из 13 ответили, один из них полный ответ) • Unmut VH – гены – 58, 7% ответа (из них 2 полных) • Рефрактерные к флударабину – 45, 5% ответа, все частичные. • Нет достоверных отличий в частоте ответа в зависимости от количества линий предшествующей терапии, возраста и стадии Fischer K et al. J. of Cl. Onc. , v. 29, № 26, 2011 заболевания
 Опыт применения бендамустина у пациентов с резистентным/рецидивным ХЛЛ в ФЦСКЭ им Алмазова
Опыт применения бендамустина у пациентов с резистентным/рецидивным ХЛЛ в ФЦСКЭ им Алмазова
 Характеристика больных • • • • Пролечено 11 пациентов Медиана линий предшествующей терапии – 4 (1 – 6) Медиана возраста – 62 года (46 – 77) Медиана курсов проведенной терапии – 6 (6 чел. – 6 курсов, 1 – 5, 4 – 3 и менее) 1 чел. – с трансформацией в синдром Рихтера 7 чел. – tumor - bulk 4 чел. – unmut VH – гены 4 чел. – высокая экспрессия CD 38 3 чел. – del 17 p. 2 чел. – начинали лечение на фоне активного гемолиза 4 чел. – стадия С 3 чел. – ранние рецидивы после применения флударабин 4 чел. – рефрактерность к флударабину (63, 6% имели проблемы с пуриновыми аналогами)
Характеристика больных • • • • Пролечено 11 пациентов Медиана линий предшествующей терапии – 4 (1 – 6) Медиана возраста – 62 года (46 – 77) Медиана курсов проведенной терапии – 6 (6 чел. – 6 курсов, 1 – 5, 4 – 3 и менее) 1 чел. – с трансформацией в синдром Рихтера 7 чел. – tumor - bulk 4 чел. – unmut VH – гены 4 чел. – высокая экспрессия CD 38 3 чел. – del 17 p. 2 чел. – начинали лечение на фоне активного гемолиза 4 чел. – стадия С 3 чел. – ранние рецидивы после применения флударабин 4 чел. – рефрактерность к флударабину (63, 6% имели проблемы с пуриновыми аналогами)
 Эффективность • • • Общий ответ – 54, 5% (6) Полный ответ – 18, 2% (2) Частичный ответ – 36, 4% (4) Стабилизация – 18, 2% (2) Прогрессия – 27, 3% (3) Проявления гемолиза на фоне терапии были купированы
Эффективность • • • Общий ответ – 54, 5% (6) Полный ответ – 18, 2% (2) Частичный ответ – 36, 4% (4) Стабилизация – 18, 2% (2) Прогрессия – 27, 3% (3) Проявления гемолиза на фоне терапии были купированы
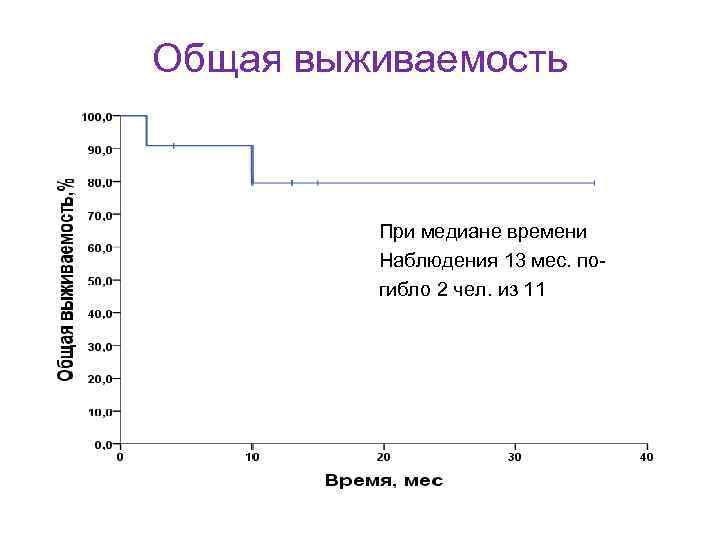 Общая выживаемость При медиане времени Наблюдения 13 мес. погибло 2 чел. из 11
Общая выживаемость При медиане времени Наблюдения 13 мес. погибло 2 чел. из 11
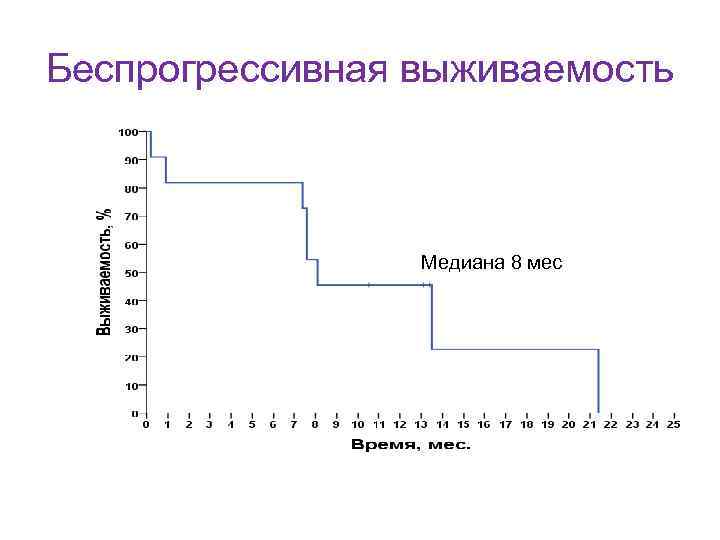 Беспрогрессивная выживаемость Медиана 8 мес
Беспрогрессивная выживаемость Медиана 8 мес
 0 26/04/2011 25/04/2011 Трансфузии ЭВ 24/04/2011 23/04/2011 22/04/2011 21/04/2011 150 20/04/2011 Метипред 19/04/2011 18/04/2011 17/04/2011 300 16/04/2011 350 15/04/2011 14/04/2011 50 13/04/2011 12/04/2011 11/04/2011 10/04/2011 200 09/04/2011 08/04/2011 Пациент Д. • 8 -я линия терапии, Курс № 1 в 04. 2011 г. Бендамустин 50 мг Ритуксимаб 250 Ret, ‰ 100 Hb, г/л
0 26/04/2011 25/04/2011 Трансфузии ЭВ 24/04/2011 23/04/2011 22/04/2011 21/04/2011 150 20/04/2011 Метипред 19/04/2011 18/04/2011 17/04/2011 300 16/04/2011 350 15/04/2011 14/04/2011 50 13/04/2011 12/04/2011 11/04/2011 10/04/2011 200 09/04/2011 08/04/2011 Пациент Д. • 8 -я линия терапии, Курс № 1 в 04. 2011 г. Бендамустин 50 мг Ритуксимаб 250 Ret, ‰ 100 Hb, г/л
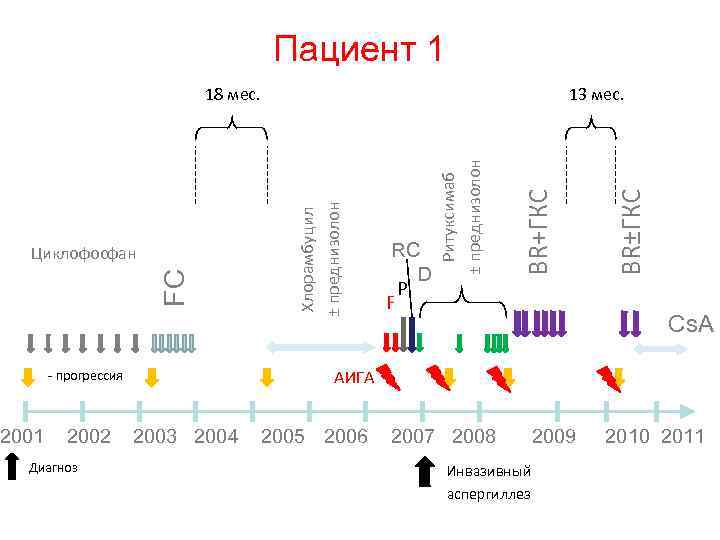 Пациент 1 BR±ГКС BR+ГКС RC D P F Ритуксимаб ± преднизолон FC Циклофосфан 13 мес. Хлорамбуцил ± преднизолон 18 мес. Cs. A АИГА - прогрессия 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Диагноз Инвазивный аспергиллез
Пациент 1 BR±ГКС BR+ГКС RC D P F Ритуксимаб ± преднизолон FC Циклофосфан 13 мес. Хлорамбуцил ± преднизолон 18 мес. Cs. A АИГА - прогрессия 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Диагноз Инвазивный аспергиллез
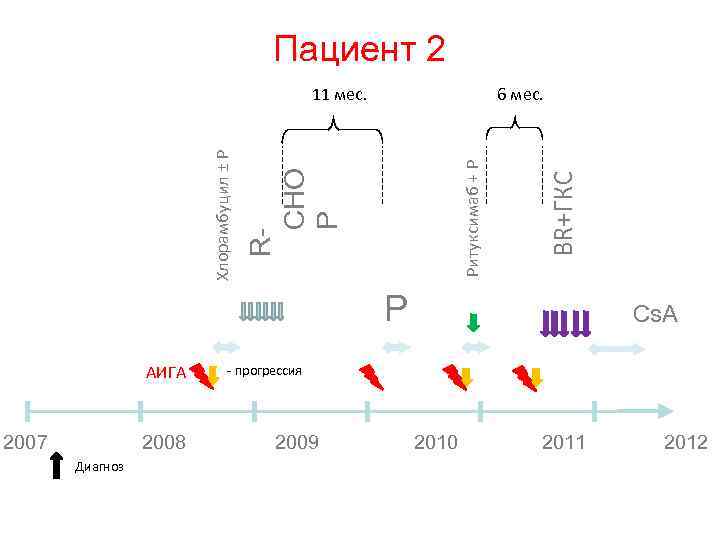 Пациент 2 P АИГА BR+ГКС Ритуксимаб + P 6 мес. RCHO P Хлорамбуцил ± Р 11 мес. Cs. A - прогрессия 2007 2008 2009 2010 2011 2012 Диагноз
Пациент 2 P АИГА BR+ГКС Ритуксимаб + P 6 мес. RCHO P Хлорамбуцил ± Р 11 мес. Cs. A - прогрессия 2007 2008 2009 2010 2011 2012 Диагноз
 Токсичность (проанализировано 47 курсов) • • Нейтропении I-II – 18, 9% Нейтропении III – 13, 2% Нейтропении IV – 22, 6% Анемии I – II – 11, 3% Анемии III – IV – не было Тромбоцитопении I-II – 9, 4% Тромбоцитопении III – 7, 5% Тромбоцитопении IV – не было
Токсичность (проанализировано 47 курсов) • • Нейтропении I-II – 18, 9% Нейтропении III – 13, 2% Нейтропении IV – 22, 6% Анемии I – II – 11, 3% Анемии III – IV – не было Тромбоцитопении I-II – 9, 4% Тромбоцитопении III – 7, 5% Тромбоцитопении IV – не было
 Токсичность • • • Инфекции I – II – 17% Инфекции III – 9, 4% Инфекции IV -1, 9% Стимуляция G – CSF – 18, 9% Гемотрансфузии – 11, 3%
Токсичность • • • Инфекции I – II – 17% Инфекции III – 9, 4% Инфекции IV -1, 9% Стимуляция G – CSF – 18, 9% Гемотрансфузии – 11, 3%
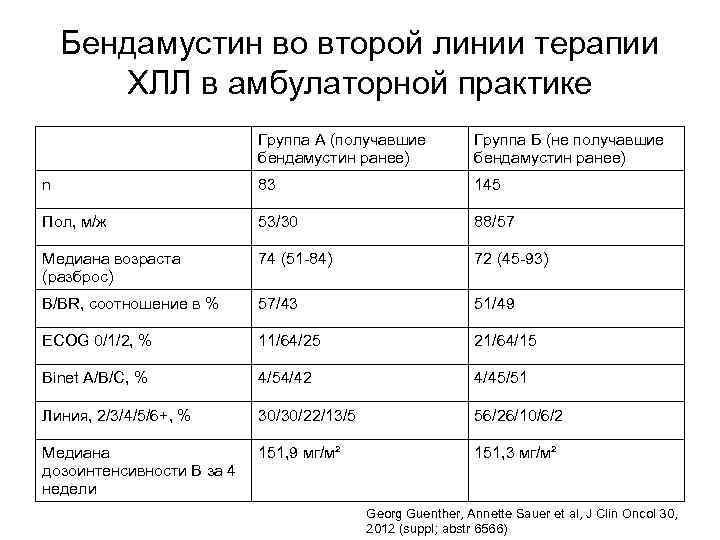 Бендамустин во второй линии терапии ХЛЛ в амбулаторной практике Группа А (получавшие бендамустин ранее) Группа Б (не получавшие бендамустин ранее) n 83 145 Пол, м/ж 53/30 88/57 Медиана возраста (разброс) 74 (51 -84) 72 (45 -93) B/BR, соотношение в % 57/43 51/49 ECOG 0/1/2, % 11/64/25 21/64/15 Binet A/B/C, % 4/54/42 4/45/51 Линия, 2/3/4/5/6+, % 30/30/22/13/5 56/26/10/6/2 Медиана дозоинтенсивности B за 4 недели 151, 9 мг/м² 151, 3 мг/м² Georg Guenther, Annette Sauer et al, J Clin Oncol 30, 2012 (suppl; abstr 6566)
Бендамустин во второй линии терапии ХЛЛ в амбулаторной практике Группа А (получавшие бендамустин ранее) Группа Б (не получавшие бендамустин ранее) n 83 145 Пол, м/ж 53/30 88/57 Медиана возраста (разброс) 74 (51 -84) 72 (45 -93) B/BR, соотношение в % 57/43 51/49 ECOG 0/1/2, % 11/64/25 21/64/15 Binet A/B/C, % 4/54/42 4/45/51 Линия, 2/3/4/5/6+, % 30/30/22/13/5 56/26/10/6/2 Медиана дозоинтенсивности B за 4 недели 151, 9 мг/м² 151, 3 мг/м² Georg Guenther, Annette Sauer et al, J Clin Oncol 30, 2012 (suppl; abstr 6566)
 Бендамустин во второй линии терапии ХЛЛ в амбулаторной практике Группа А Группа Б Общая частота ответа 80% 84% БПВ 15, 6 мес 21, 2 мес ОВ Медиана не достигнута Частота побочных эффектов 3/4 степени сопоставима в обеих группах Нейтропения – около 25% Тромбоцитопения – около 16% Инфекции – около 5% Georg Guenther, Annette Sauer et al, J Clin Oncol 30, 2012 (suppl; abstr 6566)
Бендамустин во второй линии терапии ХЛЛ в амбулаторной практике Группа А Группа Б Общая частота ответа 80% 84% БПВ 15, 6 мес 21, 2 мес ОВ Медиана не достигнута Частота побочных эффектов 3/4 степени сопоставима в обеих группах Нейтропения – около 25% Тромбоцитопения – около 16% Инфекции – около 5% Georg Guenther, Annette Sauer et al, J Clin Oncol 30, 2012 (suppl; abstr 6566)
 Выводы: • Комбинация Бендамустин + Ритуксимаб Бендамустин может быть эффективно и безопасно использована • - у пожилых пациентов - у пациентов с высоким риском инфекционных осложнений - в случае наличия активной аутоиммунной гемолитической анемии - при массивной лимфоаденопатии
Выводы: • Комбинация Бендамустин + Ритуксимаб Бендамустин может быть эффективно и безопасно использована • - у пожилых пациентов - у пациентов с высоким риском инфекционных осложнений - в случае наличия активной аутоиммунной гемолитической анемии - при массивной лимфоаденопатии

 В России официально зарегистрирован в терапии I и II линии хронического лимфолейкоза
В России официально зарегистрирован в терапии I и II линии хронического лимфолейкоза
 Будущее?
Будущее?
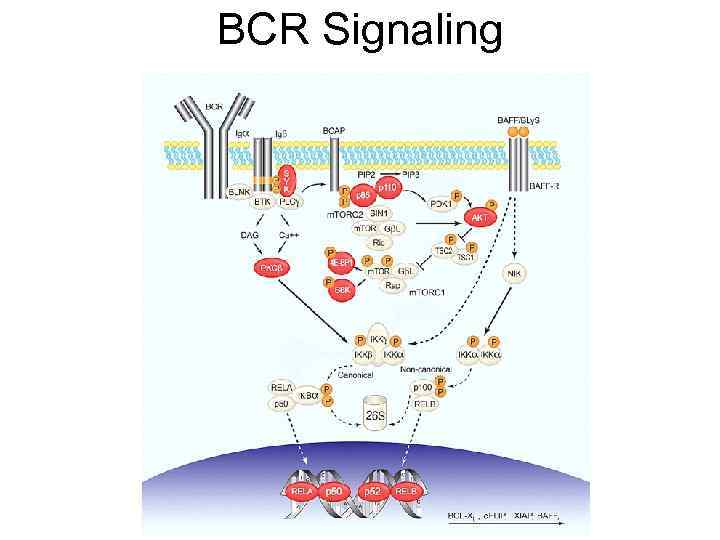 BCR Signaling
BCR Signaling
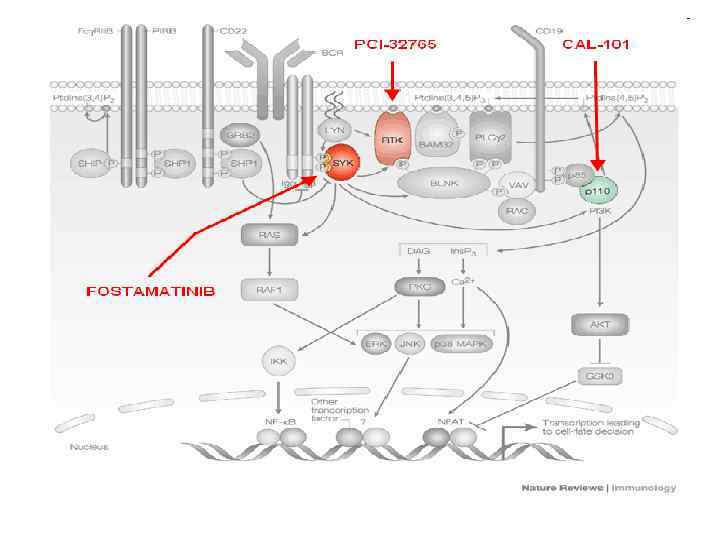
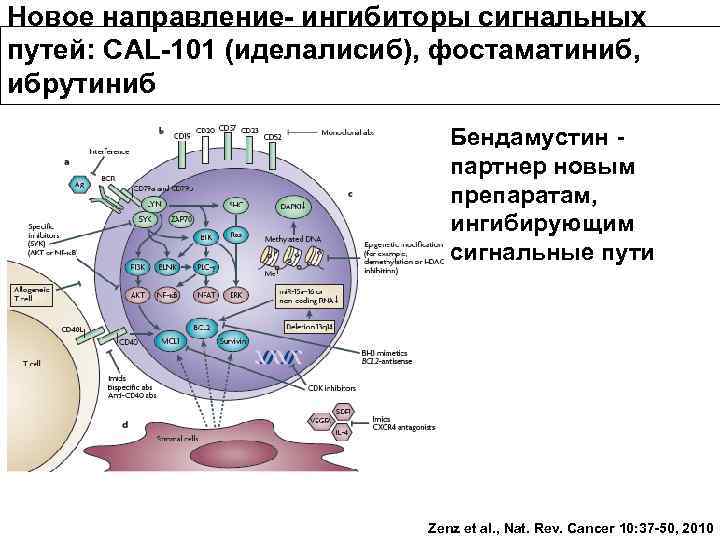 Новое направление- ингибиторы сигнальных путей: CAL-101 (иделалисиб), фостаматиниб, ибрутиниб Бендамустин - партнер новым препаратам, ингибирующим сигнальные пути Zenz et al. , Nat. Rev. Cancer 10: 37 -50, 2010
Новое направление- ингибиторы сигнальных путей: CAL-101 (иделалисиб), фостаматиниб, ибрутиниб Бендамустин - партнер новым препаратам, ингибирующим сигнальные пути Zenz et al. , Nat. Rev. Cancer 10: 37 -50, 2010
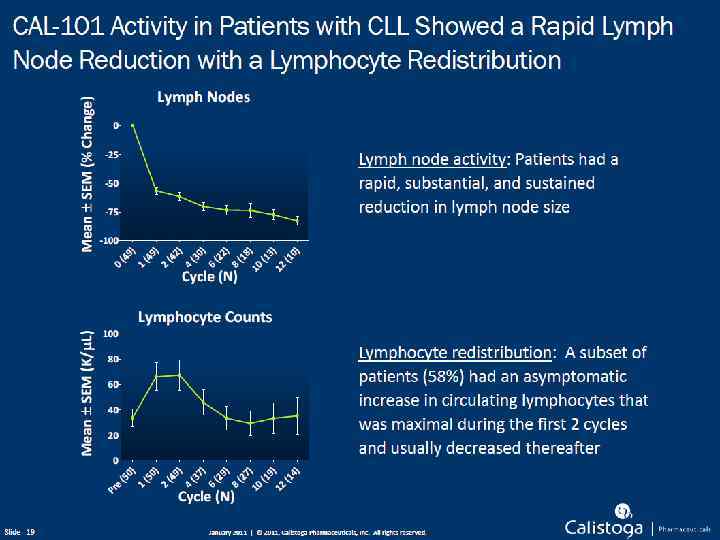
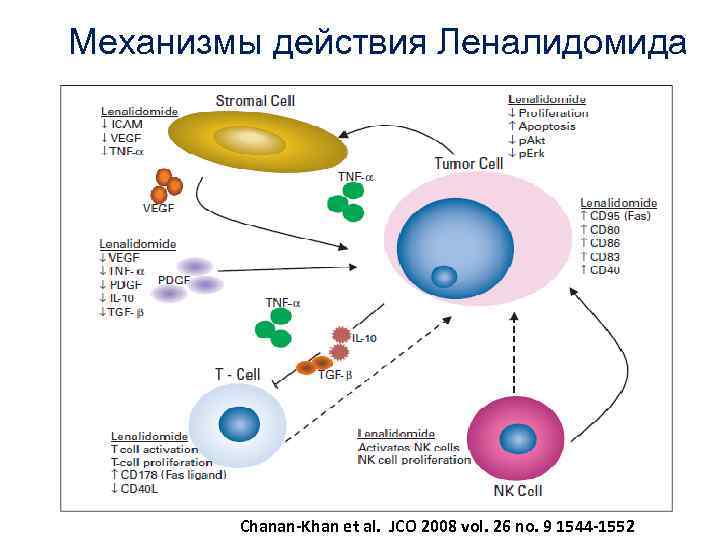 Механизмы действия Леналидомида Chanan-Khan et al. JCO 2008 vol. 26 no. 9 1544 -1552
Механизмы действия Леналидомида Chanan-Khan et al. JCO 2008 vol. 26 no. 9 1544 -1552
 Леналидомид • • • Badoux et al. , Blood 2011 Исследование II фазы у нелеченных пожилых пациентов N=60; возраст ≥ 65 лет (медиана – 71 год) Доза 5 мг/сут ежедневно, эскалация до 25 мг с 56 дня (шаг - 5 мг) У 60% пациентов макс. - доза 10 мг/сут Ответ на терапию дозозависим: § <5 мг/сут – OR 52%, CR 3% § ≥ 5 мг/сут – OR 82%, CR 26% • Ответ на терапию зависит от срока лечения: % 9 циклов 15 циклов 21 цикл CR + CRi 0 2 8 14 OR • • • 3 цикла 40 57 60 58 2 -летняя PFS - 60% (95% CI, 46%-72%) 88% пациентов живы при медиане наблюдения 31 мес. Токсичность: 88% транзиторная нейтропения 3 -4 ст. , 13% инфекции 34 ст. , 1 смерть Badoux et al. Blood. 2011 Sep 29; 118(13): 3489 -98
Леналидомид • • • Badoux et al. , Blood 2011 Исследование II фазы у нелеченных пожилых пациентов N=60; возраст ≥ 65 лет (медиана – 71 год) Доза 5 мг/сут ежедневно, эскалация до 25 мг с 56 дня (шаг - 5 мг) У 60% пациентов макс. - доза 10 мг/сут Ответ на терапию дозозависим: § <5 мг/сут – OR 52%, CR 3% § ≥ 5 мг/сут – OR 82%, CR 26% • Ответ на терапию зависит от срока лечения: % 9 циклов 15 циклов 21 цикл CR + CRi 0 2 8 14 OR • • • 3 цикла 40 57 60 58 2 -летняя PFS - 60% (95% CI, 46%-72%) 88% пациентов живы при медиане наблюдения 31 мес. Токсичность: 88% транзиторная нейтропения 3 -4 ст. , 13% инфекции 34 ст. , 1 смерть Badoux et al. Blood. 2011 Sep 29; 118(13): 3489 -98
 Перспективы: • Исследование по использованию комбинации FBR (флударабин + бендамустин + ритуксимаб) у предлеченных пациентов c ХЛЛ – MDACC. • Леналидомид - исследование по использованию комбинации BLR (бендамустин + леналидомид + ритуксимаб) у предлеченных пациентов с ХЛЛ (Cheson et al. ) - использование леналидомида в дозе 5 – 10 мг в качестве поддерживающей терапии после завершения режима BR (Chang et al. )
Перспективы: • Исследование по использованию комбинации FBR (флударабин + бендамустин + ритуксимаб) у предлеченных пациентов c ХЛЛ – MDACC. • Леналидомид - исследование по использованию комбинации BLR (бендамустин + леналидомид + ритуксимаб) у предлеченных пациентов с ХЛЛ (Cheson et al. ) - использование леналидомида в дозе 5 – 10 мг в качестве поддерживающей терапии после завершения режима BR (Chang et al. )
 Перспективы: • СAL 101 – ингибитор внутриклеточного сигнального пути PI 3 K. В 2010 году инициировано исследование по изучению эффективности комбинации CAL 101 с бендамустином и ритуксимабом у резистентных/реццидивных пациентов с ХЛЛ (A. Yu et al. )
Перспективы: • СAL 101 – ингибитор внутриклеточного сигнального пути PI 3 K. В 2010 году инициировано исследование по изучению эффективности комбинации CAL 101 с бендамустином и ритуксимабом у резистентных/реццидивных пациентов с ХЛЛ (A. Yu et al. )
 Спасибо за внимание!
Спасибо за внимание!


