ХМПЗ студенты 2013.pptx
- Количество слайдов: 164
ХРОНИЧЕСКИЕ МИЕЛОПРОЛИФЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ ВОЛОДИЧЕВА Е. М.
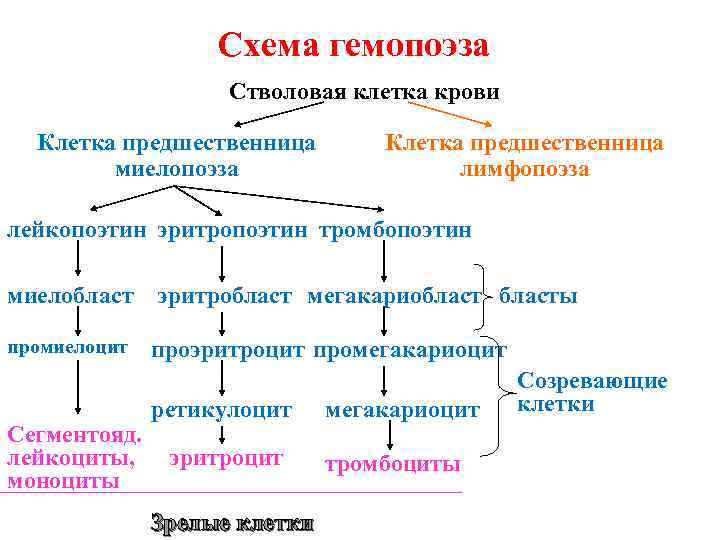
Схема гемопоэза Стволовая клетка крови Клетка предшественница миелопоэза Клетка предшественница лимфопоэза лейкопоэтин эритропоэтин тромбопоэтин миелобласт эритробласт мегакариобласты промиелоцит Сегментояд. лейкоциты, моноциты проэритроцит промегакариоцит ретикулоцит эритроцит Зрелые клетки мегакариоцит тромбоциты Созревающие клетки

Определение • Хронические миелопролиферативные заболевания (ХМПЗ) – группа заболеваний, характеризующихся клональными нарушениями полипотентных стволовых клеток костного мозга, приводящими к избыточному одно- двух- или трехростковому увеличению кроветворных клеток, сохраняющих способность к дифференцировке. Уровень поражения – стволовая клетка

ХМПЗ: признаки 1. Преобладание клонального гемопоэза над нормальным; 2. Повышенная продукция форменных элементов одного или более ростка гемопоэза при отсутствии физиологических стимулов; 3. Вовлечение в опухолевый процесс полипотентной гемопоэтической клетки; 4. Способность к развитию экстрамедуллярного гемопоэза; 5. Способность к клональной эволюции и трансформации в острый лейкоз.

Миелопролиферативные заболевания • Ведущий и объединяющий эти состояния синдром – – Гиперпродукция одного или нескольких ростков миелоидного кроветворения, обусловлено генетическими нарушениями стволовых клеток.

Исторические вехи 1845: ХМЛ, John Hughes Bennett 1879: ИМФ, Gustav Heuck 1892: ПЦЕ, Louis Henri Vaquez 1934: ЭТ, Emil Epstein 1951: William Dameshek ввел термин «Миелопролиферативные неоплазмы» - заболевания с панмиелоидной пролиферацией. Но провоцирующие факторы оставались неизвестными…

Исторические вехи 1937 -1990: цитогенетическая, молекулярная и онкогенетическая характеристика филадельфийской хромосомы 1996: открытие ИМАТИНИБА Открытие мутации FIP 1 -PDGFRA при ХЭЛ Открытие мутации PDGFRA/В при хр. миеломоноцитарном лейкозе 2001: классификация ВОЗ(WHO)

ХМПЗ: классификация ВОЗ 1. Хронический миелолейкоз 2. Хронический эозинофильный лейкоз 3. Хронический нейтрофильный лейкоз 4. Эссенциальная тромбоцитемия 5. Истинная полицитемия 6. Хронический идиопатический миелофиброз 7. Хроническое миелопролиферативное заболевание неклассифицируемое

ХРОНИЧЕСКИЙ МИЕЛОИДНЫЙ ЛЕЙКОЗ

• Хронический миелоидный лейкоз – клональное миелопролиферативное заболевание, в основе которого лежит хромосомная мутация с образованием химерного гена BCR-ABL, кодирующего мутантную тирозинкиназу, что приводит к интенсивной пролиферации клеток гранулоцитарного ряда и нарушению их созревания. • Впервые ХМЛ описан немецким патологом R. Virchov в 1849 г.

Эпидемиология ~ 25% лейкозов взрослых ~ 2 -3% от всех лейкозов у детей ~ Медиана возраста 53 года Расчетные данные для России: ~ 10 -15 человек на 1 000/год ~ 1600 новых пациентов ежегодно ~ 8000 на 145 млн населения при средней выживаемости 5 лет

Важные этапы в изучении биологии ХМЛ 1845 – заболевание впервые описано практически одновременно в Берлине (Рудольфом Вирховым) и в Шотландии (Джоном Беннеттом) 1960 – открытие Филадельфийской хромосомы 1986 – открытие химерного гена BCR-ABL

Джон Беннетт В 1845 г. патолог Королевского колледжа Эдинбурга J. Bennett опубликовал анатомические данные, которые были обнаружены при вскрытии двух умерших, страдавших при жизни увеличением Селезенки и печени и погибших, как полагал автор, от “заражения крови”. Д. Беннетт назвал картину крови “лейкоцитемией” и рассматривал эти изменения, как результат сепсиса.

Рудольф Вирхов В 1847 году патолог Берлинского госпиталя Шарите Р. Вирхов описал аналогичную анатомическую картину умершего больного и для обозначения заболевания использовал термин “лейкемия” и назвал заболевание“селезеночной лейкемией”

Пауль Эрлих В 1880 г. Пауль Эрлих предложил метод окраски клеток крови, позволивший детально различать клетки крови и выделить различные формы лейкоза.
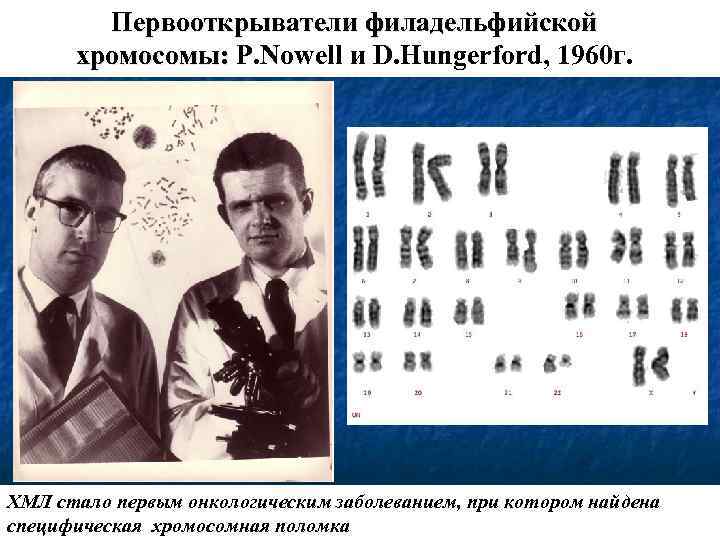
Первооткрыватели филадельфийской хромосомы: P. Nowell и D. Hungerford, 1960 г. ХМЛ стало первым онкологическим заболеванием, при котором найдена специфическая хромосомная поломка

J. Rowley – первооткрыватель t(9; 22)

The worldwide acclaim for Ph chromosome discoverer President Bill Clinton presents Dr. Janet Rowley with the Lasker Award. Dr. Janet Rowley receives a Japan Prize award from Taro Nakayama, chairman of the Japan Prize Foundation President Barack Obama presents Dr. Janet Rowley with the Presidential Medal of Freedom, the US highest civilian honor.

Cобытия, опосредуемые белком BCR/ABL ↑пролиферативной активности клеток ↓апоптоза Ph(+) клеток Нарушение адгезии клеток к строме и внеклеточному матриксу с появлением в циркуляции незрелых элементов гемопоэза Активация онкогенов Нестабильность генома, увеличение скорости мутаций вторичные лейкемогенные события эволюция в более злокачественную стадию

Механизм функционирования BCR-ABL

ХМЛ Фазы заболевания Фаза акселерации Хроническая фаза 3 -18 мес 42 -55 мес ХМЛ Бластный криз 3 -9 мес

ХМЛ Клиническая картина Хроническая фаза • Около 85% всех выявленных случаев • Выявляется случайно у 30 -50% • Тяжесть в левом подреберье • Гепатоспленомегалия • Утомляемость, похудание, бледность • Боли в суставах • Гиперлейкоцитоз с «левым» сдвигом • Базофилия • Эозинофилия • Нет моноцитоза • Гипертромбоцитоз • Анемия 30 -50% • Бластоз в периферической крови < 5% • Бластоз в к/м < 10%
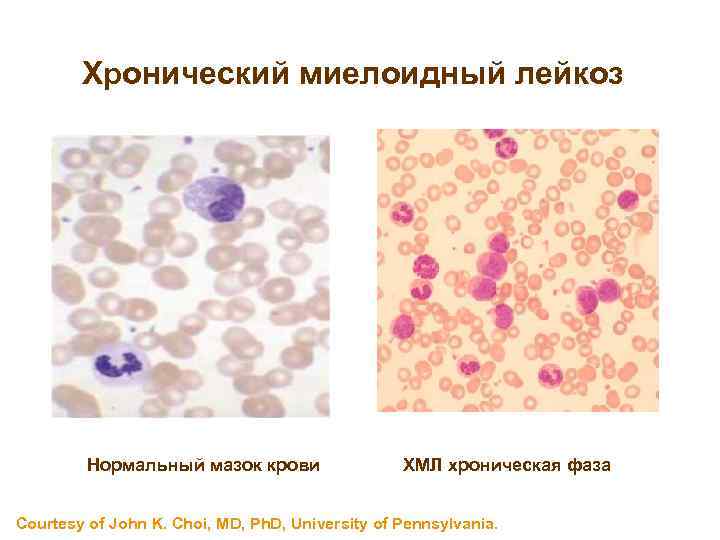
ХМЛ Хронический миелоидный лейкоз Нормальный мазок крови ХМЛ хроническая фаза Courtesy of John K. Choi, MD, Ph. D, University of Pennsylvania.
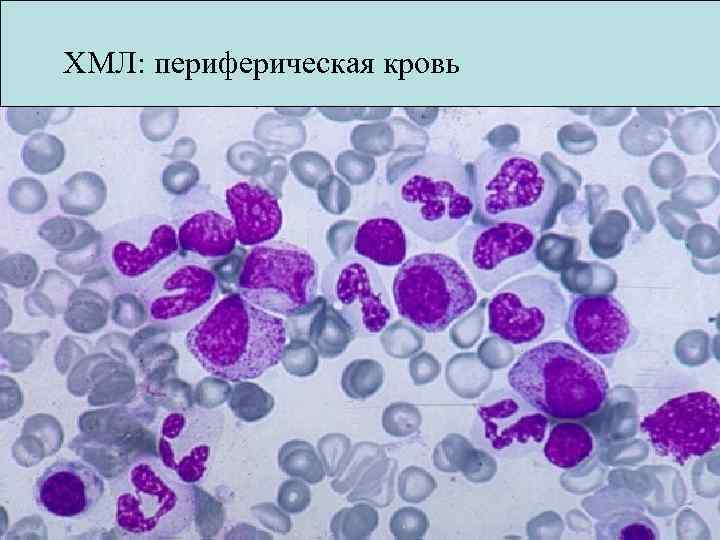
ХМЛ: периферическая кровь

ХМЛ: периферическая кровь a. CML: Peripheral blood (II)

CML: Bone marrow

ХМЛ: костный мозг

Клиническая картина Фаза акселерации (критерии ВОЗ) • Уровень бластных клеток в к/м или крови 10 -19% • Уровень базофилов п/к 20% • Тромбоцитопения, не связанная с терапией<100 х109/л или • Неконтролируемый тромбоцитоз >1000 х109/л • Дополнительные хромосомные аномалии • Прогрессирующая спленомегалия • Рост лейкоцитоза, неконтролируемый терапией Jaffe ES. Et al. 2001

Клиническая картина Фаза акселерации (критерии IBMTR) • Неконтролируемый гидроксимочевиной или бусульфаном лейкоцитоз • Быстрое удвоение уровня лейкоцитоза п/к (< 5 дней) • Уровень бластных клеток в к/м или крови >10% • Бласты+промиелоциты крови или к/м 20% • Уровень базофилов и эозинофилов п/к 20% • Анемия или тромбоцитопения, не связанные с терапией • Неконтролируемый тромбоцитоз • Дополнительные хромосомные аномалии • Прогрессирующая спленомегалия • Миелофиброз Savage DG. et al. Br J Hematol 1997; 99: 30 -35.

ХМЛ, фаза акселерации. ПК (бласты указаны стрелками). КМ: гиперклеточнос ть, расширен гранулоцитарный росток.

Клиническая картина Бластный криз (критерии ВОЗ*) • Уровень бластных клеток в к/м или крови > 20% • Экстрамедуллярные инфильтраты бластных клеток • Крупные скопления бластных клеток в костном мозге критерии IBMTR** • Уровень бластных клеток в к/м и/ или крови > 30% • Экстрамедуллярные инфильтраты бластных клеток *Jaffe ES. Et al. 2001 **De. Vita et al. 2001

ХМЛ, бластный криз по миелоидному типу (х1000)

ХМЛ, бластный криз по лимфоидному типу (х1000)

Хронический миелолейкоз – диагностические критерии 3 -х стадий заболевания ХМЛ, хроническая фаза (ХФ-ХМЛ): • миелопролиферативное заболевание вызвано сбалансированной транслокацией между длинными плечами 9 и 22 хромосом: t(9; 22)(q 34; q 11) • отсутствие критериев, характерных для фазы акселерации ХМЛ, фаза акселерации (А-ХМЛ): Для диагноза достаточного одного из этих критериев: • Бласты от 10 до 19% в периферической крови или костном мозге • Базофилы от 20% в периферической крови • Персистирующая тромбоцитопения (< 100 х 109/л), не связанная с терапией, или персистирующий тромбоцитоз (>1000 х 109/л), не отвечающий на терапию. • Нарастающая спленомегалия и нарастающий лейкоцитоз, не отвечающие на терапию • Цитогенетические признаки клональной эволюции (появление дополнительных хромосомных поломок, которые не регистрировались на момент хронической фазы) • Пролиферация мегакариоцитов, располагающихся пластами и скоплениями значительных размеров, с ретикулиновым или коллагеновым фиброзом и/или тяжелая дисплазия гранулоцитраного ростка. Эти признаки не анализировались в больших клинических исследованиях и не вполне ясно, являются ли они независимыми критериями фазы акселерации. ХМЛ, бластный криз (ХМЛ-БК): Для диагноза достаточного одного из этих критериев: • Бласты 20% или более в периферической крови или костном мозге • Экстрамедуллярная пролиферация бластов • Большие очаги или скопления бластов по данным биопсии костного мозга D. Bixby

ДИАГНОСТИКА ХМЛ Предположительный диагноз - клиническая картина - гематологическая картина Окончательный диагноз -обнаружение t(9; 22) и/или bcr-abl

Цитогенетические методы диагностики ХМЛ обнаружение t(9; 22) и/или bcr-abl: • Стандартная цитогенетика • FISH • PCR (Полимеразная цепная реакция)
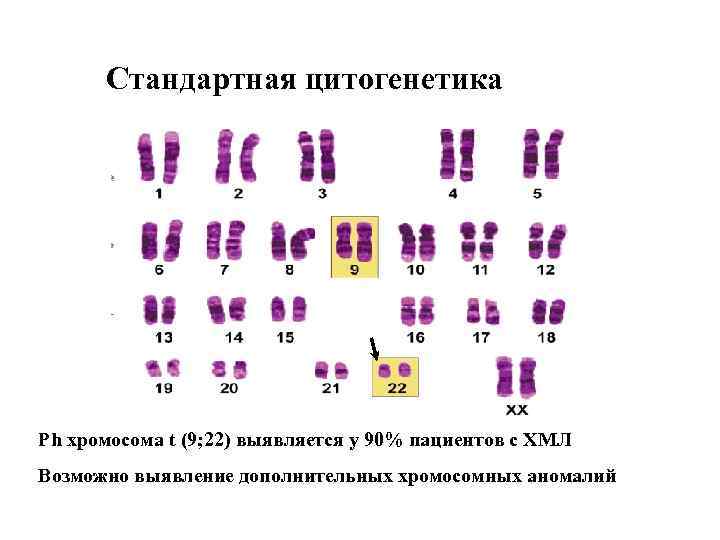
Стандартная цитогенетика Ph хромосома t (9; 22) выявляется у 90% пациентов с ХМЛ Возможно выявление дополнительных хромосомных аномалий

Метод FISH (fluorescence in situ hybridisation) Интерфаза Метафаза Courtesy of Charles Sawyers, UCLA.

МЕТОД Q-RT-PCR (КОЛИЧЕСТВЕННАЯ ПЦР С ОБРАТНОЙ ТРАНСКРИПТАЗОЙ) • Транскрипт bcr-abl выявляется у 100% пациентов с Ph+ ХМЛ • Выявление м. РНК в периферической крови или костном мозге • Позволяет выявлять м. РНК bcr-abl в 1/105 клеток • Количественное определение уровня транскрипта/количества клеток с t(9; 22).

Дифференциальный диагноз ХМЛ ØМиелофиброз ØЭссенциальная тромбоцитемия ØИстинная полицитемия ØОМЛ ØЛейкемоидные реакции

Гигантские пронормобласты при парвовирусной инфекции

ТИПЫ ОТВЕТА: o Гематологический o Цитогенетический o Молекулярный

КРИТЕРИИ ОТВЕТА Гематологический • Полный (ПГО) Нет спленомегалии Тромбоцитоз < 450 х 109 /л Лейкоцитоз <10 х109 /л Отсутствие в ПК молодых миелоидных форм (миелоциты, промиелоциты) • Парциальный Те же критерии как для полного за исключением: Наличия молодых миелоидных форм в крови Тромбоцитоз <50% от исходного уровня, но >450 х109/л Сохраняющаяся спленомегалия, но < 50%от исходной ПГО - редукция массы опухоли в 10 раз

КРИТЕРИИ ОТВЕТА Цитогенетический (>20 метафаз) Ø Большой • • Ø Полный - 0% Ph-позитивных метафаз (ПЦО) Парциальный - 1 -34% Ph-позитивных метафаз Малый • 35 -90 % Ph-позитивных метафаз ПЦО - редукция массы опухоли в 100 раз

КРИТЕРИИ ОТВЕТА Молекулярный ответ БОЛЬШОЙ – bcr-abl/abl ≤ 0, 10 ПОЛНЫЙ – bcr-abl не выявляется Большой молекулярный ответ - редукция массы опухоли в 1000 раз Полный молекулярный ответ-редукция массы опухоли в 100 000 раз

Масса опухоли Активное заболевание %bcr-abl/ abl 1012 1011 100 Полный гематологический ответ 1010 10 -1 log 1 – 2 log Полный ЦГ ответ 0, 1 -3 log 109 108 107 0, 01 Молекулярный ответ 0, 001 0, 0001 106 Излечение? 3 log = 0, 1% (большой молекулярный ответ) log – десятичный логарифм, порядок

Методы терапии (в историческом порядке) • Бусульфан • Гидроксимочевина • Интерферон- • Гливек (ингибитор тирозин киназы) • Ингибиторы ТК 2 -го поколения (нилотиниб, дазатиниб) • Аллогенная ТГСК • Экспериментальные виды терапии(клинические исследования)

Раствор фовлера. сульфид мышьяка формулы As 4 S 4 В 1865 году Х. Лиссауэр сообщил о двух своих пациентах, имевших характерную клиническую картину, у которых ему удалось добиться улучшения самочувствия и сокращения размеров селезенки с помощью мышьяка в виде фовлерова раствора. До начала 20 -го века фовлеров раствор оставался единственным средством лечения больных ХМЛ. Продолжительность жизни больных оставалась короткой – не более 2 -х лет.

Радиотерапия Первые сведения о возможности терапевтического воздействия лучистой энергией на заболевания кроветворных органов относятся к 1903 г. В этом году в Америке появилось сообщение Н. Сенна о двух случаях лейкемии, с успехом леченных им рентгеновыми лучами. Под влиянием облучений селезенки и костей количество лейкоцитов понизилось почти до нормы, наступило значительное уменьшение селезенки, и лимфатические железы подверглись обратному развитию. Продолжительность достигаемого эффекта составляла 5 -6 месяцев.

Д. Голтон В 1953 году синтезирован препарат алкилирующего действия 1, 4 -диметилсульфонилоксибутина, известного в разных странах под разными названиями: в Англии – милеран, в России – миелосан. В клинической практике для лечения больных с ХМЛ препарат впервые был использован английским химиотерапевтом Д. Голтоном.

Интерферон-альфа В 1957 английскими учеными A. Isaacs и J. Lindenmann были открыты интерфероны. В дальнейшем была показана эффективность интерферона при лечении больных с ХМЛ. Если до появления интерферонов 10 -летняя продолжительность жизни отмечалась лишь у 1 -5% больных, то при лечении интерфероном-альфа в сочетании с малыми дозами цитозара она достигалась у 27 -53% в зависимости от прогностических факторов к началу лечения. Однако по мере накопления опыта стало очевидным, что с помощью интерферонотерапи не удается добиться излечения ХМЛ.

Результаты терапии бусульфаном, гидроксимочевиной и интерфероном Hehlmann R, Heimpel H, Hasford J, et al, for the German CML Study Group. Randomized comparison of interferon- with busulfan and hydroxyurea in chronic myelogenous leukemia. Blood. 1994; 84: 40644077.

Ученые из Dana Farber Cancer Institute в Бостоне, создавшие иматиниб

ГЛИВЕК (иматиниб мезилат, STI 571) – Игибитор тирозинкиназы Bcr-Abl

Предпосылки для разработки Гливека • ХМЛ характеризуется транслокацией (9; 22), известной как Ph хромосома • Ее продуктом является слитной ген bcr-abl и тирозинкиназа, вызывающая развитие лейкоза • Bcr-Abl определяется у 100% пациентов с ХМЛ • Активность тирозинкиназы необходима для функционирования клеток ХМЛ • Ингибирование Bcr-Abl киназы должно быть эффективным лечением ХМЛ • иматиниб является селективным ингибитором Bcr-Abl киназы

ХМЛ Возможности лечения Свойства молекулы гливека • Маленький размер, соответствующий размеру молекулы АТФ • Связывается с участком связывания АТФ молекулы Bcr-Abl • Крепкое связывание с молекулой Bcr-Abl, блокирующее связывание АТФ с Bcr-Abl • Блокирует фосфорилирующую активность Bcr-Abl • Кроме Bcr-Abl тирозинкиназы блокирует тирозинкиназы PDGF, с-kit, FRGF

ХМЛ Возможности лечения Механизм действия гливека Goldman JM, Melo JV. N Engl J Med. 344: 1084 -1086

Мишени Гливека Избирательность – необходимое свойство идеальной противоопухолевой терапии! IC 50 < 10 n. M 10 -50 n. M 50 -250 n. M 250 -1000 n. M Kinome tree after that designed by Cell Signaling Technology, Inc.

Частота ПЦО Терапия первой линии Иматиниб IFN- + Ara-C Терапия второй линии Иматиниб 82% 12% 81% ПЦО - полный цитогенетический ответ Hochhaus A et al. Blood. 2007; 110: 15 a-16 a. Abstract 25. ASH 2007 oral presentation.

Назначение Гливека Фаза ХМЛ Начальная доза Хроническая 400 Фаза акселерации 600 Бластный криз 600 * 800 мг = по 400 мг 2 раза в сутки

Непреложные правила терапии ХМЛ Гливек необходимо принимать в дозе не менее 400 мг/сутки даже после достижения полного цитогенетического или молекулярного ответа! Назначение дозы Гливека <400 мг/сутки может быть причиной цитогенетического рецидива и/или источником возникновения резистентных клонов! При развитии токсичности предпочтительнее временное прекращение терапии, а не снижение дозы!

Побочные эффекты Гливека В большинстве случаев - были умеренно выражены и легко купировались • • Наиболее частые: n n n Цитопении (анемия, нейтропения, тромбоцитопения) Гепатит Дерматит Задержка жидкости Мышечные спазмы Тошнота • Прекращение лечения из-за побочных эффектов: – Менее 5% пациентов в хронической фазе

Взаимодействие Гливека с другими лекарствами Вещества, ингибирующие CYP 3 A 4/5 передозировка • антидепрессанты Вещества, активирующие CYP 3 A 4/5 снижение терапевтического эффекта • антиаритмические n снотворные n противосудорожные n седативные • противотуберкулезные препараты (изониазид) n глюкокортикоиды n прогестерон • противоглистные n дексаметазон • макролидные антибиотики • противогрибковые препараты (кетоконазол) • противоязвенные

Необходимость повышения эффективности терапии в ХФ ХМЛ • Хотя результаты терапии иматинибом впечатляют, лишь незначительное большинство пациентов (~ 55%) остается на иматинибе в рамках исследования и находятся в глубокой цитогенетической ремиссии после 8 лет • Переносимость (нежелательные явления 2 и более степени) и отсутствие приверженности терапии создают значительные проблемы для многих пациентов • Глубина ответа на иматиниб коррелирует с исходами (БМО > ПЦО, но нет БМО > нет ПЦО) • Значительная часть пациентов не достигает ПЦО или БМО к 1218 месяцам • Достижение глубоких цитогенетических и молекулярных ответов становится необходимым 64

Можем ли мы добиться лучших результатов, чем демонстрирует иматиниб 400 мг в сутки? – Высокие дозы иматиниба (600, 800 мг в сутки) – Иматиниб + интерферон- – ИТК 2 (дазатиниб, нилотиниб) – Аллогенная трансплантация костного мозга 65

Вторая линия терапии ХМЛ

Когда следует переходить на ингибиторы тирозинкиназ 2 поколения? • Персистирующая негематологическая токсичность • Несмотря на модификацию дозы иматиниба • Потеря ответа/нарастание титра bcr-abl • 75% резистентные мутации BCR-ABL • Невозможность достижения последнего рубежа: – ПЦГО к 12 месяцам или – БМО к 18 или 12 месяцам • Ответ может улучшиться со временем, но • Высок риск рецидива/прогрессии

Новые ингибиторы тирозинкиназ Избирательность – необходимое свойство идеальной противоопухолевой терапии! IC 50 < 10 n. M Иматиниб 10 -50 n. M 50 -250 n. M 250 -1000 n. M Нилотиниб Дазатиниб
Ингибиторы тирозинкиназ 2 -й линии: Нилотиниб

Нилотиниб - селективный аминопиримидиновый ингибитор BCR/ABL обладает большим сродством к bcr/ablтирозинкиназе CH 3 N N накапливается в клетках в более высокой концентрации, чем иматиниб подавляет активность bcr/abl-тирозинкиназы в более низкой концентрации, чем иматиниб N H N N H 3 C O N H F F F N Нилотиниб (AMN 107, тасигна) IC 50 25 n. M Следствие: - высокая селективность в отношении bcr/abl - более высокая активность в подавлении активности онкопротеина (>20 раз) - активность в отношении мутантного bcr/abl (исключая T 315 I) Первая линия терапии ХМЛ – регистрация в FDA 17 июня 2010 г. T et al. Cancer Cell. 2005 O'Hare
Дазатиниб

СПРАЙСЕЛ (дазатиниб) • Мощный ингибитор многочисленных онкогенных киназ in vitro 1 • Новый эффективный ингибитор bcr-abl и SRC киназы1 – Также действует на c-Kit, рецептор или киназы эфрина, рецептор PDGF-ß • in vitro в 325 раз активнее иматиниба 2 • Первый и единственный препарат, связывающийся как с активной, так и с неактивной конформацией bcr-abl 1 – Иматиниб связывается только с неактивной конформацией • Активен в отношении всех известных мутаций BCR-ABL, вызывающих резистентность к иматинибу за исключением T 315 I 2– 4 1. O’Hare T, et al. Cancer Res 2005; 65: 4500– 4505; 2. Talpaz M, et al. NEJM 2006; 354: 2531– 2541; 3. Shah NP, et al. Science 2004; 305: 399– 411; PDGF=фактор роста тромбоцитов 72

Роль аллогенной трансплантации костного мозга у пациентов с ХМЛ

Показания для ТГСК при ХМЛ • хроническая фаза ХМЛ, устойчивого к иматинибу • при установленной резистентности к 2 му поколению ИТК • развивающаяся устойчивость к 2 му поколению ИТК • при вероятном развитии устойчивости к 2 му поколению ИТК • утрата гематологического или цитогенетического ответа • обнаружение мутации Т 315 I





Первичный миелофиброз

Первичный миелофиброз: определение (хронический идиопатический миелофиброз, агногенная миелоидная метаплазия, сублейкемический миелоз алейкемический миелоз миелосклероз с миелоидной метаплазией хронический гранулоцитарно-мегакариоцитарный миелоз остеомиелопоэтическая дисплазия) – хроническое миелопролиферативное заболевание, характеризующееся ранним и значительным развитием фиброза костного мозга и появлением экстрамедуллярных очагов гемопоэза.

Первичный миелофиброз • Заболеваемость: 1 -2 случая на 1 000 населения. • Медиана возраста: 65 лет.

Миелофиброз • неопластические миелоидные стволовые клетки индукция пролиферации фибробластов фиброзирование КМ остеосклероз КМ не может быть аспирирован! • Трепанобиопсия: Трепанобиопсия - различная клеточность - ↑ ↑ ↑ ретикулин - массивное отложение коллагена

ИЗБЫТОК РОСТОВЫХ ФАКТОРОВ, ЦИТОКИНОВ, ПРОТЕАЗ Трансформирующий рост фибробластов фактор В Эпидермальный ростовой фактор Пластиночный дериват фактора роста Основной ростовой фактор фибробластов Васкулярный эндотелиальный ростовой фактор Нейтрофильная эластаза, металлопротеиназы, КСФ-1, ГМКСФ ЭПО, ТПО Остеопонтин, IL-1 B, IL-8
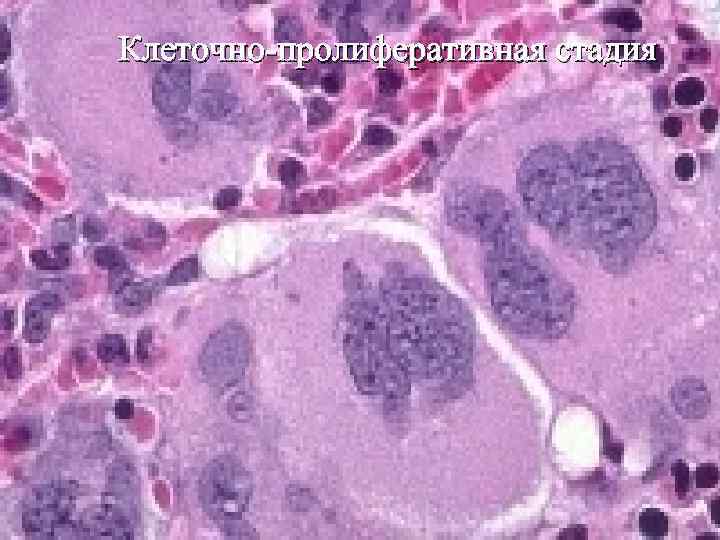
Клеточно-пролиферативная стадия

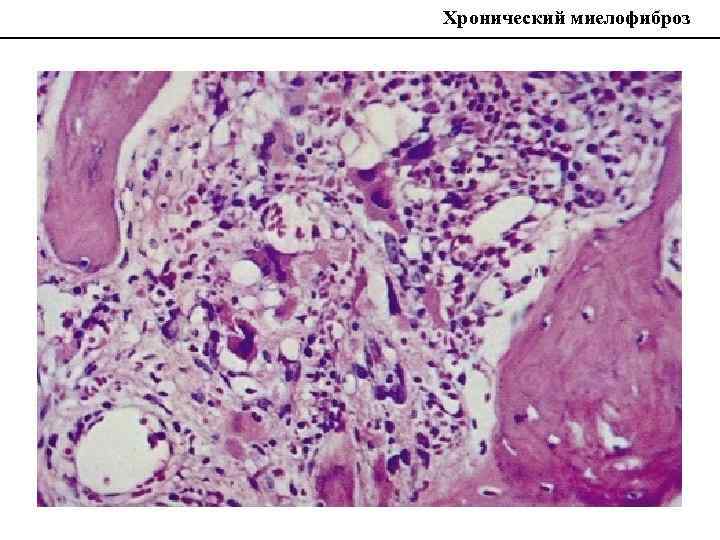
Хронический миелофиброз

Накопление ретикулиновых волокон в КМ при МФ

Хронический миелофиброз fibrosis new bone (arrows)

2005: открытие мутаций JAK 2 V 617 F - водораздел в понимании патогенеза ИПЭ, ЭТ и ПМФ


Мутация JAK 2 V 617 F при МПЗ Заболевание Истинная полицитемия Частота обнаружения 81 -99% Эссенциальная тромбоцитемия 41 -72% Первичный миелофиброз 39 -57%

ПМФ: Алгоритм диагностики 1. Клинический анализ крови 2. Миелограмма 3. Цитогенетическое исследование клеток крови или костного мозга 4. Гистологическое исследование костного мозга (трепанобиопсия) 5. Гистохимическое и иммуногистохимическое исследование костного мозга (окраска на ретикулиновые и коллагеновые волокна).

ПМФ: типичная гемограмма WBC x 109/L Hb g/L MCV fl Platelets x 109/L 2. 4 88 85 60 Neuts x 109/L Lymphs x 109/L Monos x 109/L Eos x 109/L Basos x 109/L 1. 0 0. 2 0. 1 [4 -11] [140 -180] [80 -100] [150 -450] [2 -7. 5] [1. 5 -4] [0. 2 -0. 8] [0 -0. 7] [0 -0. 1] В мазке присутствуют небольшое количество нуклеированных эритроцитов и миелоцитов, каплевидные пойкилоциты.
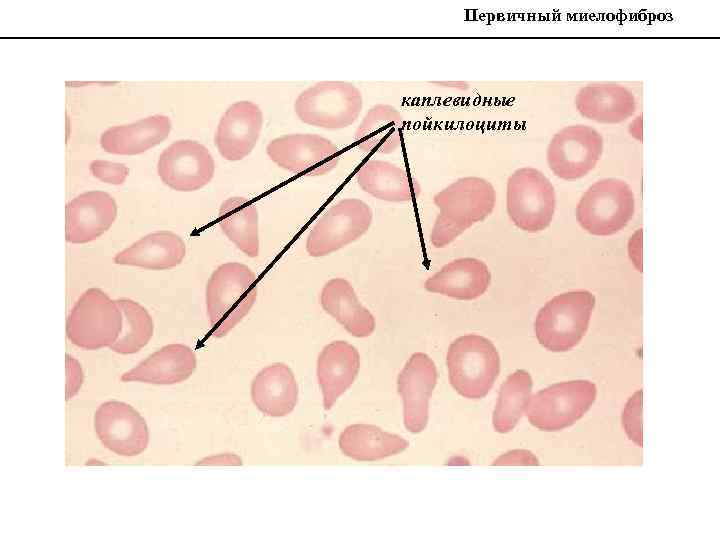
Первичный миелофиброз каплевидные пойкилоциты

ПМФ: Диагностические критерии (Michiels JJ et al. , 2002). Клинические критерии А 1 Отсутствие данных за наличие хронического миелолейкоза и других хронических миелопролиферативных заболеваний, миелодиспластического синдрома А 2 Ранняя клиническая стадия: - нормальный гемоглобин или анемия 1 степени (гемоглобин < 130 г/л, но ≥ 120 г/л); - незначительная или умеренная спленомегалия при пальпации или размеры селезенки > 11 см при ультразвуковом исследовании или компьюторной томографии; - количество тромбоцитов > 400 х109/л А 3. Промежуточная (переходная) клиническая стадия - Анемия 2 степени (гемоглобин <120 г/л, но ≥ 100 г/л) - Лейкоэритробластическая картина крови и каплевидные эритроциты - Спленомегалия, - Отсутствие прогностически неблагоприятных признаков* А 4. Развернутая клиническая стадия - Анемия 3 степени (гемоглобин < 100 г/л) - Наличие одного или более прогностически неблагоприятных признаков

ПМФ: Диагностические критерии (Michiels JJ et al. , 2002). Патоморфологические критерии В 1 Признаки избыточной пролиферации мегакариоцитарного и гранулоцитарного ростков, относительное уменьшение эритроидных предшественников по данным цитологического и гистологического исследования костного мозга. Патологические скопления и увеличение числа атипичных гигантских мегакариоцитов со складчатыми, неправильной формы, дольчатыми ядрами и признаками нарушения созревания. МФ. Гистологические стадии Хр. ИМФ. МФ 0. Префиброзная стадия (отсутствие ретикулинового фиброза в гистологических препаратах костного мозга) МФ 1. Ранняя стадия миелофиброза (слабопроявляющийся ретикулиновый фиброз) МФ 2. Стадия явного миелофиброза (явное увеличение ретикулиновых и/или коллагеновых волокон) МФ 3. Стадия распространенного выраженного миелофиброза (распространенный коллагеновый фиброз – остеосклероз с очагами остео- и ангиогенеза )

Критерии ПМФ ( Barosi G et al, 1999) I. Необходимые критерии: А. Диффузный фиброз костного мозга В. Отсутствие Филадельфийской хромосомы (t 9; 22) и BCRABL транскрипта II. Дополнительные критерии: 1. Спленомегалия в независимости от выраженности 2. Анизоцитоз, пойкилоцитоз, каплевидные эритроциты 3. Наличие незрелых миелоидных клеток в периферической крови 4. Наличие эритробластов в крови 5. Кластерное расположение мегакариобластов и измененные мегакариоциты в гистологических препаратах костного мозга 6. Миелоидная метаплазия

Диагноз ПМФ устанавливается при: • наличии у больного 2 -х основных критериев и 2 -х дополнительных критериев в случае наличия у больного спленомегалии или • наличии 2 -х основных критериев и 4 -х дополнительных критериев в случае отсутствия у больного спленомегалии

Остеосклероз при миелофиброзе

ПМФ: лечение • Цитостатические препараты – гидроксимочевина • • ИФН-а Андрогены, даназол Кортикостероиды Иммуномодулирующие препараты: – Талидомид – Леналидомид – Помалидомид

ПМФ: гидроксимочевина • Снижает уровень лейкоцитоза и тромбоцитоза в течении нескольких дней • ГМ рекомендована как терапия 1 ой линии при ПМФ • В связи с возможным лейкомогенным эффектом ГМ, для молодых пациентов следует предпочитать альтернативные препараты, напр. ИФα.

ПМФ: бусульфан • Снижает уровень лейкоцитов и тромбоцитов постепенно (недели-месяцы), медленно приводит к уменьшению селезенки • Назначается в небольшой дозе (2 мг/сут) повторяющимися курсами по 1 -2 мес с интервалами в 3 -6 мес. • Обладает лейкозогенным действием. Последовательное применение ГМ и Bu повышает риск лейкемической трансформации до 30%

ПМФ: ИФ-α • Эффективен у некоторых пациентов в гиперпролиферативную фазу заболевания • Не все пациенты достаточно хорошо переносят препарат • Не обладает лейкозогенным действием Рекомендации: • Препарат выбора для пациентов моложе 60 лет в гиперпролиферативную стадию ПМФ

Кладрибин • может использоваться при непереносимости других циторедуктивных препаратов • Используется при прогрессирующей гепатомегалии и симптоматическом лейкоцитозе и тромбоцитозе, связанными со спленэктомией • Назначается в дозе 0, 05 -0, 1 мг/кг на 7 дней ежемесячно до 5 курсов.

ПМФ: анагрелид • Может использоваться у пациентов с симптоматическим тромбоцитозом, которые плохо переносят другие циторедуктивные препараты • Не ингибирует миелофиброз, не снижает продукцию факторов роста

ПМФ: лучевая терапия ЛТ на область селезенки и легких • • • Несколько исследований показывают положительные результаты при облучении пациентов с выраженной спленомегалией. Однако, у большинства пациентов эффект оказывается временным (6 -8 мес) Облучение селезенки перед ее удалением связано с повышенным риском пост оперативных кровотечений Облучение легких может иметь значительную клиническую эффективность и снизить давление в легочной артерии при легочной гипертензиии, связанной с миелоидной метаплазией. Рекомендации: • Облучение селезенки может проводиться у пожилых пациентов, не являющихся кандидатами на спленэктомию, с симптоматической спленомегалией, рефрактерной к циторедуктивной терапии • Облучение легких может применяться для снижения легочной гипертензии.

Спленомегалия при ПМФ

ПМФ: спленэктомия Показания: • Выраженный механический дискомфорт • Эпизоды кровотечений из верхних отделов ЖКТ, связанных с портальной гипертензией • Трансфузионно-зависимая анемия • Тромбоцитопения

ПМФ: критерии ответа (European myelofibrosis network) • Клинико-гематологический ответ • Гистологический ответ • Цитогенетический ответ

• ПМФ: клинико-гематологический ответ Тип ответа Определение Полный ответ по всем критериям Большой ответ 1. 2. 3. Любой ответ по анемии и спленомегалии без прогрессироования основных симптомов Полный ответ по анемии или парциальный при трансфузионной зависимости + ответ по основным симптомам без прогрессии спленомегалии Любой ответ по спленомегалии + ответ по основным симптомам без прогрессии анемии Умеренный ответ 1. 2. 3. Малый ответ Любой ответ по уровню L и Tr без прогрессирования анемии, спленомегалии или основных симптомов Отсутствие ответа Любой ответ, который не удовлетворяет критериям малого Полный ответ по анемии прогрессировании спленомегалии Частичный ответ по анемии без прогрессии спленомегалии Любой ответ по спленомегалии без прогрессироваания анемии и основных симптомов

• Гистологический ответ Степени костно-мозгового фиброза Тип ответа Описание КМФ-0 Рассеянный линеарные непересекающиеся ретикулиновые волокна. Морфологическая картина соответствует нормальному КМ. КМФ-1 Рыхлая сеть ретикулиновых волокон, с многочисленными перемычками, особенно в периваскулярных зонах КМФ-2 Диффузное выраженное увеличение плотности размещения ретикулиновых волокон с многочисленными перемычками; встречаются локальные отложения коллагена и/или фокальный остеосклероз КМФ-3 Диффузное выраженное увеличение плотности размещения ретикулиновых волокон с многочисленными перемычками; выраженная коллагенизация, часто в участках остеосклероза.

• Цитогенетический ответ (на основании анализа 20 метафазных пластинок) Тип ответа Определение Большой ответ Отсутствие ЦГ аномалий при их предыдущем обнаружении Малый ответ Уменьшение аномальных пластинок на 50% или более.

Руксолитиниб при миелофиброзе

Результаты терапии • Уменьшение размеров селезенки- 29% больных • Коррекция анемии- 21% • Отсутствие зуда- 92% • Улучшение соматического состояния- 63%

Аллогенная трансплантация ГСК при миелофиброзе

МЕХАНИЗМЫ ДЕГРАДАЦИИ ФИБРОЗА ПРИ ТГСК? ! До ТГСК 2 года после ТГСК


Истинная полицитемия

Истинная полицитемия (эритремия, полицитемия красная истинная, болезнь Вакеза) – хроническое миелопролиферативное заболевание с поражением стволовой клетки костного мозга, характеризующееся избыточной пролиферацией трех ростков кроветворения, повышенным образованием эритроцитов и, в меньшей степени, тромбоцитов и лейкоцитов.

Истинная полицитемия • ↑↑↑ эритроидных элементов • ↑↑↑ объема и вязкости крови • КМ: – Гиперклеточный – Гиперплазия эритроидного, МГЦ и гранулоцитарного ростков →→→ фиброзирование • Анамнез: повторные флеботомии

• ИП: Эритроидная гиперплазия

Истинная полицитемия КМ при ИП: гиперклеточность с преимущественно эритроидной гиперплазией атипичные большие МГЦ с аномальной ядерной лобуляцией.

Миелофиброз при ИП

Диагностические критерии ИП PVSG* (Polycythemia Vera study group) Большие критерии Малые критерии Увеличение массы циркулирующих эритроцитов: У женщин более 32 мл/кг У мужчин более 36 мл/кг Количество тромбоцитов более 400 х 109/л Нормальная сатурация по кислороду артериальной крови (Sa более 92%) Количество лейкоцитов более 12 х 109/л Спленомегалия Уровень щелочной фосфатазы лейкоцитов более 100 ед. Уровень вит В 12 сыворотки крови более 900 пг/мл или общая вит В 12 -связывающая способность сыворотки более 2200 пг/мл * Для диагностики ИП требуется все 3 больших критерия или наличие первых 2 больших и любых 2 малых критериев.

ИП: модифицированные критерии: Критерии категории А А 1. Увеличенная масса циркулирующих эритроцитов, оцененная с использованием меченных 51 Cr эритроцитов: более чем на 25% от среднего нормального значения А 2. Отсутствие причины для вторичного эритроцитоза А 3. Пальпируемая спленомегалия А 4. Клональные маркеры ( например, аномальный кариотип) Критерии категории В В 1. Тромбоцитоз: количество тромбоцитов более 400 000 х109/л В 2. Нейтрофильный лейкоцитоз: количество нейтрофилов более 10 000 х109/л В 3. Спленомегалия, доказанная с использованием изотопного или ультразвукового метода исследования В 4. Сниженный уровень сывороточного эритропоэтина или характерный рост BFU-E ( если они доступны) Диагноз полицитемии устанавливается при наличии сочетания: • А 1 и А 2 и/или А 3 или А 4 • А 1 и А 2 и любые два из категории В.

Классификация эритроцитозов Виды эритроцитозов Врожденный/ приобретенный Этиопатогенетические характеристики Первичный эритроцитоз Врожденный Уменьшение рецепторов к эритропоэтину Приобретенный Истинная полицитемия

Виды эритроцитозов Врожденный/ приобретенный Этиопатогенетические характеристики Вторичный эритроцитоз, вызванный увеличением продукции эндогенного эритропоэтина Врожденный Приобретенный Гипоксемия Другие причины сниженного поступления кислорода в ткани: Заболевания почек Опухоли Заболевания печени Гемоглобинопатии с повышенным сродством к кислороду Врожденный дефицит 2, 3 - дифосфатглицерата в эритроцитах Автономная высокая продукция эритропоэтина Хронические обструктивные заболевания легких Артериовенозные шунты в легких Врожденные «синие» пороки сердца с право-левым сбросом крови Проживание в условиях высокогорья ( болезнь Менге) Хроническая альвеолярная гиповентиляция, например значительное ожирение ( синдром Пиквика) Синдром ночного апное Курение табака ( повышенное образование карбоксигемоглобина) Поликистоз, опухоли, стеноз почечной артерии, состояние после трансплантации почки, гидронефроз Гемангиобластома мозжечка, лейомиома матки, гепатома, карцинома бронха, опухоли надпочечников, рак почки, миксома предсердий Цирроз, гепатит, применение лекарственных препаратов, андрогенов Идиопатический эритроцитоз Персистенция увеличения объема циркулирующих эритроцитов при исключении ХМПЗ или явных причин вторичного эритроцитоза Относительный эритроцитоз (псевдополицитемия, ложный эритроцитоз) (ОЭ) Нормальный объем циркулирующих эритроцитов и сниженный объем циркулирующей плазмы (терапия диуретиками и обезвоживание, синдром Гайсбека, алкоголизм, гипертензия, ожирение)

Дифф. DS: вторичные эритроцитозы N Эритропоэтин сыворотки и↓ л и вторичные эритроцитозы ИП р. О 2 N

ИП: стадии заболевания • 1 стадия – малосимптомного течения; • 2 А стадия – эритремическая без миелоидной метаплазии селезенки; • 2 Б стадия – эритремическая с миелоидной метаплазией селезенки; • 3 стадия – постэритремической миелоидной метаплазии с миелофиброзом и без него.

ИП: факторы риска развития осложнений тромбозы • возраст >60 -65 лет • тромбозы в анамнезе • Hct >0. 45 • L >15 x 10 миелофиброз • тромбоцитоз кровотечения • Tr >1500 x 109 /л трансформация в лейкоз • L >15 x 10

ИП: терапевтические рекомендации

ИП: флеботомия • Приводит к развитию дефицита железа, сопровождающееся микроцитозом • Постепенно образуются «ножницы» : низкий Hb на фоне нормального Hct • ↓ Hb не следует коррегировать препаратами железа • риск тромбоза выше среди пациентов, получающих флеботомии по сравнению с пациентами на терапии Р 32 и хлорамбуцилом Hct Частота сосудистых осложнений за 10 лет 0. 40 -0. 44 0. 2 0. 45 -0. 49 0. 92 0. 50 -0. 54 2. 29 0. 55 -0. 59 >0. 6 3. 33 Pearson TC & Wetherley-Mein G. Vascular occlusive episodes and venous haematocrit in primary proliferative polycythaemia. Lancet 1978; 2: 1219 -1222. Рекомендации: • Hct следует поддерживать на уровне менее 52% ( у мужчин) и 45% ( у женщин)с помощью флеботомии. • Нет данных о разнице в Hct между муж и жен. 7. 5

ИП: аспирин Рекомендации: • Аспирин следует назначать всем пациентам при отсутствии противопоказаний. • Рекомендуемая доза: 75 -100 мг в день. • Сочетание Анагрелида и аспирина применять с осторожностью.

ИП: циторедуктивная терапия

Циторедуктивная терапия: показания Строгие: • Возраст > 60 лет при любом уровне Тр – в целях профилактики тромботических осложнений (grade C) • При наличии тромботических осложнений в анамнезе, при любом уровне Тр (grade C) • При уровне Тр > 1500 x 109/л (grade B) Циторедуктивная терапия может также быть назначена при: • • • L > 15 x 109/л для профилактики тромботических осложнений (grade C) возрасте < 60 лет при Тр > 600 x 109/л для достижения молекулярной ремиссии (не касается анагрелида) (grade C) При плохой переносимости флеботомий (grade C) При симптоматической спленомегалии или спленомегалии, связанной с прогрессией заболевания (grade C) при других признаках прогрессирования заболевания: потери веса, ночной потливости и т. д. (grade C)

Выбор циторедуктивной терапии 1 ая линия <60 лет 2 ая линия 3 яя линия ИФ-α Гидроксимочевина Анагрелид* ИФ-α Анагрелид* ГМ+ana*, ГМ+IFN Вu 4 ая линия - 32 P 60 -75 лет Гидрокси- мочевина >70 лет Гидроксимочевина * Анагрелид используется только в случае высокого тромбоцитоза

Эссенциальная тромбоцитемия

Эссенциальная тромбоцитемия (первичная, идиопатическая, геморрагическая тромбоцитемия, хронический мегакариоцитарный лейкоз) – хроническое миелопролиферативное заболевание, характеризующееся значительной гиперплазией мегакариоцитарного ростка кроветворения с устойчивым тромбоцитозом в периферической крови, не являющимся реактивным (т. е. вторичным к другим заболеваниям) и не связанным с другими миелопролиферативными заболеваниями.

Эссенциальная тромбоцитемия • встречаемость 1 -2, 5 х 100000 • гиперплазия мегакариоцитарного ростка → ↑↑↑ циркулирующих тромбоцитов • морфологически аномальные Тр спленомегалия кровотечения со слизистых тромбозы

Эссенциальная тромбоцитемия Диагностические критерии (ВОЗ 2008): • Тромбоцитоз в ПК при неоднократном анализе ≥ 450 х 109/л • Биопсия КМ: пролиферация преимущественно МГЦростка, с повышенным числом гигантских, зрелых МГЦ; отсутствие значительного расширения или сдвига влево нейтрофильного гранулопоэза и эритропоэза • Нет соответствия критериям ИП, ПМФ, ХМЛ, МДС или др. миелоидным неоплазмам • Обнаружение JAK 2 V 617 F или других клональных мутаций, или, при их отсутствии, исключение реактивного тромбоцитоза

Эссенциальная тромбоцитемия Диагноз ЭТ ставится методом исключения других ХМПЗ, МДС (5 q- синдрома) и вторичных тромбоцитозов.

Эссенциальная тромбоцитемия Две трети пациентов в момент постановки диагноза не имеют симптомов заболевания и диагноз устанавливается на основании лабораторных данных.
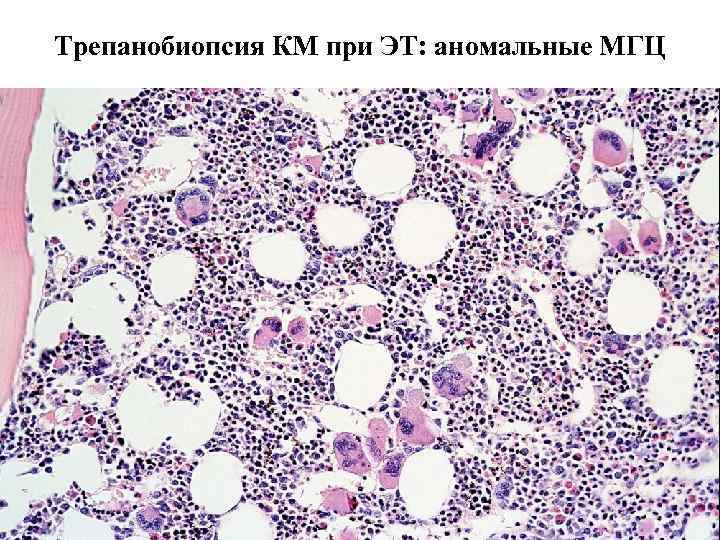
Трепанобиопсия КМ при ЭТ: аномальные МГЦ

Эссенциальная тромбоцитемия МГЦ • Два аномальных МГЦ
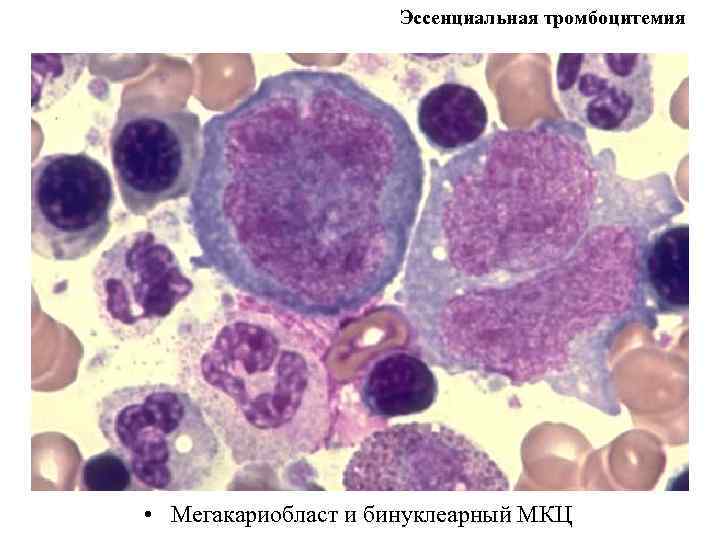
Эссенциальная тромбоцитемия • Мегакариобласт и бинуклеарный МКЦ
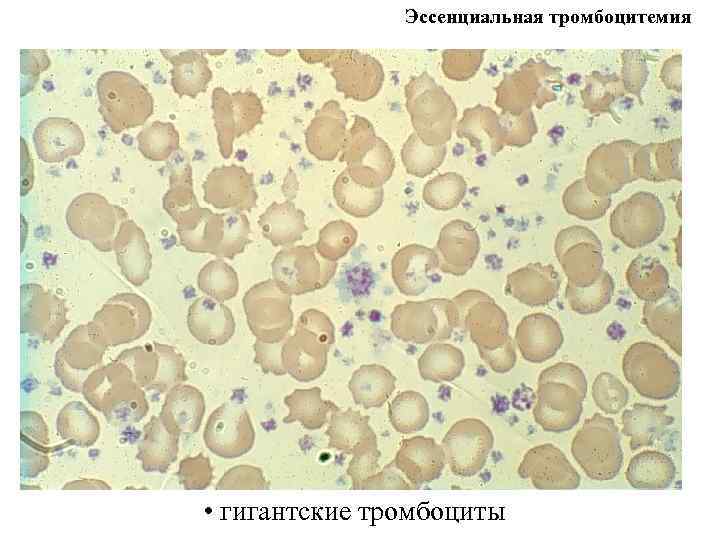
Эссенциальная тромбоцитемия • гигантские тромбоциты

Реактивный тромбоцитоз: • Низкий ферритин сыворотки • Гипоспленизм/аспления → тельца Жоли • Нейтрофильный лейкоцитоз со сдвигом влево, вакуолизация нейтрофилов, тельца Dohle, токсическая грануляция • ↑СРБ, ↑СОЭ, ↑ плазменный фибриноген

Другие характерные находки при ЭТ: • Рост эндогенных МГЦ и/или эритроцитарных колоний in vitro – у большинства пациентов с ЭТ, но никогда при реактивном тромбоцитозе • Повышенная экспрессия гена PRV-1 в периферических гранулоцитах, отмечаемая при ЭТ и при ИП, но никогда у пациентов с реактивным тромбоцитозом • JAK-2: у 50% пациентов с ЭТ обнаруживается мутация JAK-2 V 617 F

Основные причины реактивных тромбоцитозов Острые состояния Сразу после хирургического вмешательства Кровотечение Гемолиз Инфекции Повреждения тканей (острый панкреатит, инфаркт миокарда, травма, ожоги) Аортокоронарное шунтирование Период восстановления после химиотерапии или иммунной тромбоцитопении Реакция на препараты: винкристин, эпинефрин, ИЛ-1 B, производные ретиноевой кислоты Хронические причины Железодефицитная анемия Состояние после спленэктомии или функциональная аспления Метастатический рак, лимфомы Воспалительный процесс (ревматоидный артрит, васкулиты, аллергические реакции, хронические инфекции) Почечная недостаточность, нефротический синдром

Когда можно предположить ЭТ? • При персистирующем и необъяснимым другими причинами тромбоцитозе у пациента с интактной селезенкой и N значениями сыв. ферритина и СРБ

Осложнения ↓↓↓ ↑↑↑Тр функциональности Тр Тромбозы и кровотечения: • ТЭЛА, тромбозы селезенки и печени, инсульт, инфаркт миокарда, периферическая ишемия • ЖКК, кровоизлияния в ГМ, в суставы (при Тр > 1 млн)

ЭТ может трансформироваться • ИП ЭТ • ПМФ • ОМЛ

ЭТ: Факторы риска Развития тромбозов: – Возраст более 60 лет – Тромбоцитоз более 1000 x 109/л – Тромбозы в анамнезе Вторичного миелофиброза: – анемия Лейкоза: – Возраст более 60 лет Passamonti, F. et al. Haematologica 2008; 93: 1645 -1651

ЭТ: терапия

Терапия: Аспирин – НД аспирина: 100 мг/сут – ↓↓↓ риск развития инфаркта миокарда, инсульта, ТЭЛА, тромбоза крупных вен – Частота значительных кровотечений существенно не повышалась – Общая смертность и смертность от кардиоваскулярных причин не отличалась • Из-за риска кровотечений следует избегать применения препарата при Тр>1500 х 109/л и у пациентов с предшествующими кровотечениями

Аспирин: рекомендации • Аспирин 75 -100 мг/сут для всех пациентов, кроме: – пациентов с высоким тромбоцитозом (Тр ≥ 1500 x 109/л) – тогда следует начинать с циторедуктивной терапии – У пациентов с большими кровотечениями в анамнезе или др. противопоказаниями • Сочетание анагрелида и аспирина применяется с осторожностью в связи с потенцированием антиагрегантного действия препаратов

ЭТ: циторедуктивная терапия • Цель – поддержание Тр <400 x 109/л.

Терапия: Гидроксимочевина • Препарат выбора для быстрого снижения уровня тромбоцитов • Механизм действия: специфическое угнетение фермента синтеза ДНК. Обладает миелосупрессивным действием • Хорошо переносится • Начальная доза: 15 мг/кг per os • Начало действия: 3 -5 дней • Побочные действия: – Гранулоцитопения, анемия – Лихорадка н/я этиологии в начале терапии – Атрофия кожи и подкожных тканей, изъязвления кожи и слизистых, алопеция, гиперпигментация, кожная сыпь, тошнота, рвота • ↑ частота вторичных новообразований - ? ? ?

Гидроксимочевина: рекомендации • Первая линия миелосупрессивной терапии при ЭТ • В связи с возможным потенцированием ГМ лейкемической трансформации, следует ограничить применение ГМ среди пациентов младше 60 лет

Терапия: Анагрелид • Производное имидазоквиназолина • Механизм действия: блокирует пролиферацию и созревание МГЦ, оказывает антиагрегантное действие через ингибирование фосфодиэстеразы тромбоцитов. Не повреждает синтез ДНК, т. е. не является цитостатиком и не угнетает другие ростки кроветворения • Начальная дозировка: 0. 5 мг х 3 -4 р/д per os • Побочные действия: цефалгии, тахикардия, задержка жидкости, диарея • Может потенцировать серьезные кровотечения применении совместно с аспирином

Анагрелид: рекомендации • Для молодых пациентов, когда длительное использование ГМ вызывает опасение • При непереносимости ГМ – при нормальной функции сердца.

Терапия: Интерферон-α • Механизм действия: подавление мегакариоцитопоэза – Индукция супрессора сигналов цитокинов (SOCS-1); ингибирование действия тромбопоэтина на предшественников МГЦ, устраняет признаки активации тромбоцитов( исходно повышенное содержание в плазме крови втромбоглобулина) • Нет исследований, сравнивающих ИФ-α с анагрелидом или гидроксимочевиной • Множество исследований, показывающих до 32%-85% уменьшения размеров селезенки • Побочные действия: гриппоподобный синдром, тошнота, диарея, миалгия, депрессия, усталость, гипертриглицеридемия – Случаются практически у всех пациентов при начале терапии, но потом, как правило, уходят. • ↑ Риск развития аутоиммунных заболеваний: тиреоидит, артриты, ишемическая нейропатия зрительного нерва • Не обладает тератогенным и лейкомогенным эффектом

Интерферон-α: рекомендации • ИФ-α безопасен при ЭТ и может применяться для молодых пациентов, когда длительное применение ГМ вызывает опасения и при непереносимости ГМ • При необходимости циторедуктивной терапии, ИФ-α является препаратом выбора, во время беременности и подготовки к ней.

Терапия: Бусульфан • Рандомизированных исследований среди пациентов с ЭТ не проводилось. • Не рандомизированные исследования докладывают хорошие и продолжительные ответы со стороны Тр. • Предположительно, алкилирующие агенты могут стимулировать трансформацию в ОМЛ • Режим дозирования обычно – 4 -6 мг/сут до получения ответа (2 -6 нед. ) Рекомендации: • Применяется для пациентов старше 75 лет и при неэффективности / непереносимости ГМ, ИФ и анагрелида.
ХМПЗ студенты 2013.pptx