презентация хроматография 1.pptx
- Количество слайдов: 46
 Хроматографические методы анализа. (Хроматография)
Хроматографические методы анализа. (Хроматография)
 Цель: Рассмотреть один из методов разделения и концентрирования веществ – хроматографию. План: 1. Сущность хроматографического метода 2. Классификация методов хроматографии 3. Адсорбционная хроматография. 4. Осадочная хроматография 5. Распределительная хроматография. 6. Тонкослойная хроматография. Техника эксперимента в ТСХ 7. Бумажная хроматография (хроматография на бумаге) 8. Газоадсорбционная и газожидкостная хроматография
Цель: Рассмотреть один из методов разделения и концентрирования веществ – хроматографию. План: 1. Сущность хроматографического метода 2. Классификация методов хроматографии 3. Адсорбционная хроматография. 4. Осадочная хроматография 5. Распределительная хроматография. 6. Тонкослойная хроматография. Техника эксперимента в ТСХ 7. Бумажная хроматография (хроматография на бумаге) 8. Газоадсорбционная и газожидкостная хроматография
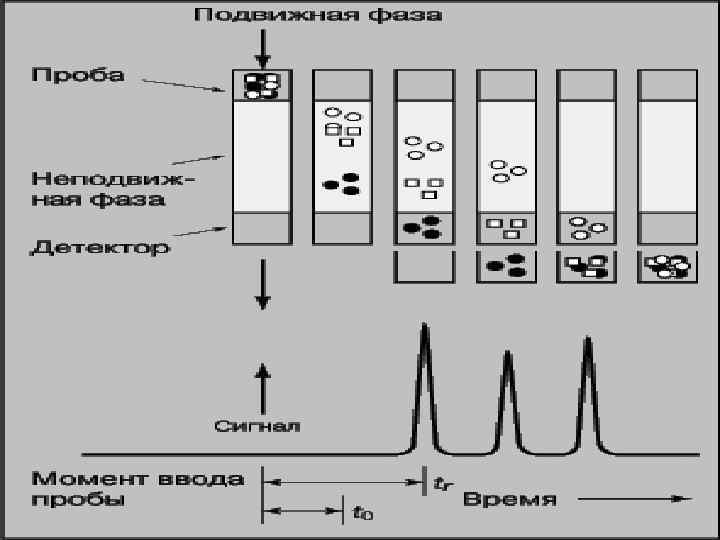
 Хроматографией называется процесс, основанный на перемещении дискретной зоны вещества вдоль слоя сорбента в потоке подвижной фазы и связанный с многократным повторением сорбционных и десорбционных актов. (от греч. «хроматос» - цвет). Хроматографический процесс осуществляется при сорбционном распределении вещества между двумя фазами, одна из которых перемещается относительно другой.
Хроматографией называется процесс, основанный на перемещении дискретной зоны вещества вдоль слоя сорбента в потоке подвижной фазы и связанный с многократным повторением сорбционных и десорбционных актов. (от греч. «хроматос» - цвет). Хроматографический процесс осуществляется при сорбционном распределении вещества между двумя фазами, одна из которых перемещается относительно другой.
 Хроматография – физико-химический метод разделения сложных смесей, основанный на использовании различных сорбционных процессов в динамических условиях. При анализе происходит разделение веществ между двумя фазами, одна из которых неподвижная (стационарная), а другая – подвижная. Подвижной фазой является сама анализируемая смесь (раствор или смесь газов), неподвижной – сорбент, взаимодействующий с компонентами смеси, или носитель, на который нанесены вещества, способствующие разделению. Разделение наблюдается в том случае, если стационарная фаза проявляет различную сорбционную способность по отношению к компонентам определяемой смеси. Разная степень сорбции этих компонентов влияет на скорость их передвижения относительно неподвижной фазы и приводит к их пространственному разделению.
Хроматография – физико-химический метод разделения сложных смесей, основанный на использовании различных сорбционных процессов в динамических условиях. При анализе происходит разделение веществ между двумя фазами, одна из которых неподвижная (стационарная), а другая – подвижная. Подвижной фазой является сама анализируемая смесь (раствор или смесь газов), неподвижной – сорбент, взаимодействующий с компонентами смеси, или носитель, на который нанесены вещества, способствующие разделению. Разделение наблюдается в том случае, если стационарная фаза проявляет различную сорбционную способность по отношению к компонентам определяемой смеси. Разная степень сорбции этих компонентов влияет на скорость их передвижения относительно неподвижной фазы и приводит к их пространственному разделению.
 ХРОМАТОГРАФИЯ - это метод разделения, анализа и физ. -хим. исследования в-в, основаный на распределении исследуемого в-ва между двумя фазами - неподвижной и подвижной (элюент). Подвижную фазу, вводимую в слой неподвижной фазы, называют элюентом, а подвижную фазу, выходящую из колонки и содержащую разделенные компоненты, - элюатом.
ХРОМАТОГРАФИЯ - это метод разделения, анализа и физ. -хим. исследования в-в, основаный на распределении исследуемого в-ва между двумя фазами - неподвижной и подвижной (элюент). Подвижную фазу, вводимую в слой неподвижной фазы, называют элюентом, а подвижную фазу, выходящую из колонки и содержащую разделенные компоненты, - элюатом.
 Принцип хроматографии, впервые разработан в 1903 г. русским ученым М. С. Цветом, и был основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
Принцип хроматографии, впервые разработан в 1903 г. русским ученым М. С. Цветом, и был основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
 2. Классификация методов хроматографии: К основным признакам классификации относятся: 1) агрегатное состояние фаз; 2) природа элементарного акта; 3) способ относительного перемещения фаз; 4) способ аппаратурного оформления процесса; 5) цель осуществления процесса.
2. Классификация методов хроматографии: К основным признакам классификации относятся: 1) агрегатное состояние фаз; 2) природа элементарного акта; 3) способ относительного перемещения фаз; 4) способ аппаратурного оформления процесса; 5) цель осуществления процесса.
 По характеру взаимодействия разделяемых веществ с неподвижной фазой различают - адсорбционную, осадочную, распределительную и ионообменную хроматографию. По способу проведения процесса – колоночную, бумажную и тонкослойную хроматографию. По агрегатному состоянию анализируемой смеси – жидкую и газовую хроматографию.
По характеру взаимодействия разделяемых веществ с неподвижной фазой различают - адсорбционную, осадочную, распределительную и ионообменную хроматографию. По способу проведения процесса – колоночную, бумажную и тонкослойную хроматографию. По агрегатному состоянию анализируемой смеси – жидкую и газовую хроматографию.
 По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессов.
По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессов.
 3. Адсорбционная хроматография основана на избирательной адсорбции молекул. При выполнении анализа исследуемый раствор пропускают через хроматографическую колонку, заполненную адсорбентом (алюмогель Al 2 O 3, силикагель Si. O 2, H 2 Si. O 3 и др. ). Компоненты смеси поглощаются адсорбентом и располагаются послойно по всей длине колонки в соответствии с сорбционной способностью каждого компонента, происходит разделение смеси. Для более полного разделения через колонку пропускают растворитель.
3. Адсорбционная хроматография основана на избирательной адсорбции молекул. При выполнении анализа исследуемый раствор пропускают через хроматографическую колонку, заполненную адсорбентом (алюмогель Al 2 O 3, силикагель Si. O 2, H 2 Si. O 3 и др. ). Компоненты смеси поглощаются адсорбентом и располагаются послойно по всей длине колонки в соответствии с сорбционной способностью каждого компонента, происходит разделение смеси. Для более полного разделения через колонку пропускают растворитель.
 В результате в колонке получают хроматограмму, на которой каждому компоненту соответствует определенная зона, расположенная тем ближе к началу колонки, чем больше сорбционная способность компонента. Хроматограмма или отдельные зоны окрашены, если окрашены компоненты. Если компоненты бесцветны, хроматограмму проявляют, обрабатывая соответствующими реактивами (рис. 1).
В результате в колонке получают хроматограмму, на которой каждому компоненту соответствует определенная зона, расположенная тем ближе к началу колонки, чем больше сорбционная способность компонента. Хроматограмма или отдельные зоны окрашены, если окрашены компоненты. Если компоненты бесцветны, хроматограмму проявляют, обрабатывая соответствующими реактивами (рис. 1).
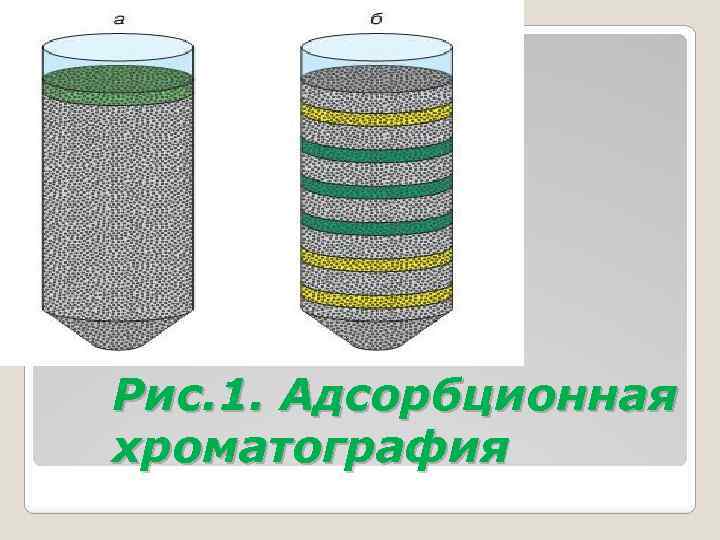 Рис. 1. Адсорбционная хроматография
Рис. 1. Адсорбционная хроматография
 4. Осадочная хроматография основана на различной растворимости малорастворимых соединений. Для выполнения анализа колонку заполняют «носителем» алюмогелью, который смешивают или пропитывают осадителем, способным образовывать осадки с ионами анализируемой смеси. На получаемой хроматограмме осадки располагаются в определенной последовательности, соответствующей увеличению их растворимости в направлении сверху вниз. Если осадки бесцветны или слабо окрашены, хроматограмму проявляют.
4. Осадочная хроматография основана на различной растворимости малорастворимых соединений. Для выполнения анализа колонку заполняют «носителем» алюмогелью, который смешивают или пропитывают осадителем, способным образовывать осадки с ионами анализируемой смеси. На получаемой хроматограмме осадки располагаются в определенной последовательности, соответствующей увеличению их растворимости в направлении сверху вниз. Если осадки бесцветны или слабо окрашены, хроматограмму проявляют.
 различают колоночную осадочную хроматогра фию, проводимую в хроматографических колонках, и плоскостную оса дочную хроматографию, реализуемую на бумаге или в тонком слое сор бента. В качестве сорбентов в осадочной хроматографии применяют смеси инертных носителей с осадителем; сорбенты, удерживающие осадители в виде ионов (ионообменные смолы) или в виде молекул (активированный уголь); бумагу, пропитанную раствором осадителя. Носителями чаще всего выбирают силикагелъ, крахмал, оксиды алюминия, кальция, сульфат бария, ионообменные смолы и т. д. Носи тель используется в тонкодисперсном состоянии с размерами частиц око ло 0, 02 0, 10 мм. ◦ В качестве осадителей применяют такие реагенты, которые образую малорастворимые осадки с хроматографируемыми ионами, например, иодид натрия Na. I, сульфид натрия Na 2 S, сульфат серебра Ag 2 SО 4, ферро цианид калия К 4[Fe(CN)6 l, оксихинолин, пиридин и т. д.
различают колоночную осадочную хроматогра фию, проводимую в хроматографических колонках, и плоскостную оса дочную хроматографию, реализуемую на бумаге или в тонком слое сор бента. В качестве сорбентов в осадочной хроматографии применяют смеси инертных носителей с осадителем; сорбенты, удерживающие осадители в виде ионов (ионообменные смолы) или в виде молекул (активированный уголь); бумагу, пропитанную раствором осадителя. Носителями чаще всего выбирают силикагелъ, крахмал, оксиды алюминия, кальция, сульфат бария, ионообменные смолы и т. д. Носи тель используется в тонкодисперсном состоянии с размерами частиц око ло 0, 02 0, 10 мм. ◦ В качестве осадителей применяют такие реагенты, которые образую малорастворимые осадки с хроматографируемыми ионами, например, иодид натрия Na. I, сульфид натрия Na 2 S, сульфат серебра Ag 2 SО 4, ферро цианид калия К 4[Fe(CN)6 l, оксихинолин, пиридин и т. д.
 Осадочная хроматография на бумаге. Рассмотрим сущность этого метода на примере анализа водного раствора, содержащего смесь катио нов меди Сu 2+, железа Fe 3+ и алюминия Al 3+. В центр листа бумаги, пропитанной раствором осадителя ферро цианида калия К 4[Fe(CN)6 l, капилляром наносится анализируемый вод ный аствор. Ионы меди Сu 2+ и железа р Fe 2+ взаимодействуют с ферро цианид ионами с образованием малорастворимых осадков: 2 Сu 2+ + [Fe(CN)6]4 → Cu 2[Fe(CN)6] (коричневый) 4 Fe 3+ + 3[Fe(CN)6]4 → Fe 4[Fe(CN)6] (синий)
Осадочная хроматография на бумаге. Рассмотрим сущность этого метода на примере анализа водного раствора, содержащего смесь катио нов меди Сu 2+, железа Fe 3+ и алюминия Al 3+. В центр листа бумаги, пропитанной раствором осадителя ферро цианида калия К 4[Fe(CN)6 l, капилляром наносится анализируемый вод ный аствор. Ионы меди Сu 2+ и железа р Fe 2+ взаимодействуют с ферро цианид ионами с образованием малорастворимых осадков: 2 Сu 2+ + [Fe(CN)6]4 → Cu 2[Fe(CN)6] (коричневый) 4 Fe 3+ + 3[Fe(CN)6]4 → Fe 4[Fe(CN)6] (синий)
 Поскольку ферроцианид меди(II) менее растворим, чем ферроцианид железа(III), то вначале выделяется осадок ферроцианида меди(II), обра зующий центральную коричневую зону (рис. 2). Затем образуется синий осадок ферро цианида железа(III), дающий синюю зону. Ионы алюминия перемещаются на пери ферию, давая бесцветную зону, поскольку они не образуют окрашенного ферроцианида алюминия. Рис. 2. Схема разделения Сu 2+, Fe 2+ и Аl 3+ методом осадочной хроматографии
Поскольку ферроцианид меди(II) менее растворим, чем ферроцианид железа(III), то вначале выделяется осадок ферроцианида меди(II), обра зующий центральную коричневую зону (рис. 2). Затем образуется синий осадок ферро цианида железа(III), дающий синюю зону. Ионы алюминия перемещаются на пери ферию, давая бесцветную зону, поскольку они не образуют окрашенного ферроцианида алюминия. Рис. 2. Схема разделения Сu 2+, Fe 2+ и Аl 3+ методом осадочной хроматографии
 5. Распределительная хроматография основана на явлении распределения компонентов анализируемой смеси между двумя несмешивающимися жидкостями. Адсорбент-носитель, которым заполнена колонка, пропитывается растворителем (неподвижная жидкая фаза) и через колонку пропускается анализируемый раствор. Затем через колонку очень медленно пропускают растворитель (подвижная жидкая фаза), не смешивающийся с первым. В качестве неподвижных растворителей используют воду и другие полярные растворители. Неподвижную фазу наносят на гидрофильные носители: целлюлозу, силикагель, ионообменные смолы.
5. Распределительная хроматография основана на явлении распределения компонентов анализируемой смеси между двумя несмешивающимися жидкостями. Адсорбент-носитель, которым заполнена колонка, пропитывается растворителем (неподвижная жидкая фаза) и через колонку пропускается анализируемый раствор. Затем через колонку очень медленно пропускают растворитель (подвижная жидкая фаза), не смешивающийся с первым. В качестве неподвижных растворителей используют воду и другие полярные растворители. Неподвижную фазу наносят на гидрофильные носители: целлюлозу, силикагель, ионообменные смолы.
 Подвижные растворителями являются неполярные органические жидкости. Происходит перераспределение отдельных компонентов смеси между растворителями в соответствии с коэффициентом распределения каждого компонента. Чем больше коэффициент распределения, тем выше скорость движения компонента, поэтому в колонке образуются зоны отдельных веществ, постепенно проходящих в фильтрат. Экстракционная хроматография – один из методов распределительной хроматографии, где неподвижной фазой служат самые разнообразные органические растворители, а подвижной фазой является водный раствор.
Подвижные растворителями являются неполярные органические жидкости. Происходит перераспределение отдельных компонентов смеси между растворителями в соответствии с коэффициентом распределения каждого компонента. Чем больше коэффициент распределения, тем выше скорость движения компонента, поэтому в колонке образуются зоны отдельных веществ, постепенно проходящих в фильтрат. Экстракционная хроматография – один из методов распределительной хроматографии, где неподвижной фазой служат самые разнообразные органические растворители, а подвижной фазой является водный раствор.
 Ионообменная хроматография основана на свойстве ионов некоторых веществ, называемых ионитами или ионообменниками, вступать в обменные реакции с ионами анализируемого раствора. В анализе используют неорганические иониты. По характеру обменивающихся ионов различают катиониты и аниониты. Катиониты содержат закрепленные на матрице фиксированные группы и способные к обмену катионы (противоионы). Ионный обмен – обратимый процесс, подчиняющийся закону эквивалентов. Сущность катионного обмена можно выразить уравнением (на примере однозарядного катиона М+): RH + M+ ↔ RM + H+ ионит раствор При пропускании анализируемого раствора через слой катионита происходит обмен Н+ катионита на катионы используемого М+ вещества.
Ионообменная хроматография основана на свойстве ионов некоторых веществ, называемых ионитами или ионообменниками, вступать в обменные реакции с ионами анализируемого раствора. В анализе используют неорганические иониты. По характеру обменивающихся ионов различают катиониты и аниониты. Катиониты содержат закрепленные на матрице фиксированные группы и способные к обмену катионы (противоионы). Ионный обмен – обратимый процесс, подчиняющийся закону эквивалентов. Сущность катионного обмена можно выразить уравнением (на примере однозарядного катиона М+): RH + M+ ↔ RM + H+ ионит раствор При пропускании анализируемого раствора через слой катионита происходит обмен Н+ катионита на катионы используемого М+ вещества.
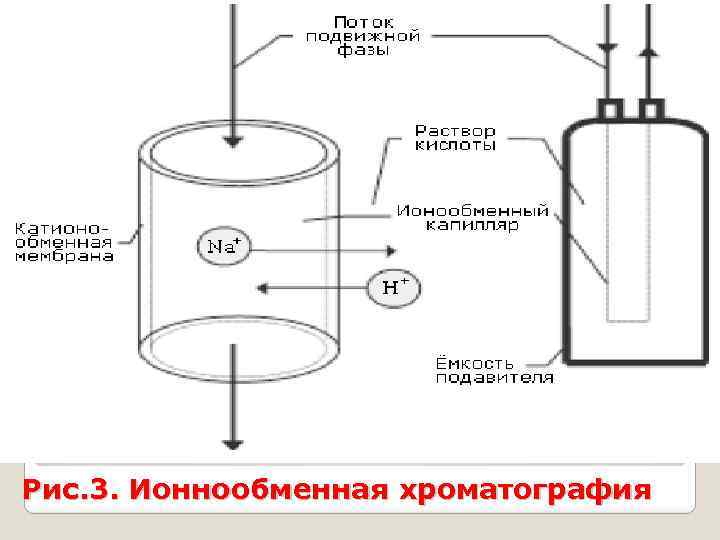 Рис. 3. Ионнообменная хроматография
Рис. 3. Ионнообменная хроматография
 Колоночная хроматография. Все рассмотренные виды хроматографии выполняют обычно в колоночном варианте, пропуская разделяемую смесь через хроматографическую колонку, заполненную адсорбентом, ионитом, осадителем или носителем с удерживаемой жидкой фазой. Рис. 4. Схема разделения ионов Сl , Br и I в хроматографической колонке методом оса дочной роматографии (первичная осадочная хроматограмма) х
Колоночная хроматография. Все рассмотренные виды хроматографии выполняют обычно в колоночном варианте, пропуская разделяемую смесь через хроматографическую колонку, заполненную адсорбентом, ионитом, осадителем или носителем с удерживаемой жидкой фазой. Рис. 4. Схема разделения ионов Сl , Br и I в хроматографической колонке методом оса дочной роматографии (первичная осадочная хроматограмма) х
 7. Бумажная хроматография является вариантом распределительной хроматографии, отличающаяся предельной доступностью и простотой выполнения, возможностью разделять микроколичества компонентов сложных смесей. В качестве носителя используют фильтровальную бумагу, очищенную от примесей, хроматографическую бумагу разных марок. Из за большой гигроскопичности ее волокна покрыты тонким слоем влаги, которая представляет собой неподвижную жидкую фазу. Техника выполнения бумажной хроматографии состоит в том, что на расстоянии 2 3 см от края бумажной полоски (стартовая линия) наносят каплю исследуемого раствора и после высыхания капли подвешивают эту полоску в стеклянную закрытую камеру.
7. Бумажная хроматография является вариантом распределительной хроматографии, отличающаяся предельной доступностью и простотой выполнения, возможностью разделять микроколичества компонентов сложных смесей. В качестве носителя используют фильтровальную бумагу, очищенную от примесей, хроматографическую бумагу разных марок. Из за большой гигроскопичности ее волокна покрыты тонким слоем влаги, которая представляет собой неподвижную жидкую фазу. Техника выполнения бумажной хроматографии состоит в том, что на расстоянии 2 3 см от края бумажной полоски (стартовая линия) наносят каплю исследуемого раствора и после высыхания капли подвешивают эту полоску в стеклянную закрытую камеру.
 Конец полоски хроматографической бумаги опускают на 0, 5 см в слой органического растворителя ниже стартовой линии, которая играет роль подвижной фазы. Подвижный растворитель, перемещаясь вверх по бумаге, увлекает за собой отдельные компоненты анализируемой смеси, каждый из которых перемещается с определенной скоростью. Через некоторое время (от нескольких часов до суток) полученную хроматограмму вынимают из камеры, высушивают и «проявляют» . Наличие тех или иных компонентов устанавливают по соответствующей окраске зон.
Конец полоски хроматографической бумаги опускают на 0, 5 см в слой органического растворителя ниже стартовой линии, которая играет роль подвижной фазы. Подвижный растворитель, перемещаясь вверх по бумаге, увлекает за собой отдельные компоненты анализируемой смеси, каждый из которых перемещается с определенной скоростью. Через некоторое время (от нескольких часов до суток) полученную хроматограмму вынимают из камеры, высушивают и «проявляют» . Наличие тех или иных компонентов устанавливают по соответствующей окраске зон.
 6. Метод тонкослойной хроматографии (ТСХ) заключается в следующем. На небольшую стеклянную пластинку наносят тонкий слой твердого сорбента носителя. На стартовую линию этого слоя (как и в бумажной хроматографии) помещают пробу. Край пластинки погружают в систему растворителей так, чтобы линия старта была несколько выше уровня растворителя. Отметив границу подъема жидкости, пластинку сушат и проявляют. На хроматограмме фиксируют зоны отдельных компонентов. Хроматограммы в тонком слое сорбента получают либо в закрепленном слое носителя, либо в незакрепленном. В качестве сорбентов чаще всего применяют диоксид кремния силикагель Si. О 2 и оксид алюминия Al 2 О 3, а также некоторые другие ма териалы (активированный уголь, сахарозу, карбонат кальция, целлюлозу, тальк, полиамидныe смолы и т. д. ).
6. Метод тонкослойной хроматографии (ТСХ) заключается в следующем. На небольшую стеклянную пластинку наносят тонкий слой твердого сорбента носителя. На стартовую линию этого слоя (как и в бумажной хроматографии) помещают пробу. Край пластинки погружают в систему растворителей так, чтобы линия старта была несколько выше уровня растворителя. Отметив границу подъема жидкости, пластинку сушат и проявляют. На хроматограмме фиксируют зоны отдельных компонентов. Хроматограммы в тонком слое сорбента получают либо в закрепленном слое носителя, либо в незакрепленном. В качестве сорбентов чаще всего применяют диоксид кремния силикагель Si. О 2 и оксид алюминия Al 2 О 3, а также некоторые другие ма териалы (активированный уголь, сахарозу, карбонат кальция, целлюлозу, тальк, полиамидныe смолы и т. д. ).
 Силикагель Si. О 2, применяемый в методе ТСХ, обладает довольно большой удельной поверхностью (до 500 м 2/г). Полагают, что активны ми центрами на поверхности частиц силикагеля являются группы Si ОH. Молекулы воды могут блокировать эти центры, дезактивируя их. Для приготовления хроматографической пластинки с тонким слоем из силикагеля порошкообразный сорбент (с добавкой гипса или крахмала в качестве закрепителей, а также других, например, флуоресциирующих веществ) суспендируют в воде или в водном этаноле, суспензию наносят в виде тонкого слоя (~0, 3 мм) на строго горизонтальную поверхность пластинки и высушивают. Обычно такой тонкий слой сорбента хорошо закрепляется на поверхности пластинки. Оксид алюмuнuя Al 2 О 3 также находит универсальное применение в качестве сорбента. Его активность сильно зависит от количества погло щенной влаги. Степень активности оксида алюминия оценивают по шка ле Брокмана: Шкала Брокмана Степень активности Al 2 О 3 I II IV V Содержание воды, % (по массе) 0 3 6 10 15
Силикагель Si. О 2, применяемый в методе ТСХ, обладает довольно большой удельной поверхностью (до 500 м 2/г). Полагают, что активны ми центрами на поверхности частиц силикагеля являются группы Si ОH. Молекулы воды могут блокировать эти центры, дезактивируя их. Для приготовления хроматографической пластинки с тонким слоем из силикагеля порошкообразный сорбент (с добавкой гипса или крахмала в качестве закрепителей, а также других, например, флуоресциирующих веществ) суспендируют в воде или в водном этаноле, суспензию наносят в виде тонкого слоя (~0, 3 мм) на строго горизонтальную поверхность пластинки и высушивают. Обычно такой тонкий слой сорбента хорошо закрепляется на поверхности пластинки. Оксид алюмuнuя Al 2 О 3 также находит универсальное применение в качестве сорбента. Его активность сильно зависит от количества погло щенной влаги. Степень активности оксида алюминия оценивают по шка ле Брокмана: Шкала Брокмана Степень активности Al 2 О 3 I II IV V Содержание воды, % (по массе) 0 3 6 10 15
 Рис. 5.
Рис. 5.
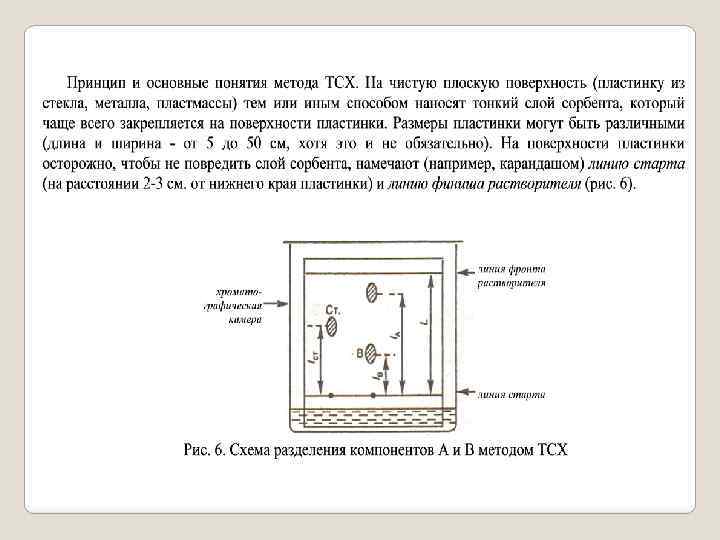
 На линию старта пластинки наносят (микрошприцом, капилляром) пробу небольшое количество жидкости, содержащей смесь разделяе мых веществ, например, двух веществ А и В в подходящем растворителе (рис. 6) Дают возможность испариться растворителю, после чего пластинку погружают в хроматографической камере в жидкую фазу ПФ, представляющую собой специально подобранный для данного случая растворитель или смесь растворителей. Под действием капиллярных сил ПФ самопроизвольно перемещается вдоль НФ от стартовой линии до линии фронта растворителя, увлекая с собой компоненты А и В пробы которые перемещаются с различной скоростью.
На линию старта пластинки наносят (микрошприцом, капилляром) пробу небольшое количество жидкости, содержащей смесь разделяе мых веществ, например, двух веществ А и В в подходящем растворителе (рис. 6) Дают возможность испариться растворителю, после чего пластинку погружают в хроматографической камере в жидкую фазу ПФ, представляющую собой специально подобранный для данного случая растворитель или смесь растворителей. Под действием капиллярных сил ПФ самопроизвольно перемещается вдоль НФ от стартовой линии до линии фронта растворителя, увлекая с собой компоненты А и В пробы которые перемещаются с различной скоростью.
 В рассматриваемом слу чае родство компонента А к НФ с меньше сродства к той же фазе компо нента В, поэтому компонент А перемещается быстрее компонента В. По сле достижения за время t подвижной фазой (растворителем) линии фронта растворителя хроматографирование прерывают, пластинку извле кают из хроматографической камеры, высушивают на воздухе и опреде ляют положение пятен веществ А и В на поверхности пластинки. Пятна (зоны) обычно имеют овальную или круглую форму. В рассматриваемом случае пятно компонента А переместилось от линии старта на расстояние l. А, пятно компонента В на расстояние lв, а растворитель прошел рас стояние. L. Иногда одновременно с нанесением пробы разделяемых веществ на линию старта наносят небольшие количества вещества стандарта, а так же веществ свидетелей (тех, которые предположительно содержатся в анализируемой пробе).
В рассматриваемом слу чае родство компонента А к НФ с меньше сродства к той же фазе компо нента В, поэтому компонент А перемещается быстрее компонента В. По сле достижения за время t подвижной фазой (растворителем) линии фронта растворителя хроматографирование прерывают, пластинку извле кают из хроматографической камеры, высушивают на воздухе и опреде ляют положение пятен веществ А и В на поверхности пластинки. Пятна (зоны) обычно имеют овальную или круглую форму. В рассматриваемом случае пятно компонента А переместилось от линии старта на расстояние l. А, пятно компонента В на расстояние lв, а растворитель прошел рас стояние. L. Иногда одновременно с нанесением пробы разделяемых веществ на линию старта наносят небольшие количества вещества стандарта, а так же веществ свидетелей (тех, которые предположительно содержатся в анализируемой пробе).
 Для характеристики разделяемых компонентов в системе вводят ко эффициент подвижности R (или Rf фактор): f Rf =V i /VE = (l I / t)/(L/ t)= l I / L, (1) где V i = l I / t и VE = L / t соответственно скорости перемещения i гo компонента и растворителя Е; l. I и L путь, пройденный i м компонен том и растворителем соответственно; t время, необходимое для пере мещения растворителя от линии старта до линии фронта растворителя. Расстояния l. I отсчитывают от линии старта до центра пятна, соответст вующего компонента. Обычно коэффициент подвижности лежит в пределах Rf = 0 1. Оп тимальное значение составляет 0, 3 -0, 7. Условия xpoматографирования подбирают так, чтобы величина Rf отличалась от нуля и единицы. Коэффициент подвижности является важной характеристикой сис темы сорбент сорбат. Для воспроизводимых и строго постоянных усло вий хроматографирования f= соnst. R
Для характеристики разделяемых компонентов в системе вводят ко эффициент подвижности R (или Rf фактор): f Rf =V i /VE = (l I / t)/(L/ t)= l I / L, (1) где V i = l I / t и VE = L / t соответственно скорости перемещения i гo компонента и растворителя Е; l. I и L путь, пройденный i м компонен том и растворителем соответственно; t время, необходимое для пере мещения растворителя от линии старта до линии фронта растворителя. Расстояния l. I отсчитывают от линии старта до центра пятна, соответст вующего компонента. Обычно коэффициент подвижности лежит в пределах Rf = 0 1. Оп тимальное значение составляет 0, 3 -0, 7. Условия xpoматографирования подбирают так, чтобы величина Rf отличалась от нуля и единицы. Коэффициент подвижности является важной характеристикой сис темы сорбент сорбат. Для воспроизводимых и строго постоянных усло вий хроматографирования f= соnst. R
 Коэффициент подвижности Rf зависит от целого ряда факторов: природы и качества растворителя, его чистоты; природы и качества сор бента(тонкого слоя), равномерности его зернения, толщины слоя; актив ности сорбента (содержания в нем влаги); техники эксперимента (массы образца, длины L пробега растворителя); навыка экспериментатора и т. д. Постоянство воспроизведения всех этих параметров на практике иногда бывает затруднительным. Для нивелирования влияния условий проведе ния процесса вводят относительный коэффициент подвижности Rs: Rs = l / lст = Rf / Rf(ст) ( 2) где Rf = l / L; Rs = lст / L; l(ст) расстояние от линии старта до центра пятна стандарта (см. рис. 6). Относительный коэффициент подвижности Rs является более объек тивной характеристикой подвижности вещества, чем коэффициент под вижности f R
Коэффициент подвижности Rf зависит от целого ряда факторов: природы и качества растворителя, его чистоты; природы и качества сор бента(тонкого слоя), равномерности его зернения, толщины слоя; актив ности сорбента (содержания в нем влаги); техники эксперимента (массы образца, длины L пробега растворителя); навыка экспериментатора и т. д. Постоянство воспроизведения всех этих параметров на практике иногда бывает затруднительным. Для нивелирования влияния условий проведе ния процесса вводят относительный коэффициент подвижности Rs: Rs = l / lст = Rf / Rf(ст) ( 2) где Rf = l / L; Rs = lст / L; l(ст) расстояние от линии старта до центра пятна стандарта (см. рис. 6). Относительный коэффициент подвижности Rs является более объек тивной характеристикой подвижности вещества, чем коэффициент под вижности f R
 В качестве стандарта часто выбирают такое вещество, для которого в данных условиях Rf ~ 0, 5. По химической природе стандарт выбирается близким к разделяемым веществам. С применением стандарта величи на Rs обычно лежит в пределах Rs = 0, 1 10, оптимальные пределы около 0, 5 2. Для более надежной идентификации разделяемых компонентов ис пользуют «свидетели» эталонные вещества, наличие которых предпо лагается анализируемой пробе. Если Rf = Rf (свид), где Rf и Rf в (свид) соответственно коэффициенты подвижности данного компонента и сви детеля, то можно с большой вероятностью предположить, что вещество свидетель присутствует в хроматографируемой смеси. Для характеристики разделения двух компонентов А и В в данных условиях вводят степень (критерий) разделения R(A/В): R(A/B) = ∆l/[а(А)/2+ а(В)/2)] = 2∆l/[а(А)+ а(В)], (3) где ∆l расстояние между центрами пятен компонентов А и В; а(А) и а(В) соответственно диаметры пятен А и В на хроматограмме (рис. 3).
В качестве стандарта часто выбирают такое вещество, для которого в данных условиях Rf ~ 0, 5. По химической природе стандарт выбирается близким к разделяемым веществам. С применением стандарта величи на Rs обычно лежит в пределах Rs = 0, 1 10, оптимальные пределы около 0, 5 2. Для более надежной идентификации разделяемых компонентов ис пользуют «свидетели» эталонные вещества, наличие которых предпо лагается анализируемой пробе. Если Rf = Rf (свид), где Rf и Rf в (свид) соответственно коэффициенты подвижности данного компонента и сви детеля, то можно с большой вероятностью предположить, что вещество свидетель присутствует в хроматографируемой смеси. Для характеристики разделения двух компонентов А и В в данных условиях вводят степень (критерий) разделения R(A/В): R(A/B) = ∆l/[а(А)/2+ а(В)/2)] = 2∆l/[а(А)+ а(В)], (3) где ∆l расстояние между центрами пятен компонентов А и В; а(А) и а(В) соответственно диаметры пятен А и В на хроматограмме (рис. 3).

 8. Газоадсорбционная хроматографии и газожидкостная Жидкостная и газовая хроматография. Во всех рассмотренных выше вариантах подвижная фаза жидкость. Это жидкостная хроматография. В газовой хроматографии подвижной фазой является газ. В газоадсорбционной хроматографии в качестве неподвижной фазы используют адсорбент с развитой поверхностью, в газожидкостной – высококипящую жидкость, нанесенную тонкой пленкой толщиной в несколько микрон на твердый носитель.
8. Газоадсорбционная хроматографии и газожидкостная Жидкостная и газовая хроматография. Во всех рассмотренных выше вариантах подвижная фаза жидкость. Это жидкостная хроматография. В газовой хроматографии подвижной фазой является газ. В газоадсорбционной хроматографии в качестве неподвижной фазы используют адсорбент с развитой поверхностью, в газожидкостной – высококипящую жидкость, нанесенную тонкой пленкой толщиной в несколько микрон на твердый носитель.
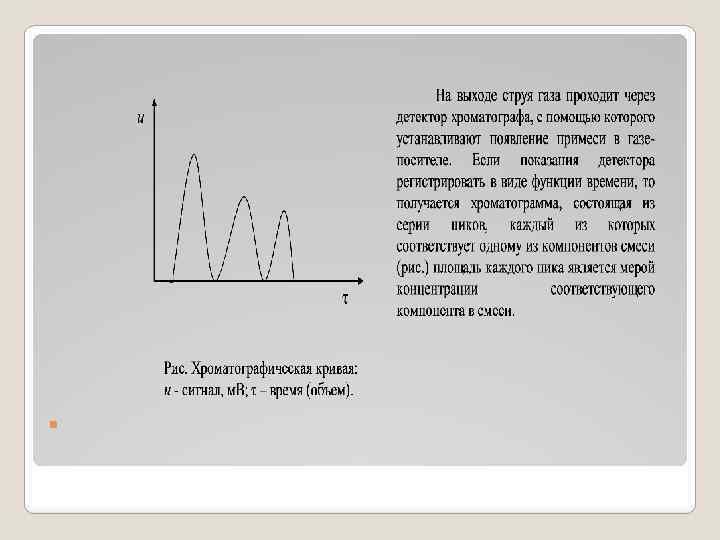
 Анализ проводят в специальных приборах, называемых хроматографами. Анализируемую пробу (жидкость или газ) впрыскивают в камеру хроматографа, в которой поддерживается высокая температура. При этом жидкая проба почти мгновенно испаряется. Анализируемая газообразная проба, увлекаемая газом носителем (Не, Ar, H 2, N 2, CO 2), поступают в колонку хроматографа с постоянной скоростью. Колонка представляет собой длинную, тонкую металлическую трубку U образной или спиральной формы, заполненную соответствующим сорбентом. В колонке поддерживается постоянная температура, чуть выше точки кипения самого высококипящего компонента анализируемой смеси. Отдельные компоненты смеси движутся по высоте колонки с различной скоростью и, следовательно, в разное время появляются на ее выходе.
Анализ проводят в специальных приборах, называемых хроматографами. Анализируемую пробу (жидкость или газ) впрыскивают в камеру хроматографа, в которой поддерживается высокая температура. При этом жидкая проба почти мгновенно испаряется. Анализируемая газообразная проба, увлекаемая газом носителем (Не, Ar, H 2, N 2, CO 2), поступают в колонку хроматографа с постоянной скоростью. Колонка представляет собой длинную, тонкую металлическую трубку U образной или спиральной формы, заполненную соответствующим сорбентом. В колонке поддерживается постоянная температура, чуть выше точки кипения самого высококипящего компонента анализируемой смеси. Отдельные компоненты смеси движутся по высоте колонки с различной скоростью и, следовательно, в разное время появляются на ее выходе.
 .
.
 Хроматограф Цвет-4000 жидкостный Достоинства: - Возможность реализации методов высокоэффективной жидкостной, ион-парной, ионэксклюзивной хроматографии - Универсальность применения - Широкий набор высокочуствительных детекторов - Высокая точность и воспроизводимость анализа - Возможность одновременного анализа анионного и катионного состава - Концентрирование пробы в хроматографе - Разделение многокомпонентных смесей в режиме градиентного элюирования - Ручной и автоматический ввод проб
Хроматограф Цвет-4000 жидкостный Достоинства: - Возможность реализации методов высокоэффективной жидкостной, ион-парной, ионэксклюзивной хроматографии - Универсальность применения - Широкий набор высокочуствительных детекторов - Высокая точность и воспроизводимость анализа - Возможность одновременного анализа анионного и катионного состава - Концентрирование пробы в хроматографе - Разделение многокомпонентных смесей в режиме градиентного элюирования - Ручной и автоматический ввод проб
 Газовый хроматограф . «Кристаллюкс4000 М» - прибор, предназначенны й для анализа состава, структуры и качества жидких и газовых проб в органических и неорганически х соединениях.
Газовый хроматограф . «Кристаллюкс4000 М» - прибор, предназначенны й для анализа состава, структуры и качества жидких и газовых проб в органических и неорганически х соединениях.
 Ионный хроматограф
Ионный хроматограф
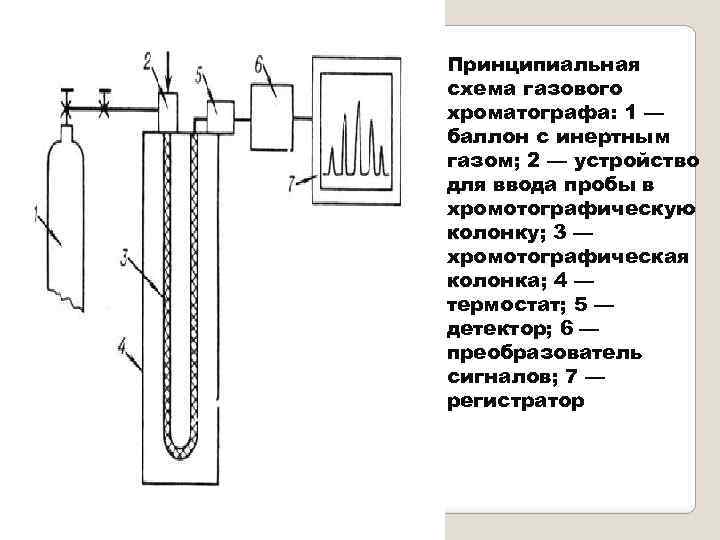 Принципиальная схема газового хроматографа: 1 — баллон с инертным газом; 2 — устройство для ввода пробы в хромотографическую колонку; 3 — хромотографическая колонка; 4 — термостат; 5 — детектор; 6 — преобразователь сигналов; 7 — регистратор
Принципиальная схема газового хроматографа: 1 — баллон с инертным газом; 2 — устройство для ввода пробы в хромотографическую колонку; 3 — хромотографическая колонка; 4 — термостат; 5 — детектор; 6 — преобразователь сигналов; 7 — регистратор
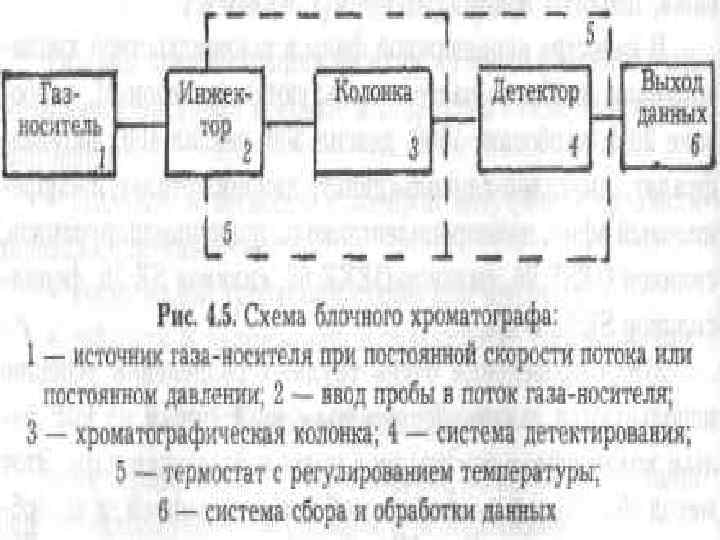
 Комплекс хроматографического оборудования: - Газовый хроматограф; -Автоматический дозатор жидких проб; -Персональный компьютер (станция управления); -Генератор чистого воздуха; -Генератор водорода; -Воздушный компрессор; -Фильтр каталитической очистки; -Генератор азота.
Комплекс хроматографического оборудования: - Газовый хроматограф; -Автоматический дозатор жидких проб; -Персональный компьютер (станция управления); -Генератор чистого воздуха; -Генератор водорода; -Воздушный компрессор; -Фильтр каталитической очистки; -Генератор азота.
 ВЫСОКОЭФФЕКТИВНЫЙ ЖИДКОСТНОЙ ИОНОБЛОЧНЫЙ ХРОМАТОГРАФ VARIAN 920 LC
ВЫСОКОЭФФЕКТИВНЫЙ ЖИДКОСТНОЙ ИОНОБЛОЧНЫЙ ХРОМАТОГРАФ VARIAN 920 LC
 Литература 1) Харитонов Ю. Я. Аналитическая химия (аналитика): М. : ВШ. 2001, 1 т. , гл. 10, § 10. 1 -10. 6 2) Васильев, В. П. Физико-химические методы анализа. , 2007. - 372 с. 3) Гольберт, К. А. Введение в газовую хроматографию [Текст] / К. А. Гольберт, М. С. Вигдергауз. - 3 -е изд. , перераб. и доп. - М. : Химия, 1990. - 352 с. 4) Белявская, Т. А. Хроматография неорганических веществ [Текст] : практ. рук. : учеб. пособие для вузов / Т. А. Белявская, Т. А. Большова, Г. Д. Брыкина. - М. : Высш. шк. , 1986. - 208 с. 5) Киселев А. В. , Яшин Я. И. , Газо-адсорбционная хроматография, М. , 1967 6) www. xumuk. ru/encyklopedia/2/5089. html 7) http: //www. xumuk. ru/biologhim/007. html
Литература 1) Харитонов Ю. Я. Аналитическая химия (аналитика): М. : ВШ. 2001, 1 т. , гл. 10, § 10. 1 -10. 6 2) Васильев, В. П. Физико-химические методы анализа. , 2007. - 372 с. 3) Гольберт, К. А. Введение в газовую хроматографию [Текст] / К. А. Гольберт, М. С. Вигдергауз. - 3 -е изд. , перераб. и доп. - М. : Химия, 1990. - 352 с. 4) Белявская, Т. А. Хроматография неорганических веществ [Текст] : практ. рук. : учеб. пособие для вузов / Т. А. Белявская, Т. А. Большова, Г. Д. Брыкина. - М. : Высш. шк. , 1986. - 208 с. 5) Киселев А. В. , Яшин Я. И. , Газо-адсорбционная хроматография, М. , 1967 6) www. xumuk. ru/encyklopedia/2/5089. html 7) http: //www. xumuk. ru/biologhim/007. html
 Спасибо за внимание!!!
Спасибо за внимание!!!


