Хром.pptx
- Количество слайдов: 17

Хром Химический элемент побочной подгруппы Vl группы периодической системы Д. И. Менделеева.
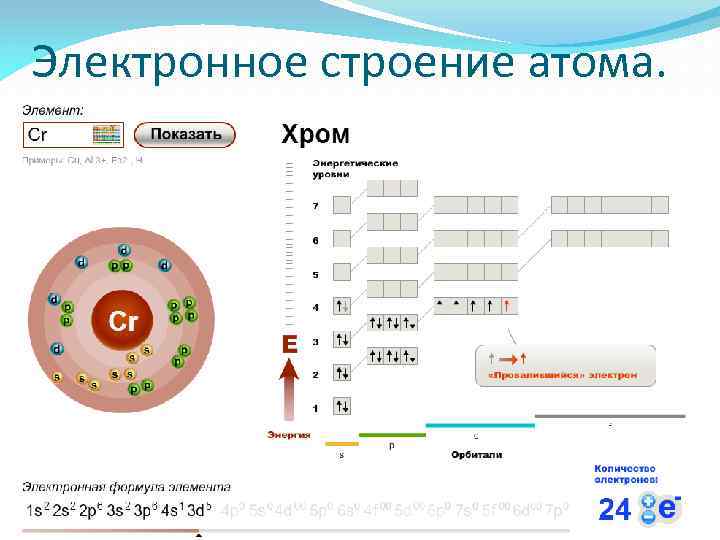
Электронное строение атома.

Физические свойства Хром – довольно тяжелый серебристо-белый тугоплавкий металл, обладающий высокой твердостью. Температура плавления: 1875 °C Незначительные примеси делают металл хрупким.

Получение Основное природное соединение: Fe. Cr 2 O 4 – хромистый железняк. Восстановление углем: Металл, не содержащий железа, получают алюминотермией: Cr 2 O 3 + 2 Al = 2 Cr + Al 2 O 3

Химические свойства. При обычных условиях неактивен, т. к. покрыт оксидной пленкой (Cr 2 O 3). При нагревании реагирует со многими неметаллами. При очень высокой температуре реагирует с водой: 2 Cr+3 H 2 O = Cr 2 O 3+3 H 2↑ Реагирует с разбавленными серной и соляной кислотами: Cr + H 2 SO 4(разб. ) = Cr. SO 4 + H 2↑ Cr + 2 HCl = Cr. Cl 2 + H 2↑ Концентрированные серная и азотная кислоты пассивируют хром.

Применение Хром является незаменимым компонентом легирования сталей. Еще одна важная область применения – хромирование металлов(блестящий вид, защита от коррозии). Хромовые квасцы используются для дубления кожи.

Оксиды и гидроксиды хрома.
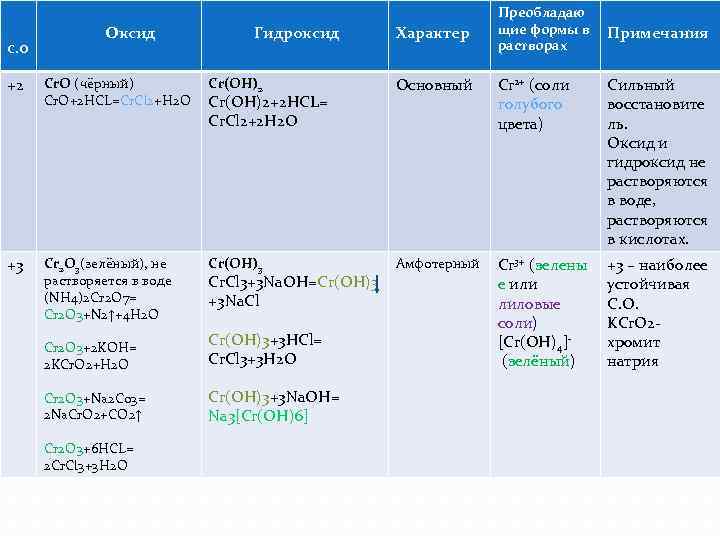
Преобладаю щие формы в Примечания растворах Оксид Гидроксид Характер +2 Cr. O (чёрный) Cr. O+2 HCL=Cr. Cl 2+H 2 O Cr(OH)2 Основный Cr 2+ (соли голубого цвета) Сильный восстановите ль. Оксид и гидроксид не растворяются в воде, растворяются в кислотах. +3 Cr 2 O 3(зелёный), не растворяется в воде (NH 4)2 Cr 2 O 7= Cr 2 O 3+N 2↑+4 H 2 O Cr(OH)3 Амфотерный Cr 3+ (зелены е или лиловые соли) [Cr(OH)4] (зелёный) +3 – наиболее устойчивая С. О. KCr. O 2 хромит натрия С. О Cr(OH)2+2 HCL= Cr. Cl 2+2 H 2 O Cr. Cl 3+3 Na. OH=Cr(OH)3 +3 Na. Cl Cr 2 O 3+2 KOH= 2 KCr. O 2+H 2 O Cr(OH)3+3 HCl= Cr. Cl 3+3 H 2 O Cr 2 O 3+Na 2 Co 3= 2 Na. Cr. O 2+CO 2↑ Cr(OH)3+3 Na. OH= Na 3[Cr(OH)6] Cr 2 O 3+6 HCL= 2 Cr. Cl 3+3 H 2 O
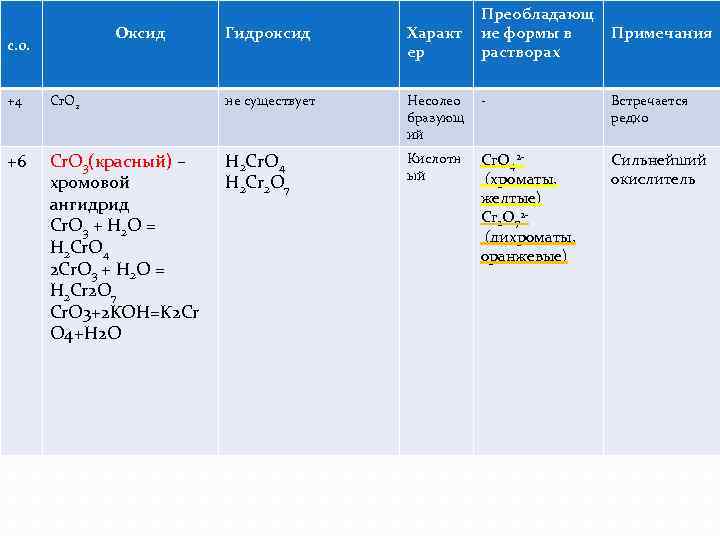
Преобладающ ие формы в растворах Оксид Гидроксид Характ ер +4 Cr. O 2 не существует Несолео бразующ ий - Встречается редко +6 Cr. O 3(красный) – хромовой ангидрид Cr. O 3 + H 2 O = H 2 Cr. O 4 2 Cr. O 3 + H 2 O = H 2 Cr 2 O 7 Cr. O 3+2 KOH=K 2 Cr O 4+H 2 O H 2 Cr. O 4 H 2 Cr 2 O 7 Кислотн ый Cr. O 42 (хроматы, желтые) Cr 2 O 72 (дихроматы, оранжевые) Сильнейший окислитель с. о. Примечания

Растворы хромата и дихромата калия легко переходят друг в друга при изменении кислотности среды. 2 Cr. O 42 - +2 H+ = Cr 2 O 72 - +H 2 O Cr 2 O 72 - +2 OH- =2 Cr. O 42 - +H 2 O

Окраска соединений хрома: 1 — Cr. Cl 2; 2 — [Cr(Н 2 О)5 Cl]Cl 2; 3 — [Cr(H 2 O)6]Cl 3; 4 — Cr(ОН) ; 5 — Na 3[Cr(OH)6].

Некоторые ОВР свойства соединений хрома. Соединения хрома(ll) легко окисляются, при этом Cr 2+ превращается в Cr 3+ : O 2 + 4 Cr(OH)2 + 2 H 2 O = 4 Cr(OH)3↓ 4 Cr. Cl 2+4 HCL+O 2=4 Cr. Cl 3+2 H 2 O Соединения хрома(Vl) – сильные окислители, Cr 6+ легко превращается в Cr 3+ Активными окислителями являются хромовый ангидрид, хроматы и дихроматы: K 2 Cr 2 O 7 + H 2 O + 3 H 2 S = 2 Cr(OH)3↓ + 3 S↓ + 2 KOH

Вопросы 1. В каком виде хром встречается в природе? 2. Какие вы знаете способы получения хрома? 3. В какой среде хроматы переходят в дихроматы и наоборот?

Вопросы из ЕГЭ А 3. Кислотные свойства сильнее всего выражены у оксида: 1 Cr. O 3 2 Cr 2 O 3 3 Cr. O 4 Mn. O

А 3 Гидроксиды хрома Cr(OH)2–Cr(OH)3 расположены в порядке 1 уменьшения степени окисления хрома 2 усиления восстановительных свойств 3 ослабления основных свойств 4 уменьшения молярной массы

А 3 Какой цвет в кислой среде имеет ион дихромата Cr 2 O 72 - ? 1) не имеет цвета 2)коричневый 3) желтый 4) ярко-оранжевый

Спасибо за внимание! Подготовили Субхангулов Эмиль и Каримов Динислам!
Хром.pptx