 Хром
Хром
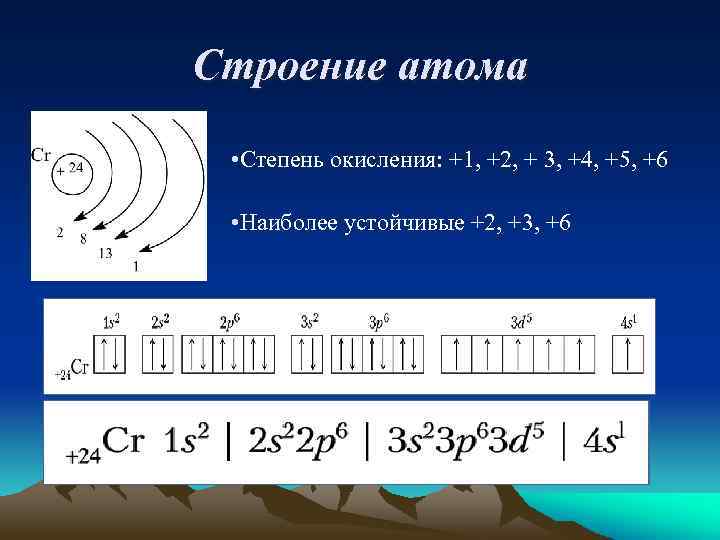 Строение атома • Степень окисления: +1, +2, + 3, +4, +5, +6 • Наиболее устойчивые +2, +3, +6
Строение атома • Степень окисления: +1, +2, + 3, +4, +5, +6 • Наиболее устойчивые +2, +3, +6
 Нахождение в природе • В природе встречается в виде соединений: • Хромовый железняк: Fe(Cr. O 2)2 • Оксид хрома (III) Сr 2 O 3
Нахождение в природе • В природе встречается в виде соединений: • Хромовый железняк: Fe(Cr. O 2)2 • Оксид хрома (III) Сr 2 O 3
 Физические свойства • Металл серебристо-белого цвета с металлическим блеском. • Плотность 7, 19 г/см 3 • Температура 1890 °С плавления
Физические свойства • Металл серебристо-белого цвета с металлическим блеском. • Плотность 7, 19 г/см 3 • Температура 1890 °С плавления
 Способы получения • I – восстановление хрома из хромового железняка Fe(Cr. O 2)2 + 4 C = 2 Cr + Fe + 4 CO↑ • II – восстановление хрома из оксида хрома (III) и (VI) Cr 2 O 3 + 2 Al = Al 2 O 3 + 2 Cr Cr. O 3 + 2 Al = Al 2 O 3 + Cr
Способы получения • I – восстановление хрома из хромового железняка Fe(Cr. O 2)2 + 4 C = 2 Cr + Fe + 4 CO↑ • II – восстановление хрома из оксида хрома (III) и (VI) Cr 2 O 3 + 2 Al = Al 2 O 3 + 2 Cr Cr. O 3 + 2 Al = Al 2 O 3 + Cr
 Химические свойства • Окисляется кислородом воздуха Cr + O 2 = Cr 2 O 3 • Оксидная пленка защищает от разрушения. • С разбавленной соляной и серной кислотой реагирует после разрушения оксидной пленки. Cr + H 2 SO 4 = Cr+2 SO 4 + H 2 • C азотной кислотой и концентрированной серной при нагревании Cr + HNO 3 = Cr+3(NO 3)3 + NO 2 + H 2 O Cr + H 2 SO 4 = Cr 2+3(SO 4)3 + SO 2 + H 2 O
Химические свойства • Окисляется кислородом воздуха Cr + O 2 = Cr 2 O 3 • Оксидная пленка защищает от разрушения. • С разбавленной соляной и серной кислотой реагирует после разрушения оксидной пленки. Cr + H 2 SO 4 = Cr+2 SO 4 + H 2 • C азотной кислотой и концентрированной серной при нагревании Cr + HNO 3 = Cr+3(NO 3)3 + NO 2 + H 2 O Cr + H 2 SO 4 = Cr 2+3(SO 4)3 + SO 2 + H 2 O
 Домашнее задание • § 26, стр. 118 упр. 7, 8, 9
Домашнее задание • § 26, стр. 118 упр. 7, 8, 9