 ХРОМ и его соединения
ХРОМ и его соединения
 I. Исторические сведения II. Хром – химический элемент: 1. Положение хрома в периодической системе химических элементов Д. И. Менделеева 2. Строение атома. 3. Нахождение в природе III. Хром – простое вещество 1. Состав. Физические свойства. 2. Получение. 3. Химические свойства 4. Биологическая роль и физиологическое действие. 5. Применение IV. Соединения хрома
I. Исторические сведения II. Хром – химический элемент: 1. Положение хрома в периодической системе химических элементов Д. И. Менделеева 2. Строение атома. 3. Нахождение в природе III. Хром – простое вещество 1. Состав. Физические свойства. 2. Получение. 3. Химические свойства 4. Биологическая роль и физиологическое действие. 5. Применение IV. Соединения хрома
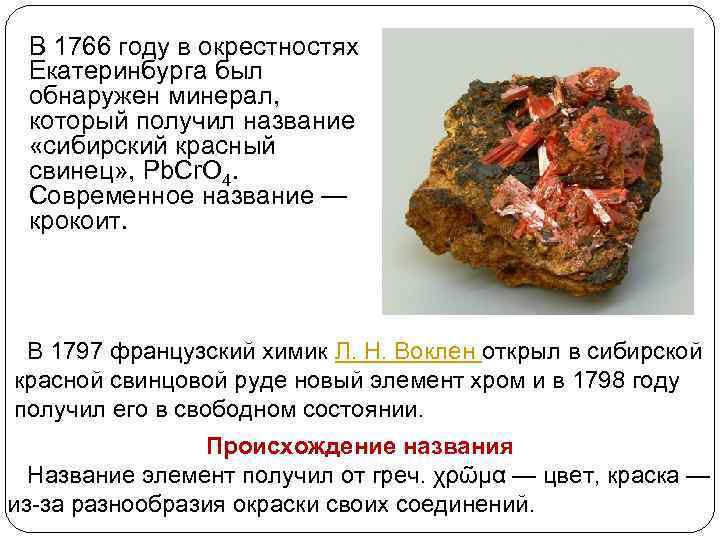 В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец» , Pb. Cr. O 4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен открыл в сибирской красной свинцовой руде новый элемент хром и в 1798 году получил его в свободном состоянии. Происхождение названия Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец» , Pb. Cr. O 4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен открыл в сибирской красной свинцовой руде новый элемент хром и в 1798 году получил его в свободном состоянии. Происхождение названия Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
 Французский химик Луи Николя Воклен родился в Сент-Андред'Эберто (Нормандия). Совместно с А. Ф. Фуркруа выяснил (1799) химическую природу мочевины. Совместно с П. Ж. Робике открыл (1806) первую аминокислоту аспарагин. Открыл также пектин и яблочную кислоту, выделил камфорную и хинную кислоты. Внёс существенный вклад в развитие анализа минералов. Создал школу химиков. Опубликовал одно из первых в мире руководств по химическому анализу – "Введение в аналитическую химию" (1799).
Французский химик Луи Николя Воклен родился в Сент-Андред'Эберто (Нормандия). Совместно с А. Ф. Фуркруа выяснил (1799) химическую природу мочевины. Совместно с П. Ж. Робике открыл (1806) первую аминокислоту аспарагин. Открыл также пектин и яблочную кислоту, выделил камфорную и хинную кислоты. Внёс существенный вклад в развитие анализа минералов. Создал школу химиков. Опубликовал одно из первых в мире руководств по химическому анализу – "Введение в аналитическую химию" (1799).
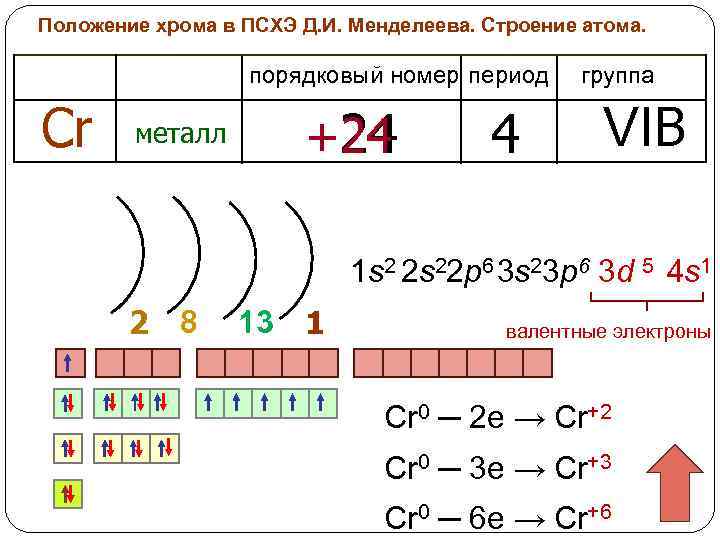 Положение хрома в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период Cr металл +24 24 4 группа VIB 1 s 2 2 s 22 p 6 3 s 23 p 6 3 d 5 4 s 1 2 8 13 1 валентные электроны Cr 0 ─ 2 e → Cr+2 Cr 0 ─ 3 e → Cr+3 Cr 0 ─ 6 e → Cr+6
Положение хрома в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период Cr металл +24 24 4 группа VIB 1 s 2 2 s 22 p 6 3 s 23 p 6 3 d 5 4 s 1 2 8 13 1 валентные электроны Cr 0 ─ 2 e → Cr+2 Cr 0 ─ 3 e → Cr+3 Cr 0 ─ 6 e → Cr+6
 Нахождение хрома в природе Хром является довольно распространённым элементом (0, 02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) Fe. O·Cr 2 O 3. Вторым по значимости минералом является крокоит Pb. Cr. O 4. хромит крокоит
Нахождение хрома в природе Хром является довольно распространённым элементом (0, 02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) Fe. O·Cr 2 O 3. Вторым по значимости минералом является крокоит Pb. Cr. O 4. хромит крокоит
 Физические свойства В свободном виде — голубовато- белый металл. Хром (с примесями) является одним из самых твердых металлов. Очень чистый хром достаточно хорошо поддаётся механической обработке, пластичен. Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома (III) Cr 2 O 3. Плотность 7, 19 г/см 3; t плавления 1890°С; t кипения 2480°С.
Физические свойства В свободном виде — голубовато- белый металл. Хром (с примесями) является одним из самых твердых металлов. Очень чистый хром достаточно хорошо поддаётся механической обработке, пластичен. Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома (III) Cr 2 O 3. Плотность 7, 19 г/см 3; t плавления 1890°С; t кипения 2480°С.
 Получение Из хромистого железняка Fe(Cr. O 2)2 (хромита железа) получают феррохром восстановлением в электропечах коксом (углеродом): Fe. O· Cr 2 O 3 + 4 C → Fe + 2 Cr + 4 CO↑ Феррохром — сплав железа и хрома (около 60% ), основные примеси – углерод (до 5%) кремний (до 8%), сера (до 0, 05 %), фосфор (до 0, 05 %). Феррохром применяют для производства легированных сталей.
Получение Из хромистого железняка Fe(Cr. O 2)2 (хромита железа) получают феррохром восстановлением в электропечах коксом (углеродом): Fe. O· Cr 2 O 3 + 4 C → Fe + 2 Cr + 4 CO↑ Феррохром — сплав железа и хрома (около 60% ), основные примеси – углерод (до 5%) кремний (до 8%), сера (до 0, 05 %), фосфор (до 0, 05 %). Феррохром применяют для производства легированных сталей.
 Чтобы получить чистый хром, реакцию ведут следующим образом: 1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе: 4 Fe(Cr. O 2)2 + 8 Na 2 CO 3 + 7 O 2 → 8 Na 2 Cr. O 4 + 2 Fe 2 O 3 + 8 CO 2↑ 2) растворяют хромат натрия и отделяют его от оксида железа; 3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат; 4) получают чистый оксид хрома восстановлением дихромата углём: Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO↑ 5) с помощью алюминотермии получают металлический хром: Cr 2 O 3 + 2 Al → Al 2 O 3 + 2 Cr + 130 ккал
Чтобы получить чистый хром, реакцию ведут следующим образом: 1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе: 4 Fe(Cr. O 2)2 + 8 Na 2 CO 3 + 7 O 2 → 8 Na 2 Cr. O 4 + 2 Fe 2 O 3 + 8 CO 2↑ 2) растворяют хромат натрия и отделяют его от оксида железа; 3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат; 4) получают чистый оксид хрома восстановлением дихромата углём: Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO↑ 5) с помощью алюминотермии получают металлический хром: Cr 2 O 3 + 2 Al → Al 2 O 3 + 2 Cr + 130 ккал
 С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса: 1) восстановление шестивалентного хрома до трехвалентного с переходом его в раствор; 2) разряд ионов водорода с выделением газообразного водорода; 3) разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома; Cr 2 O 72− + 14 Н+ + 12 е− = 2 Cr + 7 H 2 O
С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса: 1) восстановление шестивалентного хрома до трехвалентного с переходом его в раствор; 2) разряд ионов водорода с выделением газообразного водорода; 3) разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома; Cr 2 O 72− + 14 Н+ + 12 е− = 2 Cr + 7 H 2 O
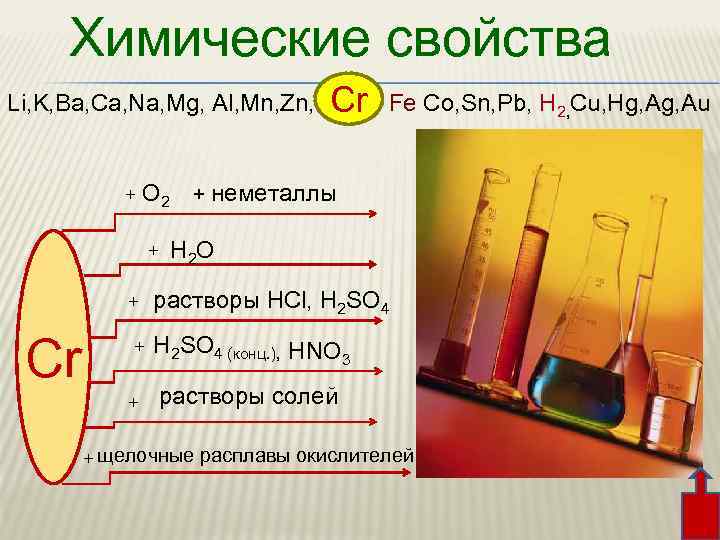 Химические свойства Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe Co, Sn, Pb, H 2, Cu, Hg, Au Cr + О 2 + неметаллы + + Cr H 2 O растворы HCl, H 2 SO 4 (конц. ), HNO 3 растворы солей + + щелочные расплавы окислителей +
Химические свойства Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe Co, Sn, Pb, H 2, Cu, Hg, Au Cr + О 2 + неметаллы + + Cr H 2 O растворы HCl, H 2 SO 4 (конц. ), HNO 3 растворы солей + + щелочные расплавы окислителей +
 При комнатной температуре хром химически мало активен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами, например: кислородом, галогенами, азотом, серой. Составьте уравнения реакций хрома с перечисленными неметаллами. Рассмотрите данные реакции как окислительно-восстановительные.
При комнатной температуре хром химически мало активен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами, например: кислородом, галогенами, азотом, серой. Составьте уравнения реакций хрома с перечисленными неметаллами. Рассмотрите данные реакции как окислительно-восстановительные.
 Cr 0 + O 20 = Cr 2+3 O 3– 2 4 3 2 Cr 0 – 3 e → Cr+3 4 O 20 + 4 e → 2 O– 2 3 Cr 0 – восстановитель, процесс окисления O 20 – окислитель, процесс восстановления Cr 0 + Br 20 = Cr+3 Br 3– 1 2 3 2 Cr 0 – 3 e → Cr+3 2 Br 20 + 2 e → 2 Br– 1 3 Cr 0 – восстановитель, процесс окисления Br 20 – окислитель, процесс восстановления
Cr 0 + O 20 = Cr 2+3 O 3– 2 4 3 2 Cr 0 – 3 e → Cr+3 4 O 20 + 4 e → 2 O– 2 3 Cr 0 – восстановитель, процесс окисления O 20 – окислитель, процесс восстановления Cr 0 + Br 20 = Cr+3 Br 3– 1 2 3 2 Cr 0 – 3 e → Cr+3 2 Br 20 + 2 e → 2 Br– 1 3 Cr 0 – восстановитель, процесс окисления Br 20 – окислитель, процесс восстановления
 Cr 0 + N 20 = Cr+3 N– 3 2 2 Cr 0 – 3 e → Cr+3 2 N 20 + 6 e → 2 N– 3 1 Cr 0 – восстановитель, процесс окисления N 20 – окислитель, процесс восстановления Cr 0 + S 0 = Cr 2+3 S 3– 2 2 3 Cr 0 – 3 e → Cr+3 2 S 0 + 2 e → S– 2 3 Cr 0 – восстановитель, процесс окисления S 0 – окислитель, процесс восстановления
Cr 0 + N 20 = Cr+3 N– 3 2 2 Cr 0 – 3 e → Cr+3 2 N 20 + 6 e → 2 N– 3 1 Cr 0 – восстановитель, процесс окисления N 20 – окислитель, процесс восстановления Cr 0 + S 0 = Cr 2+3 S 3– 2 2 3 Cr 0 – 3 e → Cr+3 2 S 0 + 2 e → S– 2 3 Cr 0 – восстановитель, процесс окисления S 0 – окислитель, процесс восстановления
 В раскаленном состоянии хром реагирует с парами воды: 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2 Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe Co, Sn, Pb, H 2, Cu, Hg, Au Cr В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснять водород из растворов соляной и серной кислот, образуя соли хрома (II). Составьте уравнения реакций хрома c растворами соляной и серной кислот. Рассмотрите данные реакции как окислительновосстановительные.
В раскаленном состоянии хром реагирует с парами воды: 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2 Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe Co, Sn, Pb, H 2, Cu, Hg, Au Cr В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснять водород из растворов соляной и серной кислот, образуя соли хрома (II). Составьте уравнения реакций хрома c растворами соляной и серной кислот. Рассмотрите данные реакции как окислительновосстановительные.
 Cr 0 + H+1 Cl = Cr+2 Cl 2 + H 20 2 Cr 0 – 2 e → Cr+2 1 2 H+ + 2 e → H 20 1 Cr 0 – восстановитель, процесс окисления HCl (за счет Н+1) – окислитель, процесс восстановления Cr 0 + H 2+1 SO 4 = Cr+2 SO 4 + H 20 Cr 0 – 2 e → Cr+2 1 2 H+ + 2 e → H 20 1 Cr 0 – восстановитель, процесс окисления H 2 SO 4(за счет Н+1) – окислитель, процесс восстановления
Cr 0 + H+1 Cl = Cr+2 Cl 2 + H 20 2 Cr 0 – 2 e → Cr+2 1 2 H+ + 2 e → H 20 1 Cr 0 – восстановитель, процесс окисления HCl (за счет Н+1) – окислитель, процесс восстановления Cr 0 + H 2+1 SO 4 = Cr+2 SO 4 + H 20 Cr 0 – 2 e → Cr+2 1 2 H+ + 2 e → H 20 1 Cr 0 – восстановитель, процесс окисления H 2 SO 4(за счет Н+1) – окислитель, процесс восстановления
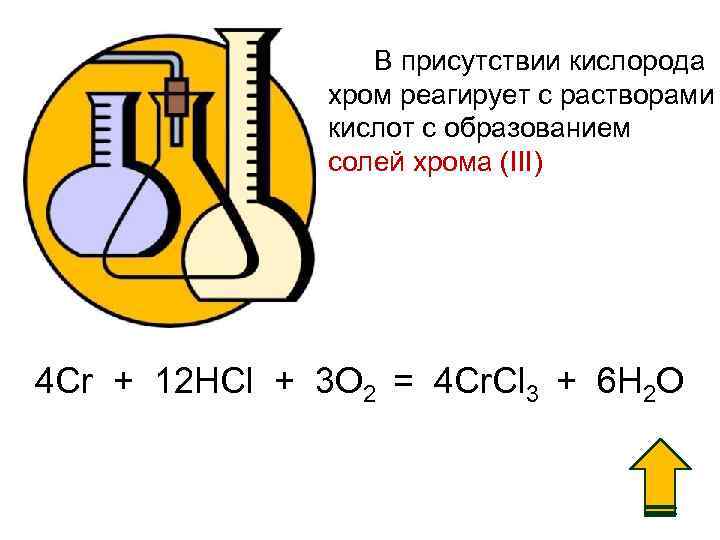 В присутствии кислорода хром реагирует с растворами кислот c образованием солей хрома (III) 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O
В присутствии кислорода хром реагирует с растворами кислот c образованием солей хрома (III) 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O
 Концентрированные серная и азотная кислоты на холоду пассивируют хром При сильном нагревании кислоты pастворяют хром с образованием cолей хрома (III) Cr + H 2 SO 4 → Cr 2(SO 4)3 + SO 2 + H 2 O Cr + HNO 3 → Cr(NO 3)3 + NO 2 + H 2 O Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.
Концентрированные серная и азотная кислоты на холоду пассивируют хром При сильном нагревании кислоты pастворяют хром с образованием cолей хрома (III) Cr + H 2 SO 4 → Cr 2(SO 4)3 + SO 2 + H 2 O Cr + HNO 3 → Cr(NO 3)3 + NO 2 + H 2 O Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.
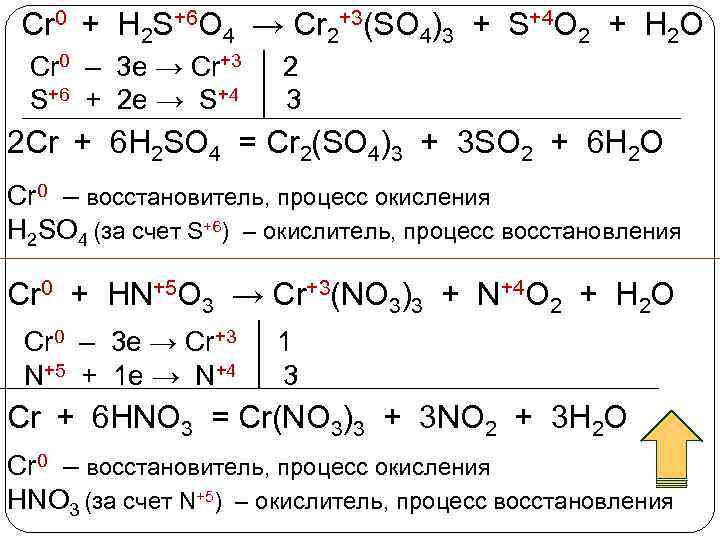 Cr 0 + H 2 S+6 O 4 → Cr 2+3(SO 4)3 + S+4 O 2 + H 2 O Cr 0 – 3 e → Cr+3 2 S+6 + 2 e → S+4 3 2 Cr + 6 H 2 SO 4 = Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr 0 – восстановитель, процесс окисления H 2 SO 4 (за счет S+6) – окислитель, процесс восстановления Cr 0 + HN+5 O 3 → Cr+3(NO 3)3 + N+4 O 2 + H 2 O Cr 0 – 3 e → Cr+3 1 N+5 + 1 e → N+4 3 Cr + 6 HNO 3 = Cr(NO 3)3 + 3 NO 2 + 3 H 2 O Cr 0 – восстановитель, процесс окисления HNO 3 (за счет N+5) – окислитель, процесс восстановления
Cr 0 + H 2 S+6 O 4 → Cr 2+3(SO 4)3 + S+4 O 2 + H 2 O Cr 0 – 3 e → Cr+3 2 S+6 + 2 e → S+4 3 2 Cr + 6 H 2 SO 4 = Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr 0 – восстановитель, процесс окисления H 2 SO 4 (за счет S+6) – окислитель, процесс восстановления Cr 0 + HN+5 O 3 → Cr+3(NO 3)3 + N+4 O 2 + H 2 O Cr 0 – 3 e → Cr+3 1 N+5 + 1 e → N+4 3 Cr + 6 HNO 3 = Cr(NO 3)3 + 3 NO 2 + 3 H 2 O Cr 0 – восстановитель, процесс окисления HNO 3 (за счет N+5) – окислитель, процесс восстановления
 Хром способен вытеснять многие металлы, например медь, олово, серебро и другие, из растворов их солей: Составьте уравнение реакции хрома c раствором сульфата меди (II). Рассмотрите данную реакцию как окислительновосстановительную. Cr 0 + Cu+2 SO 4 → Cr+2 SO 4 + Cu 0 Cr 0 – 2 e → Cr+2 1 Cu+2+ 2 e → Cu 0 1 Cr + Cu. SO 4 = Cr. SO 4 + Cu Cr 0 – восстановитель, процесс окисления Cu. SO 4 (за счет Cu+2) – окислитель, процесс восстановления
Хром способен вытеснять многие металлы, например медь, олово, серебро и другие, из растворов их солей: Составьте уравнение реакции хрома c раствором сульфата меди (II). Рассмотрите данную реакцию как окислительновосстановительную. Cr 0 + Cu+2 SO 4 → Cr+2 SO 4 + Cu 0 Cr 0 – 2 e → Cr+2 1 Cu+2+ 2 e → Cu 0 1 Cr + Cu. SO 4 = Cr. SO 4 + Cu Cr 0 – восстановитель, процесс окисления Cu. SO 4 (за счет Cu+2) – окислитель, процесс восстановления
 Растворы щелочей на хром практически не действуют. Хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты натрия, калия, хлорат калия и другие окислители. При взаимодействии с щелочными расплавами окислителей хром образует соли анионного типа, в которых проявляет высшую степень окисления. сплавление Cr + KCl. O 3 + KOH K 2 Cr. O 4 + KCl + H 2 O Рассмотрите эту реакцию как окислительно-восстановительную Расставьте коэффициенты. Назовите окислитель и восстановитель.
Растворы щелочей на хром практически не действуют. Хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты натрия, калия, хлорат калия и другие окислители. При взаимодействии с щелочными расплавами окислителей хром образует соли анионного типа, в которых проявляет высшую степень окисления. сплавление Cr + KCl. O 3 + KOH K 2 Cr. O 4 + KCl + H 2 O Рассмотрите эту реакцию как окислительно-восстановительную Расставьте коэффициенты. Назовите окислитель и восстановитель.
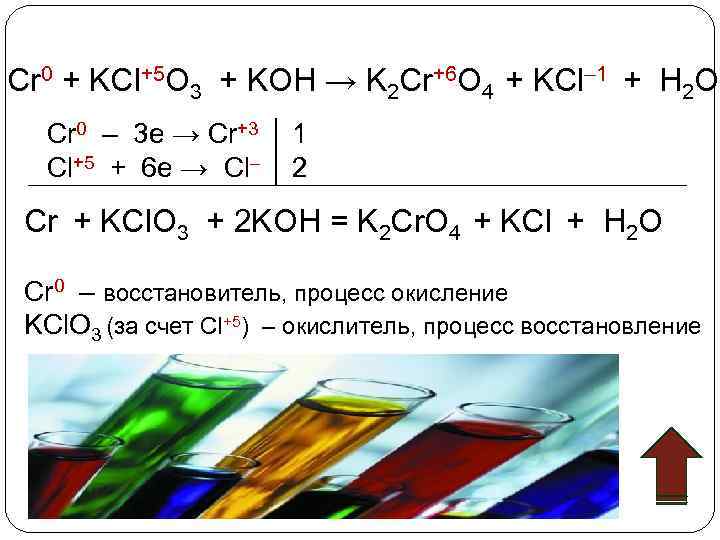 Cr 0 + KCl+5 O 3 + KOH → K 2 Cr+6 O 4 + KCl– 1 + H 2 O Cr 0 – 3 e → Cr+3 1 Cl+5 + 6 e → Cl– 2 Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O Cr 0 – восстановитель, процесс окисление KCl. O 3 (за счет Cl+5) – окислитель, процесс восстановление
Cr 0 + KCl+5 O 3 + KOH → K 2 Cr+6 O 4 + KCl– 1 + H 2 O Cr 0 – 3 e → Cr+3 1 Cl+5 + 6 e → Cl– 2 Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O Cr 0 – восстановитель, процесс окисление KCl. O 3 (за счет Cl+5) – окислитель, процесс восстановление
 Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0, 012 до 0, 0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0, 012 до 0, 0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
 Хром важный компонент во многих легированных сталях. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование) Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром важный компонент во многих легированных сталях. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование) Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
 Соединения хрома (II) оксид гидроксид соли Соединения хрома (III) оксид гидроксид соли Соединения хрома (VI) оксид гидроксид соли
Соединения хрома (II) оксид гидроксид соли Соединения хрома (III) оксид гидроксид соли Соединения хрома (VI) оксид гидроксид соли
 Соединения хрома (II) Cr. O Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном нагревании гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции. Cr(OH)2 = Cr. O + H 2 O При более высоких температурах оксид хрома (II) диспропорционирует: 700° 3 Cr. O = Cr + Cr 2 O 3
Соединения хрома (II) Cr. O Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном нагревании гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции. Cr(OH)2 = Cr. O + H 2 O При более высоких температурах оксид хрома (II) диспропорционирует: 700° 3 Cr. O = Cr + Cr 2 O 3
 Составьте уравнение реакции оксида хрома (II) с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЕД. Cr. O + 2 HCl = Cr. Cl 2 + H 2 O Cr. O + 2 H+ + Cl– = Cr 2+ + 2 Cl– + H 2 O Cr. O + 2 H+ = Cr 2+ + H 2 O Cr. O + H 2 SO 4 = Cr. SO 4 + H 2 O Cr. O + 2 H+ + SO 42– = Cr 2+ + SO 42– + H 2 O Cr. O + 2 H+ = Cr 2+ + H 2 O
Составьте уравнение реакции оксида хрома (II) с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЕД. Cr. O + 2 HCl = Cr. Cl 2 + H 2 O Cr. O + 2 H+ + Cl– = Cr 2+ + 2 Cl– + H 2 O Cr. O + 2 H+ = Cr 2+ + H 2 O Cr. O + H 2 SO 4 = Cr. SO 4 + H 2 O Cr. O + 2 H+ + SO 42– = Cr 2+ + SO 42– + H 2 O Cr. O + 2 H+ = Cr 2+ + H 2 O
 Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) Составьте уравнение реакции. Рассмотрите данную реакцию как окислительно-восстановительную. Cr+2 O + O 20 → Cr 2+3 O 3– 2 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr. O + O 2 = 2 Cr 2 O 3 Cr. O (за счет Cr+2) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) Составьте уравнение реакции. Рассмотрите данную реакцию как окислительно-восстановительную. Cr+2 O + O 20 → Cr 2+3 O 3– 2 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr. O + O 2 = 2 Cr 2 O 3 Cr. O (за счет Cr+2) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
 Гидроксид хрома (II) Cr(OH)2 Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха. Составьте уравнение реакции получения гидроксида хрома (II) действием гидроксида натрия на хлорид хрома (II). Рассмотрите реакцию с точки зрения ТЕД. Cr. Cl 2 + 2 Na. OH = Cr(OH)2 ↓ + 2 Na. Cl Cr 2+ + 2 Cl– + 2 Na+ + 2 OH– = Cr(OH)2 ↓ + 2 Na+ + 2 Cl– Cr 2+ + 2 OH– = Cr(OH)2 ↓
Гидроксид хрома (II) Cr(OH)2 Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха. Составьте уравнение реакции получения гидроксида хрома (II) действием гидроксида натрия на хлорид хрома (II). Рассмотрите реакцию с точки зрения ТЕД. Cr. Cl 2 + 2 Na. OH = Cr(OH)2 ↓ + 2 Na. Cl Cr 2+ + 2 Cl– + 2 Na+ + 2 OH– = Cr(OH)2 ↓ + 2 Na+ + 2 Cl– Cr 2+ + 2 OH– = Cr(OH)2 ↓
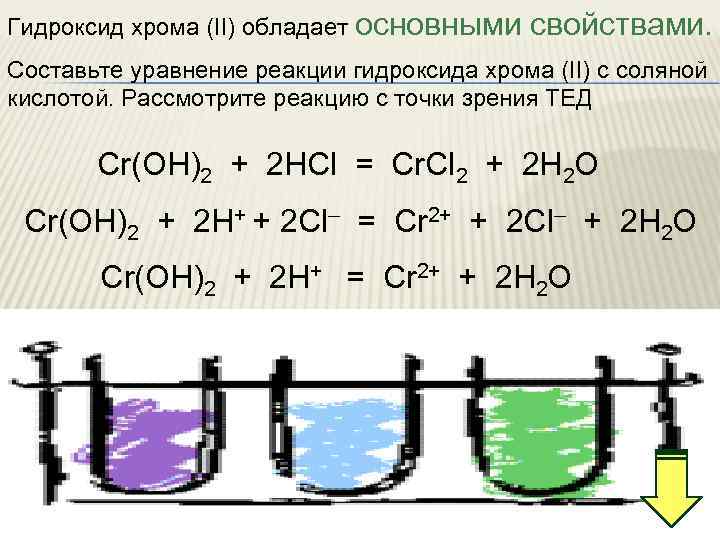 Гидроксид хрома (II) обладает основными свойствами. Составьте уравнение реакции гидроксида хрома (II) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД Cr(OН)2 + 2 HCl = Cr. Cl 2 + 2 H 2 O Cr(OН)2 + 2 H+ + 2 Cl– = Cr 2+ + 2 Cl– + 2 H 2 O Cr(OН)2 + 2 H+ = Cr 2+ + 2 H 2 O
Гидроксид хрома (II) обладает основными свойствами. Составьте уравнение реакции гидроксида хрома (II) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД Cr(OН)2 + 2 HCl = Cr. Cl 2 + 2 H 2 O Cr(OН)2 + 2 H+ + 2 Cl– = Cr 2+ + 2 Cl– + 2 H 2 O Cr(OН)2 + 2 H+ = Cr 2+ + 2 H 2 O
 Гидроксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до гидроксида хрома (III) Составьте уравнение реакции. Рассмотрите данную реакцию как окислительно-восстановительную. Cr+2(ОН)2+ O 20 + Н 2 О → Cr+3(O – 2 Н)3 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr(OН)2 + O 2 + 2 Н 2 О = 4 Cr(OН)3 Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
Гидроксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до гидроксида хрома (III) Составьте уравнение реакции. Рассмотрите данную реакцию как окислительно-восстановительную. Cr+2(ОН)2+ O 20 + Н 2 О → Cr+3(O – 2 Н)3 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr(OН)2 + O 2 + 2 Н 2 О = 4 Cr(OН)3 Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
 Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинком в кислой среде солей трехвалентного хрома. Безводные соли хрома (II) белого цвета, а водные растворы и кристаллогидраты — синего цвета. Соединения хрома (II) – сильные восстановители. Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома. Реагируют с концентрированными серной и азотной кислотами: Cr. Cl 2 + O 2 + HCl → Cr. Cl 3 + H 2 O Cr. Cl 2 + H 2 SO 4 → Cr 2(SO 4)3 + SO 2↑ + HCl↑ + H 2 O Cr. Cl 2 + HNO 3 → Cr(NO 3)3 + NO 2↑ + HCl↑ + H 2 O Рассмотрите эти реакции как окислительновосстановительные. Расставьте коэффициенты. .
Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинком в кислой среде солей трехвалентного хрома. Безводные соли хрома (II) белого цвета, а водные растворы и кристаллогидраты — синего цвета. Соединения хрома (II) – сильные восстановители. Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома. Реагируют с концентрированными серной и азотной кислотами: Cr. Cl 2 + O 2 + HCl → Cr. Cl 3 + H 2 O Cr. Cl 2 + H 2 SO 4 → Cr 2(SO 4)3 + SO 2↑ + HCl↑ + H 2 O Cr. Cl 2 + HNO 3 → Cr(NO 3)3 + NO 2↑ + HCl↑ + H 2 O Рассмотрите эти реакции как окислительновосстановительные. Расставьте коэффициенты. .
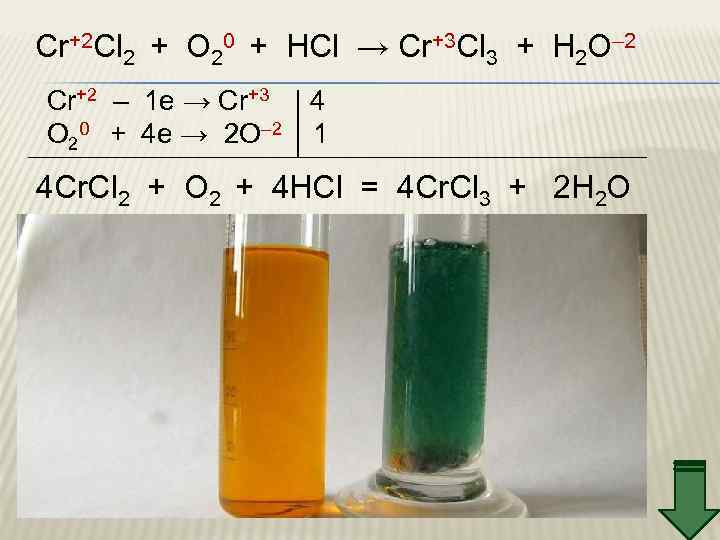 Cr+2 Cl 2 + O 20 + HCl → Cr+3 Cl 3 + H 2 O– 2 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr. Cl 2 + O 2 + 4 HCl = 4 Cr. Cl 3 + 2 H 2 O
Cr+2 Cl 2 + O 20 + HCl → Cr+3 Cl 3 + H 2 O– 2 Cr+2 – 1 e → Cr+3 4 O 20 + 4 e → 2 O– 2 1 4 Cr. Cl 2 + O 2 + 4 HCl = 4 Cr. Cl 3 + 2 H 2 O
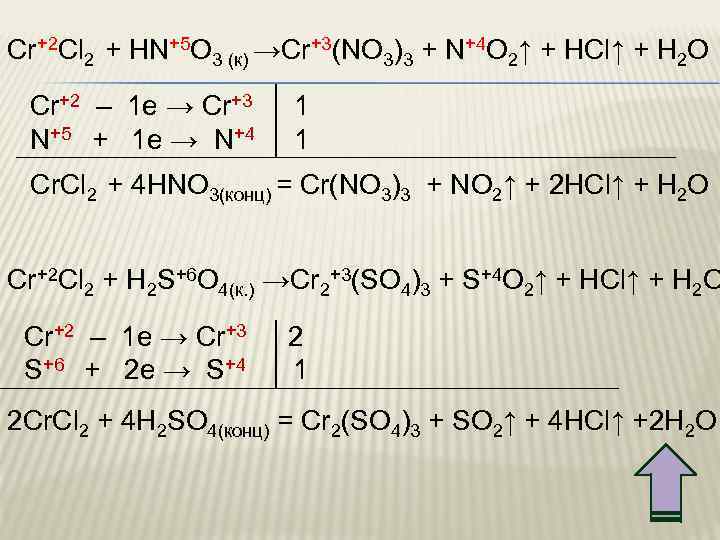 Cr+2 Cl 2 + HN+5 O 3 (к) →Cr+3(NO 3)3 + N+4 O 2↑ + HCl↑ + H 2 O Cr+2 – 1 e → Cr+3 1 N+5 + 1 e → N+4 1 Cr. Cl 2 + 4 HNO 3(конц) = Cr(NO 3)3 + NO 2↑ + 2 HCl↑ + H 2 O Cr+2 Cl 2 + H 2 S+6 O 4(к. ) →Cr 2+3(SO 4)3 + S+4 O 2↑ + HCl↑ + H 2 O Cr+2 – 1 e → Cr+3 2 S+6 + 2 e → S+4 1 2 Cr. Cl 2 + 4 H 2 SO 4(конц) = Cr 2(SO 4)3 + SO 2↑ + 4 HCl↑ +2 H 2 O
Cr+2 Cl 2 + HN+5 O 3 (к) →Cr+3(NO 3)3 + N+4 O 2↑ + HCl↑ + H 2 O Cr+2 – 1 e → Cr+3 1 N+5 + 1 e → N+4 1 Cr. Cl 2 + 4 HNO 3(конц) = Cr(NO 3)3 + NO 2↑ + 2 HCl↑ + H 2 O Cr+2 Cl 2 + H 2 S+6 O 4(к. ) →Cr 2+3(SO 4)3 + S+4 O 2↑ + HCl↑ + H 2 O Cr+2 – 1 e → Cr+3 2 S+6 + 2 e → S+4 1 2 Cr. Cl 2 + 4 H 2 SO 4(конц) = Cr 2(SO 4)3 + SO 2↑ + 4 HCl↑ +2 H 2 O
 Соединения хрома (III) Cr 2 O 3 Оксид хрома () – тугоплавкий порошок темно-зеленого цвета. Получение. В лабораторных условиях термическим разложением дихромата аммония: t° (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 2 H 2 O В промышленности восстановлением дихромата калия коксом или серой: t° K 2 Cr 2 O 7 + 3 C = 2 Cr 2 O 3 + 2 K 2 CO 3 + CO 2 t° K 2 Cr 2 O 7 + S = 2 Cr 2 O 3 + K 2 SO 4
Соединения хрома (III) Cr 2 O 3 Оксид хрома () – тугоплавкий порошок темно-зеленого цвета. Получение. В лабораторных условиях термическим разложением дихромата аммония: t° (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 2 H 2 O В промышленности восстановлением дихромата калия коксом или серой: t° K 2 Cr 2 O 7 + 3 C = 2 Cr 2 O 3 + 2 K 2 CO 3 + CO 2 t° K 2 Cr 2 O 7 + S = 2 Cr 2 O 3 + K 2 SO 4
 Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД. Cr 2 O 3 + 6 HCl = 2 Cr. Cl 3 + 3 H 2 O Cr 2 O 3 + 6 H+ + 6 Cl– = 2 Cr 3+ + 6 Cl– + 3 H 2 O Cr 2 O 3 + 6 H+ = 2 Cr 3+ + 3 H 2 O
Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД. Cr 2 O 3 + 6 HCl = 2 Cr. Cl 3 + 3 H 2 O Cr 2 O 3 + 6 H+ + 6 Cl– = 2 Cr 3+ + 6 Cl– + 3 H 2 O Cr 2 O 3 + 6 H+ = 2 Cr 3+ + 3 H 2 O
 При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III) (хромиты): t° Сr 2 O 3 + Ba(OH)2 = Ba(Cr. O 2)2 + H 2 O t° Сr 2 O 3 + Na 2 CO 3 = 2 Na. Cr. O 2 + CO 2 Оксид хрома (III) нерастворим в воде.
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III) (хромиты): t° Сr 2 O 3 + Ba(OH)2 = Ba(Cr. O 2)2 + H 2 O t° Сr 2 O 3 + Na 2 CO 3 = 2 Na. Cr. O 2 + CO 2 Оксид хрома (III) нерастворим в воде.
 В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель: Cr 2 O 3 + KOH + KMn. O 4 → K 2 Cr. O 4 + Mn. O 2 + H 2 O Cr 2 O 3 + KOH + Сa(Cl. O)2 → K 2 Cr. O 4 + Ca. Cl 2 + H 2 O Cr 2 O 3 + O 2 + Na 2 CO 3 → Na 2 Cr. O 4 + CO 2 Cr 2 O 3 + KCl. O 3 + Na 2 CO 3 → Na 2 Cr. O 4 + KCl + CO 2 Cr 2 O 3 + Na. NO 3 + Na 2 CO 3 → Na 2 Cr. O 4 + Na. NO 2 + CO 2 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты.
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель: Cr 2 O 3 + KOH + KMn. O 4 → K 2 Cr. O 4 + Mn. O 2 + H 2 O Cr 2 O 3 + KOH + Сa(Cl. O)2 → K 2 Cr. O 4 + Ca. Cl 2 + H 2 O Cr 2 O 3 + O 2 + Na 2 CO 3 → Na 2 Cr. O 4 + CO 2 Cr 2 O 3 + KCl. O 3 + Na 2 CO 3 → Na 2 Cr. O 4 + KCl + CO 2 Cr 2 O 3 + Na. NO 3 + Na 2 CO 3 → Na 2 Cr. O 4 + Na. NO 2 + CO 2 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты.
 Cr 2+3 O 3 + KOH + KMn+7 O 4 → K 2 Cr+6 O 4 + Mn+4 O 2 + H 2 O 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Mn+7 + 3 e → Mn+4 2 восстановление, окислитель Cr 2 O 3 + 2 KOH + 2 KMn. O 4 = 2 K 2 Cr. O 4 + 2 Mn. O 2 + H 2 O Cr 2+3 O 3 + KOH + Сa(Cl+1 O)2 → K 2 Cr+6 O 4 + Ca. Cl 2– 1 + H 2 O 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Cl+1 + 2 e → Cl– 1 3 восстановление, окислитель Cr 2 O 3 + 4 KOH + 3 Сa(Cl. O)2 = 2 K 2 Cr. O 4 + 3 Ca. Cl 2 + 2 H 2 O
Cr 2+3 O 3 + KOH + KMn+7 O 4 → K 2 Cr+6 O 4 + Mn+4 O 2 + H 2 O 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Mn+7 + 3 e → Mn+4 2 восстановление, окислитель Cr 2 O 3 + 2 KOH + 2 KMn. O 4 = 2 K 2 Cr. O 4 + 2 Mn. O 2 + H 2 O Cr 2+3 O 3 + KOH + Сa(Cl+1 O)2 → K 2 Cr+6 O 4 + Ca. Cl 2– 1 + H 2 O 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Cl+1 + 2 e → Cl– 1 3 восстановление, окислитель Cr 2 O 3 + 4 KOH + 3 Сa(Cl. O)2 = 2 K 2 Cr. O 4 + 3 Ca. Cl 2 + 2 H 2 O
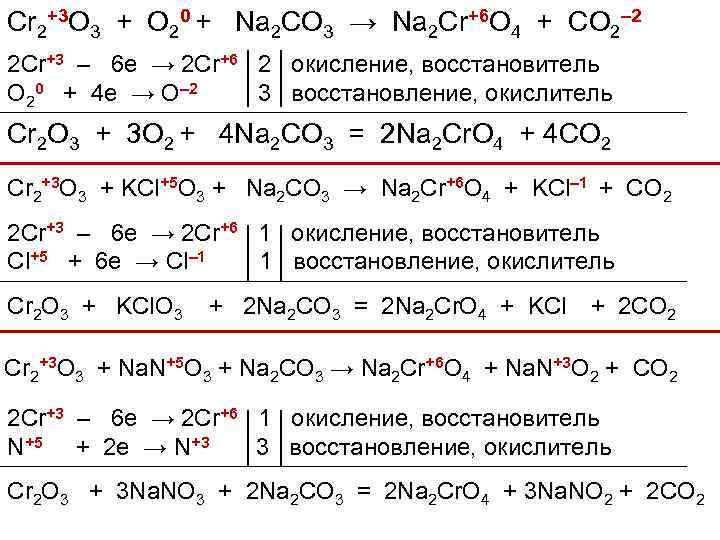 Cr 2+3 O 3 + O 20 + Na 2 CO 3 → Na 2 Cr+6 O 4 + CO 2– 2 2 Cr+3 – 6 e → 2 Cr+6 2 окисление, восстановитель O 20 + 4 e → O– 2 3 восстановление, окислитель Cr 2 O 3 + 3 O 2 + 4 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 4 CO 2 Cr 2+3 O 3 + KCl+5 O 3 + Na 2 CO 3 → Na 2 Cr+6 O 4 + KCl– 1 + CO 2 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Cl+5 + 6 e → Cl– 1 1 восстановление, окислитель Cr 2 O 3 + KCl. O 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + KCl + 2 CO 2 Cr 2+3 O 3 + Na. N+5 O 3 + Na 2 CO 3 → Na 2 Cr+6 O 4 + Na. N+3 O 2 + CO 2 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель N+5 + 2 e → N+3 3 восстановление, окислитель Cr 2 O 3 + 3 Na. NO 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 3 Na. NO 2 + 2 CO 2
Cr 2+3 O 3 + O 20 + Na 2 CO 3 → Na 2 Cr+6 O 4 + CO 2– 2 2 Cr+3 – 6 e → 2 Cr+6 2 окисление, восстановитель O 20 + 4 e → O– 2 3 восстановление, окислитель Cr 2 O 3 + 3 O 2 + 4 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 4 CO 2 Cr 2+3 O 3 + KCl+5 O 3 + Na 2 CO 3 → Na 2 Cr+6 O 4 + KCl– 1 + CO 2 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель Cl+5 + 6 e → Cl– 1 1 восстановление, окислитель Cr 2 O 3 + KCl. O 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + KCl + 2 CO 2 Cr 2+3 O 3 + Na. N+5 O 3 + Na 2 CO 3 → Na 2 Cr+6 O 4 + Na. N+3 O 2 + CO 2 2 Cr+3 – 6 e → 2 Cr+6 1 окисление, восстановитель N+5 + 2 e → N+3 3 восстановление, окислитель Cr 2 O 3 + 3 Na. NO 3 + 2 Na 2 CO 3 = 2 Na 2 Cr. O 4 + 3 Na. NO 2 + 2 CO 2
 Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
 Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта уксусный альдегид. Cr 2 O 3, t° 2 СН 3–СН 2–ОН + О 2 2 СН 3 – С ═ О + 2 H 2 O H
Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта уксусный альдегид. Cr 2 O 3, t° 2 СН 3–СН 2–ОН + О 2 2 СН 3 – С ═ О + 2 H 2 O H
 Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей хрома (III). Лабораторный опыт № 1 К раствору хлорида хрома (III) прилейте раствор аммиака. Что наблюдаете? Составьте уравнение реакции получения Cr(OH)3 действием раствора аммиака на хлорид хрома (III): Cr. Cl 3 + 3(NH 3·H 2 O) = Cr(OH)3 + 3 NH 4 Cl
Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей хрома (III). Лабораторный опыт № 1 К раствору хлорида хрома (III) прилейте раствор аммиака. Что наблюдаете? Составьте уравнение реакции получения Cr(OH)3 действием раствора аммиака на хлорид хрома (III): Cr. Cl 3 + 3(NH 3·H 2 O) = Cr(OH)3 + 3 NH 4 Cl
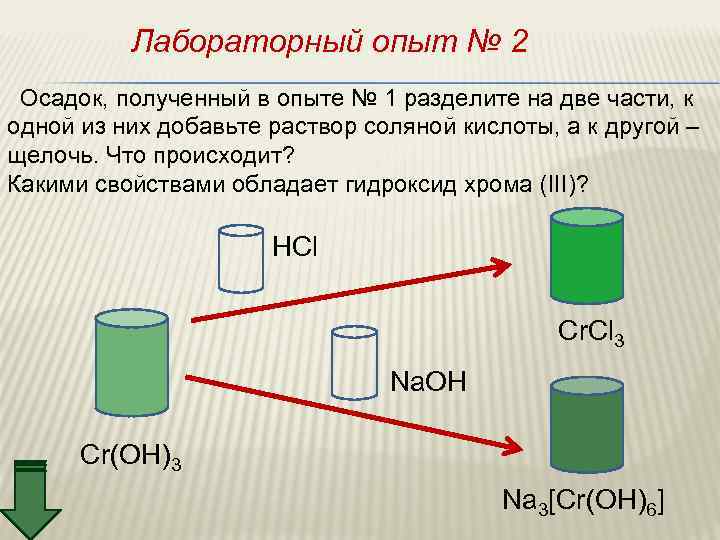 Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? HCl Cr. Cl 3 Na. OH Cr(OH)3 Na 3[Cr(OH)6]
Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? HCl Cr. Cl 3 Na. OH Cr(OH)3 Na 3[Cr(OH)6]
 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит? +H 2 SO 4 +Na. OH
Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит? +H 2 SO 4 +Na. OH
 Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции гидроксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД. Cr(OH)3 + 3 HCl = Cr. Cl 3 + 3 H 2 O Cr(OH)3 + 3 H+ + 3 Cl– = Cr 3+ + 3 Cl– + 3 H 2 O Cr(OH)3 + 3 H+ = Cr 3+ + 3 H 2 O
Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции гидроксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЕД. Cr(OH)3 + 3 HCl = Cr. Cl 3 + 3 H 2 O Cr(OH)3 + 3 H+ + 3 Cl– = Cr 3+ + 3 Cl– + 3 H 2 O Cr(OH)3 + 3 H+ = Cr 3+ + 3 H 2 O
![Гидроксид хрома (III) растворяется в щелочах Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6] Гидроксид хрома (III) растворяется в щелочах Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6]](https://present5.com/presentation/210386352_452776252/image-48.jpg) Гидроксид хрома (III) растворяется в щелочах Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6] гексагидроксохромат (III) натрия (изумрудно-зеленый) Cr(OH)3 + 3 Na+ + 3 OH– = 3 Na+ + [Cr(OH)6]3– Cr(OH)3 + 3 OH– = [Cr(OH)6]3– При нагревании гидроксид хрома (III) разлагается: t° 2 Cr(OH)3 = Cr 2 O 3 + 3 H 2 O
Гидроксид хрома (III) растворяется в щелочах Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6] гексагидроксохромат (III) натрия (изумрудно-зеленый) Cr(OH)3 + 3 Na+ + 3 OH– = 3 Na+ + [Cr(OH)6]3– Cr(OH)3 + 3 OH– = [Cr(OH)6]3– При нагревании гидроксид хрома (III) разлагается: t° 2 Cr(OH)3 = Cr 2 O 3 + 3 H 2 O
 Соли хрома (III) Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами: недостаток кислоты: Na. Cr. O 2 + HCl + H 2 O = Cr(OH)3 + Na. Cl избыток кислоты: Na. Cr. O 2 + 4 HCl = Cr. Cl 3 + Na. Cl + 2 H 2 O с угольной кислотой Na 3[Cr(OH)6] + 3 CO 2 = Cr(OH)3 + 3 Na. HCO 3 В растворе подвергаются полному гидролизу: Cr 2 S 3 + 6 H 2 O = 2 Cr(OH)3 + 3 H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O)6] 3+, который придает раствору сине-фиолетовый цвет.
Соли хрома (III) Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами: недостаток кислоты: Na. Cr. O 2 + HCl + H 2 O = Cr(OH)3 + Na. Cl избыток кислоты: Na. Cr. O 2 + 4 HCl = Cr. Cl 3 + Na. Cl + 2 H 2 O с угольной кислотой Na 3[Cr(OH)6] + 3 CO 2 = Cr(OH)3 + 3 Na. HCO 3 В растворе подвергаются полному гидролизу: Cr 2 S 3 + 6 H 2 O = 2 Cr(OH)3 + 3 H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O)6] 3+, который придает раствору сине-фиолетовый цвет.
 Сульфат хрома (III) образует двойные соли – хромовые квасцы Из смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль – KCr(SO 4)2· 12 H 2 O сине-фиолетового цвета. Применяются в качестве дубящего вещества при изготовлении эмульсий, а также в дубящих растворах и дубящих фиксажах.
Сульфат хрома (III) образует двойные соли – хромовые квасцы Из смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль – KCr(SO 4)2· 12 H 2 O сине-фиолетового цвета. Применяются в качестве дубящего вещества при изготовлении эмульсий, а также в дубящих растворах и дубящих фиксажах.
![Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3[Cr(OH)6] + Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3[Cr(OH)6] +](https://present5.com/presentation/210386352_452776252/image-51.jpg) Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3[Cr(OH)6] + Br 2 + KOH → K 2 Cr. O 4 + KBr + H 2 O Cr. Cl 3 + Zn → Cr. Cl 2 + Zn. Cl 2 KCr. O 2 + Pb. O 2 + KOH → K 2 Cr. O 4 + K 2 Pb. O 2 + H 2 O Cr. Cl 3 + H 2 O 2 + KOH → K 2 Cr. O 4 + KCl + H 2 O Cr 2(SO 4)3 + Cl 2 + Na. OH → Na 2 Cr. O 4 + Na. Cl + H 2 O + Na 2 SO 4 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.
Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3[Cr(OH)6] + Br 2 + KOH → K 2 Cr. O 4 + KBr + H 2 O Cr. Cl 3 + Zn → Cr. Cl 2 + Zn. Cl 2 KCr. O 2 + Pb. O 2 + KOH → K 2 Cr. O 4 + K 2 Pb. O 2 + H 2 O Cr. Cl 3 + H 2 O 2 + KOH → K 2 Cr. O 4 + KCl + H 2 O Cr 2(SO 4)3 + Cl 2 + Na. OH → Na 2 Cr. O 4 + Na. Cl + H 2 O + Na 2 SO 4 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.
![K 3[Cr+3(OH)6] + Br 20 + KOH → K 2 Cr+6 O 4 + K 3[Cr+3(OH)6] + Br 20 + KOH → K 2 Cr+6 O 4 +](https://present5.com/presentation/210386352_452776252/image-52.jpg) K 3[Cr+3(OH)6] + Br 20 + KOH → K 2 Cr+6 O 4 + KBr– + H 2 O Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Br 20 + 2 e → 2 Br– 1 3 восстановление, окислитель 2 K 3[Cr(OH)6] + 3 Br 2 + 4 KOH = 2 K 2 Cr. O 4 + 6 KBr + 8 H 2 O Cr+3 Cl 3 + Zn 0 → Cr+2 Cl 2 + Zn+2 Cl 2 Cr+3 + 1 e → Cr+2 2 восстановление, окислитель Zn 0 – 2 e → Zn+2 1 окисление, восстановитель 2 Cr. Cl 3 + Zn = 2 Cr. Cl 2 + Zn. Cl 2 KCr+3 O 2 + Pb+4 O 2 + KOH → K 2 Cr+6 O 4 + K 2 Pb+2 O 2 + H 2 O Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Pb+4 + 2 e → Pb– 2 3 восстановление, окислитель 2 KCr. O 2 + 3 Pb. O 2 + 8 KOH = 2 K 2 Cr. O 4 + 3 K 2 Pb. O 2 + 4 H 2 O
K 3[Cr+3(OH)6] + Br 20 + KOH → K 2 Cr+6 O 4 + KBr– + H 2 O Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Br 20 + 2 e → 2 Br– 1 3 восстановление, окислитель 2 K 3[Cr(OH)6] + 3 Br 2 + 4 KOH = 2 K 2 Cr. O 4 + 6 KBr + 8 H 2 O Cr+3 Cl 3 + Zn 0 → Cr+2 Cl 2 + Zn+2 Cl 2 Cr+3 + 1 e → Cr+2 2 восстановление, окислитель Zn 0 – 2 e → Zn+2 1 окисление, восстановитель 2 Cr. Cl 3 + Zn = 2 Cr. Cl 2 + Zn. Cl 2 KCr+3 O 2 + Pb+4 O 2 + KOH → K 2 Cr+6 O 4 + K 2 Pb+2 O 2 + H 2 O Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Pb+4 + 2 e → Pb– 2 3 восстановление, окислитель 2 KCr. O 2 + 3 Pb. O 2 + 8 KOH = 2 K 2 Cr. O 4 + 3 K 2 Pb. O 2 + 4 H 2 O
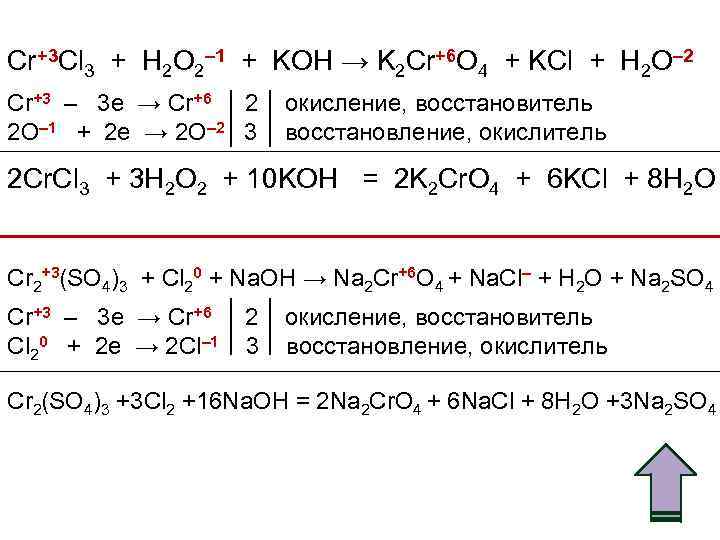 Cr+3 Cl 3 + H 2 O 2– 1 + KOH → K 2 Cr+6 O 4 + KCl + H 2 O– 2 Cr+3 – 3 e → Cr+6 2 окисление, восстановитель 2 O– 1 + 2 e → 2 O– 2 3 восстановление, окислитель 2 Cr. Cl 3 + 3 H 2 O 2 + 10 KOH = 2 K 2 Cr. O 4 + 6 KCl + 8 H 2 O Cr 2+3(SO 4)3 + Cl 20 + Na. OH → Na 2 Cr+6 O 4 + Na. Cl– + H 2 O + Na 2 SO 4 Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Cl 20 + 2 e → 2 Cl– 1 3 восстановление, окислитель Cr 2(SO 4)3 +3 Cl 2 +16 Na. OH = 2 Na 2 Cr. O 4 + 6 Na. Cl + 8 H 2 O +3 Na 2 SO 4
Cr+3 Cl 3 + H 2 O 2– 1 + KOH → K 2 Cr+6 O 4 + KCl + H 2 O– 2 Cr+3 – 3 e → Cr+6 2 окисление, восстановитель 2 O– 1 + 2 e → 2 O– 2 3 восстановление, окислитель 2 Cr. Cl 3 + 3 H 2 O 2 + 10 KOH = 2 K 2 Cr. O 4 + 6 KCl + 8 H 2 O Cr 2+3(SO 4)3 + Cl 20 + Na. OH → Na 2 Cr+6 O 4 + Na. Cl– + H 2 O + Na 2 SO 4 Cr+3 – 3 e → Cr+6 2 окисление, восстановитель Cl 20 + 2 e → 2 Cl– 1 3 восстановление, окислитель Cr 2(SO 4)3 +3 Cl 2 +16 Na. OH = 2 Na 2 Cr. O 4 + 6 Na. Cl + 8 H 2 O +3 Na 2 SO 4
 Оксид хрома (VI) Cr. O 3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. Получают Cr. O 3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na 2 Cr 2 O 7 + 2 H 2 SO 4 = 2 Cr. O 3 + 2 Na. HSO 4 + H 2 O При нагревании выше 250 °C разлагается: 4 Cr. O 3 → 2 Cr 2 O 3 + 3 O 2↑. Оксид хрома (VI) очень ядовит.
Оксид хрома (VI) Cr. O 3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. Получают Cr. O 3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na 2 Cr 2 O 7 + 2 H 2 SO 4 = 2 Cr. O 3 + 2 Na. HSO 4 + H 2 O При нагревании выше 250 °C разлагается: 4 Cr. O 3 → 2 Cr 2 O 3 + 3 O 2↑. Оксид хрома (VI) очень ядовит.
 Cr. O 3 — кислотный оксид. При растворении в воде образует кислоты. С избытком воды образуется хромовая кислота H 2 Cr. O 4 Cr. O 3 + Н 2 O = Н 2 Cr. O 4 При большой концентрации Cr. O 3 образуется дихромовая кислота Н 2 Cr 2 О 7 2 Cr. O 3 + Н 2 O = Н 2 Cr 2 O 7 которая при разбавлении переходит в хромовую кислоту: Н 2 Cr 2 О 7 + Н 2 О = 2 Н 2 Cr. O 4 Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие 2 Н 2 Cr. O 4 ↔ Н 2 Cr 2 O 7 + Н 2 O При взаимодействии Cr. O 3 со щелочами образуются хроматы Cr. O 3 + 2 KOH → K 2 Cr. O 4 + H 2 O.
Cr. O 3 — кислотный оксид. При растворении в воде образует кислоты. С избытком воды образуется хромовая кислота H 2 Cr. O 4 Cr. O 3 + Н 2 O = Н 2 Cr. O 4 При большой концентрации Cr. O 3 образуется дихромовая кислота Н 2 Cr 2 О 7 2 Cr. O 3 + Н 2 O = Н 2 Cr 2 O 7 которая при разбавлении переходит в хромовую кислоту: Н 2 Cr 2 О 7 + Н 2 О = 2 Н 2 Cr. O 4 Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие 2 Н 2 Cr. O 4 ↔ Н 2 Cr 2 O 7 + Н 2 O При взаимодействии Cr. O 3 со щелочами образуются хроматы Cr. O 3 + 2 KOH → K 2 Cr. O 4 + H 2 O.
 Cr. O 3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Cr. O 3 + C 2 H 5 OH → CO 2 + Cr 2 O 3 + H 2 O C 2 H 5 OH + 3 H 2 O – 12 e → 2 CO 2 + 12 H+ 1 2 Cr. O 3 + 6 H+ + 6 e → Cr 2 O 3 + 3 H 2 O 2 C 2 H 5 OH + 3 H 2 O + 4 Cr. O 3 + 12 H+ = 2 CO 2 + 12 H+ + 2 Cr 2 O 3 + 6 H 2 O 4 Cr. O 3 + C 2 H 5 OH → 2 CO 2 + 2 Cr 2 O 3 + 3 H 2 O Окисляет йод, серу, фосфор, уголь. 4 Cr. O 3 + 3 S = 2 Cr 2 O 3 + 3 SO 2↑.
Cr. O 3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Cr. O 3 + C 2 H 5 OH → CO 2 + Cr 2 O 3 + H 2 O C 2 H 5 OH + 3 H 2 O – 12 e → 2 CO 2 + 12 H+ 1 2 Cr. O 3 + 6 H+ + 6 e → Cr 2 O 3 + 3 H 2 O 2 C 2 H 5 OH + 3 H 2 O + 4 Cr. O 3 + 12 H+ = 2 CO 2 + 12 H+ + 2 Cr 2 O 3 + 6 H 2 O 4 Cr. O 3 + C 2 H 5 OH → 2 CO 2 + 2 Cr 2 O 3 + 3 H 2 O Окисляет йод, серу, фосфор, уголь. 4 Cr. O 3 + 3 S = 2 Cr 2 O 3 + 3 SO 2↑.
 Окисление ацетона хромовым ангидридом. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона, то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды. 16 Cr. O 3 + 3 CH 3– С – CH 3 → 9 CO 2 + 8 Cr 2 O 3 + 9 H 2 O О
Окисление ацетона хромовым ангидридом. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона, то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды. 16 Cr. O 3 + 3 CH 3– С – CH 3 → 9 CO 2 + 8 Cr 2 O 3 + 9 H 2 O О
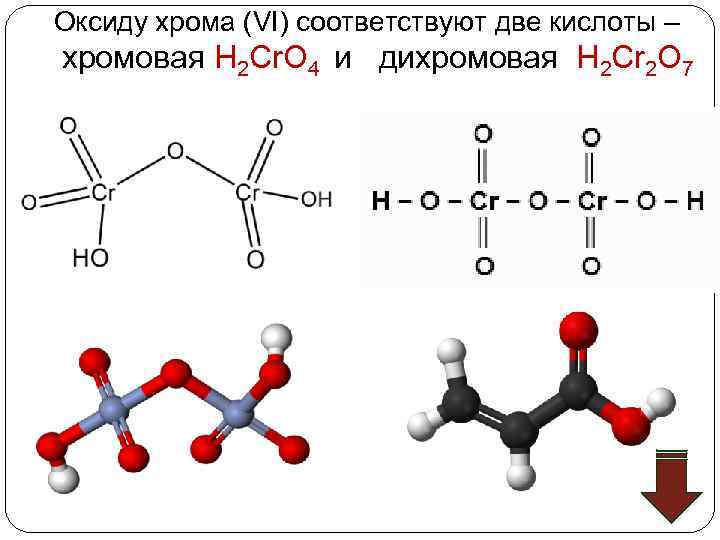 Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 Cr. O 4 и дихромовая Н 2 Cr 2 O 7
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 Cr. O 4 и дихромовая Н 2 Cr 2 O 7
 Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов Cr. O 3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов Cr. O 3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
 соли хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается. 2 Cr. O 42– + 2 H+ ↔ Cr 2 O 72– + H 2 O хроматы Н+ ОН– дихроматы
соли хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается. 2 Cr. O 42– + 2 H+ ↔ Cr 2 O 72– + H 2 O хроматы Н+ ОН– дихроматы
 Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски. Напишите уравнения реакций.
Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски. Напишите уравнения реакций.
 2 K 2 Cr. O 4 + H 2 SO 4(разб. ) = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O 2 K 2 Cr. O 4 + 2 HCl(разб. ) = K 2 Cr 2 O 7 + 2 KCl + H 2 O 2 K 2 Cr. O 4 + H 2 O + CO 2 = K 2 Cr 2 O 7 + KHCO 3 K 2 Cr 2 O 7 + 2 KOH = 2 K 2 Cr. O 4 + H 2 O
2 K 2 Cr. O 4 + H 2 SO 4(разб. ) = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O 2 K 2 Cr. O 4 + 2 HCl(разб. ) = K 2 Cr 2 O 7 + 2 KCl + H 2 O 2 K 2 Cr. O 4 + H 2 O + CO 2 = K 2 Cr 2 O 7 + KHCO 3 K 2 Cr 2 O 7 + 2 KOH = 2 K 2 Cr. O 4 + H 2 O
 Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 Cr. O 4 и дихромовая Н 2 Cr 2 O 7, Хромат калия K 2 Cr. O 4 и дихромат калия K 2 Cr 2 O 7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым. 2 K 2 Cr. O 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K 2 Cr 2 O 7 + 2 KOH = 2 K 2 Cr. O 4 + H 2 O
Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 Cr. O 4 и дихромовая Н 2 Cr 2 O 7, Хромат калия K 2 Cr. O 4 и дихромат калия K 2 Cr 2 O 7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым. 2 K 2 Cr. O 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K 2 Cr 2 O 7 + 2 KOH = 2 K 2 Cr. O 4 + H 2 O
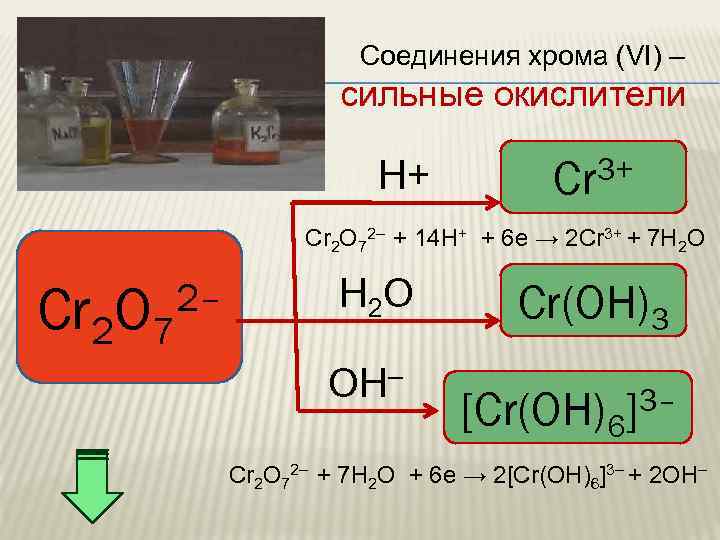 Соединения хрома (VI) – сильные окислители H+ 3+ Cr Cr 2 O 72– + 14 H+ + 6 e → 2 Cr 3+ + 7 H 2 O Cr 2 O 7 2– H 2 O OH– Cr(OH)3 [Cr(OH)6 3– ] Cr 2 O 72– + 7 Н 2 О + 6 e → 2[Cr(OH)6]3– + 2 ОН–
Соединения хрома (VI) – сильные окислители H+ 3+ Cr Cr 2 O 72– + 14 H+ + 6 e → 2 Cr 3+ + 7 H 2 O Cr 2 O 7 2– H 2 O OH– Cr(OH)3 [Cr(OH)6 3– ] Cr 2 O 72– + 7 Н 2 О + 6 e → 2[Cr(OH)6]3– + 2 ОН–
 Окислительные свойства дихроматов Дихроматы, например дихромат калия K 2 Cr 2 O 7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия. K 2 Cr 2 O 7 +3 Na 2 SO 3+4 H 2 SO 4 =Cr 2(SO 4)3 + 3 Na 2 SO 4+ K 2 SO 4 + 4 H 2 O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома - ярко окрашены, именно поэтому элемент получил такое название: "хром", что в переводе с греческого означает "цвет, краска". опыт
Окислительные свойства дихроматов Дихроматы, например дихромат калия K 2 Cr 2 O 7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия. K 2 Cr 2 O 7 +3 Na 2 SO 3+4 H 2 SO 4 =Cr 2(SO 4)3 + 3 Na 2 SO 4+ K 2 SO 4 + 4 H 2 O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома - ярко окрашены, именно поэтому элемент получил такое название: "хром", что в переводе с греческого означает "цвет, краска". опыт
 Zn + K 2 Cr 2 O 7 + H 2 SO 4 → Zn. SO 4 + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 SO 4 → S + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 → O 2 + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 O + H 2 S → S + Cr(OH)3 + KOH K 2 Cr 2 O 7 + H 2 O + K 2 S → S + K 3[Cr(OH)6] + KOH K 2 Cr 2 O 7 + KOH + (NH 4)2 S → S + K 3[Cr(OH)6] + NH 3 Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде: K 2 Cr 2 O 7 + S → K 2 SO 4 + Cr 2 O 3 K 2 Cr 2 O 7 + С → K 2 СO 3 + СО + Cr 2 O 3 K 2 Cr 2 O 7 + Al → Cr + KAl. O 2 + Al 2 O 3 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты.
Zn + K 2 Cr 2 O 7 + H 2 SO 4 → Zn. SO 4 + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 SO 4 → S + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 → O 2 + Cr 2(SO 4)3 + K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + H 2 O + H 2 S → S + Cr(OH)3 + KOH K 2 Cr 2 O 7 + H 2 O + K 2 S → S + K 3[Cr(OH)6] + KOH K 2 Cr 2 O 7 + KOH + (NH 4)2 S → S + K 3[Cr(OH)6] + NH 3 Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде: K 2 Cr 2 O 7 + S → K 2 SO 4 + Cr 2 O 3 K 2 Cr 2 O 7 + С → K 2 СO 3 + СО + Cr 2 O 3 K 2 Cr 2 O 7 + Al → Cr + KAl. O 2 + Al 2 O 3 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты.
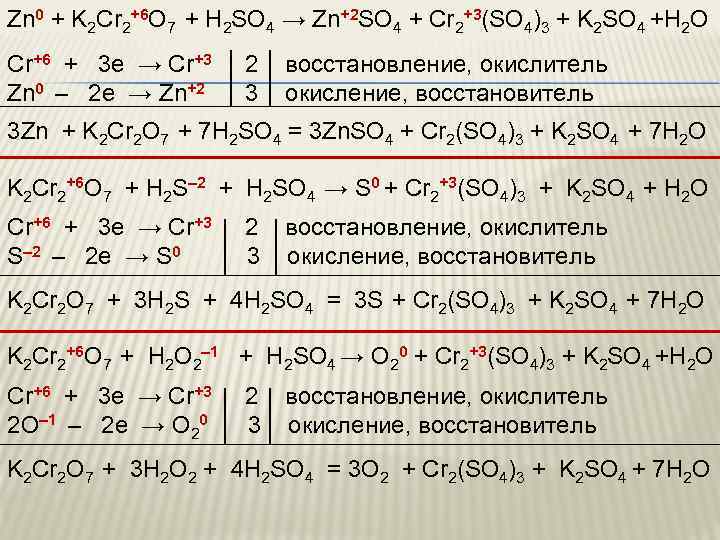 Zn 0 + K 2 Cr 2+6 O 7 + H 2 SO 4 → Zn+2 SO 4 + Cr 2+3(SO 4)3 + K 2 SO 4 +H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель Zn 0 – 2 e → Zn+2 3 окисление, восстановитель 3 Zn + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Zn. SO 4 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2+6 O 7 + H 2 S– 2 + H 2 SO 4 → S 0 + Cr 2+3(SO 4)3 + K 2 SO 4 + H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 3 H 2 S + 4 H 2 SO 4 = 3 S + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2+6 O 7 + H 2 O 2– 1 + H 2 SO 4 → O 20 + Cr 2+3(SO 4)3 + K 2 SO 4 +H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель 2 O– 1 – 2 e → O 20 3 окисление, восстановитель K 2 Cr 2 O 7 + 3 H 2 O 2 + 4 H 2 SO 4 = 3 O 2 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O
Zn 0 + K 2 Cr 2+6 O 7 + H 2 SO 4 → Zn+2 SO 4 + Cr 2+3(SO 4)3 + K 2 SO 4 +H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель Zn 0 – 2 e → Zn+2 3 окисление, восстановитель 3 Zn + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Zn. SO 4 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2+6 O 7 + H 2 S– 2 + H 2 SO 4 → S 0 + Cr 2+3(SO 4)3 + K 2 SO 4 + H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 3 H 2 S + 4 H 2 SO 4 = 3 S + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O K 2 Cr 2+6 O 7 + H 2 O 2– 1 + H 2 SO 4 → O 20 + Cr 2+3(SO 4)3 + K 2 SO 4 +H 2 O Cr+6 + 3 e → Cr+3 2 восстановление, окислитель 2 O– 1 – 2 e → O 20 3 окисление, восстановитель K 2 Cr 2 O 7 + 3 H 2 O 2 + 4 H 2 SO 4 = 3 O 2 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O
 K 2 Cr 2+6 O 7 + H 2 O + H 2 S– 2 → S 0 + Cr+3(OH)3 + KOH 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + H 2 O + 3 H 2 S = 3 S + 2 Cr(OH)3 + 2 KOH K 2 Cr 2+6 O 7 + H 2 O + K 2 S– 2 → S 0 + K 3[Cr+3 (OH)6] + KOH 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 7 H 2 O + 3 K 2 S = 3 S + 2 K 3[Cr(OH)6] + 2 KOH K 2 Cr 2+6 O 7 + KOH +H 2 O + (NH 4)2 S– 2 → S 0 + K 3[Cr+3(OH)6] + NH 3 2 Cr+6 + 6 e → 2 Cr+ 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 4 KOH + H 2 O + 3(NH 4)2 S = 3 S + 2 K 3[Cr(OH)6] + 6 NH 3
K 2 Cr 2+6 O 7 + H 2 O + H 2 S– 2 → S 0 + Cr+3(OH)3 + KOH 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + H 2 O + 3 H 2 S = 3 S + 2 Cr(OH)3 + 2 KOH K 2 Cr 2+6 O 7 + H 2 O + K 2 S– 2 → S 0 + K 3[Cr+3 (OH)6] + KOH 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 7 H 2 O + 3 K 2 S = 3 S + 2 K 3[Cr(OH)6] + 2 KOH K 2 Cr 2+6 O 7 + KOH +H 2 O + (NH 4)2 S– 2 → S 0 + K 3[Cr+3(OH)6] + NH 3 2 Cr+6 + 6 e → 2 Cr+ 1 восстановление, окислитель S– 2 – 2 e → S 0 3 окисление, восстановитель K 2 Cr 2 O 7 + 4 KOH + H 2 O + 3(NH 4)2 S = 3 S + 2 K 3[Cr(OH)6] + 6 NH 3
 K 2 Cr 2+6 O 7 + S 0 → K 2 S+6 O 4 + Cr 2+3 O 3 Cr+6 + 3 e → Cr+3 2 восстановление, окислитель S 0 – 6 e → S+6 1 окисление, восстановитель K 2 Cr 2 O 7 + S = K 2 SO 4 + Cr 2 O 3 K 2 Cr 2+6 O 7 + С 0 → K 2 С+4 O 3 + С+2 О + Cr 2+3 O 3 Cr+6 + 3 e → Cr+3 3 2 восстановление, окислитель С 0 – 4 e → С+4 4 1 окисление, восстановитель С 0 – 2 e → С+2 2 1 K 2 Cr 2 O 7 + 2 С = K 2 СO 3 + СО + Cr 2 O 3 K 2 Cr 2+6 O 7 + Al 0 → Cr 0 + KAl. O 2 + Al 2+3 O 3 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель Al 0 – 3 e → Al+3 2 окисление, восстановитель K 2 Cr 2 O 7 + 4 Al = 2 Cr + 2 KAl. O 2 + Al 2 O 3
K 2 Cr 2+6 O 7 + S 0 → K 2 S+6 O 4 + Cr 2+3 O 3 Cr+6 + 3 e → Cr+3 2 восстановление, окислитель S 0 – 6 e → S+6 1 окисление, восстановитель K 2 Cr 2 O 7 + S = K 2 SO 4 + Cr 2 O 3 K 2 Cr 2+6 O 7 + С 0 → K 2 С+4 O 3 + С+2 О + Cr 2+3 O 3 Cr+6 + 3 e → Cr+3 3 2 восстановление, окислитель С 0 – 4 e → С+4 4 1 окисление, восстановитель С 0 – 2 e → С+2 2 1 K 2 Cr 2 O 7 + 2 С = K 2 СO 3 + СО + Cr 2 O 3 K 2 Cr 2+6 O 7 + Al 0 → Cr 0 + KAl. O 2 + Al 2+3 O 3 2 Cr+6 + 6 e → 2 Cr+3 1 восстановление, окислитель Al 0 – 3 e → Al+3 2 окисление, восстановитель K 2 Cr 2 O 7 + 4 Al = 2 Cr + 2 KAl. O 2 + Al 2 O 3
 Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3 С 2 H 5 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 CH 3– CHO + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O 3 С 3 H 7 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 3 CH 3– C–CH 3 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O ║ O
Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3 С 2 H 5 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 CH 3– CHO + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O 3 С 3 H 7 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 3 CH 3– C–CH 3 + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O ║ O
 Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы Дихромат аммония разлагается при нагревании: 180°C (NH 4)2 Cr 2 O 7 Cr 2 O 3 + N 2 + 4 H 2 O
Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы Дихромат аммония разлагается при нагревании: 180°C (NH 4)2 Cr 2 O 7 Cr 2 O 3 + N 2 + 4 H 2 O
 В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н 2 Cr. О 4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н 2 Cr. О 4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
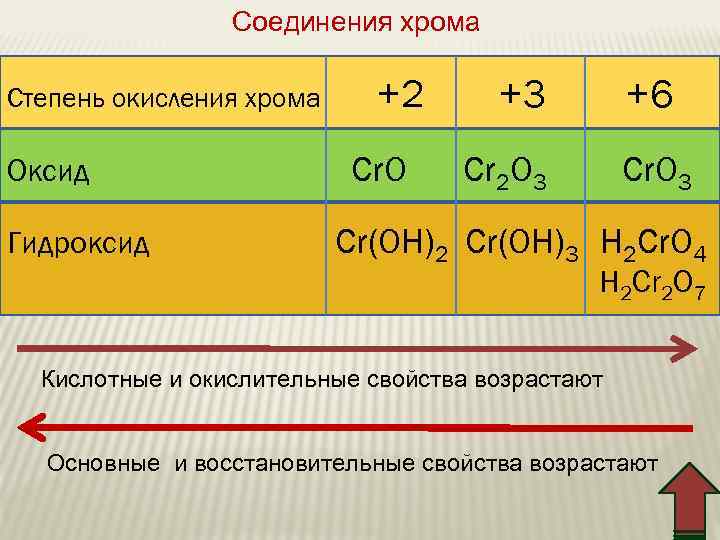 Соединения хрома Степень окисления хромa Оксид Гидроксид +2 Cr. O +3 +6 Cr 2 O 3 Cr(OH)2 Cr(OH)3 H 2 Cr. O 4 H 2 Cr 2 O 7 Кислотные и окислительные свойства возрастают Основные и восстановительные свойства возрастают
Соединения хрома Степень окисления хромa Оксид Гидроксид +2 Cr. O +3 +6 Cr 2 O 3 Cr(OH)2 Cr(OH)3 H 2 Cr. O 4 H 2 Cr 2 O 7 Кислотные и окислительные свойства возрастают Основные и восстановительные свойства возрастают
 Начала химии. Современный курс для поступающих в ВУЗы. – М. : 1 Федеративная Книготорговая Компания. Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В. Н. Доронькина. – Ростов н/Дону: Легион Химия. Пособие для поступающих в вузы /О. О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо Интернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http: //school-collection. edu. ru/ 2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без http: //ppt 4 web. ru/khimija/khrom 1. html
Начала химии. Современный курс для поступающих в ВУЗы. – М. : 1 Федеративная Книготорговая Компания. Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В. Н. Доронькина. – Ростов н/Дону: Легион Химия. Пособие для поступающих в вузы /О. О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо Интернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http: //school-collection. edu. ru/ 2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без http: //ppt 4 web. ru/khimija/khrom 1. html
 ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С СОЕДИНЕНИЯМИ ХРОМА При работе с препаратами хрома не допускать их попадания на кожу и внутрь организма. Соедине ния хрома высших степеней окисления оказывают раздражающее и сжигающее действие на слизистые оболочки и кожу. В трещи нах кожного покрова или порезах оксид хрома (VI) Сг. О 3 и дихро маты способны вызывать долго не заживающие язвы.
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С СОЕДИНЕНИЯМИ ХРОМА При работе с препаратами хрома не допускать их попадания на кожу и внутрь организма. Соедине ния хрома высших степеней окисления оказывают раздражающее и сжигающее действие на слизистые оболочки и кожу. В трещи нах кожного покрова или порезах оксид хрома (VI) Сг. О 3 и дихро маты способны вызывать долго не заживающие язвы.
 Дихроматы более опасны, чем хроматы. Менее опасны соединения хрома со степенью окисления +3, однако установлено, что пыль оксида хрома (III) Cr 2 O 3, которая образуется при разло жении дихромата аммония (NH 4)2 Cr 2 О 7 и алюмотермии оксидов хрома, взывает раздражение и способна в конечном счете привести к тяжелейшим заболеваниям легких.
Дихроматы более опасны, чем хроматы. Менее опасны соединения хрома со степенью окисления +3, однако установлено, что пыль оксида хрома (III) Cr 2 O 3, которая образуется при разло жении дихромата аммония (NH 4)2 Cr 2 О 7 и алюмотермии оксидов хрома, взывает раздражение и способна в конечном счете привести к тяжелейшим заболеваниям легких.
 ЛАБОРАТОРНЫЙ ПРАКТИКУМ Опыт 1. Получение и свойства хроматов и дихроматов Смещение равновесия между хромат(VI)- и дихромат(VI)- ионами. К раствору К 2 Cr. O 4 прилейте 2 моль/л раствор серной кислоты, а к раствору K 2 Cr 2 O 7 – 2 моль/л раствор КOH. Запишите наблюдения. Напишите в ионном виде уравнение реакции, объясняющее изменение окраски растворов. 2 K 2 Cr. O 4 + H 2 SO 4 ………. K 2 Cr 2 O 7 + 2 KOH ………. .
ЛАБОРАТОРНЫЙ ПРАКТИКУМ Опыт 1. Получение и свойства хроматов и дихроматов Смещение равновесия между хромат(VI)- и дихромат(VI)- ионами. К раствору К 2 Cr. O 4 прилейте 2 моль/л раствор серной кислоты, а к раствору K 2 Cr 2 O 7 – 2 моль/л раствор КOH. Запишите наблюдения. Напишите в ионном виде уравнение реакции, объясняющее изменение окраски растворов. 2 K 2 Cr. O 4 + H 2 SO 4 ………. K 2 Cr 2 O 7 + 2 KOH ………. .
 Окислительные свойства соединений хрома (VI). К раствору дихромата калия, подкисленному 2 моль/л раствором серной кислоты, прилейте раздельно в 2 -х пробирках растворы Na. NO 2 и Na 2 S. Запишите наблюдения. Напишите и уравняйте уравнения реакций ионно электронным методом: K 2 Cr 2 O 7+ Na. NO 2 +H 2 SO 4 K 2 Cr 2 O 7+H 2 SO 4+Na 2 S K 2 Cr 2 O 7+H 2 SO 4+С 2 Н 5 ОН
Окислительные свойства соединений хрома (VI). К раствору дихромата калия, подкисленному 2 моль/л раствором серной кислоты, прилейте раздельно в 2 -х пробирках растворы Na. NO 2 и Na 2 S. Запишите наблюдения. Напишите и уравняйте уравнения реакций ионно электронным методом: K 2 Cr 2 O 7+ Na. NO 2 +H 2 SO 4 K 2 Cr 2 O 7+H 2 SO 4+Na 2 S K 2 Cr 2 O 7+H 2 SO 4+С 2 Н 5 ОН



