SurChem&Ads_5_Pletnev_2010.ppt
- Количество слайдов: 15

ХПЯи. АП (Лекция V) Адсорбция на границах раздела фаз Адсорбция на флюидных границах раздела фаз. Адсорбционные и нерастворимые монослои. Адсорбция на границе твердое тело/ раствор. М. Ю. Плетнёв, доктор хим. наук Кафедра коллоидной химии
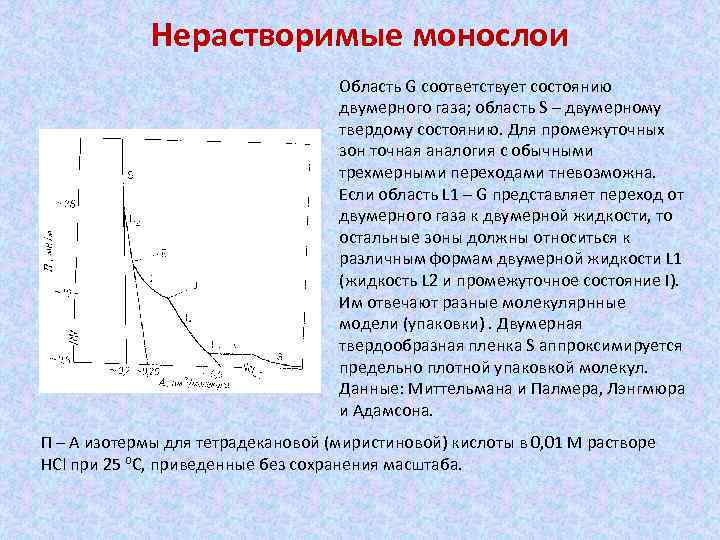
Нерастворимые монослои Область G соответствует состоянию двумерного газа; область S – двумерному твердому состоянию. Для промежуточных зон точная аналогия с обычными трехмерными переходами тневозможна. Если область L 1 – G представляет переход от двумерного газа к двумерной жидкости, то остальные зоны должны относиться к различным формам двумерной жидкости L 1 (жидкость L 2 и промежуточное состояние I). Им отвечают разные молекулярнные модели (упаковки). Двумерная твердообразная пленка S аппроксимируется предельно плотной упаковкой молекул. Данные: Миттельмана и Палмера, Лэнгмюра и Адамсона. Π – А изотермы для тетрадекановой (миристиновой) кислоты в 0, 01 М растворе HCl при 25 ⁰С, приведенные без сохранения масштаба.
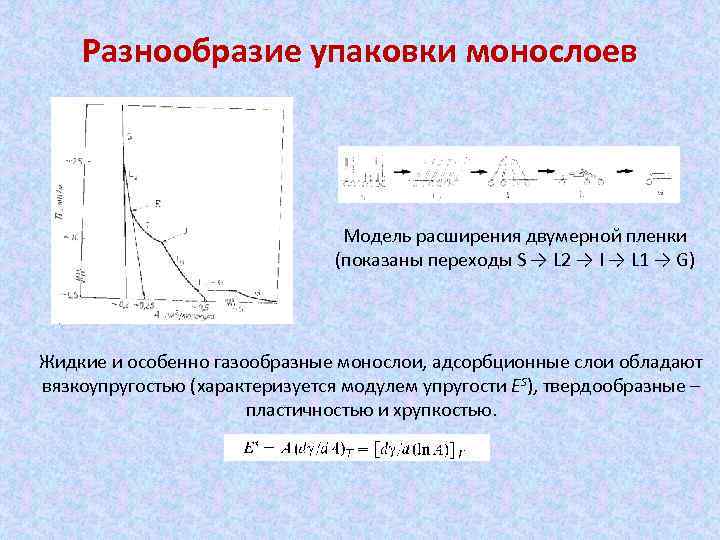
Разнообразие упаковки монослоев Модель расширения двумерной пленки (показаны переходы S → L 2 → I → L 1 → G) Жидкие и особенно газообразные монослои, адсорбционные слои обладают вязкоупругостью (характеризуется модулем упругости ЕS), твердообразные – пластичностью и хрупкостью.

Монослои: аналогия с макроскопической пленкой жидкости. Принцип независимости поверхностного действия Лэнгмюра L 1 и I пленки по Лэнгмюру – нерастворимый монослой (пленка) с различающимися поверхностями – верхней (углеводородная парафиновая) и нижней из групп СООН. Форма кривых давление – поверхность имеет в области L 1 вид почти точной гиперболы. Такие кривые описываются уравнением: (π – π0)(А – А 0) = k. T, где π = 11, 2 м. Н/м, А 0 = 0, 12 + 0, 00178 ∙(Т – 273, 15) нм 2. Величина π0 – поверхностное давление, обусловленное углеводородной частью молекул кислоты: π0 = σВ – σМ Здесь π0 очень близко к величине к-та растекания для гексадекана по поверхности воды при 20 ⁰С.
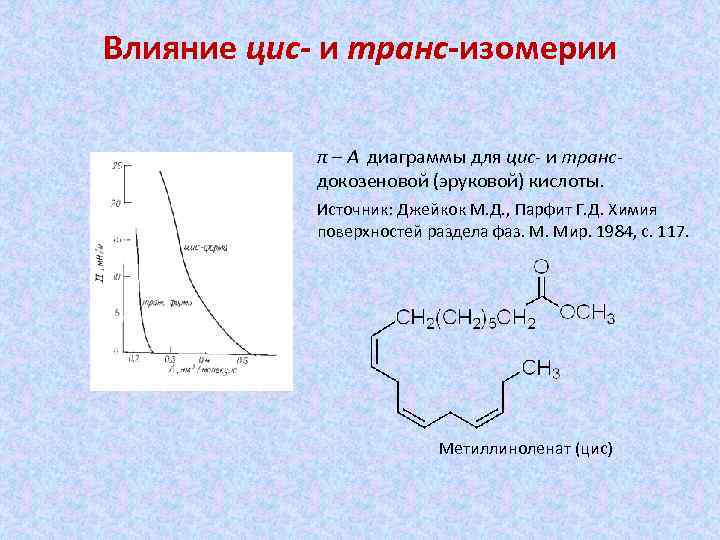
Влияние цис- и транс-изомерии π – А диаграммы для цис- и трансдокозеновой (эруковой) кислоты. Источник: Джейкок М. Д. , Парфит Г. Д. Химия поверхностей раздела фаз. М. Мир. 1984, с. 117. Метиллиноленат (цис)
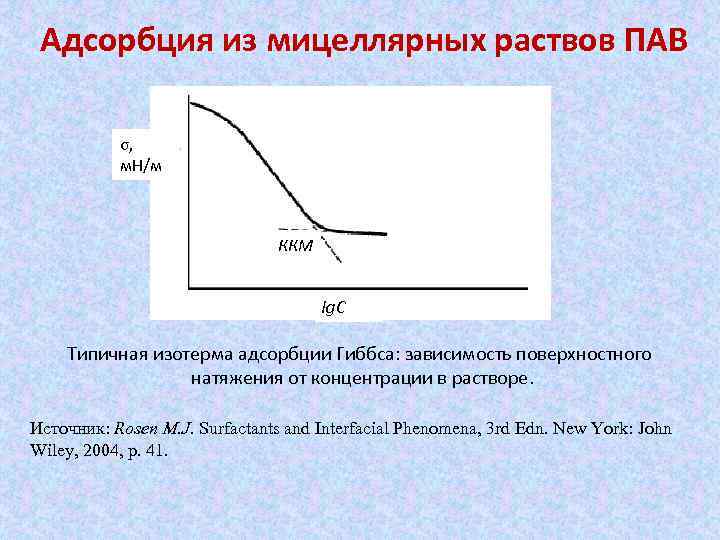
Адсорбция из мицеллярных раствов ПАВ σ, м. Н/м ККМ lg. C Типичная изотерма адсорбции Гиббса: зависимость поверхностного натяжения от концентрации в растворе. Источник: Rosen M. J. Surfactants and Interfacial Phenomena, 3 rd Edn. New York: John Wiley, 2004, p. 41.


Изотермы адсорбции на границе твердое тело/ жидкость Для описания адсорбции на границе твердое тело/ жидкость основным является уравнение Лэнгмюра: Г = а. Гm. C/(1 +a. C), в котором давление газа заменено на концентрацию С; а. Гm – количество адсорбированного вещества при насыщении; а – постоянная, связанная с теплотой адсорбции ΔНа соотношением а = К ехр(ΔНа/RT) (K – постоянная). Для активированного угля, силикагеля и др. пористых адсорбентов вид кривой обычно соответствует эмпирическому уравнению Фрейндлиха: Г = b. C 1/n (b и n – постоянные) Уравнение Фрейндлиха фактически соответствует некоторому диапазону значений Г и а. Это говорит о том, что адсорбция происходит на неоднородной поверхности. Возможность специфических взаимодействий зависит от природы полярных групп и заряда поверхности сорбента. Оксиды (как и белки, целлюлоза) обнаруживают изоэлектрические точки: для кремнезема, силикатов ИТ – в области р. Н ≈ 3, для диоксида титана, оксида алюминия – р. Н 5– 6. Для желатины ИТ – при p. H 6, 3– 9, 2 (при кислотной обработке тканей) и р. Н 4, 7– 5, 2 (при щелочной обработке).
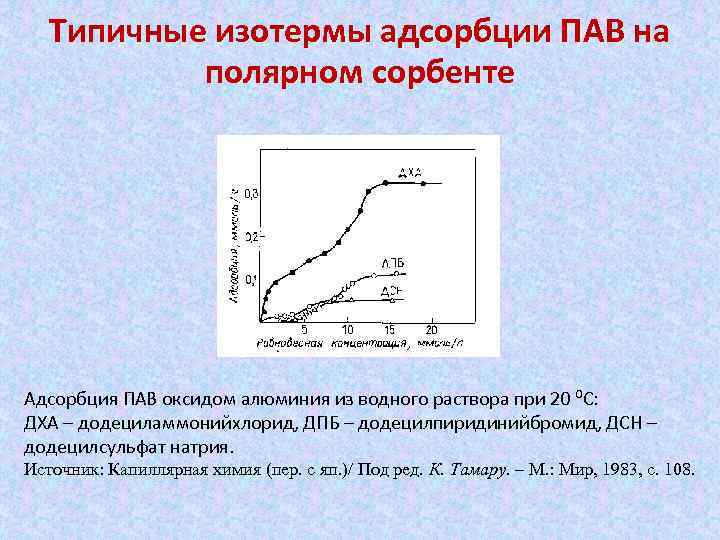
Типичные изотермы адсорбции ПАВ на полярном сорбенте Адсорбция ПАВ оксидом алюминия из водного раствора при 20 ⁰С: ДХА – додециламмонийхлорид, ДПБ – додецилпиридинийбромид, ДСН – додецилсульфат натрия. Источник: Капиллярная химия (пер. с яп. )/ Под ред. К. Тамару. – М. : Мир, 1983, с. 108.
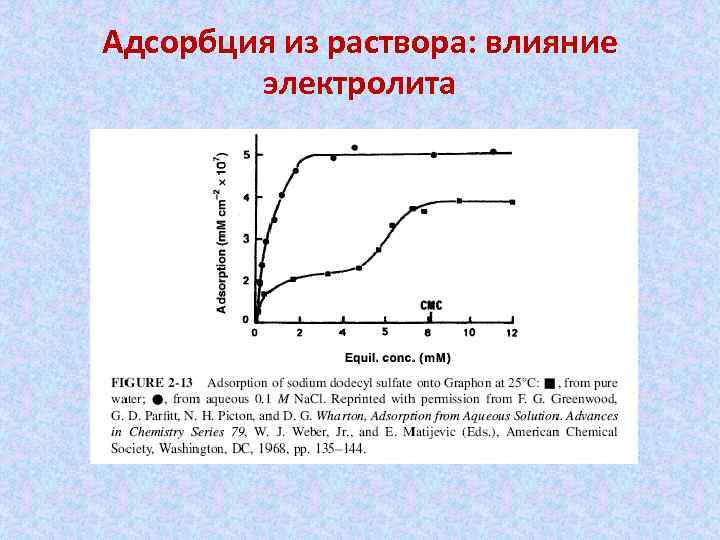
Адсорбция из раствора: влияние электролита

Адсорбция из мицеллярных раствов ПАВ Адсорбция из водных растворов дифильных агрегатов с участием гидрофобных взаимодействий (a) на незаряженной низкоэнергетической поверхности и (b) путем электростатического взаимодействия на противоположно заряженной поверхности. Источник: Rosen M. J. Surfactants and Interfacial Phenomena, 3 rd Edn. New York: John Wiley, 2004, p. 41.
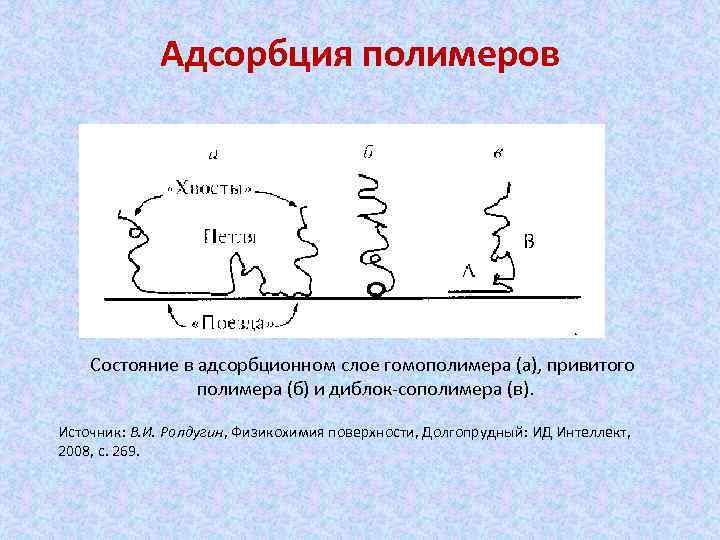
Адсорбция полимеров Состояние в адсорбционном слое гомополимера (а), привитого полимера (б) и диблок-сополимера (в). Источник: В. И. Ролдугин, Физикохимия поверхности, Долгопрудный: ИД Интеллект, 2008, с. 269.
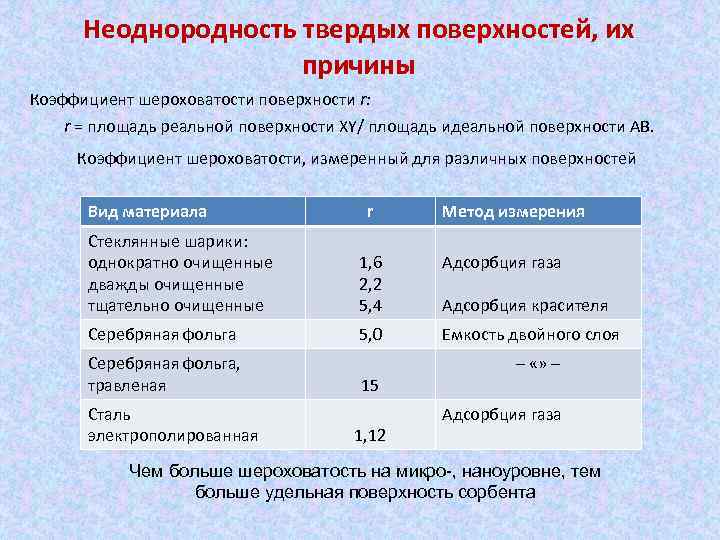
Неоднородность твердых поверхностей, их причины Коэффициент шероховатости поверхности r: r = площадь реальной поверхности XY/ площадь идеальной поверхности АВ. Коэффициент шероховатости, измеренный для различных поверхностей Вид материала r Метод измерения Стеклянные шарики: однократно очищенные дважды очищенные тщательно очищенные 1, 6 2, 2 5, 4 Адсорбция газа Серебряная фольга 5, 0 Емкость двойного слоя Серебряная фольга, травленая Сталь электрополированная 15 1, 12 Адсорбция красителя – «» – Адсорбция газа Чем больше шероховатость на микро-, наноуровне, тем больше удельная поверхность сорбента

Типичное сечение поверхности металла Модель Самуэльса для полированной поверхности. Толщина слоя оксида – 0, 01– 0, 1 мкм, слоя Бейби – 0, 1 мкм. Сильная деформация – 1– 2 мкм, умеренная деформация – 5– 10 мкм, незначительная деформация – 20– 50 мкм. Данные: Джейкок М. Д. , Парфит Г. Д. Химия поверхностей раздела фаз. М. Мир. 1984, с. 144. Получить сложный нанорельеф поверхности достаточно просто. СЛОЖНО его сохранить!

Пожалуйста, задавайте вопросы Кафедра коллоидной хиии МИТХТ
SurChem&Ads_5_Pletnev_2010.ppt