lesson.ppt
- Количество слайдов: 20


Хлорсутек сапалық реакция Хлорсутектің зертханада алу жолын, қасиеттерін меңгеру. Тұз қышқылының ортақ және өзіне тән қасиеттерін білу. Тұз қышқылы және хлоридтерді басқа заттардан ажырата білуге үйрету. Топтық “Іздесең – табасың Алыссаң – аласың” М. Әуезов

І. Ұйымдастыру ІІ. “Галогендер”, “Хлор” тақырыптарын пысықтау ІІІ. Жаңа сабақ Хлорсутек ( проблемалық сұрақтар) Тұз қышқылы (эксперименттік зерттеу) Хлоридтер (тірек – сызба, мәтінмен жұмыс) ІҮ. Деңгейлік тапсырма Ү. Бағалау ҮІ. Рефлексия ҮІІ. Үй тапсырмасы

ІІ. “Галогендер”, “Хлор” тақырыптарына арналған пысықтау сұрақтары 1. Галогендер периодтық жүйеде қай топ , қай топшада орналасқан (ҮІІ А топ) 2. Қаншасы табиғатта кездеседі ( 4 – еуі, жасанды жолмен алынады) 3. Галоген, галогенсутек, галогенидтердің химиялық байланыс типін анықтаңдар Қосылыс түрі Hal 2 HHal Тұздары Химиялық байланыс типі

№ 1 Проблемалық сұрақ Хлор молекуласы және хлорсутек молекуласындағы химиялық байланыс типі қандай? № 2 Проблемалық сұрақ Хлорсутектің химиялық байланыс типін біле отырып оның қандай физикалық қасиеттерін болжауға болады?

Хлорсутектің химиялық байланыс типін біле отырып, оның қандай физикалық қасиеттерін болжауға болады?
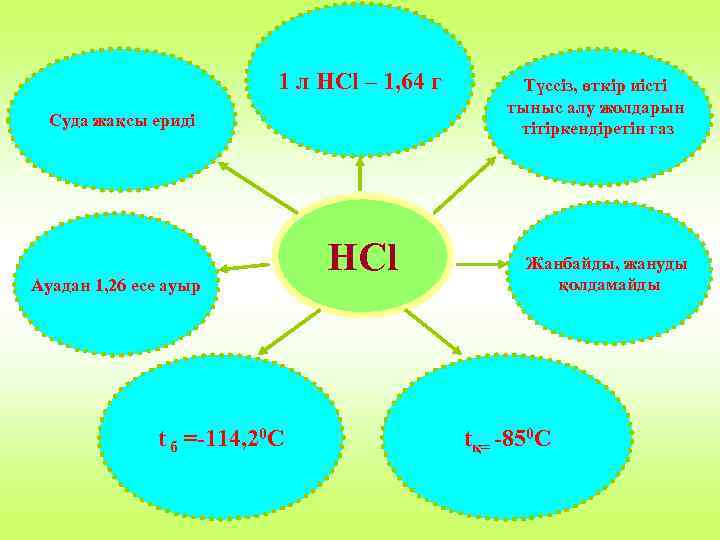
1 л HCl – 1, 64 г Суда жақсы ериді Ауадан 1, 26 есе ауыр t б =-114, 20 С HCl Түссіз, өткір иісті тыныс алу жолдарын тітіркендіретін газ Жанбайды, жануды қолдамайды tқ= -850 C

1. Қышқылдық қасиет тән емес 2. Сумен реакцияласады 1 VH 2 O – 500 V HCl 1 VH 2 O – 450 V HCl (Оо. С) (15 о С) 1 моль HCl – 17, 3 ккаль жылу

4. Табиғатта хлор қандай қосылыстар түрінде кездеседі. Неліктен бос күйінде кездеспейді? (Na. Cl, KCl ; КCl·Na. Cl; KCl·Na. Cl; КСl·Mg 2· 6 H 2 O)
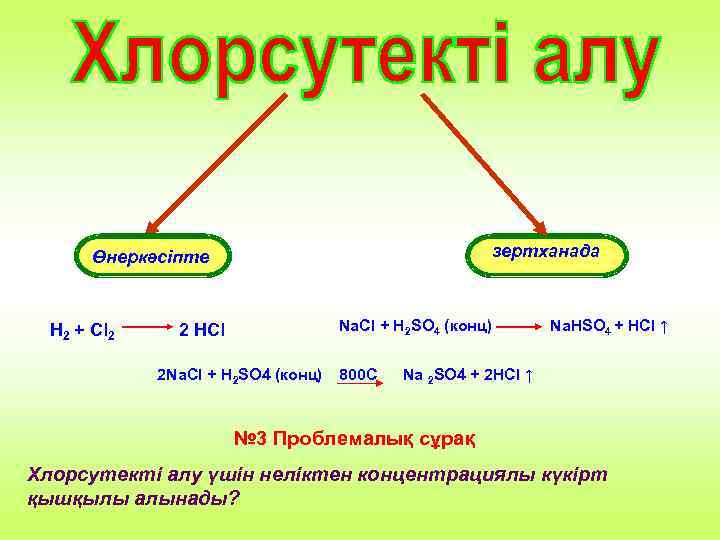
зертханада Өнеркәсіпте H 2 + Cl 2 2 HCl Na. Cl + H 2 SO 4 (конц) 2 Na. Cl + H 2 SO 4 (конц) 800 C Na. HSO 4 + HCl ↑ Na 2 SO 4 + 2 HCl ↑ № 3 Проблемалық сұрақ Хлорсутекті алу үшін неліктен концентрациялы күкірт қышқылы алынады?

( “спиритус салями”)
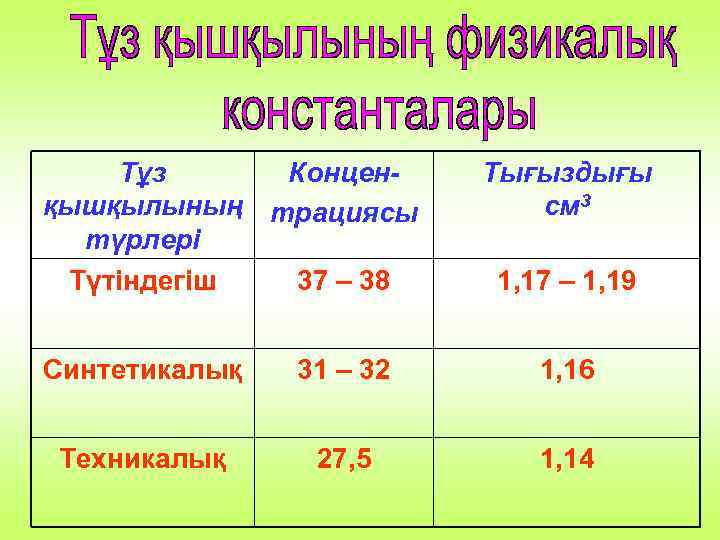
Тұз Конценқышқылының трациясы түрлері Түтіндегіш 37 – 38 Тығыздығы см 3 1, 17 – 1, 19 Синтетикалық 31 – 32 1, 16 Техникалық 27, 5 1, 14

І топ. әсері” “Тұз қышқылының индикаторларға ІІ топ. “Тұз оксидтермен ІІІ топ. “Тұз әрекеттесуі” қышқылының негіздік негіздермен

Тұз қышқылының ортақ химиялық қасиеттері 1. Индикаторларға әсер етеді Лакмус Тұз қышқылының өзіне тән химиялық қасиеттері 1. Металдармен Фенолфтамин метилоранж 2. Негіздік оксидтермен а) ә) 3. Негіздермен а) ә) 2. Күміс (1)нитраты мен (сапалық реакция)
Тұз қышқылының қолданылуы

(мәтінмен жұмыс) 1. Неліктен ас тұзы әрқашан алғашқы тағам ретінде қабылданады? 2. Қазақстанда ас тұзының қандай кең орындары бар? 3. “Алмас” деп нені атайды?

1) б реакциясы эндотермиялық әлде экзотермиялық 2) в реакциясы Mg химиялық байланыс типі 3) а реакциясы тотықсыздандырғышты анықта 4) г реакциясы НСl химиялық байланыс ІІІ деңгей ( 5 ұпай) Шыны ыдыс бірдей көлемде алынған хлор және сутек газдарымен толтырылды. Осы ыдыстың аузын тығындап күн сәулесіне қойғанда не байқалады? деген сұраққа , үш оқушы былай деп жауап берді: Арман: - Сутек жеңіл сондықтан ол жоғарыға көтеріледі Нұрлан: - Газдар араласады, бірақ ештеңе байқалмайды Аман: - Әрі тұрайық, қопарылыс болады! Қай оқушының пікіріне қосыласың?
Сипаттама Құрылысы тақырып хлорсутек тұз қышқылы Қасиеттері хлорсутек тұз қышқылы Қолданылуы хлоридтер тұз қышқылы барлығын түсіндік менің сұрақтарым бар түсінген жоқпын

& 70 6, 7, 8 есептер (196 б) (Хабарлама)

артқа
lesson.ppt