Лекция по ХП и раку ПЖ (2008)-2.ppt
- Количество слайдов: 71

Хирургическое лечение при хроническом панкреатите Новосибирский Государственный медицинский университет Кафедра госпитальной и детской хирургии

Анатомия поджелудочной железы (ПЖ)

Артерии ПЖ

Вены ПЖ

Определение хронического панкреатита (ХП) ХП – это хронический полиэтиологический воспалительно-дегенеративный процесс в ПЖ с клиническими проявлениями, которые включают боль, утрату экзокринной функции железы, сахарный диабет (СД) и различные осложнения со стороны ПЖ и смежных органов.

Этиология ХП – хронический алкоголизм; – заболевания билиарной системы; – посттравматическая обструкция протоков ПЖ; – курение; – аномалии развития ПЖ (например, pancreas divisum); – наследственная предрасположенность; – заболевания желудка, ДПК и БДС; – гиперпаратиреоидизм и др.

Патогенез и патоморфология ХП 1) Хронический обструктивный панкреатит; 2) Хронический кальцифицирующий панкреатит; 3) Аутоиммунный ХП; 4) Наследственный ХП; 5) Тропический ХП; 6) Идиопатический ХП (ювенильная и старческая формы).

Классификации ХП До настоящего времени нет общепринятой классификации ХП, которая бы отображала причины и суть заболевания, его течение, осложнения и влияла бы на выбор хирургической тактики. В настоящее время за рубежом используются несколько наиболее распространенных классификаций: Кембриджская, Марсельско-Римская, TIGAR-O.

Классификация ХП (Кембридж, 1984) – морфологическая характеристика ХП по данным инструментальных методов диагностики (ЭРХПГ, УЗИ, КТ) Степень выраженности ЭРХПГ Число симптомов УЗИ, КТ Норма ПЖ без патологических изменений Сомнительный < 3 пораженных Один из Расширенный ГПП (< 4 мм в внутриорганных симптомов: диаметре); увеличенная ПЖ протока (менее, чем двукратно); полостные образования (< 10 > 3 пораженных > 2 из мм); непостоянные контуры внутриорганных симптомов: протоков; неоднородность протока паренхимы; ослабленное эхо от Пораженный ГПП стенки протока; непостоянные и его ветви контуры головки и тела Легкий Средний Тяжелый Пораженный ГПП > 1 из Широкие полости (> 10 мм); и его ветви cимптомов: увеличение ПЖ (> двукратных размеров); внутрипротоковые дефекты наполнения или камни: обструкция протока; непостоянство изображения структуры или объема

В Марсельско-Римской классификации (1988) выделяют следующие формы ХП: обструктивный, кальцифицирующий и воспалительный (паренхиматозно-фиброзный). Одна из новых классификаций TIGAR-O (2001) категоризирует ХП на основании различных известных этиологических факторов и механизмов (TIGAR-O – токсико-метаболический, идиопатический, генетический, аутоиммунный, рецидивирующий тяжелый, обструктивный).

С учетом последних данных морфологии, диагностики и особенностей хирургического лечения ХП Н. Beger и М. Buchler (1990) предлагают также выделять форму, названную в литературе «головчатый панкреатит» (cephalic pancreatitis), или панкреатит с «воспалительной массой в головке» (inflamatory mass in the head of the pancreas). Термином «головчатый панкреатит» обозначают ХП, при котором наряду с клинической картиной по данным УЗИ и КТ определяются в динамике увеличение головки ПЖ более 4 см (максимально до 12 -15 см) и механическая желтуха или дуоденостеноз. В отечественной литературе это состояние известно как «индуративный» , или «псевдотуморозный» , панкреатит.

В 2004 г. С. Д. Добров и соавторами предложили следующую клиникоанатомическую классификацию ХП головки ПЖ: – ХП с преимущественным поражением головки (ХПППГ); – ХП с изолированным поражением головки (ХПИПГ); – псевдоопухолевый ХП; – кистозный ХП головки железы.

КТ при ХП с преимущественным поражением головки

ЭРХПГ при ХП с преимущественным поражением головки

КТ при ХП с изолированным поражением головки

ЭРХПГ при ХП с изолированным поражением головки

КТ при псевдоопухолевой форме ХП

ЭРХПГ при псевдоопухолевой форме ХП

МРХПГ при кистозной форме ХП

Эпидемиология ХП Средний возраст больных – 30 -50 лет (самый трудоспособный возраст). Соотношение мужчины : женщины = 4 : 1. Время от манифестации до операции от 1 до 20 лет, поскольку врачи слабо знают проявления ХП. Для данных больных характерны перенесенные операции по поводу острых хирургических заболеваний брюшной полости, а также госпитализация в инфекционное отделение в связи с поносами по типу «панкреатической холеры» , кровянистым калом.

Клинические проявления при ХП – боль (у 100% больных) рецидивирующего или постоянного характера, часто опоясывающая, – потеря массы тела (до 20 и более кг), – поносы, – тошнота, рвота, – механическая желтуха, – синдром портальной гипертензии (предпеченочный блок), – сахарный диабет.

У трети больных ХП развиваются осложнения (например, асцит, абсцессы, свищи ПЖ) с инвалидизацией в 15% случаев и летальностью, достигающей 5 -10%. Регистрируется также рост заболеваемости раком ПЖ, который развивается на фоне ХП. Развитие новообразований наблюдается примерно у 24% пациентов спустя 20 лет после манифестации заболевания, из которых у 4% – рак ПЖ, у 20% – злокачественные опухоли других локализаций.

Диагностика – оценка толерантности к глюкозе, – исследование внешнесекреторной функции (копрограмма, оценка содержания ферментов в соке ДПК), – ЭРХПГ, – МРХПГ, – УЗИ, – КТ. Дифференциальный диагноз проводится с опухолью ПЖ, язвенной болезнью желудка и ДПК, гастритом, ЖКБ, хроническим гепатитом.

Консервативное лечение и манипуляции: • препараты панкреатических ферментов; • ненаркотические и наркотические анальгетики; • блокады солнечного сплетения; • эндоскопическое стентирование панкреатического протока или сфинктеротомия; • другая медикаментозная терапия (применение октреотида, антиоксидантов). Однако, при ХП с выраженным болевым синдромом и осложнениями со стороны смежных органов, медикаментозная терапия не эффективна, и купировать болевой синдром можно лишь с помощью хирургического вмешательства.
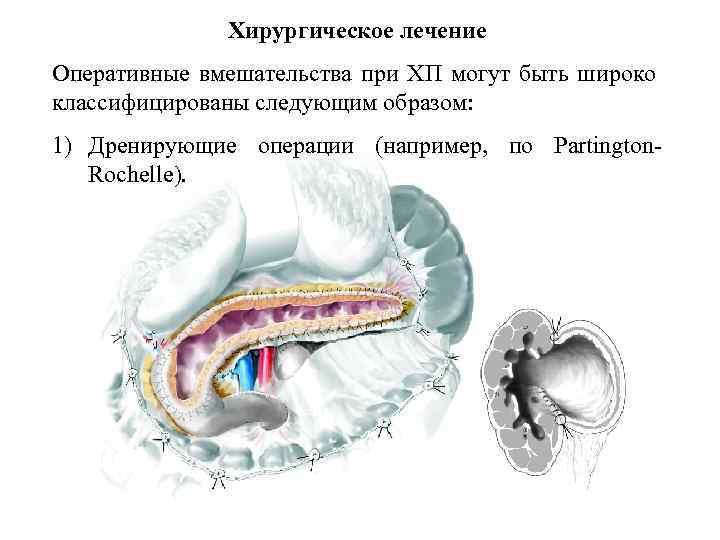
Хирургическое лечение Оперативные вмешательства при ХП могут быть широко классифицированы следующим образом: 1) Дренирующие операции (например, по Partington. Rochelle).
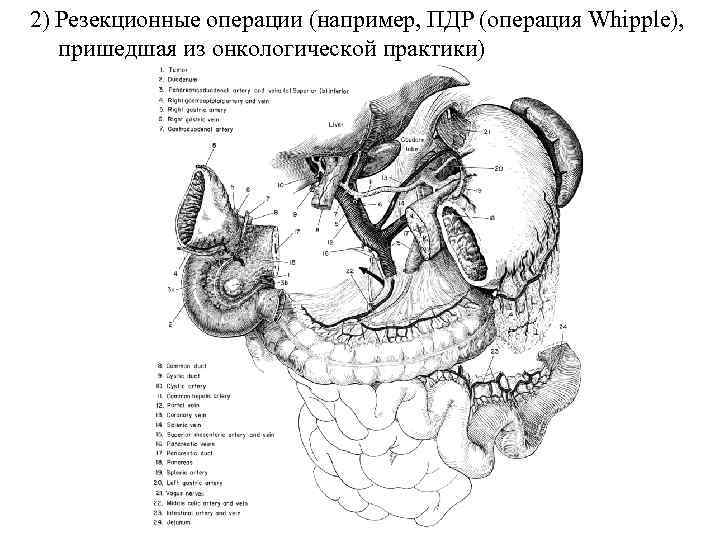
2) Резекционные операции (например, ПДР (операция Whipple), пришедшая из онкологической практики)
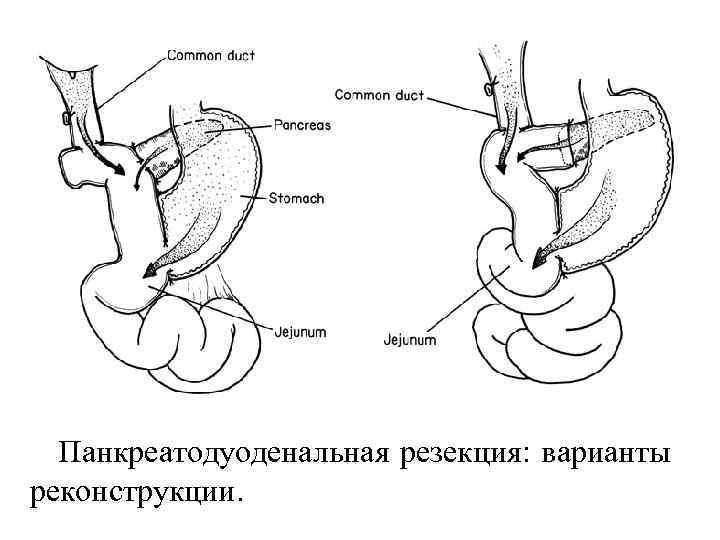
Панкреатодуоденальная резекция: варианты реконструкции.

3) Комбинированная операция – сочетание резекции с продленным дренированием (например, операции по Beger, Frey). Субтотальная резекция головки ПЖ с пересечением перешейка по Beger.

Удаление сердцевины головки ПЖ с продольным дренированием ГПП по Frey.

При данных операциях сохраняют желудок, ДПК и ОЖП. Противоболевой эффект этих операций очень высок. Однако, сложность операции по Beger (технически сложнее, чем ПДР) и недостаточное удаление воспалительных масс головки при операции по Frey, говорит об их несовершенстве. Самой современной операцией при ХП с преимущественным поражением головки ПЖ является субтотальная резекция головки ПЖ без пересечения перешейка в сочетании с продольным дренированием ГПП или без него (в случае ХП с изолированным поражением головки ПЖ).

Cубтотальная ИРГПЖ с сохранением перешейка и продольным панкреатоеюноанастомозом (оригинальная операция) I вариант (при ХПППГ)

Cубтотальная ИРГПЖ с сохранением перешейка и проксимальным ПЕА (оригинальная операция) II вариант (при ХПИПГ)

Цистоеюностомия на У-образно выключенной петле (нужна «зрелая» стенка кисты)

Цистогастростомия (можно выполнять при «незрелой» стенке кисты)

ЭНДОКРИННЫЕ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Новосибирский Государственный медицинский университет Кафедра госпитальной и детской хирургии

Диагностика функционирующих эндокринных опухолей ПЖ довольна трудна, поскольку они встречаются весьма редко, клиницисты часто забывают подумать о них. Эндокринные опухоли подразделяют на: - функционирующие (выделяют гормоны); - нефункционирующие (не выделяют); - доброкачественные; - злокачественные. Злокачественность эндокринной опухоли определяется не ее гистопатологическими характеристиками, а наличием локальной инвазии (например, прорастанием в сосуды) или метастазированием.

ИНСУЛИНОМА Инсулинома – самая частая функционирующая эндокринная опухоль ПЖ (инсулин продуцируется β -клетками островков Лангерганца), частота которой среди других эндокринных опухолей составляет до 60% и более. Опухоль встречается немного чаще у женщин, чем у мужчин, и обычно выявляется у пациентов 40 -50 лет. В большинстве случаев инсулиномы – это небольшие, солитарные, доброкачественные поражения.

Клиническая картина Избыток инсулина способствует гипогликемии. Характерны признаки гипогликемии двух типов: 1) нейрогликопенический тип (головные боли, нечеткое зрение, забывчивость, припадки, моторная дискоординация, трудности с речью и направленными движениями, вплоть до комы); 2) симпатоадреналовый тип (чрезмерное потоотделение, слабость, тахикардия, дрожь, чувство страха и нервозность). Прием пищи обычно уменьшает нейрогликопенические и симпатоадреналовые симптомы. Пациенты с инсулиномой много едят и часто отмечают увеличение массы тела.
![Диагностика Триада Виппля [Whipple]: 1) индукция признаков гипогликемии после ограничения приема пищи или физических Диагностика Триада Виппля [Whipple]: 1) индукция признаков гипогликемии после ограничения приема пищи или физических](https://present5.com/presentation/14474428_131555820/image-39.jpg)
Диагностика Триада Виппля [Whipple]: 1) индукция признаков гипогликемии после ограничения приема пищи или физических упражнений; 2) характерное снижение уровня глюкозы плазмы крови; 3) уменьшение симптомов после перорального или внутривенного введения глюкозы. Радиоиммунологическое исследование повышенного уровня инсулина сыворотки крови (в норме: 2, 6 – 24, 9 мк. Е/мл) по сравнению с уровнем глюкозы. 25% инсулинóм не выявляется даже во время операции, несмотря на полное хирургическое обследование поджелудочной железы.

Предоперационное определение локализации опухоли (УЗИ, КТ, МРТ) не всегда могут определить локализацию инсулинóм, вследствие их малых размеров. Более эффективны такие методы обследования как: – селективная ангиография ПЖ (инсулиномы очень хорошо васкуляризированы); – чрескожный чреспеченочный порто-венозный сэмплинг (контроль уровня инсулина селективно в венах ПЖ); – внутриартериальная стимуляция кальцием с печено-венозным сэмплингом (селективная инфузия препарата кальция (как стимулятора) в ветви чревного ствола и верхней брыжеечной артерии с осуществлением забора крови из печеночных вен для выявления инсулина). Это инвазивные, дорогие и технически сложные процедуры должны применяться при безуспешности других исследований. Эндоскопическое УЗИ (ЭУЗИ) хорошо выявляет опухоль в головке ПЖ. Интраоперационное УЗИ в комбинации с пальпацией ПЖ во время операции могут помочь локализовать 95 -100% инсулинóм.

ЭУЗИ инсулиномы.

Лечение Адекватное лечение при инсулиноме – оперативное удаление опухоли: – энуклеация (аденом); – дистальная резекция ПЖ (при локализации в хвосте); – ПДР (при большой опухоли в головке ПЖ, поскольку высока возможность малигнизации). У больных с метастазами инсулиномы осуществляют резекцию опухоли и метастазов, чтобы уменьшить симптомы гипогликемии. Выживаемость при этом довольно продолжительна (примерно 4 года). Химиотерапия при злокачественных инсулиномах: стрептозоцин в комбинации с 5 -фторурацилом или доксорубицином.

ГАСТРИНОМА (СИНДРОМ ЗОЛЛИНГЕРА-ЭЛЛИСОНА) Гастриномы – самые частые функционирующие, как правило, злокачественные (в 70% случаев) эндокринные опухоли ПЖ. Несколько чаще встречаются у мужчин, средний возраст начала заболевания – 50 лет.

Клиническая картина – синдром Золлингера-Эллисона: – фульминантная болезнь пептических язв (высокий уровень гастрина стимулирует париетальные клетки желудка, приводя к продукции больших объемов желудочного сока, содержащего высокую концентрацию соляной кислоты), – диарея (вследствие неспособности кишечника абсорбировать большие объемы жидкости, секретированной желудком, кислотное повреждение слизистой оболочки тощей кишки, осаждение желчных солей и инактивация панкреатической липазы при снижении p. H), – сочетание этих признаков. Синдром Золлингера-Эллисона следует заподозрить у тех пациентов, у которых развиваются рецидивирующие пептические изъязвления после адекватной медикаментозной терапии или общепринятых операций. Это особенно справедливо, если рецидивирующая язва развивается в раннем послеоперационном периоде.

Диагностика Радиоиммунологическое исследование (уровень циркулирующего гастрина (в норме: менее 100 пг/мг) неадекватно высок по сравнению с уровнем секреции кислоты в желудке). Большинство гастринóм (70 -90%) обнаруживают в так называемом треугольнике гастринóм. Это анатомическая область, ограниченная точкой слияния пузырного протока и ОЖП, перешейком ПЖ, а также местом соединения второй и третьей частей ДПК. При обычной ревизии ДПК дуоденальные гастриномы идентифицируются в 2 раза чаще, чем гастриномы ПЖ.

Треугольник гастринóм. ВБА – верхняя брыжеечная артерия; ВБВ – верхняя брыжеечная вена.

Предоперационное определение локализации опухоли: – УЗИ, – КТ, – МРТ, – селективная висцеральная ангиография, – селективный венозный сэмплинг из ветвей воротной вены, – внутриартериальная инфузия секретина с печеночно-венозным сэмплингом гастрина, – ФЭГДС. Новые методики включают: – сцинтиграфию рецепторов соматостатина – СРС (инфузия радиомаркированной формы аналога соматостатина – октреотида [ «Октреоскан» ] может выявить гастриному с высокоаффинными рецепторами соматостатина), – ЭУЗИ (часта локализация в головке ПЖ). Если гастринома не выявлена до операции, должна быть предпринята хирургическая ревизия с интраоперационной пальпацией, УЗИ и эндоскопией с трансиллюминацией ДПК.

СРС при гастриноме показывает первичную опухоль (стрелка) и метастазы в печень.

Лечение Классическое лечение при синдроме Золлингера-Эллисона – гастрэктомия (для удаления всей кислото-продуцирующей зоны). В настоящее время эффективна медикаментозная терапия (ингибиторы протонной помпы). Поскольку ингибиторы протонной помпы могут эффективно контролировать гиперсекрецию желудочной кислоты, пациенты теперь умирают в результате метастатической болезни, а не болезни пептических язв. Аналоги соматостатина, типа октреотида, уменьшают связанные с повышенной кислотностью симптомы гастринóм и могут стабилизировать прогрессирование метастатической болезни. Однако, поскольку гастринома – это опухоль, да еще и, в основном, злокачественная радикальным способом лечения является ее резекция.

Циторедуктивная операция, включая резекцию первичной опухоли и печеночных метастазов, может облегчить симптомы и помочь увеличить выживаемость в данной группе пациентов. Альтернативные подходы к лечению при печеночных метастазах: – радиочастотная абляция, – криоабляция, – эмболизация печеночной артерии или химиоэмболизация; – ортотопическая трансплантация печени. Химиотерапия: стрептозоцин и 5 -фторурацил с или без доксорубицина.

ГЛЮКАГОНОМА Глюкагономы – редкие, часто крупные (>4 см) опухоли из α-клеток островков Лангерганца, расположенные в пределах ПЖ. Возраст пациентов около 40 лет и более, с одинаковым распределением между полами. Большинство опухолей (60 -70%) являются злокачественным.

Клиническая картина – сахарный диабет легкой степени, – некролитическая мигрирующая эритема (встречается у 70% пациентов), – глоссит и стоматит, – потеря веса, – общая слабость, – диарея, – артериальный и венозный тромбоз (тромбоз глубоких вен встречается у 30% пациентов), – неврологические проявления (атаксия, деменция, слабость проксимальных мышц).

Некролитическая мигрирующая эритема – это циклически развивающаяся сыпь (продолжительность цикла 1 -2 недели) в области стоп, голеней, рук, ягодиц, промежности или периоральной области: сначала – эритематозные макулы или папулы, затем – пузыри (напоминает ожог кипятком), а затем – эрозии и корки с последующим заживлением. Дифференциальный диагноз проводится с пеллагрой, квашиоркором, токсическим эпидермальным некролизом и пустулярным псориазом.

Некролитическая мигрирующая эритема.

Лабораторные данные: – повышение уровня глюкозы плазмы крови, – нормохромная нормоцитарная анемия, – генерализованное уменьшение уровня аминокислот плазмы крови (в связи со стимуляцией глюконеогенеза).

Диагностика Радиоиммунологическое исследование – повышение уровня циркулирующего глюкагона (выше 500 пг/мл ) подтверждает диагноз. Методики предоперационного определения локализации опухоли: – КТ брюшной полости с контрастным усилением (глюкогонома – крупная, хорошо выявляемая опухоль), – ЭУЗИ (полезна при небольших опухолях). Другие методики визуализации, типа СРС, ангиографии и порто-венозного сэмплинга, являются очень чувствительными, но редко необходимы.

Лечение Радикальное лечение – хирургическое удаление опухоли. В плане предоперационной подготовки: – пищевые добавки, восполняющие дефицит аминокислот и другие метаболические дефициты (в связи с длительным и глубоким катаболическим статусом), – аналоги соматостатина (уменьшают уровень циркулирующего глюкагона и его эффекты).

Операция: Дистальная резекция ПЖ (большинство опухолей расположены в теле и хвосте железы) Циторедуктивная операция, включая резекцию первичной опухоли и печеночных метастазов, может облегчить симптомы и помочь увеличить выживаемость в данной группе пациентов, поскольку глюкогонома обладает медленным ростом. При метастазах в печень также применяют: - резекцию печени, - эмболизацию печеночной артерии, - трансплантацию печени. Химиотерапия – дакарбазин и стрептозоцин (при метастазах глюкагономы).
![ВИПома Продуцирует вазоинтестинальный пептид (ВИП). Синонимы: синдром Вернера-Моррисона [Verner -Morrison], панкреатическая холера и аббревиатура ВИПома Продуцирует вазоинтестинальный пептид (ВИП). Синонимы: синдром Вернера-Моррисона [Verner -Morrison], панкреатическая холера и аббревиатура](https://present5.com/presentation/14474428_131555820/image-59.jpg)
ВИПома Продуцирует вазоинтестинальный пептид (ВИП). Синонимы: синдром Вернера-Моррисона [Verner -Morrison], панкреатическая холера и аббревиатура ВДГА (водянистая диарея, гипокалиемия и ахлоргидрия). ВИПомы – редкие опухоли (1 случай на 10 миллионов популяции в год). Возраст пациентов – 40 -50 лет. Встречаются, в основном, в хвосте ПЖ. Часто крупные и имеют метастазы в печень к моменту выявления. 10% опухолей могут быть выявлены вне ПЖ (в ободочной кишке, бронхах, надпочечниках, печени и симпатических ганглиях).

Клиническая картина – профузная секреторная диарея (до 10 л в день, кал без запаха, цвета чая, сохраняется несмотря на ограничение пищи), – гипокалиемия (вследствие диареи), – ацидоз (вследствие диареи). Дефицит жидкости и электролитов при ВИПоме настолько глубок, что он подлежит коррекции перед переходом к процессу диагностики и лечения.

Диагностика У этих пациентов часто идет поиск других, более частых, причин диареи. Среднее время от появления первых симптомов до постановки диагноза – 3 года. Радиоиммунологическое исследование – повышенный уровень ВИП в сыворотке крови (более 200 пг/мл). Методики предоперационного определения локализации опухоли: - СРС, - КТ (большие размеры (> 3 см) опухоли.

КТ-сканограмма ВИПомы.

Лечение Хирургическое лечение – единственное радикальное мероприятие при этой опухоли. Перед операцией у пациентов должен быть адекватно восполнен дефицит жидкости в организме и скоррегированы электролитные нарушения. Аналог соматостатина – октреотид – устраняет диарею. Операция: Дистальная резекция ПЖ (большинство опухолей расположены в теле и хвосте железы) Циторедуктивная операция, включая резекцию первичной опухоли и печеночных метастазов, может облегчить симптомы и помочь увеличить выживаемость в данной группе пациентов. Химиотерапия – стрептозоцин (при метастазах ВИПомы).

СОМАТОСТАТИНОМА Самая редкая из эндокринных опухолей ПЖ, производная дельта-клеток островков Лангерганца. Средний возраст пациентов 50 лет, с равным распределением между полами. Большинство соматостатинóм являются злокачественными.

Клиническая картина Классическая тетрада: – сахарный диабет (легкая гипергликемия вследствие ингибирования секреции инсулина), – холелитиаз (уменьшенная сократительная способность ЖП вследствие ингибирования холецистокинина), – стеаторея (ингибирование панкреатических ферментов), – диарея (ингибирование секреции бикарбонатов и кишечного всасывания). Эти симптомы не выражены, неспецифичны и относительно часты в популяции, поэтому соматостатинома плохо диагностируется. У пациентов с дуоденальными соматостатиномами наблюдаются обструктивные симптомы: боль в животе и желтуха.

Диагностика Эти опухоли часто случайно обнаруживают во время операции. Радиоиммунологическое исследование – повышение уровня соматостатина сыворотки крови (выше 100 пг/мл) – помогает подтвердить диагноз. Методики предоперационного определения локализации опухоли: КТ и УЗИ (опухоль довольно крупная, локализуется, в основном, в головке ПЖ). При небольшом размере опухоли: - ЭУЗИ, - МРТ, - СРС.

Лечение Большинство соматостатинóм уже имеют метастазы во время манифестации. Циторедуктивная операция, включая резекцию первичной опухоли и печеночных метастазов, может облегчить симптомы и помочь увеличить выживаемость в данной группе пациентов. Во время операции должна быть выполнена холецистэктомия из-за высокой частоты холелитиаза. При нерезектабельных случаях октреотид может облегчить симптомы. В целом, прогноз неблагоприятный.

НЕФУНКЦИОНИРУЮЩИЕ НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ ПЖ Нефункционирующие нейроэндокринные опухоли ПЖ самые многочисленные (до 25% от всех опухолей клеточных островков). Возраст пациентов 40 -50 лет с равным распределением между полами. Отсутствие функции, возможно, является некорректным термином, поскольку эти опухоли неотличимы при патогистологическом анализе от функционирующих опухолей.

Клиническая картина Из-за отсутствия гормональной манифестации, эти опухоли часто проявляются поздно при наличии уже большой опухолевой массы и метастазов. Жалобы на локальные симптомы сдавления (симулирует рак ПЖ): - боль в животе, - потеря массы тела, - желтуха. Однако, аденокарцинома ПЖ обычно меньше размером, и если поражение больше 4 -5 см в размере, должна быть заподозрена нефункционирующая опухоль островковых клеток ПЖ.

Диагностика - КТ, - МРТ, - ЭУЗИ с биопсией. В отличие от аденокарциномы, эти опухоли не прорастают в окружающие сосудистые структуры или желчные протоки на ранних стадиях своего течения.

Лечение – ПДР (при опухолях головки ПЖ), – дистальная резекция ПЖ (при опухолях тела и хвоста). Поскольку биологические свойства нефункционирующих опухолей противоречивы, способ идеального лечения для небольших опухолей остается неясен. Считают, что для опухолей менее 2 см, которые были случайно идентифицированы, энуклеация может послужить адекватным контролем заболевания.
Лекция по ХП и раку ПЖ (2008)-2.ppt