Химиялы байланысты қ ң таби аты ғ




















himiyalyқ_baylanystyң_valenttіlіgі.ppt
- Размер: 643.5 Кб
- Автор:
- Количество слайдов: 23
Описание презентации Химиялы байланысты қ ң таби аты ғ по слайдам
 Химиялы байланысты қ ң таби аты ғ Орында ан ғ : Амитова Н Б Б-301 Қ
Химиялы байланысты қ ң таби аты ғ Орында ан ғ : Амитова Н Б Б-301 Қ
 Жоспар : • Химиялы байланыстарды т рлеріқ ң ү • Ионды байланыс қ • Ковалентті байланыс • Сутектік байланыс • Металды байланыс қ
Жоспар : • Химиялы байланыстарды т рлеріқ ң ү • Ионды байланыс қ • Ковалентті байланыс • Сутектік байланыс • Металды байланыс қ
 Химиялы байланыс т зілген кезде қ ү атомдарды электронды рылымы ң қ құ згеріске шырайды. ө ұ Атомдарды электронды рылымы ң қ құ ана рлым т ра ты ғұ ұ қ бол ан жа дайда ғ ғ ана химиялы байланыс т зіледі. ғ қ үХимиялы байланыс т зілуде е басты рольді қ ү ң электрондар ат арады. қ
Химиялы байланыс т зілген кезде қ ү атомдарды электронды рылымы ң қ құ згеріске шырайды. ө ұ Атомдарды электронды рылымы ң қ құ ана рлым т ра ты ғұ ұ қ бол ан жа дайда ғ ғ ана химиялы байланыс т зіледі. ғ қ үХимиялы байланыс т зілуде е басты рольді қ ү ң электрондар ат арады. қ
 Сырт ы электронды абатық қ қ ns 2 np 6 типті бол ан жа дайда электронды октет ж не 1 s ғ ғ ә 2 ая тал ан, қ ғ ана рлым т ра ты ғұ ұ қ болады. Бас а элементті атомдары химиялы байланыс қ ң қ т зу кезінде осындай электронды рылым ү қ құ т зуге ү мтылады. Атомдар арасында т ра ты ұ ұ қ (ая тал ан) электронды рылымда болатын қ ғ қ құ е ма ызды екі т рлі химиялы байланысты ң ң ү қ ң т рі ионды (электровалентті) ж не ковалентті ү қ ә байланыс бар.
Сырт ы электронды абатық қ қ ns 2 np 6 типті бол ан жа дайда электронды октет ж не 1 s ғ ғ ә 2 ая тал ан, қ ғ ана рлым т ра ты ғұ ұ қ болады. Бас а элементті атомдары химиялы байланыс қ ң қ т зу кезінде осындай электронды рылым ү қ құ т зуге ү мтылады. Атомдар арасында т ра ты ұ ұ қ (ая тал ан) электронды рылымда болатын қ ғ қ құ е ма ызды екі т рлі химиялы байланысты ң ң ү қ ң т рі ионды (электровалентті) ж не ковалентті ү қ ә байланыс бар.
 Ионды химиялы байланыс қ қ электртерістілігі бойынша айырмашылы ы лкен металл мен ғ ү бейметалл атомдары арасында т зіледі. ү Ионды химиялы байланыс арама қ қ қ – арсы зарядтал ан иондарды қ ғ ң электростатикалы тартылысы қ н тижесінде ж зеге асады. ә ү
Ионды химиялы байланыс қ қ электртерістілігі бойынша айырмашылы ы лкен металл мен ғ ү бейметалл атомдары арасында т зіледі. ү Ионды химиялы байланыс арама қ қ қ – арсы зарядтал ан иондарды қ ғ ң электростатикалы тартылысы қ н тижесінде ж зеге асады. ә ү
 Ионды байланыс теориясын қ 1916 жылы неміс алымы ғ В. Коссель сын ан болатын. Б л ұ ғ ұ теория типтік металдар мен типтік бейметалдар атомдары арасында: Cs. F, Cs. Cl, Na. Cl, KF, KCl, Na 2 O, Ca. O т зілетін ү байланысты т сіндіреді. Осы ү теория а байланысты ионды ғ қ байланысты т зілу кезінде ң ү типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды осып алады. қКОССЕЛЬ ( Kossel), Вальтер 1888 – 1956 ж. ж.
Ионды байланыс теориясын қ 1916 жылы неміс алымы ғ В. Коссель сын ан болатын. Б л ұ ғ ұ теория типтік металдар мен типтік бейметалдар атомдары арасында: Cs. F, Cs. Cl, Na. Cl, KF, KCl, Na 2 O, Ca. O т зілетін ү байланысты т сіндіреді. Осы ү теория а байланысты ионды ғ қ байланысты т зілу кезінде ң ү типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды осып алады. қКОССЕЛЬ ( Kossel), Вальтер 1888 – 1956 ж. ж.
 Металдар химиялы рекеттесуде валенттік қ ә электрондарын беріп, о зарядты иондар а (катиондар а): ң ғ ғ Na 0 – e = Na + Бейметалдар электрондар осып алып, теріс зарядты қ иондар а (аниондар а) айналады: ғ ғ Cl 0 + e = Cl -. р аттас зарядты Ә иондар бірін-бірі тартып молекула райды: құ
Металдар химиялы рекеттесуде валенттік қ ә электрондарын беріп, о зарядты иондар а (катиондар а): ң ғ ғ Na 0 – e = Na + Бейметалдар электрондар осып алып, теріс зарядты қ иондар а (аниондар а) айналады: ғ ғ Cl 0 + e = Cl -. р аттас зарядты Ә иондар бірін-бірі тартып молекула райды: құ
 Иондар т зілу ар ылы ж зеге асатын байланыстарды ү қ ү ионды байланыс, осылысты зін ионды осылыс қ қ ң ө қ қ деп атайды. Ионды қ осылыстарды қ ң айнау, қ бал у қ температурасы жо ары, ғ ызу а қ ғ т ра ты, ұ қ олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жа сы ткізеді. қ ө
Иондар т зілу ар ылы ж зеге асатын байланыстарды ү қ ү ионды байланыс, осылысты зін ионды осылыс қ қ ң ө қ қ деп атайды. Ионды қ осылыстарды қ ң айнау, қ бал у қ температурасы жо ары, ғ ызу а қ ғ т ра ты, ұ қ олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жа сы ткізеді. қ ө
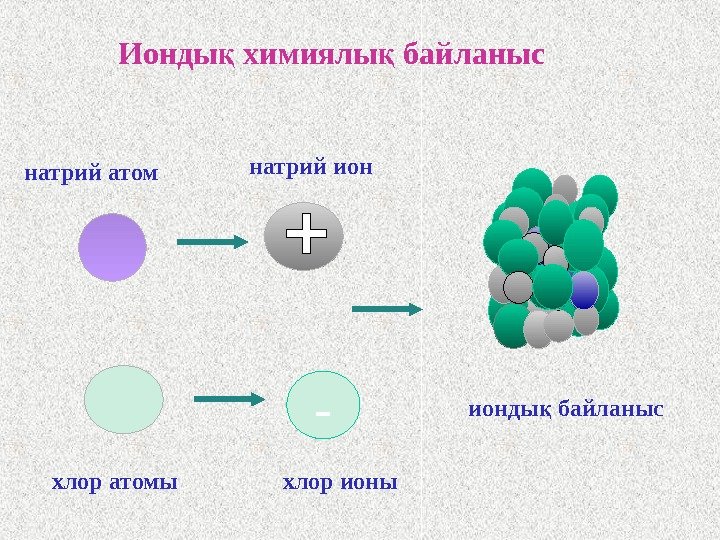
 натрий атом -Ионды химиялы байланыс қ қ натрий ион хлор атомы хлор ионы ионды байланыс қ
натрий атом -Ионды химиялы байланыс қ қ натрий ион хлор атомы хлор ионы ионды байланыс қ
 Ионды осылыстар молекуласында ы барлы қ қ ғ қ иондар зарядтарыны алгебралы осындысы ң қ қ н лге те болу ажет. Осы ан байланысты кез ө ң қ ғ келген молекула электр бейтарап б лшек болып ө табылады.
Ионды осылыстар молекуласында ы барлы қ қ ғ қ иондар зарядтарыны алгебралы осындысы ң қ қ н лге те болу ажет. Осы ан байланысты кез ө ң қ ғ келген молекула электр бейтарап б лшек болып ө табылады.
 Ковалентті байланыс – б л атомдар ұ арасында орта электронды ж п қ қ ұ есебінен ж зеге асырылатын ү химиялы байланыс. қ Ковалентті химиялы байланыста электрон қ ж быны атомдарды арасында орналасуына ұ ң ң арай қ полюсті ж неә полюссіз деп екіге б лінеді. ө
Ковалентті байланыс – б л атомдар ұ арасында орта электронды ж п қ қ ұ есебінен ж зеге асырылатын ү химиялы байланыс. қ Ковалентті химиялы байланыста электрон қ ж быны атомдарды арасында орналасуына ұ ң ң арай қ полюсті ж неә полюссіз деп екіге б лінеді. ө
 Джильбер Льюис Ковалентті байланыс теориясын 1916 жылы американды алым қ ғ Джильбер Льюис сынды. Осы ұ теория а ғ сай, ковалентті байланыс т зілуіні негізгі ү ң себебі атомдар арасында орта қ электронды ж пты т зілуі қ ұ ң ү болып табылады. Ковалентті байланыс жай зат молекулалары арасында ( H 2 ) , Cl 2 , O 2 , N 2 ж не ә р т рлі бейметалдар атомдары ә ү арасында (HCl, H 2 O, PCl 3 , NH 3 CO 2 т зіледі ү.
Джильбер Льюис Ковалентті байланыс теориясын 1916 жылы американды алым қ ғ Джильбер Льюис сынды. Осы ұ теория а ғ сай, ковалентті байланыс т зілуіні негізгі ү ң себебі атомдар арасында орта қ электронды ж пты т зілуі қ ұ ң ү болып табылады. Ковалентті байланыс жай зат молекулалары арасында ( H 2 ) , Cl 2 , O 2 , N 2 ж не ә р т рлі бейметалдар атомдары ә ү арасында (HCl, H 2 O, PCl 3 , NH 3 CO 2 т зіледі ү.
 Полюссіз ковалентті химиялы қ байланысты молекулада электрон ж бы ұ атом а ауыспай, симметриялы т рде ғ ү ортада орналасады. Полюссіз химиялы қ байланыста ы осылыстарды айнау ғ қ ң қ ж не бал у температуралары т мен, ә қ ө полюсті еріткіштерде иондар т збейді, ү электр то ын ткізбейді. ғ ө
Полюссіз ковалентті химиялы қ байланысты молекулада электрон ж бы ұ атом а ауыспай, симметриялы т рде ғ ү ортада орналасады. Полюссіз химиялы қ байланыста ы осылыстарды айнау ғ қ ң қ ж не бал у температуралары т мен, ә қ ө полюсті еріткіштерде иондар т збейді, ү электр то ын ткізбейді. ғ ө
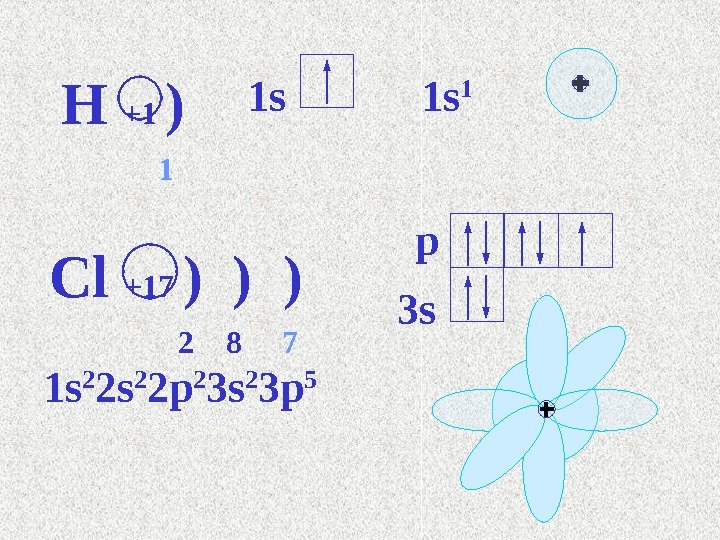
 Сутек атомыны электронды формуласы 1 sң қ 1. Сутекті электртерістілігі 2, 1. ң S – электрондарыны электрон б лттары сфера (шар) ң ұ т різді, оларды зара серлесуін былай ә ң ө ә к рсетуге болады: ө сонда s электрондарыны б лттары зара абысып, ң ұ ө қ екі электрон екі ядро а да орта , олардан бірдей ғ қ ашы ты та орналасады. қ қ қ
Сутек атомыны электронды формуласы 1 sң қ 1. Сутекті электртерістілігі 2, 1. ң S – электрондарыны электрон б лттары сфера (шар) ң ұ т різді, оларды зара серлесуін былай ә ң ө ә к рсетуге болады: ө сонда s электрондарыны б лттары зара абысып, ң ұ ө қ екі электрон екі ядро а да орта , олардан бірдей ғ қ ашы ты та орналасады. қ қ қ
 Сутегі молекуласында ы атомдарды сталып ғ ң ұ т р ан к штеріні таби атын ал аш 1927 ұ ғ ү ң ғ ғ жылы а ылшын алымдары Гейтлер мен ғ ғ Лондон квантты механика т р ысынан қ ұ ғ т сіндірді. Олар Шредингер те деуі бойынша ү ң байланысты екі сипатын — энергия мен ядро ң аралы зынды ты есептеді. Сутегі қ ұ қ молекуласы т рт микроб лшектен т рады. Екі ө ө ұ атом бір – біріне жа ында ан кезде тартылыс қ ғ к ші, ал екі ядро мен екі электрон арасында ү тебілу к ші пайда болады. Осы тартылыс ж не ү ә тебілу к ші те ескен жа дайда молекула ү ң ғ т ра ты к йге келеді. ұ қ ү
Сутегі молекуласында ы атомдарды сталып ғ ң ұ т р ан к штеріні таби атын ал аш 1927 ұ ғ ү ң ғ ғ жылы а ылшын алымдары Гейтлер мен ғ ғ Лондон квантты механика т р ысынан қ ұ ғ т сіндірді. Олар Шредингер те деуі бойынша ү ң байланысты екі сипатын — энергия мен ядро ң аралы зынды ты есептеді. Сутегі қ ұ қ молекуласы т рт микроб лшектен т рады. Екі ө ө ұ атом бір – біріне жа ында ан кезде тартылыс қ ғ к ші, ал екі ядро мен екі электрон арасында ү тебілу к ші пайда болады. Осы тартылыс ж не ү ә тебілу к ші те ескен жа дайда молекула ү ң ғ т ра ты к йге келеді. ұ қ ү
 H +1 ) 1 1 s 1 s
H +1 ) 1 1 s 1 s
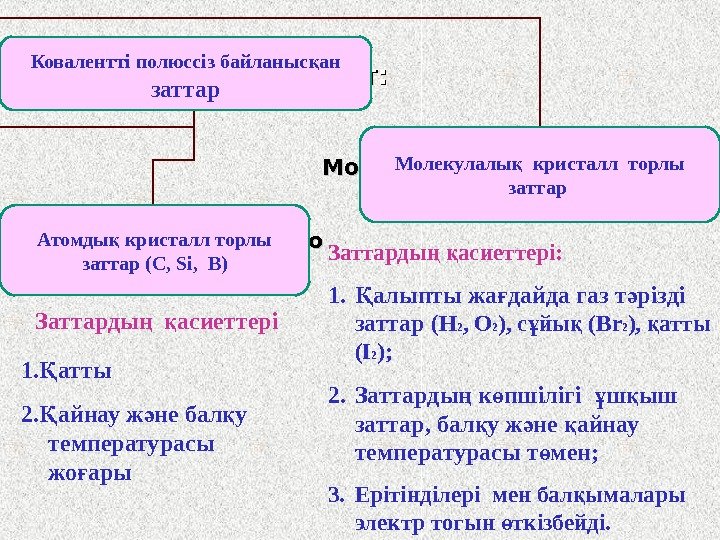
 Вещества с КНС имеют: Атомную кристаллическую решетку ( C, Si, B) Молекулярную кристаллическую решетку (( все остальные) 1. аттыҚ 2. айнау ж не бал у Қ ә қ температурасы жо ары ғ Заттарды асиеттері: ң қ 1. алыпты жа дайда газ т різді Қ ғ ә заттар ( H 2 , O 2 ) , с йы ( ұ қ Br 2 ), атты қ ( I 2 ); 2. Заттарды к пшілігі ш ыш ң ө ұ қ заттар, бал у ж не айнау қ ә қ температурасы т мен; ө 3. Ерітінділері мен бал ымалары қ электр тогын ткізбейді. өЗаттарды асиеттері ң қКовалентті полюссіз байланыс ан қ заттар Атомды кристалл торлы қ заттар (С , Si, B) Молекулалы кристалл торлы қ заттар
Вещества с КНС имеют: Атомную кристаллическую решетку ( C, Si, B) Молекулярную кристаллическую решетку (( все остальные) 1. аттыҚ 2. айнау ж не бал у Қ ә қ температурасы жо ары ғ Заттарды асиеттері: ң қ 1. алыпты жа дайда газ т різді Қ ғ ә заттар ( H 2 , O 2 ) , с йы ( ұ қ Br 2 ), атты қ ( I 2 ); 2. Заттарды к пшілігі ш ыш ң ө ұ қ заттар, бал у ж не айнау қ ә қ температурасы т мен; ө 3. Ерітінділері мен бал ымалары қ электр тогын ткізбейді. өЗаттарды асиеттері ң қКовалентті полюссіз байланыс ан қ заттар Атомды кристалл торлы қ заттар (С , Si, B) Молекулалы кристалл торлы қ заттар
 Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон ж быны ұ ң б лты электртерістігі басым элемент ұ атомына арай ы ыса орналас ан қ ғ қ байланыс. Молекуланы полюстілігі ң диполь моменті ар ылы к рсетіледі. қ ө Полюсті молекулаларды айнау ж не ң қ ә бал у температурасы т мен, полюсті қ ө еріткіштерде йектеліп иондар а ү ғ ыдырайды.
Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон ж быны ұ ң б лты электртерістігі басым элемент ұ атомына арай ы ыса орналас ан қ ғ қ байланыс. Молекуланы полюстілігі ң диполь моменті ар ылы к рсетіледі. қ ө Полюсті молекулаларды айнау ж не ң қ ә бал у температурасы т мен, полюсті қ ө еріткіштерде йектеліп иондар а ү ғ ыдырайды.
 1 s 1 s 1 Cl +17 ) ) ) 2 8 7 3 s p 1 s 2 2 p 2 3 s 2 3 p 5 H +1 )
1 s 1 s 1 Cl +17 ) ) ) 2 8 7 3 s p 1 s 2 2 p 2 3 s 2 3 p 5 H +1 )
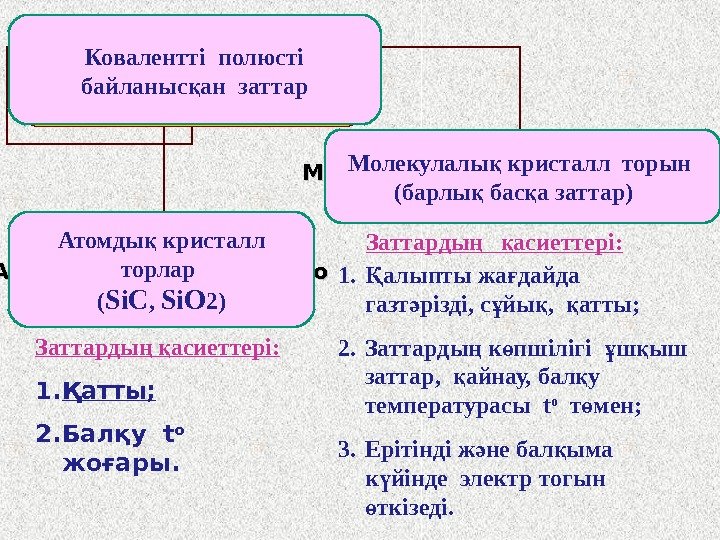
 Вещества с КПС имеют: Атомную крисаллическую Решетку ( Si. C, Si. O 22 )) Молекулярную кристаллическую решетку (все остальные) 1. алыпты жа дайда Қ ғ газт різді, с йы , атты; ә ұ қ қ 2. Заттарды к пшілігі ш ыш ң ө ұ қ заттар, айнау, бал у қ қ температурасы t o т мен; ө 3. Ерітінді ж не бал ыма ә қ к йінде электр тогын ү ткізеді. өЗаттарды асиеттері: ң қ 1. Қатты; 2. Балқу t o жоғары. Ковалентті полюсті байланыс ан заттар қ Атомды кристалл қ торлар ( Si. C , Si. O 2) Молекулалы кристалл торын қ (барлы бас а заттар) қ қ Заттарды асиеттері: ң қ
Вещества с КПС имеют: Атомную крисаллическую Решетку ( Si. C, Si. O 22 )) Молекулярную кристаллическую решетку (все остальные) 1. алыпты жа дайда Қ ғ газт різді, с йы , атты; ә ұ қ қ 2. Заттарды к пшілігі ш ыш ң ө ұ қ заттар, айнау, бал у қ қ температурасы t o т мен; ө 3. Ерітінді ж не бал ыма ә қ к йінде электр тогын ү ткізеді. өЗаттарды асиеттері: ң қ 1. Қатты; 2. Балқу t o жоғары. Ковалентті полюсті байланыс ан заттар қ Атомды кристалл қ торлар ( Si. C , Si. O 2) Молекулалы кристалл торын қ (барлы бас а заттар) қ қ Заттарды асиеттері: ң қ
 Металдық байланыстың түзілу схемасы (М – металл): Me – ne — → Me +n М ндай абілетті металдар бос к йде де, химиялы рекеттесу ұ қ ү қ ә кезінде де к рсетеді. Бос к йдегі металды белгілі физикалы ө ү ң қ асиеттері: электр ж не жылу ткізгіштігі, аттылы ы, қ ә ө қ ғ иілімділігі, созыл ышты ы, зіне т н жылтыры, т. б. б ларды ғ ғ ө ә ұ ң барлы ы да металды байланыс а т уелді. ғ қ қ ә _Металды кристалл торыны т йіндерінде атомдар немесе қ ң ү оларды иондары орналасатыны белгілі. ң Металды торда ы бостау к йдегі делокальдан ан қ ғ ү ғ электрондар к птеген ядроларды арасында зара ө ң ө тарту к штерін ү тудырып, металды қ байланыс т зеді. ү
Металдық байланыстың түзілу схемасы (М – металл): Me – ne — → Me +n М ндай абілетті металдар бос к йде де, химиялы рекеттесу ұ қ ү қ ә кезінде де к рсетеді. Бос к йдегі металды белгілі физикалы ө ү ң қ асиеттері: электр ж не жылу ткізгіштігі, аттылы ы, қ ә ө қ ғ иілімділігі, созыл ышты ы, зіне т н жылтыры, т. б. б ларды ғ ғ ө ә ұ ң барлы ы да металды байланыс а т уелді. ғ қ қ ә _Металды кристалл торыны т йіндерінде атомдар немесе қ ң ү оларды иондары орналасатыны белгілі. ң Металды торда ы бостау к йдегі делокальдан ан қ ғ ү ғ электрондар к птеген ядроларды арасында зара ө ң ө тарту к штерін ү тудырып, металды қ байланыс т зеді. ү
 Химиялы байланысты негізгі сипаттамалары: қ ң • байланыс энергиясы • байланыс зынды ы ұ ғ • валенттік б рыш ұ Байланыс энергиясы – зара байланыс ан атомдарды ө қ не иондарды бір – бірінен ажырату шін ж мсалатын ү ұ энергия. Байланыс зынды ы – химиялы байланыста ы ұ ғ қ ғ атомдар ядроларыны арасында ы ашы ты , ң ғ қ қ қ валенттік б рыш – байланыс ан атомдар ядролары ұ қ ар ылы ж ргізілетін жорамал сызы тар арасында ы қ ү қ ғ б рыш. ұ Б л к рсеткіштер зат молекуласыны рылысын, ұ ө ң құ пішінін ж не беріктігін сипаттайды. ә
Химиялы байланысты негізгі сипаттамалары: қ ң • байланыс энергиясы • байланыс зынды ы ұ ғ • валенттік б рыш ұ Байланыс энергиясы – зара байланыс ан атомдарды ө қ не иондарды бір – бірінен ажырату шін ж мсалатын ү ұ энергия. Байланыс зынды ы – химиялы байланыста ы ұ ғ қ ғ атомдар ядроларыны арасында ы ашы ты , ң ғ қ қ қ валенттік б рыш – байланыс ан атомдар ядролары ұ қ ар ылы ж ргізілетін жорамал сызы тар арасында ы қ ү қ ғ б рыш. ұ Б л к рсеткіштер зат молекуласыны рылысын, ұ ө ң құ пішінін ж не беріктігін сипаттайды. ә
 Элементті валенттілігі — б л берілген молекулада ы ң ұ ғ атомны бас а атоммен т зетін химиялы ң қ ү қ байланысты саны. Бір химиялы байланыс т зу ң қ ү шін атом бір ж птаспа ан электрон сынады. ү ұ ғ ұ Сонды тан элементті валенттілігі атомда ы қ ң ғ ж птаспа ан электрон санымен аны талады. ұ ғ қ К птеген элемент атомдары здеріні валенттілігін ө ө ң (ж птаспа ан электрон санын) алыпты жа дайдан ұ ғ қ ғ оз ан жа дай а ауыс ан жа дайда к бейте алады. қ ғ ғ ғ қ ғ ө Атомны оз ан жа дайы — б л алыпты жа даймен ң қ ғ ғ ұ қ ғ салыстыр анда жо ары энергиясы м лшерімен ғ ғ ө ерекшелінеді.
Элементті валенттілігі — б л берілген молекулада ы ң ұ ғ атомны бас а атоммен т зетін химиялы ң қ ү қ байланысты саны. Бір химиялы байланыс т зу ң қ ү шін атом бір ж птаспа ан электрон сынады. ү ұ ғ ұ Сонды тан элементті валенттілігі атомда ы қ ң ғ ж птаспа ан электрон санымен аны талады. ұ ғ қ К птеген элемент атомдары здеріні валенттілігін ө ө ң (ж птаспа ан электрон санын) алыпты жа дайдан ұ ғ қ ғ оз ан жа дай а ауыс ан жа дайда к бейте алады. қ ғ ғ ғ қ ғ ө Атомны оз ан жа дайы — б л алыпты жа даймен ң қ ғ ғ ұ қ ғ салыстыр анда жо ары энергиясы м лшерімен ғ ғ ө ерекшелінеді.

