погоня за элементам 2.ppt
- Количество слайдов: 41
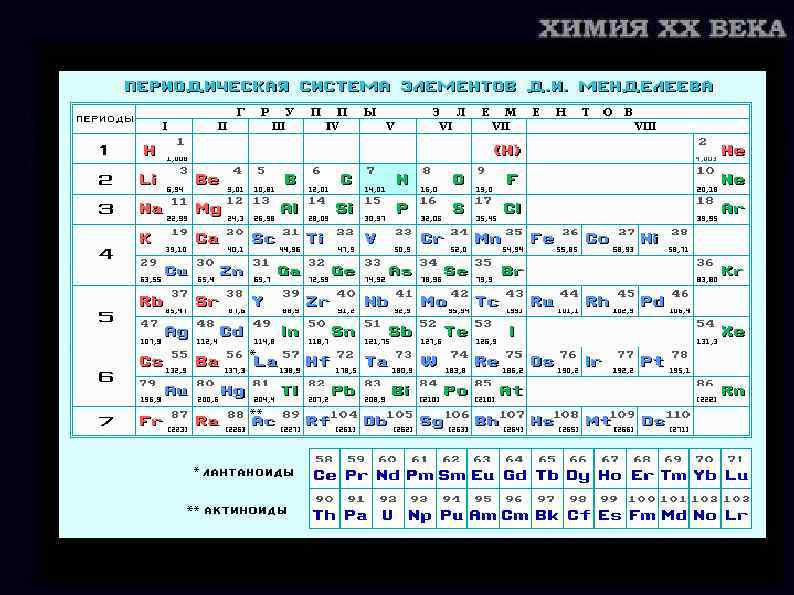
 Химия ХХ века Погоня за элементами Часть II Установление строения атома
Химия ХХ века Погоня за элементами Часть II Установление строения атома
 Нерешённые вопросы Почему свойства химических элементов периодически изменяются с возрастанием относительной атомной массы? Почему и как атомы образуют связь? Почему и как вещества взаимодействуют?
Нерешённые вопросы Почему свойства химических элементов периодически изменяются с возрастанием относительной атомной массы? Почему и как атомы образуют связь? Почему и как вещества взаимодействуют?
 Предпосылки Оценка величины атома Установление понятий электромагнетизма, зарядов, ионов и т. д. Установление дискретности электрического тока Спектральный анализ и корпускулярноволновая теория света Радиоактивность
Предпосылки Оценка величины атома Установление понятий электромагнетизма, зарядов, ионов и т. д. Установление дискретности электрического тока Спектральный анализ и корпускулярноволновая теория света Радиоактивность
 Михаил Васильевич Ломоносов (1711— 1765 гг. ). 1742 г. - искусные ювелиры могут раскатывают лист золота до толщины в одну десятитысячную долю сантиметра (10 -4 см) атомы золота никак не могут превышать этой величины. Бенджамен Франклин (1706— 1790 гг. ) 1777 г. - ложка масла ( 5 см 3), вылитого на поверхность спокойной воды, растекается по ней на площади 2 • 107 см 2. Очевидно, что диаметр молекулы не может превышать величину d = (5 см 3)/(2 • 107 см 2) = 2, 5 • 10 -7 (то есть две десятимиллионные доли сантиметра).
Михаил Васильевич Ломоносов (1711— 1765 гг. ). 1742 г. - искусные ювелиры могут раскатывают лист золота до толщины в одну десятитысячную долю сантиметра (10 -4 см) атомы золота никак не могут превышать этой величины. Бенджамен Франклин (1706— 1790 гг. ) 1777 г. - ложка масла ( 5 см 3), вылитого на поверхность спокойной воды, растекается по ней на площади 2 • 107 см 2. Очевидно, что диаметр молекулы не может превышать величину d = (5 см 3)/(2 • 107 см 2) = 2, 5 • 10 -7 (то есть две десятимиллионные доли сантиметра).
 Иоганн Йозеф Лошмидт (1821— 1895 гг. ) В 1865 году на газокинетической основе определил размер молекул газов воздуха (10 -8 см, а вес атома водорода составляет всего 10 -24 г. ). Вычислил число молекул газа в 1 куб. см при нормальных условиях, которое позже назвали в его честь постоянной Лошмидта и которое легко можно переводить число Авогадро. Лошмидт раскрыл строение озона. Он предполагал, что в соединениях углерода существуют кольцеобразные структуры и развивал отображение связей двойными и тройными штрихами. В 1861 году он впервые предложил кольцеобразную структуру бензола.
Иоганн Йозеф Лошмидт (1821— 1895 гг. ) В 1865 году на газокинетической основе определил размер молекул газов воздуха (10 -8 см, а вес атома водорода составляет всего 10 -24 г. ). Вычислил число молекул газа в 1 куб. см при нормальных условиях, которое позже назвали в его честь постоянной Лошмидта и которое легко можно переводить число Авогадро. Лошмидт раскрыл строение озона. Он предполагал, что в соединениях углерода существуют кольцеобразные структуры и развивал отображение связей двойными и тройными штрихами. В 1861 году он впервые предложил кольцеобразную структуру бензола.
 Майкл Фарадей (1791— 1867 гг. ) в 1834 году установил количественные законы электролиза
Майкл Фарадей (1791— 1867 гг. ) в 1834 году установил количественные законы электролиза
 Герман Людвиг Фердинанд фон Гельмгольц (1821— 1894) В 1881 г. прочел доклад «Современное развитие взгляда Фарадея на электричество» . В этом докладе Гельмгольц впервые отчетливо сформулировал мысль о «молекулярном строении электричества»
Герман Людвиг Фердинанд фон Гельмгольц (1821— 1894) В 1881 г. прочел доклад «Современное развитие взгляда Фарадея на электричество» . В этом докладе Гельмгольц впервые отчетливо сформулировал мысль о «молекулярном строении электричества»
 Кромвель Вэрли (1828— 1883) в 1879 году показал, что катодные лучи заряжены отрицательно
Кромвель Вэрли (1828— 1883) в 1879 году показал, что катодные лучи заряжены отрицательно
 Сэр Уильям Крукс (1832 -1919 гг) — английский химик и физик, член (с 1863 года) и Президент (в 1913— 1915 годах) Лондонского Королевского общества. В 1875 году получил Королевскую золотую медаль. Медали от Французской академии наук (1880), Дэви (1888) и медаль Копли (1904). В 1897 году королева Виктория пожаловала ему рыцарское звание. В 1910 году он получил «Орден заслуг» . Крукс вошел в историю как человек, открывший таллий и впервые получивший гелий в лабораторных условиях. Обнаружил у «Лучистой материи» свойства: распространятся прямолинейно; вызывать свечение тел и их расплавление; отклоняться в электрическом и магнитном полях; проникать сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0, 002 см. Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или лучистая материя, есть поток быстрых отрицательных частиц, величина которых значительно меньше размеров атомов.
Сэр Уильям Крукс (1832 -1919 гг) — английский химик и физик, член (с 1863 года) и Президент (в 1913— 1915 годах) Лондонского Королевского общества. В 1875 году получил Королевскую золотую медаль. Медали от Французской академии наук (1880), Дэви (1888) и медаль Копли (1904). В 1897 году королева Виктория пожаловала ему рыцарское звание. В 1910 году он получил «Орден заслуг» . Крукс вошел в историю как человек, открывший таллий и впервые получивший гелий в лабораторных условиях. Обнаружил у «Лучистой материи» свойства: распространятся прямолинейно; вызывать свечение тел и их расплавление; отклоняться в электрическом и магнитном полях; проникать сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0, 002 см. Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или лучистая материя, есть поток быстрых отрицательных частиц, величина которых значительно меньше размеров атомов.
 Жан Батист Перрен (1870 - 1942 гг. ) 1895 г катодные лучи имеют корпускулярную природу и имеют отрицательный электрический заряд. Определил значение числа Авогадро несколькими методами
Жан Батист Перрен (1870 - 1942 гг. ) 1895 г катодные лучи имеют корпускулярную природу и имеют отрицательный электрический заряд. Определил значение числа Авогадро несколькими методами
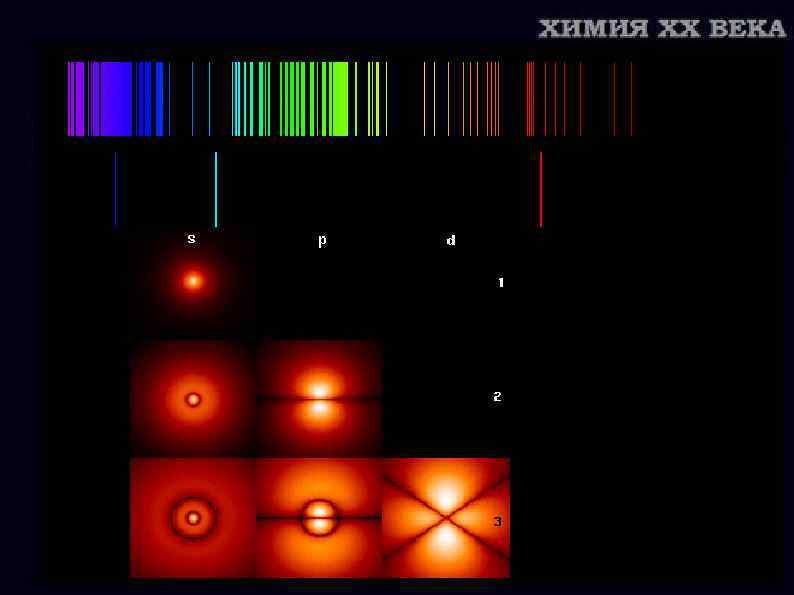
 Уильям Хайд Волластон (1766— 1828) 1802 г Обнаружил темные линии в солнечном спектре Вильям Сван (1828 — 1914) установил, что двойная желтая линия D в спектре пламени спиртовки возникает в присутствии металла натрия Иосиф Фраунгофер (1787— 1826) Насчитал 574 темные линии в солнечном спектре, дал главным названия и указал их точное местоположение в спектре.
Уильям Хайд Волластон (1766— 1828) 1802 г Обнаружил темные линии в солнечном спектре Вильям Сван (1828 — 1914) установил, что двойная желтая линия D в спектре пламени спиртовки возникает в присутствии металла натрия Иосиф Фраунгофер (1787— 1826) Насчитал 574 темные линии в солнечном спектре, дал главным названия и указал их точное местоположение в спектре.
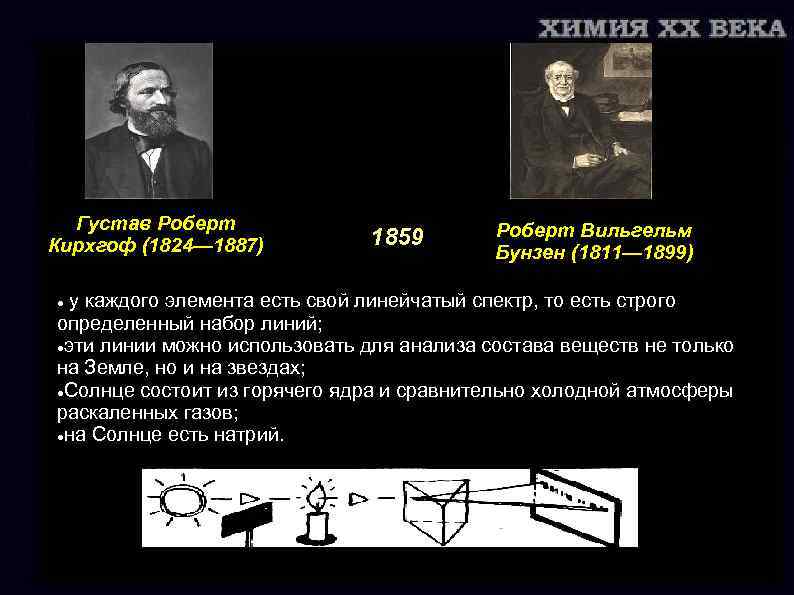 Густав Роберт Кирхгоф (1824— 1887) 1859 Роберт Вильгельм Бунзен (1811— 1899) у каждого элемента есть свой линейчатый спектр, то есть строго определенный набор линий; эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах; Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов; на Солнце есть натрий.
Густав Роберт Кирхгоф (1824— 1887) 1859 Роберт Вильгельм Бунзен (1811— 1899) у каждого элемента есть свой линейчатый спектр, то есть строго определенный набор линий; эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах; Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов; на Солнце есть натрий.

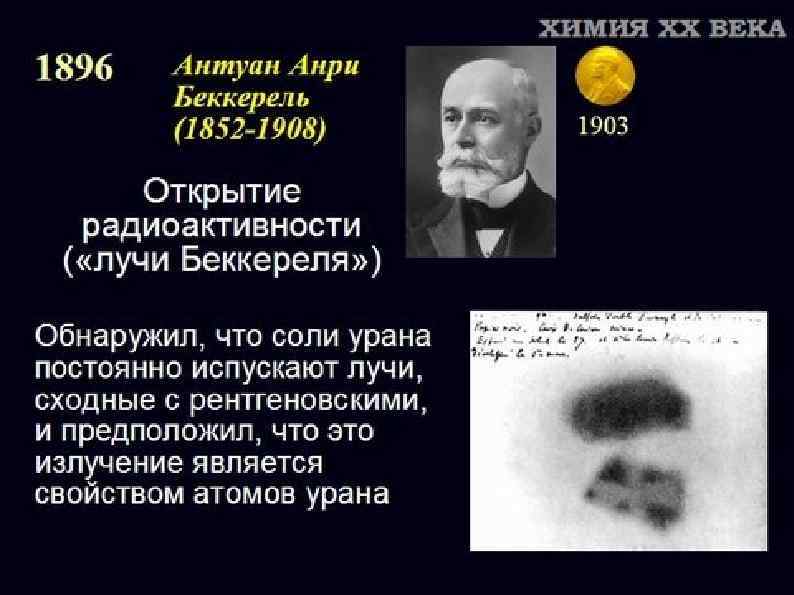

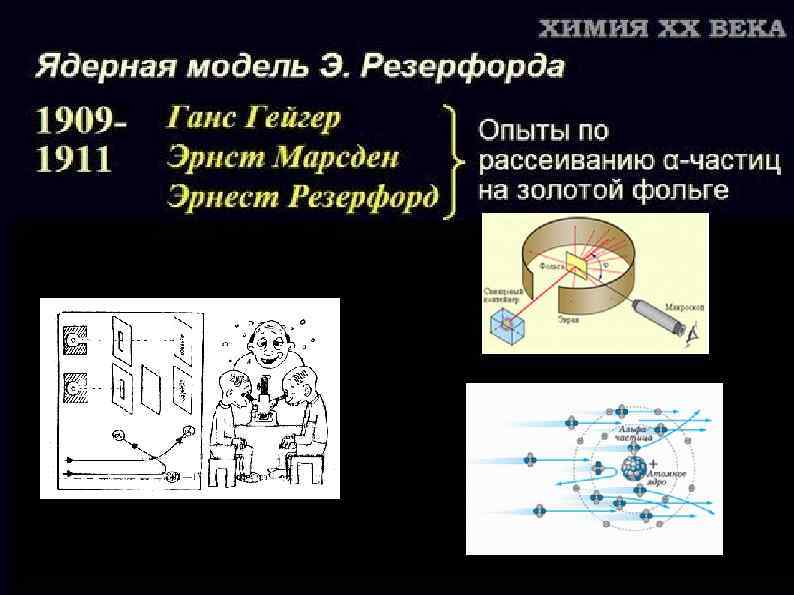
 альфа-лучи, бета-лучи и гамма-лучи Эрнест Резерфорд 1899 г. - обнаружил неоднородность уранового излучения 1900 г. -установил, что соединения тория непрерывно выделяют радиоактивный газ – эманацию тория (радон) Уильям Рамзай, Фредерик Содди 1903 г. - доказали, что при α-распаде радия образуется гелий Макс Карл Эрнст Людвиг Планк. 1900 г. - исследую спектр, постулировал, что вещество может испускать энергию излучения только конечными порциями Поль Виллар 1900 г. выделил ещё один тип: лучи, не отклоняющиеся магнитным полем.
альфа-лучи, бета-лучи и гамма-лучи Эрнест Резерфорд 1899 г. - обнаружил неоднородность уранового излучения 1900 г. -установил, что соединения тория непрерывно выделяют радиоактивный газ – эманацию тория (радон) Уильям Рамзай, Фредерик Содди 1903 г. - доказали, что при α-распаде радия образуется гелий Макс Карл Эрнст Людвиг Планк. 1900 г. - исследую спектр, постулировал, что вещество может испускать энергию излучения только конечными порциями Поль Виллар 1900 г. выделил ещё один тип: лучи, не отклоняющиеся магнитным полем.










 Иоганне Якобе Бальмере (1825— 1898), впервые обнаружил , что четыре спектральные линии в видимой части спектра водорода расположены не беспорядочно, а образуют серию, которую можно описать единой формулой: Рунге 1886 г. заметил, что формула Бальмера становится прозрачнее, если в нее вместо длины волны λ поставить частоту ν = c/λ λ = b k 2/(k 2 -n 2), где: n = 2; k = 3, 4, 5, 6; b = 3645, 6 Ǻ. Вальтер Ритц (1878— 1909) 1908 г продолжая работы Ридберга, сформулировал так называемый комбинационный принцип: частоту ν произвольной линии в спектре любого атома можно представить как разность двух термов Тn и Tk Иоганн Роберт Ридберг (1854— 1919) 1890 г - предложил записывать формулу в виде: ν = c. R[(1/n 2)- (1/k 2)].
Иоганне Якобе Бальмере (1825— 1898), впервые обнаружил , что четыре спектральные линии в видимой части спектра водорода расположены не беспорядочно, а образуют серию, которую можно описать единой формулой: Рунге 1886 г. заметил, что формула Бальмера становится прозрачнее, если в нее вместо длины волны λ поставить частоту ν = c/λ λ = b k 2/(k 2 -n 2), где: n = 2; k = 3, 4, 5, 6; b = 3645, 6 Ǻ. Вальтер Ритц (1878— 1909) 1908 г продолжая работы Ридберга, сформулировал так называемый комбинационный принцип: частоту ν произвольной линии в спектре любого атома можно представить как разность двух термов Тn и Tk Иоганн Роберт Ридберг (1854— 1919) 1890 г - предложил записывать формулу в виде: ν = c. R[(1/n 2)- (1/k 2)].







 Уравнение Шредингера уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнение второго закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы
Уравнение Шредингера уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнение второго закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы