L1_TEORII.ppt
- Количество слайдов: 35

ХИМИЯ Раздел 1. Биоорганическая химия ЛЕКЦИИ 16 ч. , ПРАКТИЧЕСКИЕ ЗАНЯТИЯ 18 ч. Раздел 2. Общая химия ЛЕКЦИИ 16 ч. , ПРАКТИЧЕСКИЕ ЗАНЯТИЯ 18 ч.

Список литературы: 1. Тюкавкина Н. А. , Бауков Ю. И. Биоорганическая химия, М. , 2012 2. Под ред. Белоконовой Н. А. Учебное пособие к практическим занятиям по биоорганической химии, Екатеринбург: УГМА, 2013.

Введение Биоорганическая химия изучает строение, ф. -х. свойства, биологические функции органических веществ, участвующих в процессах жизнедеятельности. ОБЪЕКТЫ ИЗУЧЕНИЯ БИОПОЛИМЕРЫ -пептиды, белки; -полисахариды; -нуклеиновые кислоты; -липиды БИОРЕГУЛЯТОРЫ -витамины; -гормоны; - синтетические лекарственные в-ва

ТЕОРЕТИЧЕСКИЕ ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ

Гибридизация орбиталей атома углерода Гибридизация – это «перемешивание» атомных орбиталей с целью выравнивания их по форме и энергии sp 3 -гибридизация – 1 s АО + 3 p АО = 4 ГО форма молекулы – тетраэдрическая Такой тип гибридизации характерен для насыщенных систем
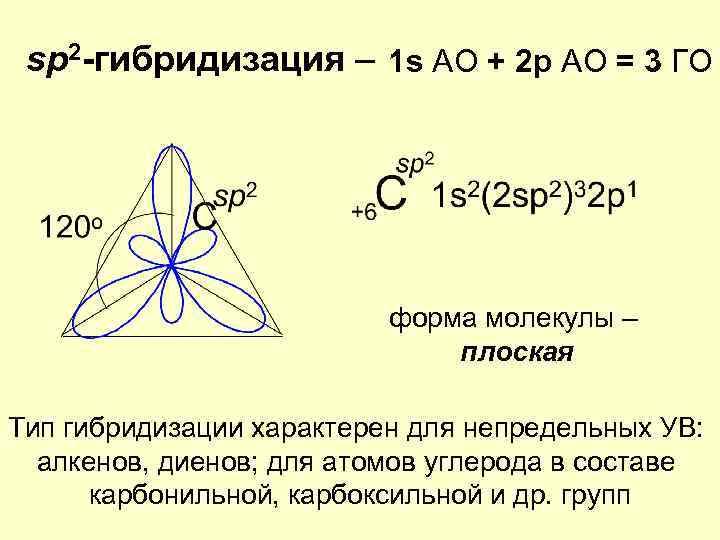
sp 2 -гибридизация – 1 s АО + 2 p АО = 3 ГО форма молекулы – плоская Тип гибридизации характерен для непредельных УВ: алкенов, диенов; для атомов углерода в составе карбонильной, карбоксильной и др. групп

sp-гибридизация – 1 s АО + 1 p АО = 2 ГО форма молекулы – линейная Тип гибридизации характерен для непредельных УВ: алкинов; для нитрилов и др.

Сопряжение и ароматичность Ковалентная связь локализованная делокализованная электроны поделены между ядрами двух связываемых атомов электроны поделены между ядрами более двух атомов Делокализованные связи характерны для сопряженных систем, т. е. систем, содержащих чередующиеся кратные связи (π-π-сопряжение), а также чередующиеся кратные связи и р-АО, содержащие НЭП (р- π-сопряжение).
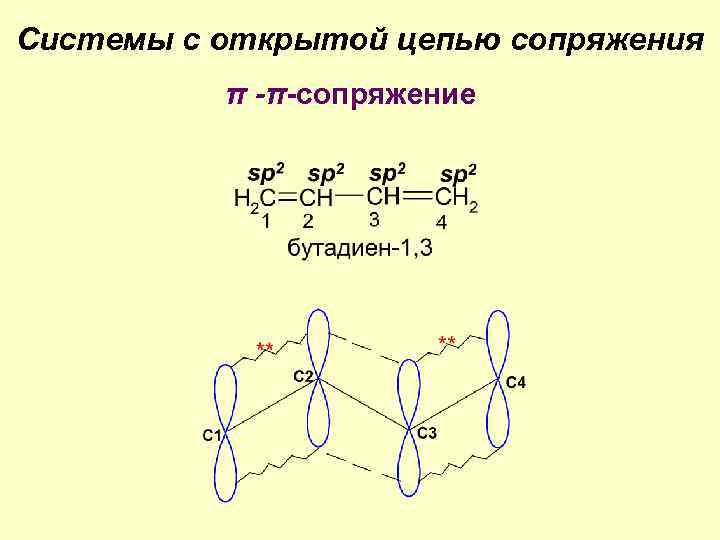
Системы с открытой цепью сопряжения π -π-сопряжение

р -π-сопряжение характерно и для систем, содержащих структурный фрагмент –СН=СН-Х, где Х – это гетероатом (Сl, O, N), имеющий НЭП

Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридных p-орбиталей. Это приводит: -к выравниванию длин связей (одинарные – укорачиваются, кратные – удлиняются); -к энергетической стабилизации сопряженных систем. Чем больше цепь сопряжения, тем более термодинамически устойчивым будет соединение. Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения (энергией делокализации).

Системы с замкнутой цепью сопряжения Ароматические соединения: -карбоциклические (цикл состоит только из атомов углерода) бензол нафталин антрацен фенантрен - гетероциклические (цикл включает гетероатомы (N, O, S) ♦ пятичленные пиррол тиофен фуран имидазол

♦ шестичленные пиридин пиримидин ♦ с конденсированными циклами пурин индол

Ароматические соединения – это циклические сопряженные системы, обладающие общими признаками в строении (критерии ароматичности) и свойствах. Критерии ароматичности 1. Плоский цикл 2. Наличие сопряженной π-электронной системы, состоящей из делокализованных р-электронов 3. Число таких электронов должно быть равно 4 n+2, где n=0, 1, 2, 3… (натуральное число) – правило Хюккеля

Общие свойства ароматических веществ -повышенная термодинамическая стабильность по сравнению с сопряженными системами с отрытой цепью; -устойчивость к действию окислителей и температуры; -склонность к реакциям замещения, а не присоединения.
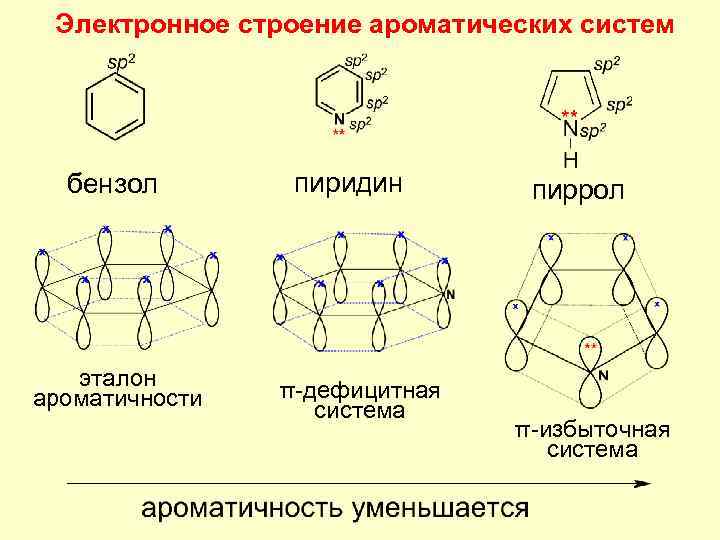
Электронное строение ароматических систем бензол эталон ароматичности пиридин π-дефицитная система пиррол π-избыточная система
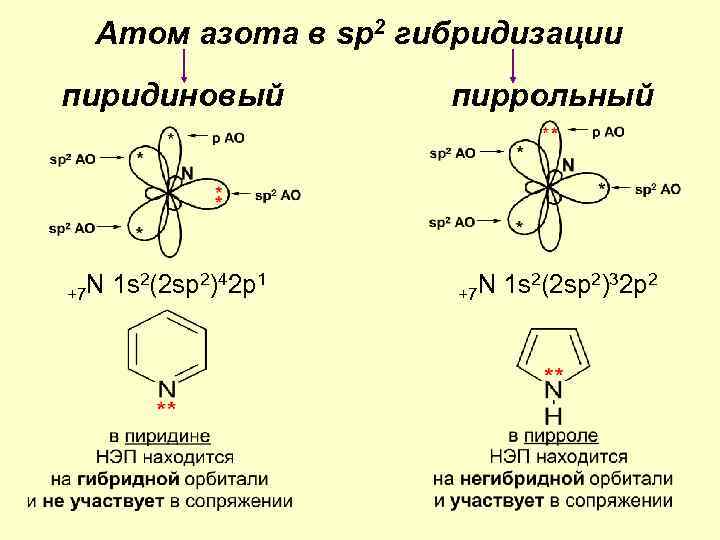
Атом азота в sp 2 гибридизации пиридиновый +7 N 1 s 2(2 sp 2)42 p 1 пиррольный +7 N 1 s 2(2 sp 2)32 p 2

Электронные эффекты Индукционный (индуктивный) эффект – Iэф. это смещение электронной плотности по цепи σ-связей
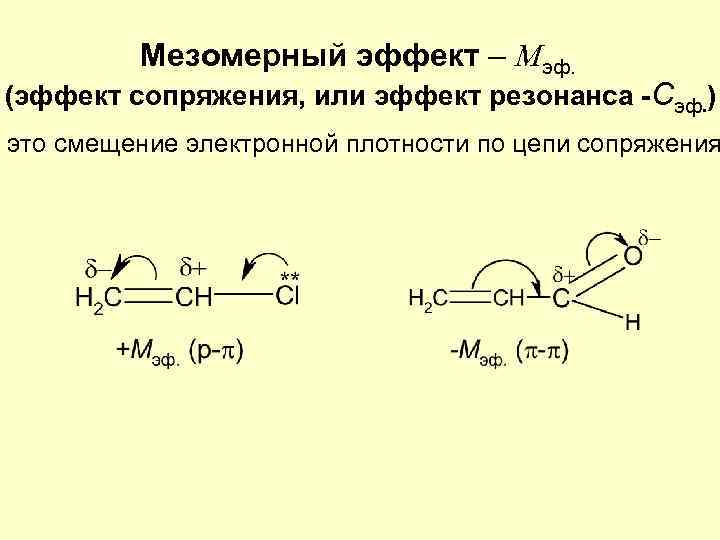
Мезомерный эффект – Mэф. (эффект сопряжения, или эффект резонанса -Cэф. ) это смещение электронной плотности по цепи сопряжения

КИСЛОТНЫЕ И ОСНÓВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ

Протолитическая теория Брёнстеда-Лоури Кислоты – вещества, способные отдавать протон (доноры Н+); Основания – вещества, способные присоединять протон (акцепторы Н+). Кислота и основание – сопряженная кислотно-основная пара. Кислотные свойства проявляются в присутствии основания, основные – в присутствии кислоты.

Элемент и связанный с ним атом водорода называют кислотным центром. Кислотами могут быть нейтральные молекулы и катионы Органические основания должны иметь либо НЭП (нейтральные молекулы), либо быть анионами.

Количественная оценка кислотно-основных свойств Чем больше Ка, тем сильнее кислота Ka (CH 3 COOH) = 1, 75· 10 -5 p. Ka = -lg. Ka Чем меньше p. Ка, тем сильнее кислота

Основность соединений в водном растворе можно охарактеризовать величиной p. Kb : p. Kb = 14 - p. Ka Чем меньше p. Кb, тем сильнее основание Основность соединений чаще обозначают величиной p. KBH+ это p. Ka сопряженной кислоты BH+ Чем больше p. KBH+ , тем сильнее основание

Качественная оценка кислотно-основных свойств КИСЛОТЫ БРЕНСТЕДА Качественный подход к оценке кислотных свойств базируется на оценке стабильности сопряженного основания Чем стабильнее сопряженное основание, тем сильнее кислота

Факторы, обусловливающие стабильность аниона А : 1. природа атома в кислотном центре; 2. возможность стабилизации аниона за счет сопряжения; 3. характер радикала, связанного с кислотным центром; 4. влияние растворителя.

Природа атома в кислотном центре Чем более электроотрицательным является элемент в кислотном центре, он более способен нести отрицательный заряд и тем стабильнее будет образующийся анион. Атом серы больше по размеру и легче поляризуется, чем элементы второго периода (O, N, C) у других кислот. Отрицательный заряд на атоме серы делокализован в большей степени, поэтому этантиолят самый стабильный.
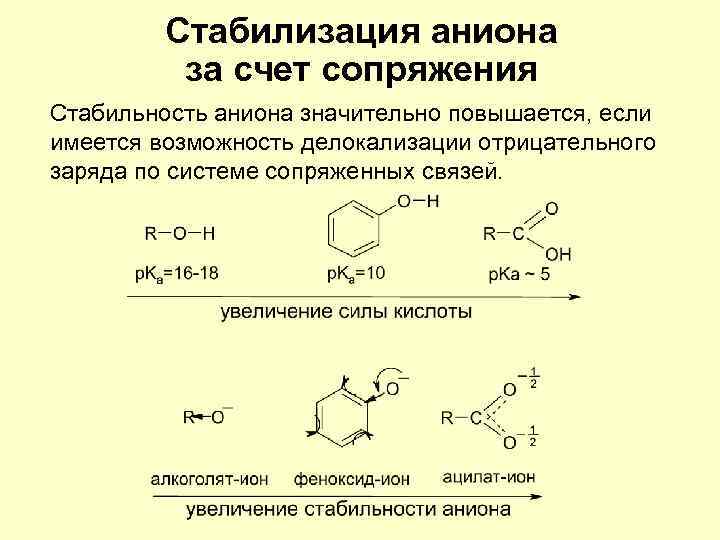
Стабилизация аниона за счет сопряжения Стабильность аниона значительно повышается, если имеется возможность делокализации отрицательного заряда по системе сопряженных связей.
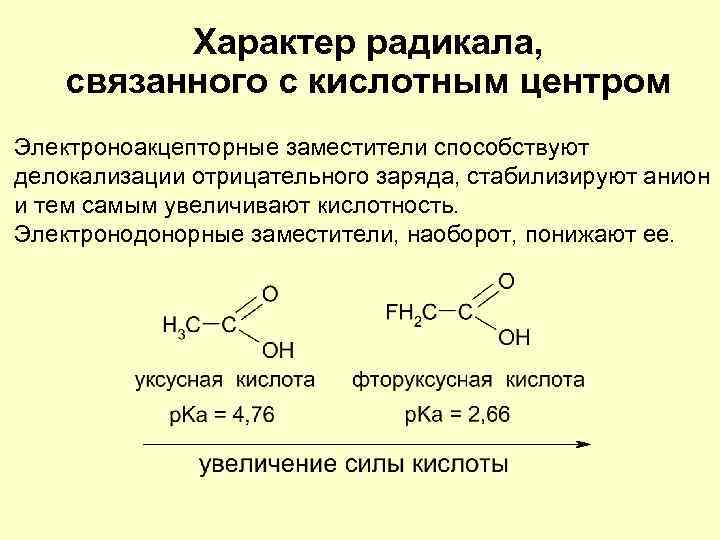
Характер радикала, связанного с кислотным центром Электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анион и тем самым увеличивают кислотность. Электронодонорные заместители, наоборот, понижают ее.

Влияние растворителя Взаимодействие между ионом и растворителем – это эффект сольватации При сольватации иона происходит перераспределение заряда с участием окружающих его молекул растворителя. Чем меньше размер иона и чем больше локализован в нем заряд, тем он лучше сольватируется, тем выше стабильность иона, тем сильнее кислота.

Изомерия Изомеры – соединения, имеющие одинаковый качественный и количественный состав, но разную последовательность связывания атомов (или расположение их в пространстве) и, следовательно, разные свойства. Изомерия структурная пространственная

структурная Структурные изомеры имеют различную последовательность связывания атомов 1) Изомерия углеродного скелета 2) Изомерия положения функциональной группы (кратной связи) 3) Межклассовая изомерия 4) Таутомерия: кето-енольная, лактим-лактамная, кольчато-цепная и др.

пространственная Пространственные изомеры (стереоизомеры) имеют одинаковую последовательность связывания атомов, но различное расположение их в пространстве. 1) Конфигурационная изомерия Конфигурационные изомеры могут существовать в виде индивидуальных форм, т. е. обладают конфигурационной устойчивостью

- оптическая изомерия (энантиомерия) Энантиомеры – это стереоизмеры, которые относятся друг к другу как предмет и несовместимое с ним зеркальное изображение - диастереоизомерия (σ- и π-диастереоизомерия) Диастереомеры – это стереоизмеры, молекулы которых не относятся друг к другу как предмет и несовместимое с ним зеркальное изображение

2) Конформационная изомерия Конформации могут существовать только все вместе в виде единого множества геометрических форм молекул с различным расположением в пространстве отдельных атомов и атомных групп
L1_TEORII.ppt