ОЗО лекции.ppt
- Количество слайдов: 112
 «ХИМИЯ» ПРЕПОДАВАТЕЛЬ доцент кафедры органической и экологической химии, кандидат химических наук Котова Татьяна Петровна E-mail: tkotova 71@mail. ru
«ХИМИЯ» ПРЕПОДАВАТЕЛЬ доцент кафедры органической и экологической химии, кандидат химических наук Котова Татьяна Петровна E-mail: tkotova 71@mail. ru
 Тема 1. Строение атома Периодический закон (1869 г. , Д. И. Менделеев): свойства химических элементов и образуемых ими химических соединений и простых веществ находятся в периодической зависимости от относительной атомной массы элемента Явление радиоактивности (1896 г. , А. Беккерель) Открытие электрона (1897 г. , Дж. Томсон)
Тема 1. Строение атома Периодический закон (1869 г. , Д. И. Менделеев): свойства химических элементов и образуемых ими химических соединений и простых веществ находятся в периодической зависимости от относительной атомной массы элемента Явление радиоактивности (1896 г. , А. Беккерель) Открытие электрона (1897 г. , Дж. Томсон)
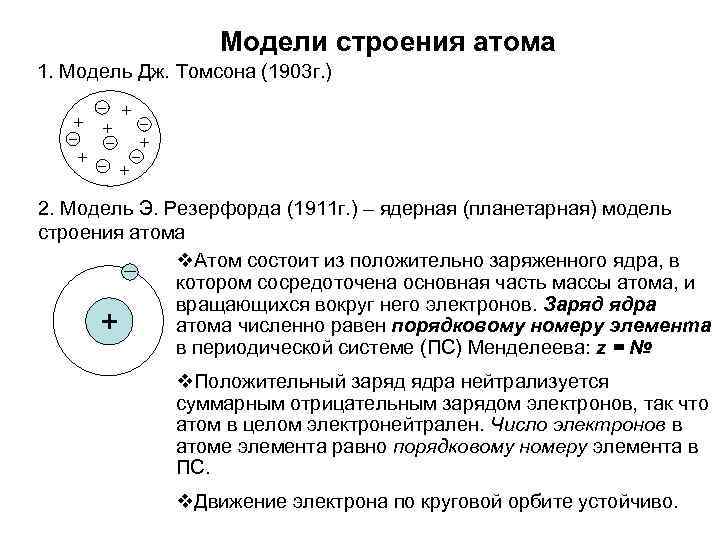 Модели строения атома 1. Модель Дж. Томсона (1903 г. ) + + + 2. Модель Э. Резерфорда (1911 г. ) – ядерная (планетарная) модель строения атома Атом состоит из положительно заряженного ядра, в котором сосредоточена основная часть массы атома, и вращающихся вокруг него электронов. Заряд ядра атома численно равен порядковому номеру элемента в периодической системе (ПС) Менделеева: z = № + Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Число электронов в атоме элемента равно порядковому номеру элемента в ПС. Движение электрона по круговой орбите устойчиво.
Модели строения атома 1. Модель Дж. Томсона (1903 г. ) + + + 2. Модель Э. Резерфорда (1911 г. ) – ядерная (планетарная) модель строения атома Атом состоит из положительно заряженного ядра, в котором сосредоточена основная часть массы атома, и вращающихся вокруг него электронов. Заряд ядра атома численно равен порядковому номеру элемента в периодической системе (ПС) Менделеева: z = № + Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Число электронов в атоме элемента равно порядковому номеру элемента в ПС. Движение электрона по круговой орбите устойчиво.
 Теория Н. Бора: Электрон может вращаться вокруг ядра не по любым, а только по определенным круговым орбитам. Эти орбиты получили название стационарных. Двигаясь по стационарной орбите, электрон не излучает энергию. Излучение происходит только при переходе с одной стационарной орбиты на другую. При этом излучается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и начальном состоянии: Е = Ек - Ен.
Теория Н. Бора: Электрон может вращаться вокруг ядра не по любым, а только по определенным круговым орбитам. Эти орбиты получили название стационарных. Двигаясь по стационарной орбите, электрон не излучает энергию. Излучение происходит только при переходе с одной стационарной орбиты на другую. При этом излучается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и начальном состоянии: Е = Ек - Ен.
 Атомное ядро, его строение и характеристика Атомные ядра состоят из протонов и нейтронов. Протоны (р) – это устойчивые частицы с положительным зарядом «+1» . Определяют заряд ядра атома. Нейтроны (n) – это неустойчивые частицы без заряда. Характеристики атомного ядра: ○Заряд ядра (z): z = №, где № - порядковый номер элемента в ПС ○Число протонов (Np): Np = z = № ○Число нейтронов (Nn) Nn = А - Np ○Массовое число (А): А = Np + Nn Ar, где Ar – относительная атомная масса элемента в ПС
Атомное ядро, его строение и характеристика Атомные ядра состоят из протонов и нейтронов. Протоны (р) – это устойчивые частицы с положительным зарядом «+1» . Определяют заряд ядра атома. Нейтроны (n) – это неустойчивые частицы без заряда. Характеристики атомного ядра: ○Заряд ядра (z): z = №, где № - порядковый номер элемента в ПС ○Число протонов (Np): Np = z = № ○Число нейтронов (Nn) Nn = А - Np ○Массовое число (А): А = Np + Nn Ar, где Ar – относительная атомная масса элемента в ПС
 Атомное ядро принято изображать следующим образом: А Z X где А – массовое число, Z – заряд ядра, Х – символ элемента Например, для атома фосфора атомное ядро изображают так: 31 15 Р Характеристики атомного ядра фосфора: Заряд ядра z = +15 Число протонов Np = 15 Массовое число А = 31 Число нейтронов Nn = А – Np = 16
Атомное ядро принято изображать следующим образом: А Z X где А – массовое число, Z – заряд ядра, Х – символ элемента Например, для атома фосфора атомное ядро изображают так: 31 15 Р Характеристики атомного ядра фосфора: Заряд ядра z = +15 Число протонов Np = 15 Массовое число А = 31 Число нейтронов Nn = А – Np = 16
 Ядра естественных атомов бывают устойчивыми и радиоактивными. Устойчивость ядер характеризуется параметром Бора, т. е. значением отношения z 2/А, где z – заряд ядра, А – его массовое число. Если z 2/А 33, то ядро атома неустойчиво, радиоактивно; если z 2/А 33, то ядро атома устойчиво.
Ядра естественных атомов бывают устойчивыми и радиоактивными. Устойчивость ядер характеризуется параметром Бора, т. е. значением отношения z 2/А, где z – заряд ядра, А – его массовое число. Если z 2/А 33, то ядро атома неустойчиво, радиоактивно; если z 2/А 33, то ядро атома устойчиво.
 Электрон - это элементарная частица с массой покоя 9, 1083*10 -28 г и отрицательным электрическим зарядом «-1» . Состояние электрона в атоме можно описать с помощью квантовых чисел: главного квантового числа, орбитального квантового числа, магнитного квантового числа, спинового квантового числа.
Электрон - это элементарная частица с массой покоя 9, 1083*10 -28 г и отрицательным электрическим зарядом «-1» . Состояние электрона в атоме можно описать с помощью квантовых чисел: главного квантового числа, орбитального квантового числа, магнитного квантового числа, спинового квантового числа.
 Главное квантовое число (n) определяет возможные энергетические состояния электрона в атоме; уровень, на котором находиться электрон в атоме; указывает на размер электронного облака. Оно может принимать положительные целочисленные значения: 1, 2, 3 до nmax Максимальное значение главного квантового числа (nmax) соответствует номеру периода элемента в ПС. Максимальное главное квантовое число указывает на то, сколько энергетических уровней у атома данного элемента.
Главное квантовое число (n) определяет возможные энергетические состояния электрона в атоме; уровень, на котором находиться электрон в атоме; указывает на размер электронного облака. Оно может принимать положительные целочисленные значения: 1, 2, 3 до nmax Максимальное значение главного квантового числа (nmax) соответствует номеру периода элемента в ПС. Максимальное главное квантовое число указывает на то, сколько энергетических уровней у атома данного элемента.
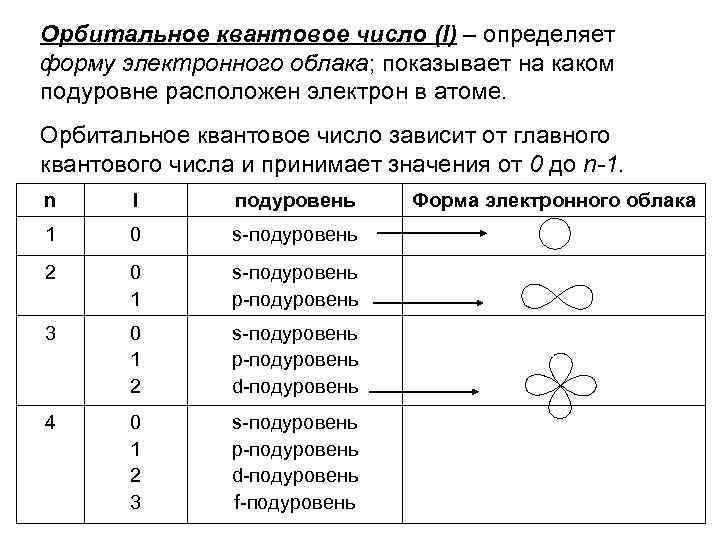 Орбитальное квантовое число (l) – определяет форму электронного облака; показывает на каком подуровне расположен электрон в атоме. Орбитальное квантовое число зависит от главного квантового числа и принимает значения от 0 до n-1. n l подуровень 1 0 s-подуровень 2 0 1 s-подуровень р-подуровень 3 0 1 2 s-подуровень р-подуровень d-подуровень 4 0 1 2 3 s-подуровень р-подуровень d-подуровень f-подуровень Форма электронного облака
Орбитальное квантовое число (l) – определяет форму электронного облака; показывает на каком подуровне расположен электрон в атоме. Орбитальное квантовое число зависит от главного квантового числа и принимает значения от 0 до n-1. n l подуровень 1 0 s-подуровень 2 0 1 s-подуровень р-подуровень 3 0 1 2 s-подуровень р-подуровень d-подуровень 4 0 1 2 3 s-подуровень р-подуровень d-подуровень f-подуровень Форма электронного облака
 Магнитное квантовое число (ml) – характеризует пространственное расположение электронных облаков; определяет число орбиталей на энергетическом подуровне. Число ml зависит от орбитального квантового числа (l) и принимает значения от –l … 0 … +l. l ml Число орбиталей Состояние электрона 0 0 1 S – состояние 1 -1, 0, +1 3 Р – состояние 2 -2, -1, 0, +1, +2 5 D – состояние 3 -3, -2, -1, 0, +1, +2, +3 7 F - состояние
Магнитное квантовое число (ml) – характеризует пространственное расположение электронных облаков; определяет число орбиталей на энергетическом подуровне. Число ml зависит от орбитального квантового числа (l) и принимает значения от –l … 0 … +l. l ml Число орбиталей Состояние электрона 0 0 1 S – состояние 1 -1, 0, +1 3 Р – состояние 2 -2, -1, 0, +1, +2 5 D – состояние 3 -3, -2, -1, 0, +1, +2, +3 7 F - состояние
 Спиновое квантовое число (ms) – это число не связано с движением электрона вокруг ядра атома, а определяет его собственное состояние. Спин можно представить как веретенообразное вращение электрона вокруг своей оси. Спиновое квантовое число имеет только два значения: -1/2 и +1/2. На одной орбитали может находиться только два электрона, которые различаются спинами. Следовательно, в s – состоянии (одна орбиталь) может быть только 2 электрона; в р – состоянии (три орбитали) – 6 электронов; в d – состоянии (5 орбиталей) – 10 электронов; в f – состоянии (7 орбиталей) – 14 электронов.
Спиновое квантовое число (ms) – это число не связано с движением электрона вокруг ядра атома, а определяет его собственное состояние. Спин можно представить как веретенообразное вращение электрона вокруг своей оси. Спиновое квантовое число имеет только два значения: -1/2 и +1/2. На одной орбитали может находиться только два электрона, которые различаются спинами. Следовательно, в s – состоянии (одна орбиталь) может быть только 2 электрона; в р – состоянии (три орбитали) – 6 электронов; в d – состоянии (5 орбиталей) – 10 электронов; в f – состоянии (7 орбиталей) – 14 электронов.
 Строение многоэлектронных атомов. Периодический закон, периодическая система элементов. Правила заполнения АО электронами: 1. Принцип наименьшей энергии. Каждый электрон занимает ту из доступных для него орбиталей, на которой его энергия будет наименьшей: 1 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 5 d 4 f. 2. Принцип Паули. В атоме не может быть двух электронов с одинаковым набором значений квантовых чисел. 3. Правило Хунда. Электроны располагаются на подуровне так, чтобы их суммарное спиновое число было максимальным.
Строение многоэлектронных атомов. Периодический закон, периодическая система элементов. Правила заполнения АО электронами: 1. Принцип наименьшей энергии. Каждый электрон занимает ту из доступных для него орбиталей, на которой его энергия будет наименьшей: 1 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 5 d 4 f. 2. Принцип Паули. В атоме не может быть двух электронов с одинаковым набором значений квантовых чисел. 3. Правило Хунда. Электроны располагаются на подуровне так, чтобы их суммарное спиновое число было максимальным.
 4. Правила Клечковского. а) Порядок заполнения электронами атомных орбиталей определяется возрастанием суммы n + l, где n – главное квантовое число, l – орбитальное квантовое число. Сначала заполняются АО с меньшим значением этой суммы. б) При одинаковом значении суммы n + l первым заполняется подуровень с меньшим значением n.
4. Правила Клечковского. а) Порядок заполнения электронами атомных орбиталей определяется возрастанием суммы n + l, где n – главное квантовое число, l – орбитальное квантовое число. Сначала заполняются АО с меньшим значением этой суммы. б) При одинаковом значении суммы n + l первым заполняется подуровень с меньшим значением n.
 Электронно-графическая структура атома марганца 25 Mn nmax = 4 n=1 l = 0… 3 l=0 1 s n=2 l = 0; 1 2 s 2 p n=3 l = 0; 1; 2 3 s 3 p 3 d n=4 l = 0; 1; 2; 3 4 s 4 p 4 d 4 f 1 s 22 p 63 s 23 p 64 s 23 d 5 – электронная формула атома Mn
Электронно-графическая структура атома марганца 25 Mn nmax = 4 n=1 l = 0… 3 l=0 1 s n=2 l = 0; 1 2 s 2 p n=3 l = 0; 1; 2 3 s 3 p 3 d n=4 l = 0; 1; 2; 3 4 s 4 p 4 d 4 f 1 s 22 p 63 s 23 p 64 s 23 d 5 – электронная формула атома Mn
 Все элементы в ПС подразделяют на электронные семейства: s-, p-, d-, f – элементы. Элемент относят к тому или иному электронному семейству в зависимости от того, какой подуровень атома заполняется электронами последним. элемент электронная формула электронное семейство Be (№ 4, n = 2) 1 s 22 s 2 s – элемент О (№ 8, n = 2) 1 s 22 p 4 p – элемент Ti (№ 22, n = 4) 1 s 22 p 63 s 23 p 64 s 23 d 2 d – элемент Ce (№ 58, n = 6) 1 s 22 p 63 s 23 p 64 s 23 d 104 p 64 d 105 s 25 p 66 s 24 f 2 f – элемент
Все элементы в ПС подразделяют на электронные семейства: s-, p-, d-, f – элементы. Элемент относят к тому или иному электронному семейству в зависимости от того, какой подуровень атома заполняется электронами последним. элемент электронная формула электронное семейство Be (№ 4, n = 2) 1 s 22 s 2 s – элемент О (№ 8, n = 2) 1 s 22 p 4 p – элемент Ti (№ 22, n = 4) 1 s 22 p 63 s 23 p 64 s 23 d 2 d – элемент Ce (№ 58, n = 6) 1 s 22 p 63 s 23 p 64 s 23 d 104 p 64 d 105 s 25 p 66 s 24 f 2 f – элемент
 Электроны, которые находятся у элементов на внешнем энергетическом уровне, называют валентными. Число валентных электронов у элементов совпадает с номером группы элемента в ПС. Элемент электронная формула число валентных электронов Al (№ 13, n = 3) 1 s 22 p 63 s 23 p 1 3 K (№ 19, n = 4) 1 s 22 p 63 s 23 p 64 s 1 1 F (№ 9, n = 2) 1 s 22 p 5 7 Mn (№ 25, n = 4) 1 s 22 p 63 s 23 p 63 d 54 s 2 7 У d – и f – элементов валентными электронами являются электроны не только на внешнем уровне, но и соответствующие d – и f – электроны.
Электроны, которые находятся у элементов на внешнем энергетическом уровне, называют валентными. Число валентных электронов у элементов совпадает с номером группы элемента в ПС. Элемент электронная формула число валентных электронов Al (№ 13, n = 3) 1 s 22 p 63 s 23 p 1 3 K (№ 19, n = 4) 1 s 22 p 63 s 23 p 64 s 1 1 F (№ 9, n = 2) 1 s 22 p 5 7 Mn (№ 25, n = 4) 1 s 22 p 63 s 23 p 63 d 54 s 2 7 У d – и f – элементов валентными электронами являются электроны не только на внешнем уровне, но и соответствующие d – и f – электроны.
 Валентность элемента – свойство атома элемента присоединять к себе один или несколько атомов другого элемента. Валентность элемента определяется числом неспаренных электронов в его атоме в данном состоянии. Максимальная валентность элемента определяется номером группы элемента в ПС. Валентность элемента может быть постоянной или переменной. Это зависит от электронной конфигурации атома этого элемента, от возможностей атома элемента переходить в возбужденное состояние.
Валентность элемента – свойство атома элемента присоединять к себе один или несколько атомов другого элемента. Валентность элемента определяется числом неспаренных электронов в его атоме в данном состоянии. Максимальная валентность элемента определяется номером группы элемента в ПС. Валентность элемента может быть постоянной или переменной. Это зависит от электронной конфигурации атома этого элемента, от возможностей атома элемента переходить в возбужденное состояние.
 6 С (№ = 6, n = 2) Стационарное состояние C E Возбужденное состояние C* n=1 1 s 1 s n=2 2 s 2 s 2 p Валентность: 2 2 p Валентность: 4
6 С (№ = 6, n = 2) Стационарное состояние C E Возбужденное состояние C* n=1 1 s 1 s n=2 2 s 2 s 2 p Валентность: 2 2 p Валентность: 4
 Наиболее устойчивы те электронные конфигурации, когда атомные орбитали заполнены электронами наполовину или полностью. F № = 9, n = 2 Ne № = 10, n = 2 n=1 1 s 1 s n=2 2 s 2 s 2 p 2 p У неона более устойчивая конфигурация, т. к. все орбитали заполнены электронами. Неон – это инертный газ.
Наиболее устойчивы те электронные конфигурации, когда атомные орбитали заполнены электронами наполовину или полностью. F № = 9, n = 2 Ne № = 10, n = 2 n=1 1 s 1 s n=2 2 s 2 s 2 p 2 p У неона более устойчивая конфигурация, т. к. все орбитали заполнены электронами. Неон – это инертный газ.
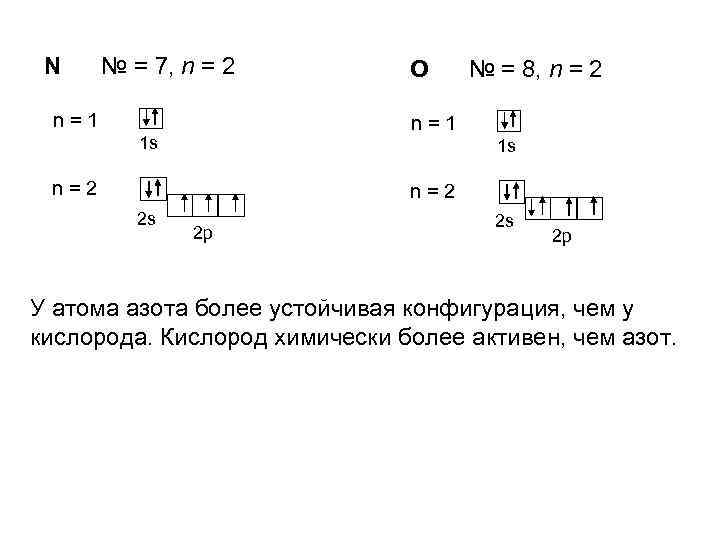 N № = 7, n = 2 n=1 O № = 8, n = 2 n=1 1 s 1 s n=2 2 s 2 p У атома азота более устойчивая конфигурация, чем у кислорода. Кислород химически более активен, чем азот.
N № = 7, n = 2 n=1 O № = 8, n = 2 n=1 1 s 1 s n=2 2 s 2 p У атома азота более устойчивая конфигурация, чем у кислорода. Кислород химически более активен, чем азот.
 Современная трактовка периодического закона: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Все свойства элементов закономерно изменяются по периодам и группам периодической системы.
Современная трактовка периодического закона: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Все свойства элементов закономерно изменяются по периодам и группам периодической системы.
 1. Размеры атомов и ионов Атомные радиусы элементов зависят от заряда ядра атома. В пределах одного периода с увеличением заряда ядра атома (т. е. с увеличением порядкового номера элемента) атомный радиус элементов уменьшается. В пределах одной подгруппы радиусы атомов с увеличением порядкового номера элемента увеличиваются. Закономерность изменения радиусов ионов по периодам и подгруппам такая же, что и для атомных радиусов.
1. Размеры атомов и ионов Атомные радиусы элементов зависят от заряда ядра атома. В пределах одного периода с увеличением заряда ядра атома (т. е. с увеличением порядкового номера элемента) атомный радиус элементов уменьшается. В пределах одной подгруппы радиусы атомов с увеличением порядкового номера элемента увеличиваются. Закономерность изменения радиусов ионов по периодам и подгруппам такая же, что и для атомных радиусов.
 2. Энергия ионизации и сродство к электрону Энергия ионизации – количество энергии, которое необходимо затратить для отрыва одного электрона от невозбужденного атома. Величина энергии ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше энергия ионизации, тем легче оторвать электрон от атома, тем сильнее выражены металлические свойства этого элемента. Энергия ионизации в пределах одной подгруппы периодической системы с увеличением порядкового номера элемента уменьшается, в пределах одного периода – увеличивается.
2. Энергия ионизации и сродство к электрону Энергия ионизации – количество энергии, которое необходимо затратить для отрыва одного электрона от невозбужденного атома. Величина энергии ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше энергия ионизации, тем легче оторвать электрон от атома, тем сильнее выражены металлические свойства этого элемента. Энергия ионизации в пределах одной подгруппы периодической системы с увеличением порядкового номера элемента уменьшается, в пределах одного периода – увеличивается.
 Энергия, которая выделяется присоединении одного электрона к свободному атому, называется сродством атома к электрону. Сродство к электрону характерно для атомов неметаллов. Сродство атома к электрону по периоду возрастает, вниз по подгруппе уменьшается.
Энергия, которая выделяется присоединении одного электрона к свободному атому, называется сродством атома к электрону. Сродство к электрону характерно для атомов неметаллов. Сродство атома к электрону по периоду возрастает, вниз по подгруппе уменьшается.
 3. Электроотрицательность = ½ (Еи + Ее), где Еи – энергия ионизации, Ее – сродство атома к электрону Электроотрицательность элементов с увеличением порядкового номера в периодах возрастает, а в подгруппах уменьшается.
3. Электроотрицательность = ½ (Еи + Ее), где Еи – энергия ионизации, Ее – сродство атома к электрону Электроотрицательность элементов с увеличением порядкового номера в периодах возрастает, а в подгруппах уменьшается.
 Тема 2. Химическая связь и строение молекул Химическая связь – это явление взаимодействия атомов элементов, обусловленное перекрыванием их электронных облаков, которое сопровождается уменьшением полной энергии системы. Химическая связь имеет электронную природу.
Тема 2. Химическая связь и строение молекул Химическая связь – это явление взаимодействия атомов элементов, обусловленное перекрыванием их электронных облаков, которое сопровождается уменьшением полной энергии системы. Химическая связь имеет электронную природу.
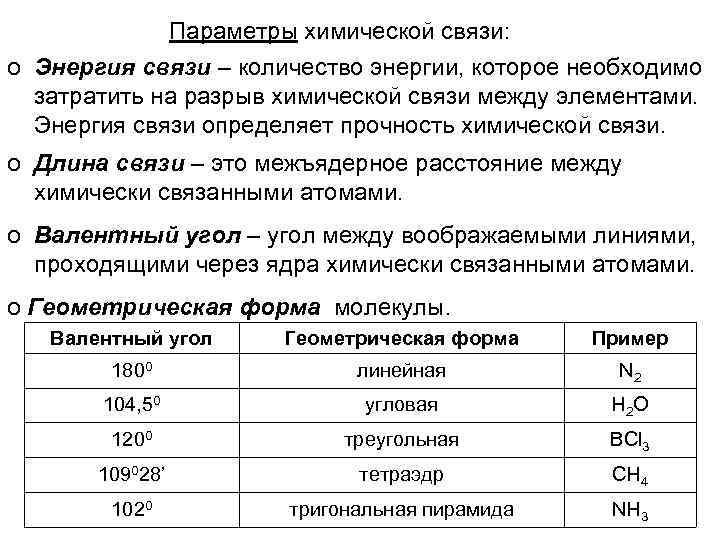 Параметры химической связи: o Энергия связи – количество энергии, которое необходимо затратить на разрыв химической связи между элементами. Энергия связи определяет прочность химической связи. o Длина связи – это межъядерное расстояние между химически связанными атомами. o Валентный угол – угол между воображаемыми линиями, проходящими через ядра химически связанными атомами. o Геометрическая форма молекулы. Валентный угол Геометрическая форма Пример 1800 линейная N 2 104, 50 угловая Н 2 О 1200 треугольная BCl 3 109028’ тетраэдр СН 4 1020 тригональная пирамида NH 3
Параметры химической связи: o Энергия связи – количество энергии, которое необходимо затратить на разрыв химической связи между элементами. Энергия связи определяет прочность химической связи. o Длина связи – это межъядерное расстояние между химически связанными атомами. o Валентный угол – угол между воображаемыми линиями, проходящими через ядра химически связанными атомами. o Геометрическая форма молекулы. Валентный угол Геометрическая форма Пример 1800 линейная N 2 104, 50 угловая Н 2 О 1200 треугольная BCl 3 109028’ тетраэдр СН 4 1020 тригональная пирамида NH 3
 Виды химической связи: ковалентная ионная металлическая водородная
Виды химической связи: ковалентная ионная металлическая водородная
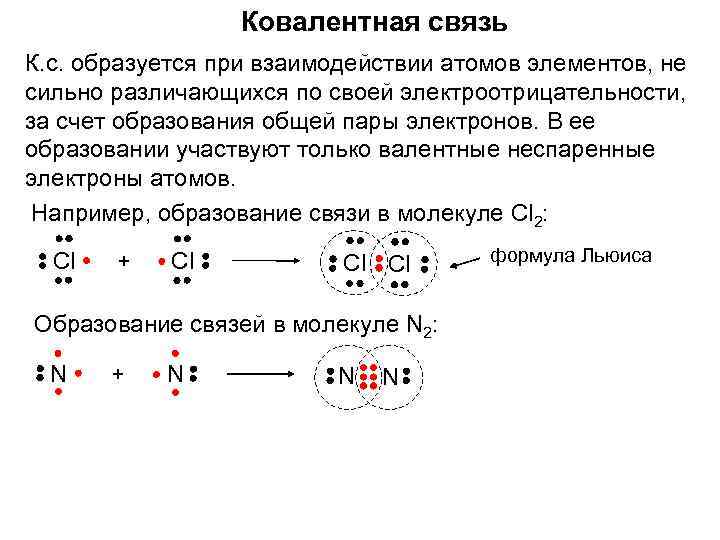 Ковалентная связь К. с. образуется при взаимодействии атомов элементов, не сильно различающихся по своей электроотрицательности, за счет образования общей пары электронов. В ее образовании участвуют только валентные неспаренные электроны атомов. Например, образование связи в молекуле Cl 2: Сl + Сl Сl Сl Образование связей в молекуле N 2: N + N N N формула Льюиса
Ковалентная связь К. с. образуется при взаимодействии атомов элементов, не сильно различающихся по своей электроотрицательности, за счет образования общей пары электронов. В ее образовании участвуют только валентные неспаренные электроны атомов. Например, образование связи в молекуле Cl 2: Сl + Сl Сl Сl Образование связей в молекуле N 2: N + N N N формула Льюиса
 Метод валентных связей (МВС): Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Метод валентных связей (МВС): Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
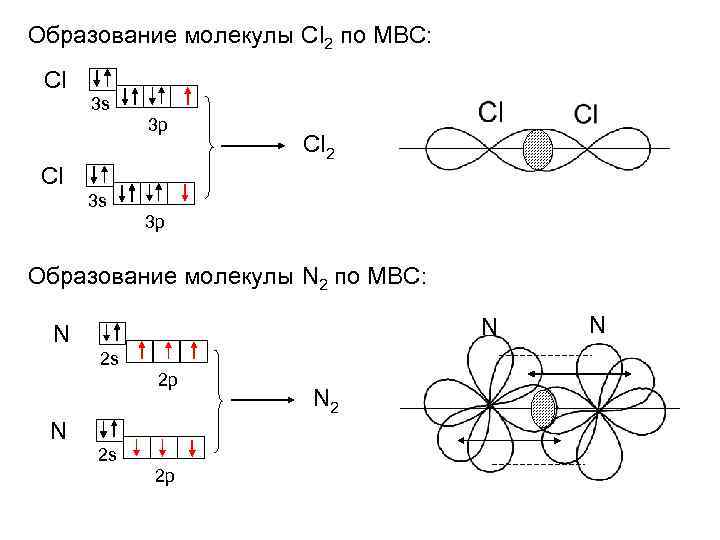 Образование молекулы Сl 2 по МВС: Cl 3 s 3 p Cl 2 Cl 3 s 3 p Образование молекулы N 2 по МВС: N N 2 s 2 p N 2 N
Образование молекулы Сl 2 по МВС: Cl 3 s 3 p Cl 2 Cl 3 s 3 p Образование молекулы N 2 по МВС: N N 2 s 2 p N 2 N
 Донорно-акцепторный механизм образования к. с. А: + В А – В донор акцептор Например, образование иона аммония: H 3 N: + H+ NH 4+
Донорно-акцепторный механизм образования к. с. А: + В А – В донор акцептор Например, образование иона аммония: H 3 N: + H+ NH 4+
 Свойства ковалентной связи: К. с. может быть полярной и неполярной. Неполярная ковалентная связь образуется в результате взаимодействия атомов одинакового типа. Сl Сl Полярная ковалентная связь образуется в результате взаимодействия атомов разных элементов. Н Сl H + Cl - электрический диполь Дипольный момент ( ): = q l, где q – величина заряда, l – расстояние между положительным и отрицательным центрами.
Свойства ковалентной связи: К. с. может быть полярной и неполярной. Неполярная ковалентная связь образуется в результате взаимодействия атомов одинакового типа. Сl Сl Полярная ковалентная связь образуется в результате взаимодействия атомов разных элементов. Н Сl H + Cl - электрический диполь Дипольный момент ( ): = q l, где q – величина заряда, l – расстояние между положительным и отрицательным центрами.
 Насыщаемость к. с. обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго определенного числа связей.
Насыщаемость к. с. обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго определенного числа связей.
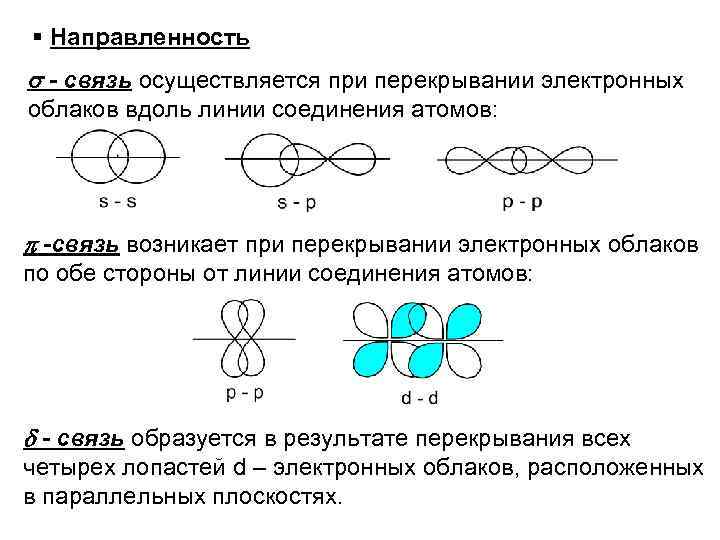 Направленность - связь осуществляется при перекрывании электронных облаков вдоль линии соединения атомов: -связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов: - связь образуется в результате перекрывания всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
Направленность - связь осуществляется при перекрывании электронных облаков вдоль линии соединения атомов: -связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов: - связь образуется в результате перекрывания всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
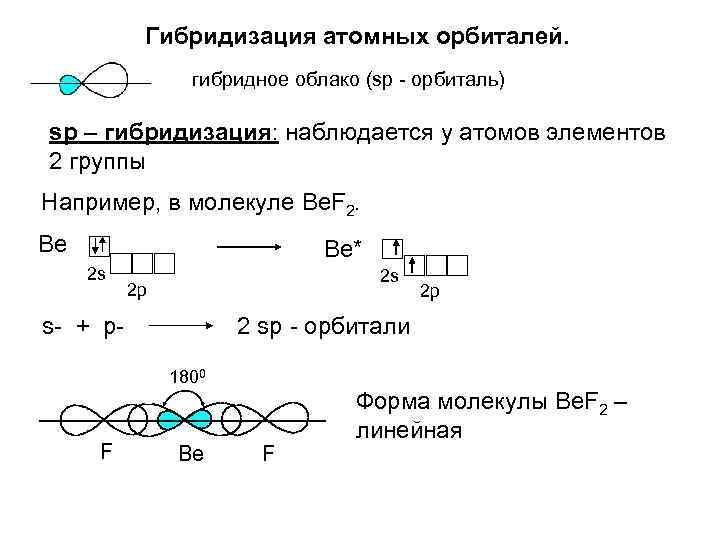 Гибридизация атомных орбиталей. гибридное облако (sp - орбиталь) sp – гибридизация: наблюдается у атомов элементов 2 группы Например, в молекуле Be. F 2. Ве Be* 2 s 2 s 2 p s- + p- 2 sp - орбитали 1800 F 2 p Be F Форма молекулы Be. F 2 – линейная
Гибридизация атомных орбиталей. гибридное облако (sp - орбиталь) sp – гибридизация: наблюдается у атомов элементов 2 группы Например, в молекуле Be. F 2. Ве Be* 2 s 2 s 2 p s- + p- 2 sp - орбитали 1800 F 2 p Be F Форма молекулы Be. F 2 – линейная
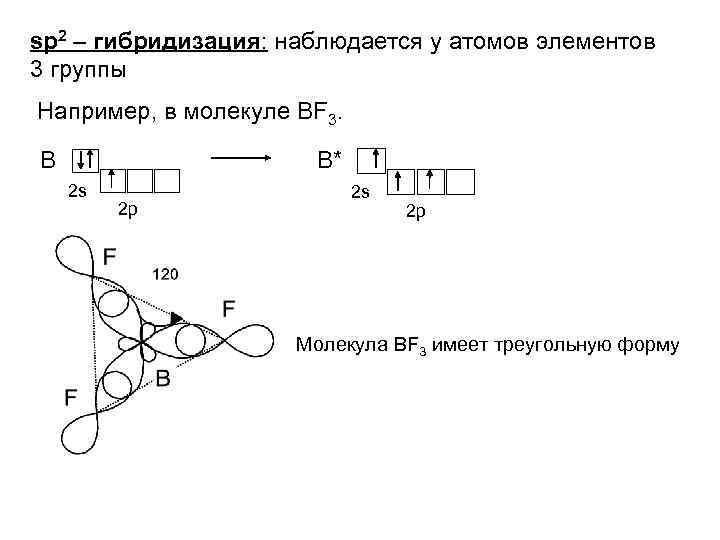 sp 2 – гибридизация: наблюдается у атомов элементов 3 группы Например, в молекуле BF 3. В В* 2 s 2 p Молекула BF 3 имеет треугольную форму
sp 2 – гибридизация: наблюдается у атомов элементов 3 группы Например, в молекуле BF 3. В В* 2 s 2 p Молекула BF 3 имеет треугольную форму
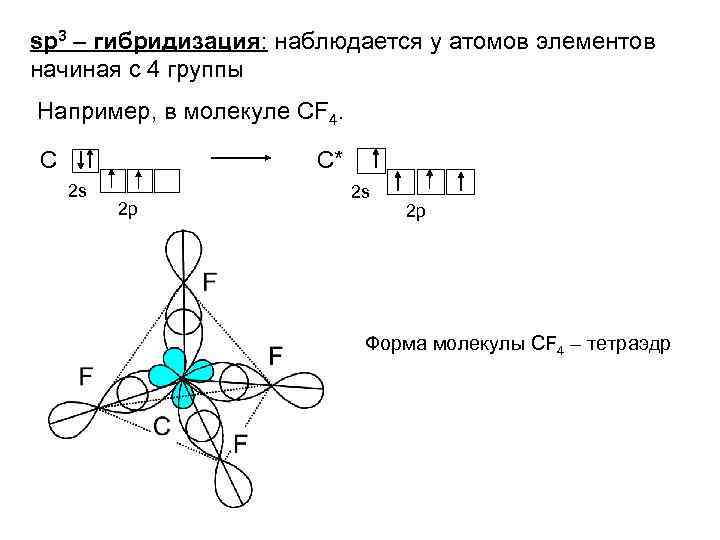 sp 3 – гибридизация: наблюдается у атомов элементов начиная с 4 группы Например, в молекуле СF 4. С С* 2 s 2 p Форма молекулы СF 4 – тетраэдр
sp 3 – гибридизация: наблюдается у атомов элементов начиная с 4 группы Например, в молекуле СF 4. С С* 2 s 2 p Форма молекулы СF 4 – тетраэдр
 Ионная связь И. с. возникает за счет перехода электронов от одного атома к другому атому и представляет собой кулоновское (электростатическое) притяжение между разноименно заряженными ионами. К образованию ионной связи склонны атомы элементов, сильно отличающихся по своей электроотрицательности. Na Cl 1 s 22 p 63 s 1 Na+ Cl– 1 s 22 p 63 s 23 p 5 1 s 22 s 22 p 63 s 23 p 6 1 e Na+Сl–
Ионная связь И. с. возникает за счет перехода электронов от одного атома к другому атому и представляет собой кулоновское (электростатическое) притяжение между разноименно заряженными ионами. К образованию ионной связи склонны атомы элементов, сильно отличающихся по своей электроотрицательности. Na Cl 1 s 22 p 63 s 1 Na+ Cl– 1 s 22 p 63 s 23 p 5 1 s 22 s 22 p 63 s 23 p 6 1 e Na+Сl–
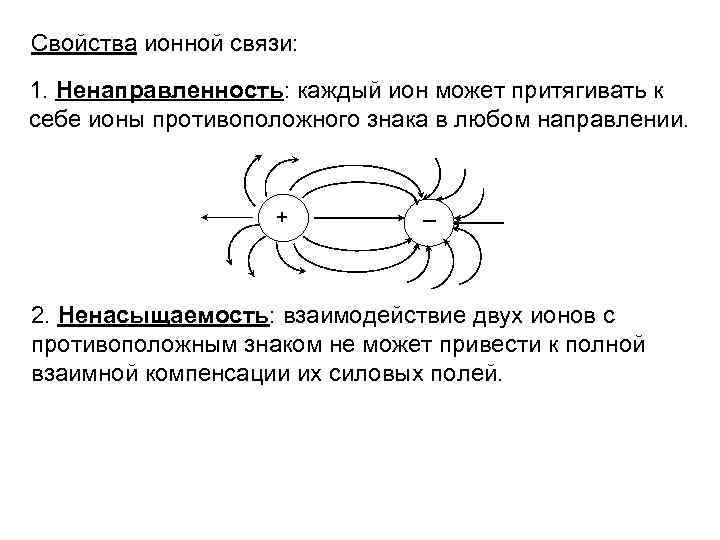 Свойства ионной связи: 1. Ненаправленность: каждый ион может притягивать к себе ионы противоположного знака в любом направлении. + 2. Ненасыщаемость: взаимодействие двух ионов с противоположным знаком не может привести к полной взаимной компенсации их силовых полей.
Свойства ионной связи: 1. Ненаправленность: каждый ион может притягивать к себе ионы противоположного знака в любом направлении. + 2. Ненасыщаемость: взаимодействие двух ионов с противоположным знаком не может привести к полной взаимной компенсации их силовых полей.
 Все ионные соединения имеют упорядоченные структуры – ионные кристаллические решетки – и являются кристаллическими веществами. Na Cl
Все ионные соединения имеют упорядоченные структуры – ионные кристаллические решетки – и являются кристаллическими веществами. Na Cl
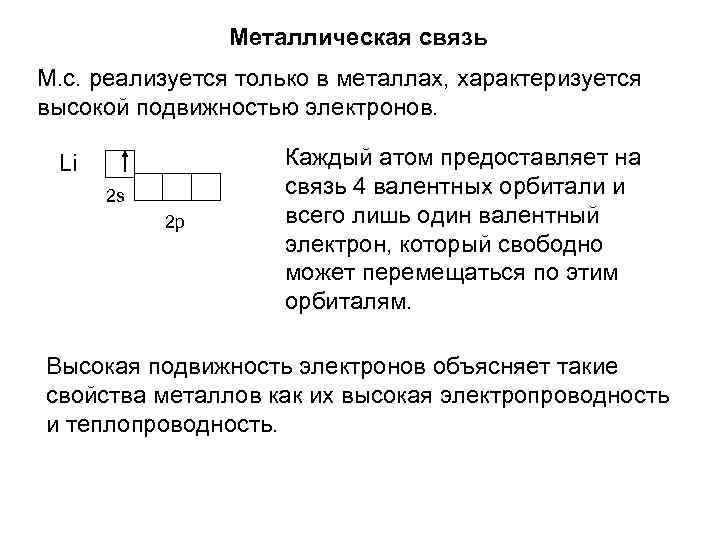 Металлическая связь М. с. реализуется только в металлах, характеризуется высокой подвижностью электронов. Li 2 s 2 p Каждый атом предоставляет на связь 4 валентных орбитали и всего лишь один валентный электрон, который свободно может перемещаться по этим орбиталям. Высокая подвижность электронов объясняет такие свойства металлов как их высокая электропроводность и теплопроводность.
Металлическая связь М. с. реализуется только в металлах, характеризуется высокой подвижностью электронов. Li 2 s 2 p Каждый атом предоставляет на связь 4 валентных орбитали и всего лишь один валентный электрон, который свободно может перемещаться по этим орбиталям. Высокая подвижность электронов объясняет такие свойства металлов как их высокая электропроводность и теплопроводность.
 Водородная связь В. с. наблюдается между молекулами различных веществ, в состав которых входят атомы водорода. X H X = F, O, N водородная связь Основным условием образования в. с. является высокая электроотрицательность атома, непосредственно связанного в молекуле с атомом водорода.
Водородная связь В. с. наблюдается между молекулами различных веществ, в состав которых входят атомы водорода. X H X = F, O, N водородная связь Основным условием образования в. с. является высокая электроотрицательность атома, непосредственно связанного в молекуле с атомом водорода.
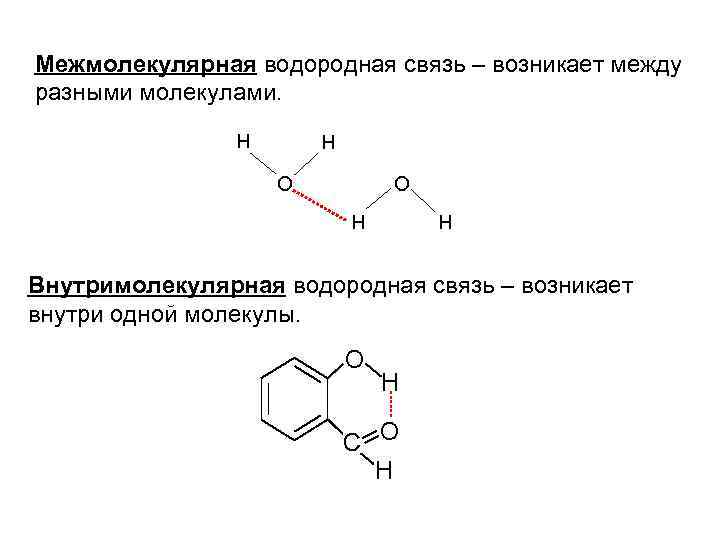 Межмолекулярная водородная связь – возникает между разными молекулами. H H O O H H Внутримолекулярная водородная связь – возникает внутри одной молекулы. O H C O H
Межмолекулярная водородная связь – возникает между разными молекулами. H H O O H H Внутримолекулярная водородная связь – возникает внутри одной молекулы. O H C O H
 Тема 3. Теория химических процессов Химическое превращение – качественный скачок, при котором одни вещества исчезают, а другие образуются. Самой простой стадией любого химического превращения является химическая реакция.
Тема 3. Теория химических процессов Химическое превращение – качественный скачок, при котором одни вещества исчезают, а другие образуются. Самой простой стадией любого химического превращения является химическая реакция.
 Термодинамика химических процессов изучает энергетику химических процессов, принципиальную возможность их протекания, условия их осуществления. Параметрами состояния – давление (Р), температура (Т), объем (V), состав. Эти параметры определяют состояние системы. Функциями состояния – внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G). Функции состояния системы зависят от параметров состояния (P, T, V). Функции состояния не зависят от пути перехода системы из одного состояния в другое, а зависят только от ее начального и конечного состояния (закон Гесса).
Термодинамика химических процессов изучает энергетику химических процессов, принципиальную возможность их протекания, условия их осуществления. Параметрами состояния – давление (Р), температура (Т), объем (V), состав. Эти параметры определяют состояние системы. Функциями состояния – внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G). Функции состояния системы зависят от параметров состояния (P, T, V). Функции состояния не зависят от пути перехода системы из одного состояния в другое, а зависят только от ее начального и конечного состояния (закон Гесса).
 В химических превращениях участвуют тепловая энергия (Q) и механическая энергия (А). Любая система обладает скрытым видом энергии – внутренней энергии (U). Внутренняя энергия U – это общий запас энергии системы, который складывается из потенциальной энергии взаимодействия всех частиц системы и кинетической энергии их движения. Первый закон термодинамики: поглощенная системой теплота (Q) расходуется на изменение внутренней энергии системы ( U) и на совершение этой системой работы (А) Q = U + A
В химических превращениях участвуют тепловая энергия (Q) и механическая энергия (А). Любая система обладает скрытым видом энергии – внутренней энергии (U). Внутренняя энергия U – это общий запас энергии системы, который складывается из потенциальной энергии взаимодействия всех частиц системы и кинетической энергии их движения. Первый закон термодинамики: поглощенная системой теплота (Q) расходуется на изменение внутренней энергии системы ( U) и на совершение этой системой работы (А) Q = U + A
 Большинство химических реакций протекает при постоянном давлении (P = const), а работа А – это работа расширения против сил внешнего давления (Р), которая зависит от объема системы, т. е. А = Р V = P (V 2 – V 1). Qp = U + P V = U 2 – U 1 + P (V 2 – V 1) = (U 2 + PV 2) – (U 1 + PV 1) Сумму U + PV = Н называют энтальпией. Изменение энтальпии – это то количество теплоты, которое выделяется или поглощается системой при постоянном давлении (P = const), т. е. Qp = H 2 – H 1 = H Изменение энтальпии определяет тепловой эффект реакции.
Большинство химических реакций протекает при постоянном давлении (P = const), а работа А – это работа расширения против сил внешнего давления (Р), которая зависит от объема системы, т. е. А = Р V = P (V 2 – V 1). Qp = U + P V = U 2 – U 1 + P (V 2 – V 1) = (U 2 + PV 2) – (U 1 + PV 1) Сумму U + PV = Н называют энтальпией. Изменение энтальпии – это то количество теплоты, которое выделяется или поглощается системой при постоянном давлении (P = const), т. е. Qp = H 2 – H 1 = H Изменение энтальпии определяет тепловой эффект реакции.
 Процессы, протекающие с выделением теплоты, называют экзотермическими (для них Н 0). Процессы, идущие с поглощением теплоты, называют эндотермическими (для них Н 0). Уравнения реакций, учитывающие тепловой эффект и агрегатное состояние исходных веществ и продуктов реакции, называются термохимическими. 2 Н 2 (г) + О 2 (г) 2 Н 2 О (г), Н = - 476 к. Дж
Процессы, протекающие с выделением теплоты, называют экзотермическими (для них Н 0). Процессы, идущие с поглощением теплоты, называют эндотермическими (для них Н 0). Уравнения реакций, учитывающие тепловой эффект и агрегатное состояние исходных веществ и продуктов реакции, называются термохимическими. 2 Н 2 (г) + О 2 (г) 2 Н 2 О (г), Н = - 476 к. Дж
 Расчет теплового эффекта реакции 1) По теплоте образования веществ: Например, для реакции 2 Н 2(г) + О 2(г) 2 Н 2 О(г) 2) По теплоте сгорания веществ:
Расчет теплового эффекта реакции 1) По теплоте образования веществ: Например, для реакции 2 Н 2(г) + О 2(г) 2 Н 2 О(г) 2) По теплоте сгорания веществ:
 Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменение упорядоченности системы. Количественной мерой беспорядка является энтропия (S). Второй закон термодинамики: часть количества теплоты, которое передается системе, идет на изменение энтропии S = Н / Т Энтропия – это функция состояния системы. Для нее также выполняется закон Гесса:
Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменение упорядоченности системы. Количественной мерой беспорядка является энтропия (S). Второй закон термодинамики: часть количества теплоты, которое передается системе, идет на изменение энтропии S = Н / Т Энтропия – это функция состояния системы. Для нее также выполняется закон Гесса:
 Об изменении энтропии в химической реакции можно судить по изменению объема системы в ходе реакции. Например, С(т) + СО 2(г) 2 СО(г) Учитывают объемы только газообразных веществ. Реакция сопровождается увеличением объема (был 1 объем, стало 2 объема) V 0, следовательно, S 0. 3 Н 2 (г) + N 2 (г) 2 NН 3 (г) Реакция сопровождается уменьшением объема (было 4 объема, стало 2 объема) V 0, следовательно, S 0.
Об изменении энтропии в химической реакции можно судить по изменению объема системы в ходе реакции. Например, С(т) + СО 2(г) 2 СО(г) Учитывают объемы только газообразных веществ. Реакция сопровождается увеличением объема (был 1 объем, стало 2 объема) V 0, следовательно, S 0. 3 Н 2 (г) + N 2 (г) 2 NН 3 (г) Реакция сопровождается уменьшением объема (было 4 объема, стало 2 объема) V 0, следовательно, S 0.
 Все химические процессы можно разделить на: Самопроизвольные процессы – это процессы, которые протекают без внешнего воздействия. Несамопроизвольные процессы – это процессы, для осуществления которых требуется затрата энергии или работы из вне.
Все химические процессы можно разделить на: Самопроизвольные процессы – это процессы, которые протекают без внешнего воздействия. Несамопроизвольные процессы – это процессы, для осуществления которых требуется затрата энергии или работы из вне.
 О самопроизвольности процесса можно судить по характеру изменения энергии Гиббса (G). G = H – T S Если для системы G 0, то процесс является термодинамически разрешенным и самопроизвольным. Если G 0 , то процесс в данных условиях термодинамически запрещен и несамопроизвольный. Если G = 0, то система находиться в состоянии химического равновесия.
О самопроизвольности процесса можно судить по характеру изменения энергии Гиббса (G). G = H – T S Если для системы G 0, то процесс является термодинамически разрешенным и самопроизвольным. Если G 0 , то процесс в данных условиях термодинамически запрещен и несамопроизвольный. Если G = 0, то система находиться в состоянии химического равновесия.
 Энергия Гиббса является функцией состояния и для нее выполняется закон Гесса: Например, 2 NO(г) + О 2(г) 2 NO 2(г)
Энергия Гиббса является функцией состояния и для нее выполняется закон Гесса: Например, 2 NO(г) + О 2(г) 2 NO 2(г)
 Кинетический аспект химических реакций Гомогенные реакции протекают в однородной среде. 2 NO(г) + O 2(г) 2 NO 2(г) Гетерогенные реакции – это реакции, которые протекают между веществами, находящимися в разных фазах (твердой и жидкой; жидкой и газовой и т. д. ). Fe(т) + 2 HCl(ж) Fe. Cl 2 + H 2
Кинетический аспект химических реакций Гомогенные реакции протекают в однородной среде. 2 NO(г) + O 2(г) 2 NO 2(г) Гетерогенные реакции – это реакции, которые протекают между веществами, находящимися в разных фазах (твердой и жидкой; жидкой и газовой и т. д. ). Fe(т) + 2 HCl(ж) Fe. Cl 2 + H 2
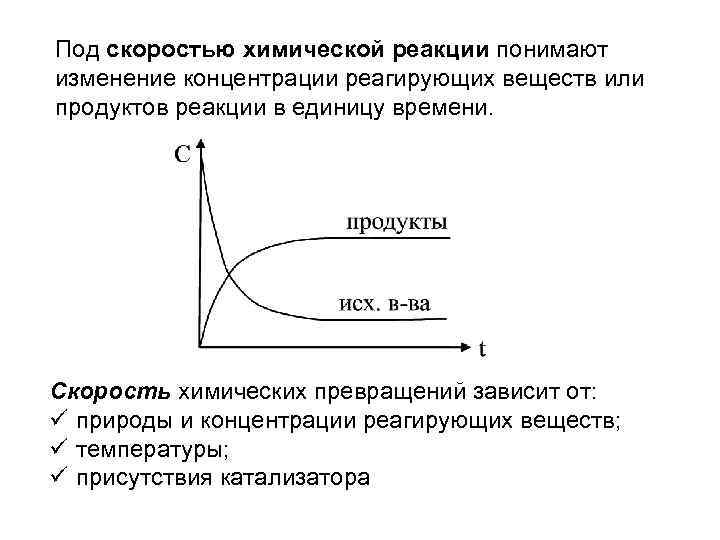 Под скоростью химической реакции понимают изменение концентрации реагирующих веществ или продуктов реакции в единицу времени. Скорость химических превращений зависит от: природы и концентрации реагирующих веществ; температуры; присутствия катализатора
Под скоростью химической реакции понимают изменение концентрации реагирующих веществ или продуктов реакции в единицу времени. Скорость химических превращений зависит от: природы и концентрации реагирующих веществ; температуры; присутствия катализатора
 1. Зависимость скорости реакции от концентрации реагирующих веществ. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ (основной закон химической кинетики или закон действия масс). a. A + b. B c. C где k – константа скорости реакции; [A] и [B] – концентрации исходных веществ; a и b – стехиометрические коэффициенты. k = , когда [A] = [B] = 1. Зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ.
1. Зависимость скорости реакции от концентрации реагирующих веществ. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ (основной закон химической кинетики или закон действия масс). a. A + b. B c. C где k – константа скорости реакции; [A] и [B] – концентрации исходных веществ; a и b – стехиометрические коэффициенты. k = , когда [A] = [B] = 1. Зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ.
 В системе протекает гомогенная реакция: 2 NO(г) + O 2 (г) 2 NO 2 (г) = k NO 2 В системе протекает гетерогенная реакция: С(т) + О 2(г) СО 2(г) = k O 2 В случае гетерогенных реакций в уравнение закона действия масс входят концентрации веществ, которые находятся в газообразном состоянии или в растворе.
В системе протекает гомогенная реакция: 2 NO(г) + O 2 (г) 2 NO 2 (г) = k NO 2 В системе протекает гетерогенная реакция: С(т) + О 2(г) СО 2(г) = k O 2 В случае гетерогенных реакций в уравнение закона действия масс входят концентрации веществ, которые находятся в газообразном состоянии или в растворе.
 2. Зависимость скорости реакции от температуры Правило Вант - Гоффа: при повышении температуры на 100 скорость большинства реакций увеличивается в 2 – 4 раза где - температурный коэффициент реакции:
2. Зависимость скорости реакции от температуры Правило Вант - Гоффа: при повышении температуры на 100 скорость большинства реакций увеличивается в 2 – 4 раза где - температурный коэффициент реакции:
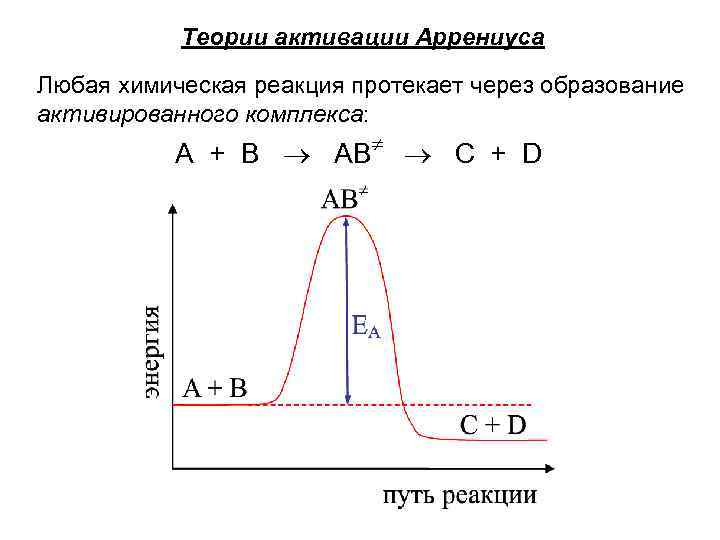 Теории активации Аррениуса Любая химическая реакция протекает через образование активированного комплекса: A + B AB C + D
Теории активации Аррениуса Любая химическая реакция протекает через образование активированного комплекса: A + B AB C + D
 Энергия активации (ЕА) – энергия, которую необходимо сообщить реагирующим веществам, чтобы перевести их в активированное состояние, т. е. в такое состояние, когда молекулы исходных веществ способны к химическому превращению. уравнение Аррениуса где k – константа скорости реакции; А 0 – предэкспоненциальный множитель - характеризует долю «удачных» столкновений, приводящих к химическому превращению; ЕА – энергия активации; R – универсальная газовая постоянная 8, 31 Дж/(моль К); Т – температура.
Энергия активации (ЕА) – энергия, которую необходимо сообщить реагирующим веществам, чтобы перевести их в активированное состояние, т. е. в такое состояние, когда молекулы исходных веществ способны к химическому превращению. уравнение Аррениуса где k – константа скорости реакции; А 0 – предэкспоненциальный множитель - характеризует долю «удачных» столкновений, приводящих к химическому превращению; ЕА – энергия активации; R – универсальная газовая постоянная 8, 31 Дж/(моль К); Т – температура.
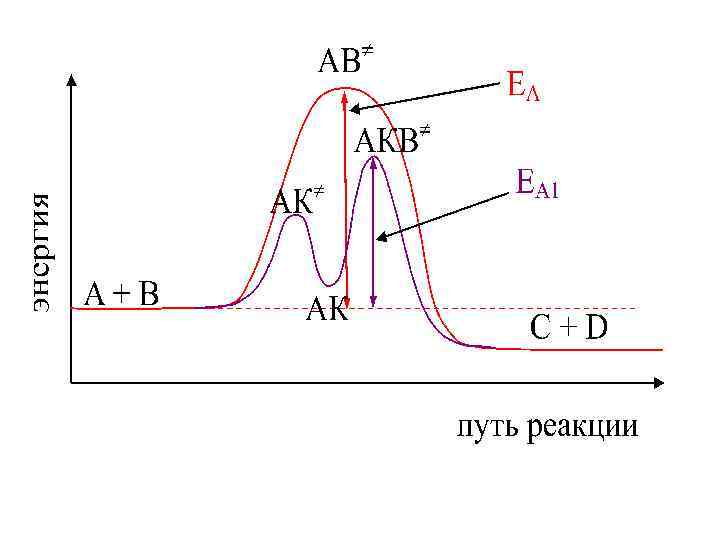
 3. Зависимость скорости химической реакции от присутствия катализатора Катализаторы – это вещества, которые ускоряют химическую реакцию, но в ней не участвуют. Катализатор изменяет путь реакции, снижая ее энергию активации. Реакция протекает без катализатора по следующей схеме: A + B AB C + D (ЕА) В присутствии катализатора: A + K AK AK + B AKB C + D + K (ЕА 1)
3. Зависимость скорости химической реакции от присутствия катализатора Катализаторы – это вещества, которые ускоряют химическую реакцию, но в ней не участвуют. Катализатор изменяет путь реакции, снижая ее энергию активации. Реакция протекает без катализатора по следующей схеме: A + B AB C + D (ЕА) В присутствии катализатора: A + K AK AK + B AKB C + D + K (ЕА 1)
 Химическое равновесие Большинство химических реакций являются обратимыми, т. е. могут протекать как в прямом направлении, так и в обратном направлении. 1 2 Состояние, когда реакция идет в прямом и обратном направлениях с одинаковой скоростью, т. е. 1 = 2, называют химическим равновесием.
Химическое равновесие Большинство химических реакций являются обратимыми, т. е. могут протекать как в прямом направлении, так и в обратном направлении. 1 2 Состояние, когда реакция идет в прямом и обратном направлениях с одинаковой скоростью, т. е. 1 = 2, называют химическим равновесием.
 Признаки химического равновесия 1. Признак неизменности: состояние системы остается неизменным во времени при отсутствии внешних воздействий; 2. Подвижность химического равновесия: состояние системы изменяется под влиянием внешних воздействий, даже если они очень малы; при прекращении этих воздействий система вновь возвращается в состояние равновесия; 3. Признак двусторонности: равновесное состояние не зависит от того, с какой стороны к нему подойти – со стороны исходных веществ или со стороны продуктов реакции. 4. Изменение энергии Гиббса: в состоянии химического равновесия G = 0.
Признаки химического равновесия 1. Признак неизменности: состояние системы остается неизменным во времени при отсутствии внешних воздействий; 2. Подвижность химического равновесия: состояние системы изменяется под влиянием внешних воздействий, даже если они очень малы; при прекращении этих воздействий система вновь возвращается в состояние равновесия; 3. Признак двусторонности: равновесное состояние не зависит от того, с какой стороны к нему подойти – со стороны исходных веществ или со стороны продуктов реакции. 4. Изменение энергии Гиббса: в состоянии химического равновесия G = 0.
 В состоянии равновесия скорости прямой и обратной реакций равны: Закон действия масс для обратимых процессов: соотношение равновесных концентраций продуктов и исходных веществ при данной температуре есть величина постоянная и равно константе равновесия данной реакции.
В состоянии равновесия скорости прямой и обратной реакций равны: Закон действия масс для обратимых процессов: соотношение равновесных концентраций продуктов и исходных веществ при данной температуре есть величина постоянная и равно константе равновесия данной реакции.
 Константа равновесия химической реакции определяет глубину ее протекания к моменту достижения равновесия. Чем больше Кравн, тем больше степень превращения исходных веществ в продукты. На значение константы равновесия (Кравн) влияет природа реагирующих веществ и температура. Присутствие катализатора и концентрация реагирующих веществ на величину Кравн не влияют.
Константа равновесия химической реакции определяет глубину ее протекания к моменту достижения равновесия. Чем больше Кравн, тем больше степень превращения исходных веществ в продукты. На значение константы равновесия (Кравн) влияет природа реагирующих веществ и температура. Присутствие катализатора и концентрация реагирующих веществ на величину Кравн не влияют.
 Зависимость константы равновесия от температуры Уравнение Вант - Гоффа: где Н – тепловой эффект реакции, R – универсальная газовая постоянная, Т – температура. 1. Если Н 0 (прямая реакция эндотермическая), то с повышением температуры значение константы равновесия увеличивается. 2. Если Н 0 (реакция экзотермическая), то повышение температуры приводит к снижению значения константы равновесия.
Зависимость константы равновесия от температуры Уравнение Вант - Гоффа: где Н – тепловой эффект реакции, R – универсальная газовая постоянная, Т – температура. 1. Если Н 0 (прямая реакция эндотермическая), то с повышением температуры значение константы равновесия увеличивается. 2. Если Н 0 (реакция экзотермическая), то повышение температуры приводит к снижению значения константы равновесия.
 Применение закона действия масс для обратимых процессов Гомогенные реакции а) H 2(г) + J 2(г) 2 HJ(г) б) С 2 Н 5 ОН(ж) + СН 3 СООН(ж) СН 3 СООС 2 Н 5(ж) + Н 2 О(ж)
Применение закона действия масс для обратимых процессов Гомогенные реакции а) H 2(г) + J 2(г) 2 HJ(г) б) С 2 Н 5 ОН(ж) + СН 3 СООН(ж) СН 3 СООС 2 Н 5(ж) + Н 2 О(ж)
 Гетерогенные реакции а) С(т) + О 2(г) СО 2 б) С(т) + СО 2(г) 2 СО(г) в) Sb 2 S 3(т) + 3 H 2(г) 2 Sb(т) + 3 H 2 S(г)
Гетерогенные реакции а) С(т) + О 2(г) СО 2 б) С(т) + СО 2(г) 2 СО(г) в) Sb 2 S 3(т) + 3 H 2(г) 2 Sb(т) + 3 H 2 S(г)
 В состоянии равновесия химическая система, если не оказывать на нее никакого воздействия, может находиться бесконечно долгое время. Если же на нее оказывается какое-либо воздействие, то система выйдет из состояния равновесия. Химическое равновесие может нарушаться: при изменении концентрации одного из веществ; при изменении давления; при изменении температуры. Принцип Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в том направлении, которое способствует ослаблению этого воздействия.
В состоянии равновесия химическая система, если не оказывать на нее никакого воздействия, может находиться бесконечно долгое время. Если же на нее оказывается какое-либо воздействие, то система выйдет из состояния равновесия. Химическое равновесие может нарушаться: при изменении концентрации одного из веществ; при изменении давления; при изменении температуры. Принцип Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в том направлении, которое способствует ослаблению этого воздействия.
![Влияние изменения концентраций СО(г) + Cl 2(г) СОCl 2(г) 1. Увеличиваем [COCl 2], равновесие Влияние изменения концентраций СО(г) + Cl 2(г) СОCl 2(г) 1. Увеличиваем [COCl 2], равновесие](https://present5.com/presentation/18811058_437083175/image-74.jpg) Влияние изменения концентраций СО(г) + Cl 2(г) СОCl 2(г) 1. Увеличиваем [COCl 2], равновесие смещается в сторону исходных веществ (←) 2. Увеличиваем [Cl 2], равновесие смещается в сторону продуктов ( ) 3. Уменьшаем [CO], равновесие смещается в сторону исходных веществ (←)
Влияние изменения концентраций СО(г) + Cl 2(г) СОCl 2(г) 1. Увеличиваем [COCl 2], равновесие смещается в сторону исходных веществ (←) 2. Увеличиваем [Cl 2], равновесие смещается в сторону продуктов ( ) 3. Уменьшаем [CO], равновесие смещается в сторону исходных веществ (←)
 Влияние температуры Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции; понижение температуры – в сторону экзотермической реакции. A + B C + D, H 0 При повышении температуры равновесие смещается в сторону продуктов С и D, при понижении – в сторону исходных веществ А и В.
Влияние температуры Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции; понижение температуры – в сторону экзотермической реакции. A + B C + D, H 0 При повышении температуры равновесие смещается в сторону продуктов С и D, при понижении – в сторону исходных веществ А и В.
 Влияние изменения давления Изменение давления влияет на состояние равновесия в тех случаях, когда реакция сопровождается изменением объема системы. Повышение давления сдвигает химическое равновесие в сторону реакции, идущей с уменьшением объема. При понижении давления равновесие смещается в сторону реакции, идущей с увеличением объема. N 2 O 4(г) 2 NO 2(г) 1 объем 2 объема При повышении давления равновесие смещается в сторону N 2 O 4. При понижении давления в сторону NO 2.
Влияние изменения давления Изменение давления влияет на состояние равновесия в тех случаях, когда реакция сопровождается изменением объема системы. Повышение давления сдвигает химическое равновесие в сторону реакции, идущей с уменьшением объема. При понижении давления равновесие смещается в сторону реакции, идущей с увеличением объема. N 2 O 4(г) 2 NO 2(г) 1 объем 2 объема При повышении давления равновесие смещается в сторону N 2 O 4. При понижении давления в сторону NO 2.
 H 2(г) + J 2(г) 2 HJ(г) 2 объема Изменение давления не влияет на смещение равновесия этой реакции. 2 С(т) + О 2(г) 2 СО(г) 1 объем 2 объема При повышении давления равновесие смещается влево ( ), при уменьшении – вправо ( ).
H 2(г) + J 2(г) 2 HJ(г) 2 объема Изменение давления не влияет на смещение равновесия этой реакции. 2 С(т) + О 2(г) 2 СО(г) 1 объем 2 объема При повышении давления равновесие смещается влево ( ), при уменьшении – вправо ( ).
 Тема 4. Химические системы. Раствором называется гомогенная система, состоящая не менее чем из двух компонентов. Растворителем называют компонент раствора, который имеется в избытке по сравнению с другими компонентами. Остальные компоненты, которые находятся в растворе в меньшем количестве, называются растворенными веществами.
Тема 4. Химические системы. Раствором называется гомогенная система, состоящая не менее чем из двух компонентов. Растворителем называют компонент раствора, который имеется в избытке по сравнению с другими компонентами. Остальные компоненты, которые находятся в растворе в меньшем количестве, называются растворенными веществами.
 Концентрация – это величина, выражающая относительное содержание растворенного вещества в растворе. Способы выражения концентрации растворов: Процентная концентрация – это масса растворенного вещества в 100 г раствора, выраженная в процентах. Массовая концентрация – это отношение массы растворенного вещества к объему раствора.
Концентрация – это величина, выражающая относительное содержание растворенного вещества в растворе. Способы выражения концентрации растворов: Процентная концентрация – это масса растворенного вещества в 100 г раствора, выраженная в процентах. Массовая концентрация – это отношение массы растворенного вещества к объему раствора.
 Молярная концентрация – отношение числа молей растворенного вещества к объему раствора. Молярная концентрация эквивалентов – отношение числа молей эквивалента вещества к объему раствора.
Молярная концентрация – отношение числа молей растворенного вещества к объему раствора. Молярная концентрация эквивалентов – отношение числа молей эквивалента вещества к объему раствора.
 Моляльная концентрация – отношение числа молей растворенного вещества к массе растворителя. Доля компонента (мольная, массовая, объемная) – отношение числа частей компонента к общему числу частей объекта.
Моляльная концентрация – отношение числа молей растворенного вещества к массе растворителя. Доля компонента (мольная, массовая, объемная) – отношение числа частей компонента к общему числу частей объекта.
 Коллигативные свойства растворов Свойства растворов, которые зависят от концентрации раствора, называют коллигативными. Давление пара растворов Равновесие: жидкость пар Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление, которое оказывает насыщенный пар на жидкость, называют давлением насыщенного пара. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Коллигативные свойства растворов Свойства растворов, которые зависят от концентрации раствора, называют коллигативными. Давление пара растворов Равновесие: жидкость пар Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление, которое оказывает насыщенный пар на жидкость, называют давлением насыщенного пара. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
 I закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. где Р 0 – давление насыщенного пара над чистым растворителем; Р – давление насыщенного пара растворителя над раствором; x 2 – мольная доля растворенного вещества.
I закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. где Р 0 – давление насыщенного пара над чистым растворителем; Р – давление насыщенного пара растворителя над раствором; x 2 – мольная доля растворенного вещества.
 Температуры замерзания и кипения растворов II закон Рауля: повышение температуры кипения или понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества где t 0 кип, t 0 зам – для чистого растворителя; tкип, tзам – для раствора; КЭ - эбуллиоскопическая постоянная; КЗ – криоскопическая постоянная; m – моляльная концентрация раствора.
Температуры замерзания и кипения растворов II закон Рауля: повышение температуры кипения или понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества где t 0 кип, t 0 зам – для чистого растворителя; tкип, tзам – для раствора; КЭ - эбуллиоскопическая постоянная; КЗ – криоскопическая постоянная; m – моляльная концентрация раствора.
 Явление осмоса Явление самопроизвольного перехода растворителя через полупроницаемую перегородку в раствор с большей концентрацией называют осмосом. Количественной характеристикой осмоса является осмотическое давление. Осмотическое давление – это мера силы, с которой растворитель стремиться перейти через перегородку в раствор. Осмотическое давление зависит от концентрации раствора и его температуры, но не зависит ни от природы растворителя, ни от природы растворенного вещества. - осмотическое давление; С – молярная концентрация раствора; R – универсальная газовая постоянная; Т – температура.
Явление осмоса Явление самопроизвольного перехода растворителя через полупроницаемую перегородку в раствор с большей концентрацией называют осмосом. Количественной характеристикой осмоса является осмотическое давление. Осмотическое давление – это мера силы, с которой растворитель стремиться перейти через перегородку в раствор. Осмотическое давление зависит от концентрации раствора и его температуры, но не зависит ни от природы растворителя, ни от природы растворенного вещества. - осмотическое давление; С – молярная концентрация раствора; R – универсальная газовая постоянная; Т – температура.
 Растворы электролитов Все растворы в зависимости от природы растворенного вещества подразделяют на: растворы электролитов проводят ток растворы неэлектролитов не проводят ток подвергаются диссоциации Диссоциация – это процесс распада вещества под действием молекул растворителя на ионы.
Растворы электролитов Все растворы в зависимости от природы растворенного вещества подразделяют на: растворы электролитов проводят ток растворы неэлектролитов не проводят ток подвергаются диссоциации Диссоциация – это процесс распада вещества под действием молекул растворителя на ионы.
 В результате диссоциации число частиц в растворе увеличивается. Для электролитов: Изотонический коэффициент (i) учитывает фактическое число частиц в растворе, увеличенное за счет полной или частичной диссоциации электролита: Изотонический коэффициент находят экспериментально:
В результате диссоциации число частиц в растворе увеличивается. Для электролитов: Изотонический коэффициент (i) учитывает фактическое число частиц в растворе, увеличенное за счет полной или частичной диссоциации электролита: Изотонический коэффициент находят экспериментально:
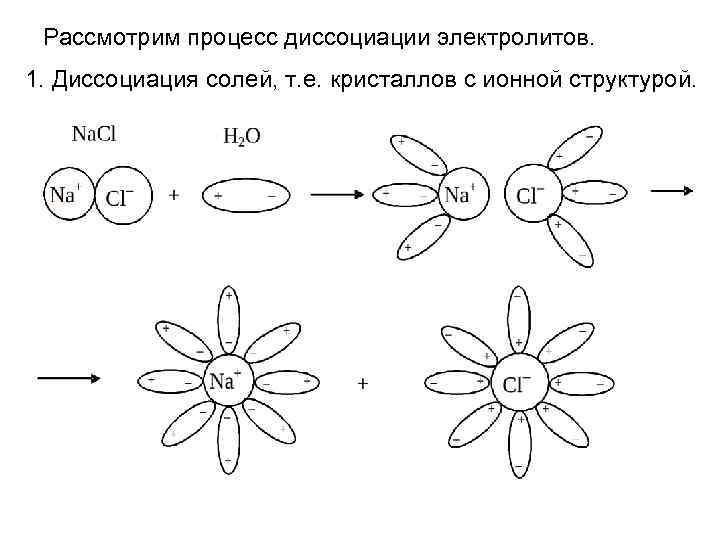 Рассмотрим процесс диссоциации электролитов. 1. Диссоциация солей, т. е. кристаллов с ионной структурой.
Рассмотрим процесс диссоциации электролитов. 1. Диссоциация солей, т. е. кристаллов с ионной структурой.
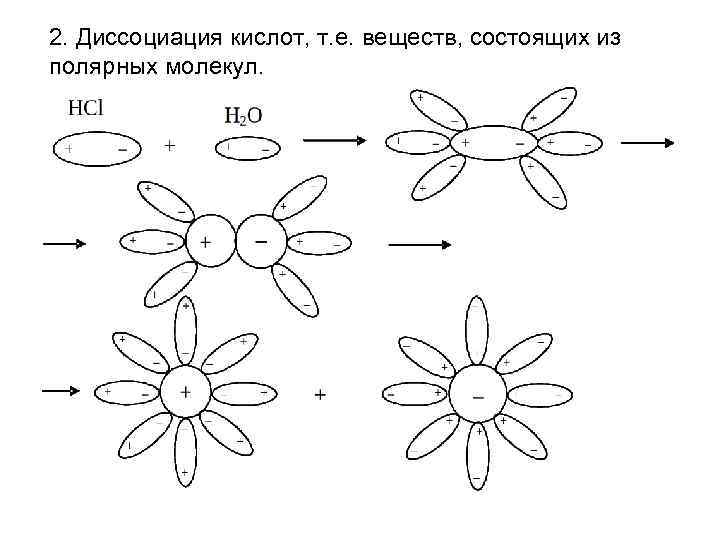 2. Диссоциация кислот, т. е. веществ, состоящих из полярных молекул.
2. Диссоциация кислот, т. е. веществ, состоящих из полярных молекул.
 Степенью диссоциации электролита называют отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе: Степень ионизации зависит от: природы растворителя: Чем более полярна молекула растворителя, тем выше степень диссоциации растворенного вещества. природы растворенного вещества температуры концентрации раствора: чем меньше концентрация раствора, тем больше степень диссоциации растворенного вещества.
Степенью диссоциации электролита называют отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе: Степень ионизации зависит от: природы растворителя: Чем более полярна молекула растворителя, тем выше степень диссоциации растворенного вещества. природы растворенного вещества температуры концентрации раствора: чем меньше концентрация раствора, тем больше степень диссоциации растворенного вещества.
 По степени диссоциации электролиты делятся на: Сильные электролиты ( 30 %) – почти все соли, а также кислоты: азотная HNO 3, серная H 2 SO 4, хлорная HCl. O 4, соляная HCl, бромоводородная HBr, иодоводородная HI; гидроксиды щелочных и щелочноземельных металлов – Na. OH, KOH, Ba(OH)2, Ca(OH)2. Средние электролиты ( = 3 – 30 %) Слабые электролиты ( 3 %) – большинство органических кислот (уксусная, щавелевая и т. д. ), а также кислоты: угольная H 2 CO 3, сероводородная H 2 S, синильная HCN, кремневая H 2 Si. O 3, азотистая HNO 2, фосфорная H 3 PO 4; гидроксид аммония NH 4 OH.
По степени диссоциации электролиты делятся на: Сильные электролиты ( 30 %) – почти все соли, а также кислоты: азотная HNO 3, серная H 2 SO 4, хлорная HCl. O 4, соляная HCl, бромоводородная HBr, иодоводородная HI; гидроксиды щелочных и щелочноземельных металлов – Na. OH, KOH, Ba(OH)2, Ca(OH)2. Средние электролиты ( = 3 – 30 %) Слабые электролиты ( 3 %) – большинство органических кислот (уксусная, щавелевая и т. д. ), а также кислоты: угольная H 2 CO 3, сероводородная H 2 S, синильная HCN, кремневая H 2 Si. O 3, азотистая HNO 2, фосфорная H 3 PO 4; гидроксид аммония NH 4 OH.
 Растворы сильных электролитов Все сильные электролиты диссоциируют на ионы полностью и необратимо. H 2 SO 4 2 H+ + SO 42 - Ba(OH)2 Ba 2+ + 2 OH- Для оценки состояния ионов в растворе сильного электролита используют величину, называемую активностью: где а – активность иона, С – его концентрация, f – коэффициент активности Коэффициент активности f учитывает взаимодействие ионов в растворе. Его значение зависит от заряда иона (z) и ионной силы раствора (I): Ионная сила раствора (I) равна полусумме произведений концентраций ионов на квадрат их зарядов:
Растворы сильных электролитов Все сильные электролиты диссоциируют на ионы полностью и необратимо. H 2 SO 4 2 H+ + SO 42 - Ba(OH)2 Ba 2+ + 2 OH- Для оценки состояния ионов в растворе сильного электролита используют величину, называемую активностью: где а – активность иона, С – его концентрация, f – коэффициент активности Коэффициент активности f учитывает взаимодействие ионов в растворе. Его значение зависит от заряда иона (z) и ионной силы раствора (I): Ионная сила раствора (I) равна полусумме произведений концентраций ионов на квадрат их зарядов:
 Растворы слабых электролитов Слабые электролиты диссоциируют на ионы частично, обратимо, ступенчато. Например, диссоциация угольной кислоты: I ступень II ступень К 1 > К 2 Константа диссоциации электролита (К) связана со степенью диссоциации (α) (закон разбавления Оствальда):
Растворы слабых электролитов Слабые электролиты диссоциируют на ионы частично, обратимо, ступенчато. Например, диссоциация угольной кислоты: I ступень II ступень К 1 > К 2 Константа диссоциации электролита (К) связана со степенью диссоциации (α) (закон разбавления Оствальда):
![Диссоциация воды. Ионное произведение воды. Водородный показатель. Произведение [H+][OH ] = КW называют ионным Диссоциация воды. Ионное произведение воды. Водородный показатель. Произведение [H+][OH ] = КW называют ионным](https://present5.com/presentation/18811058_437083175/image-94.jpg) Диссоциация воды. Ионное произведение воды. Водородный показатель. Произведение [H+][OH ] = КW называют ионным произведением воды. При 250 С произведение воды есть величина постоянная: КW = [H+][OH ] = 10 -14. Водородным показателем называют отрицательный десятичный логарифм концентрации ионов водорода в растворе: Если р. Н = 7 – нейтральная среда Если р. Н < 7 – кислая среда Если р. Н > 7 – щелочная среда
Диссоциация воды. Ионное произведение воды. Водородный показатель. Произведение [H+][OH ] = КW называют ионным произведением воды. При 250 С произведение воды есть величина постоянная: КW = [H+][OH ] = 10 -14. Водородным показателем называют отрицательный десятичный логарифм концентрации ионов водорода в растворе: Если р. Н = 7 – нейтральная среда Если р. Н < 7 – кислая среда Если р. Н > 7 – щелочная среда
 Реакции, протекающие в водных растворах электролитов В водных растворах электролитов протекают реакции двух типов: реакции ионного обмена и окислительновосстановительные реакции. Реакции ионного обмена. Эти реакции протекают, если образуется: малорастворимый осадок; выделяется газ; слабый электролит; прочный комплекс. К реакциям ионного обмена относят реакции нейтрализации, гидролиз солей, реакции осаждения, реакции комплексообразования.
Реакции, протекающие в водных растворах электролитов В водных растворах электролитов протекают реакции двух типов: реакции ионного обмена и окислительновосстановительные реакции. Реакции ионного обмена. Эти реакции протекают, если образуется: малорастворимый осадок; выделяется газ; слабый электролит; прочный комплекс. К реакциям ионного обмена относят реакции нейтрализации, гидролиз солей, реакции осаждения, реакции комплексообразования.
 1. Реакции нейтрализации. В основе реакции нейтрализации лежит процесс: H+ + OH─ H 2 O Например, а) Na. OH + HCl Na. Cl + H 2 O Na+ + OH─ + H+ + Cl─ Na+ + Cl─ + H 2 O Н+ + ОН Н 2 О б) CH 3 COOH + KOH CH 3 COOK + H 2 O CH 3 COOH + K+ + OH─ CH 3 COO─ + K+ + H 2 O CH 3 COOH + OH─ CH 3 COO─ + H 2 O
1. Реакции нейтрализации. В основе реакции нейтрализации лежит процесс: H+ + OH─ H 2 O Например, а) Na. OH + HCl Na. Cl + H 2 O Na+ + OH─ + H+ + Cl─ Na+ + Cl─ + H 2 O Н+ + ОН Н 2 О б) CH 3 COOH + KOH CH 3 COOK + H 2 O CH 3 COOH + K+ + OH─ CH 3 COO─ + K+ + H 2 O CH 3 COOH + OH─ CH 3 COO─ + H 2 O
 2. Осадительные реакции - это реакции ионного обмена, в результате которых образуется малорастворимое вещество (осадок). Гетерогенное равновесие: Произведение равновесных концентраций ионов трудно растворимого вещества называют произведением растворимости. Для Ag. Cl: ПР = [Ag+][Cl ] ПР характеризует растворимость осадка.
2. Осадительные реакции - это реакции ионного обмена, в результате которых образуется малорастворимое вещество (осадок). Гетерогенное равновесие: Произведение равновесных концентраций ионов трудно растворимого вещества называют произведением растворимости. Для Ag. Cl: ПР = [Ag+][Cl ] ПР характеризует растворимость осадка.
 3. Гидролиз солей Гидролизом называют взаимодействие солей с водой, в результате чего образуется слабый электролит. Гидролизу подвергаются соли, которые образованы: слабыми основаниями и сильной кислотой; сильными основаниями и слабой кислотой; слабыми основаниями и слабой кислотой. Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой.
3. Гидролиз солей Гидролизом называют взаимодействие солей с водой, в результате чего образуется слабый электролит. Гидролизу подвергаются соли, которые образованы: слабыми основаниями и сильной кислотой; сильными основаниями и слабой кислотой; слабыми основаниями и слабой кислотой. Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой.
 1 тип: гидролиз соли по катиону. Этому типу гидролиза подвергаются соли, которые образованы слабым основанием и сильной кислотой. Например, NH 4 Cl, Cu. SO 4, Fe. Cl 2, Fe. Cl 3, Al. Cl 3 и т. д. Рассмотрим гидролиз соли Cu. SO 4. Соль образована слабым основанием Cu(OH)2 и сильной кислотой H 2 SO 4. Гидролиз соли идет по катиону Cu 2+ ступенчато. I ступень гидролиза: молекулярное уравнение ионное уравнение II ступень гидролиза: p. H < 7 – кислая среда
1 тип: гидролиз соли по катиону. Этому типу гидролиза подвергаются соли, которые образованы слабым основанием и сильной кислотой. Например, NH 4 Cl, Cu. SO 4, Fe. Cl 2, Fe. Cl 3, Al. Cl 3 и т. д. Рассмотрим гидролиз соли Cu. SO 4. Соль образована слабым основанием Cu(OH)2 и сильной кислотой H 2 SO 4. Гидролиз соли идет по катиону Cu 2+ ступенчато. I ступень гидролиза: молекулярное уравнение ионное уравнение II ступень гидролиза: p. H < 7 – кислая среда
 2 тип: гидролиз соли по аниону. Этому типу гидролиза подвергаются соли, которые образованы сильным основанием и слабой кислотой. Например, Na 3 PO 4, K 2 SO 3, K 3 As. O 4, KNO 2 и т. д. Рассмотрим гидролиз соли Na 2 CO 3. Эта соль образована сильным основанием Na. OH и слабой кислотой Н 2 СО 3. Гидролиз соли идет по аниону СО 32 - ступенчато. I ступень: II ступень: Раствор этой соли будет иметь щелочную среду р. Н 7.
2 тип: гидролиз соли по аниону. Этому типу гидролиза подвергаются соли, которые образованы сильным основанием и слабой кислотой. Например, Na 3 PO 4, K 2 SO 3, K 3 As. O 4, KNO 2 и т. д. Рассмотрим гидролиз соли Na 2 CO 3. Эта соль образована сильным основанием Na. OH и слабой кислотой Н 2 СО 3. Гидролиз соли идет по аниону СО 32 - ступенчато. I ступень: II ступень: Раствор этой соли будет иметь щелочную среду р. Н 7.
 3 тип: гидролиз соли по катиону и аниону. Этому виду гидролиза подвергаются соли, образованные слабым основанием и слабой кислотой. Например, NH 4 CN, Zn. S, Cu. CO 3 и т. д. Рассмотрим гидролиз соли NH 4 CN. Эта соль образована слабым основанием NH 4 OH и слабой кислотой HCN. Гидролиз будет идти по катиону NH 4+ и по аниону CN-. При гидролизе солей, образованных слабым основанием и слабой кислотой, р. Н раствора будет находиться вблизи нейтральности, т. е. р. Н 7.
3 тип: гидролиз соли по катиону и аниону. Этому виду гидролиза подвергаются соли, образованные слабым основанием и слабой кислотой. Например, NH 4 CN, Zn. S, Cu. CO 3 и т. д. Рассмотрим гидролиз соли NH 4 CN. Эта соль образована слабым основанием NH 4 OH и слабой кислотой HCN. Гидролиз будет идти по катиону NH 4+ и по аниону CN-. При гидролизе солей, образованных слабым основанием и слабой кислотой, р. Н раствора будет находиться вблизи нейтральности, т. е. р. Н 7.
 Гидролиз солей многоосновных кислот и многокислотных оснований протекает ступенчато. Но до конца гидролиз таких солей не доходит, так как накопление в растворе ионов ОН (или Н+) препятствует образованию соответствующего слабого электролита. Поэтому гидролиз таких солей идет только по первой (иногда и по второй) ступени.
Гидролиз солей многоосновных кислот и многокислотных оснований протекает ступенчато. Но до конца гидролиз таких солей не доходит, так как накопление в растворе ионов ОН (или Н+) препятствует образованию соответствующего слабого электролита. Поэтому гидролиз таких солей идет только по первой (иногда и по второй) ступени.
 Например, гидролиз соли Al. Cl 3. Соль образована слабым основанием Al(OH)3 и сильной кислотой HCl. Следовательно, гидролиз этой соли идет по катиону Al 3+. I ступень: II ступень: Далее гидролиз не протекает, т. к. в растворе накапливаются ионы водорода Н+, которые препятствуют образованию Al(OH)3.
Например, гидролиз соли Al. Cl 3. Соль образована слабым основанием Al(OH)3 и сильной кислотой HCl. Следовательно, гидролиз этой соли идет по катиону Al 3+. I ступень: II ступень: Далее гидролиз не протекает, т. к. в растворе накапливаются ионы водорода Н+, которые препятствуют образованию Al(OH)3.
 Окислительно-восстановительные реакции. Реакции, в результате которых происходит изменение степени окисления элементов, называют окислительно-восстановительными. Под степенью окисления элемента подразумевают число электронов, смещенных от одного атома данного элемента в соединении к другому атому другого элемента в зависимости от их электроотрицательности. Степень окисления может быть положительной, отрицательной и нулевой. В простых веществах степень окисления элемента всегда равна нулю. Например, Br 20, S 0 и т. д. Постоянную степень окисления имеют щелочные металлы «+1» (Na, K и т. д. ), щелочно-земельные металлы «+2» (Ca, Mg и т. д. ), фтор «-1» , в большинстве соединений кислород «-2» , водород «+1» .
Окислительно-восстановительные реакции. Реакции, в результате которых происходит изменение степени окисления элементов, называют окислительно-восстановительными. Под степенью окисления элемента подразумевают число электронов, смещенных от одного атома данного элемента в соединении к другому атому другого элемента в зависимости от их электроотрицательности. Степень окисления может быть положительной, отрицательной и нулевой. В простых веществах степень окисления элемента всегда равна нулю. Например, Br 20, S 0 и т. д. Постоянную степень окисления имеют щелочные металлы «+1» (Na, K и т. д. ), щелочно-земельные металлы «+2» (Ca, Mg и т. д. ), фтор «-1» , в большинстве соединений кислород «-2» , водород «+1» .
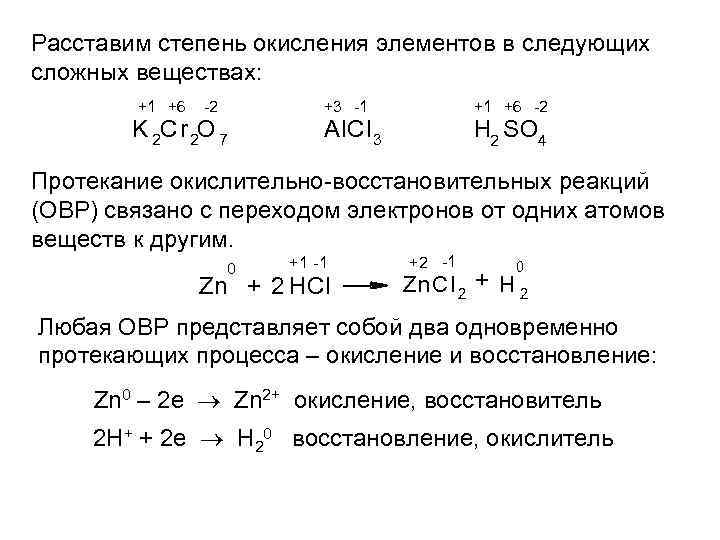 Расставим степень окисления элементов в следующих сложных веществах: +1 +6 -2 +3 -1 K 2 Cr 2 O 7 +1 +6 -2 Al. Cl 3 H 2 SO 4 Протекание окислительно-восстановительных реакций (ОВР) связано с переходом электронов от одних атомов веществ к другим. 0 +1 -1 Zn + 2 HCl +2 -1 0 Zn. C l 2 + H 2 Любая ОВР представляет собой два одновременно протекающих процесса – окисление и восстановление: Zn 0 – 2 e Zn 2+ окисление, восстановитель 2 Н+ + 2 е Н 20 восстановление, окислитель
Расставим степень окисления элементов в следующих сложных веществах: +1 +6 -2 +3 -1 K 2 Cr 2 O 7 +1 +6 -2 Al. Cl 3 H 2 SO 4 Протекание окислительно-восстановительных реакций (ОВР) связано с переходом электронов от одних атомов веществ к другим. 0 +1 -1 Zn + 2 HCl +2 -1 0 Zn. C l 2 + H 2 Любая ОВР представляет собой два одновременно протекающих процесса – окисление и восстановление: Zn 0 – 2 e Zn 2+ окисление, восстановитель 2 Н+ + 2 е Н 20 восстановление, окислитель
 Процесс отдачи электронов называется окислением. Он сопровождается повышением степени окисления элемента. Вещество, в состав которого входит элемент, отдающий электроны, называют восстановителем. Процесс приема электронов называется восстановлением, он сопровождается понижением степени окисления. Вещества, которые принимают электроны, называются окислителями. Для составления уравнений ОВР используют два метода: метод электронного баланса; метод электронно-ионного баланса.
Процесс отдачи электронов называется окислением. Он сопровождается повышением степени окисления элемента. Вещество, в состав которого входит элемент, отдающий электроны, называют восстановителем. Процесс приема электронов называется восстановлением, он сопровождается понижением степени окисления. Вещества, которые принимают электроны, называются окислителями. Для составления уравнений ОВР используют два метода: метод электронного баланса; метод электронно-ионного баланса.
 2. Метод электронно-ионного баланса. Этот метод отличается от электронного баланса тем, что: а) в нем оперируют частицами, которые реально существуют в растворах; б) учитывают влияние среды на протекание реакции. При составлении уравнений ОВР этим методом следует помнить(!): малорастворимые вещества (оксиды, гидроксиды и т. д. ), слабые электролиты (Н 2 S, Н 2 О и т. п. ), газы в полуреакциях записываются в молекулярной форме; в зависимости от среды протекания реакции для составления уравнения и подбора коэффициентов используют строго определенный набор частиц.
2. Метод электронно-ионного баланса. Этот метод отличается от электронного баланса тем, что: а) в нем оперируют частицами, которые реально существуют в растворах; б) учитывают влияние среды на протекание реакции. При составлении уравнений ОВР этим методом следует помнить(!): малорастворимые вещества (оксиды, гидроксиды и т. д. ), слабые электролиты (Н 2 S, Н 2 О и т. п. ), газы в полуреакциях записываются в молекулярной форме; в зависимости от среды протекания реакции для составления уравнения и подбора коэффициентов используют строго определенный набор частиц.
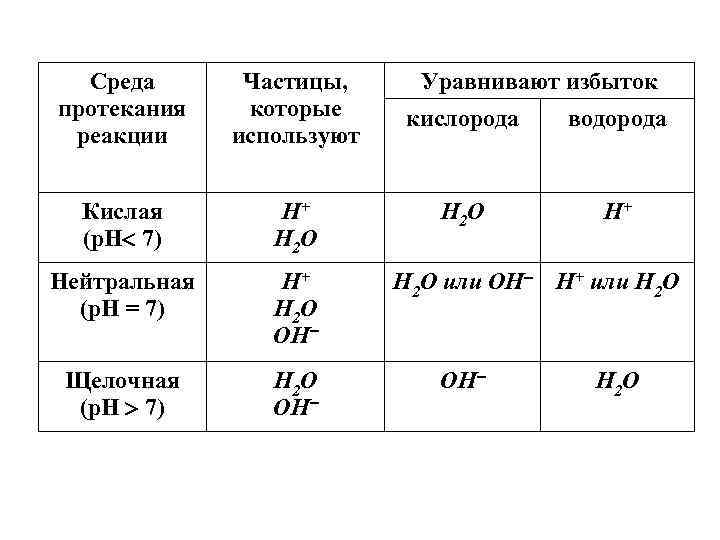 Среда протекания реакции Частицы, которые используют Кислая (р. Н 7) Н+ Н 2 О Нейтральная (р. Н = 7) Н+ Н 2 О ОН Щелочная (р. Н 7) Н 2 О ОН Уравнивают избыток кислорода водорода Н 2 О Н+ Н 2 О или ОН Н+ или Н 2 О ОН Н 2 О
Среда протекания реакции Частицы, которые используют Кислая (р. Н 7) Н+ Н 2 О Нейтральная (р. Н = 7) Н+ Н 2 О ОН Щелочная (р. Н 7) Н 2 О ОН Уравнивают избыток кислорода водорода Н 2 О Н+ Н 2 О или ОН Н+ или Н 2 О ОН Н 2 О
 Последовательность составления уравнения методом электронно-ионного баланса: 1) составляют схему реакции с указанием исходных веществ и образующихся веществ, отмечают элементы, которые изменяют степень окисления; 2) составляют схемы полуреакций с указанием исходных и образующихся реально в условиях реакции ионов или молекул; 3) уравнивают число атомов каждого элемента в левой и правой частях полуреакций; 4) уравнивают суммарное число зарядов в обеих частях каждой полуреакции, прибавив к левой или правой части необходимое число электронов; 5) подбирают коэффициенты для полуреакций, так чтобы число электронов отдаваемых и принимаемых было одинаковым; 6) складывают уравнения полуреакций с учетом найденных коэффициентов; 7) расставляют коэффициенты в молекулярное уравнение реакции.
Последовательность составления уравнения методом электронно-ионного баланса: 1) составляют схему реакции с указанием исходных веществ и образующихся веществ, отмечают элементы, которые изменяют степень окисления; 2) составляют схемы полуреакций с указанием исходных и образующихся реально в условиях реакции ионов или молекул; 3) уравнивают число атомов каждого элемента в левой и правой частях полуреакций; 4) уравнивают суммарное число зарядов в обеих частях каждой полуреакции, прибавив к левой или правой части необходимое число электронов; 5) подбирают коэффициенты для полуреакций, так чтобы число электронов отдаваемых и принимаемых было одинаковым; 6) складывают уравнения полуреакций с учетом найденных коэффициентов; 7) расставляют коэффициенты в молекулярное уравнение реакции.
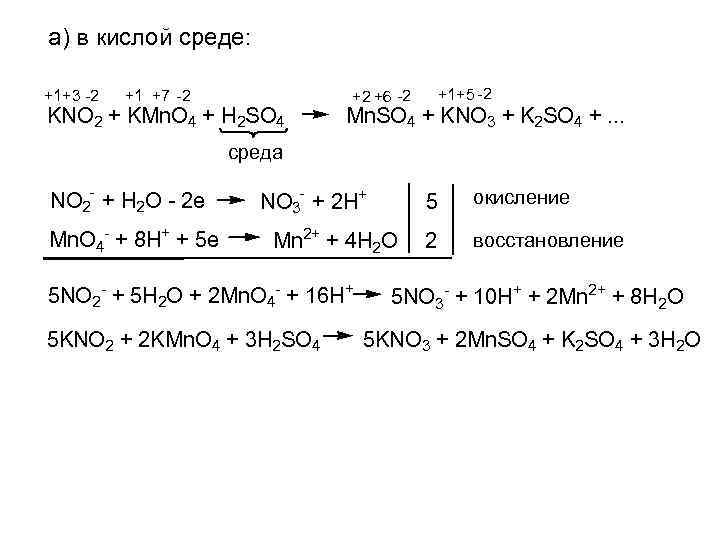 а) в кислой среде: +1+3 -2 +1 +7 -2 KNO 2 + KMn. O 4 + H 2 SO 4 +1+5 -2 +2 +6 -2 Mn. SO 4 + KNO 3 + K 2 SO 4 +. . . среда NO 2 - + H 2 O - 2 e Mn. O 4 - + 8 H+ + 5 e NO 3 - + 2 H+ 5 Mn 2+ + 4 H 2 O 5 NO 2 - + 5 H 2 O + 2 Mn. O 4 - + 16 H+ 5 KNO 2 + 2 KMn. O 4 + 3 H 2 SO 4 окисление 2 восстановление 5 NO 3 - + 10 H+ + 2 Mn 2+ + 8 H 2 O 5 KNO 3 + 2 Mn. SO 4 + K 2 SO 4 + 3 H 2 O
а) в кислой среде: +1+3 -2 +1 +7 -2 KNO 2 + KMn. O 4 + H 2 SO 4 +1+5 -2 +2 +6 -2 Mn. SO 4 + KNO 3 + K 2 SO 4 +. . . среда NO 2 - + H 2 O - 2 e Mn. O 4 - + 8 H+ + 5 e NO 3 - + 2 H+ 5 Mn 2+ + 4 H 2 O 5 NO 2 - + 5 H 2 O + 2 Mn. O 4 - + 16 H+ 5 KNO 2 + 2 KMn. O 4 + 3 H 2 SO 4 окисление 2 восстановление 5 NO 3 - + 10 H+ + 2 Mn 2+ + 8 H 2 O 5 KNO 3 + 2 Mn. SO 4 + K 2 SO 4 + 3 H 2 O
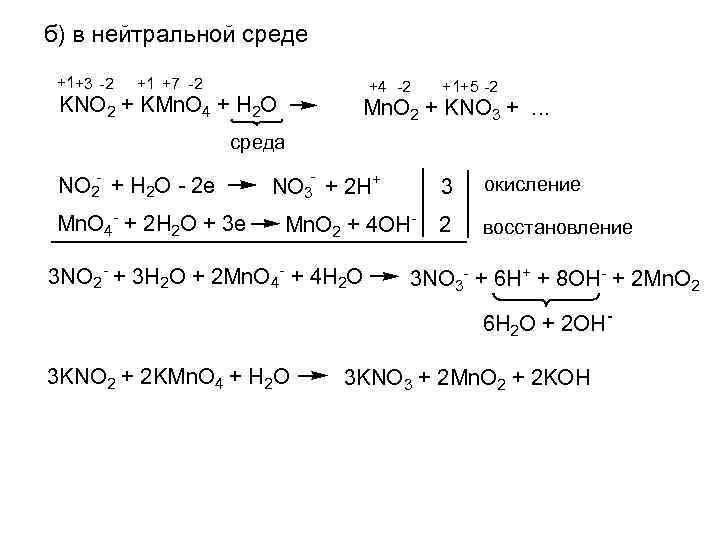 б) в нейтральной среде +1+3 -2 +1 +7 -2 +4 -2 KNO 2 + KMn. O 4 + H 2 O +1+5 -2 Mn. O 2 + KNO 3 +. . . среда NO 2 - + H 2 O - 2 e Mn. O 4 - + 2 H 2 O + 3 e - NO 3 + 2 H+ 3 Mn. O 2 + 4 OH- 3 NO 2 - + 3 H 2 O + 2 Mn. O 4 - + 4 H 2 O окисление 2 восстановление 3 NO 3 - + 6 H+ + 8 OH- + 2 Mn. O 2 6 H 2 O + 2 OH- 3 KNO 2 + 2 KMn. O 4 + H 2 O 3 KNO 3 + 2 Mn. O 2 + 2 KOH
б) в нейтральной среде +1+3 -2 +1 +7 -2 +4 -2 KNO 2 + KMn. O 4 + H 2 O +1+5 -2 Mn. O 2 + KNO 3 +. . . среда NO 2 - + H 2 O - 2 e Mn. O 4 - + 2 H 2 O + 3 e - NO 3 + 2 H+ 3 Mn. O 2 + 4 OH- 3 NO 2 - + 3 H 2 O + 2 Mn. O 4 - + 4 H 2 O окисление 2 восстановление 3 NO 3 - + 6 H+ + 8 OH- + 2 Mn. O 2 6 H 2 O + 2 OH- 3 KNO 2 + 2 KMn. O 4 + H 2 O 3 KNO 3 + 2 Mn. O 2 + 2 KOH
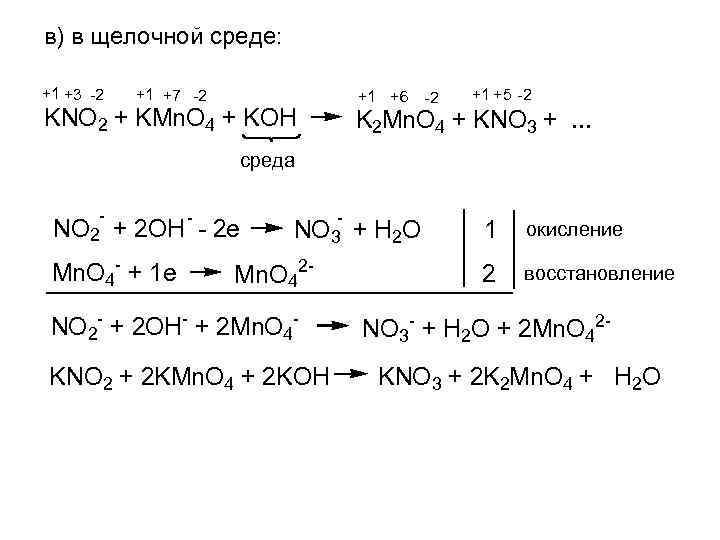 в) в щелочной среде: +1 +3 -2 +1 +7 -2 +1 +6 -2 KNO 2 + KMn. O 4 + KOH +1 +5 -2 K 2 Mn. O 4 + KNO 3 +. . . среда NO 2 + 2 OH - - 2 e Mn. O 4 - + 1 e - NO 3 + H 2 O Mn. O 42 - NO 2 - + 2 OH- + 2 Mn. O 4 KNO 2 + 2 KMn. O 4 + 2 KOH 1 окисление 2 восстановление NO 3 - + H 2 O + 2 Mn. O 42 KNO 3 + 2 K 2 Mn. O 4 + H 2 O
в) в щелочной среде: +1 +3 -2 +1 +7 -2 +1 +6 -2 KNO 2 + KMn. O 4 + KOH +1 +5 -2 K 2 Mn. O 4 + KNO 3 +. . . среда NO 2 + 2 OH - - 2 e Mn. O 4 - + 1 e - NO 3 + H 2 O Mn. O 42 - NO 2 - + 2 OH- + 2 Mn. O 4 KNO 2 + 2 KMn. O 4 + 2 KOH 1 окисление 2 восстановление NO 3 - + H 2 O + 2 Mn. O 42 KNO 3 + 2 K 2 Mn. O 4 + H 2 O


