osn.zakony_2011-2012___2_semestr.ppt
- Количество слайдов: 27
 Химия Преподаватель: Андросюк Евгения Романовна канд. хим. наук, доцент кафедры «Общая и неорганическая химия»
Химия Преподаватель: Андросюк Евгения Романовна канд. хим. наук, доцент кафедры «Общая и неорганическая химия»
 Лекция № 1 Основные понятия и законы ХИМИИ
Лекция № 1 Основные понятия и законы ХИМИИ
 ХИМИЯ - наука о веществах, их свойствах, строении и превращениях друг в друга. • В результате химических процессов возникают новые вещества с новыми физическими и химическими свойствами. • • HCl + Na. OH = Na. Cl + Н 2 O кислота щелочь соль вода • H++Cl ¯+Na ++OH ¯= Na ++ Cl ¯+Н 2 O
ХИМИЯ - наука о веществах, их свойствах, строении и превращениях друг в друга. • В результате химических процессов возникают новые вещества с новыми физическими и химическими свойствами. • • HCl + Na. OH = Na. Cl + Н 2 O кислота щелочь соль вода • H++Cl ¯+Na ++OH ¯= Na ++ Cl ¯+Н 2 O
 ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ. ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Объектом изучения в химии являются химические элементы. • Химический элемент – вид атомов, имеющих одинаковый заряд ядра. • Атом – наименьшая частица химического элемента, обладающая всеми его химическими свойствами.
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ. ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Объектом изучения в химии являются химические элементы. • Химический элемент – вид атомов, имеющих одинаковый заряд ядра. • Атом – наименьшая частица химического элемента, обладающая всеми его химическими свойствами.
 Каждый из элементов имеет определённый химический знак, или символ и определённое название. Химические элементы представлены в периодической системе химических элементов Д. И. Менделеева (ПСЭ). В настоящее время известно о существовании 117 химических элементов. Последний элемент, встречающийся в природе - уран. Все стоящие за ним получены искусственно - в лабораториях.
Каждый из элементов имеет определённый химический знак, или символ и определённое название. Химические элементы представлены в периодической системе химических элементов Д. И. Менделеева (ПСЭ). В настоящее время известно о существовании 117 химических элементов. Последний элемент, встречающийся в природе - уран. Все стоящие за ним получены искусственно - в лабораториях.
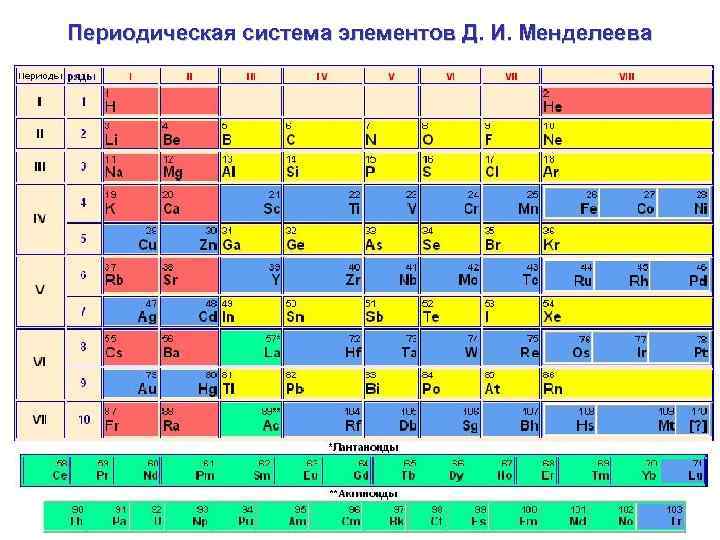 Периодическая система элементов Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева
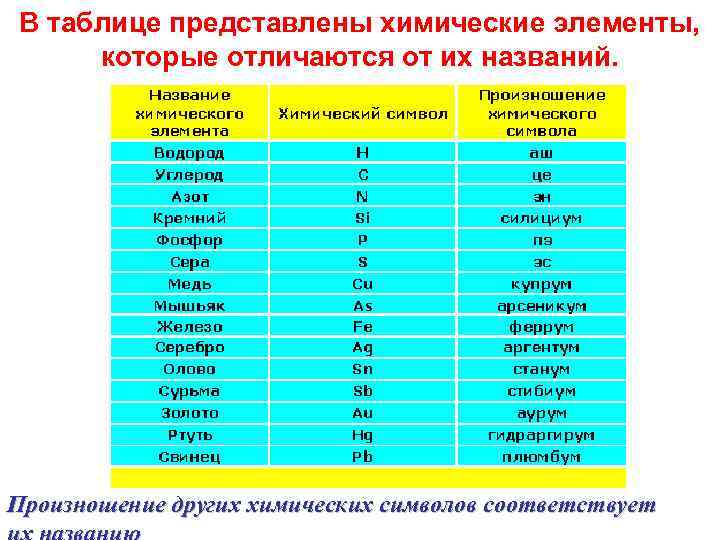 В таблице представлены химические элементы, которые отличаются от их названий. Произношение других химических символов соответствует
В таблице представлены химические элементы, которые отличаются от их названий. Произношение других химических символов соответствует
 • В названиях некоторых хим. элементов отражены их важные свойства, например: • водород Н - рождающий воду, • кислород О - рождающий кислоты, • фосфор Р - несущий свет. • • • Часть хим. элементов названа в честь планет: селен Se (Селена - Луна), теллур Te (Теллурис - Земля), плутоний Pu, нептуний Np, уран U.
• В названиях некоторых хим. элементов отражены их важные свойства, например: • водород Н - рождающий воду, • кислород О - рождающий кислоты, • фосфор Р - несущий свет. • • • Часть хим. элементов названа в честь планет: селен Se (Селена - Луна), теллур Te (Теллурис - Земля), плутоний Pu, нептуний Np, уран U.
 • Многие химические элементы названы в честь государств, частей света, населённых пунктов: • полоний Po (Польша), • рутений Ru (Рутения - Россия), • франций Fr, • европий Eu и т. д. • В некоторых названиях увековечены имена учёных физиков и химиков: • курчатовий Ku, • эйнштейний Es, • менделевий Md, • нобелий No и т. д.
• Многие химические элементы названы в честь государств, частей света, населённых пунктов: • полоний Po (Польша), • рутений Ru (Рутения - Россия), • франций Fr, • европий Eu и т. д. • В некоторых названиях увековечены имена учёных физиков и химиков: • курчатовий Ku, • эйнштейний Es, • менделевий Md, • нобелий No и т. д.
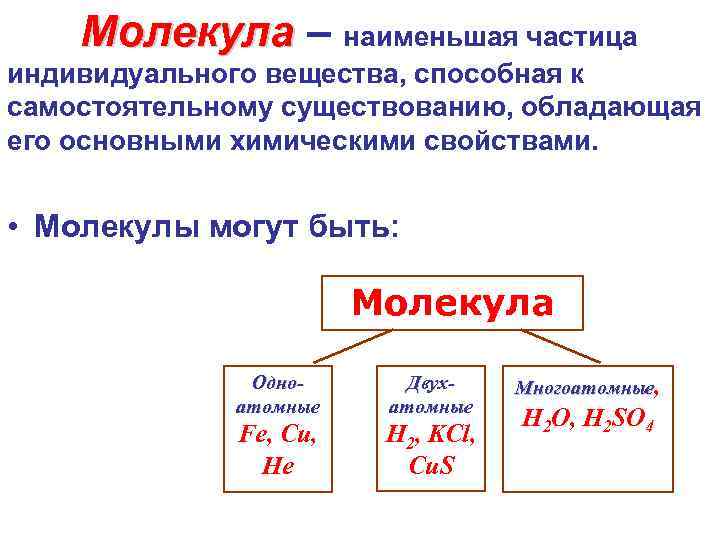 Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами. • Молекулы могут быть: Молекула Одноатомные Двухатомные Fe, Cu, Не Н 2, KCl, Cu. S Многоатомные, H 2 O, H 2 SO 4
Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами. • Молекулы могут быть: Молекула Одноатомные Двухатомные Fe, Cu, Не Н 2, KCl, Cu. S Многоатомные, H 2 O, H 2 SO 4
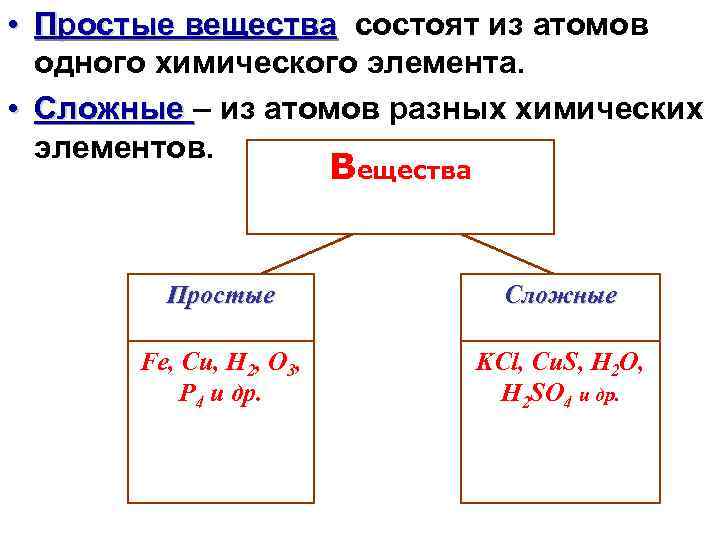 • Простые вещества состоят из атомов одного химического элемента. • Сложные – из атомов разных химических элементов. Вещества Простые Сложные Fe, Cu, H 2, O 3, Р 4 и др. KCl, Cu. S, H 2 O, H 2 SO 4 и др.
• Простые вещества состоят из атомов одного химического элемента. • Сложные – из атомов разных химических элементов. Вещества Простые Сложные Fe, Cu, H 2, O 3, Р 4 и др. KCl, Cu. S, H 2 O, H 2 SO 4 и др.
 ОСНОВНЫЕ ПОНЯТИЯ И ФОРМУЛИРОВКИ • Абсолютная атомная масса m - истинная масса атома элемента, г. • Относительная атомная масса элемента - величина, показывающая во сколько раз масса атома данного элемента больше 1/12 массы атома изотопа углерода 12 С. • mатома • Ar = ———— • 1/12 m(12 C)
ОСНОВНЫЕ ПОНЯТИЯ И ФОРМУЛИРОВКИ • Абсолютная атомная масса m - истинная масса атома элемента, г. • Относительная атомная масса элемента - величина, показывающая во сколько раз масса атома данного элемента больше 1/12 массы атома изотопа углерода 12 С. • mатома • Ar = ———— • 1/12 m(12 C)
 • Относительная молекулярная масса величина, показывающая во сколько раз масса молекулы вещества больше 1/12 массы атома изотопа углерода 12 С. • mмолекулы • Мr = ————— • 1/12 m(12 C) • Например, Мr (Н 2 О) = 18 у. е.
• Относительная молекулярная масса величина, показывающая во сколько раз масса молекулы вещества больше 1/12 массы атома изотопа углерода 12 С. • mмолекулы • Мr = ————— • 1/12 m(12 C) • Например, Мr (Н 2 О) = 18 у. е.
 Моль - это количество вещества системы, содержащей столько же структурных образований (атомов, ионов, молекул и т. п. ), сколько содержится атомов углерода в 12 г изотопа углерода 12 C.
Моль - это количество вещества системы, содержащей столько же структурных образований (атомов, ионов, молекул и т. п. ), сколько содержится атомов углерода в 12 г изотопа углерода 12 C.
 Постоянная Авогадро - число структурных единиц (атомов, ионов, молекул и т. п. ), содержащееся в одном моле вещества NА≈ 6, 02٠ 1023, моль 1 • • ***** Молярная масса - масса 1 моля вещества. ***** Молярная масса вещества численно равна его относительной молекулярной (атомной) массе, М, г/моль Например, Мr (Н 2 О) = 18 у. е. М (Н 2 О) = 18 г/моль
Постоянная Авогадро - число структурных единиц (атомов, ионов, молекул и т. п. ), содержащееся в одном моле вещества NА≈ 6, 02٠ 1023, моль 1 • • ***** Молярная масса - масса 1 моля вещества. ***** Молярная масса вещества численно равна его относительной молекулярной (атомной) массе, М, г/моль Например, Мr (Н 2 О) = 18 у. е. М (Н 2 О) = 18 г/моль
 Эквивалент • Эквивалент - это реальная или условная химическая частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотноосновных реакциях или одному электрону в окислительновосстановительных реакциях: Н - ℮ = Н+ 1 экв.
Эквивалент • Эквивалент - это реальная или условная химическая частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотноосновных реакциях или одному электрону в окислительновосстановительных реакциях: Н - ℮ = Н+ 1 экв.
 Эквивалентная масса - это масса 1 моль эквивалентов. • Эквивалентная масса вещества рассчитывается на: • а) для элемента делением молярной массы элемента на степень окисления элемента (W)
Эквивалентная масса - это масса 1 моль эквивалентов. • Эквивалентная масса вещества рассчитывается на: • а) для элемента делением молярной массы элемента на степень окисления элемента (W)
 • б) для кислоты делением молярной массы кислоты на ее основность (число катионов Н+, принимающих участие в реакции): • в) для основания делением молярной массы основания на кислотность основания (число групп ОН , принимающих участие в реакции):
• б) для кислоты делением молярной массы кислоты на ее основность (число катионов Н+, принимающих участие в реакции): • в) для основания делением молярной массы основания на кислотность основания (число групп ОН , принимающих участие в реакции):
 • г) для соли делением молярной массы соли на произведение числа катионов металла (n) на его степень окисления (Wм): • д) для оксида делением молярной массы оксида на удвоенное количество числа атомов кислорода (m)
• г) для соли делением молярной массы соли на произведение числа катионов металла (n) на его степень окисления (Wм): • д) для оксида делением молярной массы оксида на удвоенное количество числа атомов кислорода (m)
 • Эквивалентный объем VЭ - это объем, который занимает в-во, взятое количеством 1 моль эквивалентов, л/моль. • Закон эквивалентов: массы (объемы) реагирующих и получающихся веществ относятся между собой как их эквивалентные массы (объемы):
• Эквивалентный объем VЭ - это объем, который занимает в-во, взятое количеством 1 моль эквивалентов, л/моль. • Закон эквивалентов: массы (объемы) реагирующих и получающихся веществ относятся между собой как их эквивалентные массы (объемы):
 ГАЗОВЫЕ ЗАКОНЫ
ГАЗОВЫЕ ЗАКОНЫ
 Объединенный газовый закон • Произведение давления на объем, деленное на абсолютную температуру для данной массы газа есть постоянная величина
Объединенный газовый закон • Произведение давления на объем, деленное на абсолютную температуру для данной массы газа есть постоянная величина
 Уравнение состояния идеального газа, или уравнение Менделеева-Клапейрона:
Уравнение состояния идеального газа, или уравнение Менделеева-Клапейрона:
 Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число структурных единиц • Первое следствие из закона Авогадро: • 1 моль любого газа при одинаковых физич. усл. (Т, р) содержит одинаковое число структурных • единиц, равное • числу Авогадро NА = 6, 02 • 1023 моль– 1
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число структурных единиц • Первое следствие из закона Авогадро: • 1 моль любого газа при одинаковых физич. усл. (Т, р) содержит одинаковое число структурных • единиц, равное • числу Авогадро NА = 6, 02 • 1023 моль– 1
 Второе следствие из закона Авогадро • При одинаковых физических условиях 1 моль любого газа занимает один и тот же объем. • При нормальных условиях • (Т = 273, 15 К; р = 101325 Па) • молярный объем составляет 22, 4 л/моль
Второе следствие из закона Авогадро • При одинаковых физических условиях 1 моль любого газа занимает один и тот же объем. • При нормальных условиях • (Т = 273, 15 К; р = 101325 Па) • молярный объем составляет 22, 4 л/моль
 Относительная плотность одного газа по другому • Отношение плотностей, масс или молярных масс первого газа по второму (взятого при тех же условиях) называется плотностью первого газа по второму:
Относительная плотность одного газа по другому • Отношение плотностей, масс или молярных масс первого газа по второму (взятого при тех же условиях) называется плотностью первого газа по второму:
 Закон Дальтона • Общее давление в смеси газов, химически не реагирующих друг с другом, равно сумме парциальных давлений компонентов смеси: • Рсмеси = Р 1 + Р 2 + …+ Рn • Парциальное давление газа в смеси равно тому давлению газа, которым обладал бы данный газ, если бы при той же температуре он занимал объем всей смеси газов
Закон Дальтона • Общее давление в смеси газов, химически не реагирующих друг с другом, равно сумме парциальных давлений компонентов смеси: • Рсмеси = Р 1 + Р 2 + …+ Рn • Парциальное давление газа в смеси равно тому давлению газа, которым обладал бы данный газ, если бы при той же температуре он занимал объем всей смеси газов


