Лекция 1. Строение ядра атома.ppt
- Количество слайдов: 61
 ХИМИЯ
ХИМИЯ

 Наш телефон (8 -812)-714 -39 -44
Наш телефон (8 -812)-714 -39 -44

 Предмет химии • Химия является естественнонаучной дисциплиной и изучает строение, свойства и превращения вещества; • Вещество – вид материи, состоящей из частиц, имеющих массу покоя (электроны, протоны, нейтроны, атомы, ионы, молекулы, кристаллы, живые организмы, планеты и т. д. ).
Предмет химии • Химия является естественнонаучной дисциплиной и изучает строение, свойства и превращения вещества; • Вещество – вид материи, состоящей из частиц, имеющих массу покоя (электроны, протоны, нейтроны, атомы, ионы, молекулы, кристаллы, живые организмы, планеты и т. д. ).
 Роль химии в подготовке специалиста в области физической культуры • Изучение химии расширяет научный кругозор тренера и преподавателя физической культуры, позволяет им лучше понимать законы материального мира и противостоять различным лженаучным представлениям; • Изучение химии создает необходимые предпосылки для последующего освоения таких дисциплин как биохимия, физика, физиология, гигиена и др.
Роль химии в подготовке специалиста в области физической культуры • Изучение химии расширяет научный кругозор тренера и преподавателя физической культуры, позволяет им лучше понимать законы материального мира и противостоять различным лженаучным представлениям; • Изучение химии создает необходимые предпосылки для последующего освоения таких дисциплин как биохимия, физика, физиология, гигиена и др.
 Разделы дисциплины • • • Общая и неорганическая химия; Физическая и коллоидная химия; Аналитическая химия; Органическая химия; Высокомолекулярные соединения.
Разделы дисциплины • • • Общая и неорганическая химия; Физическая и коллоидная химия; Аналитическая химия; Органическая химия; Высокомолекулярные соединения.



 Лекция № 1 Атомно-молекулярное учение
Лекция № 1 Атомно-молекулярное учение
 Первые представления о строении атома • Первые представления о наличии атомов были высказаны еще мыслителями Древней Греции Левкиппом и Демокритом; • По их мнению, все вещества состоят из мельчайших, неделимых частиц; • Эти частицы были названы атомами (от греч. ατομοσ – неделимый);
Первые представления о строении атома • Первые представления о наличии атомов были высказаны еще мыслителями Древней Греции Левкиппом и Демокритом; • По их мнению, все вещества состоят из мельчайших, неделимых частиц; • Эти частицы были названы атомами (от греч. ατομοσ – неделимый);
 • Атомы, входящие в разные вещества, отличаются друг от друга формой и размерами; • Все атомы находятся в состоянии вечного движения; • При нагревании скорость движения атомов возрастает, что приводит к увеличению объема тел; • При охлаждении скорость движения атомов снижается, следствием чего является уменьшение объема.
• Атомы, входящие в разные вещества, отличаются друг от друга формой и размерами; • Все атомы находятся в состоянии вечного движения; • При нагревании скорость движения атомов возрастает, что приводит к увеличению объема тел; • При охлаждении скорость движения атомов снижается, следствием чего является уменьшение объема.
 В конце ХIХ века были получены экспериментальные данные о том, что атом не является гомогенной, неделимой частицей, как считалось ранее, а имеет сложное строение.
В конце ХIХ века были получены экспериментальные данные о том, что атом не является гомогенной, неделимой частицей, как считалось ранее, а имеет сложное строение.
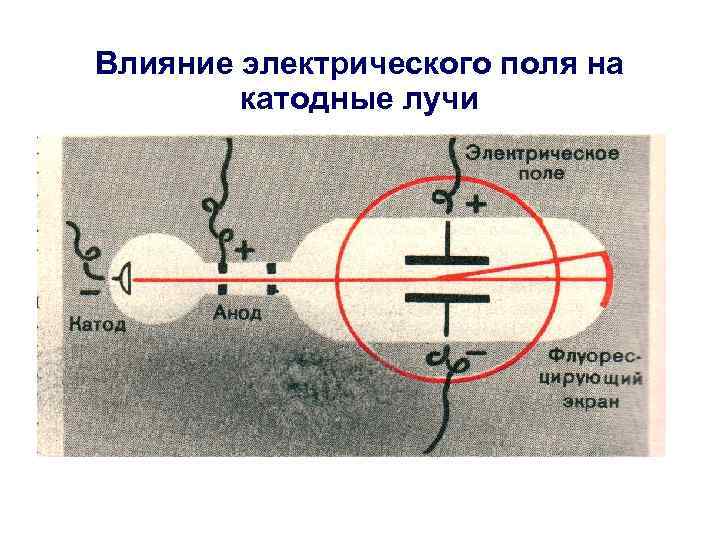 Влияние электрического поля на катодные лучи
Влияние электрического поля на катодные лучи
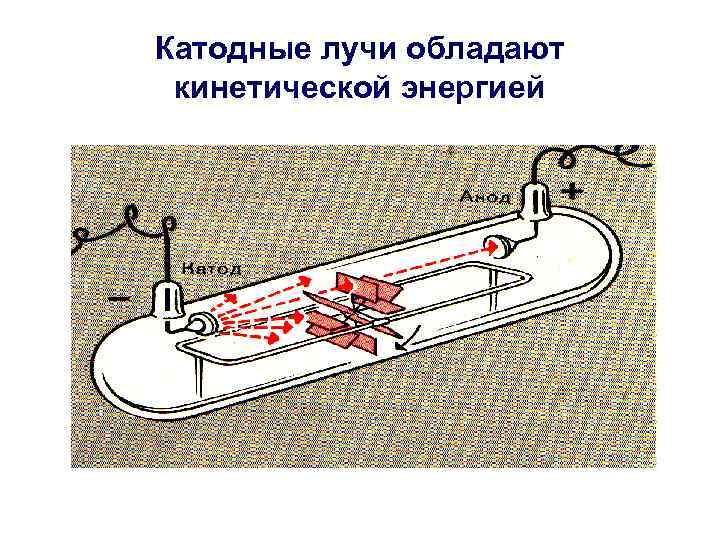 Катодные лучи обладают кинетической энергией
Катодные лучи обладают кинетической энергией
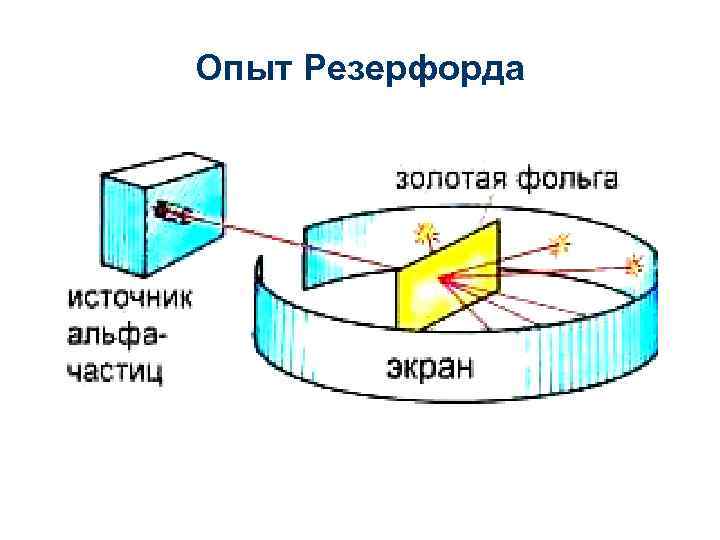 Опыт Резерфорда
Опыт Резерфорда
 • Согласно планетарной или ядерной модели, предложенной Резерфордом в 1911 г. , атом состоит из ядра и электронной оболочки;
• Согласно планетарной или ядерной модели, предложенной Резерфордом в 1911 г. , атом состоит из ядра и электронной оболочки;
 • Ядро находится в центре атома, заряжено положительно и имеет очень маленький размер и очень большую плотность; • Средний диаметр атома 10 -10 м, а размер ядра 10 -15 м. Следовательно, по размеру ядро примерно в 100 тыс. раз меньше атома. • Ядро состоит из положительно заряженных протонов и нейтронов, не имеющих заряда. • Вокруг ядра вращаются электроны, заряженные отрицательно.
• Ядро находится в центре атома, заряжено положительно и имеет очень маленький размер и очень большую плотность; • Средний диаметр атома 10 -10 м, а размер ядра 10 -15 м. Следовательно, по размеру ядро примерно в 100 тыс. раз меньше атома. • Ядро состоит из положительно заряженных протонов и нейтронов, не имеющих заряда. • Вокруг ядра вращаются электроны, заряженные отрицательно.
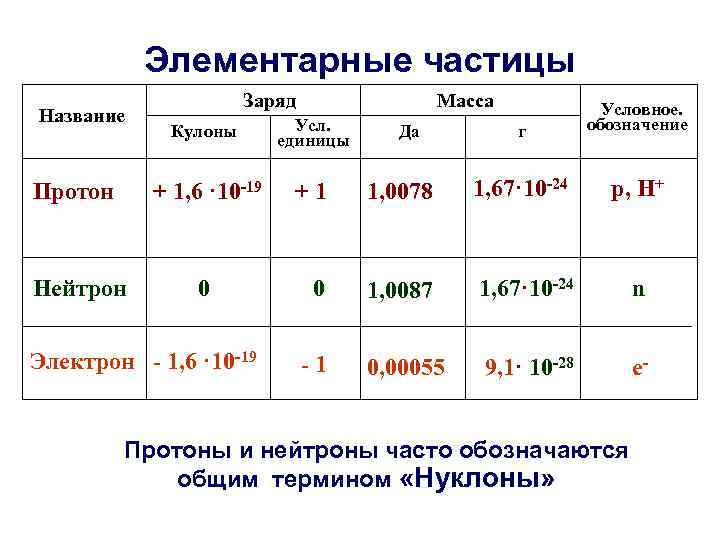 Элементарные частицы Название Заряд Масса г Условное. обозначение 1, 0078 1, 67· 10 -24 р, Н+ 0 1, 0087 1, 67· 10 -24 n -1 0, 00055 9, 1· 10 -28 е- Кулоны Усл. единицы Протон + 1, 6 · 10 -19 +1 Нейтрон 0 Электрон - 1, 6 · 10 -19 Да Протоны и нейтроны часто обозначаются общим термином «Нуклоны»
Элементарные частицы Название Заряд Масса г Условное. обозначение 1, 0078 1, 67· 10 -24 р, Н+ 0 1, 0087 1, 67· 10 -24 n -1 0, 00055 9, 1· 10 -28 е- Кулоны Усл. единицы Протон + 1, 6 · 10 -19 +1 Нейтрон 0 Электрон - 1, 6 · 10 -19 Да Протоны и нейтроны часто обозначаются общим термином «Нуклоны»
 • Количество электронов равно количеству протонов; • Заряд ядра атома равен количеству протонов; • Масса ядра атома равна сумме протонов и нейтронов; • Масса ядра практически равна массе атома; • Количество нейтронов в ядре атома равняется разности между массой атома и количеством протонов.
• Количество электронов равно количеству протонов; • Заряд ядра атома равен количеству протонов; • Масса ядра атома равна сумме протонов и нейтронов; • Масса ядра практически равна массе атома; • Количество нейтронов в ядре атома равняется разности между массой атома и количеством протонов.

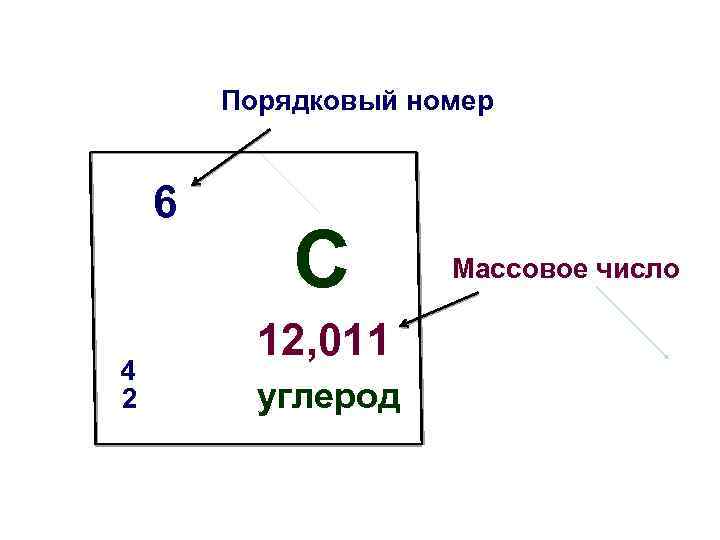 Порядковый номер 6 4 2 C 12, 011 углерод Массовое число
Порядковый номер 6 4 2 C 12, 011 углерод Массовое число
 Таблица Д. И. Менделеева и элементарные частицы • Порядковый номер химического элемента соответствует количеству электронов, протонов и заряду ядра; • Округленное массовое число соответствует сумме протонов и нейтронов и, следовательно, массе ядра; • Разность между округленным массовым числом и порядковым номером соответствует количеству нейтронов.
Таблица Д. И. Менделеева и элементарные частицы • Порядковый номер химического элемента соответствует количеству электронов, протонов и заряду ядра; • Округленное массовое число соответствует сумме протонов и нейтронов и, следовательно, массе ядра; • Разность между округленным массовым числом и порядковым номером соответствует количеству нейтронов.
 Строение ядра атома
Строение ядра атома
 Ядерные силы • В ядре атома протоны и нейтроны соединяются особыми ядерными силами; • Эти силы действуют только на очень малом расстоянии (порядка 10 -14 – 10 -15 м); • Протоны и нейтроны притягиваются другу с огромной силой – до 240 тонн; • Вследствие этого ядро атома имеет очень малый размер и обладает чрезвычайно высокой плотностью – около 130 млн. тонн/см 3
Ядерные силы • В ядре атома протоны и нейтроны соединяются особыми ядерными силами; • Эти силы действуют только на очень малом расстоянии (порядка 10 -14 – 10 -15 м); • Протоны и нейтроны притягиваются другу с огромной силой – до 240 тонн; • Вследствие этого ядро атома имеет очень малый размер и обладает чрезвычайно высокой плотностью – около 130 млн. тонн/см 3
 Дефект массы • Образование ядра атома из протонов и нейтронов сопровождается выделением очень большого количества энергии, что является основной причиной высокой прочности и плотности ядра; • Выделение энергии приводит к уменьшению массы ядра и, следовательно всего атома; Это явление называется дефект массы;
Дефект массы • Образование ядра атома из протонов и нейтронов сопровождается выделением очень большого количества энергии, что является основной причиной высокой прочности и плотности ядра; • Выделение энергии приводит к уменьшению массы ядра и, следовательно всего атома; Это явление называется дефект массы;
 • Например, ядро гелия имеет массу на 0, 03 Да меньше суммарной массы составляющих его двух протонов и нейтронов; • В соответствии с уравнением Эйнштейна Е = мс2 (Е - энергия, м – масса, с – скорость света) следствием дефекта массы является выделение очень большого количества энергии;
• Например, ядро гелия имеет массу на 0, 03 Да меньше суммарной массы составляющих его двух протонов и нейтронов; • В соответствии с уравнением Эйнштейна Е = мс2 (Е - энергия, м – масса, с – скорость света) следствием дефекта массы является выделение очень большого количества энергии;
 • Так, при образовании одного моля гелия (4 г) дефицит массы составляет 0, 03 г, что соответствует выделению 2, 7 · 1012 Дж энергии (2, 7 триллиона Дж); • Образование ядер гелия постоянно происходит на Солнце и сопровождается выделением огромного количества энергии.
• Так, при образовании одного моля гелия (4 г) дефицит массы составляет 0, 03 г, что соответствует выделению 2, 7 · 1012 Дж энергии (2, 7 триллиона Дж); • Образование ядер гелия постоянно происходит на Солнце и сопровождается выделением огромного количества энергии.
 Изотопы • Химический элемент – совокупность атомов, обладающих одинаковыми химическими свойствами; • Большинство атомов в природе находится в форме изотопов; • Изотопы отличаются друг от друга только количеством нейтронов и, следовательно массой, и занимают в таблице Д. И. Менделеева одну ячейку;
Изотопы • Химический элемент – совокупность атомов, обладающих одинаковыми химическими свойствами; • Большинство атомов в природе находится в форме изотопов; • Изотопы отличаются друг от друга только количеством нейтронов и, следовательно массой, и занимают в таблице Д. И. Менделеева одну ячейку;
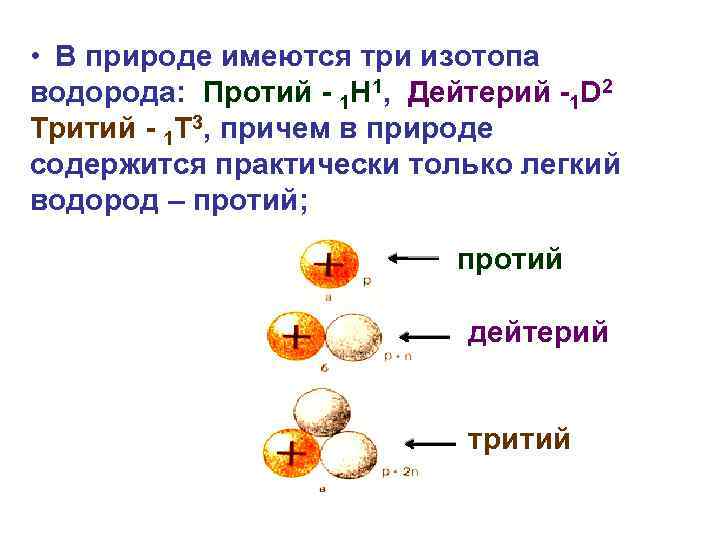 • В природе имеются три изотопа водорода: Протий - 1 Н 1, Дейтерий -1 D 2 Тритий - 1 Т 3, причем в природе содержится практически только легкий водород – протий; протий дейтерий тритий
• В природе имеются три изотопа водорода: Протий - 1 Н 1, Дейтерий -1 D 2 Тритий - 1 Т 3, причем в природе содержится практически только легкий водород – протий; протий дейтерий тритий

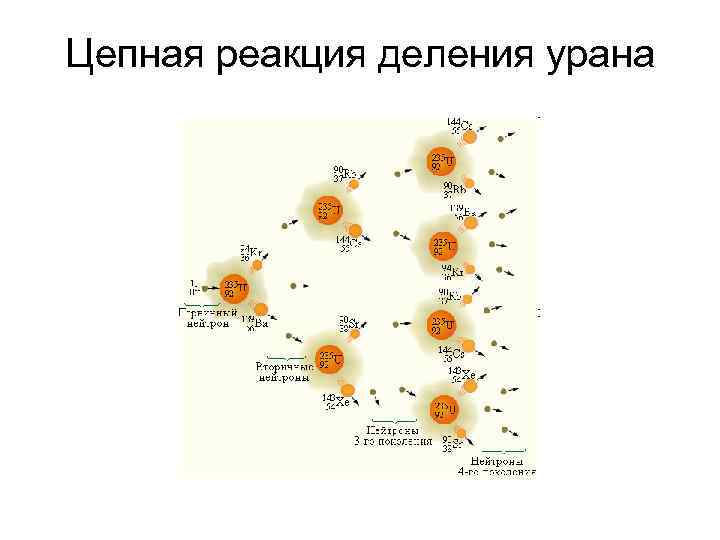 Цепная реакция деления урана
Цепная реакция деления урана
 • • У хлора имеются два изотопа: 17 Cl 35 и Cl 37; 17 В таблице Д. И. Менделеева приводится средняя масса атома с учетом всех его изотопов. • Средняя атомная масса хлора – 35, 5 Да, так как в природе преобладает легкий изотоп хлора Сl 35 (75 %), а доля тяжелого хлора – Cl 37 составляет только 25 %.
• • У хлора имеются два изотопа: 17 Cl 35 и Cl 37; 17 В таблице Д. И. Менделеева приводится средняя масса атома с учетом всех его изотопов. • Средняя атомная масса хлора – 35, 5 Да, так как в природе преобладает легкий изотоп хлора Сl 35 (75 %), а доля тяжелого хлора – Cl 37 составляет только 25 %.
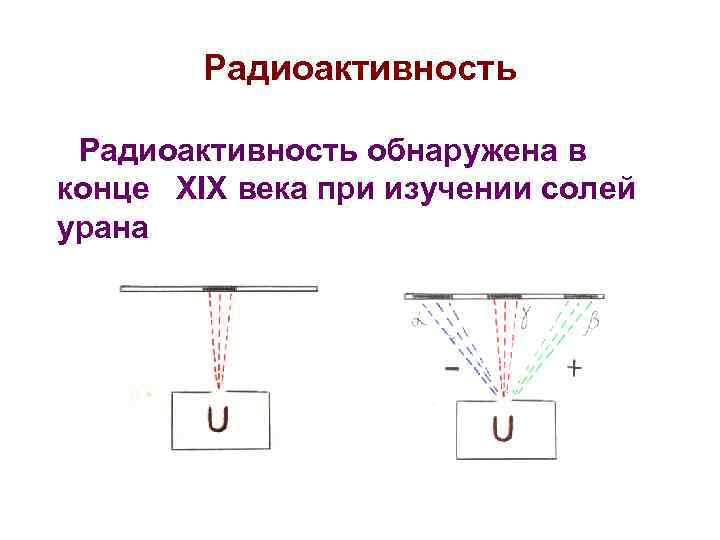 Радиоактивность обнаружена в конце XIX века при изучении солей урана
Радиоактивность обнаружена в конце XIX века при изучении солей урана
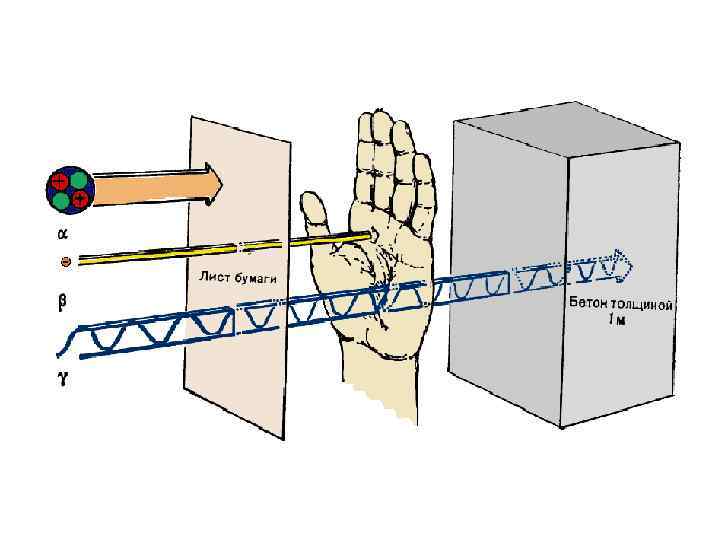
 α-излучение • α-частицы состоят из двух протонов и двух нейтронов (2 р2 n) и по строению соответствуют ядрам гелия; • Масса = 4 Да, заряд = +2 ед. • Скорость движения α-частиц – 20 тыс. км/с; • Проникающая способность очень низкая: лист алюминия толщиной 0, 1 мм их полностью задерживает; • Образуются при распаде ядра.
α-излучение • α-частицы состоят из двух протонов и двух нейтронов (2 р2 n) и по строению соответствуют ядрам гелия; • Масса = 4 Да, заряд = +2 ед. • Скорость движения α-частиц – 20 тыс. км/с; • Проникающая способность очень низкая: лист алюминия толщиной 0, 1 мм их полностью задерживает; • Образуются при распаде ядра.
 β-излучение • Β-лучи – поток электронов, двигающихся со скоростью света (300 тыс. км/с); • Проникающая способность выше, чем у α-лучей. Легко проходят через лист алюминия толщиной до 10 мм. • Образуются в ядре атома в процессе превращения нейтронов в протоны: n 1 0 → p 1 + +1 e 0 -1
β-излучение • Β-лучи – поток электронов, двигающихся со скоростью света (300 тыс. км/с); • Проникающая способность выше, чем у α-лучей. Легко проходят через лист алюминия толщиной до 10 мм. • Образуются в ядре атома в процессе превращения нейтронов в протоны: n 1 0 → p 1 + +1 e 0 -1
 γ-излучение • Представляет собой высокочастотное коротковолновое электромагнитное излучение (подобное рентгеновским лучам); • Распространяется со скоростью света; • Проникающая способность очень высокая: проходят через стальной лист толщиной до 30 см.
γ-излучение • Представляет собой высокочастотное коротковолновое электромагнитное излучение (подобное рентгеновским лучам); • Распространяется со скоростью света; • Проникающая способность очень высокая: проходят через стальной лист толщиной до 30 см.
 Ионизирующая способность • Под воздействием радиоактивного излучения нейтральные молекулы могут приобретать заряд и превращаться в ионы; • В связи с этим радиоактивное излучение еще называют ионизирующим; • Наибольшей ионизирующей способностью обладают α-лучи, а самой низкой - γ-излучение.
Ионизирующая способность • Под воздействием радиоактивного излучения нейтральные молекулы могут приобретать заряд и превращаться в ионы; • В связи с этим радиоактивное излучение еще называют ионизирующим; • Наибольшей ионизирующей способностью обладают α-лучи, а самой низкой - γ-излучение.
 Природа радиоактивности • В основе проявления радиоактивности лежит самопроизвольный распад ядер нестабильных атомов. • У этих атомов содержание нейтронов в ядре значительно превосходит количество протонов; • Такие атомы имеют большую массу и находятся в нижней части таблицы Д. И. Менделеева (Po, Ra, Ac, U, Pu и др. ).
Природа радиоактивности • В основе проявления радиоактивности лежит самопроизвольный распад ядер нестабильных атомов. • У этих атомов содержание нейтронов в ядре значительно превосходит количество протонов; • Такие атомы имеют большую массу и находятся в нижней части таблицы Д. И. Менделеева (Po, Ra, Ac, U, Pu и др. ).
 Виды радиоактивного распада • α-распад: от ядра отщепляются фрагмент, состоящий из двух протонов и двух нейтронов, т. е. αчастица 226 222 + 4 +88 Ra +86 Rn +2 He • β-распад: в ядре нейтрон превращается в протон с 1 0 выделением электрона: 0 n 1 +1 p + -1 e Al 28 +13 Si 28 + +14 e 0 -1
Виды радиоактивного распада • α-распад: от ядра отщепляются фрагмент, состоящий из двух протонов и двух нейтронов, т. е. αчастица 226 222 + 4 +88 Ra +86 Rn +2 He • β-распад: в ядре нейтрон превращается в протон с 1 0 выделением электрона: 0 n 1 +1 p + -1 e Al 28 +13 Si 28 + +14 e 0 -1
 · Электронный захват: Ядро может захватить электрон из ближайшего электронного слоя. Этот электрон в ядре присоединяется к протону с образованием нейтрона: +1 p 1 + -1 e 0 0 n 1 V 49 + +23 e 0 -1 Ti 49 +22 α –распад, β-распад и электронный захват обычно сопровождаются γ-излучением;
· Электронный захват: Ядро может захватить электрон из ближайшего электронного слоя. Этот электрон в ядре присоединяется к протону с образованием нейтрона: +1 p 1 + -1 e 0 0 n 1 V 49 + +23 e 0 -1 Ti 49 +22 α –распад, β-распад и электронный захват обычно сопровождаются γ-излучением;
 • Спонтанное деление ядра атома При бомбардировке нейтронами ядро захватывает нейтрон, становится неустойчивым и распадается на несколько ядер с меньшими массами: U 235 + 0 n 1 U 236 Ba, Kr и т. п. +92 • Деление ядра сопровождается α-, βи γ-излучением; • Радиоактивный распад носит цепной характер. При распаде одного радиоактивного элемента образуются новые радиоактивные элементы, которые подвергаются дальнейшему распаду; • Радиоактивный распад обычно протекает до образования стабильного изотопа свинца.
• Спонтанное деление ядра атома При бомбардировке нейтронами ядро захватывает нейтрон, становится неустойчивым и распадается на несколько ядер с меньшими массами: U 235 + 0 n 1 U 236 Ba, Kr и т. п. +92 • Деление ядра сопровождается α-, βи γ-излучением; • Радиоактивный распад носит цепной характер. При распаде одного радиоактивного элемента образуются новые радиоактивные элементы, которые подвергаются дальнейшему распаду; • Радиоактивный распад обычно протекает до образования стабильного изотопа свинца.
 Период полураспада - Т 1/2 • Период полураспада - время, в течение которого распаду подвергается половина (50%) радиоактивного элемента; • Период полураспада не зависит от первоначальной массы радиоактивного элемента; • Величина периода полураспада для различных радиоактивных веществ колеблется в колоссальных пределах - от долей секунды до миллиардов лет.
Период полураспада - Т 1/2 • Период полураспада - время, в течение которого распаду подвергается половина (50%) радиоактивного элемента; • Период полураспада не зависит от первоначальной массы радиоактивного элемента; • Величина периода полураспада для различных радиоактивных веществ колеблется в колоссальных пределах - от долей секунды до миллиардов лет.
 Искусственная радиоактивность • • Искусственной радиоактивностью обладают химические элементы, отсутствующие в природе и полученные путем бомбардировки некоторых природных элементов протонами, нейтронами и α-частицами Fe 56 + 0 n 1 +26 Mn 56 +25 Mn 56 + +1 p 1 +25 Fe 56 + -1 e 0 +26 У изотопов, обладающих искусственной радиоактивностью, величина периода полураспада очень низкая (доли с. или мин. ), и поэтому они отсутствуют в природе.
Искусственная радиоактивность • • Искусственной радиоактивностью обладают химические элементы, отсутствующие в природе и полученные путем бомбардировки некоторых природных элементов протонами, нейтронами и α-частицами Fe 56 + 0 n 1 +26 Mn 56 +25 Mn 56 + +1 p 1 +25 Fe 56 + -1 e 0 +26 У изотопов, обладающих искусственной радиоактивностью, величина периода полураспада очень низкая (доли с. или мин. ), и поэтому они отсутствуют в природе.
 Тест 1 Количество электронов в атоме равно: а) атомной массе б) количеству нейтронов в) количеству протонов г) сумме протонов и нейтронов
Тест 1 Количество электронов в атоме равно: а) атомной массе б) количеству нейтронов в) количеству протонов г) сумме протонов и нейтронов
 Тест 2 В состав атома серы с атомной массой 32 Да входит: а) 3 нейтрона б) 6 нейтронов в) 16 нейтронов г) 32 нейтрона
Тест 2 В состав атома серы с атомной массой 32 Да входит: а) 3 нейтрона б) 6 нейтронов в) 16 нейтронов г) 32 нейтрона
 Тест 3 Изотопы одного химического элемента отличаются друг от друга: а) количеством нейтронов б) количеством протонов в) количеством электронов г) количеством электронных слоев
Тест 3 Изотопы одного химического элемента отличаются друг от друга: а) количеством нейтронов б) количеством протонов в) количеством электронов г) количеством электронных слоев
 Тест 4 Положительный заряд имеет элементарная частица: а) нейтрон б) нейтрино в) протон г) электрон
Тест 4 Положительный заряд имеет элементарная частица: а) нейтрон б) нейтрино в) протон г) электрон
 Тест 5 Элементарная частица, не имеющая заряда, называется: а) нейтрон б) позитрон в) протон г) электрон
Тест 5 Элементарная частица, не имеющая заряда, называется: а) нейтрон б) позитрон в) протон г) электрон
 Тест 6 Заряд ядра атома равен: а) б) в) г) количеству нейтронов количеству протонов номеру главной подгруппы номеру периода
Тест 6 Заряд ядра атома равен: а) б) в) г) количеству нейтронов количеству протонов номеру главной подгруппы номеру периода
 Тест 7 Наибольшей массой обладает: а) нейтрино б) позитрон в) протон г) электрон
Тест 7 Наибольшей массой обладает: а) нейтрино б) позитрон в) протон г) электрон
 Тест 8 Элементарная частица, имеющая положительный заряд, называется: а) нейтрино б) нейтрон в) протон г) электрон
Тест 8 Элементарная частица, имеющая положительный заряд, называется: а) нейтрино б) нейтрон в) протон г) электрон
 Тест 9 При β-распаде выделяются: а) нейтроны б) протоны в) позитроны г) электроны
Тест 9 При β-распаде выделяются: а) нейтроны б) протоны в) позитроны г) электроны
 Тест 10 Элементарная частица, имеющая отрицательный заряд, называется: а) нейтрон б) позитрон в) протон г) электрон
Тест 10 Элементарная частица, имеющая отрицательный заряд, называется: а) нейтрон б) позитрон в) протон г) электрон
 Тест 11 Наибольшее распространение в природе имеет изотоп водорода: а) +1 Н 1 б) +1 Н 2 в) +1 Н 3 г) +1 Н 4
Тест 11 Наибольшее распространение в природе имеет изотоп водорода: а) +1 Н 1 б) +1 Н 2 в) +1 Н 3 г) +1 Н 4
 Тест 12 Наибольшей массой обладает: а) нейтрино б) нейтрон в) позитрон г) электрон
Тест 12 Наибольшей массой обладает: а) нейтрино б) нейтрон в) позитрон г) электрон
 Тест 13 При α-распаде выделяются частицы: а) +1 е 1 б) -1 е 1 в) +1 Н 1 г) +2 Не 4
Тест 13 При α-распаде выделяются частицы: а) +1 е 1 б) -1 е 1 в) +1 Н 1 г) +2 Не 4
 Тест 14 Изотопы одного химического элемента отличаются друг от друга: а) зарядом ядра б) массой в) количеством протонов г) количеством электронов
Тест 14 Изотопы одного химического элемента отличаются друг от друга: а) зарядом ядра б) массой в) количеством протонов г) количеством электронов


