Химия. Лекции для строителей. Структура курса 1.Строение атомов

































![ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ] ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ]](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_94.jpg)























![КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n, КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n,](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_129.jpg)



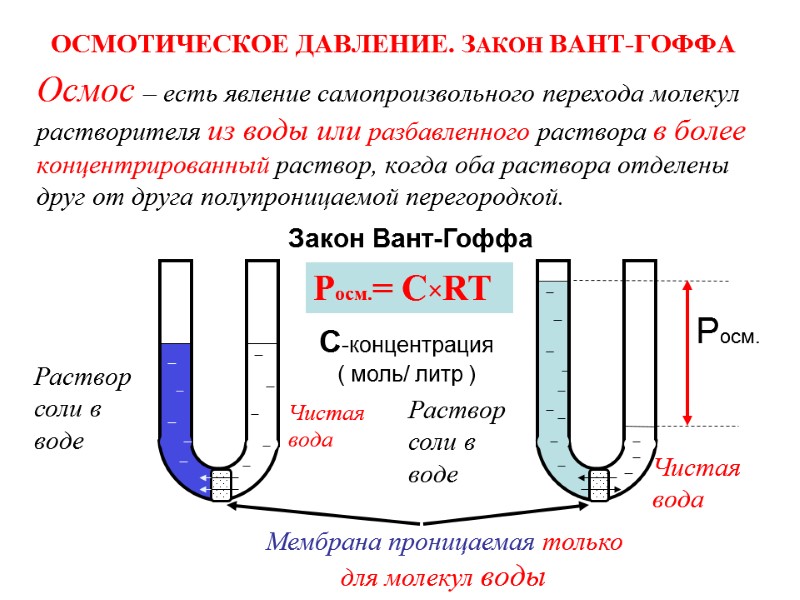
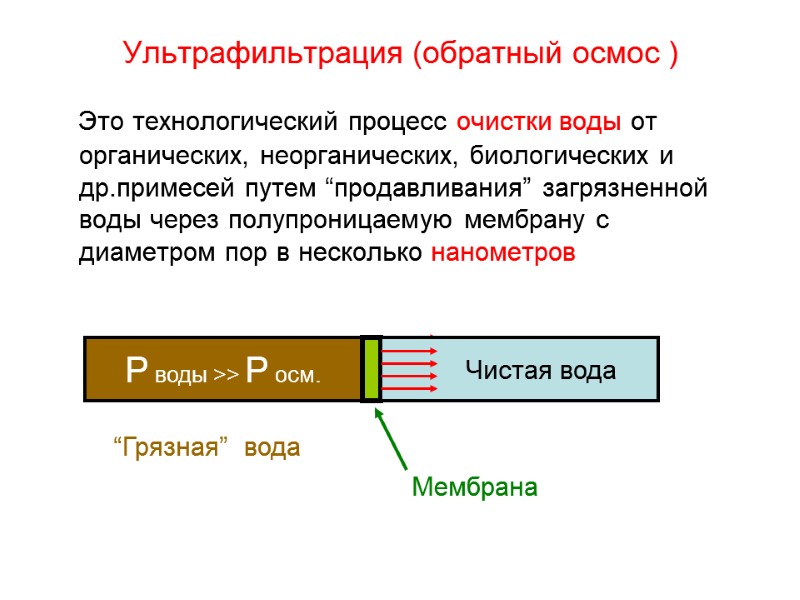

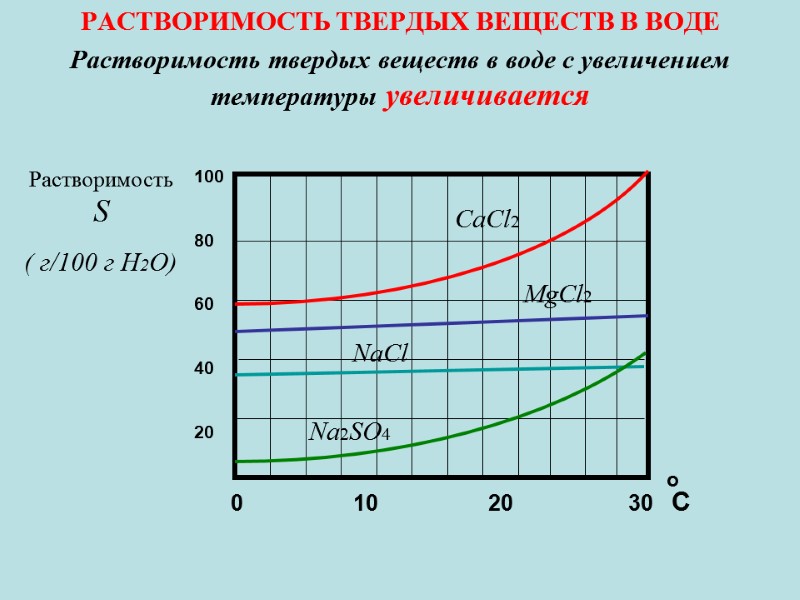

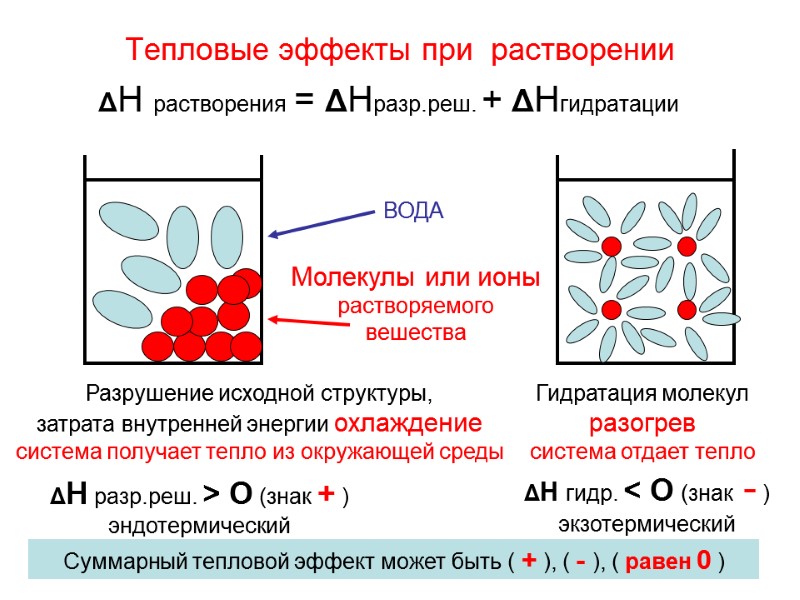


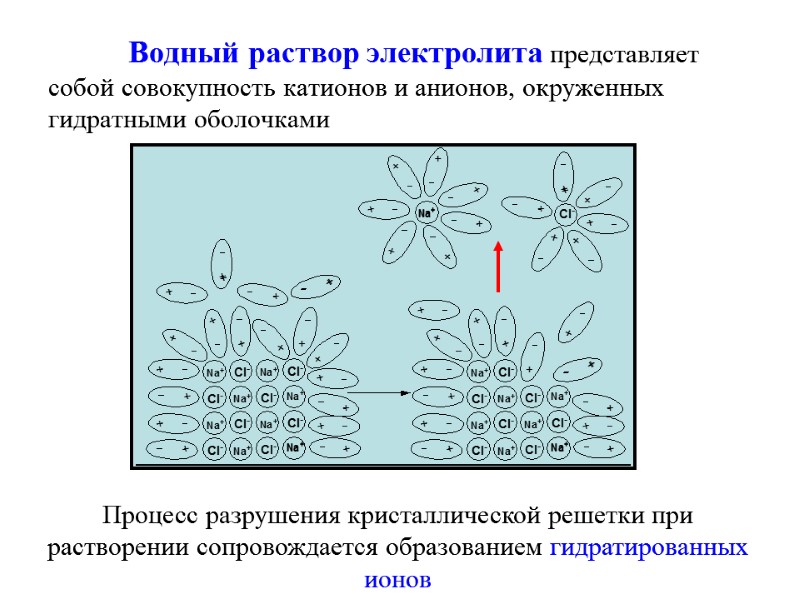









![Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+] Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+]](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_161.jpg)






































5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt
- Количество слайдов: 247
 Химия. Лекции для строителей. Структура курса 1.Строение атомов 2.Химическая связь 3.Вещества в ГАЗ. ЖИДК. ТВ. состоянии 4.Химическая термодинамика 5.Скорость хим. реакций 6.Растворы неэлектролитов 7. Электролитич.диссоциация 8.Электрохимия, коррозия металлов 9.Дисперсные системы 10.Вяжущие вещества 11.Органич.химия, Полимеры 12.Аналитическая химия Литература 1.Яблоков В.А. Химия.Теор.основы курса/Учебн.пособие,/часть1/ ННГАСУ,2009г. 2.Яблоков В.А. Химия Получение и превр.веществ и энерг./ч. 2/ ННГАСУ,2010г. 3.Глинка Н.Л. Общая химия: учебн.пособие-Л.: Химия,1985.-704с. 4.Глинка Н.Л. Задачи и упр. по общ.химии.-М.:Интеграл-Пресс,2003.-240 с. 5.Электронный вариант данного курса (можно скачать на каф.химии ННГАСУ )
Химия. Лекции для строителей. Структура курса 1.Строение атомов 2.Химическая связь 3.Вещества в ГАЗ. ЖИДК. ТВ. состоянии 4.Химическая термодинамика 5.Скорость хим. реакций 6.Растворы неэлектролитов 7. Электролитич.диссоциация 8.Электрохимия, коррозия металлов 9.Дисперсные системы 10.Вяжущие вещества 11.Органич.химия, Полимеры 12.Аналитическая химия Литература 1.Яблоков В.А. Химия.Теор.основы курса/Учебн.пособие,/часть1/ ННГАСУ,2009г. 2.Яблоков В.А. Химия Получение и превр.веществ и энерг./ч. 2/ ННГАСУ,2010г. 3.Глинка Н.Л. Общая химия: учебн.пособие-Л.: Химия,1985.-704с. 4.Глинка Н.Л. Задачи и упр. по общ.химии.-М.:Интеграл-Пресс,2003.-240 с. 5.Электронный вариант данного курса (можно скачать на каф.химии ННГАСУ )
 В в е д е н и е. Основные законы химии.
В в е д е н и е. Основные законы химии.







 Основные законы химии Закон сохранения масс (Лавуазье—Ломоносов, 1774г.) «Масса вешеств, вступающих в реакцию, равна массе продуктов этой реакции.» Закон постоянства состава ( Пруст, 1799г.) «Любое чистое вещество, независимо от способа его получения, имеет одинаковый качественный и количественный состав.» Закон кратных отношений ( Дальтон, Пруст ) «Число атомов (количество) некоторого элемента, соединяющегося с одним и тем же количеством другого, соотносятся как небольшие целые числа.» Например в оксидах азота N2O -1/2 NO- 1/1 NO2 -2/1 Моль – в одном моле содержится столько же структурных единиц (атомов, ионов, молекул),сколько атомов в 12 граммах изотопа углерода С-12 а именно - NAвогадро = 6,02×10 ( частиц/моль ) 5. Молярная масса – масса 1моля вещества, напр. М(Н2О) = 18 г/моль 6. Молярный объем – 1 моль любого газа или пара при нормальных условиях ( Н.У. -- температура Т = 0 С , давление Р = 1атм ). занимает объем 22,4 литра. V(м) = 22,4 л/моль 23 о
Основные законы химии Закон сохранения масс (Лавуазье—Ломоносов, 1774г.) «Масса вешеств, вступающих в реакцию, равна массе продуктов этой реакции.» Закон постоянства состава ( Пруст, 1799г.) «Любое чистое вещество, независимо от способа его получения, имеет одинаковый качественный и количественный состав.» Закон кратных отношений ( Дальтон, Пруст ) «Число атомов (количество) некоторого элемента, соединяющегося с одним и тем же количеством другого, соотносятся как небольшие целые числа.» Например в оксидах азота N2O -1/2 NO- 1/1 NO2 -2/1 Моль – в одном моле содержится столько же структурных единиц (атомов, ионов, молекул),сколько атомов в 12 граммах изотопа углерода С-12 а именно - NAвогадро = 6,02×10 ( частиц/моль ) 5. Молярная масса – масса 1моля вещества, напр. М(Н2О) = 18 г/моль 6. Молярный объем – 1 моль любого газа или пара при нормальных условиях ( Н.У. -- температура Т = 0 С , давление Р = 1атм ). занимает объем 22,4 литра. V(м) = 22,4 л/моль 23 о
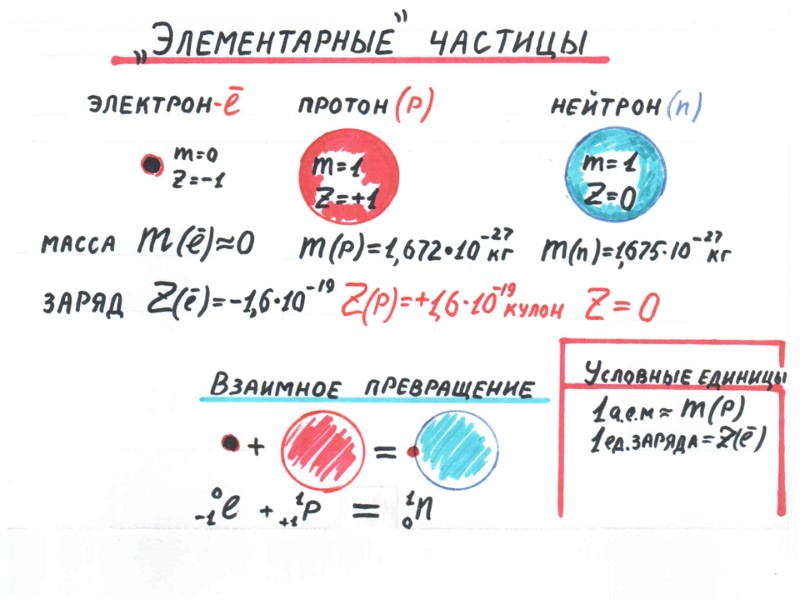
 Закон эквивалентов Эквивалент- Э -это количество вещества,которое соединяется с 1 молем атомов водорода (масса 1 гр.) или замещает зто количество водорода в химических реакциях. Э кислорода в Н2О - э(о)=1/2 моля Эквивалентная масса – масса 1 эквивалента вещества в граммах, напр. в молекуле Н2О Э(о) =16/2=8 г/экв в молекуле Н2S Э(s) =32/2 =16 г/экв Закон эквивалентов –массы взаимодействующих веществ относятся как их эквиваленты m(1)/m(2) = Э(1) /Э(2) Расчетные формулы для сложных веществ Э оксида =М(оксида) / число атомов элемента × валентность Э кислоты =М(кислоты) / число атомов Н в молекуле Э основания = М (основания) / число групп ОН в молекуле Э соли = М (соли) / число атомов металла × валентность металла
Закон эквивалентов Эквивалент- Э -это количество вещества,которое соединяется с 1 молем атомов водорода (масса 1 гр.) или замещает зто количество водорода в химических реакциях. Э кислорода в Н2О - э(о)=1/2 моля Эквивалентная масса – масса 1 эквивалента вещества в граммах, напр. в молекуле Н2О Э(о) =16/2=8 г/экв в молекуле Н2S Э(s) =32/2 =16 г/экв Закон эквивалентов –массы взаимодействующих веществ относятся как их эквиваленты m(1)/m(2) = Э(1) /Э(2) Расчетные формулы для сложных веществ Э оксида =М(оксида) / число атомов элемента × валентность Э кислоты =М(кислоты) / число атомов Н в молекуле Э основания = М (основания) / число групп ОН в молекуле Э соли = М (соли) / число атомов металла × валентность металла
 Основные газовые законы 1. Объединенный закон Бойля-Мариотта и Гей-Люссака для данной массы газа PV/T = PoVo/To где: Po=101325 Па, Vo=0,0224 куб.м., To=273,15 К для 1 моля газа PoVo/To = R = 101325 ×0,0224/ 273,15 = 8,31 Универсальная газовая постоянная R = 8,31 Дж/моль× К для n молей PV=nRT или PV=mRT/M ур-е Менделеева-Клапейрона 2. Объемы газов, участвующих в реакции, при одинаковых условиях относятся друг к другу как простые целые числа 3H2+ 1N2 = 2NH3 ( 3:1:2 ) 3. Отношение масс газов ( при одинаковых P,V,T ) равно отношению их молярных масс m1/m2 = M1/M2 где: M1/M2 = D –относительная плотность первого газа по второму Хлор тяжелее водорода в D(CI2/ H2) =71/ 2 =35,5 раз Метан легче воздуха в D(воздух/ CH4 ) =29/16 =1,8 раза
Основные газовые законы 1. Объединенный закон Бойля-Мариотта и Гей-Люссака для данной массы газа PV/T = PoVo/To где: Po=101325 Па, Vo=0,0224 куб.м., To=273,15 К для 1 моля газа PoVo/To = R = 101325 ×0,0224/ 273,15 = 8,31 Универсальная газовая постоянная R = 8,31 Дж/моль× К для n молей PV=nRT или PV=mRT/M ур-е Менделеева-Клапейрона 2. Объемы газов, участвующих в реакции, при одинаковых условиях относятся друг к другу как простые целые числа 3H2+ 1N2 = 2NH3 ( 3:1:2 ) 3. Отношение масс газов ( при одинаковых P,V,T ) равно отношению их молярных масс m1/m2 = M1/M2 где: M1/M2 = D –относительная плотность первого газа по второму Хлор тяжелее водорода в D(CI2/ H2) =71/ 2 =35,5 раз Метан легче воздуха в D(воздух/ CH4 ) =29/16 =1,8 раза
 строение и свойства атомов Лекция 1
строение и свойства атомов Лекция 1


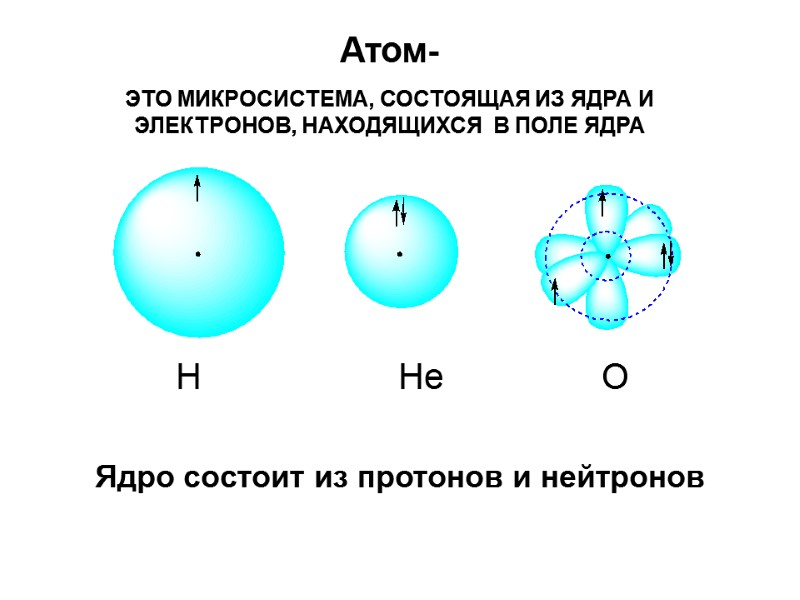
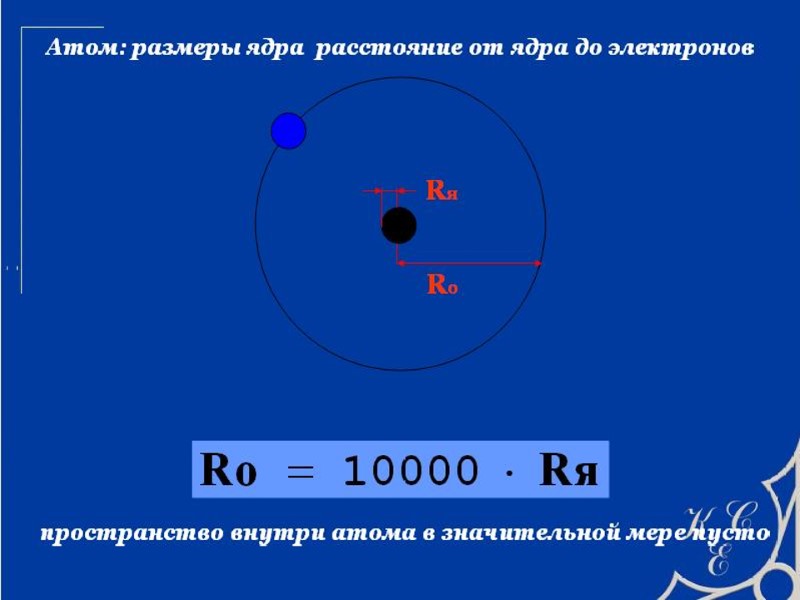
 Ядро состоит из протонов и нейтронов Атом- ЭТО МИКРОСИСТЕМА, СОСТОЯЩАЯ ИЗ ЯДРА И ЭЛЕКТРОНОВ, НАХОДЯЩИХСЯ В ПОЛЕ ЯДРА Н Не О
Ядро состоит из протонов и нейтронов Атом- ЭТО МИКРОСИСТЕМА, СОСТОЯЩАЯ ИЗ ЯДРА И ЭЛЕКТРОНОВ, НАХОДЯЩИХСЯ В ПОЛЕ ЯДРА Н Не О

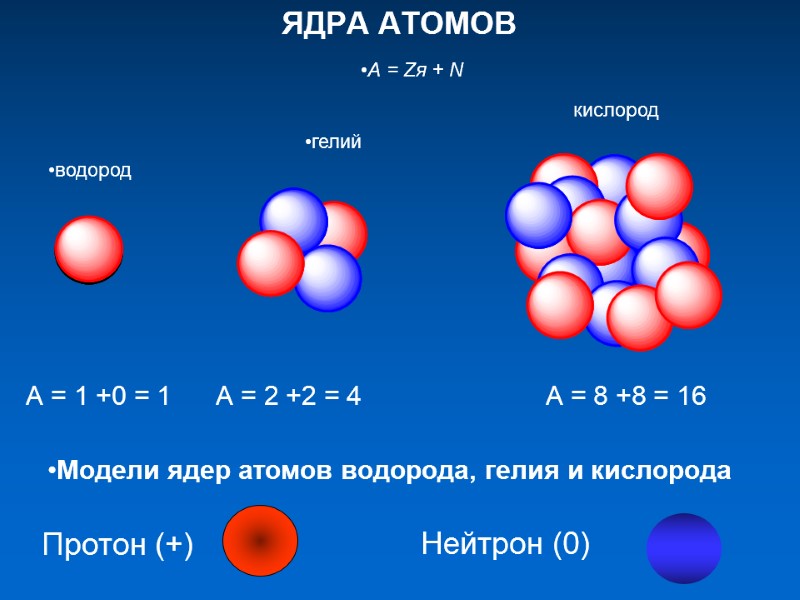
 ЯДРА АТОМОВ Модели ядер атомов водорода, гелия и кислорода Протон (+) Нейтрон (0) А = 1 +0 = 1 А = 2 +2 = 4 А = 8 +8 = 16 А = Zя + N кислород гелий водород
ЯДРА АТОМОВ Модели ядер атомов водорода, гелия и кислорода Протон (+) Нейтрон (0) А = 1 +0 = 1 А = 2 +2 = 4 А = 8 +8 = 16 А = Zя + N кислород гелий водород
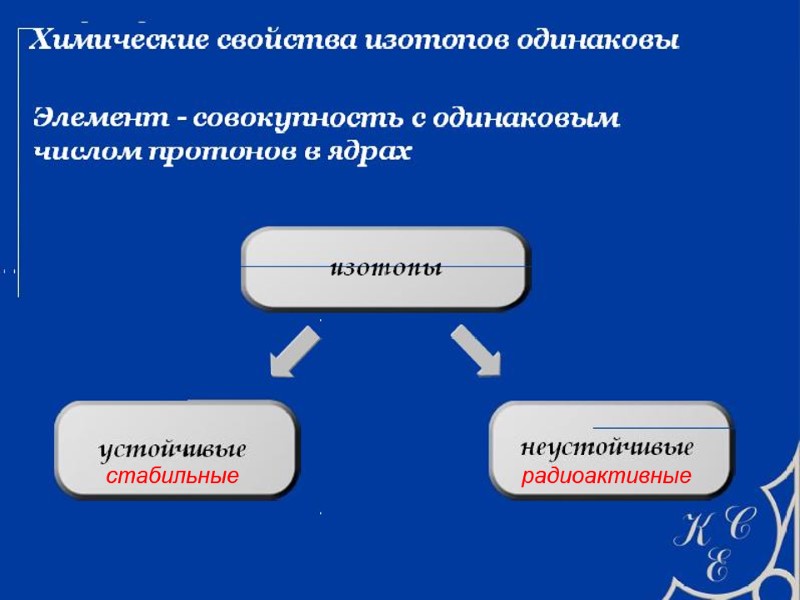
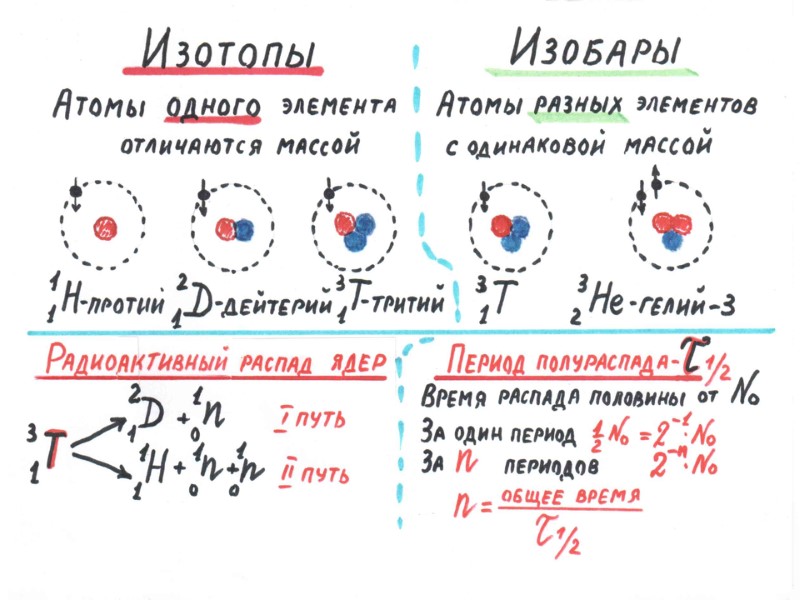
 радиоактивные стабильные
радиоактивные стабильные


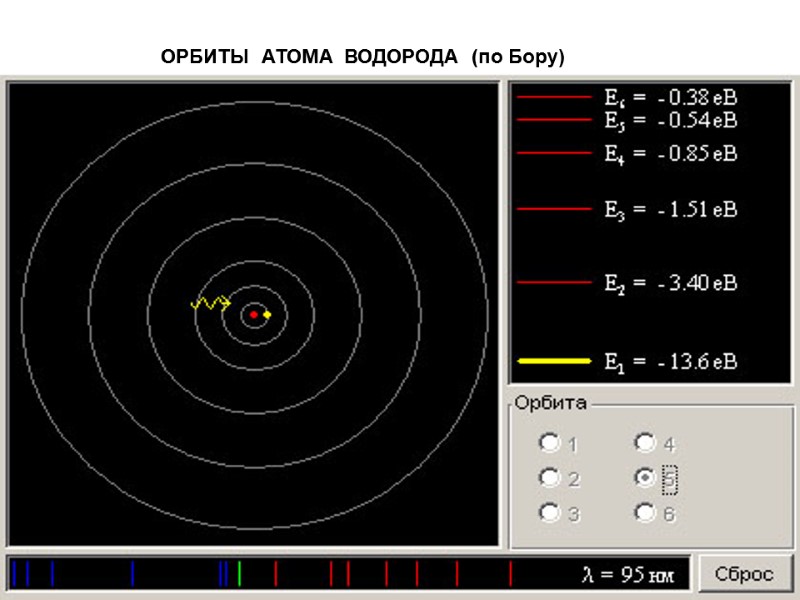
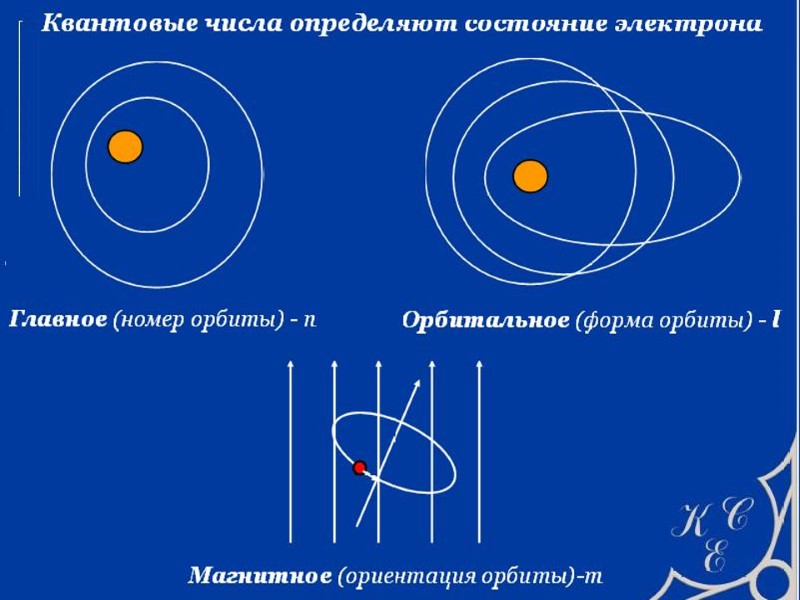
 ОРБИТЫ АТОМА ВОДОРОДА (по Бору)
ОРБИТЫ АТОМА ВОДОРОДА (по Бору)
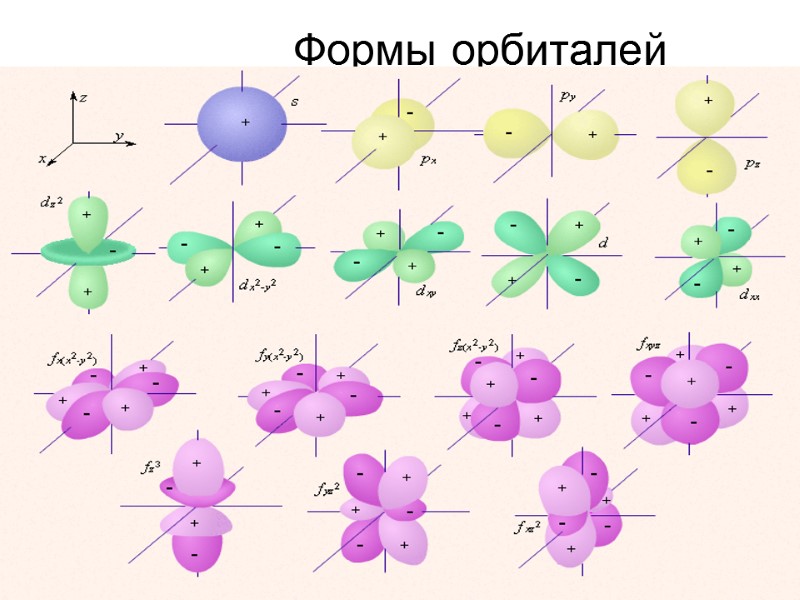
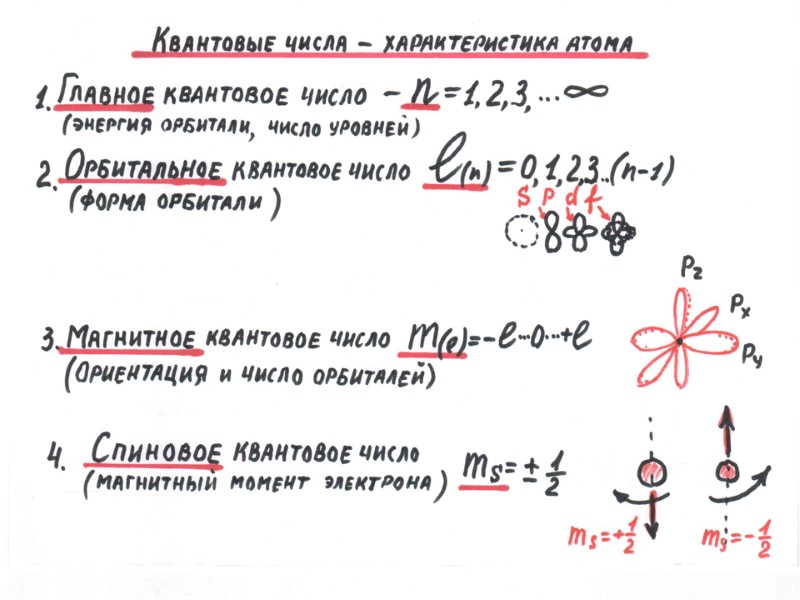
 Формы орбиталей
Формы орбиталей


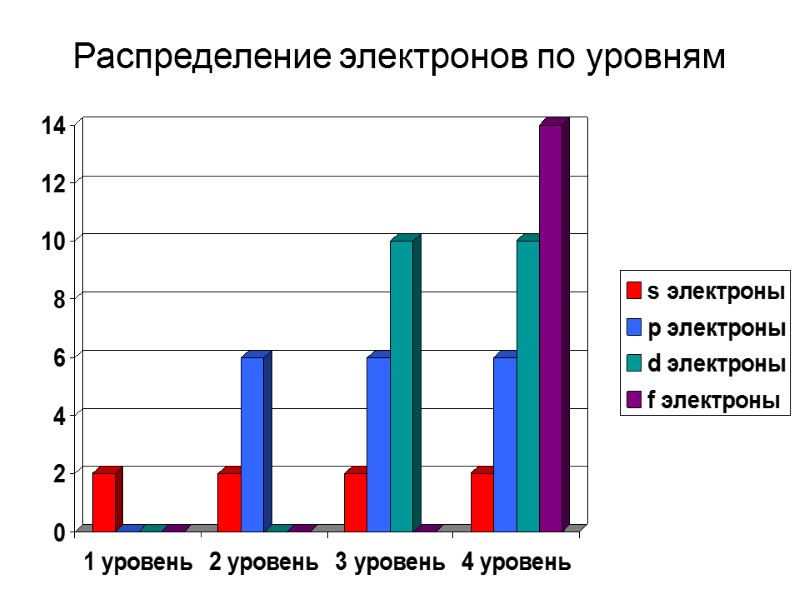
 Распределение электронов по уровням
Распределение электронов по уровням




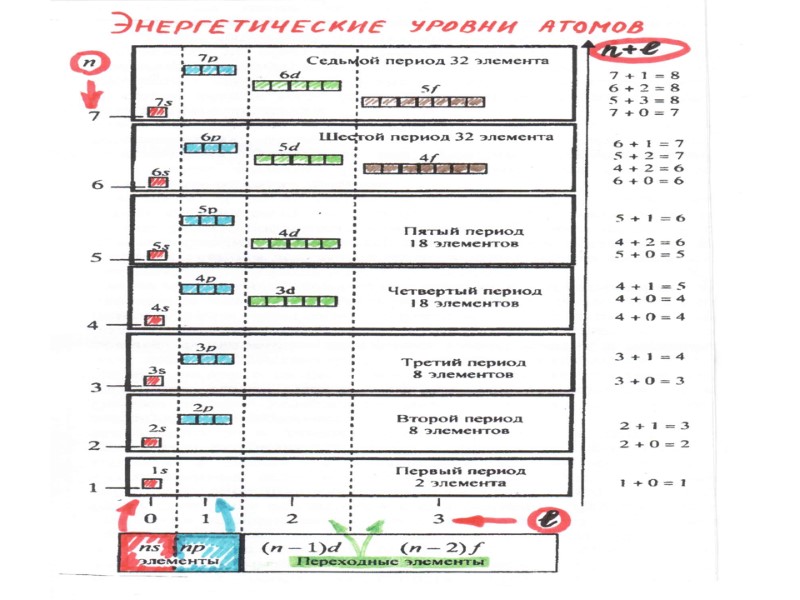
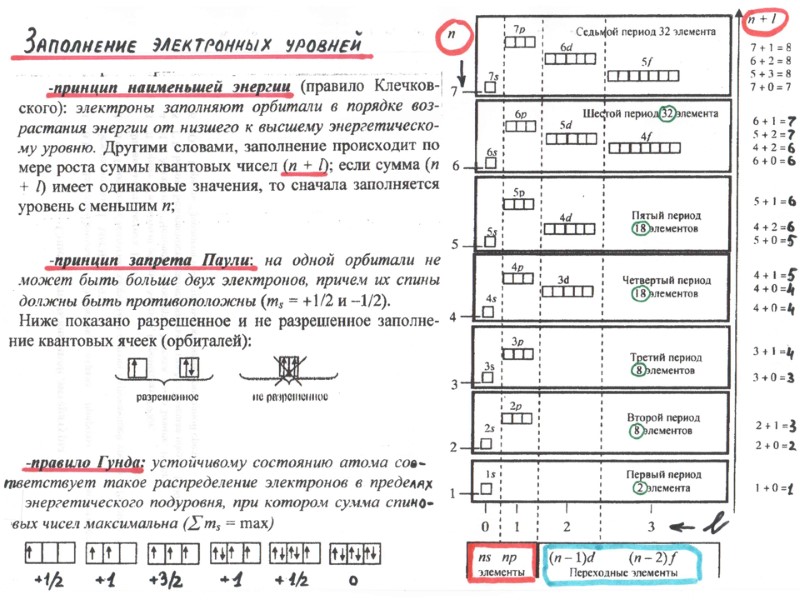
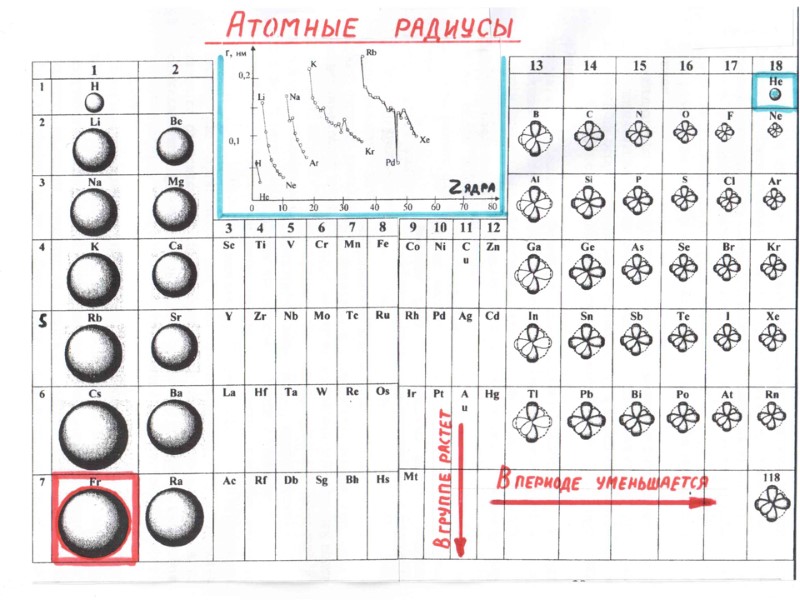
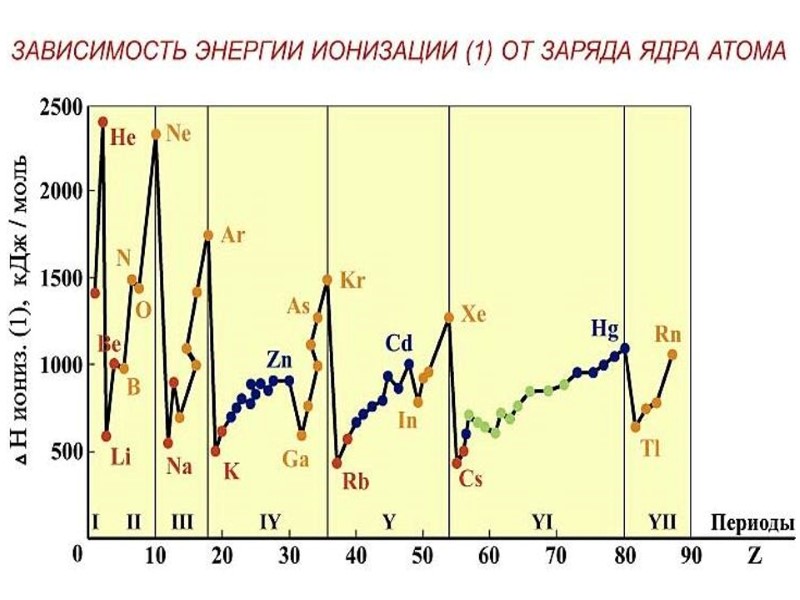
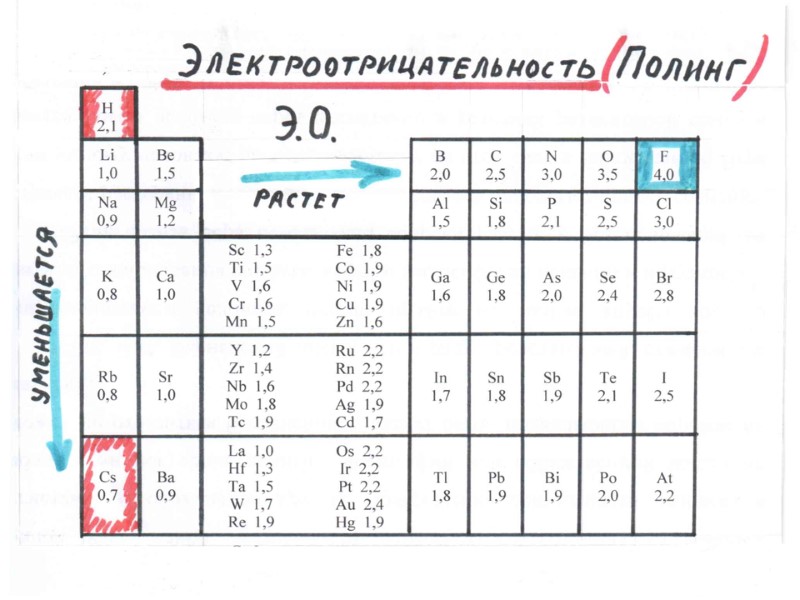
 ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов Период – это горизонтальный ряд элементов, в атомах которых электроны последовательно заполняют ns- и завершают заполнение np- орбиталей (n – главное квантовое число, соответствует номеру периода). Группа – это вертикальный ряд, в котором объединены атомы химических элементов с одинаковым числом электронов на внешней орбитали.
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов Период – это горизонтальный ряд элементов, в атомах которых электроны последовательно заполняют ns- и завершают заполнение np- орбиталей (n – главное квантовое число, соответствует номеру периода). Группа – это вертикальный ряд, в котором объединены атомы химических элементов с одинаковым числом электронов на внешней орбитали.
 Краткий итог темы Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов Атом устойчивая динамическая система. Электронное облако (орбиталь) характеризует не образ «размытых» в пространстве электронов или электрона, а область движения электронов в поле ядра Форма, пространственное расположение орбиталей и последовательность заполнения электронами энергетических уровней определяется квантовыми числами и квантовыми правилами Носителем свойств атомов является атомное ядро Заряд ядра определяет количество электронов в атоме и, следовательно, характер распределения электронов по энергетическим уровням Свойства атомов: обмениваться энергией, отдавать и присоединять электроны, образовывать химические связи, изменять геометрическую конфигурацию
Краткий итог темы Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов Атом устойчивая динамическая система. Электронное облако (орбиталь) характеризует не образ «размытых» в пространстве электронов или электрона, а область движения электронов в поле ядра Форма, пространственное расположение орбиталей и последовательность заполнения электронами энергетических уровней определяется квантовыми числами и квантовыми правилами Носителем свойств атомов является атомное ядро Заряд ядра определяет количество электронов в атоме и, следовательно, характер распределения электронов по энергетическим уровням Свойства атомов: обмениваться энергией, отдавать и присоединять электроны, образовывать химические связи, изменять геометрическую конфигурацию
 Вопросы для проверки знаний 1. Какую микросистему называют атомом? 2. Почему заряд ядра определяет свойства атома? 3. Что подразумевается под электронной орбиталью? 4. Согласны ли вы с утверждением, что «электронным клеем», соединяющим атомы, являются электрические силы притяжения? 5. Согласны ли вы с утверждением, что по мере увеличения заряда ядра атомные орбитали сокращаются в размере? 6. По какому признаку атомы элементов объединены в периоды и группы?
Вопросы для проверки знаний 1. Какую микросистему называют атомом? 2. Почему заряд ядра определяет свойства атома? 3. Что подразумевается под электронной орбиталью? 4. Согласны ли вы с утверждением, что «электронным клеем», соединяющим атомы, являются электрические силы притяжения? 5. Согласны ли вы с утверждением, что по мере увеличения заряда ядра атомные орбитали сокращаются в размере? 6. По какому признаку атомы элементов объединены в периоды и группы?
 Молекулы Лекция 2 Химическая связь
Молекулы Лекция 2 Химическая связь
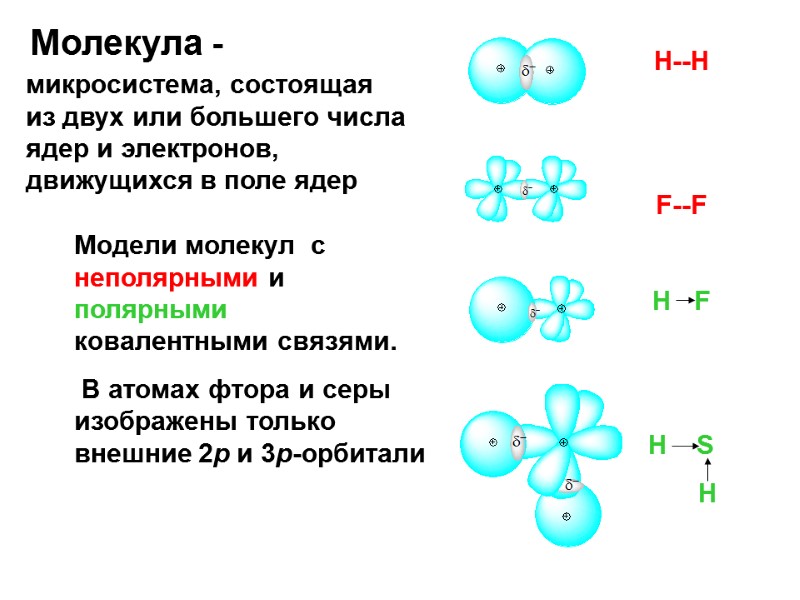
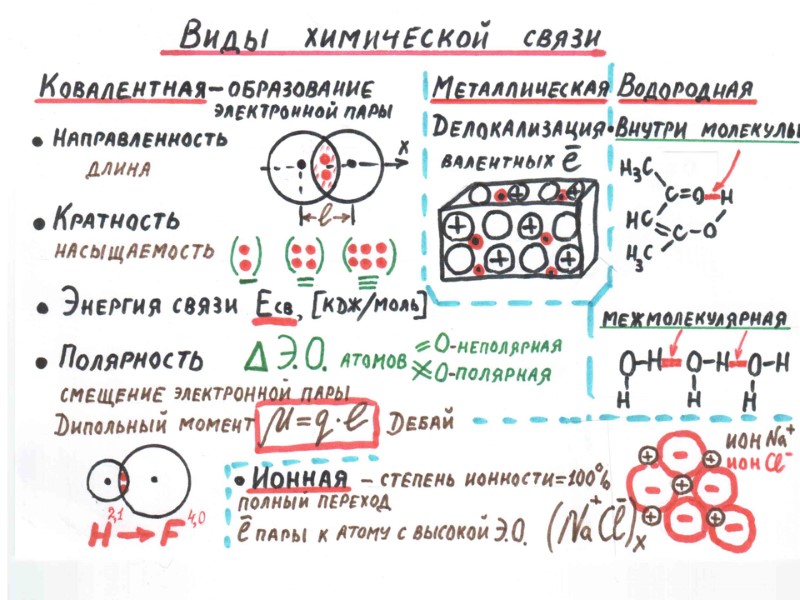
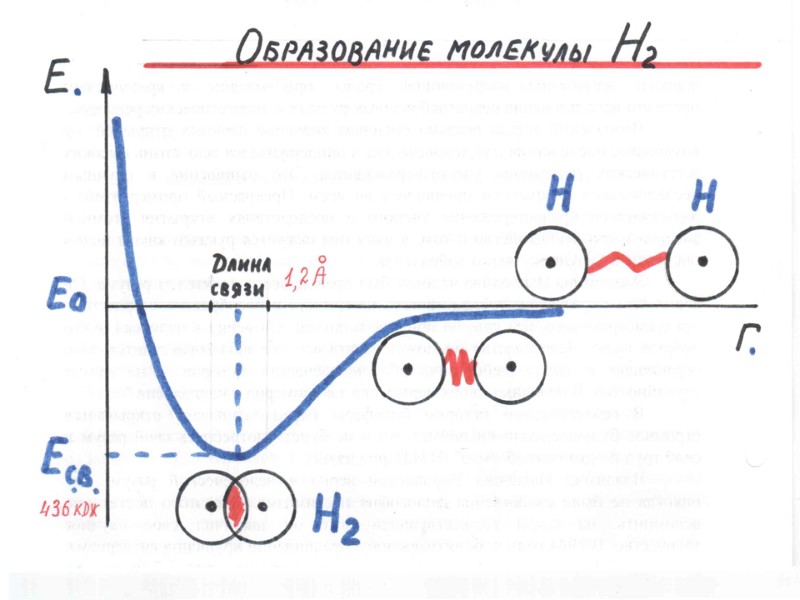
 Молекула - микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер Н--Н F--F H F H S H Модели молекул с неполярными и полярными ковалентными связями. В атомах фтора и серы изображены только внешние 2р и 3р-орбитали
Молекула - микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер Н--Н F--F H F H S H Модели молекул с неполярными и полярными ковалентными связями. В атомах фтора и серы изображены только внешние 2р и 3р-орбитали



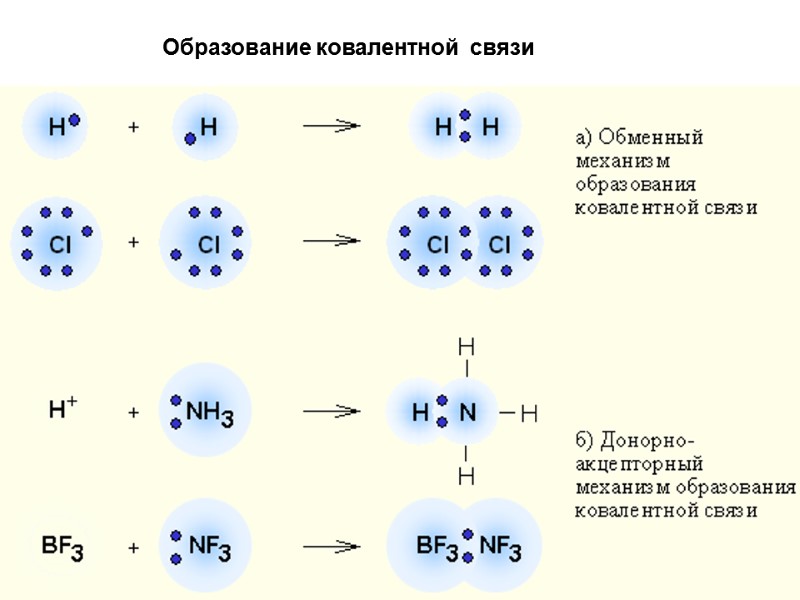
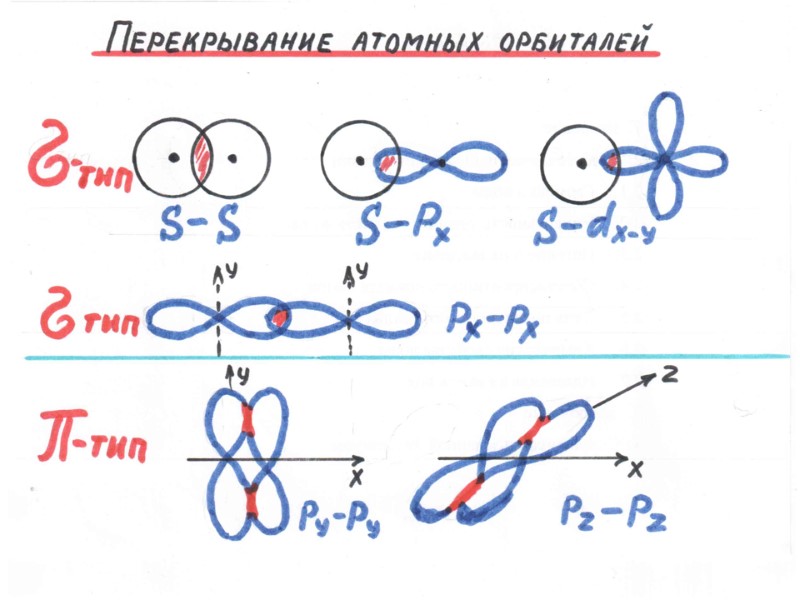
 МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ, МЕТОД (ВС) 1. В образовании ковалентной связи участвуют валентные электроны, т. е. электроны внешней электронной оболочки атома; 2. Каждая ковалентная химическая связь образуется при участии пары электронов с противоположными спинами; 3. Ковалентная химическая связь образуется при перекрывании атомных орбиталей. Между ядрами появляется область повышенной электронной плотности, удерживающая ядра на расстоянии, соответствующем длине химической связи.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ, МЕТОД (ВС) 1. В образовании ковалентной связи участвуют валентные электроны, т. е. электроны внешней электронной оболочки атома; 2. Каждая ковалентная химическая связь образуется при участии пары электронов с противоположными спинами; 3. Ковалентная химическая связь образуется при перекрывании атомных орбиталей. Между ядрами появляется область повышенной электронной плотности, удерживающая ядра на расстоянии, соответствующем длине химической связи.
 Образование ковалентной связи
Образование ковалентной связи



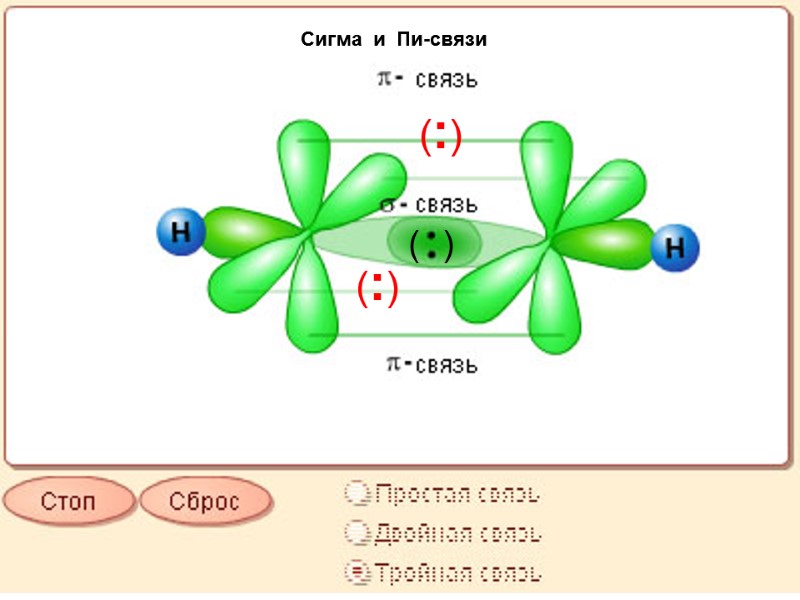
 Сигма и Пи-связи (:) (:) ( )
Сигма и Пи-связи (:) (:) ( )
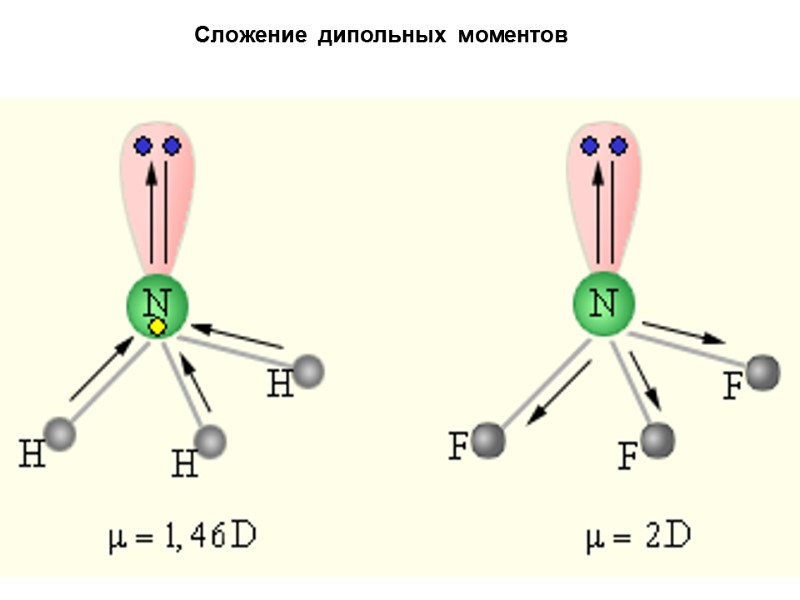
 Сложение дипольных моментов
Сложение дипольных моментов
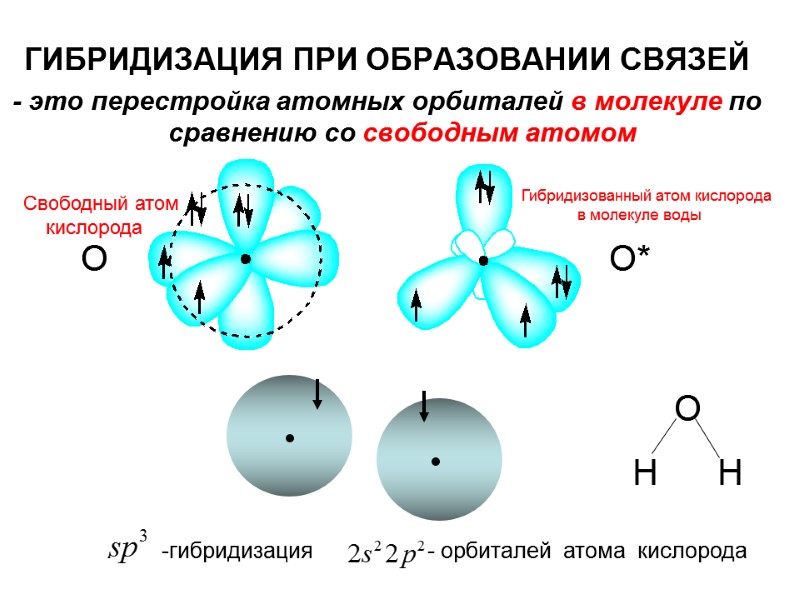
 О О* О Н Н ГИБРИДИЗАЦИЯ ПРИ ОБРАЗОВАНИИ СВЯЗЕЙ - это перестройка атомных орбиталей в молекуле по сравнению со свободным атомом . -гибридизация - орбиталей атома кислорода Свободный атом кислорода Гибридизованный атом кислорода в молекуле воды
О О* О Н Н ГИБРИДИЗАЦИЯ ПРИ ОБРАЗОВАНИИ СВЯЗЕЙ - это перестройка атомных орбиталей в молекуле по сравнению со свободным атомом . -гибридизация - орбиталей атома кислорода Свободный атом кислорода Гибридизованный атом кислорода в молекуле воды

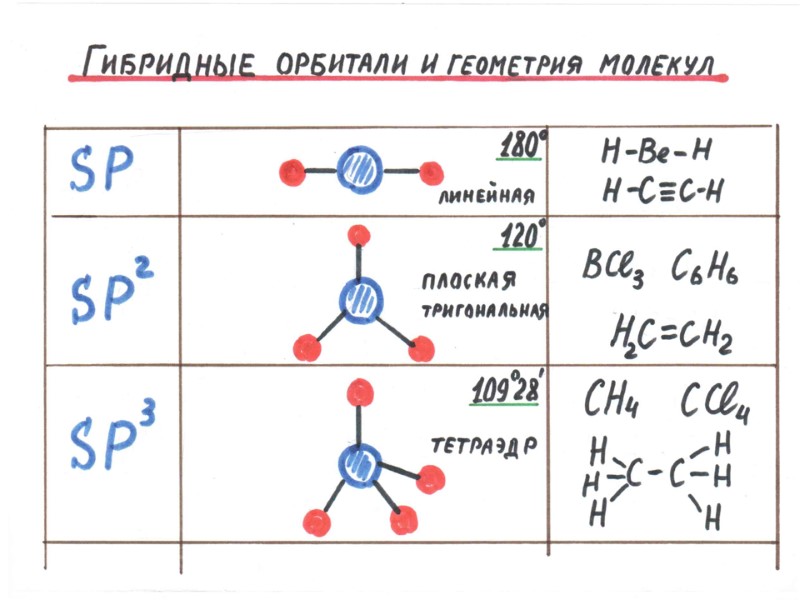
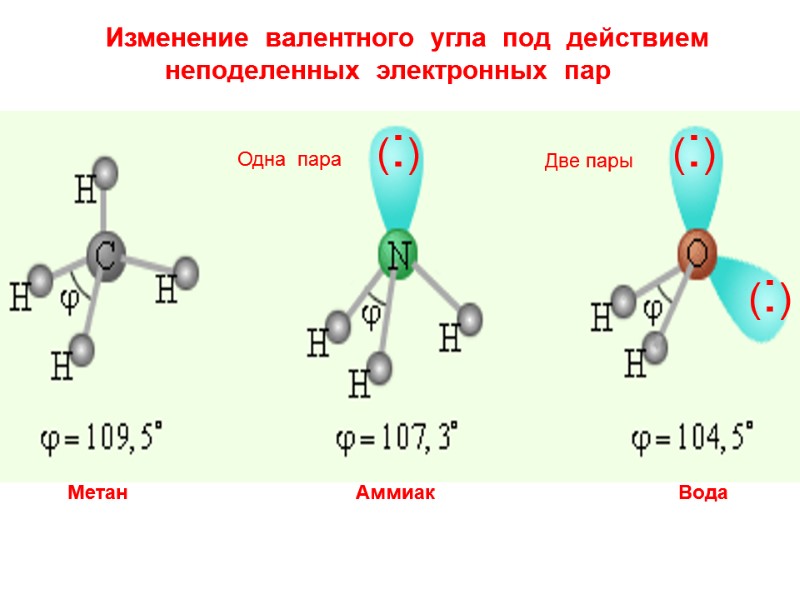
 Метан Аммиак Вода Изменение валентного угла под действием неподеленных электронных пар Одна пара Две пары (:) (:) (:)
Метан Аммиак Вода Изменение валентного угла под действием неподеленных электронных пар Одна пара Две пары (:) (:) (:)
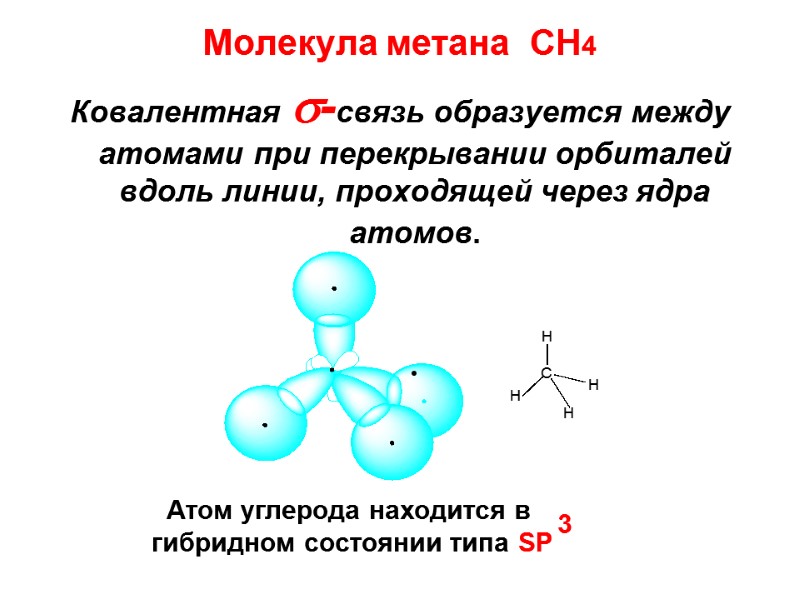
 Молекула метана СН4 Ковалентная -связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов. Атом углерода находится в гибридном состоянии типа SP 3
Молекула метана СН4 Ковалентная -связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов. Атом углерода находится в гибридном состоянии типа SP 3
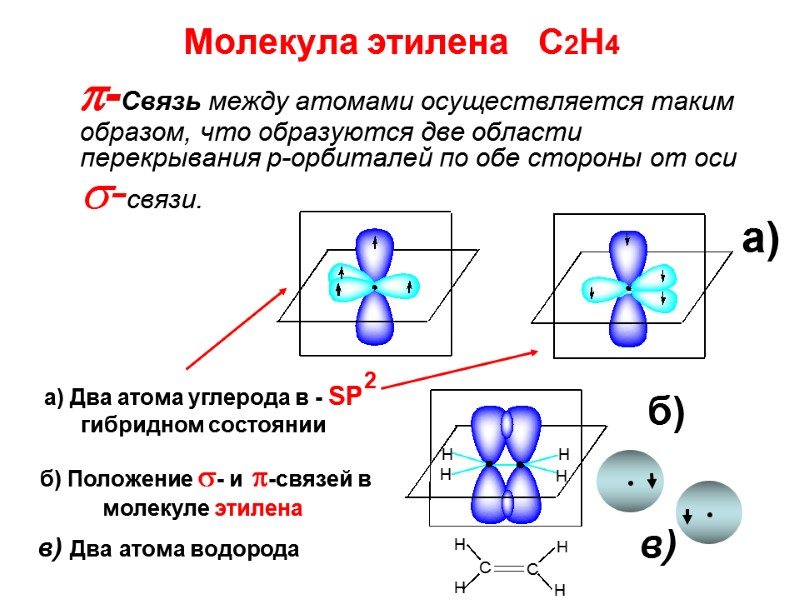
 Молекула этилена С2Н4 -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси -связи. а) Два атома углерода в - SP гибридном состоянии б) Положение - и -связей в молекуле этилена а) б) 2 в) в) Два атома водорода
Молекула этилена С2Н4 -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси -связи. а) Два атома углерода в - SP гибридном состоянии б) Положение - и -связей в молекуле этилена а) б) 2 в) в) Два атома водорода
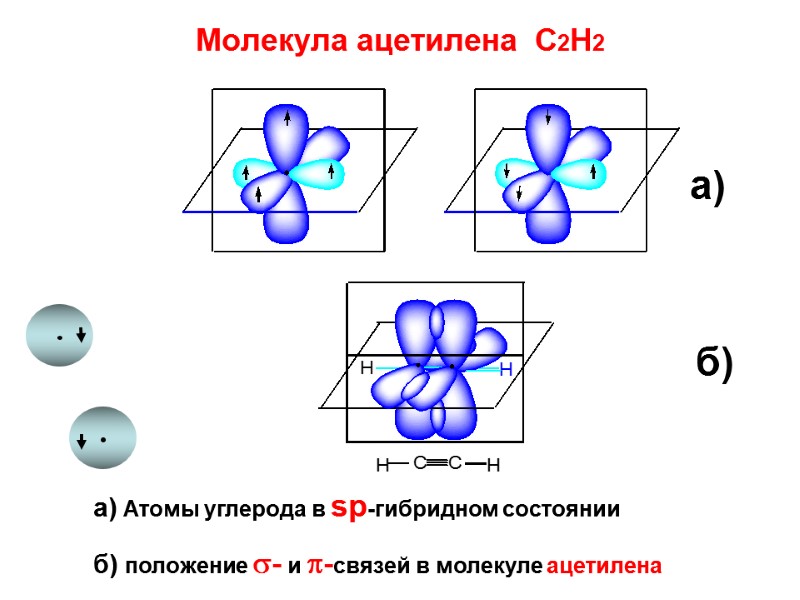
 Молекула ацетилена С2Н2 а) Атомы углерода в sp-гибридном состоянии б) положение - и -связей в молекуле ацетилена а) б)
Молекула ацетилена С2Н2 а) Атомы углерода в sp-гибридном состоянии б) положение - и -связей в молекуле ацетилена а) б)
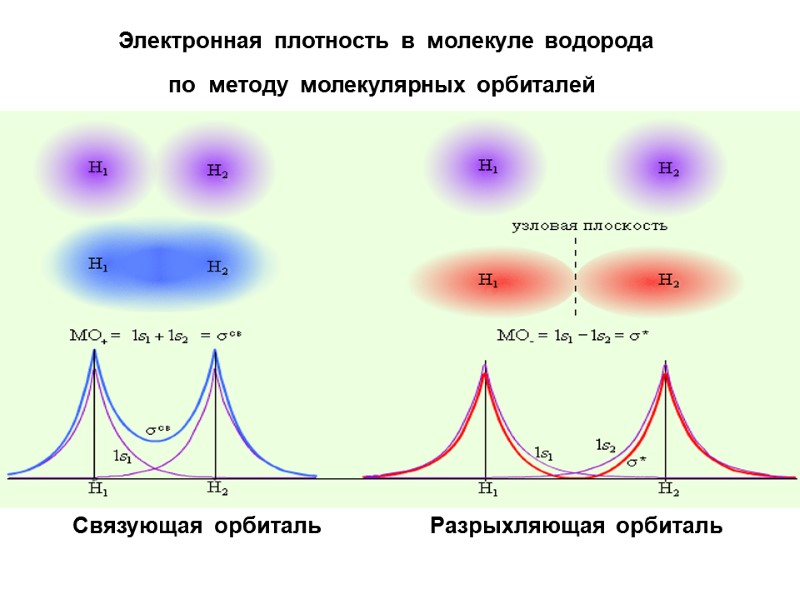
 Электронная плотность в молекуле водорода Связующая орбиталь Разрыхляющая орбиталь по методу молекулярных орбиталей
Электронная плотность в молекуле водорода Связующая орбиталь Разрыхляющая орбиталь по методу молекулярных орбиталей
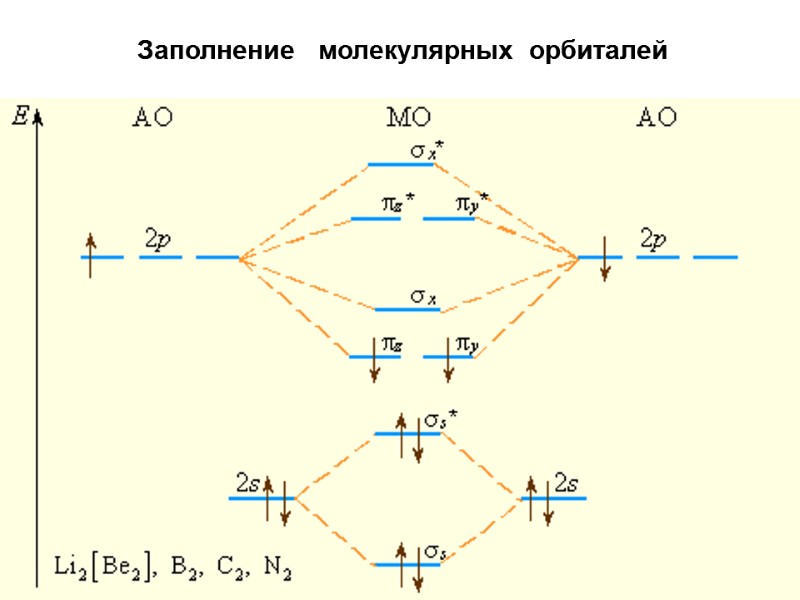
 Заполнение молекулярных орбиталей
Заполнение молекулярных орбиталей
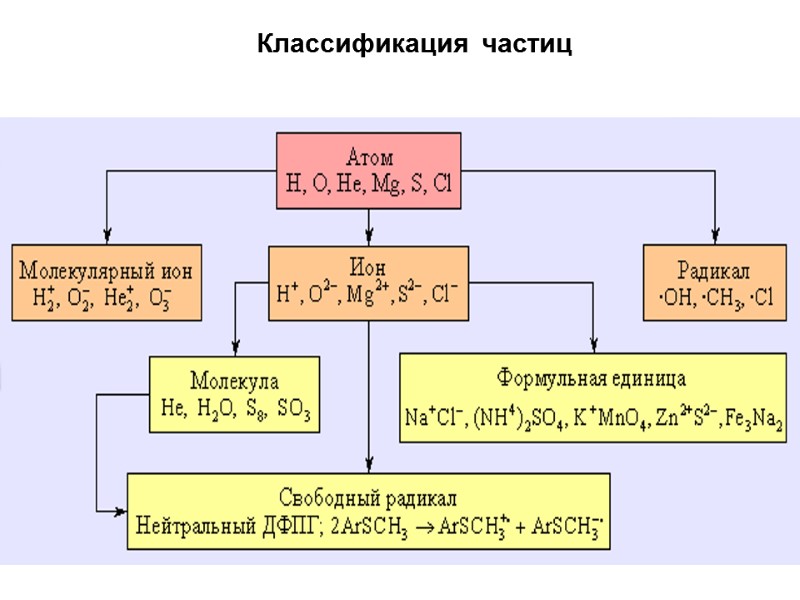
 Классификация частиц
Классификация частиц
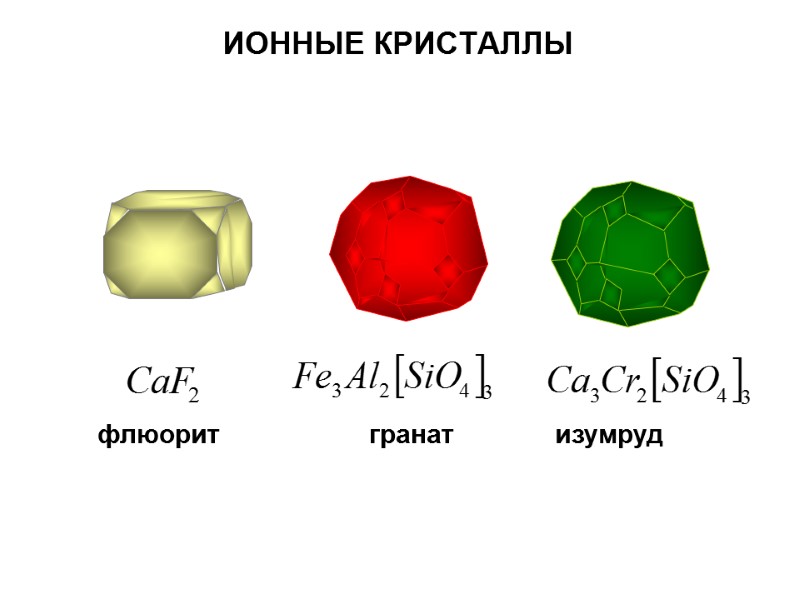
 ИОННЫЕ КРИСТАЛЛЫ флюорит гранат изумруд
ИОННЫЕ КРИСТАЛЛЫ флюорит гранат изумруд
 Краткий итог темы 1. Существует три типа химических связей между атомами: ковалентная, ионная и металлическая. 2. Химические связи в молекулах, ионных и металлических соединениях имеют электрическую природу. Электромагнитное взаимодействие удерживает систему ядер и электронов в молекулах и ионы в узлах кристаллической решетки. 3. В молекулах длина ковалентной связи есть расстояние между ядрами ковалентно связанных атомов. 4. В ионных соединениях длина связи соответствует расстоянию между центрами ионов. 5. В металлах длина связи соответствует расстоянию между узлами кристаллической решетки, занимаемыми ионами металла. 6. С позиций метода валентных связей (ВС) ковалентная связь между атомами в молекуле осуществляется парой электронов при перекрывании атомных орбиталей. 7. Ионная связь существует между катионами и анионами в ионных кристаллах. 8. Металлическая связь осуществляется подвижными электронами, удерживающими положительно заряженные ионы в узлах кристаллической решетки металла.
Краткий итог темы 1. Существует три типа химических связей между атомами: ковалентная, ионная и металлическая. 2. Химические связи в молекулах, ионных и металлических соединениях имеют электрическую природу. Электромагнитное взаимодействие удерживает систему ядер и электронов в молекулах и ионы в узлах кристаллической решетки. 3. В молекулах длина ковалентной связи есть расстояние между ядрами ковалентно связанных атомов. 4. В ионных соединениях длина связи соответствует расстоянию между центрами ионов. 5. В металлах длина связи соответствует расстоянию между узлами кристаллической решетки, занимаемыми ионами металла. 6. С позиций метода валентных связей (ВС) ковалентная связь между атомами в молекуле осуществляется парой электронов при перекрывании атомных орбиталей. 7. Ионная связь существует между катионами и анионами в ионных кристаллах. 8. Металлическая связь осуществляется подвижными электронами, удерживающими положительно заряженные ионы в узлах кристаллической решетки металла.
 Вопросы для проверки знаний 1. Что подразумевается под молекулой? 2. В чем различие и сходство между ковалентной и ионной связью? 3. В чем различие между и ковалентными связями? 4. Что на ваш взгляд явилось причиной введения представления о гибридизации атомных орбиталей? 5. Какой физический смысл вкладывается в понятия «направленность» и «насыщаемость» ковалентных связей? 6. В чем различие и сходство между ионной и металлической связями? 7. Согласны ли вы с утверждением, что «химическая связь обусловлена электромагнитным взаимодействием заряженных частей микросистемы»? 9. Что подразумевается под структурной и молекулярной формулами? 10. В чем различие и сходство между ковалентной полярной и неполярной связями? 11. Можно ли назвать ионное соединение LiF молекулой? 12. Какая связь называется ковалентной? Какая связь называется ионной? 13. Какая связь называется металлической?
Вопросы для проверки знаний 1. Что подразумевается под молекулой? 2. В чем различие и сходство между ковалентной и ионной связью? 3. В чем различие между и ковалентными связями? 4. Что на ваш взгляд явилось причиной введения представления о гибридизации атомных орбиталей? 5. Какой физический смысл вкладывается в понятия «направленность» и «насыщаемость» ковалентных связей? 6. В чем различие и сходство между ионной и металлической связями? 7. Согласны ли вы с утверждением, что «химическая связь обусловлена электромагнитным взаимодействием заряженных частей микросистемы»? 9. Что подразумевается под структурной и молекулярной формулами? 10. В чем различие и сходство между ковалентной полярной и неполярной связями? 11. Можно ли назвать ионное соединение LiF молекулой? 12. Какая связь называется ковалентной? Какая связь называется ионной? 13. Какая связь называется металлической?
 ЛЕКЦИЯ 3 ВЕЩЕСТВА
ЛЕКЦИЯ 3 ВЕЩЕСТВА
 МИР МАКРОСИСТЕМ Макросистема представляет собой твердое, жидкое или газообразное тело, состоящее из взаимосвязанных атомов, молекул или ионов. Капля воды или гидросфера – это макросистемы. Так 18 г воды занимают небольшую часть стакана. Мы видим 18 г жидкости (макросистема), но мы не видим микрочастиц (молекулы воды) в этом объеме. Все химические превращения, происходящие в макросистемах, – это превращения атомов, молекул или ионов, из которых состоят макросистемы.
МИР МАКРОСИСТЕМ Макросистема представляет собой твердое, жидкое или газообразное тело, состоящее из взаимосвязанных атомов, молекул или ионов. Капля воды или гидросфера – это макросистемы. Так 18 г воды занимают небольшую часть стакана. Мы видим 18 г жидкости (макросистема), но мы не видим микрочастиц (молекулы воды) в этом объеме. Все химические превращения, происходящие в макросистемах, – это превращения атомов, молекул или ионов, из которых состоят макросистемы.
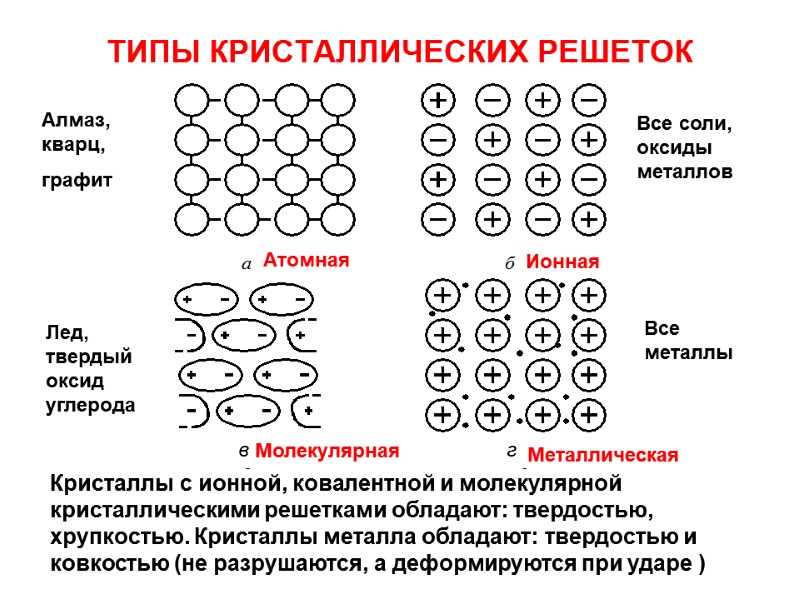
 ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Кристаллы с ионной, ковалентной и молекулярной кристаллическими решетками обладают: твердостью, хрупкостью. Кристаллы металла обладают: твердостью и ковкостью (не разрушаются, а деформируются при ударе ) в г Алмаз, кварц, графит Лед, твердый оксид углерода Все соли, оксиды металлов Все металлы Атомная Ионная Молекулярная Металлическая
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Кристаллы с ионной, ковалентной и молекулярной кристаллическими решетками обладают: твердостью, хрупкостью. Кристаллы металла обладают: твердостью и ковкостью (не разрушаются, а деформируются при ударе ) в г Алмаз, кварц, графит Лед, твердый оксид углерода Все соли, оксиды металлов Все металлы Атомная Ионная Молекулярная Металлическая
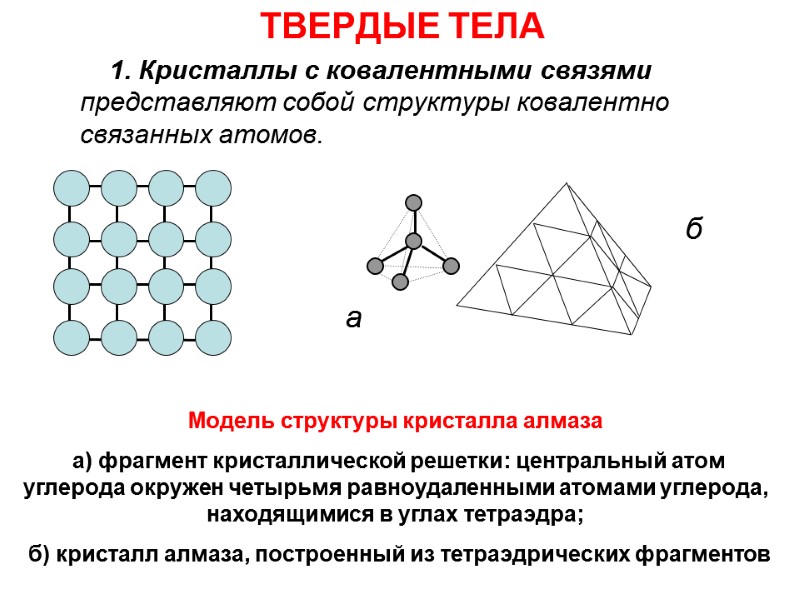
 ТВЕРДЫЕ ТЕЛА 1. Кристаллы с ковалентными связями представляют собой структуры ковалентно связанных атомов. б а Модель структуры кристалла алмаза а) фрагмент кристаллической решетки: центральный атом углерода окружен четырьмя равноудаленными атомами углерода, находящимися в углах тетраэдра; б) кристалл алмаза, построенный из тетраэдрических фрагментов
ТВЕРДЫЕ ТЕЛА 1. Кристаллы с ковалентными связями представляют собой структуры ковалентно связанных атомов. б а Модель структуры кристалла алмаза а) фрагмент кристаллической решетки: центральный атом углерода окружен четырьмя равноудаленными атомами углерода, находящимися в углах тетраэдра; б) кристалл алмаза, построенный из тетраэдрических фрагментов
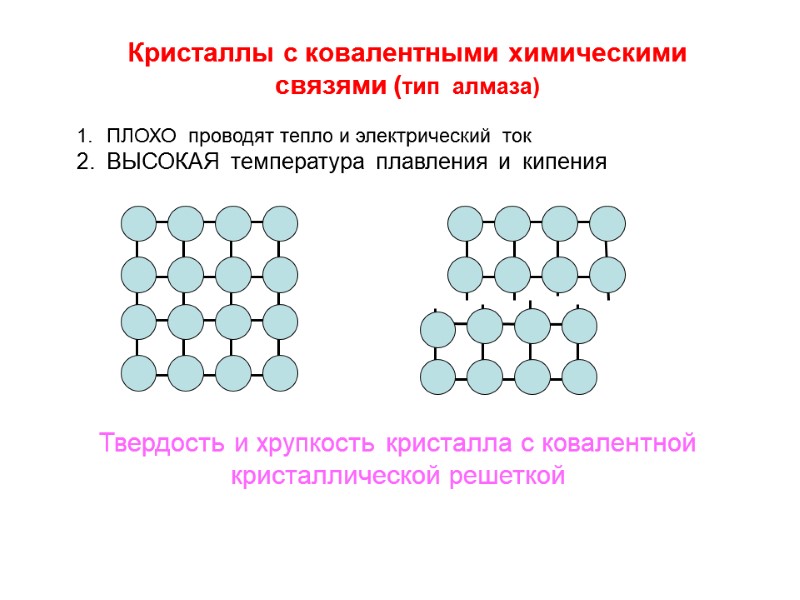
 Кристаллы с ковалентными химическими связями (тип алмаза) Твердость и хрупкость кристалла с ковалентной кристаллической решеткой ПЛОХО проводят тепло и электрический ток ВЫСОКАЯ температура плавления и кипения
Кристаллы с ковалентными химическими связями (тип алмаза) Твердость и хрупкость кристалла с ковалентной кристаллической решеткой ПЛОХО проводят тепло и электрический ток ВЫСОКАЯ температура плавления и кипения
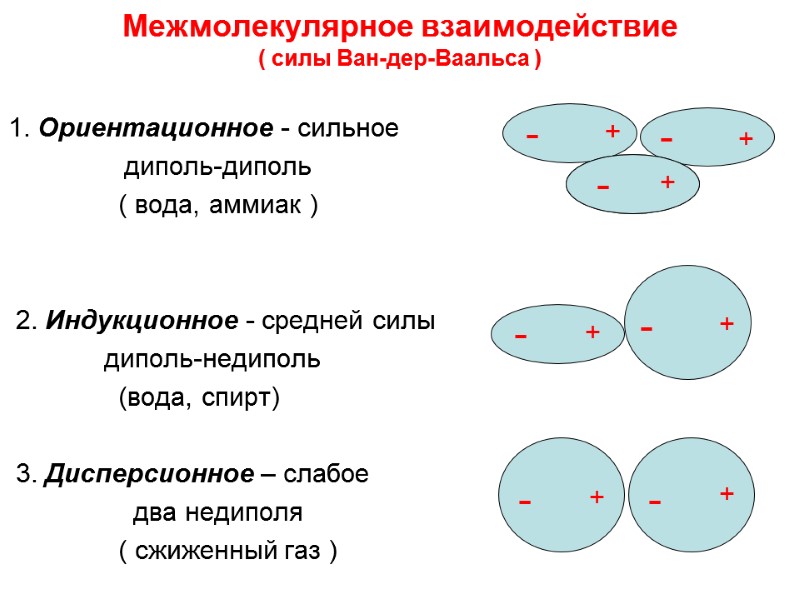
 Межмолекулярное взаимодействие ( силы Ван-дер-Ваальса ) 1. Ориентационное - сильное диполь-диполь ( вода, аммиак ) 2. Индукционное - средней силы диполь-недиполь (вода, спирт) 3. Дисперсионное – слабое два недиполя ( сжиженный газ ) + + - - + + - - + + + + - - + + - - -
Межмолекулярное взаимодействие ( силы Ван-дер-Ваальса ) 1. Ориентационное - сильное диполь-диполь ( вода, аммиак ) 2. Индукционное - средней силы диполь-недиполь (вода, спирт) 3. Дисперсионное – слабое два недиполя ( сжиженный газ ) + + - - + + - - + + + + - - + + - - -
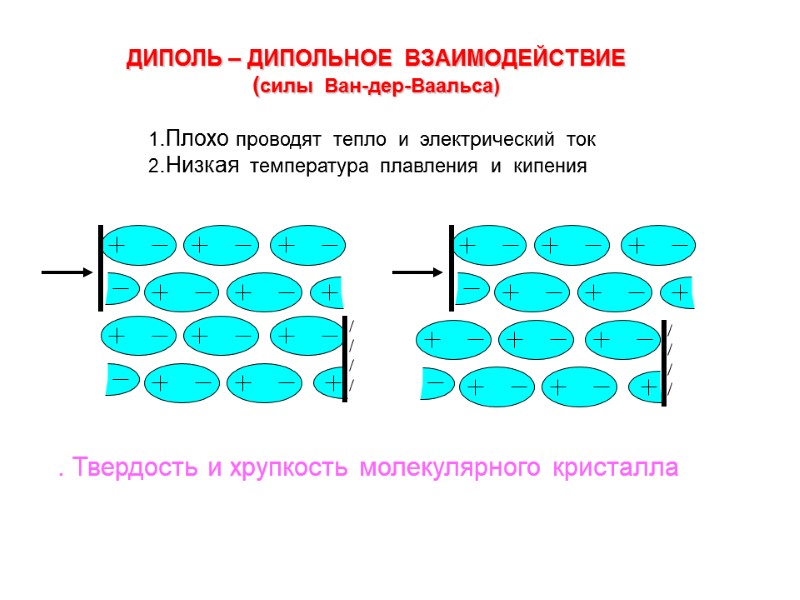
 . Твердость и хрупкость молекулярного кристалла ДИПОЛЬ – ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ (силы Ван-дер-Ваальса) 1.Плохо проводят тепло и электрический ток 2.Низкая температура плавления и кипения
. Твердость и хрупкость молекулярного кристалла ДИПОЛЬ – ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ (силы Ван-дер-Ваальса) 1.Плохо проводят тепло и электрический ток 2.Низкая температура плавления и кипения
 Фрагмент кристалла льда Молекулярные кристаллы льда имеют плотность меньше, чем плотность жидкой воды, поэтому при замерзании воды объем льда увеличивается. Например, 200 литровая бочка, заполненная водой не выдерживает давления льда, объем которого составляет 218 литров и бочка разрывается по шву или выдавливается дно.
Фрагмент кристалла льда Молекулярные кристаллы льда имеют плотность меньше, чем плотность жидкой воды, поэтому при замерзании воды объем льда увеличивается. Например, 200 литровая бочка, заполненная водой не выдерживает давления льда, объем которого составляет 218 литров и бочка разрывается по шву или выдавливается дно.
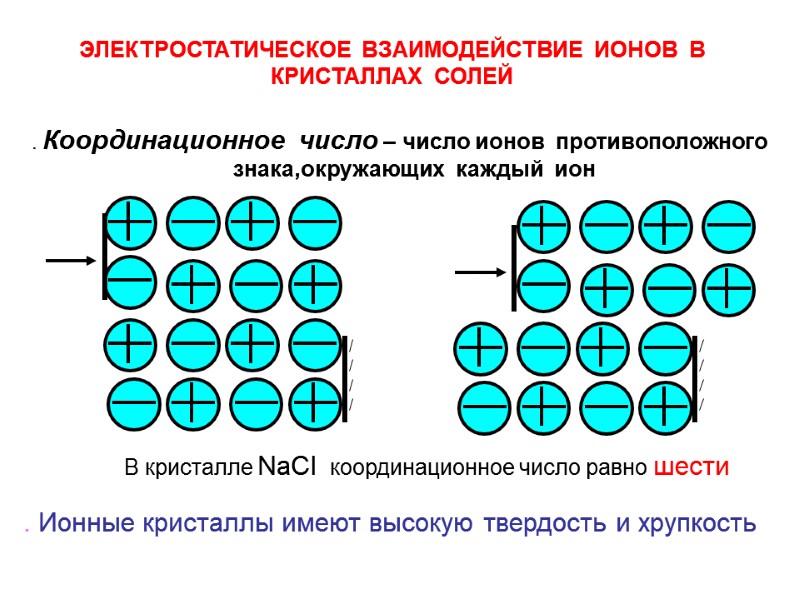
 . Ионные кристаллы имеют высокую твердость и хрупкость ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ИОНОВ В КРИСТАЛЛАХ СОЛЕЙ . Координационное число – число ионов противоположного знака,окружающих каждый ион В кристалле NaCI координационное число равно шести
. Ионные кристаллы имеют высокую твердость и хрупкость ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ИОНОВ В КРИСТАЛЛАХ СОЛЕЙ . Координационное число – число ионов противоположного знака,окружающих каждый ион В кристалле NaCI координационное число равно шести
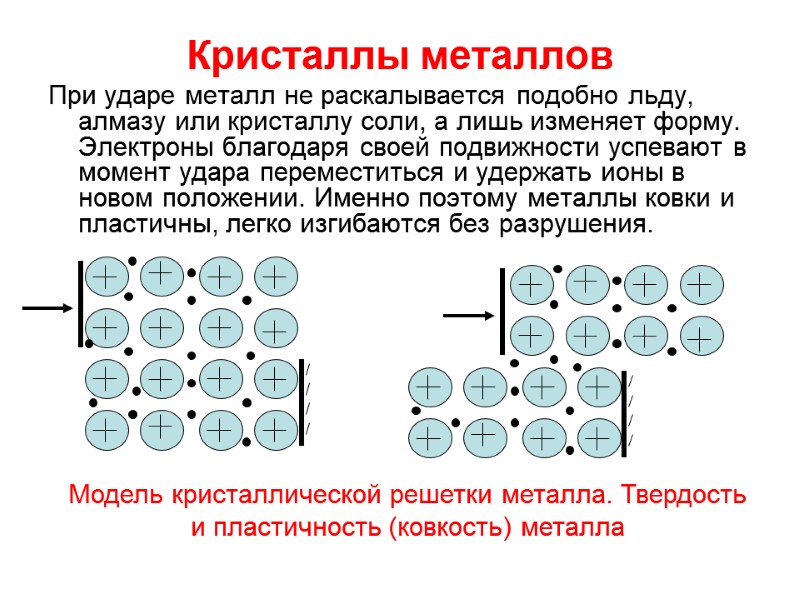
 Кристаллы металлов При ударе металл не раскалывается подобно льду, алмазу или кристаллу соли, а лишь изменяет форму. Электроны благодаря своей подвижности успевают в момент удара переместиться и удержать ионы в новом положении. Именно поэтому металлы ковки и пластичны, легко изгибаются без разрушения. Модель кристаллической решетки металла. Твердость и пластичность (ковкость) металла
Кристаллы металлов При ударе металл не раскалывается подобно льду, алмазу или кристаллу соли, а лишь изменяет форму. Электроны благодаря своей подвижности успевают в момент удара переместиться и удержать ионы в новом положении. Именно поэтому металлы ковки и пластичны, легко изгибаются без разрушения. Модель кристаллической решетки металла. Твердость и пластичность (ковкость) металла
 ЖИДКОСТИ Степень раздробленности жидкостей молекулярная (например, вода), ионная (например, расплав NaCl), атомарная (например, жидкий аргон, Ar). В жидкостях происходит хаотическое (беспорядочное) перемещением атомов, молекул, ионов. В жидкостях силы электромагнитного взаимодействия (притяжения и отталкивания) удерживают микрочастицы на близких расстояниях, поэтому жидкости имеют высокую плотность и малую сжимаемость. Жидкости текут, заполняют сосуд, принимая его форму.
ЖИДКОСТИ Степень раздробленности жидкостей молекулярная (например, вода), ионная (например, расплав NaCl), атомарная (например, жидкий аргон, Ar). В жидкостях происходит хаотическое (беспорядочное) перемещением атомов, молекул, ионов. В жидкостях силы электромагнитного взаимодействия (притяжения и отталкивания) удерживают микрочастицы на близких расстояниях, поэтому жидкости имеют высокую плотность и малую сжимаемость. Жидкости текут, заполняют сосуд, принимая его форму.
 ГАЗЫ В газах расстояниями между частицами очень большое. Так 1 моль жидкой воды занимает объем 18,7 см. куб., а 1 моль насыщенного водяного пара при этой же температуре занимает объем 30000 см. куб. Хаотическое движение частиц позволяет молекулам газа занимать весь предоставленный им объем. Состояние идеального газа подчиняется уравнению РV = nRT где р - давление, V – объем, n [моль ] – количество вещества, R = 8.314 [Дж/моль К] – газовая постоянная, Т [K] - температура Идеальный газ – это предельное состояние реального газа при бесконечно малом давлении. Такие газы, как азот, кислород, гелий, аргон, по своим свойствам приближаются к идеальным газам Менделеева - Клапейрона
ГАЗЫ В газах расстояниями между частицами очень большое. Так 1 моль жидкой воды занимает объем 18,7 см. куб., а 1 моль насыщенного водяного пара при этой же температуре занимает объем 30000 см. куб. Хаотическое движение частиц позволяет молекулам газа занимать весь предоставленный им объем. Состояние идеального газа подчиняется уравнению РV = nRT где р - давление, V – объем, n [моль ] – количество вещества, R = 8.314 [Дж/моль К] – газовая постоянная, Т [K] - температура Идеальный газ – это предельное состояние реального газа при бесконечно малом давлении. Такие газы, как азот, кислород, гелий, аргон, по своим свойствам приближаются к идеальным газам Менделеева - Клапейрона
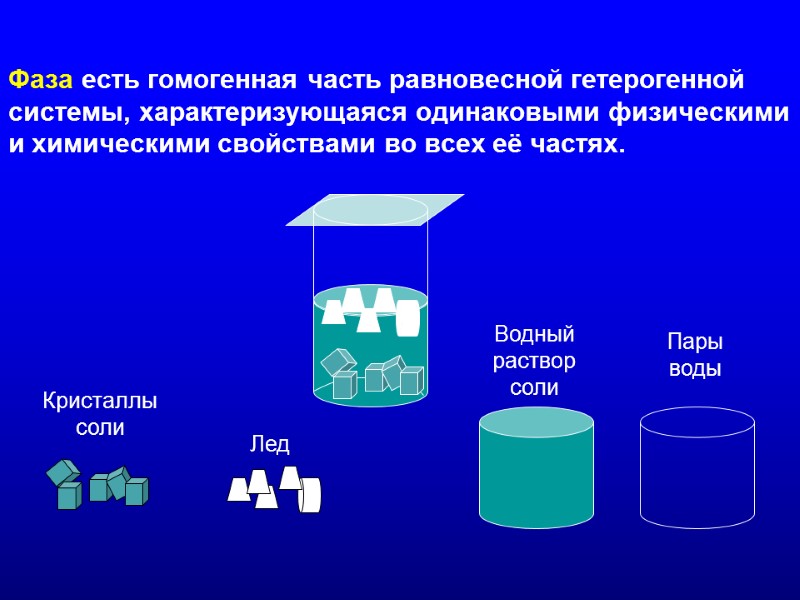
 ФАЗОВЫЕ ПРЕВРАЩЕНИЯ ВЕЩЕСТВА 1) Компонент – вещество, входящее в состав данной системы, которое может быть выделено и существовать независимо от данной системы. Число веществ-компонентов обозначим К. 2) Фаза есть гомогенная часть равновесной гетерогенной системы, характеризующаяся одинаковыми физическими и химическими свойствами во всех её частях. Число фаз системы обозначим . 3) Число степеней свободы есть число переменных величин, которые можно изменять без изменения числа фаз системы. Число степеней свободы обозначим f. 4) Переменные величины в гетерогенной системе: давление р, температура Т , а также К и . 5) Правило фаз утверждает: f = К - + 2, где цифра 2 учитывает давление и температуру как переменные величины
ФАЗОВЫЕ ПРЕВРАЩЕНИЯ ВЕЩЕСТВА 1) Компонент – вещество, входящее в состав данной системы, которое может быть выделено и существовать независимо от данной системы. Число веществ-компонентов обозначим К. 2) Фаза есть гомогенная часть равновесной гетерогенной системы, характеризующаяся одинаковыми физическими и химическими свойствами во всех её частях. Число фаз системы обозначим . 3) Число степеней свободы есть число переменных величин, которые можно изменять без изменения числа фаз системы. Число степеней свободы обозначим f. 4) Переменные величины в гетерогенной системе: давление р, температура Т , а также К и . 5) Правило фаз утверждает: f = К - + 2, где цифра 2 учитывает давление и температуру как переменные величины
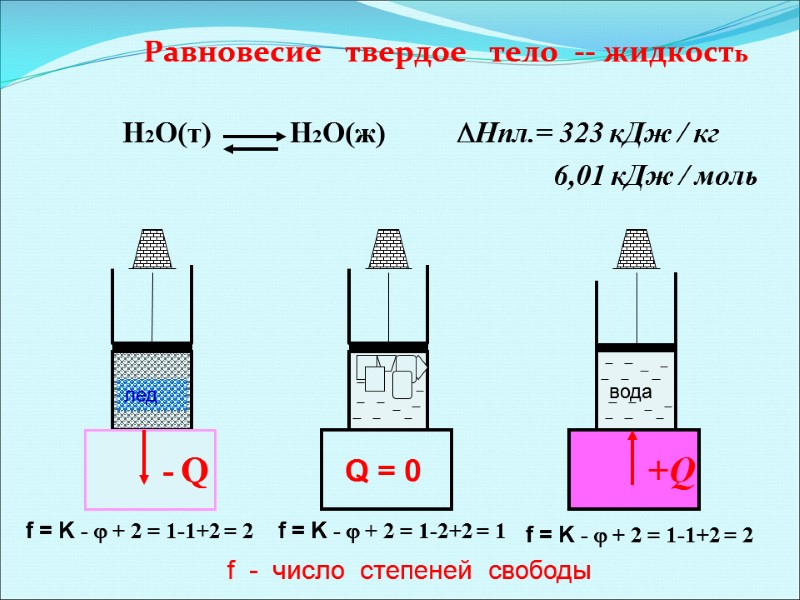
 Равновесие твердое тело -- жидкость Н2О(т) Н2О(ж) Нпл.= 323 кДж / кг 6,01 кДж / моль +Q - Q f = K - + 2 = 1-1+2 = 2 f = K - + 2 = 1-2+2 = 1 f = K - + 2 = 1-1+2 = 2 вода лед Q = 0 f - число степеней свободы
Равновесие твердое тело -- жидкость Н2О(т) Н2О(ж) Нпл.= 323 кДж / кг 6,01 кДж / моль +Q - Q f = K - + 2 = 1-1+2 = 2 f = K - + 2 = 1-2+2 = 1 f = K - + 2 = 1-1+2 = 2 вода лед Q = 0 f - число степеней свободы
 Давление водяного пара Пар, находящийся в равновесии со своей жидкостью или льдом,называют насыщенным. Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.
Давление водяного пара Пар, находящийся в равновесии со своей жидкостью или льдом,называют насыщенным. Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.
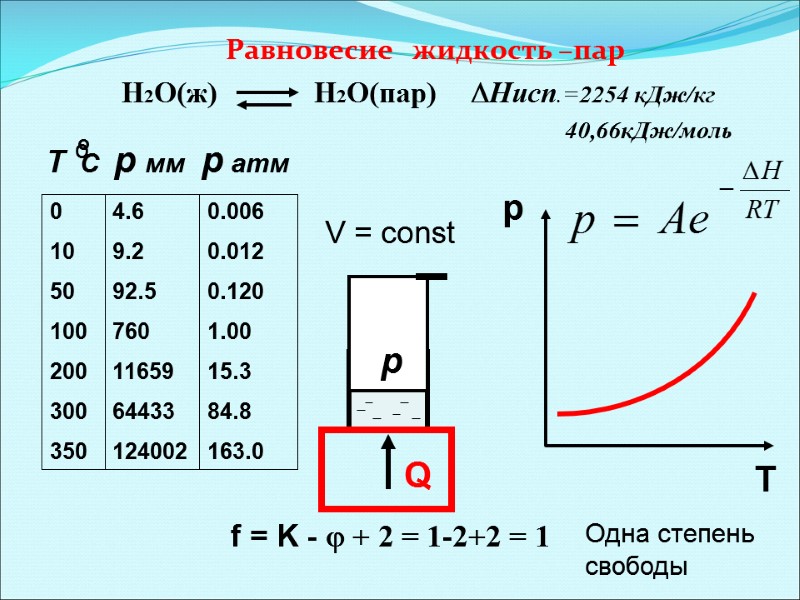
 Равновесие жидкость –пар Н2О(ж) Н2О(пар) Нисп.=2254 кДж/кг 40,66кДж/моль f = K - + 2 = 1-2+2 = 1 V = const p Q Т С р мм р атм 0 10 50 100 200 300 350 4.6 9.2 92.5 760 11659 64433 124002 0.006 0.012 0.120 1.00 15.3 84.8 163.0 p Т Одна степень свободы o о
Равновесие жидкость –пар Н2О(ж) Н2О(пар) Нисп.=2254 кДж/кг 40,66кДж/моль f = K - + 2 = 1-2+2 = 1 V = const p Q Т С р мм р атм 0 10 50 100 200 300 350 4.6 9.2 92.5 760 11659 64433 124002 0.006 0.012 0.120 1.00 15.3 84.8 163.0 p Т Одна степень свободы o о
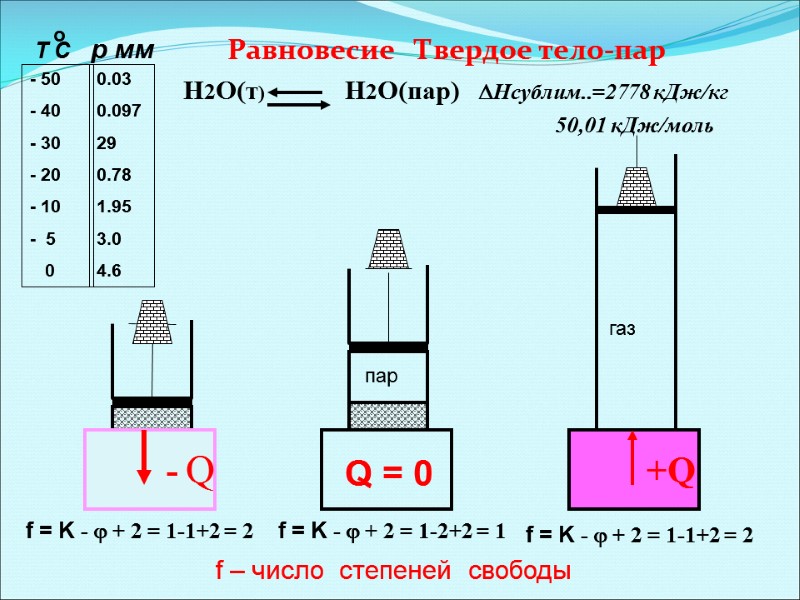
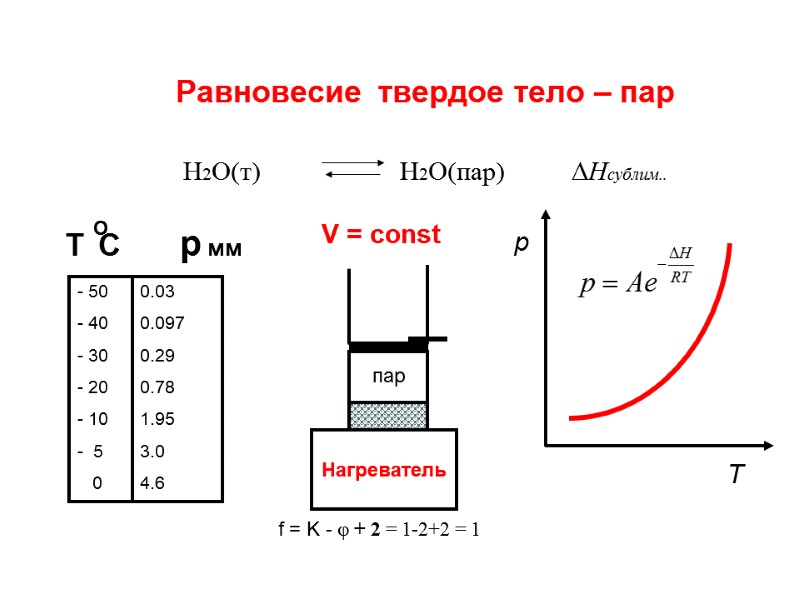
 Равновесие Твердое тело-пар Н2О(т) Н2О(пар) Нсублим..=2778 кДж/кг 50,01 кДж/моль +Q - Q f = K - + 2 = 1-1+2 = 2 f = K - + 2 = 1-2+2 = 1 f = K - + 2 = 1-1+2 = 2 Т С р мм - 50 - 40 - 30 - 20 - 10 - 5 0 0.03 0.097 29 0.78 1.95 3.0 4.6 газ пар f – число степеней свободы Q = 0 о
Равновесие Твердое тело-пар Н2О(т) Н2О(пар) Нсублим..=2778 кДж/кг 50,01 кДж/моль +Q - Q f = K - + 2 = 1-1+2 = 2 f = K - + 2 = 1-2+2 = 1 f = K - + 2 = 1-1+2 = 2 Т С р мм - 50 - 40 - 30 - 20 - 10 - 5 0 0.03 0.097 29 0.78 1.95 3.0 4.6 газ пар f – число степеней свободы Q = 0 о
 Равновесие твердое тело – пар Н2О(т) Н2О(пар) Нсублим.. Нагреватель f = K - + 2 = 1-2+2 = 1 Т С р мм - 50 - 40 - 30 - 20 - 10 - 5 0 0.03 0.097 0.29 0.78 1.95 3.0 4.6 V = const p Т пар О
Равновесие твердое тело – пар Н2О(т) Н2О(пар) Нсублим.. Нагреватель f = K - + 2 = 1-2+2 = 1 Т С р мм - 50 - 40 - 30 - 20 - 10 - 5 0 0.03 0.097 0.29 0.78 1.95 3.0 4.6 V = const p Т пар О
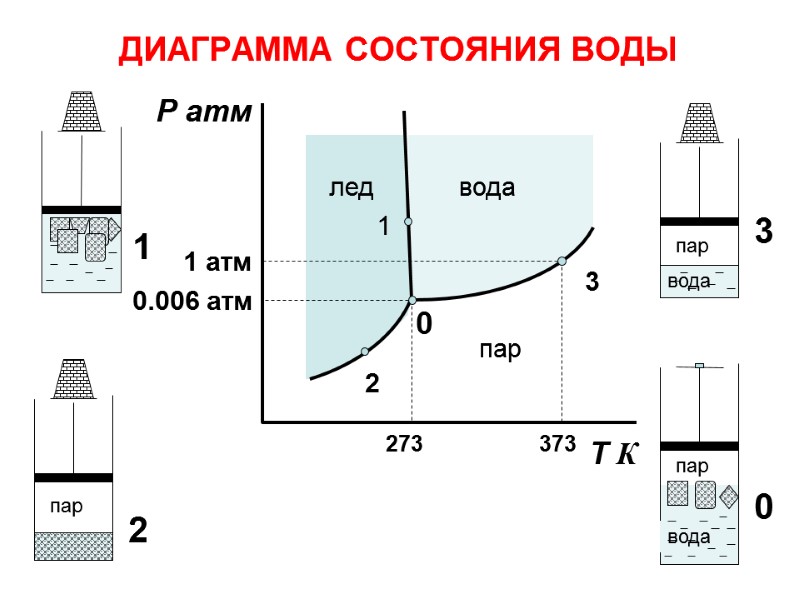
 ДИАГРАММА СОСТОЯНИЯ ВОДЫ лед пар вода Р атм Т К пар вода пар пар вода 1 1 2 2 3 3 0 0 273 373 1 атм 0.006 атм
ДИАГРАММА СОСТОЯНИЯ ВОДЫ лед пар вода Р атм Т К пар вода пар пар вода 1 1 2 2 3 3 0 0 273 373 1 атм 0.006 атм
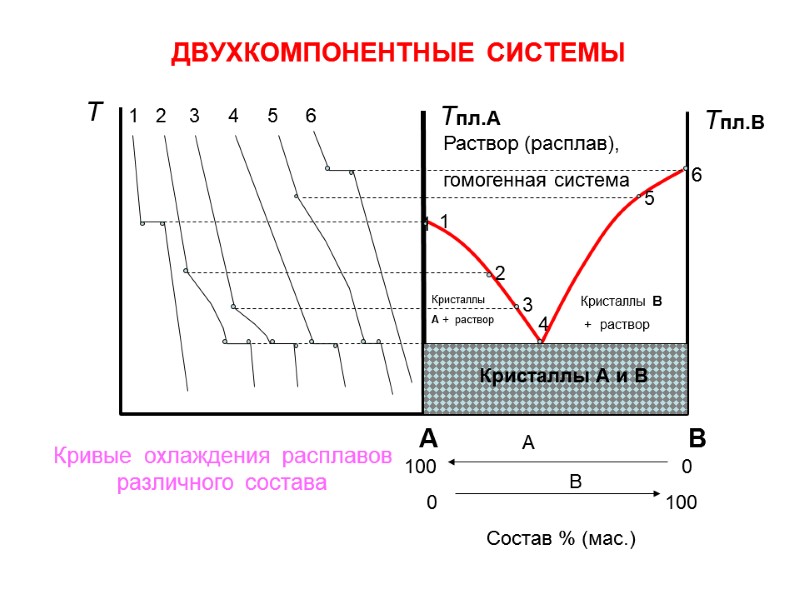
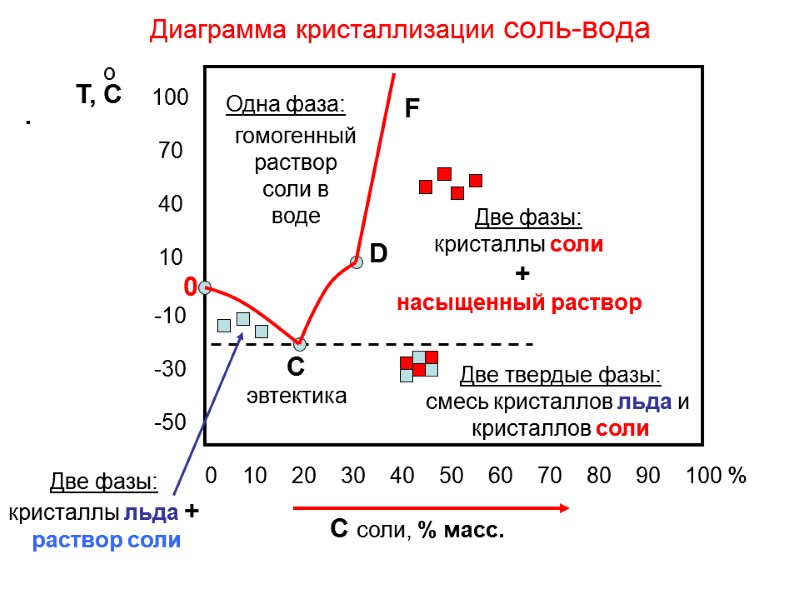
 ДВУХКОМПОНЕНТНЫЕ СИСТЕМЫ 1 Т Тпл.А Тпл.В 1 2 3 4 5 6 2 3 4 5 6 Раствор (расплав), гомогенная система А В 100 0 0 100 Состав % (мас.) Кристаллы А и В Кристаллы А + раствор Кристаллы В + раствор А В Кривые охлаждения расплавов различного состава 1
ДВУХКОМПОНЕНТНЫЕ СИСТЕМЫ 1 Т Тпл.А Тпл.В 1 2 3 4 5 6 2 3 4 5 6 Раствор (расплав), гомогенная система А В 100 0 0 100 Состав % (мас.) Кристаллы А и В Кристаллы А + раствор Кристаллы В + раствор А В Кривые охлаждения расплавов различного состава 1
 ТЕМПЕРАТУРА ПЛАВЛЕНИЯ СМЕСИ ЛЬДА И СОЛИ (эвтектика) (33 г NaCl + 100 г Н2О) Тпл. = - 21.2 С о (125 г СаCl2 6Н2О + 100 г Н2О) Тпл. = - 40.3 С о (143 г СаCl2 6Н2О + 100 г Н2О) Тпл. = - 55.0 С Снег и лед на городских дорогах и тротуарах посыпают смесью соли с песком. При температуре воздуха -15 – - 20 С, лед и снег плавятся. Образуется жидкая соленая масса исключающая скольжение. НЕДОСТАТКИ Электрохимическая коррозия автомобилей Гибель деревьев Обувь покрывается солью о о
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ СМЕСИ ЛЬДА И СОЛИ (эвтектика) (33 г NaCl + 100 г Н2О) Тпл. = - 21.2 С о (125 г СаCl2 6Н2О + 100 г Н2О) Тпл. = - 40.3 С о (143 г СаCl2 6Н2О + 100 г Н2О) Тпл. = - 55.0 С Снег и лед на городских дорогах и тротуарах посыпают смесью соли с песком. При температуре воздуха -15 – - 20 С, лед и снег плавятся. Образуется жидкая соленая масса исключающая скольжение. НЕДОСТАТКИ Электрохимическая коррозия автомобилей Гибель деревьев Обувь покрывается солью о о
 Химическая термодинамика Лекция 4
Химическая термодинамика Лекция 4
 ХИМИЧЕСКИЕ РЕАКЦИИ Любая химическая реакция – это «молекулярная катастрофа», она сопровождается изменением химического состава и энергетического состояния соединений, участвующих в процессе Химические реакции используются для получения ВЕЩЕСТВА И ЭНЕРГИИ Из нефти на нефтеперегонных заводах получают: Бензин Авиационный керосин Дизельное топливо Моторные масла Мазут Гудрон Битум Электроэнергию и горячую воду получают при сжигании на электростанциях и в котельных : Каменного угля Мазута Природного газа При движении автомобили сжигают: бензин, дизельное топл. В полете самолеты сжигают авиационный керосин Например Например
ХИМИЧЕСКИЕ РЕАКЦИИ Любая химическая реакция – это «молекулярная катастрофа», она сопровождается изменением химического состава и энергетического состояния соединений, участвующих в процессе Химические реакции используются для получения ВЕЩЕСТВА И ЭНЕРГИИ Из нефти на нефтеперегонных заводах получают: Бензин Авиационный керосин Дизельное топливо Моторные масла Мазут Гудрон Битум Электроэнергию и горячую воду получают при сжигании на электростанциях и в котельных : Каменного угля Мазута Природного газа При движении автомобили сжигают: бензин, дизельное топл. В полете самолеты сжигают авиационный керосин Например Например
 В химии рассматривают неподвижные системы (сосуды, реакторы с химическими соединениями). Изменение энергетического состояния таких систем определяется изменением их внутренней энергии ΔU Внутренняя энергия U есть сумма кинетической Е(кин.) и потенциальной Е(пот.) энергии всех микрочастиц системы: U = Е(кин.) + Е(пот.) Кинетическая энергия – это энергия поступательного, вращательного, колебательного, деформационного и др. видов движения микрочастиц. Потенциальная энергия – это энергия межмолекулярного и внутримолекулярного взаимодействия (притяжения и отталкивания) микрочастиц, составляющих систему. ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ ( U –кДж )
В химии рассматривают неподвижные системы (сосуды, реакторы с химическими соединениями). Изменение энергетического состояния таких систем определяется изменением их внутренней энергии ΔU Внутренняя энергия U есть сумма кинетической Е(кин.) и потенциальной Е(пот.) энергии всех микрочастиц системы: U = Е(кин.) + Е(пот.) Кинетическая энергия – это энергия поступательного, вращательного, колебательного, деформационного и др. видов движения микрочастиц. Потенциальная энергия – это энергия межмолекулярного и внутримолекулярного взаимодействия (притяжения и отталкивания) микрочастиц, составляющих систему. ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ ( U –кДж )
 ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА Важным свойством идеального газа является независимость его внутренней энергии от изменения объема и давления: и Внутренняя энергия идеального газа является функцией только температуры: Если система в начальном состоянии обладала внутренней энергией и перешла в конечное состояние то изменение внутренней энергии будет определяться разностью:
ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА Важным свойством идеального газа является независимость его внутренней энергии от изменения объема и давления: и Внутренняя энергия идеального газа является функцией только температуры: Если система в начальном состоянии обладала внутренней энергией и перешла в конечное состояние то изменение внутренней энергии будет определяться разностью:
 ОПРЕДЕЛЕНИЕ И ХАРАКТЕРИСТИКА ТЕПЛОТЫ (Q) Теплота Q – есть форма обмена энергией между телами посредством соударения микрочастиц, составляющих тела. Теплота Q [Дж] имеет ту же размерность, что и внутренняя энергия U [Дж], но теплота есть характеристика процесса. Нет соударения микрочастиц между телами, нет процесса передачи кинетической энергии (движения), тогда Q = 0. Внутренняя энергия U есть характеристика состояния системы. Любое тело, любая макросистема обладает внутренней энергией: микрочастицы тела движутся, притягиваются и отталкиваются
ОПРЕДЕЛЕНИЕ И ХАРАКТЕРИСТИКА ТЕПЛОТЫ (Q) Теплота Q – есть форма обмена энергией между телами посредством соударения микрочастиц, составляющих тела. Теплота Q [Дж] имеет ту же размерность, что и внутренняя энергия U [Дж], но теплота есть характеристика процесса. Нет соударения микрочастиц между телами, нет процесса передачи кинетической энергии (движения), тогда Q = 0. Внутренняя энергия U есть характеристика состояния системы. Любое тело, любая макросистема обладает внутренней энергией: микрочастицы тела движутся, притягиваются и отталкиваются
 ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ Для системы (тела), состоящей из громадного числа микрочастиц (атомов, молекул, ионов) разной массы и совершающих разнообразные движения, температура системы определяется энергией движения микрочастиц, например, поступательного, вращательного, колебательного, деформационного движения. Температура системы Т определяется средней кинетической энергией микрочастиц, составляющих систему. Для одноатомного газа температура определяется энергией поступательного движения : Е КИН. = 3kT/2 k-постоянная Больцмана 1,38× 10 Дж/К -23
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ Для системы (тела), состоящей из громадного числа микрочастиц (атомов, молекул, ионов) разной массы и совершающих разнообразные движения, температура системы определяется энергией движения микрочастиц, например, поступательного, вращательного, колебательного, деформационного движения. Температура системы Т определяется средней кинетической энергией микрочастиц, составляющих систему. Для одноатомного газа температура определяется энергией поступательного движения : Е КИН. = 3kT/2 k-постоянная Больцмана 1,38× 10 Дж/К -23
 ТЕПЛОЕМКОСТЬ (С) Средняя теплоемкость – это количество энергии в форме теплоты, затраченное на нагревание одного моля или одного грамма вещества на 1 К: [Дж/моль К ] или [Дж/г К] Энергия в форме теплоты, которая необходима для нагревания количества вещества (n моль) или массы вещества (m г), вычисляется по уравнениям:
ТЕПЛОЕМКОСТЬ (С) Средняя теплоемкость – это количество энергии в форме теплоты, затраченное на нагревание одного моля или одного грамма вещества на 1 К: [Дж/моль К ] или [Дж/г К] Энергия в форме теплоты, которая необходима для нагревания количества вещества (n моль) или массы вещества (m г), вычисляется по уравнениям:
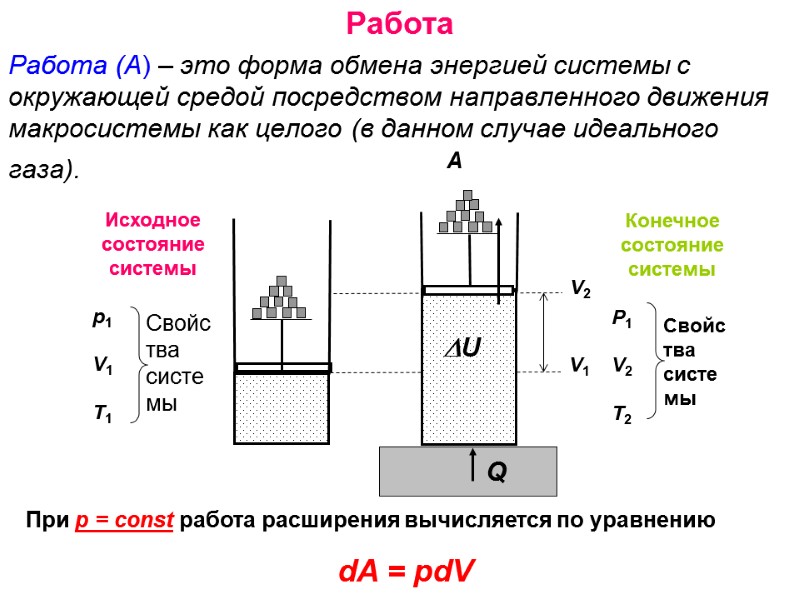
 Работа Работа (А) – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого (в данном случае идеального газа). При р = const работа расширения вычисляется по уравнению dA = pdV
Работа Работа (А) – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого (в данном случае идеального газа). При р = const работа расширения вычисляется по уравнению dA = pdV
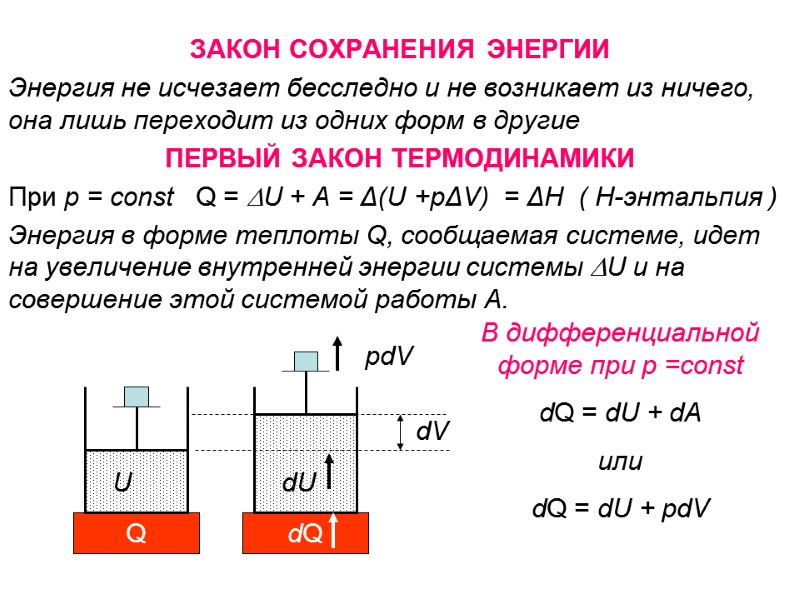
 ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ Энергия не исчезает бесследно и не возникает из ничего, она лишь переходит из одних форм в другие ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ При р = const Q = U + A = Δ(U +pΔV) = ΔН ( Н-энтальпия ) Энергия в форме теплоты Q, сообщаемая системе, идет на увеличение внутренней энергии системы U и на совершение этой системой работы A. Q U dQ dU dV pdV В дифференциальной форме при р =const dQ = dU + dA или dQ = dU + pdV
ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ Энергия не исчезает бесследно и не возникает из ничего, она лишь переходит из одних форм в другие ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ При р = const Q = U + A = Δ(U +pΔV) = ΔН ( Н-энтальпия ) Энергия в форме теплоты Q, сообщаемая системе, идет на увеличение внутренней энергии системы U и на совершение этой системой работы A. Q U dQ dU dV pdV В дифференциальной форме при р =const dQ = dU + dA или dQ = dU + pdV
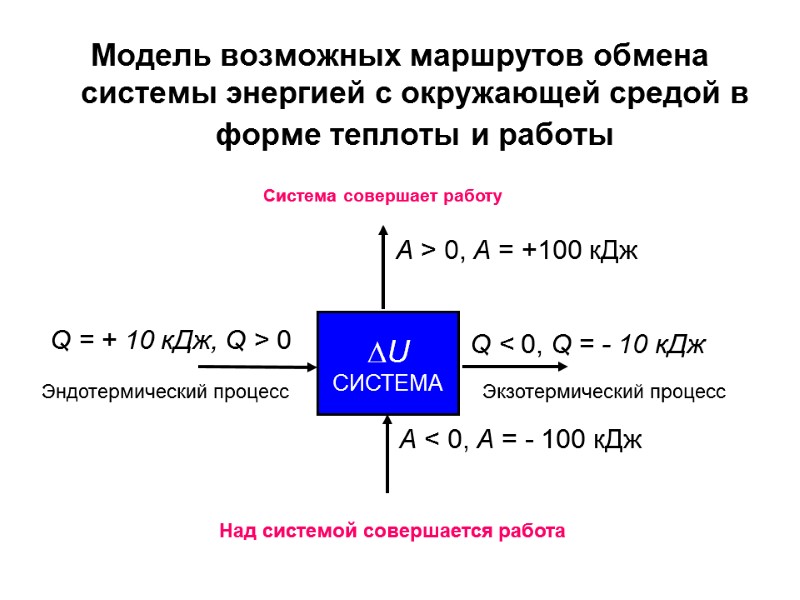
 Модель возможных маршрутов обмена системы энергией с окружающей средой в форме теплоты и работы А < 0, А = - 100 кДж Q < 0, Q = - 10 кДж Q = + 10 кДж, Q > 0 U СИСТЕМА А > 0, А = +100 кДж Эндотермический процесс Экзотермический процесс Система совершает работу Над системой совершается работа
Модель возможных маршрутов обмена системы энергией с окружающей средой в форме теплоты и работы А < 0, А = - 100 кДж Q < 0, Q = - 10 кДж Q = + 10 кДж, Q > 0 U СИСТЕМА А > 0, А = +100 кДж Эндотермический процесс Экзотермический процесс Система совершает работу Над системой совершается работа
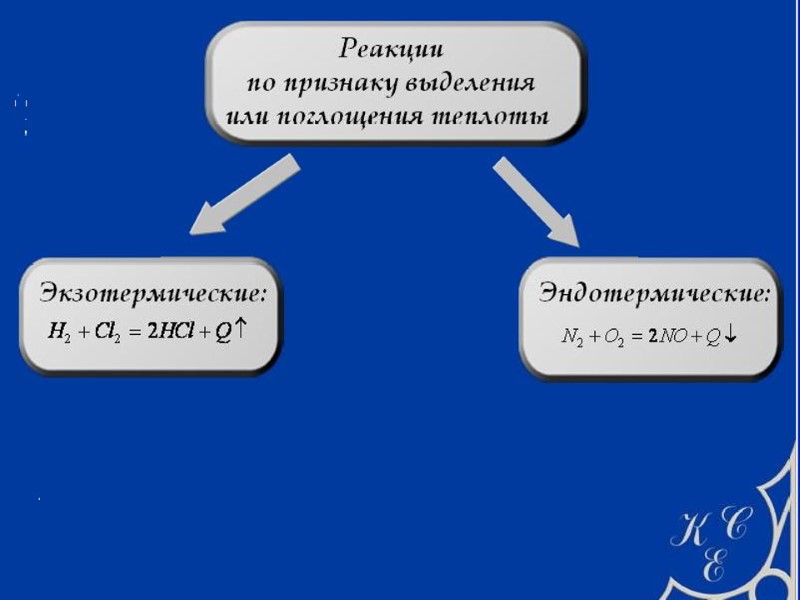
 ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ ПРОЦЕССЫ Теплота (Q) берется со знаком плюс, например, (Q) = + 100 кДж, если система получает энергию из окружающей среды. Такой процесс называется эндотермическим [ др.-греч. внутри, тепло]. Теплота (Q) берется со знаком минус, например, (Q) = 100 кДж, если система отдает энергию в окружающую среду. Такой процесс называется экзотермическим [др.-греч. снаружи, вне, тепло]. Работа (А) считается положительной, если совершается системой. Например, автомобиль (система) везет пассажиров. Работа (А) считается отрицательной, если совершается над системой. Например, пассажиры толкают машину, у которой заглох двигатель.
ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ ПРОЦЕССЫ Теплота (Q) берется со знаком плюс, например, (Q) = + 100 кДж, если система получает энергию из окружающей среды. Такой процесс называется эндотермическим [ др.-греч. внутри, тепло]. Теплота (Q) берется со знаком минус, например, (Q) = 100 кДж, если система отдает энергию в окружающую среду. Такой процесс называется экзотермическим [др.-греч. снаружи, вне, тепло]. Работа (А) считается положительной, если совершается системой. Например, автомобиль (система) везет пассажиров. Работа (А) считается отрицательной, если совершается над системой. Например, пассажиры толкают машину, у которой заглох двигатель.
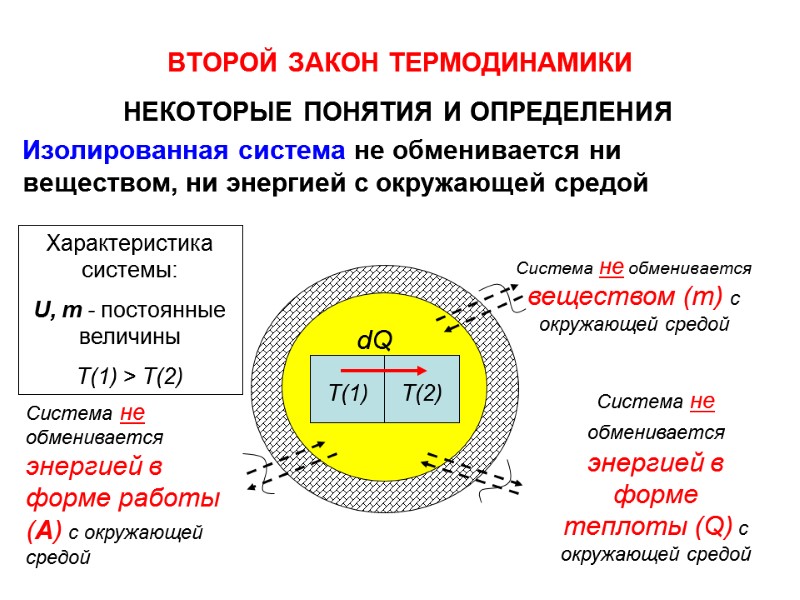
 ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Изолированная система не обменивается ни веществом, ни энергией с окружающей средой Т(1) Т(2) dQ Система не обменивается энергией в форме теплоты (Q) с окружающей средой Система не обменивается энергией в форме работы (А) с окружающей средой Система не обменивается веществом (m) с окружающей средой Характеристика системы: U, m - постоянные величины Т(1) > Т(2)
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Изолированная система не обменивается ни веществом, ни энергией с окружающей средой Т(1) Т(2) dQ Система не обменивается энергией в форме теплоты (Q) с окружающей средой Система не обменивается энергией в форме работы (А) с окружающей средой Система не обменивается веществом (m) с окружающей средой Характеристика системы: U, m - постоянные величины Т(1) > Т(2)
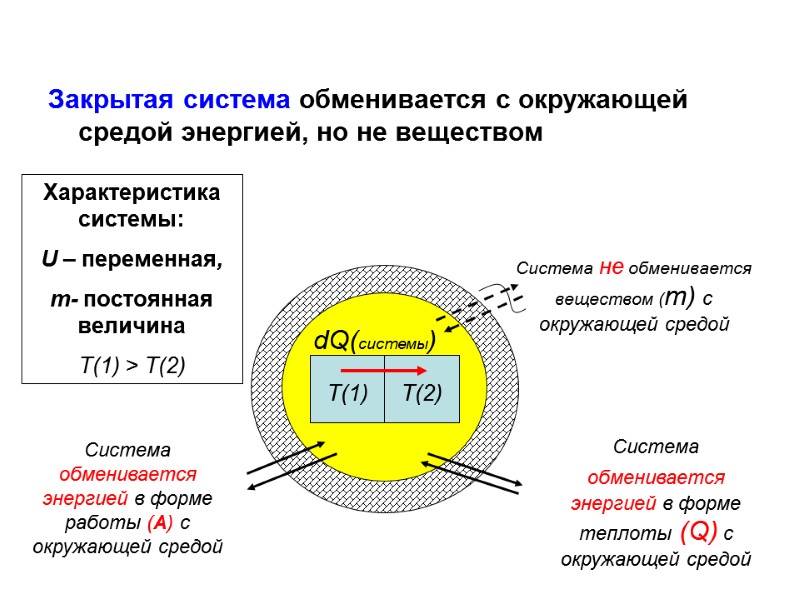
 Закрытая система обменивается с окружающей средой энергией, но не веществом Т(1) Т(2) dQ(системы) Характеристика системы: U – переменная, m- постоянная величина Т(1) > Т(2) Система не обменивается веществом (m) с окружающей средой Система обменивается энергией в форме работы (А) с окружающей средой Система обменивается энергией в форме теплоты (Q) с окружающей средой
Закрытая система обменивается с окружающей средой энергией, но не веществом Т(1) Т(2) dQ(системы) Характеристика системы: U – переменная, m- постоянная величина Т(1) > Т(2) Система не обменивается веществом (m) с окружающей средой Система обменивается энергией в форме работы (А) с окружающей средой Система обменивается энергией в форме теплоты (Q) с окружающей средой
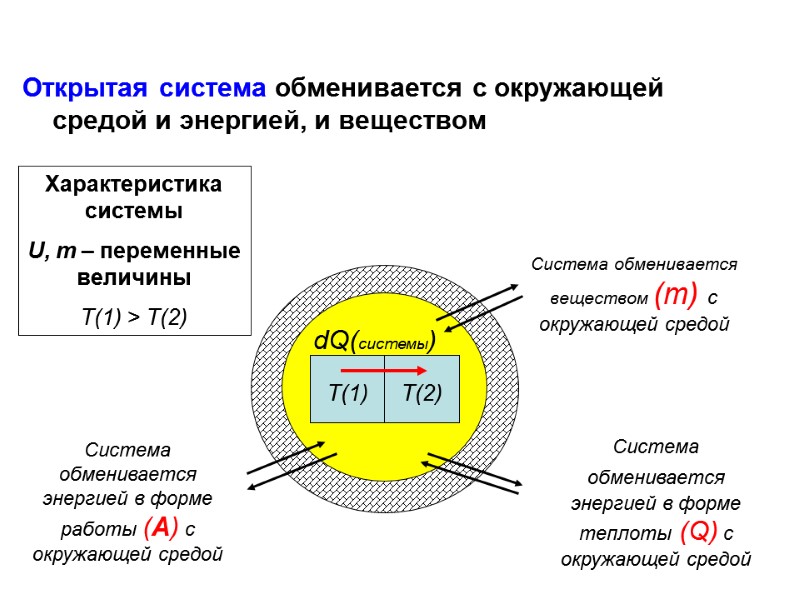
 Открытая система обменивается с окружающей средой и энергией, и веществом Т(1) Т(2) dQ(системы) Характеристика системы U, m – переменные величины Т(1) > Т(2) Система обменивается веществом (m) с окружающей средой Система обменивается энергией в форме работы (А) с окружающей средой Система обменивается энергией в форме теплоты (Q) с окружающей средой
Открытая система обменивается с окружающей средой и энергией, и веществом Т(1) Т(2) dQ(системы) Характеристика системы U, m – переменные величины Т(1) > Т(2) Система обменивается веществом (m) с окружающей средой Система обменивается энергией в форме работы (А) с окружающей средой Система обменивается энергией в форме теплоты (Q) с окружающей средой
 ОСНОВНАЯ ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ Невозможен циклический процесс, имеющий единственным результатом превращение теплоты в работу ПРИМЕР Поршни в двигателе автомобиля должны совершать циклически повторяющиеся движения, чтобы заставить вращаться коленчатый вал. При этом в атмосферу выбрасываются горячие выхлопные газы. Следовательно, часть энергии, выделяющаяся при сжигании топлива, расходуется не на движение автомобиля, а на нагревание окружающей среды. И эта энергия не может быть превращена в работу
ОСНОВНАЯ ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ Невозможен циклический процесс, имеющий единственным результатом превращение теплоты в работу ПРИМЕР Поршни в двигателе автомобиля должны совершать циклически повторяющиеся движения, чтобы заставить вращаться коленчатый вал. При этом в атмосферу выбрасываются горячие выхлопные газы. Следовательно, часть энергии, выделяющаяся при сжигании топлива, расходуется не на движение автомобиля, а на нагревание окружающей среды. И эта энергия не может быть превращена в работу
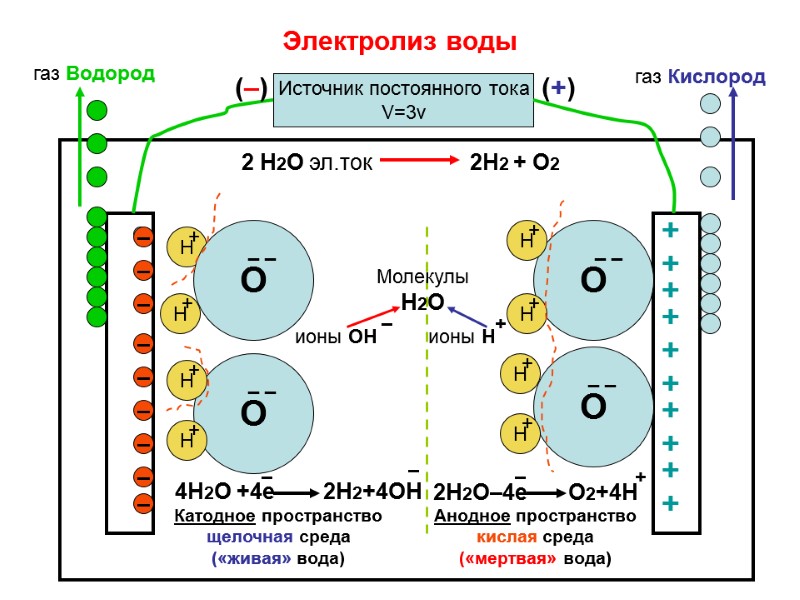
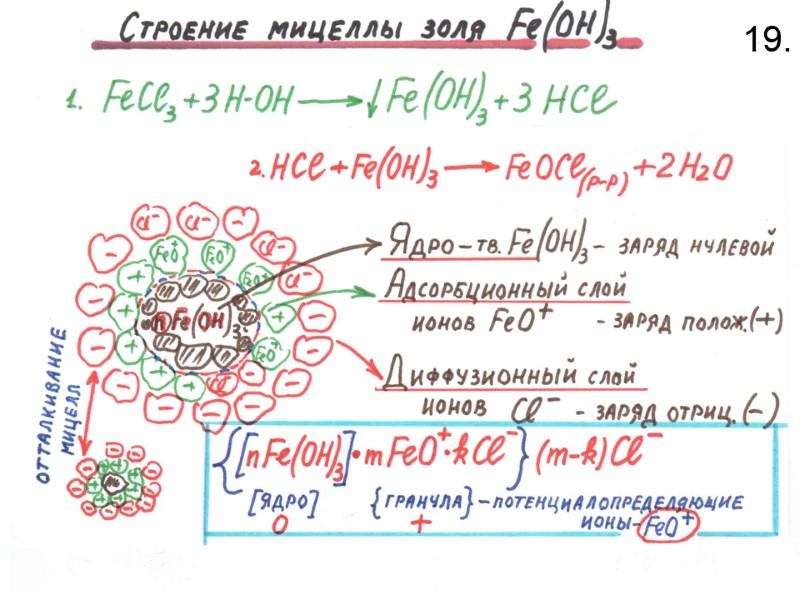
![>ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ] >ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ]](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_94.jpg) ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ] S – есть мера рассеяния энергии системой и степени беспорядка в системе: S(т) < S(ж) < S(г) Изменение энтропии связано с теплотой и температурой системы соотношением ΔS=ΔН/Т dS Q/T ГАЗ Жидкость Лед
ЭНТРОПИЯ Существует свойство системы - энтропия S -[ Дж/моль×К ] S – есть мера рассеяния энергии системой и степени беспорядка в системе: S(т) < S(ж) < S(г) Изменение энтропии связано с теплотой и температурой системы соотношением ΔS=ΔН/Т dS Q/T ГАЗ Жидкость Лед
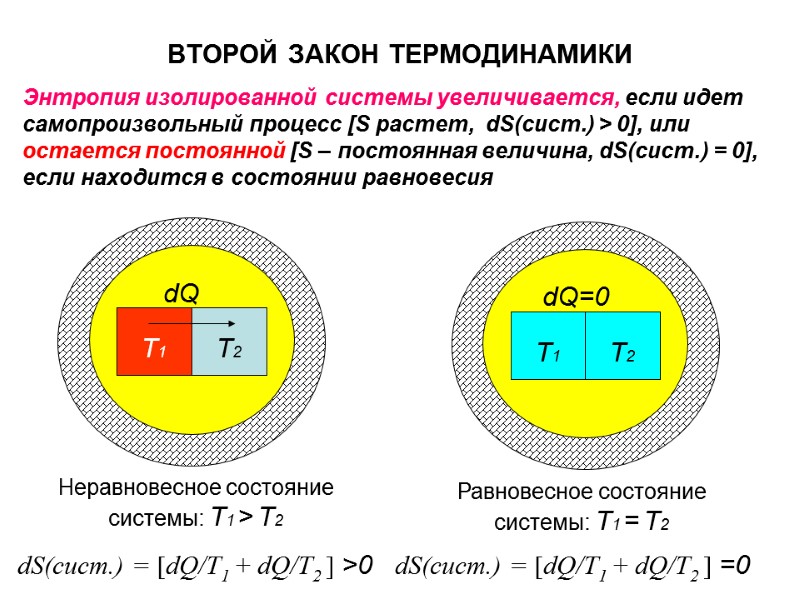
 ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Энтропия изолированной системы увеличивается, если идет самопроизвольный процесс [S растет, dS(сист.) > 0], или остается постоянной [S – постоянная величина, dS(сист.) = 0], если находится в состоянии равновесия Т1 Т2 dQ dS(сист.) = [dQ/T1 + dQ/T2 ] >0 Неравновесное состояние системы: Т1 > Т2 Т1 Т2 dQ=0 Равновесное состояние системы: Т1 = Т2 dS(сист.) = [dQ/T1 + dQ/T2 ] =0
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Энтропия изолированной системы увеличивается, если идет самопроизвольный процесс [S растет, dS(сист.) > 0], или остается постоянной [S – постоянная величина, dS(сист.) = 0], если находится в состоянии равновесия Т1 Т2 dQ dS(сист.) = [dQ/T1 + dQ/T2 ] >0 Неравновесное состояние системы: Т1 > Т2 Т1 Т2 dQ=0 Равновесное состояние системы: Т1 = Т2 dS(сист.) = [dQ/T1 + dQ/T2 ] =0
 Третий закон термодинамики При температуре равной абсолютному нулю ( 0 К = 273 С ) энтропия правильного кристаллического тела равна нулю ST=0 = 0 _ o o
Третий закон термодинамики При температуре равной абсолютному нулю ( 0 К = 273 С ) энтропия правильного кристаллического тела равна нулю ST=0 = 0 _ o o
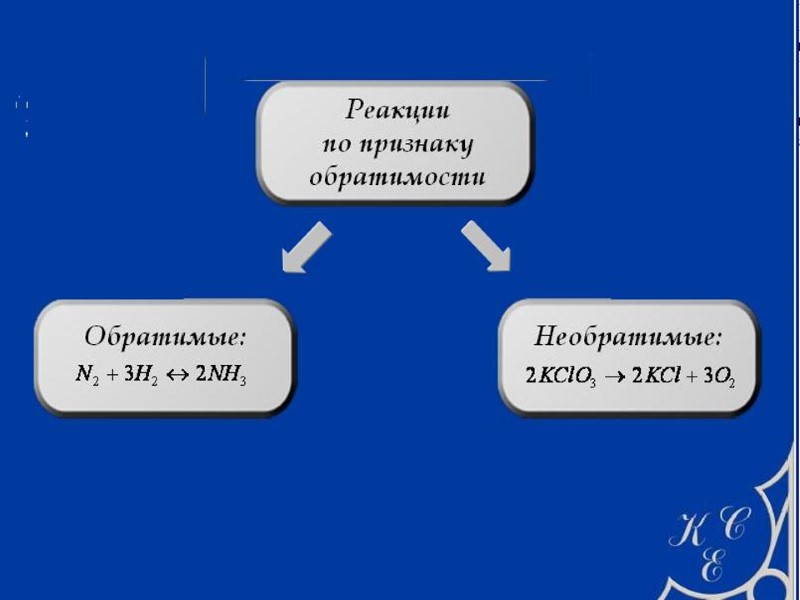
 ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ Реакции между соединениями происходят только потому, что исходные соединения находятся в неустойчивом состоянии и стремятся перейти в устойчивое состояние ПРИМЕРЫ 1. Обратимая химическая реакция Неустойчивое состояние: N2 , 3H2 Устойчивое состояние: N2 + 3H2 2NH3 2. Необратимая химическая реакция Неустойчивое состояние: 2Fe, 3O2 Устойчивое состояние: 2Fe2O3 (2Fe + 3O2 2Fe2O3) – химическая коррозия металла
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ Реакции между соединениями происходят только потому, что исходные соединения находятся в неустойчивом состоянии и стремятся перейти в устойчивое состояние ПРИМЕРЫ 1. Обратимая химическая реакция Неустойчивое состояние: N2 , 3H2 Устойчивое состояние: N2 + 3H2 2NH3 2. Необратимая химическая реакция Неустойчивое состояние: 2Fe, 3O2 Устойчивое состояние: 2Fe2O3 (2Fe + 3O2 2Fe2O3) – химическая коррозия металла
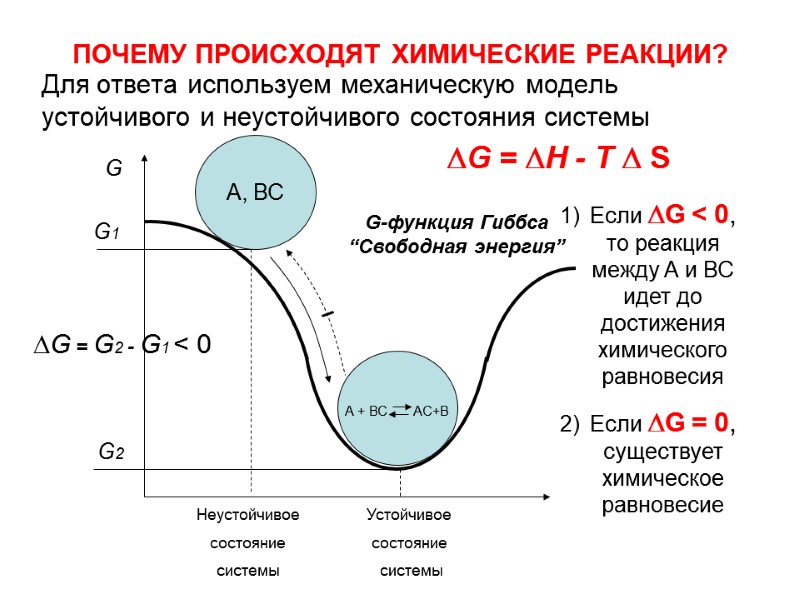
 ПОЧЕМУ ПРОИСХОДЯТ ХИМИЧЕСКИЕ РЕАКЦИИ? Для ответа используем механическую модель устойчивого и неустойчивого состояния системы А + ВС АС+В А, ВС Неустойчивое состояние системы Устойчивое состояние системы G G1 G2 G = H - T S G = G2 - G1 < 0 Если G < 0, то реакция между А и ВС идет до достижения химического равновесия Если G = 0, существует химическое равновесие G-функция Гиббса “Свободная энергия”
ПОЧЕМУ ПРОИСХОДЯТ ХИМИЧЕСКИЕ РЕАКЦИИ? Для ответа используем механическую модель устойчивого и неустойчивого состояния системы А + ВС АС+В А, ВС Неустойчивое состояние системы Устойчивое состояние системы G G1 G2 G = H - T S G = G2 - G1 < 0 Если G < 0, то реакция между А и ВС идет до достижения химического равновесия Если G = 0, существует химическое равновесие G-функция Гиббса “Свободная энергия”
 ХИМИЧЕСКОЕ РАВНОВЕСИЕ Гомогенное равновесие в газе N2(г) + 3H2(г) ⇄ 2NH3(г) Гетерогенное равновесие в системе тверд. тело - газ Гомогенное химическое равновесие в растворе (р-р) ⇄ С(т) + СО2(г) ⇄ 2СО(г)
ХИМИЧЕСКОЕ РАВНОВЕСИЕ Гомогенное равновесие в газе N2(г) + 3H2(г) ⇄ 2NH3(г) Гетерогенное равновесие в системе тверд. тело - газ Гомогенное химическое равновесие в растворе (р-р) ⇄ С(т) + СО2(г) ⇄ 2СО(г)
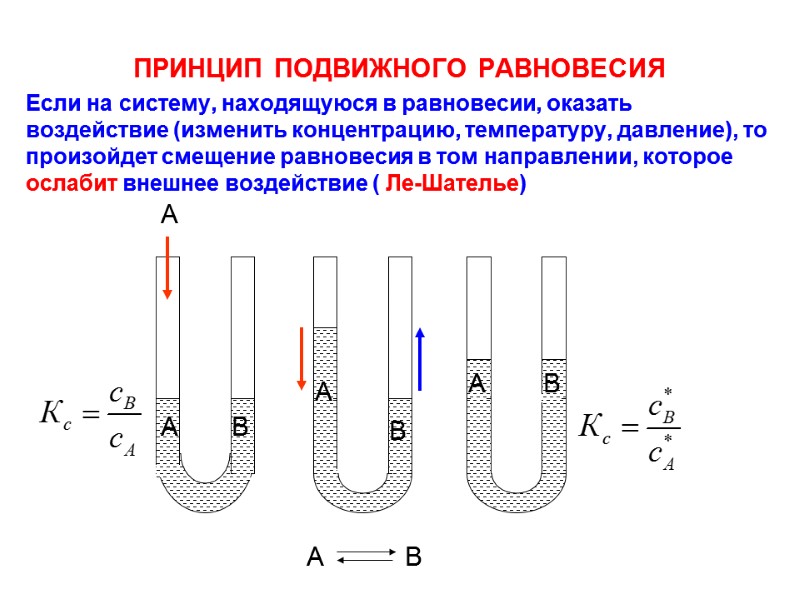
 ПРИНЦИП ПОДВИЖНОГО РАВНОВЕСИЯ Если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в том направлении, которое ослабит внешнее воздействие ( Ле-Шателье) А В А А В А В А В
ПРИНЦИП ПОДВИЖНОГО РАВНОВЕСИЯ Если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в том направлении, которое ослабит внешнее воздействие ( Ле-Шателье) А В А А В А В А В
 ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ При нагревании реакционной смеси равновесие смещается в сторону эндотермического процесса N2(г) + 3H2(г) ⇄ 2NH3(г) ΔН = - 91.9 кДж/моль Константа равновесия уменьшается Константа равновесия увеличивается Константа равновесия зависит от температуры реакционной смеси: Кр = f(T) С(т) + СО2(г) ⇄ 2СО(г) ΔН= + 172.5 кДж/моль
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ При нагревании реакционной смеси равновесие смещается в сторону эндотермического процесса N2(г) + 3H2(г) ⇄ 2NH3(г) ΔН = - 91.9 кДж/моль Константа равновесия уменьшается Константа равновесия увеличивается Константа равновесия зависит от температуры реакционной смеси: Кр = f(T) С(т) + СО2(г) ⇄ 2СО(г) ΔН= + 172.5 кДж/моль
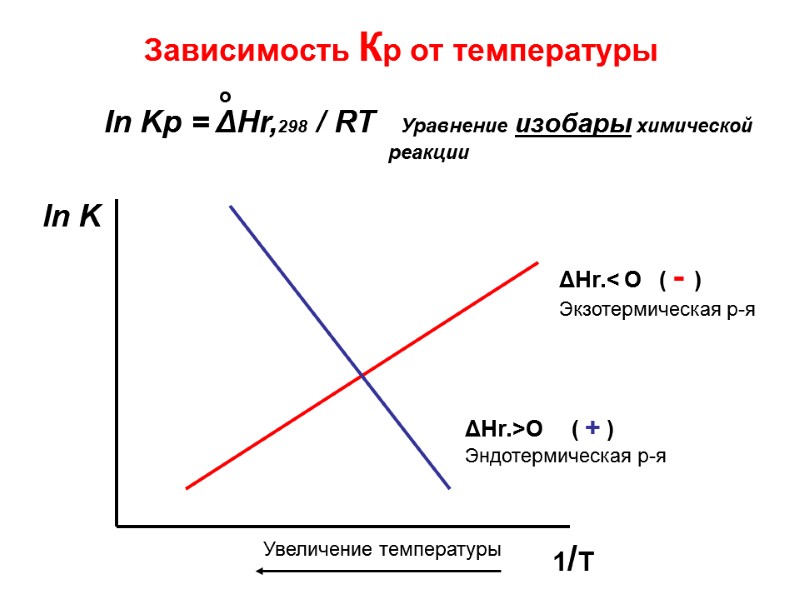
 Зависимость Кр от температуры ln K 1/T ΔHr.< O ( - ) Экзотермическая р-я ΔHr.>O ( + ) Эндотермическая р-я In Kр = ΔНr,298 / RT Уравнение изобары химической реакции Увеличение температуры о
Зависимость Кр от температуры ln K 1/T ΔHr.< O ( - ) Экзотермическая р-я ΔHr.>O ( + ) Эндотермическая р-я In Kр = ΔНr,298 / RT Уравнение изобары химической реакции Увеличение температуры о
 ВЛИЯНИЕ КОНЦЕНТРАЦИИ (ДАВЛЕНИЯ) НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ При увеличении концентрации N2 или H2 равновесие смещается в сторону образования NH3 N2(г) + 3H2(г) ⇄ 2NH3(г) Константа равновесия не изменяется При увеличении концентрации NH3 равновесие смещается в сторону образования N2 и H2 N2(г) + 3H2(г) ⇄ 2NH3(г) Константа равновесия не изменяется
ВЛИЯНИЕ КОНЦЕНТРАЦИИ (ДАВЛЕНИЯ) НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ При увеличении концентрации N2 или H2 равновесие смещается в сторону образования NH3 N2(г) + 3H2(г) ⇄ 2NH3(г) Константа равновесия не изменяется При увеличении концентрации NH3 равновесие смещается в сторону образования N2 и H2 N2(г) + 3H2(г) ⇄ 2NH3(г) Константа равновесия не изменяется
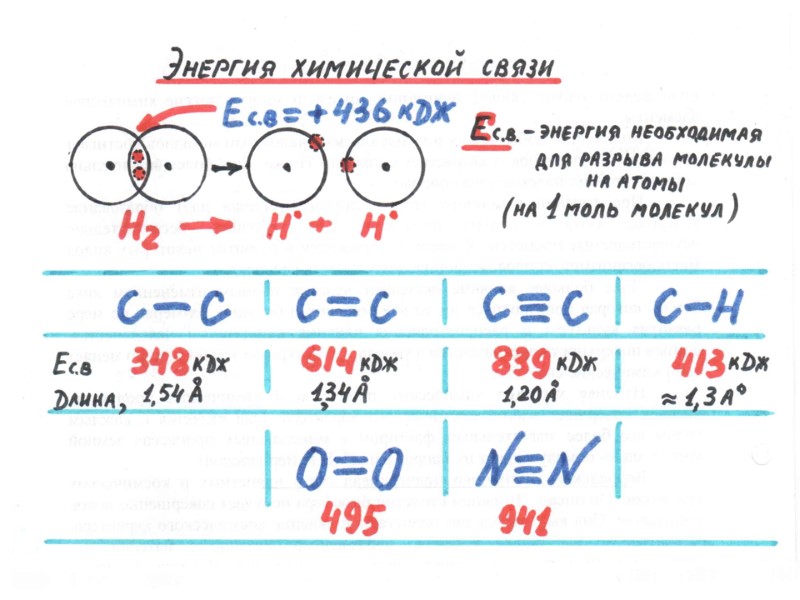
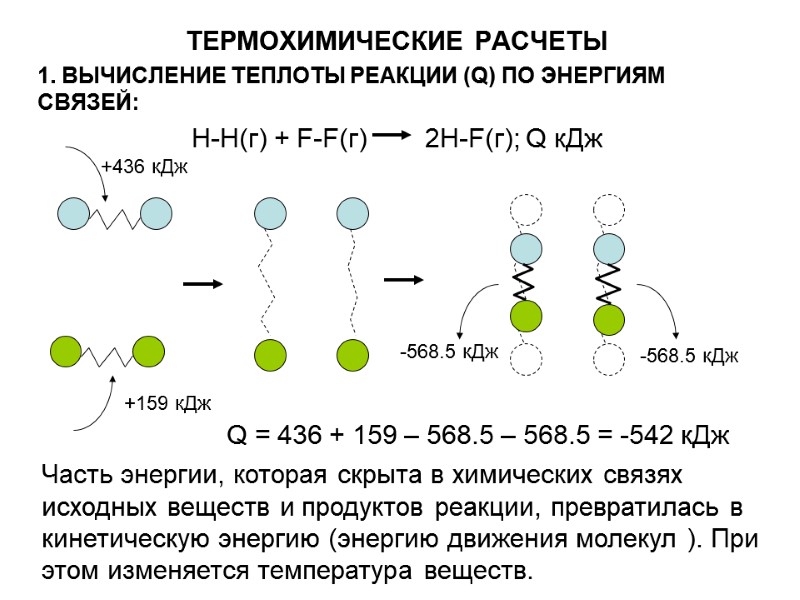
 ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ 1. ВЫЧИСЛЕНИЕ ТЕПЛОТЫ РЕАКЦИИ (Q) ПО ЭНЕРГИЯМ СВЯЗЕЙ: Н-Н(г) + F-F(г) 2H-F(г); Q кДж +436 кДж +159 кДж -568.5 кДж -568.5 кДж Q = 436 + 159 – 568.5 – 568.5 = -542 кДж Часть энергии, которая скрыта в химических связях исходных веществ и продуктов реакции, превратилась в кинетическую энергию (энергию движения молекул ). При этом изменяется температура веществ.
ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ 1. ВЫЧИСЛЕНИЕ ТЕПЛОТЫ РЕАКЦИИ (Q) ПО ЭНЕРГИЯМ СВЯЗЕЙ: Н-Н(г) + F-F(г) 2H-F(г); Q кДж +436 кДж +159 кДж -568.5 кДж -568.5 кДж Q = 436 + 159 – 568.5 – 568.5 = -542 кДж Часть энергии, которая скрыта в химических связях исходных веществ и продуктов реакции, превратилась в кинетическую энергию (энергию движения молекул ). При этом изменяется температура веществ.
 ЭНТАЛЬПИЯ ХИМИЧЕСКОЙ РЕАКЦИИ. ЗАКОН ГЕССА Введем эквивалентный теплоте (Q) параметр - энтальпию процесса (ΔН). При постоянном внешнем давлении (р = 1атм) Q = ΔН кДж/ моль Реакцию горения углерода можно провести в одну стадию: ; ΔН(1)= - 393.5 кДж Реакцию горения углерода можно провести в две стадии: ; ΔН(2)= - 110.5 кДж ; ΔН(3)= - 283.0 кДж Если сложить вторую и третью реакции, то получим реакцию (1): ; ΔН(2) + ΔН(3)= ΔН(1) Энтальпия реакции ΔН, протекающей при р,Т = const, не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы (Закон Гесса) 1. 2. 3.
ЭНТАЛЬПИЯ ХИМИЧЕСКОЙ РЕАКЦИИ. ЗАКОН ГЕССА Введем эквивалентный теплоте (Q) параметр - энтальпию процесса (ΔН). При постоянном внешнем давлении (р = 1атм) Q = ΔН кДж/ моль Реакцию горения углерода можно провести в одну стадию: ; ΔН(1)= - 393.5 кДж Реакцию горения углерода можно провести в две стадии: ; ΔН(2)= - 110.5 кДж ; ΔН(3)= - 283.0 кДж Если сложить вторую и третью реакции, то получим реакцию (1): ; ΔН(2) + ΔН(3)= ΔН(1) Энтальпия реакции ΔН, протекающей при р,Т = const, не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы (Закон Гесса) 1. 2. 3.
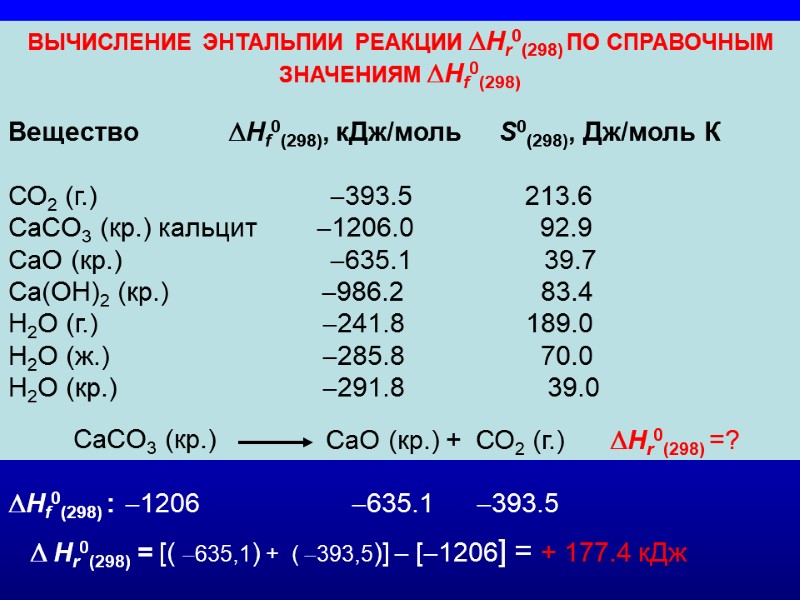
 ВЫЧИСЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ Hr0(298) ПО СПРАВОЧНЫМ ЗНАЧЕНИЯМ Hf0(298) Вещество Hf0(298), кДж/моль S0(298), Дж/моль К СО2 (г.) 393.5 213.6 CaCO3 (кр.) кальцит 1206.0 92.9 CaO (кр.) 635.1 39.7 Са(ОН)2 (кр.) 986.2 83.4 H2O (г.) 241.8 189.0 H2O (ж.) 285.8 70.0 H2O (кр.) 291.8 39.0 CaCO3 (кр.) CaO (кр.) + СО2 (г.) Hr0(298) =? Hf0(298) : 1206 635.1 393.5 Hr0(298) = [( 635,1) + ( 393,5)] [1206] = + 177.4 кДж
ВЫЧИСЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ Hr0(298) ПО СПРАВОЧНЫМ ЗНАЧЕНИЯМ Hf0(298) Вещество Hf0(298), кДж/моль S0(298), Дж/моль К СО2 (г.) 393.5 213.6 CaCO3 (кр.) кальцит 1206.0 92.9 CaO (кр.) 635.1 39.7 Са(ОН)2 (кр.) 986.2 83.4 H2O (г.) 241.8 189.0 H2O (ж.) 285.8 70.0 H2O (кр.) 291.8 39.0 CaCO3 (кр.) CaO (кр.) + СО2 (г.) Hr0(298) =? Hf0(298) : 1206 635.1 393.5 Hr0(298) = [( 635,1) + ( 393,5)] [1206] = + 177.4 кДж
 ТЕРМИНЫ ДЛЯ ЗАПОМИНАНИЯ 1. Абсолютная температура системы Т определяется средней кинетической энергией (энергией движения) микрочастиц. 2. Внутренняя энергия U есть сумма кинетической и потенциальной энергии всех видов микрочастиц, составляющих систему:U = Екин + Епот 3. Второй закон термодинамики: 1) невозможен круговой (циклический) процесс, имеющий своим единственным результатом превращение теплоты в работу; 2) в изолированной системе самопроизвольно идут процессы в сторону рассеяния энергии и увеличения беспорядка: dS = dQ/T 4. Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие в строго эквивалентных количествах.
ТЕРМИНЫ ДЛЯ ЗАПОМИНАНИЯ 1. Абсолютная температура системы Т определяется средней кинетической энергией (энергией движения) микрочастиц. 2. Внутренняя энергия U есть сумма кинетической и потенциальной энергии всех видов микрочастиц, составляющих систему:U = Екин + Епот 3. Второй закон термодинамики: 1) невозможен круговой (циклический) процесс, имеющий своим единственным результатом превращение теплоты в работу; 2) в изолированной системе самопроизвольно идут процессы в сторону рассеяния энергии и увеличения беспорядка: dS = dQ/T 4. Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие в строго эквивалентных количествах.
 5. Основной закон термохимии (закон Гесса): энтальпия реакций, протекающих при p,T = const, не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. 6. Первый закон термодинамики: энергия, полученная системой в форме теплоты, равна алгебраической сумме изменений её внутренней энергии и совершенной ею работы: при р = const Q = U + A или dQ = dU + dA 7. Под кинетической составляющей внутренней энергии подразумевается энергия поступательного, вращательного, колебательного, деформационного и других видов движения микрочастиц системы. 8. Принцип подвижного равновесия: если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в направлении ослабления внешнего воздействия.
5. Основной закон термохимии (закон Гесса): энтальпия реакций, протекающих при p,T = const, не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. 6. Первый закон термодинамики: энергия, полученная системой в форме теплоты, равна алгебраической сумме изменений её внутренней энергии и совершенной ею работы: при р = const Q = U + A или dQ = dU + dA 7. Под кинетической составляющей внутренней энергии подразумевается энергия поступательного, вращательного, колебательного, деформационного и других видов движения микрочастиц системы. 8. Принцип подвижного равновесия: если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в направлении ослабления внешнего воздействия.
 9. Под потенциальной составляющей внутренней энергии подразумевается притяжение и отталкивание микрочастиц, составляющих макросистему (твердое тело, жидкость или газ) 10. Работа А – форма обмена энергией системы с окружающей средой посредством направленного движения микрочастиц, составляющих макросистему. 11. Теплоемкость – количество энергии в форме теплоты, затраченное на нагревание одного моля (молярная)или одного грамма(удельная) вещества на 1 К. 12. Теплота Q есть форма передачи энергии от одного тела другому посредством соударения микрочастиц, составляющих тела.
9. Под потенциальной составляющей внутренней энергии подразумевается притяжение и отталкивание микрочастиц, составляющих макросистему (твердое тело, жидкость или газ) 10. Работа А – форма обмена энергией системы с окружающей средой посредством направленного движения микрочастиц, составляющих макросистему. 11. Теплоемкость – количество энергии в форме теплоты, затраченное на нагревание одного моля (молярная)или одного грамма(удельная) вещества на 1 К. 12. Теплота Q есть форма передачи энергии от одного тела другому посредством соударения микрочастиц, составляющих тела.
 13. Энтальпия образования Hf равна количеству энергии в форме теплоты, выделяющаяся или поглощающаяся при образовании сложного вещества из простых веществ при p = 1атм и температуре Т. 14. Энтальпия реакции Нr равна количеству энергии в форме теплоты, выделяющаяся или поглощающаяся в результате реакции при р = 1 атм и температуре Т. 15. Энтропия S – есть мера рассеяния энергии и беспорядка системы.
13. Энтальпия образования Hf равна количеству энергии в форме теплоты, выделяющаяся или поглощающаяся при образовании сложного вещества из простых веществ при p = 1атм и температуре Т. 14. Энтальпия реакции Нr равна количеству энергии в форме теплоты, выделяющаяся или поглощающаяся в результате реакции при р = 1 атм и температуре Т. 15. Энтропия S – есть мера рассеяния энергии и беспорядка системы.
 ВОПРОСЫ ДЛЯ ПРОВЕРКИ ЗНАНИЙ 1. Приведите примеры экзотермической и эндотермической реакций. 2. В чем различие между энтальпией реакции и энтальпией образования вещества? 3. Что подразумевается под внутренней энергией системы? 4. Объясните, почему и теплота и работа относятся к процессу, а внутренняя энергия к состоянию системы? 5. Что, на ваш взгляд, является причиной самопроизвольного химического процесса и почему? 6. Согласны ли вы с утверждением, что если горячее и холодное тела вступают в контакт, то одинаковыми становятся не только температуры тел, но и внутренние энергии тел? 7. Что подразумевается под температурой тела? 8. Каким образом можно использовать энергии связей для расчета энтальпии химической реакции? 9. Согласны ли вы с утверждением, что передача энергии в форме тепла от холодного тела к горячему не противоречит первому закону термодинамики? 10. Противоречит ли работа домашнего холодильника, в котором морозильная камера отдает энергию (еще больше охлаждаясь) задней горячей стенке, расположенной снаружи, второму закону термодинамики? 11. Согласуется ли со вторым законом термодинамики росте из желудя дерева за счет реакции фотосинтеза и превращения углекислого газа воды и минеральных веществ в упорядоченную структуру (корни, ствол, ветви)?
ВОПРОСЫ ДЛЯ ПРОВЕРКИ ЗНАНИЙ 1. Приведите примеры экзотермической и эндотермической реакций. 2. В чем различие между энтальпией реакции и энтальпией образования вещества? 3. Что подразумевается под внутренней энергией системы? 4. Объясните, почему и теплота и работа относятся к процессу, а внутренняя энергия к состоянию системы? 5. Что, на ваш взгляд, является причиной самопроизвольного химического процесса и почему? 6. Согласны ли вы с утверждением, что если горячее и холодное тела вступают в контакт, то одинаковыми становятся не только температуры тел, но и внутренние энергии тел? 7. Что подразумевается под температурой тела? 8. Каким образом можно использовать энергии связей для расчета энтальпии химической реакции? 9. Согласны ли вы с утверждением, что передача энергии в форме тепла от холодного тела к горячему не противоречит первому закону термодинамики? 10. Противоречит ли работа домашнего холодильника, в котором морозильная камера отдает энергию (еще больше охлаждаясь) задней горячей стенке, расположенной снаружи, второму закону термодинамики? 11. Согласуется ли со вторым законом термодинамики росте из желудя дерева за счет реакции фотосинтеза и превращения углекислого газа воды и минеральных веществ в упорядоченную структуру (корни, ствол, ветви)?
 Упражнения Воспользуйтесь таблицами термодинамических данных и установите: 1. Возможна ли самопроизвольная реакция СаО(кр.) + Н2О(ж) Са(ОН)2(кр.) 2. Возможна ли самопроизвольная реакция Са(ОН)2(кр.) + СО2(г) СаСО3(кр.) + Н2О(ж) 3. Сопровождается ли плавление льда и испарение жидкой воды возрастанием энтропии? 4. Возможно ли самопроизвольное превращение алмаза в графит: С(алмаз) С(графит)?
Упражнения Воспользуйтесь таблицами термодинамических данных и установите: 1. Возможна ли самопроизвольная реакция СаО(кр.) + Н2О(ж) Са(ОН)2(кр.) 2. Возможна ли самопроизвольная реакция Са(ОН)2(кр.) + СО2(г) СаСО3(кр.) + Н2О(ж) 3. Сопровождается ли плавление льда и испарение жидкой воды возрастанием энтропии? 4. Возможно ли самопроизвольное превращение алмаза в графит: С(алмаз) С(графит)?
 Х И М И Ч Е С К А Я К И Н Е Т И К А ЛЕКЦИЯ 5
Х И М И Ч Е С К А Я К И Н Е Т И К А ЛЕКЦИЯ 5
 СКОРОСТЬ И МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Гетерогенная (разнородная) система состоит из двух или большего числа соединений, разделенных поверхностью раздела Гомогенная (однородная) система состоит из соединений, между которыми нет поверхности раздела. Гомогенная система имеет молекулярную, ионную или атомную степень раздробленности входящих в нее соединений. Вода и кристалл соли Водный раствор соли
СКОРОСТЬ И МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Гетерогенная (разнородная) система состоит из двух или большего числа соединений, разделенных поверхностью раздела Гомогенная (однородная) система состоит из соединений, между которыми нет поверхности раздела. Гомогенная система имеет молекулярную, ионную или атомную степень раздробленности входящих в нее соединений. Вода и кристалл соли Водный раствор соли
 Фаза есть гомогенная часть равновесной гетерогенной системы, характеризующаяся одинаковыми физическими и химическими свойствами во всех её частях. Пары воды Водный раствор соли Кристаллы соли Лед
Фаза есть гомогенная часть равновесной гетерогенной системы, характеризующаяся одинаковыми физическими и химическими свойствами во всех её частях. Пары воды Водный раствор соли Кристаллы соли Лед
 Гетерогенная химическая реакция протекает на граничной поверхности раздела фаз: Гомогенная химическая реакция протекает в однофазной системе (в газе или в растворе): О2, СО2 С С(т) + О2(г) СО2(г) СН4(г) + 2О2(г) СО2(г) + 2Н2О(г) NaOH(р-р) + HCl(р-р) NaCl(р-р) + Н2О(р-р) Na + OH + H + Cl Na + Cl + Н2О 4Fe(т) + 3О2(г) 2Fe2О3(т) + + +
Гетерогенная химическая реакция протекает на граничной поверхности раздела фаз: Гомогенная химическая реакция протекает в однофазной системе (в газе или в растворе): О2, СО2 С С(т) + О2(г) СО2(г) СН4(г) + 2О2(г) СО2(г) + 2Н2О(г) NaOH(р-р) + HCl(р-р) NaCl(р-р) + Н2О(р-р) Na + OH + H + Cl Na + Cl + Н2О 4Fe(т) + 3О2(г) 2Fe2О3(т) + + +
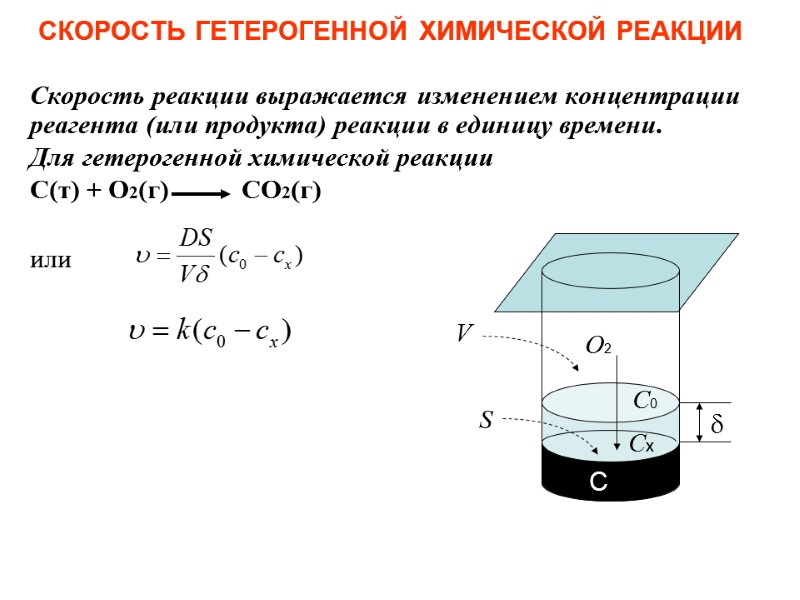
 СКОРОСТЬ ГЕТЕРОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ Скорость реакции выражается изменением концентрации реагента (или продукта) реакции в единицу времени. Для гетерогенной химической реакции С(т) + О2(г) СО2(г) или Сх С0 S С О2 V
СКОРОСТЬ ГЕТЕРОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ Скорость реакции выражается изменением концентрации реагента (или продукта) реакции в единицу времени. Для гетерогенной химической реакции С(т) + О2(г) СО2(г) или Сх С0 S С О2 V
 СКОРОСТЬ ГОМОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ Для гомогенной химической реакции, например, реакции перегруппировки перэфира из формы (А) в форму (С) скорость химической реакции запишется – скорость реакции [моль/лс] СА– концентрация исходного вещества (реагента А) [моль/л] t – время реакции в секундах [с] k – константа скорости реакции А С
СКОРОСТЬ ГОМОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ Для гомогенной химической реакции, например, реакции перегруппировки перэфира из формы (А) в форму (С) скорость химической реакции запишется – скорость реакции [моль/лс] СА– концентрация исходного вещества (реагента А) [моль/л] t – время реакции в секундах [с] k – константа скорости реакции А С
 Реакция первого порядка A продукты реакции -dCA/dt =k×CA разделение переменных –dCA/CA=kdt Интегрирование в пределах от Со до С и от to до t дает k=1/t × ln(co/c) Период полураспада –время уменьшения концентрации в два раза k=1/t(1/2) × ln(co×2/cо) t(1/2) =(ln2)/k =0,693/k
Реакция первого порядка A продукты реакции -dCA/dt =k×CA разделение переменных –dCA/CA=kdt Интегрирование в пределах от Со до С и от to до t дает k=1/t × ln(co/c) Период полураспада –время уменьшения концентрации в два раза k=1/t(1/2) × ln(co×2/cо) t(1/2) =(ln2)/k =0,693/k
 ЗАКОН ДЕЙСТВИЯ МАСС Простая бимолекулярная реакция А + ВС продукты Теория соударений утверждает: скорость простой бимолекулярной реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ. V = kcAcBC
ЗАКОН ДЕЙСТВИЯ МАСС Простая бимолекулярная реакция А + ВС продукты Теория соударений утверждает: скорость простой бимолекулярной реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ. V = kcAcBC
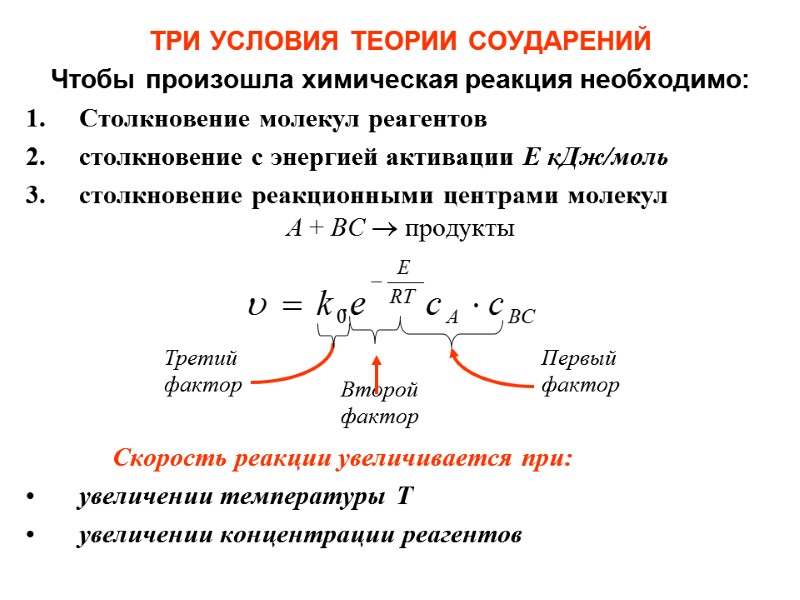
 ТРИ УСЛОВИЯ ТЕОРИИ СОУДАРЕНИЙ Чтобы произошла химическая реакция необходимо: Столкновение молекул реагентов столкновение с энергией активации Е кДж/моль столкновение реакционными центрами молекул А + ВС продукты Скорость реакции увеличивается при: увеличении температуры Т увеличении концентрации реагентов Первый фактор Второйфактор Третий фактор .
ТРИ УСЛОВИЯ ТЕОРИИ СОУДАРЕНИЙ Чтобы произошла химическая реакция необходимо: Столкновение молекул реагентов столкновение с энергией активации Е кДж/моль столкновение реакционными центрами молекул А + ВС продукты Скорость реакции увеличивается при: увеличении температуры Т увеличении концентрации реагентов Первый фактор Второйфактор Третий фактор .
 Пример: сложная реакция: 2Н2(г) + О2(г) = 2Н2О(г) включает в себя простые реакции: Н2 + О2 Н + НОО реакция зарождения цепи: Н + О2 НО + О Н2 + О НО + Н реакции разветвления цепи НО + Н2 Н2О + Н реакция продолжения цепи НО + Н + М Н2О + М* реакция обрыва цепи Простая реакция включает совокупность однотипных элементарных реакций – реакций, идущих в один акт, в одно действие МЕХАНИЗМ ХИМИЧЕСКОЙ РЕАКЦИИ Механизм химической реакции есть совокупность последовательно и параллельно протекающих простых реакций, ведущих к образованию конечных продуктов
Пример: сложная реакция: 2Н2(г) + О2(г) = 2Н2О(г) включает в себя простые реакции: Н2 + О2 Н + НОО реакция зарождения цепи: Н + О2 НО + О Н2 + О НО + Н реакции разветвления цепи НО + Н2 Н2О + Н реакция продолжения цепи НО + Н + М Н2О + М* реакция обрыва цепи Простая реакция включает совокупность однотипных элементарных реакций – реакций, идущих в один акт, в одно действие МЕХАНИЗМ ХИМИЧЕСКОЙ РЕАКЦИИ Механизм химической реакции есть совокупность последовательно и параллельно протекающих простых реакций, ведущих к образованию конечных продуктов
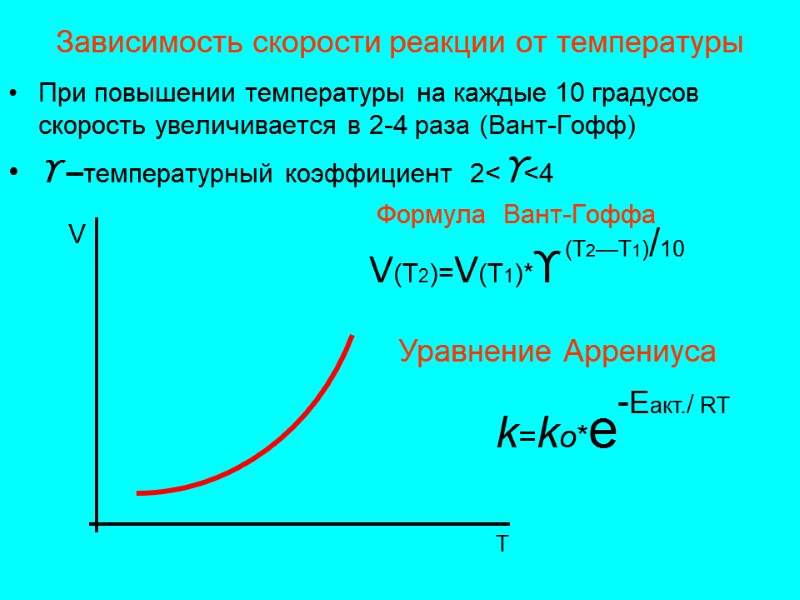
 Зависимость скорости реакции от температуры При повышении температуры на каждые 10 градусов скорость увеличивается в 2-4 раза (Вант-Гофф) ϒ –температурный коэффициент 2<ϒ<4 Формула Вант-Гоффа V(T2)=V(T1)*ϒ (Т2—Т1)/10 Уравнение Аррениуса k=ko*e -Еакт./ RT V T
Зависимость скорости реакции от температуры При повышении температуры на каждые 10 градусов скорость увеличивается в 2-4 раза (Вант-Гофф) ϒ –температурный коэффициент 2<ϒ<4 Формула Вант-Гоффа V(T2)=V(T1)*ϒ (Т2—Т1)/10 Уравнение Аррениуса k=ko*e -Еакт./ RT V T
 КАТАЛИЗ Катализатор – вещество, участвующее в химических превращениях и увеличивающее скорость реакции, но после завершения процесса остающееся в неизменном состоянии и количестве А + ВС = АВ + С = k1 cAсВС А + ВС + К = АВ + С + К К = k2 cKcAсВС К >>
КАТАЛИЗ Катализатор – вещество, участвующее в химических превращениях и увеличивающее скорость реакции, но после завершения процесса остающееся в неизменном состоянии и количестве А + ВС = АВ + С = k1 cAсВС А + ВС + К = АВ + С + К К = k2 cKcAсВС К >>
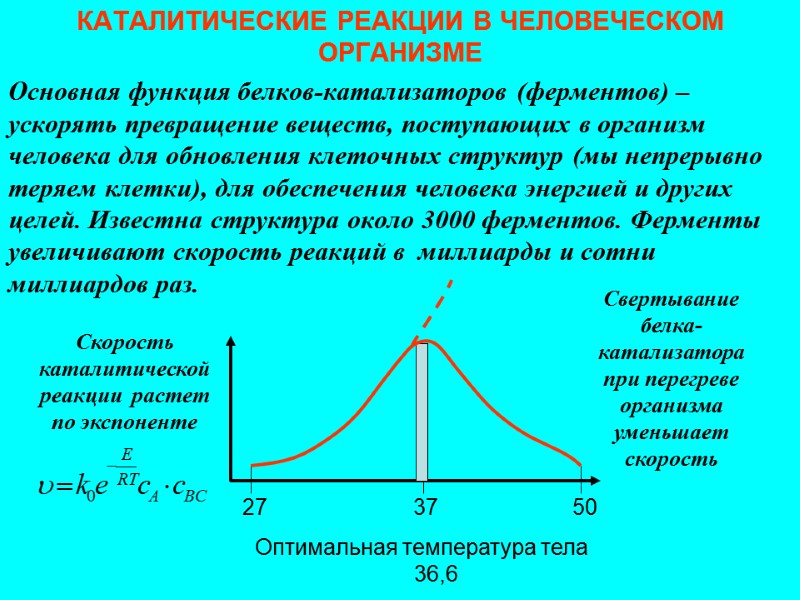
 КАТАЛИТИЧЕСКИЕ РЕАКЦИИ В ЧЕЛОВЕЧЕСКОМ ОРГАНИЗМЕ Основная функция белков-катализаторов (ферментов) – ускорять превращение веществ, поступающих в организм человека для обновления клеточных структур (мы непрерывно теряем клетки), для обеспечения человека энергией и других целей. Известна структура около 3000 ферментов. Ферменты увеличивают скорость реакций в миллиарды и сотни миллиардов раз. 37 50 Оптимальная температура тела 36,6 Скорость каталитической реакции растет по экспоненте Свертывание белка-катализатора при перегреве организма уменьшает скорость
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ В ЧЕЛОВЕЧЕСКОМ ОРГАНИЗМЕ Основная функция белков-катализаторов (ферментов) – ускорять превращение веществ, поступающих в организм человека для обновления клеточных структур (мы непрерывно теряем клетки), для обеспечения человека энергией и других целей. Известна структура около 3000 ферментов. Ферменты увеличивают скорость реакций в миллиарды и сотни миллиардов раз. 37 50 Оптимальная температура тела 36,6 Скорость каталитической реакции растет по экспоненте Свертывание белка-катализатора при перегреве организма уменьшает скорость
 ВОПРОСЫ ДЛЯ ПРОВЕРКИ ЗНАНИЙ 1. В чем различие между простой и сложной реакцией? 2. Согласны ли вы с утверждением, что скорость гомогенной реакции соответствует изменению массы реагента в единицу времени? 3. Объясните, почему скорость реакции прямо пропорциональна произведению концентраций, а не сумме концентраций реагирующих веществ? 3. Дайте определение каталитической реакцией.
ВОПРОСЫ ДЛЯ ПРОВЕРКИ ЗНАНИЙ 1. В чем различие между простой и сложной реакцией? 2. Согласны ли вы с утверждением, что скорость гомогенной реакции соответствует изменению массы реагента в единицу времени? 3. Объясните, почему скорость реакции прямо пропорциональна произведению концентраций, а не сумме концентраций реагирующих веществ? 3. Дайте определение каталитической реакцией.
 Р а с т в о р ы Лекция 6
Р а с т в о р ы Лекция 6
 РАСТВОРЫ Раствор - гомогенная система, состоящая из двух или более компонентов, имеющих молекулярную, ионную или атомную степень раздробленности. ЖИДКИЕ, ТВЕРДЫЕ, ГАЗООБРАЗНЫЕ РАСТВОРЫ Au, Ag N2, 78% O2, 21% Ar, 0.96% CO2, 0.036% Жидкий раствор молекулярная и ионная степень раздробленности Твердый раствор атомная степень раздробленности Газообразный раствор атомная и молекулярная степень раздробленности воздух сплав металлов Водный раствор соли
РАСТВОРЫ Раствор - гомогенная система, состоящая из двух или более компонентов, имеющих молекулярную, ионную или атомную степень раздробленности. ЖИДКИЕ, ТВЕРДЫЕ, ГАЗООБРАЗНЫЕ РАСТВОРЫ Au, Ag N2, 78% O2, 21% Ar, 0.96% CO2, 0.036% Жидкий раствор молекулярная и ионная степень раздробленности Твердый раствор атомная степень раздробленности Газообразный раствор атомная и молекулярная степень раздробленности воздух сплав металлов Водный раствор соли
![>КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n, >КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n,](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_129.jpg) КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n, моль) к объему раствора (V, л): или Молярная доля N (безразмерная величина) – равна отношению количества растворенного вещества ( моль) к суммарному количеству всех веществ ( моль), составляющих раствор: Массовая доля (безразмерная величина) равна отношению массы растворенного вещества (mi кг) к массе раствора ( кг): Массовый процент: 100%
КОНЦЕНТРАЦИЯ РАСТВОРА Молярность М или с [моль/л] равна отношению количества растворенного вещества (n, моль) к объему раствора (V, л): или Молярная доля N (безразмерная величина) – равна отношению количества растворенного вещества ( моль) к суммарному количеству всех веществ ( моль), составляющих раствор: Массовая доля (безразмерная величина) равна отношению массы растворенного вещества (mi кг) к массе раствора ( кг): Массовый процент: 100%
 ПРИМЕРЫ ВЫЧИСЛЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА 1) В мерную колбу на 1 литр насыпали m = 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в воде и добавили воды до метки, соответствующей объему, равному 1л. Вычислить молярную концентрацию раствора сахарозы Решение
ПРИМЕРЫ ВЫЧИСЛЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА 1) В мерную колбу на 1 литр насыпали m = 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в воде и добавили воды до метки, соответствующей объему, равному 1л. Вычислить молярную концентрацию раствора сахарозы Решение
 2) 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить мольную долю сахарозы и воды в растворе Решение
2) 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить мольную долю сахарозы и воды в растворе Решение
 3) 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить массовую долю и процентную долю сахарозы и воды в растворе Решение или 16% сахарозы в водном растворе или 84% воды в водном растворе
3) 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить массовую долю и процентную долю сахарозы и воды в растворе Решение или 16% сахарозы в водном растворе или 84% воды в водном растворе
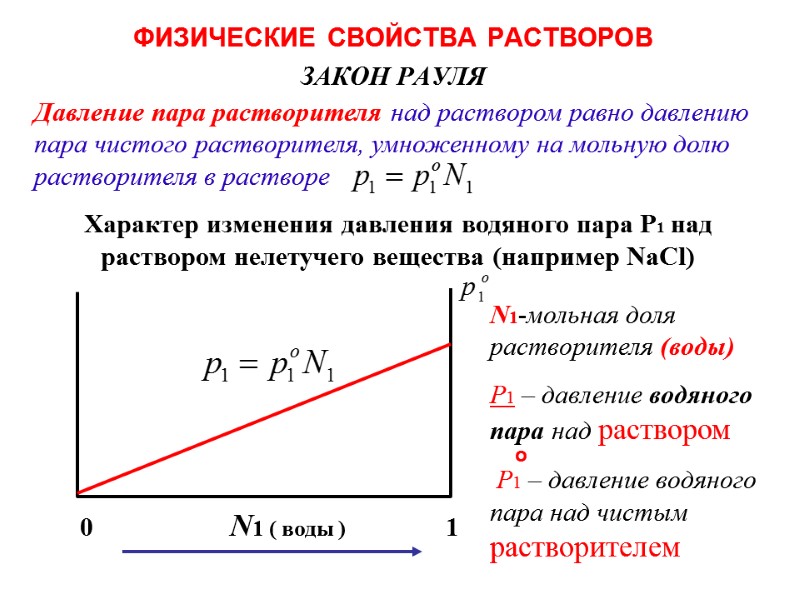
 ФИЗИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ЗАКОН РАУЛЯ 0 N1 ( воды ) 1 Давление пара растворителя над раствором равно давлению пара чистого растворителя, умноженному на мольную долю растворителя в растворе Характер изменения давления водяного пара P1 над раствором нелетучего вещества (например NaCl) N1-мольная доля растворителя (воды) Р1 – давление водяного пара над раствором Р1 – давление водяного пара над чистым растворителем о
ФИЗИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ЗАКОН РАУЛЯ 0 N1 ( воды ) 1 Давление пара растворителя над раствором равно давлению пара чистого растворителя, умноженному на мольную долю растворителя в растворе Характер изменения давления водяного пара P1 над раствором нелетучего вещества (например NaCl) N1-мольная доля растворителя (воды) Р1 – давление водяного пара над раствором Р1 – давление водяного пара над чистым растворителем о
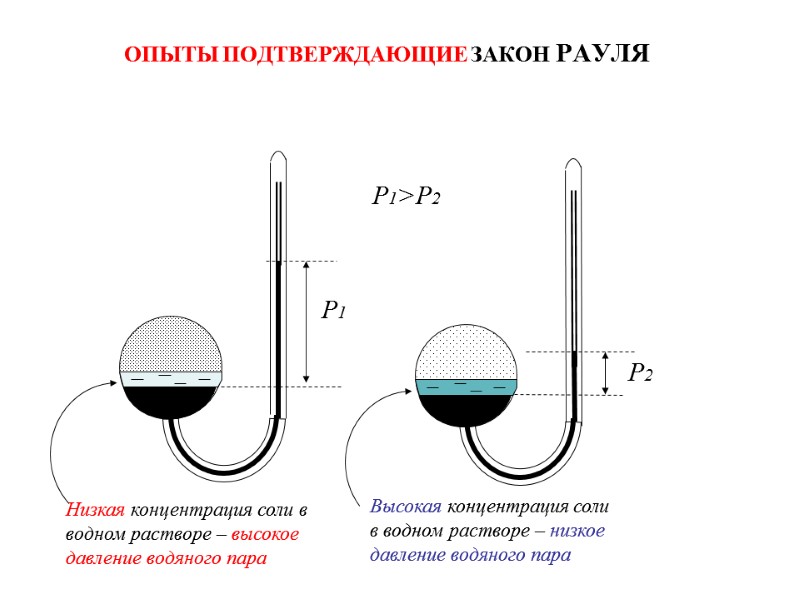
 ОПЫТЫ ПОДТВЕРЖДАЮЩИЕ ЗАКОН РАУЛЯ Р1 Р2 Р1>P2 Низкая концентрация соли в водном растворе – высокое давление водяного пара Высокая концентрация соли в водном растворе – низкое давление водяного пара
ОПЫТЫ ПОДТВЕРЖДАЮЩИЕ ЗАКОН РАУЛЯ Р1 Р2 Р1>P2 Низкая концентрация соли в водном растворе – высокое давление водяного пара Высокая концентрация соли в водном растворе – низкое давление водяного пара
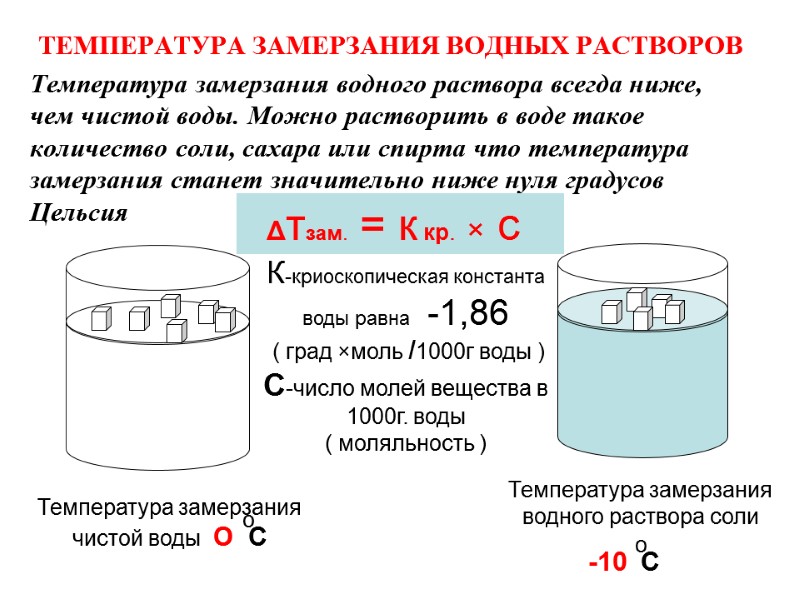
 ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ ВОДНЫХ РАСТВОРОВ Температура замерзания водного раствора всегда ниже, чем чистой воды. Можно растворить в воде такое количество соли, сахара или спирта что температура замерзания станет значительно ниже нуля градусов Цельсия Температура замерзания чистой воды О С Температура замерзания водного раствора соли -10 С Δтзам. = к кр. × с К-криоскопическая константа воды равна -1,86 ( град ×моль /1000г воды ) С-число молей вещества в 1000г. воды ( моляльность ) о о
ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ ВОДНЫХ РАСТВОРОВ Температура замерзания водного раствора всегда ниже, чем чистой воды. Можно растворить в воде такое количество соли, сахара или спирта что температура замерзания станет значительно ниже нуля градусов Цельсия Температура замерзания чистой воды О С Температура замерзания водного раствора соли -10 С Δтзам. = к кр. × с К-криоскопическая константа воды равна -1,86 ( град ×моль /1000г воды ) С-число молей вещества в 1000г. воды ( моляльность ) о о
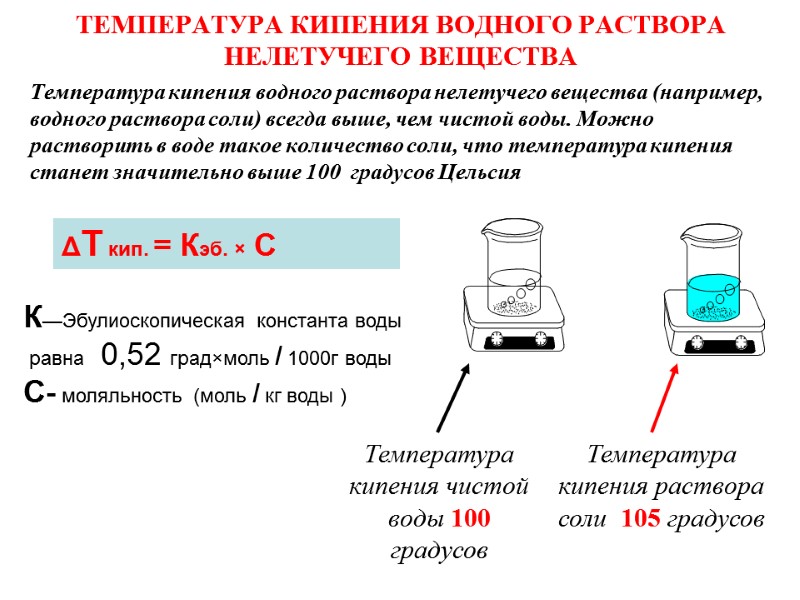
 ТЕМПЕРАТУРА КИПЕНИЯ ВОДНОГО РАСТВОРА НЕЛЕТУЧЕГО ВЕЩЕСТВА Температура кипения водного раствора нелетучего вещества (например, водного раствора соли) всегда выше, чем чистой воды. Можно растворить в воде такое количество соли, что температура кипения станет значительно выше 100 градусов Цельсия Температура кипения чистой воды 100 градусов Температура кипения раствора соли 105 градусов ΔТ кип. = Кэб. × С К—Эбулиоскопическая константа воды равна 0,52 град×моль / 1000г воды С- моляльность (моль / кг воды )
ТЕМПЕРАТУРА КИПЕНИЯ ВОДНОГО РАСТВОРА НЕЛЕТУЧЕГО ВЕЩЕСТВА Температура кипения водного раствора нелетучего вещества (например, водного раствора соли) всегда выше, чем чистой воды. Можно растворить в воде такое количество соли, что температура кипения станет значительно выше 100 градусов Цельсия Температура кипения чистой воды 100 градусов Температура кипения раствора соли 105 градусов ΔТ кип. = Кэб. × С К—Эбулиоскопическая константа воды равна 0,52 град×моль / 1000г воды С- моляльность (моль / кг воды )
 ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ-ГОФФА Осмос – есть явление самопроизвольного перехода молекул растворителя из воды или разбавленного раствора в более концентрированный раствор, когда оба раствора отделены друг от друга полупроницаемой перегородкой. Раствор соли в воде Чистая вода Раствор соли в воде Чистая вода Мембрана проницаемая только для молекул воды Росм.= С×RT Закон Вант-Гоффа Росм. С-концентрация ( моль/ литр )
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ-ГОФФА Осмос – есть явление самопроизвольного перехода молекул растворителя из воды или разбавленного раствора в более концентрированный раствор, когда оба раствора отделены друг от друга полупроницаемой перегородкой. Раствор соли в воде Чистая вода Раствор соли в воде Чистая вода Мембрана проницаемая только для молекул воды Росм.= С×RT Закон Вант-Гоффа Росм. С-концентрация ( моль/ литр )
 Ультрафильтрация (обратный осмос ) Это технологический процесс очистки воды от органических, неорганических, биологических и др.примесей путем “продавливания” загрязненной воды через полупроницаемую мембрану с диаметром пор в несколько нанометров Р воды >> Р осм. “Грязная” вода Чистая вода Мембрана
Ультрафильтрация (обратный осмос ) Это технологический процесс очистки воды от органических, неорганических, биологических и др.примесей путем “продавливания” загрязненной воды через полупроницаемую мембрану с диаметром пор в несколько нанометров Р воды >> Р осм. “Грязная” вода Чистая вода Мембрана
 РАСТВОРИМОСТЬ ГАЗОВ В ВОДЕ 1) С увеличением температуры растворимость газов в воде уменьшается. Растворимость О2 в воде при парциальном давлении, соответствующем его содержанию в атмосфере Т, С 0 5 10 15 20 25 29 S, мг/л 14.7 12.8 11.3 10.2 9.2 8.4 7.6 2) С увеличением давления растворимость газов в воде увеличивается. N = Kp Закон Генри где: N – молярная доля газа в водном растворе К – коэффициент (зависит от природы газа) р – парциальное давление газа над раствором Растворимость газа в жидкости прямо пропорциональна давлению газа над жидкостью о
РАСТВОРИМОСТЬ ГАЗОВ В ВОДЕ 1) С увеличением температуры растворимость газов в воде уменьшается. Растворимость О2 в воде при парциальном давлении, соответствующем его содержанию в атмосфере Т, С 0 5 10 15 20 25 29 S, мг/л 14.7 12.8 11.3 10.2 9.2 8.4 7.6 2) С увеличением давления растворимость газов в воде увеличивается. N = Kp Закон Генри где: N – молярная доля газа в водном растворе К – коэффициент (зависит от природы газа) р – парциальное давление газа над раствором Растворимость газа в жидкости прямо пропорциональна давлению газа над жидкостью о
 РАСТВОРИМОСТЬ ТВЕРДЫХ ВЕЩЕСТВ В ВОДЕ Растворимость твердых веществ в воде с увеличением температуры увеличивается 0 10 20 30 С 100 80 60 40 20 РастворимостьS ( г/100 г Н2О) о CaCl2 Na2SO4 NaCl MgCl2
РАСТВОРИМОСТЬ ТВЕРДЫХ ВЕЩЕСТВ В ВОДЕ Растворимость твердых веществ в воде с увеличением температуры увеличивается 0 10 20 30 С 100 80 60 40 20 РастворимостьS ( г/100 г Н2О) о CaCl2 Na2SO4 NaCl MgCl2
 Растворимость жидкостей в воде Подобное растворяется в подобном ! Вода – полярный растворитель Хорошо растворяются сильно полярные вещества Спирты ( до С5 ) Ацетон и др. Плохо растворяются неполярные вещества Углеводороды (октан) Бензол, Эфир и др. При повышении температуры растворимость значительно увеличивается Вода хорошо растворяется в спирте, но плохо в бензине
Растворимость жидкостей в воде Подобное растворяется в подобном ! Вода – полярный растворитель Хорошо растворяются сильно полярные вещества Спирты ( до С5 ) Ацетон и др. Плохо растворяются неполярные вещества Углеводороды (октан) Бензол, Эфир и др. При повышении температуры растворимость значительно увеличивается Вода хорошо растворяется в спирте, но плохо в бензине
 Тепловые эффекты при растворении ΔН растворения = ΔНразр.реш. + ΔНгидратации ВОДА Молекулы или ионы растворяемого вешества Разрушение исходной структуры, затрата внутренней энергии охлаждение система получает тепло из окружающей среды Гидратация молекул разогрев система отдает тепло ΔН разр.реш. > O (знак + ) эндотермический ΔН гидр. < O (знак - ) экзотермический Суммарный тепловой эффект может быть ( + ), ( - ), ( равен 0 )
Тепловые эффекты при растворении ΔН растворения = ΔНразр.реш. + ΔНгидратации ВОДА Молекулы или ионы растворяемого вешества Разрушение исходной структуры, затрата внутренней энергии охлаждение система получает тепло из окружающей среды Гидратация молекул разогрев система отдает тепло ΔН разр.реш. > O (знак + ) эндотермический ΔН гидр. < O (знак - ) экзотермический Суммарный тепловой эффект может быть ( + ), ( - ), ( равен 0 )
 Диаграмма кристаллизации соль-вода . Т, С 100 70 40 10 0 -10 -30 -50 0 10 20 30 40 50 60 70 80 90 100 % F гомогенный раствор соли в воде Две фазы: кристаллы соли + насыщенный раствор Две фазы: кристаллы льда + раствор соли С эвтектика Две твердые фазы: смесь кристаллов льда и кристаллов соли D Одна фаза: о С соли, % масс.
Диаграмма кристаллизации соль-вода . Т, С 100 70 40 10 0 -10 -30 -50 0 10 20 30 40 50 60 70 80 90 100 % F гомогенный раствор соли в воде Две фазы: кристаллы соли + насыщенный раствор Две фазы: кристаллы льда + раствор соли С эвтектика Две твердые фазы: смесь кристаллов льда и кристаллов соли D Одна фаза: о С соли, % масс.
 Методы выделения веществ из раствора 1. Дегазация- удаление растворенных газов при нагревании или понижении давления 2. Кристаллизация Выделение воды при охлаждении ниже О С ( вымораживание ) Выделение соли при охлаждении раствора насыщенного при 100 С о о 3. Дистилляция Выделение воды ( испарение ) при кипячении раствора соли Выделение спирта при кипении его раствора ( перегонка )
Методы выделения веществ из раствора 1. Дегазация- удаление растворенных газов при нагревании или понижении давления 2. Кристаллизация Выделение воды при охлаждении ниже О С ( вымораживание ) Выделение соли при охлаждении раствора насыщенного при 100 С о о 3. Дистилляция Выделение воды ( испарение ) при кипячении раствора соли Выделение спирта при кипении его раствора ( перегонка )
 Ректификация спирта Это технологический процесс многократного испарения и конденсации исходной смеси на ”тарелках” ректификационной колонны Содержание спирта в паре больше чем в жидкости 100 % спирт Состав жидкости конденсатор колонна Куб-испаритель Сборники
Ректификация спирта Это технологический процесс многократного испарения и конденсации исходной смеси на ”тарелках” ректификационной колонны Содержание спирта в паре больше чем в жидкости 100 % спирт Состав жидкости конденсатор колонна Куб-испаритель Сборники
 Р А С Т В О Р Ы Э Л Е К Т Р О Л И Т О В Лекция 7
Р А С Т В О Р Ы Э Л Е К Т Р О Л И Т О В Лекция 7
 Основоположники теории электролитической диссоциации Сванте Дмитрий Иван Август Иванович Алексеевич Аррениус Менделеев Каблуков 1859-1927 гг. 1834-1907 гг. 1857-1942 гг.
Основоположники теории электролитической диссоциации Сванте Дмитрий Иван Август Иванович Алексеевич Аррениус Менделеев Каблуков 1859-1927 гг. 1834-1907 гг. 1857-1942 гг.
 РАСТВОРЫ ЭЛЕКТРОЛИТОВ Электролит - вещество, которые в расплаве или в растворе распадается на положительно и отрицательно заряженные ионы ( катионы и анионы ), проявляя при этом электропроводность ионного типа Расплав -это расплавленный кристалл (вещество в жидкой фазе при высокой температуре) Кристалл соли при комнатной температуре (твердый электролит) Расплав соли при 801 С (жидкий электролит) о
РАСТВОРЫ ЭЛЕКТРОЛИТОВ Электролит - вещество, которые в расплаве или в растворе распадается на положительно и отрицательно заряженные ионы ( катионы и анионы ), проявляя при этом электропроводность ионного типа Расплав -это расплавленный кристалл (вещество в жидкой фазе при высокой температуре) Кристалл соли при комнатной температуре (твердый электролит) Расплав соли при 801 С (жидкий электролит) о
 Водный раствор электролита представляет собой совокупность катионов и анионов, окруженных гидратными оболочками Процесс разрушения кристаллической решетки при растворении сопровождается образованием гидратированных ионов
Водный раствор электролита представляет собой совокупность катионов и анионов, окруженных гидратными оболочками Процесс разрушения кристаллической решетки при растворении сопровождается образованием гидратированных ионов
 СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ Сильные электролиты полностью распадаются на ионы при растворении в воде. К сильным электролитам относятся: 1) соли: NaCl, КCl, CaCl2, MgCl2, CaSO4 и др., 2) основания щелочных и щелочноземельных металлов: NaOH, Ca(OH)2 и др., 3) кислоты, такие, как серная H2SO4, азотная HNO3, соляная HCl 3. ПРИМЕРЫ ПОЛНОЙ ДИССОЦИАЦИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ NaCl (кр.) + H2O(ж) Na (р-р) + Cl (р-р) NaOH (кр.) + Н2О(ж) Na (р-р) + OH (р-р) H2SO4 (ж) + Н2О (ж) Н (р-р) + НSO4 (р-р) + + +
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ Сильные электролиты полностью распадаются на ионы при растворении в воде. К сильным электролитам относятся: 1) соли: NaCl, КCl, CaCl2, MgCl2, CaSO4 и др., 2) основания щелочных и щелочноземельных металлов: NaOH, Ca(OH)2 и др., 3) кислоты, такие, как серная H2SO4, азотная HNO3, соляная HCl 3. ПРИМЕРЫ ПОЛНОЙ ДИССОЦИАЦИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ NaCl (кр.) + H2O(ж) Na (р-р) + Cl (р-р) NaOH (кр.) + Н2О(ж) Na (р-р) + OH (р-р) H2SO4 (ж) + Н2О (ж) Н (р-р) + НSO4 (р-р) + + +
 СЛАБЫЕ ЭЛЕКТРОЛИТЫ Слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. К слабым электролитам относятся: 1) вода Н2О 2) некоторые неорганические кислоты, например, синильная кислота HCN, сероводород H2S, угольная кислота Н2СО3 (в свободном виде она не существует и выделить её из водного раствора нельзя, она распадается на воду и углекислый газ) 3) многие основания металлов кроме щелочных и щелочноземельных металлов, например, Al(OH)3 4) аммиачная вода, NH3(р-р) или NH4OH 5) органические кислоты, например, СН3СООН
СЛАБЫЕ ЭЛЕКТРОЛИТЫ Слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. К слабым электролитам относятся: 1) вода Н2О 2) некоторые неорганические кислоты, например, синильная кислота HCN, сероводород H2S, угольная кислота Н2СО3 (в свободном виде она не существует и выделить её из водного раствора нельзя, она распадается на воду и углекислый газ) 3) многие основания металлов кроме щелочных и щелочноземельных металлов, например, Al(OH)3 4) аммиачная вода, NH3(р-р) или NH4OH 5) органические кислоты, например, СН3СООН
 Количественные характеристики силы электролита степень диссоциации α константа диссоциации Кд
Количественные характеристики силы электролита степень диссоциации α константа диссоциации Кд
 Степень диссоциации 0 < α < 100%, Если: α>40% - сильные электролиты 10<α<40% - средние электролиты α<10%, - слабые электролиты α –зависит от температуры и разбавления раствора α=
Степень диссоциации 0 < α < 100%, Если: α>40% - сильные электролиты 10<α<40% - средние электролиты α<10%, - слабые электролиты α –зависит от температуры и разбавления раствора α=
 Степень диссоциации α зависит от: природы электролита природы растворителя концентрации раствора (при разбавлении α увеличивается) Температуры наличия в растворе одноименного иона (подавление ионизации)
Степень диссоциации α зависит от: природы электролита природы растворителя концентрации раствора (при разбавлении α увеличивается) Температуры наличия в растворе одноименного иона (подавление ионизации)
 Степень диссоциации Истинная α сильного электролита =100% АВ → А++ В- [А+ ] = [В- ] = См• α(каж.) «кажущаяся» α – измеренная экспериментально < 100% это объясняется электростатическим взаимодействием ионов
Степень диссоциации Истинная α сильного электролита =100% АВ → А++ В- [А+ ] = [В- ] = См• α(каж.) «кажущаяся» α – измеренная экспериментально < 100% это объясняется электростатическим взаимодействием ионов
 Константа диссоциации Кд Диссоциация слабых электролитов – обратимый, равновесный процесс: АВ А+ + В- Который количественно описывается законом действующих масс: Кд=
Константа диссоциации Кд Диссоциация слабых электролитов – обратимый, равновесный процесс: АВ А+ + В- Который количественно описывается законом действующих масс: Кд=

 Произведение растворимости (ПР) ПР – важная характеристика для малорастворимого электролита AgCl Ag+ +Cl- Кd (AgCl) = [Ag+]• [Cl-] –величина const и называется произведением растворимости ПР [ Ag ] + × [ CI ] _ [ AgCI ] Kдисс. =
Произведение растворимости (ПР) ПР – важная характеристика для малорастворимого электролита AgCl Ag+ +Cl- Кd (AgCl) = [Ag+]• [Cl-] –величина const и называется произведением растворимости ПР [ Ag ] + × [ CI ] _ [ AgCI ] Kдисс. =
 Произведение растворимости (ПР) AgCl Ag+ +Cl- ПР = [Ag+]• [Cl-] при 250С ПР(AgCl)=1,78•10-8 Если [Ag+]• [Cl-] < 1,78•10-8 осадок растворится [Ag+]• [Cl-] > 1,78•10-8 выпадет осадок
Произведение растворимости (ПР) AgCl Ag+ +Cl- ПР = [Ag+]• [Cl-] при 250С ПР(AgCl)=1,78•10-8 Если [Ag+]• [Cl-] < 1,78•10-8 осадок растворится [Ag+]• [Cl-] > 1,78•10-8 выпадет осадок
 Диссоциация воды H2O H+ + OH- Кд=[H+]×[OH-] / [H2O] Кд(H2O)=1,8×10-16 при 220С Кд ×[H2O]=[H+] ×[OH-]- const КH2O = [H+] ×[OH-] ионное произведение воды В 1л воды содержится: 1000г/18г/моль =55,55моль 1,8•10-16 55,55 = 10-14 =[H+] ×[OH-] [H+]=[OH-] = 10-7 КH2O =10-14 ×
Диссоциация воды H2O H+ + OH- Кд=[H+]×[OH-] / [H2O] Кд(H2O)=1,8×10-16 при 220С Кд ×[H2O]=[H+] ×[OH-]- const КH2O = [H+] ×[OH-] ионное произведение воды В 1л воды содержится: 1000г/18г/моль =55,55моль 1,8•10-16 55,55 = 10-14 =[H+] ×[OH-] [H+]=[OH-] = 10-7 КH2O =10-14 ×
![>Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+] >Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+]](https://present5.com/presentacii-2/20171208\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl.ppt\5256-zelyaev_khimia_lektsii_dlya_stroiteley_247_sl_161.jpg) Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+] < 10-7 [H+] >[OH-] среда кислая, т.е. [H+] > 10-7 рН = -lg [H+] среда нейтральная при рН=7 среда щелочная при рН>7 среда кислая при рН< 7 рОН= - lg [ОH-] рН + рОН = 14
Водородный показатель (рН) [H+]=[OH-] = 10-7 среда нейтральная [H+]< [OH-] среда щелочная, т.е [H+] < 10-7 [H+] >[OH-] среда кислая, т.е. [H+] > 10-7 рН = -lg [H+] среда нейтральная при рН=7 среда щелочная при рН>7 среда кислая при рН< 7 рОН= - lg [ОH-] рН + рОН = 14
 ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ рН рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 кислая среда щелочная среда Нейтральная среда [моль/л] pH < 7 pH > 7 pH = 7
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ рН рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 кислая среда щелочная среда Нейтральная среда [моль/л] pH < 7 pH > 7 pH = 7
 ЗНАЧЕНИЯ рН НЕКОТОРЫХ ЖИДКОСТЕЙ Раствор соляной кислоты (HCl) 1 моль/л Чистый желудочный сок человека Лимонный сок Речная вода Грудное молоко Сыворотка крови человека Морская вода Раствор щелочи (КОН) 1 моль/л 0.0 0.9 – 1.1 2.3 5.6 6.6 – 6.9 7.4 7.8 – 8.3 14.0 рН
ЗНАЧЕНИЯ рН НЕКОТОРЫХ ЖИДКОСТЕЙ Раствор соляной кислоты (HCl) 1 моль/л Чистый желудочный сок человека Лимонный сок Речная вода Грудное молоко Сыворотка крови человека Морская вода Раствор щелочи (КОН) 1 моль/л 0.0 0.9 – 1.1 2.3 5.6 6.6 – 6.9 7.4 7.8 – 8.3 14.0 рН
 РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 1. Реакции нейтрализации (образование воды) HCl(р-р) + KOH(р-р) KCl(р-р) + H2O(ж) Ионное уравнение: H + CI + K + OH K + CI + H2O Краткое ионное ур-е: Н + ОН Н2О 2. Реакции осаждения (образование нерастворимой соли) CaCl2(р-р) + Na2SO4(р-р) NaCl(р-р) + CaSO4 (т) Ионное уравнение: Са (р-р) + SO4 (р-р) CaSO4(тв) 3. Реакции образования газообразного вещества CaCO3(т) + 2HCI(р-р) СaCI2(р-р) + H2O(ж) + CO2(газ) Ионное уравнение: CaCO3 +2H (р-р) Ca (р-р) + Н2О(ж) +СО2(г) +2 -2 + +2 + _ + _ + _ + _
РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 1. Реакции нейтрализации (образование воды) HCl(р-р) + KOH(р-р) KCl(р-р) + H2O(ж) Ионное уравнение: H + CI + K + OH K + CI + H2O Краткое ионное ур-е: Н + ОН Н2О 2. Реакции осаждения (образование нерастворимой соли) CaCl2(р-р) + Na2SO4(р-р) NaCl(р-р) + CaSO4 (т) Ионное уравнение: Са (р-р) + SO4 (р-р) CaSO4(тв) 3. Реакции образования газообразного вещества CaCO3(т) + 2HCI(р-р) СaCI2(р-р) + H2O(ж) + CO2(газ) Ионное уравнение: CaCO3 +2H (р-р) Ca (р-р) + Н2О(ж) +СО2(г) +2 -2 + +2 + _ + _ + _ + _
 4. Окислительно-восстановительные реакции с участием металлов (метод электронного баланса) Zn(т) + CuSO4(р-р) ZnSO4(р-р) + Cu(т) Реакция окисления (атом цинка отдает электроны) Zn (т) - 2e Zn (р-р) Реакция восстановления (ион меди принимает электроны) Cu + 2e Cu о +2 +2 _ о _ 5. Окислительно-восстановительные реакции с неметаллами Cl2 (газ) + НОН HCI + HOCI CI - 1e CI окисление хлора о + CI + 1e CI восстановление хлора о о -1 +1 _ _ _
4. Окислительно-восстановительные реакции с участием металлов (метод электронного баланса) Zn(т) + CuSO4(р-р) ZnSO4(р-р) + Cu(т) Реакция окисления (атом цинка отдает электроны) Zn (т) - 2e Zn (р-р) Реакция восстановления (ион меди принимает электроны) Cu + 2e Cu о +2 +2 _ о _ 5. Окислительно-восстановительные реакции с неметаллами Cl2 (газ) + НОН HCI + HOCI CI - 1e CI окисление хлора о + CI + 1e CI восстановление хлора о о -1 +1 _ _ _
 Гидролиз солей Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катион или анион при взаимодействии с водой образует слабый электролит, то раствор становится либо щелочной либо кислой средой. Взаимодействие ионов солей с водой, изменяющее рН среды с электронейтральной на кислую или щелочную называется гидролизом. ПРИМЕРЫ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ 1. реакция воды с анионом слабой кислоты CH3COONa(р-р) + H2O(ж) ⇄ CH3COOH(р-р) + NaOH(р-р) CH3COO + Na + H2O ⇄ CH3COOH + Na + OH CH3COO + H2O ⇄ CH3COOH + OH (среда щелочная) - + + - - -
Гидролиз солей Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катион или анион при взаимодействии с водой образует слабый электролит, то раствор становится либо щелочной либо кислой средой. Взаимодействие ионов солей с водой, изменяющее рН среды с электронейтральной на кислую или щелочную называется гидролизом. ПРИМЕРЫ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ 1. реакция воды с анионом слабой кислоты CH3COONa(р-р) + H2O(ж) ⇄ CH3COOH(р-р) + NaOH(р-р) CH3COO + Na + H2O ⇄ CH3COOH + Na + OH CH3COO + H2O ⇄ CH3COOH + OH (среда щелочная) - + + - - -
 2.реакция воды с катионом слабого основания (1 ступень) AlCl3 + HOН ⇄ Al(OH)Cl2 + H + Cl Al + 3Cl + HOН ⇄ Al(OH)Cl2 + H + Cl Al + 2Cl + HOН ⇄ Al(OH)Cl2 + H (среда кислая) 3. реакция воды с ионами соли слабой кислоты и слабого основания (CH3COO) +NН4(р-р) + H2O(ж) ⇄ CH3COOH(р-р) + NH4OH(р-р) (среда близка к нейтральной) + _ + _ 3+ _ 3+ _ + _ +
2.реакция воды с катионом слабого основания (1 ступень) AlCl3 + HOН ⇄ Al(OH)Cl2 + H + Cl Al + 3Cl + HOН ⇄ Al(OH)Cl2 + H + Cl Al + 2Cl + HOН ⇄ Al(OH)Cl2 + H (среда кислая) 3. реакция воды с ионами соли слабой кислоты и слабого основания (CH3COO) +NН4(р-р) + H2O(ж) ⇄ CH3COOH(р-р) + NH4OH(р-р) (среда близка к нейтральной) + _ + _ 3+ _ 3+ _ + _ +
 Степень гидролиза ( hг.) NH4 +CI + HOH NH4OH + H +CI + _ + _ NH3 (газ) H2O Число гидролизовавшихся молекул Общее число молекул соли h(г) = 100% Cтепень гидролиза увеличивается при: 1. Нагревании раствора 2. Разбавлении раствора водой 3. Удалении продуктов гидролиза в виде осадка или газа (при растворении соды идет бурное выделение газа СО2)
Степень гидролиза ( hг.) NH4 +CI + HOH NH4OH + H +CI + _ + _ NH3 (газ) H2O Число гидролизовавшихся молекул Общее число молекул соли h(г) = 100% Cтепень гидролиза увеличивается при: 1. Нагревании раствора 2. Разбавлении раствора водой 3. Удалении продуктов гидролиза в виде осадка или газа (при растворении соды идет бурное выделение газа СО2)
 Э Л Е К Т Р О Х И М И Я Лекция 8
Э Л Е К Т Р О Х И М И Я Лекция 8


 ВОЗНИКНОВЕНИЕ ЗАРЯДА НА МЕТАЛЛЕ ПОГРУЖЕННОМ В РАСТВОР ЕГО СОЛИ а) Возникновение отрицательного заряда на АКТИВНОМ металле Исходное (электронейтральное) состояние электрода Конечное (отрицательно заряженное) состояние электрода (-) ( О ) Переход ионов металла ( + ) в раствор
ВОЗНИКНОВЕНИЕ ЗАРЯДА НА МЕТАЛЛЕ ПОГРУЖЕННОМ В РАСТВОР ЕГО СОЛИ а) Возникновение отрицательного заряда на АКТИВНОМ металле Исходное (электронейтральное) состояние электрода Конечное (отрицательно заряженное) состояние электрода (-) ( О ) Переход ионов металла ( + ) в раствор
 б) Возникновение положительного заряда на ПАССИВНОМ металле Исходное (электронейтральное) состояние электрода Конечное (положительно заряженное) состояние электрода (+) ( О ) Переход ионов соли ( + ) из раствора на металл
б) Возникновение положительного заряда на ПАССИВНОМ металле Исходное (электронейтральное) состояние электрода Конечное (положительно заряженное) состояние электрода (+) ( О ) Переход ионов соли ( + ) из раствора на металл
 ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ НА ГРАНИЦЕ РАЗДЕЛА МЕТАЛЛ---ВОДНЫЙ РАСТВОР (а)—вода или низкая концентрация соли (б)—высокая концентрация соли
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ НА ГРАНИЦЕ РАЗДЕЛА МЕТАЛЛ---ВОДНЫЙ РАСТВОР (а)—вода или низкая концентрация соли (б)—высокая концентрация соли
 МЕТОД ИЗМЕРЕНИЯ ПОТЕНЦИАЛОВ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ К Cl + - Н2 Н2 Pt Zn Zn Zn + 2e 2H + 2e H2 +2 + - - e - e - Стандартный водородный электрод Цинковый электрод о о / /
МЕТОД ИЗМЕРЕНИЯ ПОТЕНЦИАЛОВ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ К Cl + - Н2 Н2 Pt Zn Zn Zn + 2e 2H + 2e H2 +2 + - - e - e - Стандартный водородный электрод Цинковый электрод о о / /
 . СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ И НЕМЕТАЛЛОВ В ВОДНОМ РАСТВОРЕ Электрод Электродная реакция
. СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ И НЕМЕТАЛЛОВ В ВОДНОМ РАСТВОРЕ Электрод Электродная реакция
 ВЫЧИСЛЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА. УРАВНЕНИЕ НЕРНСТА Для любого металлического электрода, электродный потенциал вычисляется по уравнению Нернста: где, - стандартный электродный потенциал при С = 1моль/л -электродный потенциал при концентрации электролита, отличающейся от 1 моль/л R = 8,31– газовая постоянная; Т = 298 [К]; Z – число электронов, участвующее в электродном процессе; F = 96500 – единица количества электричества [Фарадей]. Электродный потенциал зависит: а) от температуры, при которой находится электрод б) от концентрации ионов металла в разбавленном растворе, в) от природы металла (его свойства отдавать электроны).
ВЫЧИСЛЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА. УРАВНЕНИЕ НЕРНСТА Для любого металлического электрода, электродный потенциал вычисляется по уравнению Нернста: где, - стандартный электродный потенциал при С = 1моль/л -электродный потенциал при концентрации электролита, отличающейся от 1 моль/л R = 8,31– газовая постоянная; Т = 298 [К]; Z – число электронов, участвующее в электродном процессе; F = 96500 – единица количества электричества [Фарадей]. Электродный потенциал зависит: а) от температуры, при которой находится электрод б) от концентрации ионов металла в разбавленном растворе, в) от природы металла (его свойства отдавать электроны).
 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭЛЕКТРОЛИЗЕРЫ Для того, чтобы энергию химической реакции превратить в электрическую и наоборот электрическую энергию использовать для осуществления химической реакции превращения веществ ученые создали специальные устройства. В них отсутствует непосредственный контакт реагирующих веществ. Такими устройствами являются: а) гальванические элементы -- химические источники тока ( аккумуляторы, батарейки, топливные элементы ) б) электролизеры –устройства для получения веществ, нанесения покрытий и обработки деталей
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭЛЕКТРОЛИЗЕРЫ Для того, чтобы энергию химической реакции превратить в электрическую и наоборот электрическую энергию использовать для осуществления химической реакции превращения веществ ученые создали специальные устройства. В них отсутствует непосредственный контакт реагирующих веществ. Такими устройствами являются: а) гальванические элементы -- химические источники тока ( аккумуляторы, батарейки, топливные элементы ) б) электролизеры –устройства для получения веществ, нанесения покрытий и обработки деталей
 ( + ) ( - ) Электро лампа Е Zn/Zn =-–0,76v 2+ Е Zn/Zn = –0,76v E Cu/Cu =+0,34v 2+ ЭДС =+0,34 –(–0,76) = 1,1 вольта ОКИСЛЕНИЕ – АНОД ВОССТАНОВЛЕНИЕ– КАТОД суммарная реакция
( + ) ( - ) Электро лампа Е Zn/Zn =-–0,76v 2+ Е Zn/Zn = –0,76v E Cu/Cu =+0,34v 2+ ЭДС =+0,34 –(–0,76) = 1,1 вольта ОКИСЛЕНИЕ – АНОД ВОССТАНОВЛЕНИЕ– КАТОД суммарная реакция
 ВЫЧИСЛЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (э.д.с., Е ) ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 1. Сокращенно обозначим гальванический элемент, записывая отрицательный электрод слева: (-)Zn|ZnSO4||CuSO4|Cu(+) 2. Знаки (+) и (-) указывают, что на отрицательном электроде (аноде) происходит окисление металла, а на положительном электроде (катоде) восстановление иона до металла. Реакция на аноде: Zn Zn + 2e (окисление металла) Реакция на катоде: Cu + 2e Cu (восстановление до металла) 3. Вычитают из потенциала положительного электрода потенциал более отрицательного электрода: = - = 0.337 – (-0.763) = 1.10 В 2+ 2+ - -
ВЫЧИСЛЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (э.д.с., Е ) ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 1. Сокращенно обозначим гальванический элемент, записывая отрицательный электрод слева: (-)Zn|ZnSO4||CuSO4|Cu(+) 2. Знаки (+) и (-) указывают, что на отрицательном электроде (аноде) происходит окисление металла, а на положительном электроде (катоде) восстановление иона до металла. Реакция на аноде: Zn Zn + 2e (окисление металла) Реакция на катоде: Cu + 2e Cu (восстановление до металла) 3. Вычитают из потенциала положительного электрода потенциал более отрицательного электрода: = - = 0.337 – (-0.763) = 1.10 В 2+ 2+ - -
 КОРРОЗИЯ МЕТАЛЛОВ Химическая коррозия - окисление металла кислородом воздуха или другим окислителем без участия воды Fe O2 O2 3Fe(т) + 2O2(г) Fe3O4(т); G = - 1014 кДж/моль Бурая ржавчина ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ –В ВОДНЫХ РАСТВОРАХ
КОРРОЗИЯ МЕТАЛЛОВ Химическая коррозия - окисление металла кислородом воздуха или другим окислителем без участия воды Fe O2 O2 3Fe(т) + 2O2(г) Fe3O4(т); G = - 1014 кДж/моль Бурая ржавчина ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ –В ВОДНЫХ РАСТВОРАХ
 Электрохимическая коррозия – окисление металла в микрогальваническом элементе, образующемся на участке поверхности металла, покрытого каплей воды Анод Катод O2 ОН - Fe 2+ е - Реакции в микрогальваническом элементе на электродах: (-) анод (окисление): 2Fe(т) 2Fe(р-р) + 4е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) Реакции в капле раствора: 2Fe(р-р) + 4ОН(р-р) 2Fe(OH)2(т) 4Fe(OH)2(т) + О2 + 2Н2О(ж) 4Fe(OH)3(т) 2Fe(OH)3(т) Fe2O3 Н2О[бурый осадок] + 2Н2О(ж) . +2 - - 2+ - -
Электрохимическая коррозия – окисление металла в микрогальваническом элементе, образующемся на участке поверхности металла, покрытого каплей воды Анод Катод O2 ОН - Fe 2+ е - Реакции в микрогальваническом элементе на электродах: (-) анод (окисление): 2Fe(т) 2Fe(р-р) + 4е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) Реакции в капле раствора: 2Fe(р-р) + 4ОН(р-р) 2Fe(OH)2(т) 4Fe(OH)2(т) + О2 + 2Н2О(ж) 4Fe(OH)3(т) 2Fe(OH)3(т) Fe2O3 Н2О[бурый осадок] + 2Н2О(ж) . +2 - - 2+ - -
 РЖАВЛЕНИЕ ЖЕЛЕЗА ВО ВЛАЖНОМ ВОЗДУХЕ
РЖАВЛЕНИЕ ЖЕЛЕЗА ВО ВЛАЖНОМ ВОЗДУХЕ
 ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ (полимером, металлом) 1) Полимером (электрический провод в полимерной оболочке) 2)Металлом (белая жесть – листовая сталь, покрытая слоем олова, широко используется при изготовлении консервных банок и др.) Пленка олова более устойчива по сравнению со сталью при действии кислорода воздуха, растворов кислот и щелочей. Если покрытие повреждено и есть доступ к поверхности стали, то начинается интенсивная электрохимическая коррозия железа Анод Катод O2 ОН - Fe 2+ 2е - Fe Sn (-) анод (окисление): 2Fe(т) 2Fe(р-р) + 4е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) 2+ - - - Среда нейтральная Среда щелочная
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ (полимером, металлом) 1) Полимером (электрический провод в полимерной оболочке) 2)Металлом (белая жесть – листовая сталь, покрытая слоем олова, широко используется при изготовлении консервных банок и др.) Пленка олова более устойчива по сравнению со сталью при действии кислорода воздуха, растворов кислот и щелочей. Если покрытие повреждено и есть доступ к поверхности стали, то начинается интенсивная электрохимическая коррозия железа Анод Катод O2 ОН - Fe 2+ 2е - Fe Sn (-) анод (окисление): 2Fe(т) 2Fe(р-р) + 4е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) 2+ - - - Среда нейтральная Среда щелочная
 КОРРОЗИЯ ЖЕЛЕЗА ПОКРЫТОГО ОЛОВОМ
КОРРОЗИЯ ЖЕЛЕЗА ПОКРЫТОГО ОЛОВОМ
 ЗАЩИТА ЖЕЛЕЗА ПРИ РАЗРУШЕНИИ ЦИНКОВОГО ПОКРЫТИЯ
ЗАЩИТА ЖЕЛЕЗА ПРИ РАЗРУШЕНИИ ЦИНКОВОГО ПОКРЫТИЯ
 Оцинкованная сталь широко пользуется для изготовления кровельного материала, днищей автомобилей, ведер и т.д.) Если покрытие повреждено и есть доступ к поверхности стали - происходит разрушение цинкового покрытия, но не стали Fe Zn Zn Катод (+) Анод (--) Zn 2+ (-) анод (окисление): Zn(т) Zn (р-р) + 2е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) 2+ - - - ОН -
Оцинкованная сталь широко пользуется для изготовления кровельного материала, днищей автомобилей, ведер и т.д.) Если покрытие повреждено и есть доступ к поверхности стали - происходит разрушение цинкового покрытия, но не стали Fe Zn Zn Катод (+) Анод (--) Zn 2+ (-) анод (окисление): Zn(т) Zn (р-р) + 2е (+) катод (восстановление): О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) 2+ - - - ОН -
 ПРОТЕКТОРНАЯ ЗАЩИТА ТРУБОПРОВОДА ЗА СЧЕТ РАСТВОРЕНИЯ АНОДА
ПРОТЕКТОРНАЯ ЗАЩИТА ТРУБОПРОВОДА ЗА СЧЕТ РАСТВОРЕНИЯ АНОДА
 Электрохимическая защита за счет создания на металле отрицательного заряда, препятствующего переходу ионов металла в раствор (катодная защита) с использованием источника постоянного тока (-) (+) Fe Fe е - е - Fe 2+
Электрохимическая защита за счет создания на металле отрицательного заряда, препятствующего переходу ионов металла в раствор (катодная защита) с использованием источника постоянного тока (-) (+) Fe Fe е - е - Fe 2+
 Электрохимическая защита за счет создания на металле отрицательного заряда, препятствующего переходу ионов металла в раствор (катодная защита) с использованием источника постоянного тока (–) (+) Fe Fe е - Fe 2+ Станция катодной защиты (источник постоянноготока) V = 10-15 вольт Разрушаемое заземление Катод (–) внешнего источника отрицательный потенциал на защищаемой конструкции Ионы Fe в грунте 2+
Электрохимическая защита за счет создания на металле отрицательного заряда, препятствующего переходу ионов металла в раствор (катодная защита) с использованием источника постоянного тока (–) (+) Fe Fe е - Fe 2+ Станция катодной защиты (источник постоянноготока) V = 10-15 вольт Разрушаемое заземление Катод (–) внешнего источника отрицательный потенциал на защищаемой конструкции Ионы Fe в грунте 2+
 ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ Сухие элементы (батареи) 1 – металлический колпачок; 2 – изолятор; 3 – графитовый катод; 4 – водная паста, содержащая NH4Cl(р-р) и MnO2(т); 5 – цинковый анод 1 2 3 4 5 (-) (+) Реакция на аноде - окисление А ( + ) Zn(т) Zn + 2e Реакция на катоде - восстановление К ( - ) 2NH4(р-р) + 2MnO2(т) + 2e Mn2O3(т) + 2NH3(г) + 2 H2O(ж) - + 2+ -
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ Сухие элементы (батареи) 1 – металлический колпачок; 2 – изолятор; 3 – графитовый катод; 4 – водная паста, содержащая NH4Cl(р-р) и MnO2(т); 5 – цинковый анод 1 2 3 4 5 (-) (+) Реакция на аноде - окисление А ( + ) Zn(т) Zn + 2e Реакция на катоде - восстановление К ( - ) 2NH4(р-р) + 2MnO2(т) + 2e Mn2O3(т) + 2NH3(г) + 2 H2O(ж) - + 2+ -
 Свинцовый аккумулятор Процесс разрядки На аноде: Pb(т) + HSO4(р-р) PbSO4(т) + H(р-р) + 2е На катоде: PbO2(т) + 3H(р-р) + HSO4(р-р) + 2е PbSO4(т) + 2Н2О(ж) Процесс зарядки На аноде: PbSO4(т) + 2Н2О(ж) PbO2(т) + 3H(р-р) + HSO4(р-р) + 2е На катоде: PbSO4(т) + H(р-р) + 2е Pb(т) + HSO4(р-р) + _ PbO2 Pb HSO4 H + _ + + + + _ _ _ _ _ _ _ _
Свинцовый аккумулятор Процесс разрядки На аноде: Pb(т) + HSO4(р-р) PbSO4(т) + H(р-р) + 2е На катоде: PbO2(т) + 3H(р-р) + HSO4(р-р) + 2е PbSO4(т) + 2Н2О(ж) Процесс зарядки На аноде: PbSO4(т) + 2Н2О(ж) PbO2(т) + 3H(р-р) + HSO4(р-р) + 2е На катоде: PbSO4(т) + H(р-р) + 2е Pb(т) + HSO4(р-р) + _ PbO2 Pb HSO4 H + _ + + + + _ _ _ _ _ _ _ _
 Топливный элемент Катод ( +) О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) Анод (-) 2Н2(г) + 4ОН(р-р) - 4e 4Н2О(ж) Суммарная реакция 2Н2(г) + О2(г) 2Н2О(ж) Анод-окисление водорода ( - ) ( + ) Катод-восстановление кислорода Н2 Н2 Н2О О2 О2 Н2О К ОН Н2О _ + _ _ _
Топливный элемент Катод ( +) О2(г) + 2Н2О(ж) + 4е 4ОН(р-р) Анод (-) 2Н2(г) + 4ОН(р-р) - 4e 4Н2О(ж) Суммарная реакция 2Н2(г) + О2(г) 2Н2О(ж) Анод-окисление водорода ( - ) ( + ) Катод-восстановление кислорода Н2 Н2 Н2О О2 О2 Н2О К ОН Н2О _ + _ _ _
 ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного тока. 1) Электролиз водного раствора серной кислоты Н2SO4 (-) (+) Катод Анод SO4 2- Н + H2O (-) Катод (восстановление): 4Н + 4е 2Н2 (+) Анод (окисление): 2Н2О - 4e 4Н + О2 Суммарная реакция: 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 + + - В водных растворах кислот с кислородсодержащим анионом электролизу подвергается вода Инертный электрод Инертный электрод -
ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного тока. 1) Электролиз водного раствора серной кислоты Н2SO4 (-) (+) Катод Анод SO4 2- Н + H2O (-) Катод (восстановление): 4Н + 4е 2Н2 (+) Анод (окисление): 2Н2О - 4e 4Н + О2 Суммарная реакция: 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 + + - В водных растворах кислот с кислородсодержащим анионом электролизу подвергается вода Инертный электрод Инертный электрод -
 Электролиз воды Источник постоянного тока V=3v - – – О + Н Н О Н Н О Н Н + + + + + + _ _ _ _ _ _ + + + + + + + + + + 4Н2О +4e 2Н2+4ОН О Н Н + + _ _ 2Н2О–4e О2+4Н газ Водород газ Кислород Катодное пространство щелочная среда («живая» вода) Анодное пространство кислая среда («мертвая» вода) (–) (+) – + 2 Н2О эл.ток 2Н2 + О2 – – – – – – – – – ионы ОН – ионы Н + Молекулы Н2О
Электролиз воды Источник постоянного тока V=3v - – – О + Н Н О Н Н О Н Н + + + + + + _ _ _ _ _ _ + + + + + + + + + + 4Н2О +4e 2Н2+4ОН О Н Н + + _ _ 2Н2О–4e О2+4Н газ Водород газ Кислород Катодное пространство щелочная среда («живая» вода) Анодное пространство кислая среда («мертвая» вода) (–) (+) – + 2 Н2О эл.ток 2Н2 + О2 – – – – – – – – – ионы ОН – ионы Н + Молекулы Н2О
 2) Электролиз водного раствора щелочи, например, NaOH (-) (+) Катод Анод H2O (-) Катод (восстановление): 4Н2О + 4е 2Н2 + 4ОН (+) Анод (окисление): 4ОН 2Н2О + О2 + 4е Суммарная реакция: 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 - В водных растворах щелочей электролизу подвергается вода OН - - - - OН Na +
2) Электролиз водного раствора щелочи, например, NaOH (-) (+) Катод Анод H2O (-) Катод (восстановление): 4Н2О + 4е 2Н2 + 4ОН (+) Анод (окисление): 4ОН 2Н2О + О2 + 4е Суммарная реакция: 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 - В водных растворах щелочей электролизу подвергается вода OН - - - - OН Na +
 3) Электролиз водных растворов солей с кислородсодержащим анионом, например, Na2SO4 (-) (+) Катод Анод H2O (-) Катод (восстановление): 4Н2О + 4е 2Н2 + 4ОН (+) Анод (окисление): 2Н2О 4Н + О2 + 4е Суммарная реакция: 4Н2О + 2Н2О 2Н2 + О2 + 4ОН + 4Н или 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 - В водных растворах солей с кислородсодержащим анионом электролизу подвергается вода + - - Na + SO4 2- H2O - +
3) Электролиз водных растворов солей с кислородсодержащим анионом, например, Na2SO4 (-) (+) Катод Анод H2O (-) Катод (восстановление): 4Н2О + 4е 2Н2 + 4ОН (+) Анод (окисление): 2Н2О 4Н + О2 + 4е Суммарная реакция: 4Н2О + 2Н2О 2Н2 + О2 + 4ОН + 4Н или 2Н2О(ж) 2Н2(г) + О2(г) Н2 Источник постоянного тока О2 - В водных растворах солей с кислородсодержащим анионом электролизу подвергается вода + - - Na + SO4 2- H2O - +
 4) Электролиз водного раствора соли с галогенсодержащим анионом ( например NaCl ) (-) (+) Катод Анод H2O (-) Катод (восстановление): 2Н2О + 2е Н2 + 2ОН (+) Анод (окисление): 2Cl Cl2 + 2е Суммарная реакция: 2Н2О + 2Cl Cl2 + Н2 + 2ОН или 2Н2О(ж) + 2NaCl(р-р) 2Н2(г) + Cl2(г) + NaOH(р-р) Н2 Источник постоянного тока Сl2 - При электролизе водного раствора NaCl выделяется водород и хлор. При завершении выделения хлора раствор становится щелочным + - - Na + Сl - - - -
4) Электролиз водного раствора соли с галогенсодержащим анионом ( например NaCl ) (-) (+) Катод Анод H2O (-) Катод (восстановление): 2Н2О + 2е Н2 + 2ОН (+) Анод (окисление): 2Cl Cl2 + 2е Суммарная реакция: 2Н2О + 2Cl Cl2 + Н2 + 2ОН или 2Н2О(ж) + 2NaCl(р-р) 2Н2(г) + Cl2(г) + NaOH(р-р) Н2 Источник постоянного тока Сl2 - При электролизе водного раствора NaCl выделяется водород и хлор. При завершении выделения хлора раствор становится щелочным + - - Na + Сl - - - -
 5) Электролиз расплава NaCl(ж) Т > 800 градусов Цельсия) (-) (+) Катод Анод (-) Катод (восстановление) 2Na + 2е 2Na (+) Анод (окисление) 2Cl Cl2 + 2е Суммарная реакция: 2Na + 2е + 2Cl 2Na + Cl2 + 2е или 2Na(расплав) + 2Cl(расплав) 2Na(расплав) + Cl2(газ) Источник постоянного тока Сl2(газ) При электролизе расплава NaCl выделяются натрий и хлор. - - Na + Сl - - Na (ж) + - - - + + -
5) Электролиз расплава NaCl(ж) Т > 800 градусов Цельсия) (-) (+) Катод Анод (-) Катод (восстановление) 2Na + 2е 2Na (+) Анод (окисление) 2Cl Cl2 + 2е Суммарная реакция: 2Na + 2е + 2Cl 2Na + Cl2 + 2е или 2Na(расплав) + 2Cl(расплав) 2Na(расплав) + Cl2(газ) Источник постоянного тока Сl2(газ) При электролизе расплава NaCl выделяются натрий и хлор. - - Na + Сl - - Na (ж) + - - - + + -

 Электролиз CuSO4 с растворимым медным анодом (рафинирование меди в промышленности) Источник постоянного тока V=3v - – – SО4 Cu ионы 2+ _ _ + + + + + + + + (–) (+) Перенос меди с анода на катод (рафинирование) – – – – – – – Cu атомы Cu атомы Шлам примесей Cu – 2e Cu Окисление меди на аноде o 2+ – Cu + 2e Cu Восстановление ионов меди на катоде 2+ – o Чистая медь(катод) «Грязная» медь (анод) ЭЛ.ТОК
Электролиз CuSO4 с растворимым медным анодом (рафинирование меди в промышленности) Источник постоянного тока V=3v - – – SО4 Cu ионы 2+ _ _ + + + + + + + + (–) (+) Перенос меди с анода на катод (рафинирование) – – – – – – – Cu атомы Cu атомы Шлам примесей Cu – 2e Cu Окисление меди на аноде o 2+ – Cu + 2e Cu Восстановление ионов меди на катоде 2+ – o Чистая медь(катод) «Грязная» медь (анод) ЭЛ.ТОК
 Электролизом получают вещества ГАЗЫ ТВЕРДЫЕ И ЖИДКИЕ ПОКРЫТИЯ Водород 1. кислоты 1. медь Кислород 2.щелочи 2. хром Хлор 3. металлы (алюминий,медь) 3. никель Фтор,бром,иод 4.изотопы (тяжелая вода) 4. золото ГАЛЬВАНОПЛАСТИКА (наращивание слоя металла в нужном месте детали) ГАЛЬВАНОСТЕГИЯ (растворение металла,создание отверстий,рисунков и т.д.) Пример: определить выход меди (по току) при электролизе CuSO4, если сила тока I =5 ампер, время t=2 часа, масса полученного металла m=11,2 грамма Решение: по закону ФАРАДЕЯ теоретическая масса меди равна: М(г/моль) ×I(ампер)× t(сек.) 63,5 × 5 ×( 60 × 60 × 2) n (заряд иона) ×96500 кулон 2 × 96500 Выход меди = ( 11,2/11,84) ×100%= 94% m(теор.) = = = 11,84 гр.
Электролизом получают вещества ГАЗЫ ТВЕРДЫЕ И ЖИДКИЕ ПОКРЫТИЯ Водород 1. кислоты 1. медь Кислород 2.щелочи 2. хром Хлор 3. металлы (алюминий,медь) 3. никель Фтор,бром,иод 4.изотопы (тяжелая вода) 4. золото ГАЛЬВАНОПЛАСТИКА (наращивание слоя металла в нужном месте детали) ГАЛЬВАНОСТЕГИЯ (растворение металла,создание отверстий,рисунков и т.д.) Пример: определить выход меди (по току) при электролизе CuSO4, если сила тока I =5 ампер, время t=2 часа, масса полученного металла m=11,2 грамма Решение: по закону ФАРАДЕЯ теоретическая масса меди равна: М(г/моль) ×I(ампер)× t(сек.) 63,5 × 5 ×( 60 × 60 × 2) n (заряд иона) ×96500 кулон 2 × 96500 Выход меди = ( 11,2/11,84) ×100%= 94% m(теор.) = = = 11,84 гр.
 Д И С П Е Р С Н Ы Е С И С Т Е М Ы Лекция 9
Д И С П Е Р С Н Ы Е С И С Т Е М Ы Лекция 9
 ДИСПЕРСНЫЕ СИСТЕМЫ Дисперсная система – это гетерогенная система, в которой одна фаза раздроблена до мелких частиц, распределенных в газе, жидкости или однородном твердом теле. Пузырьки газа в жидкости Частички твердого тела в жидкости Капельки масла в воде г/ж т/ж ж/ж Пузырьки газа в твердом теле Капельки жидкости в твердом теле Кристаллы одного твердого вещества в другом г/т ж/т т/т 1) Частички газообразной, жидкой или твердой фазы в жидкости 2) Частички газообразной, жидкой или твердой фазы в твердом теле 2.
ДИСПЕРСНЫЕ СИСТЕМЫ Дисперсная система – это гетерогенная система, в которой одна фаза раздроблена до мелких частиц, распределенных в газе, жидкости или однородном твердом теле. Пузырьки газа в жидкости Частички твердого тела в жидкости Капельки масла в воде г/ж т/ж ж/ж Пузырьки газа в твердом теле Капельки жидкости в твердом теле Кристаллы одного твердого вещества в другом г/т ж/т т/т 1) Частички газообразной, жидкой или твердой фазы в жидкости 2) Частички газообразной, жидкой или твердой фазы в твердом теле 2.
 3) Частички жидкой или твердой фазы в газе Частички твердого тела в газе Капельки воды в газе т/г ж/г Г/Ж Газовые эмульсии, пены Газированная вода, мыльная пена. Ж/Ж Эмульсии, кремы Молоко, майонез, краски, лаки. Т/Ж Золи, суспензии, гели, пасты Краски, золи металлов. Г/Т Пористые тела, твердые пены Хлеб, сыр, пенопласты. Ж/Т Пористые тела Древесина Т/Т Сплавы, твердые золи Чугун, сталь, бетон, цемент Ж/Г Туман, капли Аэрозоли, моторн. топливо Т/Г Порошки, пыль, дым Аэрозоли, пыль в воздухе Дисперсная фаза (что) Дисперсионная среда (в чем) ПРИМЕРЫ 3.
3) Частички жидкой или твердой фазы в газе Частички твердого тела в газе Капельки воды в газе т/г ж/г Г/Ж Газовые эмульсии, пены Газированная вода, мыльная пена. Ж/Ж Эмульсии, кремы Молоко, майонез, краски, лаки. Т/Ж Золи, суспензии, гели, пасты Краски, золи металлов. Г/Т Пористые тела, твердые пены Хлеб, сыр, пенопласты. Ж/Т Пористые тела Древесина Т/Т Сплавы, твердые золи Чугун, сталь, бетон, цемент Ж/Г Туман, капли Аэрозоли, моторн. топливо Т/Г Порошки, пыль, дым Аэрозоли, пыль в воздухе Дисперсная фаза (что) Дисперсионная среда (в чем) ПРИМЕРЫ 3.
 ВИДЫ ДИСПЕРСНЫХ СИСТЕМ Золи – высокодисперсные системы Т/Ж с размером твердых частиц в жидкой дисперсионной среде 10 - 10 м Коллоидный раствор или золь частичек золота (Au) в воде Суспензии – грубодисперсные системы Т/Ж с размером твердых частиц в жидкой дисперсионной среде > 10 м или 0.01 мм -9 -7 -7 «Цементный раствор» или суспензия частичек цемента в воде Пасты – концентрированные суспензии, например, зубная паста – смесь порошка мела (СаСО3), крахмального клейстера, глицерина (трехатомного спирта) и ПАВ 4.
ВИДЫ ДИСПЕРСНЫХ СИСТЕМ Золи – высокодисперсные системы Т/Ж с размером твердых частиц в жидкой дисперсионной среде 10 - 10 м Коллоидный раствор или золь частичек золота (Au) в воде Суспензии – грубодисперсные системы Т/Ж с размером твердых частиц в жидкой дисперсионной среде > 10 м или 0.01 мм -9 -7 -7 «Цементный раствор» или суспензия частичек цемента в воде Пасты – концентрированные суспензии, например, зубная паста – смесь порошка мела (СаСО3), крахмального клейстера, глицерина (трехатомного спирта) и ПАВ 4.
 Пены – грубодисперсные системы Г/Ж 5.
Пены – грубодисперсные системы Г/Ж 5.
 Эмульсии – грубодисперсные системы Ж/Ж. Прямые эмульсии - капельки масла в воде М/В, обратные эмульсии – капельки воды в масле В/М. Пример прямой эмульсии М/В: молоко Пример обратной эмульсии В/М: нефть, маргарин, сливочное масло, крем в торте, косметические кремы Гидрофильными и гидрофобными эмульгаторами являются ПАВ ГИДРОФИЛЬНЫЕ -- вещества «любящие» воду ГИДРОФОБНЫЕ-- «водоотталкивающие» вещества 6.
Эмульсии – грубодисперсные системы Ж/Ж. Прямые эмульсии - капельки масла в воде М/В, обратные эмульсии – капельки воды в масле В/М. Пример прямой эмульсии М/В: молоко Пример обратной эмульсии В/М: нефть, маргарин, сливочное масло, крем в торте, косметические кремы Гидрофильными и гидрофобными эмульгаторами являются ПАВ ГИДРОФИЛЬНЫЕ -- вещества «любящие» воду ГИДРОФОБНЫЕ-- «водоотталкивающие» вещества 6.
 КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Газ, жидкость, твердое тело с молекулярной, атомной или ионной степенью раздробленности являются гомогенными системами. Они выполняют функцию дисперсионные среды В дисперсной системе между дисперсной фазой и дисперсионной средой существует поверхность раздела фаз. Класс Размеры частиц, м Представители Высокодисперсные 10 - 10 Золь (золото в воде) Среднедисперсные 10 - 10 Сажа, пудра Грубодисперсные > 10 Цемент, туман -9 -7 -7 -5 -5 7.
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ ПО РАЗМЕРУ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ Газ, жидкость, твердое тело с молекулярной, атомной или ионной степенью раздробленности являются гомогенными системами. Они выполняют функцию дисперсионные среды В дисперсной системе между дисперсной фазой и дисперсионной средой существует поверхность раздела фаз. Класс Размеры частиц, м Представители Высокодисперсные 10 - 10 Золь (золото в воде) Среднедисперсные 10 - 10 Сажа, пудра Грубодисперсные > 10 Цемент, туман -9 -7 -7 -5 -5 7.
 УДЕЛЬНАЯ ПОВЕРХНОСТЬ РАЗДЕЛА ФАЗ Пример. Если раздробить 1 горной породы на частицы размером 1 , то поверхность горной породы возрастет с 6 до 6000 , т.е. в 1000 раз 8.
УДЕЛЬНАЯ ПОВЕРХНОСТЬ РАЗДЕЛА ФАЗ Пример. Если раздробить 1 горной породы на частицы размером 1 , то поверхность горной породы возрастет с 6 до 6000 , т.е. в 1000 раз 8.
 ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Поверхностное натяжение это энергия затрачиваемая на увеличение единицы площади жидкого или твердого тела Слой молекул воды на поверхности жидкой капли 9.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Поверхностное натяжение это энергия затрачиваемая на увеличение единицы площади жидкого или твердого тела Слой молекул воды на поверхности жидкой капли 9.
 ПОВЕРХНОСТНЫЕ ПРОЦЕССЫ Любое раздробленное жидкое или твердое тело стремиться сократить свою поверхность под действием сил межмолекулярного (атомного, ионного) притяжения, существующего на границе раздела фаз ЖИДКОСТЬ ТВЕРДОЕ ТЕЛО Самопроизвольный процесс слияния 6S1 > S2 Самопроизвольный процесс слипания 10.
ПОВЕРХНОСТНЫЕ ПРОЦЕССЫ Любое раздробленное жидкое или твердое тело стремиться сократить свою поверхность под действием сил межмолекулярного (атомного, ионного) притяжения, существующего на границе раздела фаз ЖИДКОСТЬ ТВЕРДОЕ ТЕЛО Самопроизвольный процесс слияния 6S1 > S2 Самопроизвольный процесс слипания 10.
 АДГЕЗИЯ Адгезия (прилипание) – процесс межмолекулярного притяжения поверхностей соприкасающихся тел. При адгезии сохраняется граница раздела фаз между а) твердыми телами б) твердым телом и жидкостью Слипание частиц порошка Стекло Вода Парафин Вода пластмасса Вода 11.
АДГЕЗИЯ Адгезия (прилипание) – процесс межмолекулярного притяжения поверхностей соприкасающихся тел. При адгезии сохраняется граница раздела фаз между а) твердыми телами б) твердым телом и жидкостью Слипание частиц порошка Стекло Вода Парафин Вода пластмасса Вода 11.
 АДСОРБЦИЯ Адсорбция – процесс концентрирования вещества на границе раздела фаз Адсорбция на границе твердое тело – газ (Т/Г) Адсорбтив Адсорбент Адсорбат Адсорбент – поверхность твердого тела или жидкости, на которой концентрируются молекулы вещества из газовой или жидкой фазы Адсорбтив – молекулы вещества в объеме газовой или жидкой фазы до их адсорбции на поверхности адсорбента Адсорбат – молекулы адсорбированного вещества на поверхности адсорбента 12.
АДСОРБЦИЯ Адсорбция – процесс концентрирования вещества на границе раздела фаз Адсорбция на границе твердое тело – газ (Т/Г) Адсорбтив Адсорбент Адсорбат Адсорбент – поверхность твердого тела или жидкости, на которой концентрируются молекулы вещества из газовой или жидкой фазы Адсорбтив – молекулы вещества в объеме газовой или жидкой фазы до их адсорбции на поверхности адсорбента Адсорбат – молекулы адсорбированного вещества на поверхности адсорбента 12.
 ПРИЧИНЫ ФИЗИЧЕСКОЙ АДСОРБЦИИ Физическая адсорбция обусловлена силами притяжения между молекулами адсорбата и адсорбента. Их называют силами Ван-дер-Ваальса. Модели межмолекулярных взаимодействий 1) ориентационное (диполь – диполь) 2) индукционное (диполь-- неполярная молекула) 3) дисперсионное (двух неполярных молекул) 13.
ПРИЧИНЫ ФИЗИЧЕСКОЙ АДСОРБЦИИ Физическая адсорбция обусловлена силами притяжения между молекулами адсорбата и адсорбента. Их называют силами Ван-дер-Ваальса. Модели межмолекулярных взаимодействий 1) ориентационное (диполь – диполь) 2) индукционное (диполь-- неполярная молекула) 3) дисперсионное (двух неполярных молекул) 13.
 МОНОМОЛЕКУЛЯРНАЯ АДСОРБЦИЯ Теория мономолекулярной адсорбции опирается на следующие положения: адсорбция происходит не на всей поверхности, а на отдельных участках поверхности, называемых активными центрами; пределом процесса адсорбции является заполнение адсорбатом всех активных центров адсорбента А С, моль/л – концентрация адсорбтива в объеме жидкой или газовой фазы Изотерма (Т = const) мономолекулярной адсорбции А, моль/м 2 Количество адсорбата на единице поверхности адсорбента 14. С
МОНОМОЛЕКУЛЯРНАЯ АДСОРБЦИЯ Теория мономолекулярной адсорбции опирается на следующие положения: адсорбция происходит не на всей поверхности, а на отдельных участках поверхности, называемых активными центрами; пределом процесса адсорбции является заполнение адсорбатом всех активных центров адсорбента А С, моль/л – концентрация адсорбтива в объеме жидкой или газовой фазы Изотерма (Т = const) мономолекулярной адсорбции А, моль/м 2 Количество адсорбата на единице поверхности адсорбента 14. С
 ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ПРОЦЕССОВ АДСОРБЦИИ Использование углеволокнистых материалов для очистки воздуха промышленных предприятий от вредных примесей Средства индивидуальной защиты (противогазы) Средства очистки воды от вредных примесей 15.
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ПРОЦЕССОВ АДСОРБЦИИ Использование углеволокнистых материалов для очистки воздуха промышленных предприятий от вредных примесей Средства индивидуальной защиты (противогазы) Средства очистки воды от вредных примесей 15.
 ПОВЕРХНОСТНО АКТИВНЫЕ ВЕЩЕСТВА (ПАВ) СН3(СН2)СН2СОО Na СН3(СН2)СН2СОО + Na + - Мыло – соль органической кислоты + - Ионы соли в воде Модель ПАВ – анион органической кислоты + + + + + + + + + + + + + + + + + воздух вода Мицелла ПАВ Неполярная группа полярная группа ПАВ «обманывает» полярные молекулы воды, закрывая неполярные группы Неполярная среда Полярная среда Адсорбция на границе раздела жидкость - газ 16.
ПОВЕРХНОСТНО АКТИВНЫЕ ВЕЩЕСТВА (ПАВ) СН3(СН2)СН2СОО Na СН3(СН2)СН2СОО + Na + - Мыло – соль органической кислоты + - Ионы соли в воде Модель ПАВ – анион органической кислоты + + + + + + + + + + + + + + + + + воздух вода Мицелла ПАВ Неполярная группа полярная группа ПАВ «обманывает» полярные молекулы воды, закрывая неполярные группы Неполярная среда Полярная среда Адсорбция на границе раздела жидкость - газ 16.
 СТИРКА 1 2 3 Грязная ткань Мыльная вода с грязью 17. Чистая ткань ткань Чистая мыльная вода
СТИРКА 1 2 3 Грязная ткань Мыльная вода с грязью 17. Чистая ткань ткань Чистая мыльная вода
 18.
18.
 19.
19.
 20.
20.
 А Н А Л И Т И Ч Е С К А Я Х И М И Я
А Н А Л И Т И Ч Е С К А Я Х И М И Я


 Схема работы масс-спектрометра
Схема работы масс-спектрометра
 Масс-спектр образца меди
Масс-спектр образца меди
 Масс-спектрометрический анализ поверхности МАРСА
Масс-спектрометрический анализ поверхности МАРСА
 Определение алкоголя в организме водителя
Определение алкоголя в организме водителя
 Универсальный иономер
Универсальный иономер


















