Химия гидросферы Содержание


































 Химия гидросферы
Химия гидросферы
 Содержание I. Вода – уникальное вещество 1. Строение воды 2. Состав воды 3. Свойства воды a. Физические свойства воды b. Химические свойства воды c. Чудесные свойства воды 4. Вода как растворитель 5. Среда водных растворов 6. Круговорот воды в природе II. Вода в жизни людей 1. Природные воды 2. Питьевая вода 3. Загрязнение воды 4. Очистка сточных вод 5. Охрана водных ресурсов
Содержание I. Вода – уникальное вещество 1. Строение воды 2. Состав воды 3. Свойства воды a. Физические свойства воды b. Химические свойства воды c. Чудесные свойства воды 4. Вода как растворитель 5. Среда водных растворов 6. Круговорот воды в природе II. Вода в жизни людей 1. Природные воды 2. Питьевая вода 3. Загрязнение воды 4. Очистка сточных вод 5. Охрана водных ресурсов
 I. Вода – уникальное вещество Строение воды Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр.
I. Вода – уникальное вещество Строение воды Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр.
 Состав воды 1. Изотопный состав воды: Вода H 2 O на 99, 73 % состоит из 1 H 2 16 O, но в природе встречается еще дейтерий (стабилен) 2 D и тритий ( 3 T), а если принять во внимание, что кроме 16 O есть еще 17 O и 18 O, то в природе встречается девять разновидностей воды.
Состав воды 1. Изотопный состав воды: Вода H 2 O на 99, 73 % состоит из 1 H 2 16 O, но в природе встречается еще дейтерий (стабилен) 2 D и тритий ( 3 T), а если принять во внимание, что кроме 16 O есть еще 17 O и 18 O, то в природе встречается девять разновидностей воды.
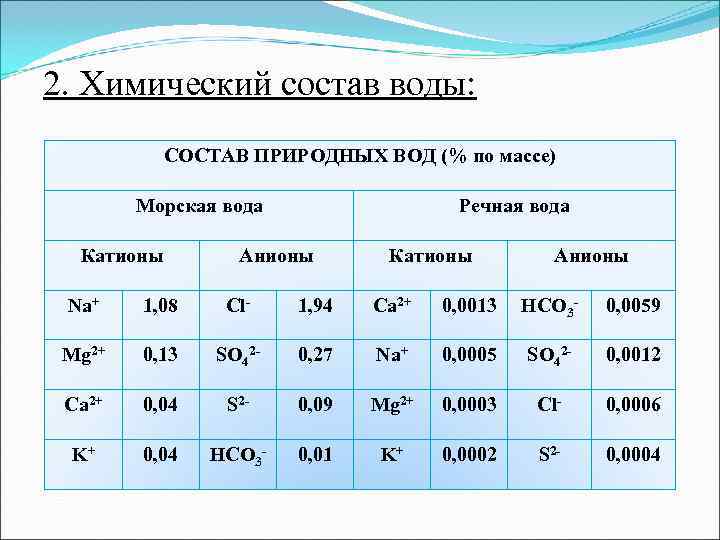
 2. Химический состав воды: СОСТАВ ПРИРОДНЫХ ВОД (% по массе) Морская вода Речная вода Катионы Анионы Na+ 1, 08 Cl- 1, 94 Ca 2+ 0, 0013 HCO 3 - 0, 0059 Mg 2+ 0, 13 SO 42 - 0, 27 Na+ 0, 0005 SO 42 - 0, 0012 Ca 2+ 0, 04 S 2 - 0, 09 Mg 2+ 0, 0003 Cl- 0, 0006 K+ 0, 04 HCO 3 - 0, 01 K+ 0, 0002 S 2 - 0, 0004
2. Химический состав воды: СОСТАВ ПРИРОДНЫХ ВОД (% по массе) Морская вода Речная вода Катионы Анионы Na+ 1, 08 Cl- 1, 94 Ca 2+ 0, 0013 HCO 3 - 0, 0059 Mg 2+ 0, 13 SO 42 - 0, 27 Na+ 0, 0005 SO 42 - 0, 0012 Ca 2+ 0, 04 S 2 - 0, 09 Mg 2+ 0, 0003 Cl- 0, 0006 K+ 0, 04 HCO 3 - 0, 01 K+ 0, 0002 S 2 - 0, 0004
 Содержание различных веществ в пресных водах меняется в зависимости от местоположения водоема. Химический состав рек, озер и грунтовых вод зависит от состава дождевых осадков и сухих атмосферных выпадений, процессов разрушения горных пород и разложения органического вещества в почвах, различного вовлечения в биологические процессы. Кроме того, сильное влияние на пресные воды может оказывать деятельность человека. Разрушая горные породы, пресные воды обогащаются содержащимися в них элементами. Однако, несмотря на то, что почти все катионы в речной воде появляются в результате выветривания, ионный состав растворенных веществ в пресной воде принципиально отличается от состава континентальной коры. Это особенно заметно для алюминия и железа. Причиной низкой концентрации в природных водах этих достаточно распространенных в земной коре элементов является их склонность к образованию малорастворимых соединений. В то же время катионы с низкими зарядами легко переходят в раствор.
Содержание различных веществ в пресных водах меняется в зависимости от местоположения водоема. Химический состав рек, озер и грунтовых вод зависит от состава дождевых осадков и сухих атмосферных выпадений, процессов разрушения горных пород и разложения органического вещества в почвах, различного вовлечения в биологические процессы. Кроме того, сильное влияние на пресные воды может оказывать деятельность человека. Разрушая горные породы, пресные воды обогащаются содержащимися в них элементами. Однако, несмотря на то, что почти все катионы в речной воде появляются в результате выветривания, ионный состав растворенных веществ в пресной воде принципиально отличается от состава континентальной коры. Это особенно заметно для алюминия и железа. Причиной низкой концентрации в природных водах этих достаточно распространенных в земной коре элементов является их склонность к образованию малорастворимых соединений. В то же время катионы с низкими зарядами легко переходят в раствор.
 Физические свойства воды Н 2 О Вода обладает необычными физическими свойствами: 1. Наибольшая ее плотность наблюдается при температуре 4°С. 2. Температура замерзания воды 0 °С. 3. Температура кипения воды 100 °С. 4. Не имеет вкуса, цвета и запаха. 5. Усваивается живыми организмами. 6. В состав обычной воды Н 2 О имеется небольшое количество тяжелой воды D 2 O и совсем незначительное количество сверхтяжелой воды Т, О. В молекулу тяжелой воды вместо обыкновенного водорода Н — протия входит его тяжелый изотоп D — дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т — тритий. В природной воде на 1000 молекул Н 2 О приходится две молекулы D 2 O и на одну молекулу Т 2 О — 1019 молекул Н 2 О. 7. sp 3 - гибридизация.
Физические свойства воды Н 2 О Вода обладает необычными физическими свойствами: 1. Наибольшая ее плотность наблюдается при температуре 4°С. 2. Температура замерзания воды 0 °С. 3. Температура кипения воды 100 °С. 4. Не имеет вкуса, цвета и запаха. 5. Усваивается живыми организмами. 6. В состав обычной воды Н 2 О имеется небольшое количество тяжелой воды D 2 O и совсем незначительное количество сверхтяжелой воды Т, О. В молекулу тяжелой воды вместо обыкновенного водорода Н — протия входит его тяжелый изотоп D — дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т — тритий. В природной воде на 1000 молекул Н 2 О приходится две молекулы D 2 O и на одну молекулу Т 2 О — 1019 молекул Н 2 О. 7. sp 3 - гибридизация.
 Химические свойства воды Экспериментально установлено, что протон в воде может быть только гидратированным. Гидратация не исчерпывается реакцией: H+ + H 2 O = H 3 O+. Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4 -мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи - спонтанные, короткоживущие, быстро рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
Химические свойства воды Экспериментально установлено, что протон в воде может быть только гидратированным. Гидратация не исчерпывается реакцией: H+ + H 2 O = H 3 O+. Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4 -мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи - спонтанные, короткоживущие, быстро рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
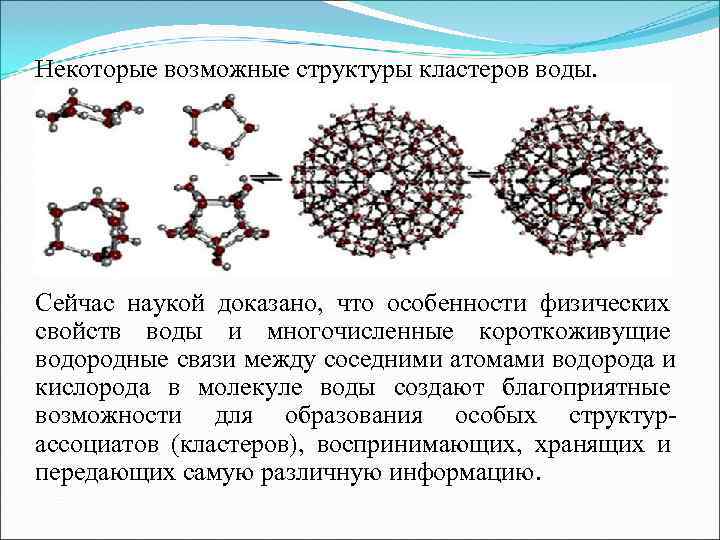
 Некоторые возможные структуры кластеров воды. Сейчас наукой доказано, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур- ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.
Некоторые возможные структуры кластеров воды. Сейчас наукой доказано, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур- ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.
 В 1999 г. известный российский исследователь воды С. В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С. В. Зенин, Б. В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С. В. Зенин с соавт. , 1998) и протонного магнитного резонанса (С. В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С. В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
В 1999 г. известный российский исследователь воды С. В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С. В. Зенин, Б. В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С. В. Зенин с соавт. , 1998) и протонного магнитного резонанса (С. В. Зенин, 1993) построена и доказана геометрическая модель основного стабильного структурного образования из молекул воды (структурированная вода), а затем (С. В. Зенин, 2004) получено изображение с помощью контрастно-фазового микроскопа этих структур.
 Чудесные свойства воды Ученые насчитали у воды около 80 уникальных свойств. Одно из самых замечательных – ее высокая растворяющая способность, благодаря которой огромное количество разнообразных веществ переносится по любым системам биосферы и доставляется к каждой клетке любого организма. Другое чудесное свойство воды, над которым продолжают ломать голову ученые, состоит в том, что она расширяется как при нагревании, так и при охлаждении ниже 4 °С. Благодаря этому в водоемах даже под сплошным ледяным панцирем температура воды у дна не опускается ниже 4 °С, а потому жизнь обитателей водоемов в зимнее время не прекращается. Важнейшим условием существования жизни на Земле является способность воды за счет капиллярных сил подниматься по узким почвенным каналам и сосудам растений. Вода обладает самой высокой теплоемкостью из всех известных веществ. Именно благодаря этому Мировой океан поддерживает среднегодовую температуру Земли в пределах 15°С.
Чудесные свойства воды Ученые насчитали у воды около 80 уникальных свойств. Одно из самых замечательных – ее высокая растворяющая способность, благодаря которой огромное количество разнообразных веществ переносится по любым системам биосферы и доставляется к каждой клетке любого организма. Другое чудесное свойство воды, над которым продолжают ломать голову ученые, состоит в том, что она расширяется как при нагревании, так и при охлаждении ниже 4 °С. Благодаря этому в водоемах даже под сплошным ледяным панцирем температура воды у дна не опускается ниже 4 °С, а потому жизнь обитателей водоемов в зимнее время не прекращается. Важнейшим условием существования жизни на Земле является способность воды за счет капиллярных сил подниматься по узким почвенным каналам и сосудам растений. Вода обладает самой высокой теплоемкостью из всех известных веществ. Именно благодаря этому Мировой океан поддерживает среднегодовую температуру Земли в пределах 15°С.
 Вода как растворитель Вода является лучшим растворителем для твердых, жидких и газообразных веществ. Примером служит растворение как органических (сахар) так и неорганических (соли) веществ. Вода хорошо растворяет газы (особенно при низких температурах), главным образом кислород, азот, диоксид углерода, сероводород. Количество кислорода иногда достигает 6 мг/л. В минеральных водах типа «Нарзан» общее содержание газов может составлять до 0, 1%. В природной воде присутствуют гумусовые вещества - сложные органические соединения, образующиеся в результате неполного распада остатков растительных и животных тканей, а также соединения типа белков, сахаров, спиртов.
Вода как растворитель Вода является лучшим растворителем для твердых, жидких и газообразных веществ. Примером служит растворение как органических (сахар) так и неорганических (соли) веществ. Вода хорошо растворяет газы (особенно при низких температурах), главным образом кислород, азот, диоксид углерода, сероводород. Количество кислорода иногда достигает 6 мг/л. В минеральных водах типа «Нарзан» общее содержание газов может составлять до 0, 1%. В природной воде присутствуют гумусовые вещества - сложные органические соединения, образующиеся в результате неполного распада остатков растительных и животных тканей, а также соединения типа белков, сахаров, спиртов.
 Среда водных растворов Большая часть почвенных вод, питающих реки, и грунтовые воды имеют среду, близкую к нейтральной. Подкисление пресных вод может происходить в результате поступления дождевой воды, обычно имеющей слабокислотную реакцию (за счет растворения диоксида углерода и других газов), а также разложения органических веществ с образованием карбоновых кислот. Несмотря на все большее распространение кислотных дождей, подкисленные пресные воды встречаются не очень часто. Это связано с расходом катионов водорода в процессах разрушения некоторых минералов. Подкисление пресной воды особенно заметно в горных областях с большим количеством дождевых осадков. С 1930 до 1975 величина р. Н в некоторых озерах на северо-востоке США уменьшилась с 6, 7 до 5, 1, что вызвало гибель рыбы и других животных. Появление щелочных вод менее вероятно, так как они нейтрализуются такими атмосферными газами, как диоксид углерода и диоксид серы. Тем не менее реки с щелочной средой известны, например, на Ямайке. Обычно это — результат загрязнения воды отходами с высокими значениями р. Н.
Среда водных растворов Большая часть почвенных вод, питающих реки, и грунтовые воды имеют среду, близкую к нейтральной. Подкисление пресных вод может происходить в результате поступления дождевой воды, обычно имеющей слабокислотную реакцию (за счет растворения диоксида углерода и других газов), а также разложения органических веществ с образованием карбоновых кислот. Несмотря на все большее распространение кислотных дождей, подкисленные пресные воды встречаются не очень часто. Это связано с расходом катионов водорода в процессах разрушения некоторых минералов. Подкисление пресной воды особенно заметно в горных областях с большим количеством дождевых осадков. С 1930 до 1975 величина р. Н в некоторых озерах на северо-востоке США уменьшилась с 6, 7 до 5, 1, что вызвало гибель рыбы и других животных. Появление щелочных вод менее вероятно, так как они нейтрализуются такими атмосферными газами, как диоксид углерода и диоксид серы. Тем не менее реки с щелочной средой известны, например, на Ямайке. Обычно это — результат загрязнения воды отходами с высокими значениями р. Н.
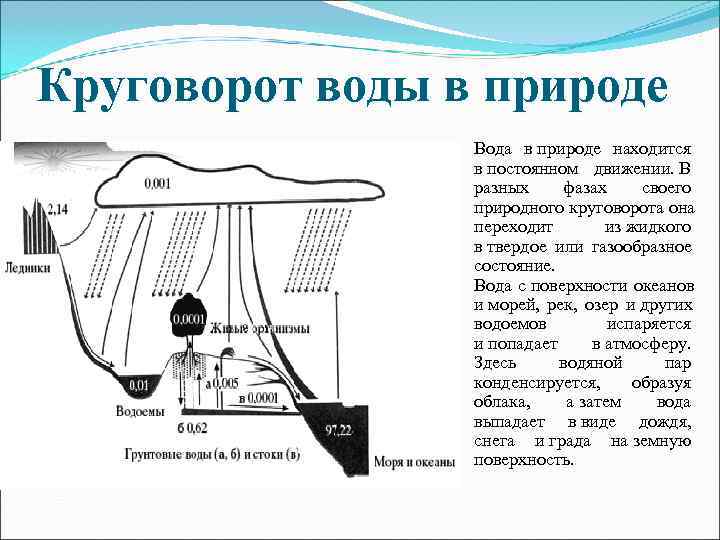
 Круговорот воды в природе Вода в природе находится в постоянном движении. В разных фазах своего природного круговорота она переходит из жидкого в твердое или газообразное состояние. Вода с поверхности океанов и морей, рек, озер и других водоемов испаряется и попадает в атмосферу. Здесь водяной пар конденсируется, образуя облака, а затем вода выпадает в виде дождя, снега и града на земную поверхность.
Круговорот воды в природе Вода в природе находится в постоянном движении. В разных фазах своего природного круговорота она переходит из жидкого в твердое или газообразное состояние. Вода с поверхности океанов и морей, рек, озер и других водоемов испаряется и попадает в атмосферу. Здесь водяной пар конденсируется, образуя облака, а затем вода выпадает в виде дождя, снега и града на земную поверхность.
 Несмотря на короткое время пребывания в атмосфере (около 10 дней), вода переносится на значительное расстояние — до 1000 км, где возвращается либо в океаны, либо на континенты. Воды морей и океанов содержат, в среднем, 3, 5% растворенных веществ. В основном это соли — хлориды и сульфаты натрия и магния, которые находятся в морской воде в виде ионов. Относительные концентрации основных ионов морской воды во всех океанах Земли отличаются удивительным постоянством. Помимо ионов, морская вода содержит растворенные газы и органические соединения. Большая часть дождевых осадков, попадающих на континенты, просачивается через отложения, пористые или раздробленные породы, образуя подземные воды. Остальная вода течет по поверхности в виде рек или вновь испаряется в атмосферу. Вода, стекающая по поверхности суши, захватывает многие химические вещества. Речные воды содержат ионы, нейтральные молекулы, взвешенные частицы и существенно отличаются по составу от вод Мирового океана. Солей здесь намного меньше.
Несмотря на короткое время пребывания в атмосфере (около 10 дней), вода переносится на значительное расстояние — до 1000 км, где возвращается либо в океаны, либо на континенты. Воды морей и океанов содержат, в среднем, 3, 5% растворенных веществ. В основном это соли — хлориды и сульфаты натрия и магния, которые находятся в морской воде в виде ионов. Относительные концентрации основных ионов морской воды во всех океанах Земли отличаются удивительным постоянством. Помимо ионов, морская вода содержит растворенные газы и органические соединения. Большая часть дождевых осадков, попадающих на континенты, просачивается через отложения, пористые или раздробленные породы, образуя подземные воды. Остальная вода течет по поверхности в виде рек или вновь испаряется в атмосферу. Вода, стекающая по поверхности суши, захватывает многие химические вещества. Речные воды содержат ионы, нейтральные молекулы, взвешенные частицы и существенно отличаются по составу от вод Мирового океана. Солей здесь намного меньше.
 II. Вода в жизни людей Природные воды Происходящее в почвах процессы окисления органических веществ вызывают расход кислорода и выделение углекислоты, поэтому в воде при фильтрации её через почву возрастает содержание углекислоты, что приводит к обогащению природных вод карбонатами кальция, магния и железа, с образованием растворимых в воде кислых солей типа: Ca. CO 3 + H 2 O + CO 2 Ca(HCO 3)2. Бикарбонаты присутствуют почти во всех водах в тех или иных количествах. Большую роль в формировании химического состава воды играют подстилающие почву грунты, с которыми вода вступает в соприкосновение, фильтруясь и растворяя некоторые минералы. Особенно интенсивно обогащают воды осадочные породы, такие, как известняки, доломиты, мергели, гипс, каменная соль и др. В свою очередь почва и породы обладают способностью адсорбировать из природной воды некоторые ионы ( например, Ca 2+ , Mg 2+ ), замещая их эквивалентным количество других ионов ( Na+, K+ ).
II. Вода в жизни людей Природные воды Происходящее в почвах процессы окисления органических веществ вызывают расход кислорода и выделение углекислоты, поэтому в воде при фильтрации её через почву возрастает содержание углекислоты, что приводит к обогащению природных вод карбонатами кальция, магния и железа, с образованием растворимых в воде кислых солей типа: Ca. CO 3 + H 2 O + CO 2 Ca(HCO 3)2. Бикарбонаты присутствуют почти во всех водах в тех или иных количествах. Большую роль в формировании химического состава воды играют подстилающие почву грунты, с которыми вода вступает в соприкосновение, фильтруясь и растворяя некоторые минералы. Особенно интенсивно обогащают воды осадочные породы, такие, как известняки, доломиты, мергели, гипс, каменная соль и др. В свою очередь почва и породы обладают способностью адсорбировать из природной воды некоторые ионы ( например, Ca 2+ , Mg 2+ ), замещая их эквивалентным количество других ионов ( Na+, K+ ).
 Подпочвенными водами легче всего растворяются хлориды и сульфаты натрия и магния, хлорид кальция. Силикатные и алюмосиликатны породы (граниты, кварцевые породы и т. д. ) почти нерастворимы в воде и содержащей углекислоту и органические кислоты. Наиболее распространенными в природных водах являются следующие ионы : Cl- , SO 2 -4 , HCO-3 , CO 2 -3 , Na+ , Mg 2+ , Ca 2+ , H+. Ион хлора присутствует почти во всех природных водоемах, причем его содержание меняется в очень широких пределах. Сульфат - ион также распространен повсеместно. Основным источником растворенных в воде сульфатов является гипс. В подземных водах с содержанием сульфат - иона обычно выше, чем в воде рек и озер. Из ионов щелочных металлов в природных водоемах в наибольших количествах находится ион натрия, который является характерным ионом сильноминерализованных вод морей и океанов.
Подпочвенными водами легче всего растворяются хлориды и сульфаты натрия и магния, хлорид кальция. Силикатные и алюмосиликатны породы (граниты, кварцевые породы и т. д. ) почти нерастворимы в воде и содержащей углекислоту и органические кислоты. Наиболее распространенными в природных водах являются следующие ионы : Cl- , SO 2 -4 , HCO-3 , CO 2 -3 , Na+ , Mg 2+ , Ca 2+ , H+. Ион хлора присутствует почти во всех природных водоемах, причем его содержание меняется в очень широких пределах. Сульфат - ион также распространен повсеместно. Основным источником растворенных в воде сульфатов является гипс. В подземных водах с содержанием сульфат - иона обычно выше, чем в воде рек и озер. Из ионов щелочных металлов в природных водоемах в наибольших количествах находится ион натрия, который является характерным ионом сильноминерализованных вод морей и океанов.
 Помимо веществ ионного состава природные воды содержат также газы и органические и грубодисперсные взвеси. Наиболее распространенными в природных водах газами являются кислород и углекислый газ. Источником кислорода является атмосфера, углекислоты - биохимические процессы, происходящие в глубинных слоях земной коры, углекислота из атмосферы. Из органических веществ, попадающих извне, следует отметить гуминовые вещества, вымываемые водой из гумусовых почв (торфяников, сапропелитов и др. ). Большая часть из них находится в коллоидном состоянии. В самих водоемах органические вещества непрерывно поступают в воду в результате отмирания различных водных организмов. При этом часть из них остается взвешенной в воде, а другая опускается на дно, где происходит их распад. Грубодисперсные примеси, обуславливающие мутность природных вод, представляют собой вещества минерального и органического происхождения, смываемые с верхнего покрова земли дождями или талыми водами во время весенних паводков.
Помимо веществ ионного состава природные воды содержат также газы и органические и грубодисперсные взвеси. Наиболее распространенными в природных водах газами являются кислород и углекислый газ. Источником кислорода является атмосфера, углекислоты - биохимические процессы, происходящие в глубинных слоях земной коры, углекислота из атмосферы. Из органических веществ, попадающих извне, следует отметить гуминовые вещества, вымываемые водой из гумусовых почв (торфяников, сапропелитов и др. ). Большая часть из них находится в коллоидном состоянии. В самих водоемах органические вещества непрерывно поступают в воду в результате отмирания различных водных организмов. При этом часть из них остается взвешенной в воде, а другая опускается на дно, где происходит их распад. Грубодисперсные примеси, обуславливающие мутность природных вод, представляют собой вещества минерального и органического происхождения, смываемые с верхнего покрова земли дождями или талыми водами во время весенних паводков.
 Питьевая вода Не плюй в колодец – пригодится: воды напиться! (народная мудрость) Питьевая вода и чистая вода — не синонимы. Чистая вода, в отличие от воды питьевой, неопределенный термин. Для химика «чистая вода» — дистиллят, свободный от примесей; для рыболова — вода, в которой водится рыба; для микробиолога — вода, в которой могут обитать бактерии, а для производственника — вода, которая годится для производственных процессов. Питьевая же вода всегда должна отвечать определённым установленным стандартам и ГОСТам.
Питьевая вода Не плюй в колодец – пригодится: воды напиться! (народная мудрость) Питьевая вода и чистая вода — не синонимы. Чистая вода, в отличие от воды питьевой, неопределенный термин. Для химика «чистая вода» — дистиллят, свободный от примесей; для рыболова — вода, в которой водится рыба; для микробиолога — вода, в которой могут обитать бактерии, а для производственника — вода, которая годится для производственных процессов. Питьевая же вода всегда должна отвечать определённым установленным стандартам и ГОСТам.
 Существует несколько стандартов на питьевую воду: -Российский стандарт, определяемый соответствующими нормами и ГОСТами; -Стандарт ВОЗ (Всемирной организации здравоохранения); -Стандарт США и стандарта стран Европейского союза (ЕС). Российский ГОСТ на питьевую воду действует с 1982 г. Сейчас он дополнен более новым нормативом — Санитарные правила и нормы (Сан. Пи. Н) 2. 1. 4. 550 -96 «Питьевая вода» . В соответствии с действующими стандартами и нормами под термином питьевая вода высокого качества подразумевается: v вода с соответствующими органолептическими показателями — прозрачная, без запаха и с приятным вкусом; v вода с р. Н = 7— 7, 5 и жесткостью не выше 7 ммоль/л; v вода, в которой суммарное количество полезных минералов не более 1 г/л; v вода, в которой вредные химические примеси либо составляют десятые-сотые доли их ПДК, либо вообще отсутствуют (то есть их концентрации настолько малы, что лежат за гранью возможностей современных аналитических методов); v вода, в которой практически нет болезнетворных бактерий и вирусов. Краткий перечень неорганических и органических веществ, а также бактерий и вирусов в питьевой воде, оказывающих неблаготворное влияние на организм человека, представлен в таблице 1.
Существует несколько стандартов на питьевую воду: -Российский стандарт, определяемый соответствующими нормами и ГОСТами; -Стандарт ВОЗ (Всемирной организации здравоохранения); -Стандарт США и стандарта стран Европейского союза (ЕС). Российский ГОСТ на питьевую воду действует с 1982 г. Сейчас он дополнен более новым нормативом — Санитарные правила и нормы (Сан. Пи. Н) 2. 1. 4. 550 -96 «Питьевая вода» . В соответствии с действующими стандартами и нормами под термином питьевая вода высокого качества подразумевается: v вода с соответствующими органолептическими показателями — прозрачная, без запаха и с приятным вкусом; v вода с р. Н = 7— 7, 5 и жесткостью не выше 7 ммоль/л; v вода, в которой суммарное количество полезных минералов не более 1 г/л; v вода, в которой вредные химические примеси либо составляют десятые-сотые доли их ПДК, либо вообще отсутствуют (то есть их концентрации настолько малы, что лежат за гранью возможностей современных аналитических методов); v вода, в которой практически нет болезнетворных бактерий и вирусов. Краткий перечень неорганических и органических веществ, а также бактерий и вирусов в питьевой воде, оказывающих неблаготворное влияние на организм человека, представлен в таблице 1.
 Название вещества, бактерии или вируса Органы и системы человека, на которые влияют эти соединения Неорганические вещества Бериллий Желудочно-кишечный тракт Кадмий Почки Медь Почки, печень Мышьяк Кожа, кровь; канцероген Нитраты и нитриты Мутации Ртуть Почки Свинец Почки, замедление развития Таблица 1. Влияние Селен Кровь Таллий Желудочно-кишечный тракт, кровь, почки, неорганических и печень неорганических Цианид Нервная система веществ, бактерий и Органические вещества вирусов на организм Бензол Канцероген Пестициды (ДДТ, анахлор, гептахлор) Канцерогены человека Соединения хлора (винилхлорид, Кровь, почки, печень дихлорэтан) Фенол Печень, почки, обмен веществ Толуол Нервная система, почки, печень Бактерии и вирусы Кишечная палочка Желудочно-кишечный тракт Энтеровирусы Желудочно-кишечный тракт Вирус гепатита Печень
Название вещества, бактерии или вируса Органы и системы человека, на которые влияют эти соединения Неорганические вещества Бериллий Желудочно-кишечный тракт Кадмий Почки Медь Почки, печень Мышьяк Кожа, кровь; канцероген Нитраты и нитриты Мутации Ртуть Почки Свинец Почки, замедление развития Таблица 1. Влияние Селен Кровь Таллий Желудочно-кишечный тракт, кровь, почки, неорганических и печень неорганических Цианид Нервная система веществ, бактерий и Органические вещества вирусов на организм Бензол Канцероген Пестициды (ДДТ, анахлор, гептахлор) Канцерогены человека Соединения хлора (винилхлорид, Кровь, почки, печень дихлорэтан) Фенол Печень, почки, обмен веществ Толуол Нервная система, почки, печень Бактерии и вирусы Кишечная палочка Желудочно-кишечный тракт Энтеровирусы Желудочно-кишечный тракт Вирус гепатита Печень
 Зеленые и бурые подтеки на посуде - наличие в воде минеральных кислот: серной и соляной. Рыбный, затхлый или древесный запах - присутствие в воде хлорорганических соединений. Образование темных пятен на посуде и предметах из серебра, наличие желтоватых, черных пятен на поверхности раковины - присутствие в воде растворенного сероводорода. Запах фенола - попадание промышленных сточных вод в системы водоснабжения. Солоноватый привкус - высокое содержание солей магния и натрия. Образование пятен на алюминиевой посуде - высокое содержание щелочи. Металлический привкус высокое содержание железа. Потемнение и коррозия раковины из нержавеющей стали - высокое содержание хлоридов. Красновато-бурый осадок - присутствие окисленного железа, вымываемого из ржавых труб. Мутная вода - либо высокое содержание воздуха из-за неисправного насоса, либо присутствие метана.
Зеленые и бурые подтеки на посуде - наличие в воде минеральных кислот: серной и соляной. Рыбный, затхлый или древесный запах - присутствие в воде хлорорганических соединений. Образование темных пятен на посуде и предметах из серебра, наличие желтоватых, черных пятен на поверхности раковины - присутствие в воде растворенного сероводорода. Запах фенола - попадание промышленных сточных вод в системы водоснабжения. Солоноватый привкус - высокое содержание солей магния и натрия. Образование пятен на алюминиевой посуде - высокое содержание щелочи. Металлический привкус высокое содержание железа. Потемнение и коррозия раковины из нержавеющей стали - высокое содержание хлоридов. Красновато-бурый осадок - присутствие окисленного железа, вымываемого из ржавых труб. Мутная вода - либо высокое содержание воздуха из-за неисправного насоса, либо присутствие метана.
 Представьте, что мы получили стерильную воду. В такой воде нет вредных веществ и микроорганизмов. Является ли такая вода полноценной для нашего употребления? Оказывается, нет. Ведь с водой организм должен получать целый комплекс минеральных веществ, без которых человек рискует столкнуться со многими неприятностями. В питьевой воде должны быть не только фтор и йод, но и кальций, магний, железо, медь, цинк. Но и это еще не все. Минерализация воды (количество растворенных в воде солей) является неоднозначным параметром. Исследования, проведенные в последние годы, показали неблагоприятное воздействие на организм человека питьевой воды с минерализацией свыше 1500 мг/л и ниже 30 -50 мг/л.
Представьте, что мы получили стерильную воду. В такой воде нет вредных веществ и микроорганизмов. Является ли такая вода полноценной для нашего употребления? Оказывается, нет. Ведь с водой организм должен получать целый комплекс минеральных веществ, без которых человек рискует столкнуться со многими неприятностями. В питьевой воде должны быть не только фтор и йод, но и кальций, магний, железо, медь, цинк. Но и это еще не все. Минерализация воды (количество растворенных в воде солей) является неоднозначным параметром. Исследования, проведенные в последние годы, показали неблагоприятное воздействие на организм человека питьевой воды с минерализацией свыше 1500 мг/л и ниже 30 -50 мг/л.
 Такая питьевая вода плохо утоляет жажду, ухудшает работу желудка, нарушает водно-солевой обмен в организме. До недавнего времени на высокую минерализацию воды – жесткость – обращали внимание лишь из-за ее влияния на пригодность воды для мытья волос и стирки, а также на интенсивность образования накипи при кипячении воды. Теперь благодаря полученным научным данным стало ясно, что очистка воды необходима, т. к. жесткость питьевой воды имеет большое значение для поддержания здоровья. Например, повышенное содержание солей кальция и магния в воде способствует развитию атеросклероза, мочекаменной болезни, вызывает нарушение обменных процессов. С другой стороны, смертность от сердечно-сосудистых заболеваний на 25 -30% выше среди людей, употребляющих для питья мягкую воду, содержащую менее 75 миллиграммов кальция и магия в литре воды.
Такая питьевая вода плохо утоляет жажду, ухудшает работу желудка, нарушает водно-солевой обмен в организме. До недавнего времени на высокую минерализацию воды – жесткость – обращали внимание лишь из-за ее влияния на пригодность воды для мытья волос и стирки, а также на интенсивность образования накипи при кипячении воды. Теперь благодаря полученным научным данным стало ясно, что очистка воды необходима, т. к. жесткость питьевой воды имеет большое значение для поддержания здоровья. Например, повышенное содержание солей кальция и магния в воде способствует развитию атеросклероза, мочекаменной болезни, вызывает нарушение обменных процессов. С другой стороны, смертность от сердечно-сосудистых заболеваний на 25 -30% выше среди людей, употребляющих для питья мягкую воду, содержащую менее 75 миллиграммов кальция и магия в литре воды.
 Существует распространенное мнение относительно целебных свойств воды из недр земли. Чем же она отличается от воды из минеральных источников Северного Кавказа. Оказывается, отличается, и очень значительно. Во-первых, глубиной скважины. Артезианские скважины бурят до напорных вод. Вблизи больших городов, водоносные слои с глубиной залегания менее 100 м уже нельзя считать безопасными в бактериологическом отношении.
Существует распространенное мнение относительно целебных свойств воды из недр земли. Чем же она отличается от воды из минеральных источников Северного Кавказа. Оказывается, отличается, и очень значительно. Во-первых, глубиной скважины. Артезианские скважины бурят до напорных вод. Вблизи больших городов, водоносные слои с глубиной залегания менее 100 м уже нельзя считать безопасными в бактериологическом отношении.
 Загрязнение воды Человек часто нарушает природные процессы в пресных водоемах и прибрежных областях морей и океанов в результате своей хозяйственной деятельности. В результате работы промышленных предприятий и транспорта в природных водах накапливаются тяжелые металлы. Наиболее опасными признаны ртуть, свинец и кадмий, так как они ядовиты даже в малых количествах. Хотя эти металлы до сих пор незаменимы в технике, от некоторых областей их применения человечество отказалось.
Загрязнение воды Человек часто нарушает природные процессы в пресных водоемах и прибрежных областях морей и океанов в результате своей хозяйственной деятельности. В результате работы промышленных предприятий и транспорта в природных водах накапливаются тяжелые металлы. Наиболее опасными признаны ртуть, свинец и кадмий, так как они ядовиты даже в малых количествах. Хотя эти металлы до сих пор незаменимы в технике, от некоторых областей их применения человечество отказалось.
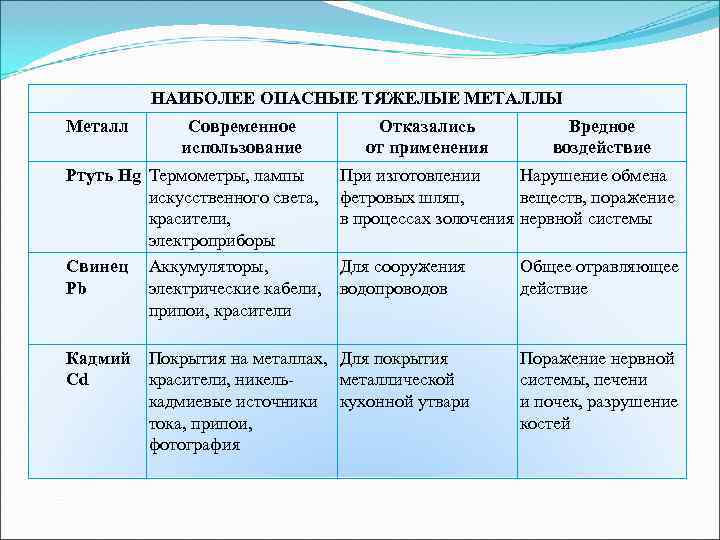
 НАИБОЛЕЕ ОПАСНЫЕ ТЯЖЕЛЫЕ МЕТАЛЛЫ Металл Современное Отказались Вредное использование от применения воздействие Ртуть Hg Термометры, лампы При изготовлении Нарушение обмена искусственного света, фетровых шляп, веществ, поражение красители, в процессах золочения нервной системы электроприборы Свинец Аккумуляторы, Для сооружения Общее отравляющее Pb электрические кабели, водопроводов действие припои, красители Кадмий Покрытия на металлах, Для покрытия Поражение нервной Cd красители, никель- металлической системы, печени кадмиевые источники кухонной утвари и почек, разрушение тока, припои, костей фотография
НАИБОЛЕЕ ОПАСНЫЕ ТЯЖЕЛЫЕ МЕТАЛЛЫ Металл Современное Отказались Вредное использование от применения воздействие Ртуть Hg Термометры, лампы При изготовлении Нарушение обмена искусственного света, фетровых шляп, веществ, поражение красители, в процессах золочения нервной системы электроприборы Свинец Аккумуляторы, Для сооружения Общее отравляющее Pb электрические кабели, водопроводов действие припои, красители Кадмий Покрытия на металлах, Для покрытия Поражение нервной Cd красители, никель- металлической системы, печени кадмиевые источники кухонной утвари и почек, разрушение тока, припои, костей фотография
 Химическое загрязнение природных вод Всякий водоем или водный источник связан с окружающей его внешней средой. На него оказывают влияние условия формирования поверхностного или подземного водного стока, разнообразные природные явления, индустрия, промышленное и коммунальное строительство, транспорт, хозяйственная и бытовая деятельность человека. Последствием этих влияний является привнесение в водную среду новых, несвойственных ей веществ - загрязнителей, ухудшающих качество воды. Загрязнения, поступающие в водную среду, классифицируют по разному, в зависимости от подходов, критериев и задач. Так, обычно выделяют химическое, физическое и биологические загрязнения. Химическое загрязнение представляет собой изменение естественных химических свойств вода за счет увеличения содержания в ней вредных примесей как неорганической (минеральные соли, кислоты, щелочи, глинистые частицы), так и органической природы (нефть и нефтепродукты, органические остатки, поверхностно - активные вещества, пестициды).
Химическое загрязнение природных вод Всякий водоем или водный источник связан с окружающей его внешней средой. На него оказывают влияние условия формирования поверхностного или подземного водного стока, разнообразные природные явления, индустрия, промышленное и коммунальное строительство, транспорт, хозяйственная и бытовая деятельность человека. Последствием этих влияний является привнесение в водную среду новых, несвойственных ей веществ - загрязнителей, ухудшающих качество воды. Загрязнения, поступающие в водную среду, классифицируют по разному, в зависимости от подходов, критериев и задач. Так, обычно выделяют химическое, физическое и биологические загрязнения. Химическое загрязнение представляет собой изменение естественных химических свойств вода за счет увеличения содержания в ней вредных примесей как неорганической (минеральные соли, кислоты, щелочи, глинистые частицы), так и органической природы (нефть и нефтепродукты, органические остатки, поверхностно - активные вещества, пестициды).
 Нефть и нефтепродукты К числу наиболее вредных химических загрязнений относятся нефть и нефтепродукты. Ежегодно в океан попадает более 10 млн. т нефти. Загрязняют поверхность танкеры, содействует загрязнению и утечка нефти при подводном бурении. В период между 1973 -1984 годами в США Институтом охраны окружающей среды и энергетики отмечено до 12000 случаев загрязнения вод нефтью. В период между 1970 -1982 годами в мире зарегистрировано 169 крупных аварий танкеров и 17000 второстепенных случаев разлития нефти. Обеспокоенность общественности нефтяным загрязнением обусловливается неуклонным ростом экономических потерь в рыболовстве, туризме и других сферах деятельности. Только 1 т нефти способна покрыть до 12 км 2 поверхности моря. А нефтяная плёнка нарушает все физико-химические процессы: повышается температура поверхностного слоя воды, ухудшается газообмен, рыба уходит или погибает, но и осевшая на дно нефть долгое время вредит всему живому. Нарушается обмен океана с атмосферой: энергией, газами, теплом и влагой, в результате перестаёт размножаться планктон – основной продукт питания морских обитателей.
Нефть и нефтепродукты К числу наиболее вредных химических загрязнений относятся нефть и нефтепродукты. Ежегодно в океан попадает более 10 млн. т нефти. Загрязняют поверхность танкеры, содействует загрязнению и утечка нефти при подводном бурении. В период между 1973 -1984 годами в США Институтом охраны окружающей среды и энергетики отмечено до 12000 случаев загрязнения вод нефтью. В период между 1970 -1982 годами в мире зарегистрировано 169 крупных аварий танкеров и 17000 второстепенных случаев разлития нефти. Обеспокоенность общественности нефтяным загрязнением обусловливается неуклонным ростом экономических потерь в рыболовстве, туризме и других сферах деятельности. Только 1 т нефти способна покрыть до 12 км 2 поверхности моря. А нефтяная плёнка нарушает все физико-химические процессы: повышается температура поверхностного слоя воды, ухудшается газообмен, рыба уходит или погибает, но и осевшая на дно нефть долгое время вредит всему живому. Нарушается обмен океана с атмосферой: энергией, газами, теплом и влагой, в результате перестаёт размножаться планктон – основной продукт питания морских обитателей.
 Загрязнение подземных вод Особенно чувствительны к загрязнению подземные воды. Это связано с низкими скоростями потока и слабой микробиологической активностью. Основную угрозу для подземных вод составляют утечки из подземных цистерн, а также сток с сельскохозяйственных полей, мест захоронения городских отходов, заброшенных хранилищ вредных веществ. Загрязненные подземные воды могут попадать в реки и озера, в результате чего загрязнение распространяется на поверхностные воды. Рост населения, промышленности и сельского хозяйства тесно связаны с водными ресурсам, однако прирост ресурсов рождает новые потребности и новые проблемы, в том числе экологические. По-видимому, уже пришло время защищать природные водоемы и их обитателей от вмешательства человека.
Загрязнение подземных вод Особенно чувствительны к загрязнению подземные воды. Это связано с низкими скоростями потока и слабой микробиологической активностью. Основную угрозу для подземных вод составляют утечки из подземных цистерн, а также сток с сельскохозяйственных полей, мест захоронения городских отходов, заброшенных хранилищ вредных веществ. Загрязненные подземные воды могут попадать в реки и озера, в результате чего загрязнение распространяется на поверхностные воды. Рост населения, промышленности и сельского хозяйства тесно связаны с водными ресурсам, однако прирост ресурсов рождает новые потребности и новые проблемы, в том числе экологические. По-видимому, уже пришло время защищать природные водоемы и их обитателей от вмешательства человека.
 Очистка сточных вод Одной из насущных проблем человечества с древних времен было получение питьевой воды, с дефицитом которой люди борются не одно тысячелетие. Четыре тысячи лет назад индусы для очистки воды пропускали ее через древесный уголь (этот же способ очистки воды описан в сказке В. Одоевского "Мороз Иванович"). Аристотель в IV в. до н. э. получал пресную воду путем конденсации ее паров после испарения с поверхности соленой воды. Плиний Старший в I в. до н. э. описал, как руно при нагревании на солнце поглощает водяные пары, а ночью их конденсирует (этот процесс римляне использовали для получения пресной воды на морских судах).
Очистка сточных вод Одной из насущных проблем человечества с древних времен было получение питьевой воды, с дефицитом которой люди борются не одно тысячелетие. Четыре тысячи лет назад индусы для очистки воды пропускали ее через древесный уголь (этот же способ очистки воды описан в сказке В. Одоевского "Мороз Иванович"). Аристотель в IV в. до н. э. получал пресную воду путем конденсации ее паров после испарения с поверхности соленой воды. Плиний Старший в I в. до н. э. описал, как руно при нагревании на солнце поглощает водяные пары, а ночью их конденсирует (этот процесс римляне использовали для получения пресной воды на морских судах).
 В XIX в. для очистки воды в лабораторных условиях стали использовать метод вымораживания, позже появились методы ионообмена и мембранные методы. После разработки методов определения электрических свойств контролировать качество очистки воды стали по величине ее удельного электрического сопротивления. В 1935 г. Герман Штаудингер синтезировал трехмерный, сетчатый полистирол (Нобелевская премия 1953 г. ), на основе которого чуть позже были созданы катион- и анионобменники с высокой емкостью, что приблизило решение проблемы получения ультрачистой воды.
В XIX в. для очистки воды в лабораторных условиях стали использовать метод вымораживания, позже появились методы ионообмена и мембранные методы. После разработки методов определения электрических свойств контролировать качество очистки воды стали по величине ее удельного электрического сопротивления. В 1935 г. Герман Штаудингер синтезировал трехмерный, сетчатый полистирол (Нобелевская премия 1953 г. ), на основе которого чуть позже были созданы катион- и анионобменники с высокой емкостью, что приблизило решение проблемы получения ультрачистой воды.
 Процесс начинается с сорбции активным углем или макропористым анионобменником органических примесей воды. Затем для сорбции ионных примесей используют последовательно катионный обмен, анионный обмен и сорбцию смешанным слоем гранулированных катион- и анионобменников. На стадии катионного обмена удаляются ионы Са и Мg, вызывающие жесткость воды, причем одновременно идет реакция для удаления углекислого газа. На стадии сорбции смешанным слоем гранулированных обменников достигается глубокое обессоливание воды с практически полным извлечением хлорида натрия. Однако ионнообменная технология требует последующей химической регенерации ионнообменных смол, что приводит к экологическим проблемам: технология процесса такова, что в сточных водах масса удаленных веществ на порядок превышает исходно извлекаемые примеси, и таким образом в районе сбросов экспоненциально растет минерализация. Избавиться от экологических промахов при получении ультрачистой воды позволяют мембранные методы опреснения и глубокой очистки природных вод. Отличием этого подхода является равенство массы веществ, попадающих в стоки и извлекаемых при ее очистке.
Процесс начинается с сорбции активным углем или макропористым анионобменником органических примесей воды. Затем для сорбции ионных примесей используют последовательно катионный обмен, анионный обмен и сорбцию смешанным слоем гранулированных катион- и анионобменников. На стадии катионного обмена удаляются ионы Са и Мg, вызывающие жесткость воды, причем одновременно идет реакция для удаления углекислого газа. На стадии сорбции смешанным слоем гранулированных обменников достигается глубокое обессоливание воды с практически полным извлечением хлорида натрия. Однако ионнообменная технология требует последующей химической регенерации ионнообменных смол, что приводит к экологическим проблемам: технология процесса такова, что в сточных водах масса удаленных веществ на порядок превышает исходно извлекаемые примеси, и таким образом в районе сбросов экспоненциально растет минерализация. Избавиться от экологических промахов при получении ультрачистой воды позволяют мембранные методы опреснения и глубокой очистки природных вод. Отличием этого подхода является равенство массы веществ, попадающих в стоки и извлекаемых при ее очистке.
 Основные стадии ионообменной технологии получения ультрачистой воды.
Основные стадии ионообменной технологии получения ультрачистой воды.
 Охрана водных ресурсов Согласно водному кодексу Российской Федерации, использование водных объектов для питьевого и хозяйственно бытового водоснабжения является приоритетным. Для этих целей должны использоваться защищённые от загрязнения и засорения поверхностные и подземные водные объекты. Запрещается сброс сточных и дренажных вод в водные объекты. Их пригодность для питьевого и хозяйственно-бытового водоснабжения определяется органами санитарно-эпидемиологического надзора. Централизованное питьевое и хозяйственно-бытовое водоснабжение населения осуществляют специальные организации, имеющие лицензию на водопользование. Поддержание поверхностных и подземных вод в состоянии, соответствующем экологическим требованиям, обеспечивается установлением нормативов предельно допустимых вредных воздействий на водные объекты.
Охрана водных ресурсов Согласно водному кодексу Российской Федерации, использование водных объектов для питьевого и хозяйственно бытового водоснабжения является приоритетным. Для этих целей должны использоваться защищённые от загрязнения и засорения поверхностные и подземные водные объекты. Запрещается сброс сточных и дренажных вод в водные объекты. Их пригодность для питьевого и хозяйственно-бытового водоснабжения определяется органами санитарно-эпидемиологического надзора. Централизованное питьевое и хозяйственно-бытовое водоснабжение населения осуществляют специальные организации, имеющие лицензию на водопользование. Поддержание поверхностных и подземных вод в состоянии, соответствующем экологическим требованиям, обеспечивается установлением нормативов предельно допустимых вредных воздействий на водные объекты.
 Домашнее задание: 1. Подготовка докладов на темы: «Химический состав морской воды» , «Загрязнение Мирового океана» , «Очистка сточных вод» , «Вода – как уникальное вещество» . 2. Подготовка к практической работе.
Домашнее задание: 1. Подготовка докладов на темы: «Химический состав морской воды» , «Загрязнение Мирового океана» , «Очистка сточных вод» , «Вода – как уникальное вещество» . 2. Подготовка к практической работе.
 Спасибо за внимание!
Спасибо за внимание!

