lekt 1 C Si.ppt
- Количество слайдов: 31

Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний
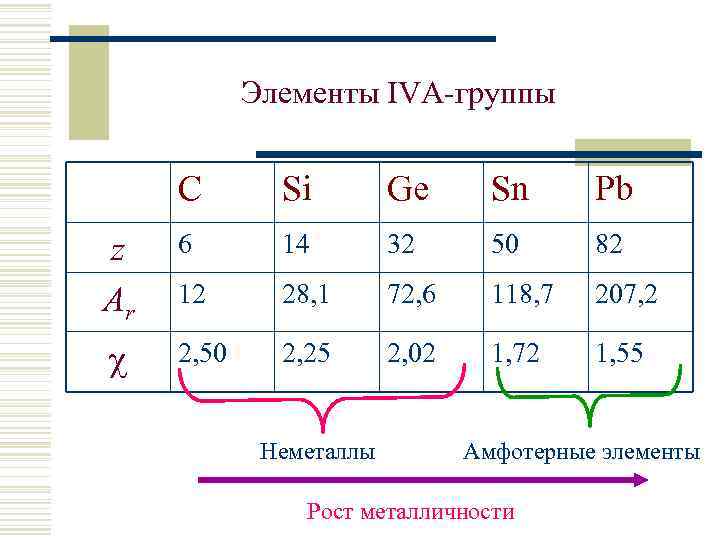
Элементы IVА-группы C Si Ge Sn Pb z Ar 6 14 32 50 82 12 28, 1 72, 6 118, 7 207, 2 2, 50 2, 25 2, 02 1, 72 1, 55 Неметаллы Амфотерные элементы Рост металличности
![Общая электронная формула: […] ns 2 (n– 1)d 10 np 2 nd 0 ns Общая электронная формула: […] ns 2 (n– 1)d 10 np 2 nd 0 ns](https://present5.com/presentation/187242376_325789504/image-3.jpg)
Общая электронная формула: […] ns 2 (n– 1)d 10 np 2 nd 0 ns 2 np 2 Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6 Степени окисления: –IV, 0, +II, +IV Устойчивые ст. ок. : С, Si, Ge, Sn: +IV (Pb. IV – сильн. окисл. ). Уст. ок. : Pb: +II
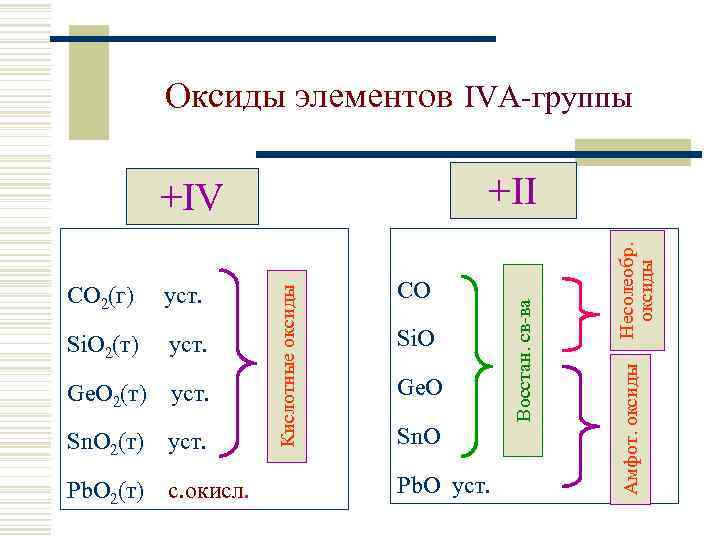
Оксиды элементов IVА-группы уст. Ge. O 2(т) уст. Sn. O 2(т) уст. Pb. O 2(т) с. окисл. Si. O Ge. O Sn. O Pb. O уст. Несолеобр. оксиды Si. O 2(т) CO Амфот. оксиды уст. Кислотные оксиды CO 2(г) Восстан. св-ва +II +IV
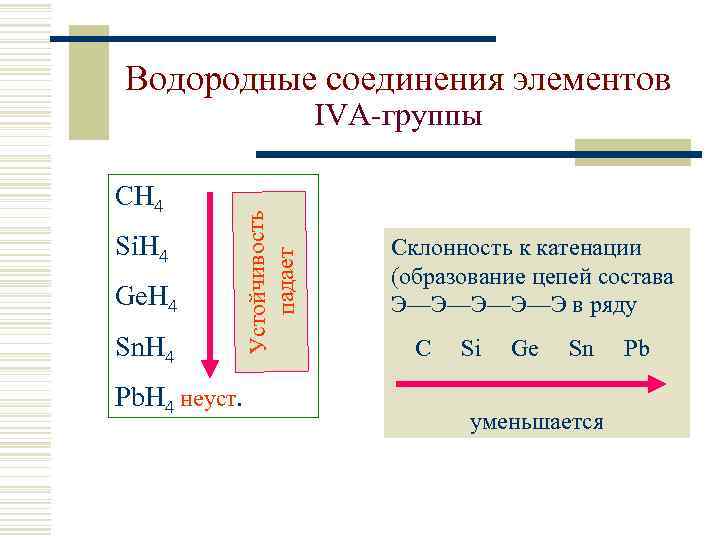
Водородные соединения элементов СH 4 Si. H 4 Ge. H 4 Sn. H 4 Устойчивость падает IVА-группы Pb. H 4 неуст. Склонность к катенации (образование цепей состава Э—Э—Э в ряду C Si Ge Sn уменьшается Pb
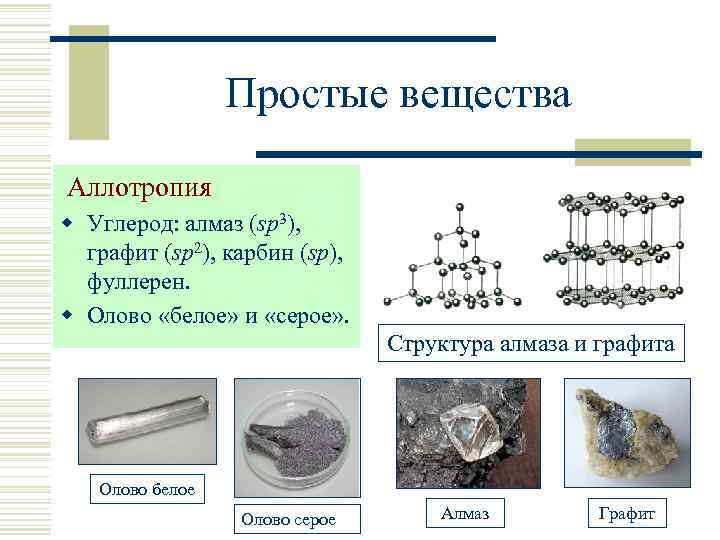
Простые вещества Аллотропия w Углерод: алмаз (sp 3), графит (sp 2), карбин (sp), фуллерен. w Олово «белое» и «серое» . Структура алмаза и графита Олово белое Олово серое Алмаз Графит

Химические свойства При комн. темп. w С, Si, Ge + H 2 O w С, Si, Ge + H 3 O+ w Sn, Pb + H 2 O Кремний Германий w Sn + H 3 O+ Sn 2+ + H 2 w Pb + H 3 O+ Pb 2+ + H 2 Олово Свинец

Химические свойства w С(т) + KOH w Si + 4 Na. OH = Na 4 Si. O 4 + 2 H 2 Si + 8 OH– – 4 e – = Si. O 44– + 4 H 2 O 2 H 2 O + 2 e – = H 2 + 2 OH– w Ge + 2 KOH + 2 H 2 O 2 = K 2[Ge(OH)6] Ge + 6 OH– – 4 e – = [Ge(OH)6]2– H 2 O 2 + 2 e – = 2 OH– w Sn + Na. OH + 2 H 2 O = Na[Sn(OH)3] + H 2 Sn + 3 OH– – 2 e – = [Sn(OH)3]– 2 H 2 O + 2 e – = H 2 + 2 OH–
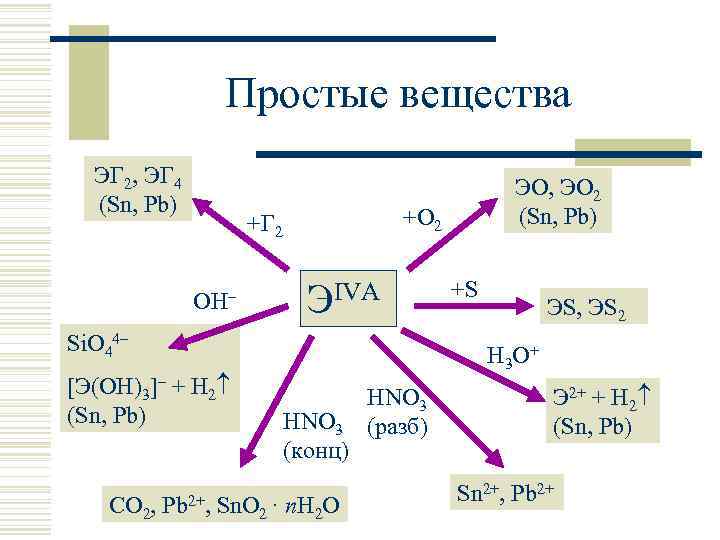
Простые вещества ЭГ 2, ЭГ 4 (Sn, Pb) +O 2 +Г 2 OH– ЭIVA Si. O 44– [Э(OH)3]– + H 2 (Sn, Pb) CO 2, Pb 2+, ЭO, ЭO 2 (Sn, Pb) +S ЭS, ЭS 2 H 3 O + HNO 3 (конц) Sn. O 2 · n. H 2 O HNO 3 (разб) Э 2+ + H 2 (Sn, Pb) Sn 2+, Pb 2+

Распространение в природе и важнейшие минералы 2. Si 25, 80% (27, 72% в литосфере) 13. C 0, 087% (0, 032% в литосфере) 31. Sn 0, 0035% 35. Pb 0, 0018% 46. Ge 6 · 10– 4% (РРЭ) Аметист Агат Кремний: кварц, яшма, агат, опал, силикаты, алюмосиликаты Кварц Опал Каолинит

Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты Графит Кальцит Алмаз Газодобыча Каменный уголь

Германий, олово и свинец Касситерит Sn. O 2 Галенит Pb. S Аргиродит Германит (Fe. IICu 6 IGe 2)S 8 (Ag 8 IGe. IV)S 6

Шкала степеней окисления углерода +IV CO 2, CO 32 , H 2 CO 3, Na 2 CO 3, CS 2, CF 4, CCl 2 O, C(NH 2)2 O +II CO, HCN, C 2 F 4 0 IV C (графит, алмаз, карбин, фуллерен) СH 4, Be 2 C, Al 4 C 3, Si. C
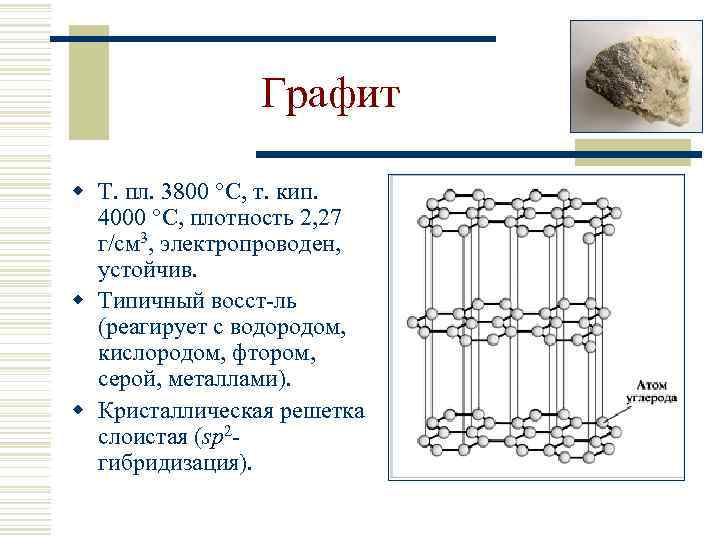
Графит w Т. пл. 3800 С, т. кип. 4000 С, плотность 2, 27 г/см 3, электропроводен, устойчив. w Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой, металлами). w Кристаллическая решетка слоистая (sp 2 гибридизация).
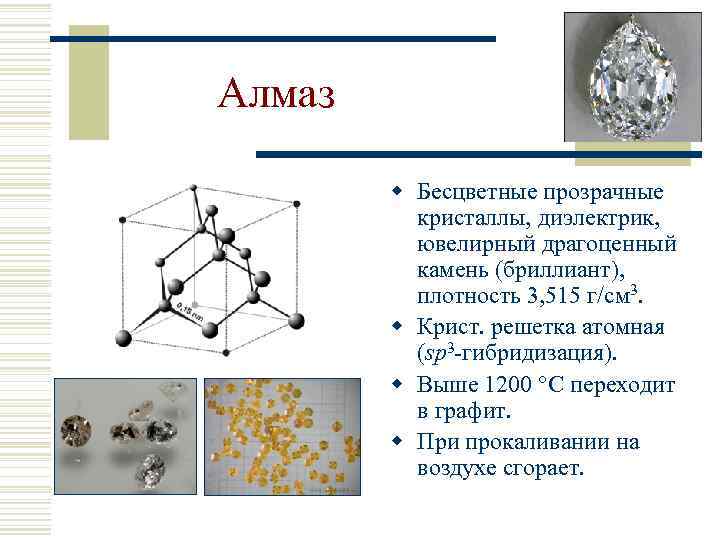
Алмаз w Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3, 515 г/см 3. w Крист. решетка атомная (sp 3 -гибридизация). w Выше 1200 С переходит в графит. w При прокаливании на воздухе сгорает.

Карбин и фуллерен w Карбин: линейные макромолекулы (С 2)n, бесцветен и прозрачен, полупроводник; плотность 3, 27 г/см 3; выше 2300 С переходит в графит. w Фуллерен: С 60 и С 70 (полые сферы), темноокрашенный порошок, полупроводник, т. пл. 500 -600 C, плотность 1, 7 г/см 3 (С 60). Фуллерен С 70 Фуллерен С 60
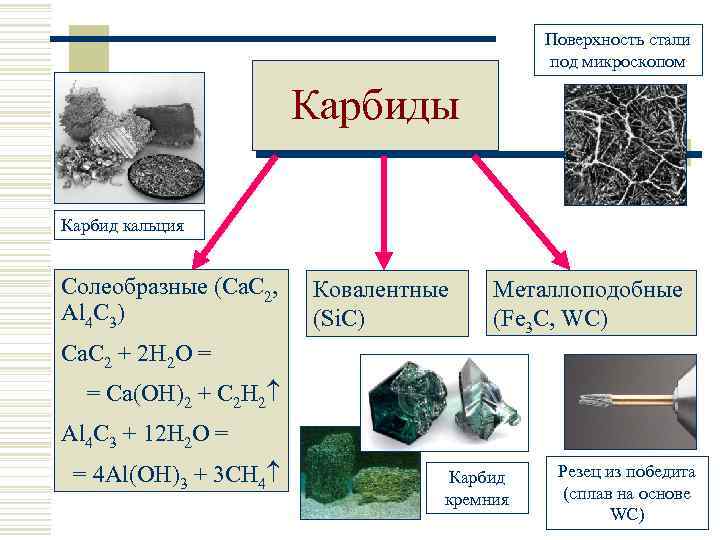
Поверхность стали под микроскопом Карбиды Карбид кальция Солеобразные (Ca. C 2, Al 4 C 3) Ковалентные (Si. C) Металлоподобные (Fe 3 C, WC) Ca. C 2 + 2 H 2 O = = Ca(OH)2 + C 2 H 2 Al 4 C 3 + 12 H 2 O = = 4 Al(OH)3 + 3 CH 4 Карбид кремния Резец из победита (сплав на основе WC)

Водородные соединения. Метан CH 4 sp 3 w СН 4 – газ без цвета и запаха, горюч, главная сост. часть природного газа. w Получение в лаборатории: CH 3 COONa + Na. OH (+t) = = Na 2 CO 3 + CH 4 w Горение: CH 4 + O 2 = С + 2 H 2 O CH 4 + 2 O 2 (изб. ) = = СO 2 + 2 H 2 O
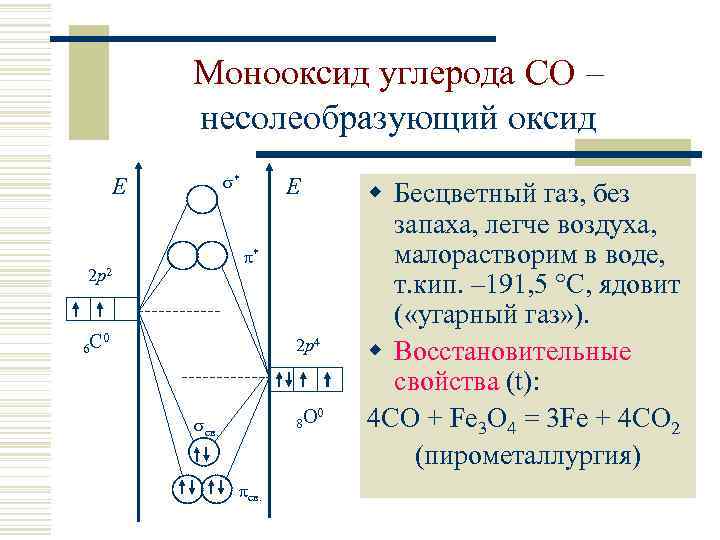
Монооксид углерода CO – несолеобразующий оксид * E * 2 p 2 6 С E 0 2 p 4 8 O св. 0 w Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т. кип. – 191, 5 С, ядовит ( «угарный газ» ). w Восстановительные свойства (t): 4 CO + Fe 3 O 4 = 3 Fe + 4 CO 2 (пирометаллургия)
![Монооксид углерода CO w Донорные свойства: CO образует Fe прочные комплексы, например [Fe(CO)5]. : Монооксид углерода CO w Донорные свойства: CO образует Fe прочные комплексы, например [Fe(CO)5]. :](https://present5.com/presentation/187242376_325789504/image-20.jpg)
Монооксид углерода CO w Донорные свойства: CO образует Fe прочные комплексы, например [Fe(CO)5]. : C : : : O w Обнаружение: Pd. Cl 2 + CO + H 2 O = Pd + CO 2 + 2 HCl I 2 O 5 + 5 CO = I 2 + 5 CO 2

Диоксид углерода CO 2 (кислотный оксид) O , С , O sp-гибридизация «Сухой лед» w Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в 1 л воды – около 1, 7 л CO 2). w В тв. сост. ( «сухой лёд» ) – молекулярная крист. решетка; т. возгонки – 78 С, т. пл. – 57 С (р = 5 атм).

Моногидрат CO 2. H 2 O и угольная кислота H 2 CO 3 w В водном растворе: CO 2 (г) + H 2 O CO 2. H 2 O H 2 CO 3 w H 2 CO 3 – слабая двухосновная кислота: H 2 CO 3 + H 2 O HCO 3– + H 3 O+ ; KK = 4, 27 · 10– 7 HCO 3– + H 2 O CO 32– + H 3 O+ ; KK = 4, 68 · 10– 11 w. Соли – карбонаты и гидрокарбонаты M 2 CO 3 и MHCO 3 подвергаются гидролизу (р. Н > 7). w Термическое разложение гидрокарбонатов: 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + H 2 O Видеофрагмент
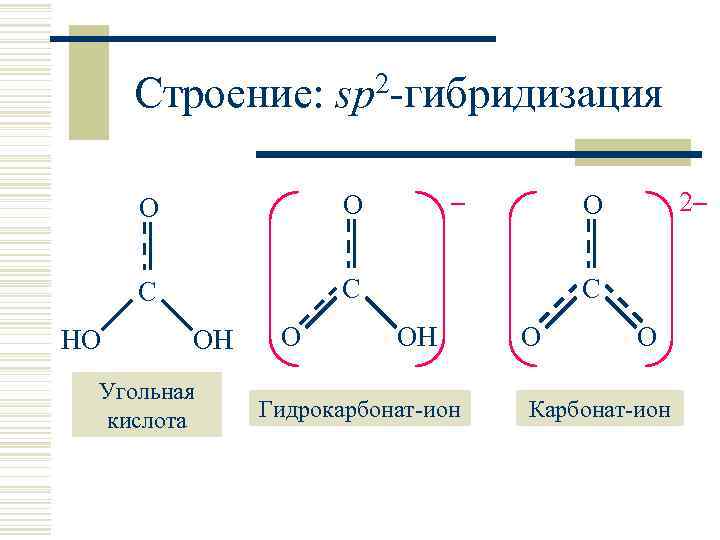
Строение: sp 2 -гибридизация O C HO – O C OH Угольная кислота O 2– O C OH Гидрокарбонат-ион O O Карбонат-ион
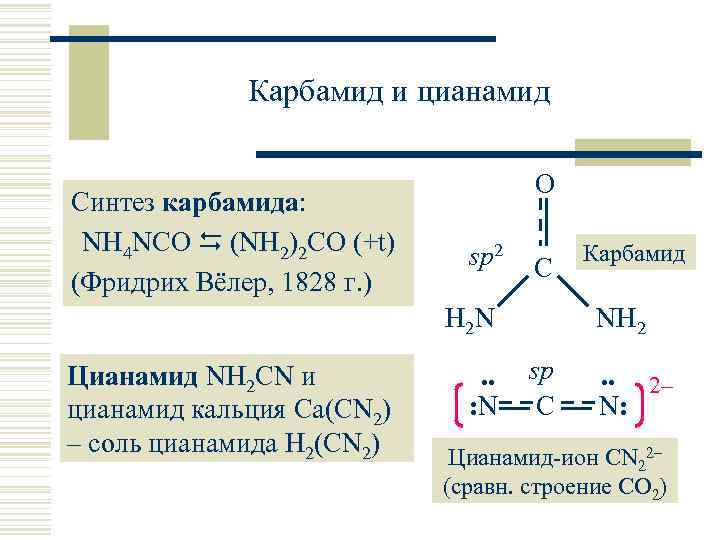
Карбамид и цианамид Синтез карбамида: NH 4 NCO (NH 2)2 CO (+t) (Фридрих Вёлер, 1828 г. ) O sp 2 C H 2 N Цианамид NH 2 CN и цианамид кальция Ca(CN 2) – соль цианамида H 2(CN 2) . . : N Карбамид NH 2 sp C . . 2– N: Цианамид-ион CN 22– (сравн. строение CO 2)

Псевдогалогениды w Циановодород HCN – бесцв. ж. , т. пл. – 13, 3 С, т. кип. +25, 6 С). w В водн. р-ре – слабая «синильная кислота» : HCN + H 2 O CN– + H 3 O+; KK = 4, 93 · 10– 10 w Цианид-ион CN : донорные св-ва, образует прочные комплексы, ядовит. Fe : C: : : N– HCN – производное дициана C 2 N 2
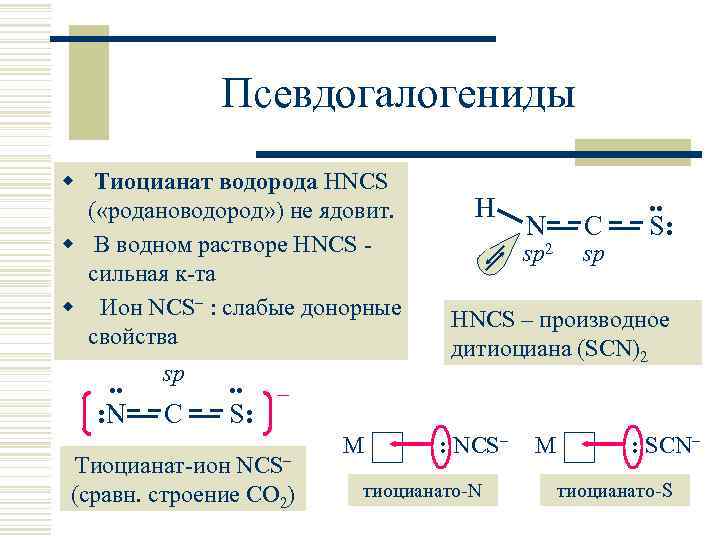
Псевдогалогениды w Тиоцианат водорода HNCS ( «родановодород» ) не ядовит. w В водном растворе HNCS сильная к-та w Ион NCS : слабые донорные свойства. . sp. . – : N C H N sp 2 C sp . . S: HNCS – производное дитиоциана (SCN)2 S: Тиоцианат-ион NCS– (сравн. строение CO 2) M : NCS– тиоцианато-N M : SCN– тиоцианато-S

Кремний Химическое растворение 3 Si + 4 HNO 3 + 18 HF = 3 H 2[Si. F 6] + 4 NO + 8 H 2 O Si + 4 Na. OH = Na 4 Si. O 4 + 2 H 2 Получение кремния Si. O 2 + 2 Mg = 2 Mg. O + Si Si. Cl 4 + 2 H 2 = Si + 4 HCl (кремний ос. ч. )

Водородные соединения Sin. H 2 n+2 (силаны) w Моносилан Si. H 4: w Si. H 4 + 2 O 2 = Si. O 2 + 2 H 2 O Получение силанов: w Si. O 2 + 4 Mg(изб) = Mg 2 Si + 2 Mg. O (силицид магния) w Mg 2 Si + 4 H 2 O = 2 Mg(OH)2 + Si. H 4 w Mg 2 Si + 4 H 3 O+ = 2 Mg 2+ + 4 H 2 O + Si. H 4 Видео: магниетермия и получение силана Получение кремния и силана

Кислородные соединения Полиморфизм диоксида кремния: 573 С 1470 С 1728 С кварц тридимит кристобалит Si. O 2 Ge. O 2 + H 2 O Si. O 2 Ge. O 2 Si. O 2(ж) (расплав) + H 3 O+ Si. O 2 + 4 Na. OH(р) = Na 4 Si. O 4 + 2 H 2 O (ортосиликат натрия) Ge. O 2 + 2 Na. OH(т) = Na 2 Ge. O 3 + H 2 O (метагерманат натрия)

Травление стекла w Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O w Si. O 2 + 6 HF (изб. ) = H 2[Si. F 6] + 2 H 2 O (гексафторосиликат водорода)
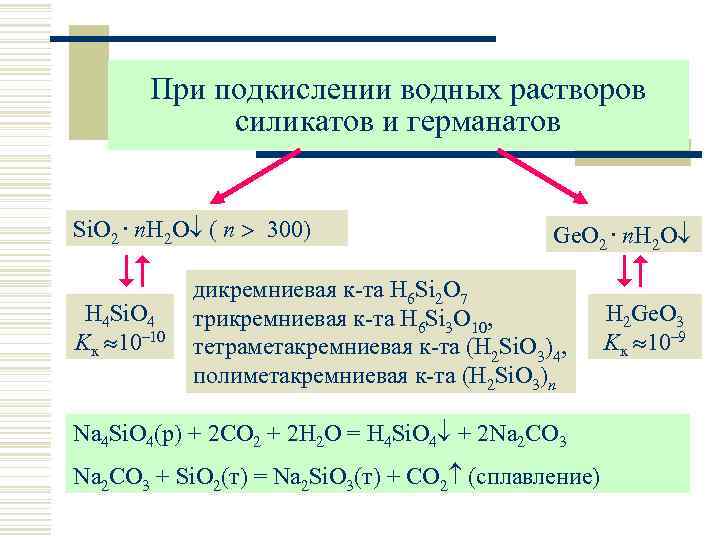
При подкислении водных растворов силикатов и германатов Si. O 2. n. H 2 O ( n 300) H 4 Si. O 4 Kк 10– 10 Ge. O 2. n. H 2 O дикремниевая к-та H 6 Si 2 O 7 трикремниевая к-та H 6 Si 3 O 10, тетраметакремниевая к-та (H 2 Si. O 3)4, полиметакремниевая к-та (H 2 Si. O 3)n Na 4 Si. O 4(р) + 2 CO 2 + 2 H 2 O = H 4 Si. O 4 + 2 Na 2 CO 3 + Si. O 2(т) = Na 2 Si. O 3(т) + CO 2 (сплавление) H 2 Ge. O 3 Kк 10– 9
lekt 1 C Si.ppt