ХИМИЯ ЭЛЕМЕНТОВ d – БЛОКАЛЕКЦИЯ 11 Характеристика






























lektsiya_7_svoystva_d_elementov_i_ikh_soedinen.ppt
- Размер: 128.5 Кб
- Количество слайдов: 32
Описание презентации ХИМИЯ ЭЛЕМЕНТОВ d – БЛОКАЛЕКЦИЯ 11 Характеристика по слайдам
 ХИМИЯ ЭЛЕМЕНТОВ d – БЛОКАЛЕКЦИЯ
ХИМИЯ ЭЛЕМЕНТОВ d – БЛОКАЛЕКЦИЯ
 Характеристика элементов I -Б группы Электронная формула этих элементов : (n-1)d 9 n. S 2 Для стабилизации наблюдается «провал» электрона и электронная формула имеет вид : (n-1)d 10 n. S
Характеристика элементов I -Б группы Электронная формула этих элементов : (n-1)d 9 n. S 2 Для стабилизации наблюдается «провал» электрона и электронная формула имеет вид : (n-1)d 10 n. S
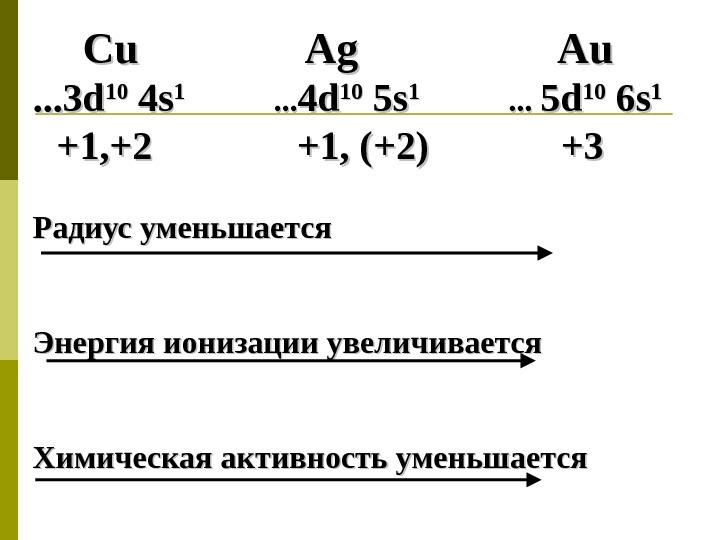
 Cu Cu Ag Au. . . . 33 dd 1010 4 4 ss 11 . . . 44 dd 1010 5 5 ss 11 . . . 55 dd 1010 6 6 ss 11 +1, +2 +1, (+2) +3+3 Радиус уменьшается Энергия ионизации увеличивается Химическая активность уменьшается
Cu Cu Ag Au. . . . 33 dd 1010 4 4 ss 11 . . . 44 dd 1010 5 5 ss 11 . . . 55 dd 1010 6 6 ss 11 +1, +2 +1, (+2) +3+3 Радиус уменьшается Энергия ионизации увеличивается Химическая активность уменьшается
![ХИМИЧЕСКИЕ СВОЙСТВА Cu. CI + 2 NH 33 = [Cu(NH 33 )) 22 ]CI]CI ХИМИЧЕСКИЕ СВОЙСТВА Cu. CI + 2 NH 33 = [Cu(NH 33 )) 22 ]CI]CI](/docs//lektsiya_7_svoystva_d_elementov_i_ikh_soedinen_images/lektsiya_7_svoystva_d_elementov_i_ikh_soedinen_3.jpg) ХИМИЧЕСКИЕ СВОЙСТВА Cu. CI + 2 NH 33 = [Cu(NH 33 )) 22 ]CI]CI Au(OH)+Na. OH → Na[Au(OH) 44 ] ]
ХИМИЧЕСКИЕ СВОЙСТВА Cu. CI + 2 NH 33 = [Cu(NH 33 )) 22 ]CI]CI Au(OH)+Na. OH → Na[Au(OH) 44 ] ]
 Cu, Ag, Au – малоактивные металлы, стоят в ряду напряжения после водорода Cu, Ag. Ag – – взаимодействуют с концентрированными кислотами HNOHNO 33 , , HH 22 SOSO 44 Au-Au- растворяется в «царской водке» Au +4 HCI + HNO 33 = H[Au. CI 44 ] + NO + H 22 OO « « золотая кислота» ХИМИЧЕСКИЕ СВОЙСТВА
Cu, Ag, Au – малоактивные металлы, стоят в ряду напряжения после водорода Cu, Ag. Ag – – взаимодействуют с концентрированными кислотами HNOHNO 33 , , HH 22 SOSO 44 Au-Au- растворяется в «царской водке» Au +4 HCI + HNO 33 = H[Au. CI 44 ] + NO + H 22 OO « « золотая кислота» ХИМИЧЕСКИЕ СВОЙСТВА
 Биологическая роль d- d- элементов II Б групп Гидроксилазы Е + О 22 → Е-О — + + [O][O] Оксигеназы [E[E 11 ×× Cu. Cu ++ ] + O 22 →→ + R-CH 22 -OH →→ →→ RCOOH + [E 11 ×× Cu. Cu ++ ] + H 22 OOЕ 1 × С u +2 O —
Биологическая роль d- d- элементов II Б групп Гидроксилазы Е + О 22 → Е-О — + + [O][O] Оксигеназы [E[E 11 ×× Cu. Cu ++ ] + O 22 →→ + R-CH 22 -OH →→ →→ RCOOH + [E 11 ×× Cu. Cu ++ ] + H 22 OOЕ 1 × С u +2 O —
 Биологическая роль d -элементов I- Б группы СОД (супероксиддисмутаза) [ СОД × С u 2+ ] + О 2 — → [ СОД ×Cu + ] + O 2 [ СОД × С u + ]+O 2 — +2 H + →[ СОД × С u +2 ] +H 2 O
Биологическая роль d -элементов I- Б группы СОД (супероксиддисмутаза) [ СОД × С u 2+ ] + О 2 — → [ СОД ×Cu + ] + O 2 [ СОД × С u + ]+O 2 — +2 H + →[ СОД × С u +2 ] +H 2 O
 Биологическая роль d -элементов I -Б группы O 2 +4 e — +4 H + Fe +2 + [ ЦП × С u +2 ] → Fe +3 + [ ЦП ×Cu + ] → 2 H 2 O ЦП + С u +2 → [ орган ×Cu +2 ] + ЦП
Биологическая роль d -элементов I -Б группы O 2 +4 e — +4 H + Fe +2 + [ ЦП × С u +2 ] → Fe +3 + [ ЦП ×Cu + ] → 2 H 2 O ЦП + С u +2 → [ орган ×Cu +2 ] + ЦП
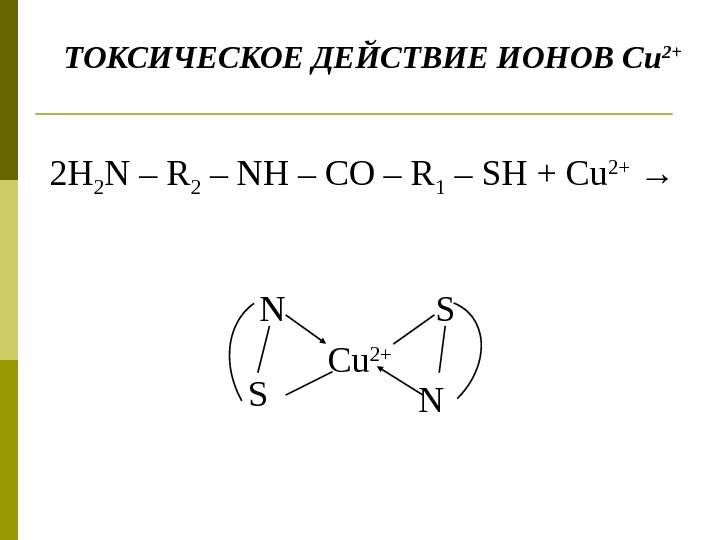
 2 Н 2 N – R 2 – NH – CO – R 1 – SH + Cu 2+ → Cu 2+N N S SТОКСИЧЕСКОЕ ДЕЙСТВИЕ ИОНОВ С u 2+
2 Н 2 N – R 2 – NH – CO – R 1 – SH + Cu 2+ → Cu 2+N N S SТОКСИЧЕСКОЕ ДЕЙСТВИЕ ИОНОВ С u 2+
 Электронное строение элементов II -Б группы ( n-1)d 10 n. S
Электронное строение элементов II -Б группы ( n-1)d 10 n. S
 Общая характеристика d -элементов II- Б группы Zn Cd Hg. Hg . . . 33 dd 1010 44 ss 22 . . . 44 dd 1010 55 ss 22 . . . 55 dd 1010 44 ss 22 +2+2 +2 +2 +1, +2 радиус уменьшается восстановительные свойства уменьшаются основные свойства уменьшаются
Общая характеристика d -элементов II- Б группы Zn Cd Hg. Hg . . . 33 dd 1010 44 ss 22 . . . 44 dd 1010 55 ss 22 . . . 55 dd 1010 44 ss 22 +2+2 +2 +2 +1, +2 радиус уменьшается восстановительные свойства уменьшаются основные свойства уменьшаются
 ХИМИЧЕСКИЕ СВОЙСТВА Zn. O + 2 HCI +3 H 22 O = [Zn(H 22 O)O) 44 ]CI]CI 22 Zn. O + 2 Na. OH + H 22 O = Na 22 [Zn(OH) 44 ]] Cd(OH) 22 + 6 NH 33 = [Cd(NH 33 )) 66 ](OH) 22 СС d(OH) 22 + 2 HCl = Cd. Cl 22 +2 H 22 OO
ХИМИЧЕСКИЕ СВОЙСТВА Zn. O + 2 HCI +3 H 22 O = [Zn(H 22 O)O) 44 ]CI]CI 22 Zn. O + 2 Na. OH + H 22 O = Na 22 [Zn(OH) 44 ]] Cd(OH) 22 + 6 NH 33 = [Cd(NH 33 )) 66 ](OH) 22 СС d(OH) 22 + 2 HCl = Cd. Cl 22 +2 H 22 OO
 Из солей ртути известны : Hg 2 Cl 2 – каломель ( практически не растворима в воде) Hg +2 Cl 2 – сулема (устойчива на воздухе, токсична, растворяется в воде. Сильнейший яд. Применяется в медицине как сильное дезинфицирующее средство, в с/х для протравы семян, дубления кожи.
Из солей ртути известны : Hg 2 Cl 2 – каломель ( практически не растворима в воде) Hg +2 Cl 2 – сулема (устойчива на воздухе, токсична, растворяется в воде. Сильнейший яд. Применяется в медицине как сильное дезинфицирующее средство, в с/х для протравы семян, дубления кожи.
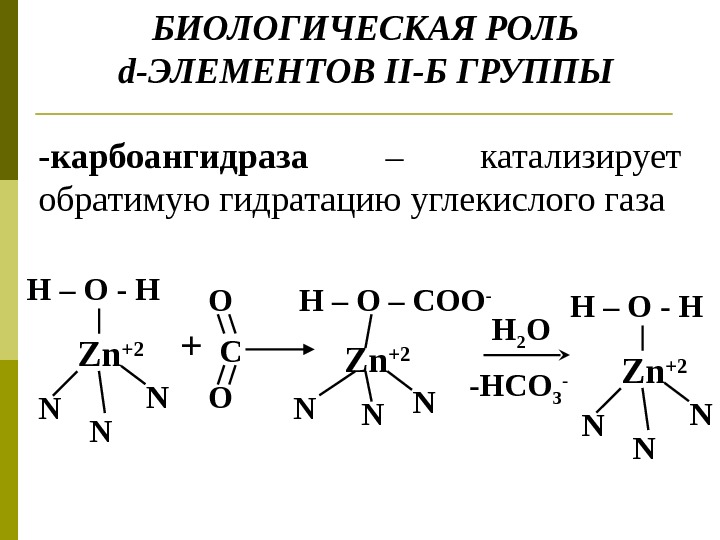
 БИОЛОГИЧЕСКАЯ РОЛЬ d -ЭЛЕМЕНТОВ II- Б ГРУППЫ N Zn +2 H – O — H N N + N Zn +2 H – O – COO — N N H 2 O -HCO 3 — OO C N Zn +2 H – O — H N N-карбоангидраза – катализирует обратимую гидратацию углекислого газа
БИОЛОГИЧЕСКАЯ РОЛЬ d -ЭЛЕМЕНТОВ II- Б ГРУППЫ N Zn +2 H – O — H N N + N Zn +2 H – O – COO — N N H 2 O -HCO 3 — OO C N Zn +2 H – O — H N N-карбоангидраза – катализирует обратимую гидратацию углекислого газа
 БИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ II -Б ГРУППЫ — карбоксипептидаза – катализирует процесс гидролиза пептидной связи R 1 — C NH R 2 O + H O H КОП ·Zn +2 O R 1 -C OH + + R 2 – NH
БИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ II -Б ГРУППЫ — карбоксипептидаза – катализирует процесс гидролиза пептидной связи R 1 — C NH R 2 O + H O H КОП ·Zn +2 O R 1 -C OH + + R 2 – NH
 ОБЩАЯ ХАРАКТЕРИСТИКА d -ЭЛЕМЕНТОВ VI — Б ГРУППЫ (n – 1) dd aa n. S bb , , где а = от 1 до 10, bb = от 1 до
ОБЩАЯ ХАРАКТЕРИСТИКА d -ЭЛЕМЕНТОВ VI — Б ГРУППЫ (n – 1) dd aa n. S bb , , где а = от 1 до 10, bb = от 1 до
 ОБЩАЯ ХАРАКТЕРИСТИКА d -ЭЛЕМЕНТОВ VI- Б ГРУППЫ Cr. Cr Mo. Mo WW . . . 3 d 3 d 55 4 s 4 s 11 . . . 4 d 4 d 55 5 s 5 s 11 . . . 5 d 5 d 44 6 s 6 s 22 +2, +3, +6 +6 Радиус уменьшается Энергия ионизации увеличивается Химическая активность снижается
ОБЩАЯ ХАРАКТЕРИСТИКА d -ЭЛЕМЕНТОВ VI- Б ГРУППЫ Cr. Cr Mo. Mo WW . . . 3 d 3 d 55 4 s 4 s 11 . . . 4 d 4 d 55 5 s 5 s 11 . . . 5 d 5 d 44 6 s 6 s 22 +2, +3, +6 +6 Радиус уменьшается Энергия ионизации увеличивается Химическая активность снижается
 Свойства соединений элементов VI- Б группы В низшей степени окисления – основные и восстановительные свойства – Cr +2+2 OO , (С r(OH) 22 ))
Свойства соединений элементов VI- Б группы В низшей степени окисления – основные и восстановительные свойства – Cr +2+2 OO , (С r(OH) 22 ))
 Свойства соединений VI – Б группы В промежуточой степени окисления –амфотерные свойства — Cr 22 OO 33 Cr(OH) 3 – гидроксид хрома ( III ) H 3 Cr. O 3 – ортохромистая к-та HCr. O 2 – метахромистая к-та Cr. Cr 22 OO 33 + + 2 Na. OH = 2 Na. Cr. O 22 + H 22 OO Cr. Cr (ОН) 33 + 3 Н 22 О + 3 HCIHCI = [ Cr. Cr (Н(Н 22 О)О) 66 ]] CICI 33 Cr. Cr (ОН) 33 + 3 Na. Na ОНОН = = Na. Na 33 [[ Cr. Cr (ОН) 66 ]] 3 -3 —
Свойства соединений VI – Б группы В промежуточой степени окисления –амфотерные свойства — Cr 22 OO 33 Cr(OH) 3 – гидроксид хрома ( III ) H 3 Cr. O 3 – ортохромистая к-та HCr. O 2 – метахромистая к-та Cr. Cr 22 OO 33 + + 2 Na. OH = 2 Na. Cr. O 22 + H 22 OO Cr. Cr (ОН) 33 + 3 Н 22 О + 3 HCIHCI = [ Cr. Cr (Н(Н 22 О)О) 66 ]] CICI 33 Cr. Cr (ОН) 33 + 3 Na. Na ОНОН = = Na. Na 33 [[ Cr. Cr (ОН) 66 ]] 3 -3 —
 В высшей степени окисления – кислотные и окислительные свойства — — Cr. O 33 Свойства соединений VI – Б группы Cr. O 33 + Н 22 О = HH 22 Cr. O 44 хромовая кислота (желтая ) 22 Cr. O 33 + Н 22 О = HH 22 Cr. Cr 22 OO 7 7 дихромовая кислота (оранжевая)
В высшей степени окисления – кислотные и окислительные свойства — — Cr. O 33 Свойства соединений VI – Б группы Cr. O 33 + Н 22 О = HH 22 Cr. O 44 хромовая кислота (желтая ) 22 Cr. O 33 + Н 22 О = HH 22 Cr. Cr 22 OO 7 7 дихромовая кислота (оранжевая)
 БИОЛОГИЧЕСКАЯ РОЛЬ VI- Б ГРУППЫ R – COH + КОКС · Мо +6 +Н 2 О → → H 3 O. . . OCR — КОКС · Мо +4 → → RCOOH + КОКС · Мо +6 + 2 Н +Ксантиноксидаза (КОКС) – катализирует окисление ксантина и гипоксантина до мочевой кислоты, альдегидов и кислот
БИОЛОГИЧЕСКАЯ РОЛЬ VI- Б ГРУППЫ R – COH + КОКС · Мо +6 +Н 2 О → → H 3 O. . . OCR — КОКС · Мо +4 → → RCOOH + КОКС · Мо +6 + 2 Н +Ксантиноксидаза (КОКС) – катализирует окисление ксантина и гипоксантина до мочевой кислоты, альдегидов и кислот
 ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII –Б ГРУППЫ Mn Tc Re Re . . . 33 dd 55 44 ss 22 . . . 4 d 4 d 55 5 s 5 s 22 . . . 5 d 5 d 55 6 s 6 s 22 +2, +3, +4, +6, +7 +4, +7 Степень окисления Mn: +2 Mn. O, Mn(OH) 22 , [Mn(H 22 O)O) 44 ]CI]CI
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII –Б ГРУППЫ Mn Tc Re Re . . . 33 dd 55 44 ss 22 . . . 4 d 4 d 55 5 s 5 s 22 . . . 5 d 5 d 55 6 s 6 s 22 +2, +3, +4, +6, +7 +4, +7 Степень окисления Mn: +2 Mn. O, Mn(OH) 22 , [Mn(H 22 O)O) 44 ]CI]CI
 ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления Mn: +4 Mn. O 22 , Mn(OH) 44 HH 44 Mn. O 44 — — орто-марганцеватистая HH 22 Mn. O 33 – – мета-марганцеватистая
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления Mn: +4 Mn. O 22 , Mn(OH) 44 HH 44 Mn. O 44 — — орто-марганцеватистая HH 22 Mn. O 33 – – мета-марганцеватистая
 ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления : +6 Mn. O 3 H 2 Mn. O 4 – марганцовистая к-та КК 22 Mn. O 44 — манганат калия соединения неустойчивы, являются окислителями
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления : +6 Mn. O 3 H 2 Mn. O 4 – марганцовистая к-та КК 22 Mn. O 44 — манганат калия соединения неустойчивы, являются окислителями
 ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления : +7 Mn 2 O 7 — оксид марганца ( VII) HMn. O 4 – марганцовая к-та (соли наз. — перманганаты) KMn. O 4 – перманганат калия
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII -Б ГРУППЫ Степень окисления : +7 Mn 2 O 7 — оксид марганца ( VII) HMn. O 4 – марганцовая к-та (соли наз. — перманганаты) KMn. O 4 – перманганат калия
 БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦА В организме находится в степени окисления Mn. Mn +2+2 1. 1. Образует комплексы с нуклеиновыми кислотами и аминокислотами 2. 2. Входит в состав ферментов : : аргиназы, холинэстеразы, фосфоглюкомутазы, пируваткарбокси лазы. 3. 3. Участвует в синтезе витаминов С и В 12 Марганец содержится в красной свекле, картофеле, печени.
БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦА В организме находится в степени окисления Mn. Mn +2+2 1. 1. Образует комплексы с нуклеиновыми кислотами и аминокислотами 2. 2. Входит в состав ферментов : : аргиназы, холинэстеразы, фосфоглюкомутазы, пируваткарбокси лазы. 3. 3. Участвует в синтезе витаминов С и В 12 Марганец содержится в красной свекле, картофеле, печени.
 ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МАРГАНЦА В МЕДИЦИНЕ KMn. O 44 – 5% дезинфицирующее средство, как кровоостанавливающее Mn. SO 4 4 – – при лечении анемии Mn. CI 22 – – при лечении атеросклероза
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МАРГАНЦА В МЕДИЦИНЕ KMn. O 44 – 5% дезинфицирующее средство, как кровоостанавливающее Mn. SO 4 4 – – при лечении анемии Mn. CI 22 – – при лечении атеросклероза
 ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Fe Co Ni. . . . 3 d 3 d 66 4 s 4 s 22 . . . 3 d 3 d 77 4 s 4 s 22 . . . 3 d 3 d 88 4 s 4 s 22 +2, +3, +6; +2, +3, +5; +2, +3, +4; В степени окисления +2 +2 элементы проявляют основные и восстановительные свойства ; ; +3 – амфотерные ; ; +4, +5, +6 – окислительные и кислотные
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Fe Co Ni. . . . 3 d 3 d 66 4 s 4 s 22 . . . 3 d 3 d 77 4 s 4 s 22 . . . 3 d 3 d 88 4 s 4 s 22 +2, +3, +6; +2, +3, +5; +2, +3, +4; В степени окисления +2 +2 элементы проявляют основные и восстановительные свойства ; ; +3 – амфотерные ; ; +4, +5, +6 – окислительные и кислотные
 ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Степень окисления +3 Fe. Fe 22 OO 33 , Co 22 OO 33 , Ni 22 OO 33 Fe(OH) 33 – – амфотерное соединение Fe(OH) 33 + 3 HCI + 3 H 22 O = [Fe(H 22 O)O) 66 ]CI]CI 33 Fe(OH) 33 + 3 Na. OH = Na 33 [Fe(OH) 66 ]] Сплавление Fe(OH) 33 + + 3 Na. OH = = Na. Na 33 Fe. O 33 + 3 H 22 OO феррит натрия Соль железистой кислоты: H H 33 Fe. O 33 — — орто HFe. O 22 — мета
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Степень окисления +3 Fe. Fe 22 OO 33 , Co 22 OO 33 , Ni 22 OO 33 Fe(OH) 33 – – амфотерное соединение Fe(OH) 33 + 3 HCI + 3 H 22 O = [Fe(H 22 O)O) 66 ]CI]CI 33 Fe(OH) 33 + 3 Na. OH = Na 33 [Fe(OH) 66 ]] Сплавление Fe(OH) 33 + + 3 Na. OH = = Na. Na 33 Fe. O 33 + 3 H 22 OO феррит натрия Соль железистой кислоты: H H 33 Fe. O 33 — — орто HFe. O 22 — мета
 ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Степень окисления : +6 Fe. O 3 – оксид железа ( VI) H 2 Fe. O 4 – железная кислота (соли наз. ферратами)
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII- Б ГРУППЫ Степень окисления : +6 Fe. O 3 – оксид железа ( VI) H 2 Fe. O 4 – железная кислота (соли наз. ферратами)
 Применение в медицине 1. Железо восстановленное, при лечении анемии 2. Ферамид [Fe(C 6 H 5 CONH 2 )2 CI 2 ] 3. Fe. CI 2 наружное –кровоостанавливающее и дезинфицирующее
Применение в медицине 1. Железо восстановленное, при лечении анемии 2. Ферамид [Fe(C 6 H 5 CONH 2 )2 CI 2 ] 3. Fe. CI 2 наружное –кровоостанавливающее и дезинфицирующее
 Семейство платины Цис-дихлородиаммин платина ( II) Pt +2 NH 3 H 3 N CI CI
Семейство платины Цис-дихлородиаммин платина ( II) Pt +2 NH 3 H 3 N CI CI

