Химия элементов 5-ой А группы.pptx
- Количество слайдов: 51
 Химия элементов 5 -ой А группы: N, P, As, Sb, Bi
Химия элементов 5 -ой А группы: N, P, As, Sb, Bi
 К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут. Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна -5, а отрицательная - 3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода H, таким образом, не обладают кислотными свойствами.
К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут. Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна -5, а отрицательная - 3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода H, таким образом, не обладают кислотными свойствами.
 - распространения в природе - методы получения - взаимодействие с простыми веществами - взаимодействие с водой, щелочью, кислотами - химия соединения оксидов, кислот, солей - применение
- распространения в природе - методы получения - взаимодействие с простыми веществами - взаимодействие с водой, щелочью, кислотами - химия соединения оксидов, кислот, солей - применение
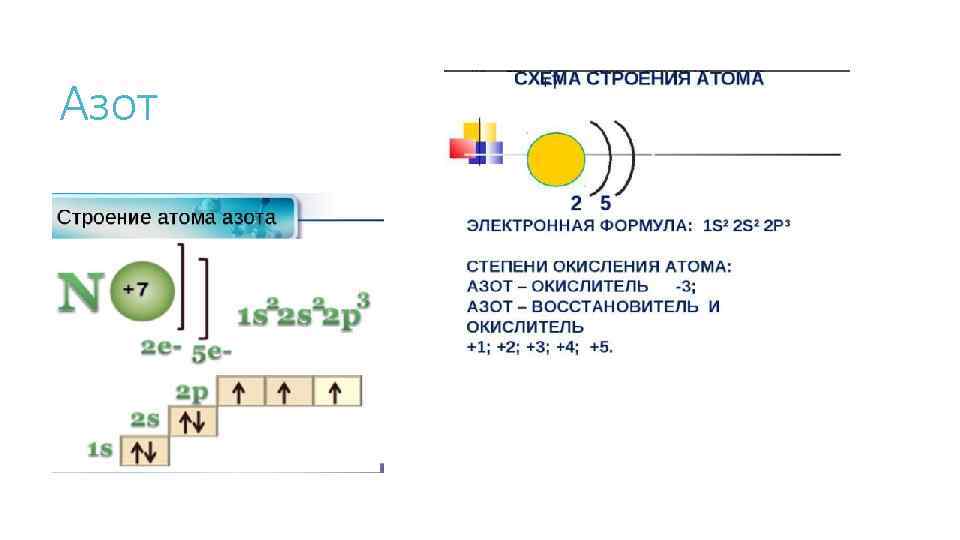 Азот
Азот
 Нахождение в природе - изотропы - распространенность - биологическая роль - круговорот азота в природе - токсикология азота и его соединений
Нахождение в природе - изотропы - распространенность - биологическая роль - круговорот азота в природе - токсикология азота и его соединений
 Изотропы Природный азот состоит из двух стабильных изотопов 14 N — 99, 635 % и 15 N — 0, 365 %. Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин. Спин ядер стабильных изотопов азота: 14 N — 1; 15 N — 1/2.
Изотропы Природный азот состоит из двух стабильных изотопов 14 N — 99, 635 % и 15 N — 0, 365 %. Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин. Спин ядер стабильных изотопов азота: 14 N — 1; 15 N — 1/2.
![Распространенность Азот — один из самых распространённых элементов на Земле[4]. Вне пределов Земли азот Распространенность Азот — один из самых распространённых элементов на Земле[4]. Вне пределов Земли азот](https://present5.com/presentation/1/100915592_437527119.pdf-img/100915592_437527119.pdf-7.jpg) Распространенность Азот — один из самых распространённых элементов на Земле[4]. Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Атмосферы спутников Титан, Тритон и карликовой планеты Плутон тоже в основном состоят из азота. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода). Азот в форме двухатомных молекул N 2 составляет большую часть атмосферы Земли, где его содержание составляет 75, 6 % (по массе) или 78, 084 % (по объёму), то есть около 3, 87· 1015 т. Содержание азота в земной коре, по данным разных авторов, составляет (0, 7— 1, 5)· 1015 т (причём в гумусе — порядка 6· 1010 т), а в мантии Земли — 1, 3· 1016 т.
Распространенность Азот — один из самых распространённых элементов на Земле[4]. Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Атмосферы спутников Титан, Тритон и карликовой планеты Плутон тоже в основном состоят из азота. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода). Азот в форме двухатомных молекул N 2 составляет большую часть атмосферы Земли, где его содержание составляет 75, 6 % (по массе) или 78, 084 % (по объёму), то есть около 3, 87· 1015 т. Содержание азота в земной коре, по данным разных авторов, составляет (0, 7— 1, 5)· 1015 т (причём в гумусе — порядка 6· 1010 т), а в мантии Земли — 1, 3· 1016 т.
 Биологическая роль Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16— 18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2, 5 % (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1, 9· 1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Биологическая роль Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16— 18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2, 5 % (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1, 9· 1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
 Круговорот азота в природе Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Круговорот азота в природе Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
 Токсикология азота и его соединений Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь. Многие соединения азота очень активны и нередко токсичны.
Токсикология азота и его соединений Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь. Многие соединения азота очень активны и нередко токсичны.
 Получение В лабораториях его можно получать по реакции разложения нитрита аммония: Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Получение В лабораториях его можно получать по реакции разложения нитрита аммония: Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
 Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2: 1 по массе). Реакция идёт по уравнениям: Наиболее чистый азот можно получить разложением азидов металлов:
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2: 1 по массе). Реакция идёт по уравнениям: Наиболее чистый азот можно получить разложением азидов металлов:
 Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот» . Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот» . Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
 Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700 °C: Аммиак берут из его насыщенного раствора при нагревании. Количество Cu. O в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700 °C: Аммиак берут из его насыщенного раствора при нагревании. Количество Cu. O в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
 Химические свойства азотной кислоты Типичные свойства кислот 1) Взаимодействует с основными и амфотерными оксидами: 2) С основаниями, амфотерными гидроксидами:
Химические свойства азотной кислоты Типичные свойства кислот 1) Взаимодействует с основными и амфотерными оксидами: 2) С основаниями, амфотерными гидроксидами:
 3) Вытесняет слабые кислоты из их солей:
3) Вытесняет слабые кислоты из их солей:
 Специфические свойства азотной кислоты как окислителя 1) Взаимодействие азотной кислоты с металлами Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.
Специфические свойства азотной кислоты как окислителя 1) Взаимодействие азотной кислоты с металлами Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.



 2) Проявляет окислительные свойства при взаимодействии с неметаллами: 3) Азотная кислота окисляет сложные вещества:
2) Проявляет окислительные свойства при взаимодействии с неметаллами: 3) Азотная кислота окисляет сложные вещества:
 4) Ксантопротеиновая реакция: Азотная кислота окрашивает белки в оранжево-желтый цвет(при попадании на кожу рук – “ксантопротеиновая реакция”) Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты
4) Ксантопротеиновая реакция: Азотная кислота окрашивает белки в оранжево-желтый цвет(при попадании на кожу рук – “ксантопротеиновая реакция”) Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты
 5) Окислительные свойства «Царской водки»
5) Окислительные свойства «Царской водки»
 Применение Жидкий азот применяется как хладагент и для криотерапии В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п.
Применение Жидкий азот применяется как хладагент и для криотерапии В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п.
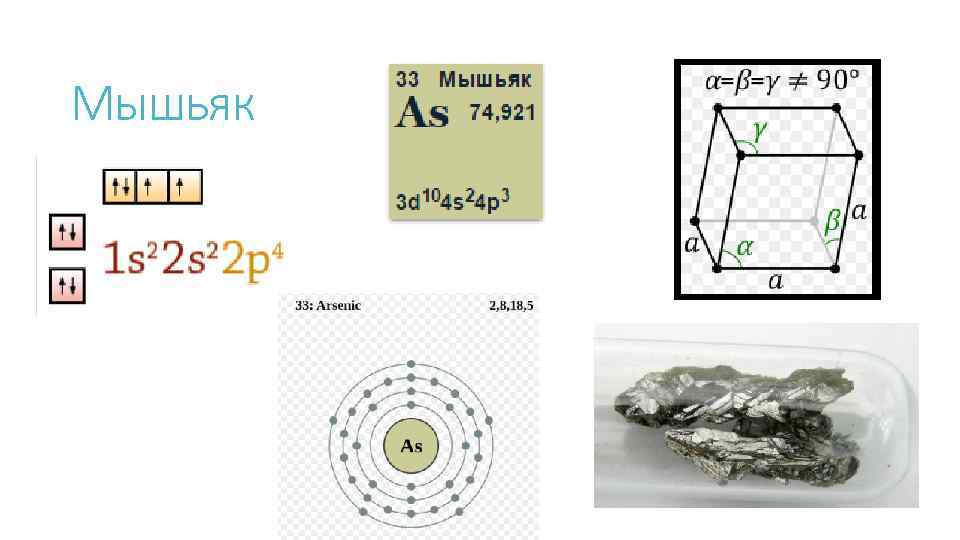 Мышьяк
Мышьяк
 Распространение мышьяка в природе Мышьяк — рассеянный элемент. Содержание в земной коре 1, 7· 10− 4% по массе. В морской воде 0, 003 мг/л[7]. Этот элемент иногда встречается в природе в самородном виде, минерал имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из мелких зёрнышек. Известно около 200 мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам. Довольно распространены два природных минерала мышьяка в виде сульфидов (бинарных соединений с серой): оранжево-красный прозрачный реальгар As. S и лимонно-жёлтый аурипигмент As 2 S 3. Минерал, имеющий промышленное значение для получения мышьяка, — арсенопирит (мышьяковый колчедан) Fe. As. S или Fe. S 2 • Fe. As 2 (46 % As), также перерабатывают мышьяковистый колчедан — лёллингит (Fe. As 2) (72, 8 % As), скородит Fe. As. O 4 (27 — 36 % As). Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
Распространение мышьяка в природе Мышьяк — рассеянный элемент. Содержание в земной коре 1, 7· 10− 4% по массе. В морской воде 0, 003 мг/л[7]. Этот элемент иногда встречается в природе в самородном виде, минерал имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из мелких зёрнышек. Известно около 200 мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам. Довольно распространены два природных минерала мышьяка в виде сульфидов (бинарных соединений с серой): оранжево-красный прозрачный реальгар As. S и лимонно-жёлтый аурипигмент As 2 S 3. Минерал, имеющий промышленное значение для получения мышьяка, — арсенопирит (мышьяковый колчедан) Fe. As. S или Fe. S 2 • Fe. As 2 (46 % As), также перерабатывают мышьяковистый колчедан — лёллингит (Fe. As 2) (72, 8 % As), скородит Fe. As. O 4 (27 — 36 % As). Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
 Месторождения Главный промышленный минерал мышьяка — арсенопирит Fe. As. S. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые — в Канаде, мышьяково-оловянные — в Боливии и Англии. Кроме того, известны золотомышьяковые месторождения в США и. Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке[8].
Месторождения Главный промышленный минерал мышьяка — арсенопирит Fe. As. S. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые — в Канаде, мышьяково-оловянные — в Боливии и Англии. Кроме того, известны золотомышьяковые месторождения в США и. Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке[8].
 Изотопы Известны 33 изотопа и, по крайней мере, 10 возбуждённых состояний ядерных изомеров. Из этих изотопов стабилен только 75 As и природный мышьяк состоит только из этого изотопа. Наиболее долгоживущий радиоактивный изотоп 73 As имеет период полураспада 80, 3 дня.
Изотопы Известны 33 изотопа и, по крайней мере, 10 возбуждённых состояний ядерных изомеров. Из этих изотопов стабилен только 75 As и природный мышьяк состоит только из этого изотопа. Наиболее долгоживущий радиоактивный изотоп 73 As имеет период полураспада 80, 3 дня.
 Получение Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами. Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др. В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печахбез доступа воздуха.
Получение Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами. Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др. В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печахбез доступа воздуха.
 Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углем
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углем
 Соединения мышьяка Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения: 6 Ca +As 4 = 2 Ca 3 As 2 При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As 2 O 3: As 4 + 3 O 2 =2 As 2 O 3
Соединения мышьяка Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения: 6 Ca +As 4 = 2 Ca 3 As 2 При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As 2 O 3: As 4 + 3 O 2 =2 As 2 O 3
 По отношению к кислотам мышьяк ведет себя следующим образом: — с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка As. Cl 3: 4 As +3 O 2 +12 HCl = 4 As. Cl 3 +6 H 2 O — разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H 3 As. O 3, а концентрированная азотная кислота – до ортомышьякой кислоты H 3 As. O 4: 3 As + 5 HNO 3 + 2 H 2 O = 3 H 2 As. O 4 +5 NO
По отношению к кислотам мышьяк ведет себя следующим образом: — с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка As. Cl 3: 4 As +3 O 2 +12 HCl = 4 As. Cl 3 +6 H 2 O — разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H 3 As. O 3, а концентрированная азотная кислота – до ортомышьякой кислоты H 3 As. O 4: 3 As + 5 HNO 3 + 2 H 2 O = 3 H 2 As. O 4 +5 NO
 Ортомышьяковая кислота (мышьяковая кислота) H 3 As. O 4*0. 5 H 2 O – бесцветные кристаллы; температура плавления – 36 о. С (с разложением); растворима в воде (88% по массе при 20 о. С); гигроскопична; в водных растворах – трех основная кислота; при нагревании около 100 о. С теряет воду, превращаясь в пиромышьяковую кислоту H 4 As 5 O 7, при более высоких температурах переходит в метамышьяковую кислоту HAs. O 3. Получают окислением As или As 2 O 3 концентрированной HNO 3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной. Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I 2 по обратимым реакциям: H 3 As. O 4 + 2 HI = H 3 As. O 3 + I 2 + H 2 O
Ортомышьяковая кислота (мышьяковая кислота) H 3 As. O 4*0. 5 H 2 O – бесцветные кристаллы; температура плавления – 36 о. С (с разложением); растворима в воде (88% по массе при 20 о. С); гигроскопична; в водных растворах – трех основная кислота; при нагревании около 100 о. С теряет воду, превращаясь в пиромышьяковую кислоту H 4 As 5 O 7, при более высоких температурах переходит в метамышьяковую кислоту HAs. O 3. Получают окислением As или As 2 O 3 концентрированной HNO 3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной. Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I 2 по обратимым реакциям: H 3 As. O 4 + 2 HI = H 3 As. O 3 + I 2 + H 2 O
 Применение Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца возрастают в разы Мышьяк особой чистоты (99, 9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки. Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого» , или «индийского» , огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Применение Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца возрастают в разы Мышьяк особой чистоты (99, 9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки. Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого» , или «индийского» , огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
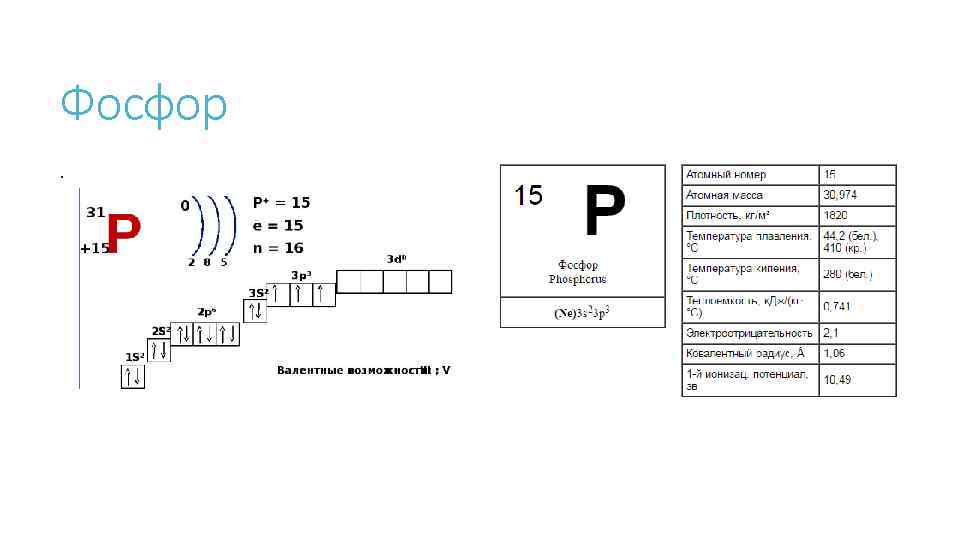 Фосфор.
Фосфор.
 Распространение фосфора в природе Среднее содержание Фосфора в земной коре (кларк) - 9, 3· 10 -2% по массе; в средних горных породах 1, 6· 10 -1, в основных породах 1, 4· 10 -1, меньше в гранитах и других кислых изверженных породах - 7· 10 -2 и еще меньше в ультраосновных породах (мантии) - 1, 7· 102 %; в осадочных горных породах от 1, 7· 10 -2 (песчаники) до 4· 10 -2% (карбонатные породы). Фосфор принимает участие в магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов. Фосфор - исключительно важный биогенный элемент, он накапливается многими организмами. С биогенной миграцией связаны многие процессы концентрации Фосфора в земной коре. Из вод Фосфор легко осаждается в виде нерастворимых минералов или захватывается живым веществом. Поэтому в морской воде лишь 7· 10 -6% Фосфора. Известно около 180 минералов Фосфора, в основном - это различные фосфаты, из которых наиболее распространены фосфаты кальция.
Распространение фосфора в природе Среднее содержание Фосфора в земной коре (кларк) - 9, 3· 10 -2% по массе; в средних горных породах 1, 6· 10 -1, в основных породах 1, 4· 10 -1, меньше в гранитах и других кислых изверженных породах - 7· 10 -2 и еще меньше в ультраосновных породах (мантии) - 1, 7· 102 %; в осадочных горных породах от 1, 7· 10 -2 (песчаники) до 4· 10 -2% (карбонатные породы). Фосфор принимает участие в магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов. Фосфор - исключительно важный биогенный элемент, он накапливается многими организмами. С биогенной миграцией связаны многие процессы концентрации Фосфора в земной коре. Из вод Фосфор легко осаждается в виде нерастворимых минералов или захватывается живым веществом. Поэтому в морской воде лишь 7· 10 -6% Фосфора. Известно около 180 минералов Фосфора, в основном - это различные фосфаты, из которых наиболее распространены фосфаты кальция.
 Методы получения Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С: Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Методы получения Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С: Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
 Взаимодействие с простыми веществами Фосфор легко окисляется кислородом: Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства: с металлами — окислитель, образует фосфиды: фосфиды разлагаются водой и кислотами с образованием фосфина с неметаллами — восстановитель: С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
Взаимодействие с простыми веществами Фосфор легко окисляется кислородом: Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства: с металлами — окислитель, образует фосфиды: фосфиды разлагаются водой и кислотами с образованием фосфина с неметаллами — восстановитель: С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
 Взаимодействие с водой, щелочью, кислотами Взаимодействие с водой H 2 O Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты: Взаимодействие со щелочами В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования
Взаимодействие с водой, щелочью, кислотами Взаимодействие с водой H 2 O Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты: Взаимодействие со щелочами В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования
 Восстановительные свойства Сильные окислители превращают фосфор в фосфорную кислоту: Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Восстановительные свойства Сильные окислители превращают фосфор в фосфорную кислоту: Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
 Химия соединения оксидов, кислот, солей Фосфор образует несколько оксидов. Важнейшими из них являются оксид фосфора (V) P 4 O 10 и оксид фосфора (III) P 4 O 6. Часто их формулы пишут в упрощённом виде - P 2 O 5 и P 2 O 3. В структуре этих оксидов сохраняется тетраэдрическое расположение атомов фосфора Оксид фосфора (III) P 4 O 6 - воскообразная кристаллическая масса, плавящаяся при 22, 5°С и превращающаяся при этом в бесцветную жидкость. Ядовит. При растворении в холодной воде образует фосфористую кислоту: P 4 O 6 + 6 H 2 O = 4 H 3 PO 3, а при реакции со щелочами - соответствующие соли (фосфиты). Сильный восстановитель. При взаимодействии с кислородом окисляется до Р 4 О 10. Оксид фосфора (III) получается окислением белого фосфора при недостатке кислорода.
Химия соединения оксидов, кислот, солей Фосфор образует несколько оксидов. Важнейшими из них являются оксид фосфора (V) P 4 O 10 и оксид фосфора (III) P 4 O 6. Часто их формулы пишут в упрощённом виде - P 2 O 5 и P 2 O 3. В структуре этих оксидов сохраняется тетраэдрическое расположение атомов фосфора Оксид фосфора (III) P 4 O 6 - воскообразная кристаллическая масса, плавящаяся при 22, 5°С и превращающаяся при этом в бесцветную жидкость. Ядовит. При растворении в холодной воде образует фосфористую кислоту: P 4 O 6 + 6 H 2 O = 4 H 3 PO 3, а при реакции со щелочами - соответствующие соли (фосфиты). Сильный восстановитель. При взаимодействии с кислородом окисляется до Р 4 О 10. Оксид фосфора (III) получается окислением белого фосфора при недостатке кислорода.
 Оксид фосфора (V) P 4 O 10 - белый кристаллический порошок. Температура возгонки 36°С. Имеет несколько модификаций, одна из которых (так называемая летучая) имеет состав Р 4 О 10. Кристаллическая решётка этой модификации слагается из молекул Р 4 О 10, связанных между собой слабыми межмолекулярными силами, легко разрывающимися при нагревании. Отсюда и летучесть этой разновидности. Другие модификации полимерны. Они образованы бесконечными слоями тетраэдров РО 4. При взаимодействии Р 4 О 10 с водой образуется фосфорная кислота: P 4 O 10 + 6 H 2 O = 4 H 3 PO 4. Будучи кислотным оксидом, Р 4 О 10 вступает в реакции с основными оксидами и гидроксидами. Образуется при высокотемпературном окислении фосфора в избытке кислорода (сухого воздуха).
Оксид фосфора (V) P 4 O 10 - белый кристаллический порошок. Температура возгонки 36°С. Имеет несколько модификаций, одна из которых (так называемая летучая) имеет состав Р 4 О 10. Кристаллическая решётка этой модификации слагается из молекул Р 4 О 10, связанных между собой слабыми межмолекулярными силами, легко разрывающимися при нагревании. Отсюда и летучесть этой разновидности. Другие модификации полимерны. Они образованы бесконечными слоями тетраэдров РО 4. При взаимодействии Р 4 О 10 с водой образуется фосфорная кислота: P 4 O 10 + 6 H 2 O = 4 H 3 PO 4. Будучи кислотным оксидом, Р 4 О 10 вступает в реакции с основными оксидами и гидроксидами. Образуется при высокотемпературном окислении фосфора в избытке кислорода (сухого воздуха).
 От безводной хлорной кислоты отнимает химически связанную воду с образованием её ангидрида: 4 HCl. O 4 + P 4 O 10 = (HPO 3)4 + 2 Cl 2 O 7.
От безводной хлорной кислоты отнимает химически связанную воду с образованием её ангидрида: 4 HCl. O 4 + P 4 O 10 = (HPO 3)4 + 2 Cl 2 O 7.
 Кислоты и их соли а) Фосфористая кислота H 3 PO 3. Безводная фосфористая кислота Н 3 РО 3 образует кристаллы плотностью 1, 65 г/см 3, плавящиеся при 74°С. При нагревании безводной Н 3 РО 3 происходит реакция диспропорционирования (самоокисления-самовосстановления): 4 H 3 PO 3 = PH 3^ + 3 H 3 PO 4. Соли фосфористой кислоты - фосфиты. Например, K 3 PO 3 (фосфит калия) или Mg 3(PO 3)2 (фосфит магния). Фосфористую кислоту Н 3 РО 3 получают растворением в воде оксида фосфора (III) или гидролизом хлорида фосфора (III) РCl 3: РCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl^.
Кислоты и их соли а) Фосфористая кислота H 3 PO 3. Безводная фосфористая кислота Н 3 РО 3 образует кристаллы плотностью 1, 65 г/см 3, плавящиеся при 74°С. При нагревании безводной Н 3 РО 3 происходит реакция диспропорционирования (самоокисления-самовосстановления): 4 H 3 PO 3 = PH 3^ + 3 H 3 PO 4. Соли фосфористой кислоты - фосфиты. Например, K 3 PO 3 (фосфит калия) или Mg 3(PO 3)2 (фосфит магния). Фосфористую кислоту Н 3 РО 3 получают растворением в воде оксида фосфора (III) или гидролизом хлорида фосфора (III) РCl 3: РCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl^.
 б) Фосфорная кислота (ортофосфорная кислота) H 3 PO 4. Безводная фосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42, 35°С. С водой фосфорная кислота образует растворы любых концентраций. Фосфорная кислота реагирует с металлами, расположенными в ряду стандартных электродных потенциалов до водорода, с основными оксидами, с основаниями, с солями слабых кислот. В лаборатории фосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой: 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO^. В промышленности фосфорную кислоту получают двумя способами: экстракционным и термическим. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой: Ca 3(PO 4)2 + 3 H 2 SO 4 = 2 H 3 PO 4 + 3 Ca. SO 4 v. Фосфорная кислота затем отфильтровывается и концентрируется упариванием.
б) Фосфорная кислота (ортофосфорная кислота) H 3 PO 4. Безводная фосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42, 35°С. С водой фосфорная кислота образует растворы любых концентраций. Фосфорная кислота реагирует с металлами, расположенными в ряду стандартных электродных потенциалов до водорода, с основными оксидами, с основаниями, с солями слабых кислот. В лаборатории фосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой: 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO^. В промышленности фосфорную кислоту получают двумя способами: экстракционным и термическим. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой: Ca 3(PO 4)2 + 3 H 2 SO 4 = 2 H 3 PO 4 + 3 Ca. SO 4 v. Фосфорная кислота затем отфильтровывается и концентрируется упариванием.
 Фосфорная кислота не является сильной кислотой. Как трёхосновная кислота, в водном растворе диссоциирует ступенчато. Легче идет диссоциация по первой ступени. 1. H 3 PO 4 H+ + (дигидрофосфат-ион); 2. H+ + (гидрофосфат-ион); 3. H+ + (фосфат-ион). Суммарное ионное уравнение диссоциации фосфорной кислоты: H 3 PO 4 3 H+ +. Фосфорная кислота образует три ряда солей: а) K 3 PO 4, Ca 3(PO 4)2 - трёхзамещённые, или фосфаты; б) K 2 HPO 4, Ca. HPO 4 - двухзамещённые, или гидрофосфаты; в) KH 2 PO 4, Ca(H 2 PO 4)2 - однозамещённые, или дигидрофосфаты. Однозамещенные фосфаты имеют кислую реакцию, двухзамещённые - слабощелочную, трехзамещённые - щелочную.
Фосфорная кислота не является сильной кислотой. Как трёхосновная кислота, в водном растворе диссоциирует ступенчато. Легче идет диссоциация по первой ступени. 1. H 3 PO 4 H+ + (дигидрофосфат-ион); 2. H+ + (гидрофосфат-ион); 3. H+ + (фосфат-ион). Суммарное ионное уравнение диссоциации фосфорной кислоты: H 3 PO 4 3 H+ +. Фосфорная кислота образует три ряда солей: а) K 3 PO 4, Ca 3(PO 4)2 - трёхзамещённые, или фосфаты; б) K 2 HPO 4, Ca. HPO 4 - двухзамещённые, или гидрофосфаты; в) KH 2 PO 4, Ca(H 2 PO 4)2 - однозамещённые, или дигидрофосфаты. Однозамещенные фосфаты имеют кислую реакцию, двухзамещённые - слабощелочную, трехзамещённые - щелочную.
 Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворяется в воде лишь дигидрофосфат кальция. Гидрофосфат кальция и фосфат кальция растворимы в органических кислотах. При нагревании фосфорная кислота вначале теряет воду - растворитель, затем начинается дегидратация фосфорной кислоты и образуется дифосфорная кислота: 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O. Значительная часть фосфорной кислоты превращается в дифосфорную при температуре около 260°С.
Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворяется в воде лишь дигидрофосфат кальция. Гидрофосфат кальция и фосфат кальция растворимы в органических кислотах. При нагревании фосфорная кислота вначале теряет воду - растворитель, затем начинается дегидратация фосфорной кислоты и образуется дифосфорная кислота: 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O. Значительная часть фосфорной кислоты превращается в дифосфорную при температуре около 260°С.
 в) Фосфорноватая кислота (гипофосфорная кислота) H 4 P 2 O 6. . H 4 P 2 O 6 - четырёхосновная кислота средней силы. При хранении гипофосфорная кислота постепенно разлагается. При нагревании её растворов превращается в Н 3 РО 4 и Н 3 РО 3. Образуется при медленном окислении Н 3 РО 3 на воздухе или окислении белого фосфора во влажном воздухе. г) Фосфорноватистая кислота (гипофосфористая кислота) H 3 PO 2. Эта кислота одноосновная, сильная. Фосфорноватистой кислоте соответствует следующая структурная формула: . Гипофосфиты - соли фосфорноватистой кислоты - обычно хорошо растворимы в воде.
в) Фосфорноватая кислота (гипофосфорная кислота) H 4 P 2 O 6. . H 4 P 2 O 6 - четырёхосновная кислота средней силы. При хранении гипофосфорная кислота постепенно разлагается. При нагревании её растворов превращается в Н 3 РО 4 и Н 3 РО 3. Образуется при медленном окислении Н 3 РО 3 на воздухе или окислении белого фосфора во влажном воздухе. г) Фосфорноватистая кислота (гипофосфористая кислота) H 3 PO 2. Эта кислота одноосновная, сильная. Фосфорноватистой кислоте соответствует следующая структурная формула: . Гипофосфиты - соли фосфорноватистой кислоты - обычно хорошо растворимы в воде.
 Гипофосфиты и Н 3 РО 2 - энергичные восстановители (особенно в кислой среде). Их ценной особенностью является способность восстанавливать растворённые соли некоторых металлов (Ni, Cu и др. ) до свободного металла: 2 Ni 2+ + + 2 H 2 O > Ni 0 + + 6 H+. Получается фосфорноватистая кислота разложением гипофосфитов кальция или бария серной кислотой: Ba(H 2 PO 2)2 + H 2 SO 4 = 2 H 3 PO 2 + Ba. SO 4 v. Гипофосфиты образуются при кипячении белого фосфора в суспензиях гидроксидов кальция или бария. 2 P 4 (белый) + 3 Ba(OH)2 + 6 H 2 O = 2 PH 3^ + 3 Ba(H 2 PO 2)2.
Гипофосфиты и Н 3 РО 2 - энергичные восстановители (особенно в кислой среде). Их ценной особенностью является способность восстанавливать растворённые соли некоторых металлов (Ni, Cu и др. ) до свободного металла: 2 Ni 2+ + + 2 H 2 O > Ni 0 + + 6 H+. Получается фосфорноватистая кислота разложением гипофосфитов кальция или бария серной кислотой: Ba(H 2 PO 2)2 + H 2 SO 4 = 2 H 3 PO 2 + Ba. SO 4 v. Гипофосфиты образуются при кипячении белого фосфора в суспензиях гидроксидов кальция или бария. 2 P 4 (белый) + 3 Ba(OH)2 + 6 H 2 O = 2 PH 3^ + 3 Ba(H 2 PO 2)2.
 Применение Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение. - элементный фосфор - соединения фосфора в сельском хозяйстве - соединения фосфора в промышленности - фосфатные связующие
Применение Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение. - элементный фосфор - соединения фосфора в сельском хозяйстве - соединения фосфора в промышленности - фосфатные связующие
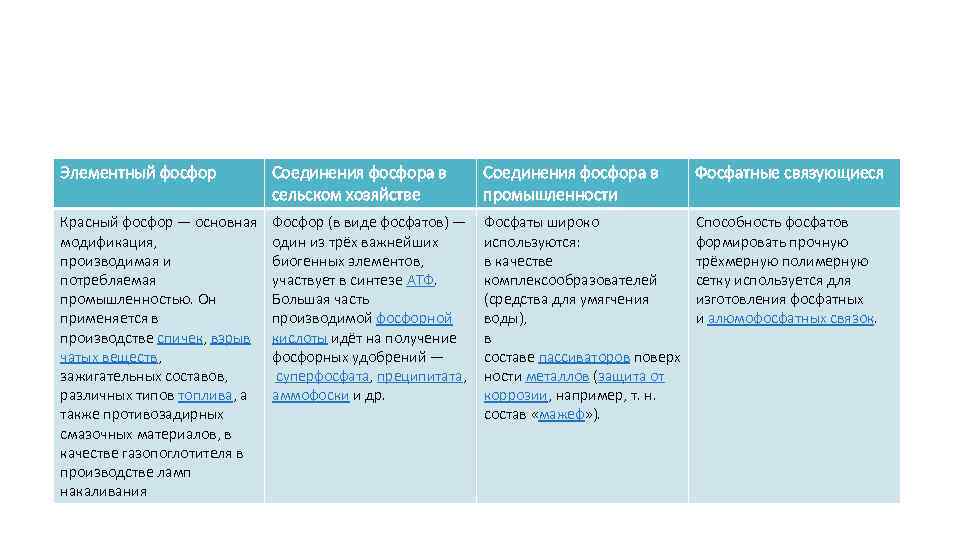 Элементный фосфор Соединения фосфора в сельском хозяйстве Соединения фосфора в промышленности Фосфатные связующиеся Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрыв чатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др. Фосфаты широко используются: в качестве комплексообразователей (средства для умягчения воды), в составе пассиваторов поверх ности металлов (защита от коррозии, например, т. н. состав «мажеф» ). Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Элементный фосфор Соединения фосфора в сельском хозяйстве Соединения фосфора в промышленности Фосфатные связующиеся Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрыв чатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др. Фосфаты широко используются: в качестве комплексообразователей (средства для умягчения воды), в составе пассиваторов поверх ности металлов (защита от коррозии, например, т. н. состав «мажеф» ). Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.


