Lektsia_11_7V_gruppa_Marganets.ppt
- Количество слайдов: 24

Химия d-элементов ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIIВ ГРУППЫ. МАРГАНЕЦ.
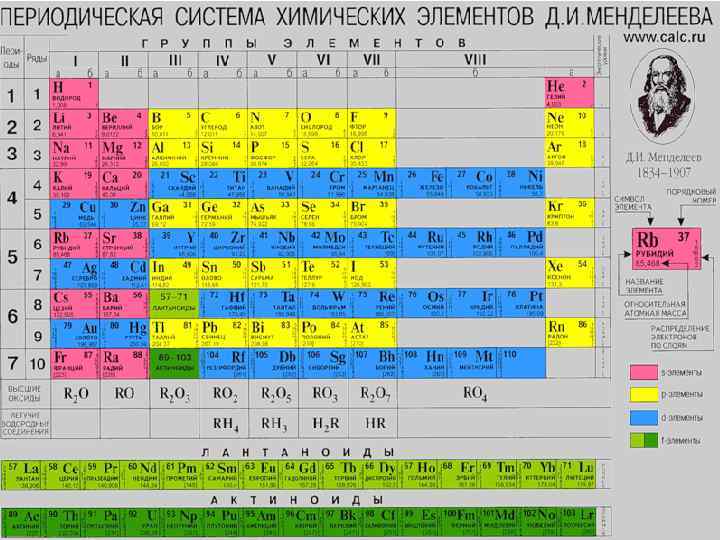
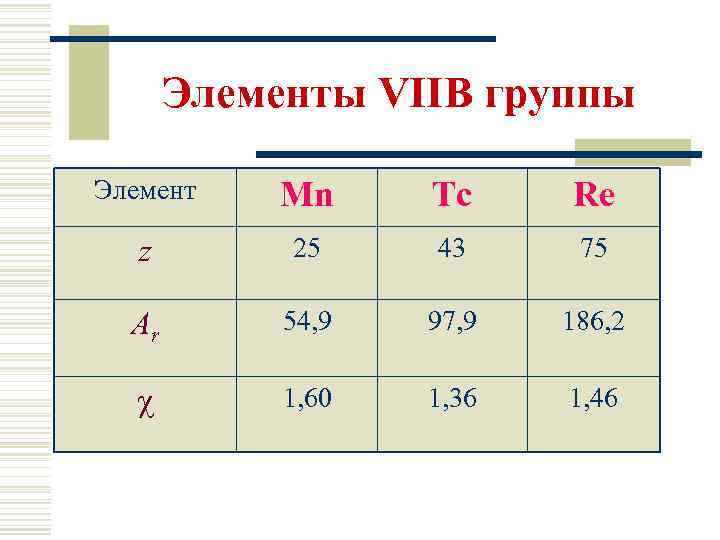
Элементы VIIВ группы Элемент Mn Tc Re z 25 43 75 Ar 54, 9 97, 9 186, 2 1, 60 1, 36 1, 46
![Элементы VIIВ группы w Общая электронная формула: […] ns 2 (n– 1)d 5 np Элементы VIIВ группы w Общая электронная формула: […] ns 2 (n– 1)d 5 np](https://present5.com/presentation/198569245_449820691/image-4.jpg)
Элементы VIIВ группы w Общая электронная формула: […] ns 2 (n– 1)d 5 np 0 ns 2 (n– 1)d 5 Степени окисления: +II +VII КЧ 4, 6 (Mn) Валентные возможности: Tc, Re 4, 6
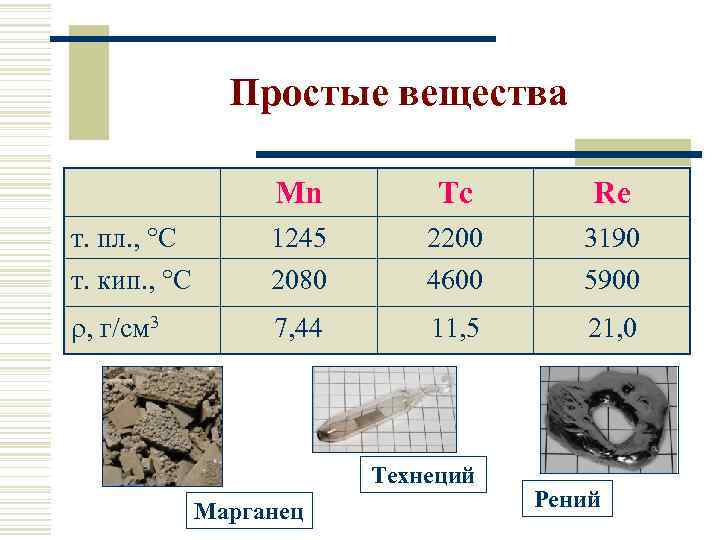
Простые вещества Mn Tc Re т. пл. , С т. кип. , С 1245 2080 2200 4600 3190 5900 , г/см 3 7, 44 11, 5 21, 0 Технеций Марганец Рений
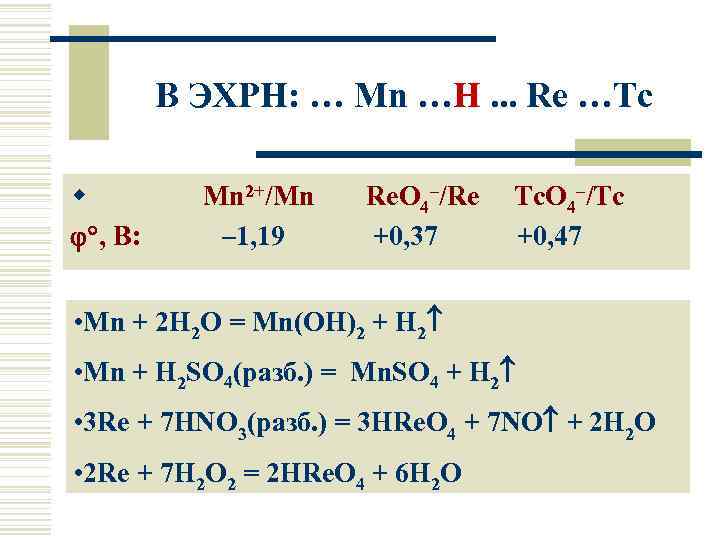
В ЭХРН: … Mn …H. . . Re …Tc w Mn 2+/Mn , В: – 1, 19 Re. O 4–/Re +0, 37 Tc. O 4–/Tc +0, 47 • Mn + 2 H 2 O = Mn(OH)2 + H 2 • Mn + H 2 SO 4(разб. ) = Mn. SO 4 + H 2 • 3 Re + 7 HNO 3(разб. ) = 3 HRe. O 4 + 7 NO + 2 H 2 O • 2 Re + 7 H 2 O 2 = 2 HRe. O 4 + 6 H 2 O

Простые вещества Пассивация холодн. HNO 3, H 2 SO 4 (>90%) Mn t°, HNO 3 t°, конц. H 2 SO 4 Mn 2+ + SO 2 (S, H 2 S) Mn 2+ + NO 2 (конц. ) NO (разб. ) NH 4+ (оч. р. ) w Mn, Tc, Re + Na. OH w Реагир. с окислителями в расплаве щелочи: w 2 Mn + 4 Na. OH + 3 O 2 = = 2 Na 2 Mn. VIO 4 + 2 H 2 O w 2 Re + 2 Na. OH + 7 KNO 3 = = 2 Na. Re. VIIO 4 + 7 KNO 2 + H 2 O w 2 Tc + 2 Na. OH + 7 KNO 3 = = 2 Na. Tc. VIIO 4 + 7 KNO 2 + H 2 O
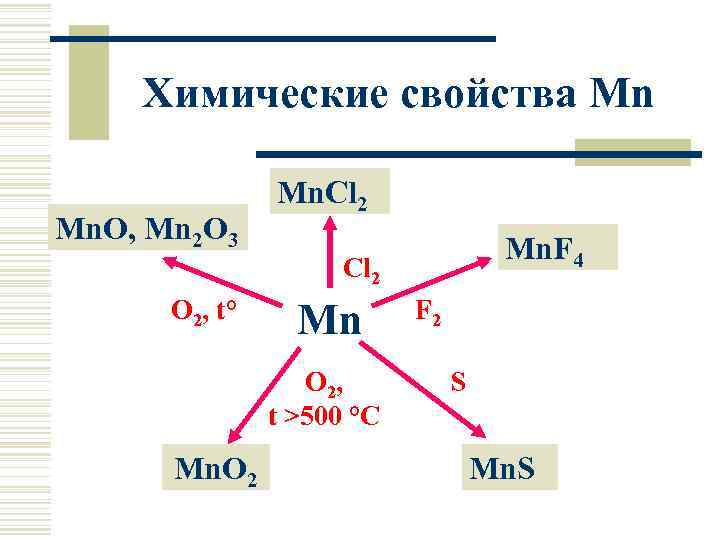
Химические свойства Mn Mn. O, Mn 2 O 3 Mn. Cl 2 Mn. F 4 Cl 2 O 2, t° Mn O 2, t >500 °C Mn. O 2 F 2 S Mn. S
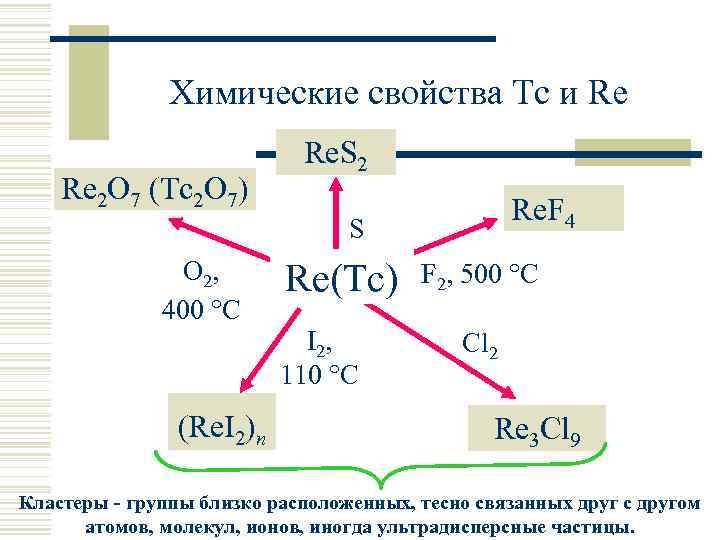
Химические свойства Tc и Re Re 2 O 7 (Tc 2 O 7) Re. S 2 Re. F 4 S O 2, 400 °C (Re. I 2)n Re(Tc) I 2, 110 °C F 2, 500 °C Cl 2 Re 3 Cl 9 Кластеры - группы близко расположенных, тесно связанных друг с другом атомов, молекул, ионов, иногда ультрадисперсные частицы.
![Строение [Re 3 Cl 9] Re Cl Строение [Re 3 Cl 9] Re Cl](https://present5.com/presentation/198569245_449820691/image-10.jpg)
Строение [Re 3 Cl 9] Re Cl
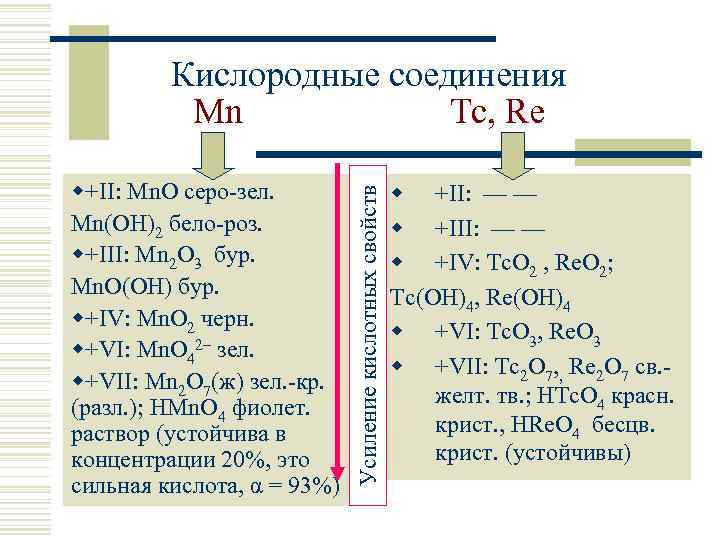
w+II: Mn. O серо-зел. Mn(OH)2 бело-роз. w+III: Mn 2 O 3 бур. Mn. O(OH) бур. w+IV: Mn. O 2 черн. w+VI: Mn. O 42– зел. w+VII: Mn 2 O 7(ж) зел. -кр. (разл. ); HMn. O 4 фиолет. раствор (устойчива в концентрации 20%, это сильная кислота, α = 93%) Усиление кислотных свойств Кислородные соединения Mn Tc, Re w +II: — — w +IV: Tc. O 2 , Re. O 2; Tc(OH)4, Re(OH)4 w +VI: Tc. O 3, Re. O 3 w +VII: Tc 2 O 7, , Re 2 O 7 св. желт. тв. ; HTc. O 4 красн. крист. , HRe. O 4 бесцв. крист. (устойчивы)

Распространение в природе и важнейшие минералы 14. Mn 0, 085 % масс. 81. Re – редкий рассеянный элемент; встреч. в виде примеси в молибдените Mo. S 2; существ. редкий минерал джезказганит Cu. I(Re. S 4); 89. Tc – радиоактивный элемент, встречается в урановых рудах. Молибденит Уранинит

Минералы марганца w Пиролюзит Mn. O 2 w Гаусманит (Mn. IIMn 2 III)O 4 w Манганит Mn. O(OH) w Родохрозит Mn. CO 3 w Гюбнерит Mn. WO 4 w Вольфрамит (Mn, Fe)WO 4 w Псиломелан Ba. Mn. IIMn 8 IVO 16 Пиролюзит Гюбнерит Родохрозит Псиломелан Гаусманит Манганит Вольфрамит

Получение металлов Tc w Mn: а) электролиз раствора Mn. SO 4 б) Mn. O 2 + Si = Mn + Si. O 2 3 Mn. O 2 + 4 Al = 3 Mn + 2 Al 2 O 3 w Re: 2 NH 4 Re. O 4(т) + 4 H 2 = 2 Re + N 2 + 8 H 2 O Re+VII + 7 e– = Re 0 – +4 e N–III – 3 e– = N 0 – 2 e– H 2 – 2 e– = 2 H+ Рений

Марганец w Активный металл. w Устойч. ст. ок. +II (в кисл. среде) и +IV. w В ст. ок. +II похож на Mg (реаг. с водой, неамфотерен, гидроксид раств. под действием солей аммония) w С увелич. ст. ок. – рост кислотн. св-в. w С увелич. ст. ок. – увелич. окислит. св-в.

Марганец(II) w Mn. O 1 1, 13 – нестехиом. (изб. O–II, до 6, 5% ат. Mn в крист. реш. имеют ст. ок. +III); полупроводник. w Mn(OH)2 – бело-роз. , основный, малор-рим. w На воздухе окисляется: 4 Mn(OH)2 + O 2 = 4 Mn. O(OH) + 2 H 2 O Mn(OH)2 + OH– – 1 e– = Mn. O(OH) + H 2 O O 2 + 2 H 2 O + 4 e– = 4 OH– w [Mn(H 2 O)6]2+ слабо подвергается протолизу (KK = 2, 57· 10– 11); в кисл. среде устойчив.
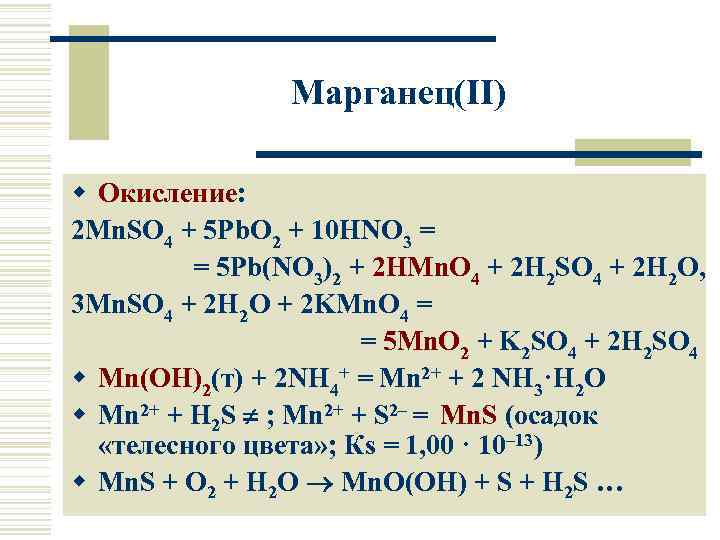
Марганец(II) w Окисление: 2 Mn. SO 4 + 5 Pb. O 2 + 10 HNO 3 = = 5 Pb(NO 3)2 + 2 HMn. O 4 + 2 H 2 SO 4 + 2 H 2 O, 3 Mn. SO 4 + 2 H 2 O + 2 KMn. O 4 = = 5 Mn. O 2 + K 2 SO 4 + 2 H 2 SO 4 w Mn(OH)2(т) + 2 NH 4+ = Mn 2+ + 2 NH 3·H 2 O w Mn 2+ + H 2 S ; Mn 2+ + S 2– = Mn. S (осадок «телесного цвета» ; Кs = 1, 00 · 10– 13) w Mn. S + O 2 + H 2 O Mn. O(OH) + S + H 2 S …
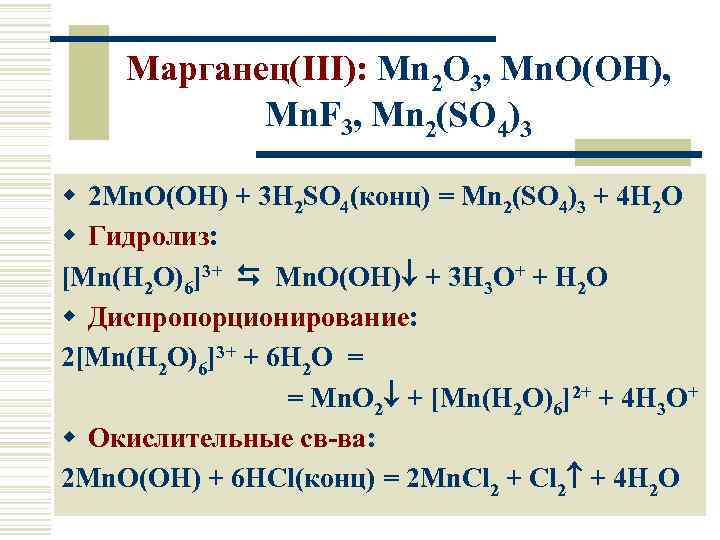
Марганец(III): Mn 2 O 3, Mn. O(OH), Mn. F 3, Mn 2(SO 4)3 w 2 Mn. O(OH) + 3 H 2 SO 4(конц) = Mn 2(SO 4)3 + 4 H 2 O w Гидролиз: [Mn(H 2 O)6]3+ Mn. O(OH) + 3 H 3 O+ + H 2 O w Диспропорционирование: 2[Mn(H 2 O)6]3+ + 6 H 2 O = = Mn. O 2 + [Mn(H 2 O)6]2+ + 4 H 3 O+ w Окислительные св-ва: 2 Mn. O(OH) + 6 HCl(конц) = 2 Mn. Cl 2 + 4 H 2 O
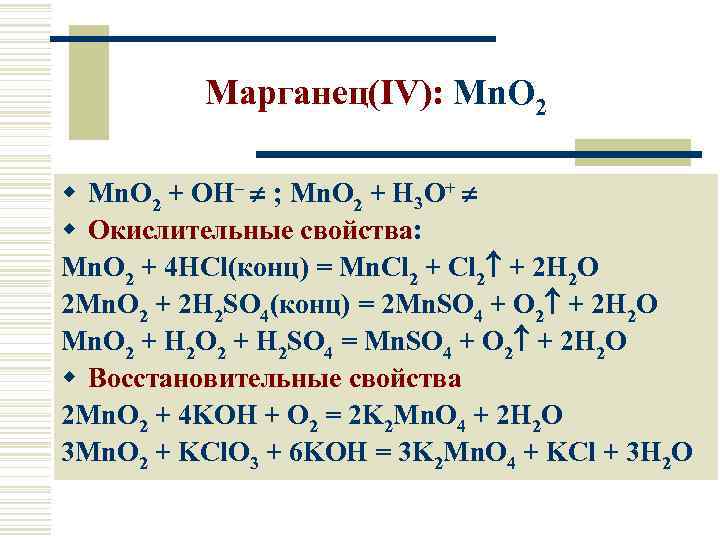
Марганец(IV): Mn. O 2 w Mn. O 2 + OH– ; Mn. O 2 + H 3 O+ w Окислительные свойства: Mn. O 2 + 4 HCl(конц) = Mn. Cl 2 + 2 H 2 O 2 Mn. O 2 + 2 H 2 SO 4(конц) = 2 Mn. SO 4 + O 2 + 2 H 2 O Mn. O 2 + H 2 SO 4 = Mn. SO 4 + O 2 + 2 H 2 O w Восстановительные свойства 2 Mn. O 2 + 4 KOH + O 2 = 2 K 2 Mn. O 4 + 2 H 2 O 3 Mn. O 2 + KCl. O 3 + 6 KOH = 3 K 2 Mn. O 4 + KCl + 3 H 2 O

Марганец(IV): Mn. O 2 w. Получение Mn. O 2 : 3 Mn. CO 3 + KCl. O 3 = 3 Mn. O 2 + KCl + 3 CO 2 w Mn. O 2 – катализатор Каталитическое разложение пероксида водорода: 2 H 2 O 2 = 2 H 2 O + O 2 Видеофрагмент

Марганец(VI) w В сильнощел. среде уст. соли, напр. K 2 Mn. O 4. w В растворе – диспропорционирует: 3 Mn. O 42 + 2 H 2 O = 2 Mn. O 4 + Mn. O 2 + 4 OH , 3 Mn. O 42 + 4 H 3 O+ = 2 Mn. O 4 + Mn. O 2 + 6 H 2 O w Манганат-ион проявляет как окислительные, так и восстановительные свойства: 2 K 2 Mn. O 4 + Cl 2 = 2 KMn. O 4 + 2 KCl K 2 Mn. O 4 + H 2 S = Mn. O 2 + S + 2 KOH

w. Mn 2 O 7 – маслянистая жидк. w. Получение (видео): 2 KMn. O 4 + 2 H 2 SO 4 = = Mn 2 O 7 + 2 KHSO 4 + H 2 O 2 Mn 2 O 7 = 4 Mn. O 2 + 3 O 2 (медл. ) w. Марганцовая кислота HMn. O 4 + H 2 O = H 3 O+ + Mn. O 4─ 4 HMn. O 4 = 4 Mn. O 2 + 3 O 2 + 2 H 2 O Получение Mn 2 O 7 (видео) Марганец(VII)

Окислительные свойства р. Н < 7 w Mn. O 4– + 8 H+ + 5 e– = Mn 2+ + 4 H 2 O; Е = +1, 53 B p. H > 7 w Mn. O 4– + 1 e– = Mn. O 42–; Е = +0, 56 B p. H 7 w Mn. O 4– + 2 H 2 O + 3 e– = Mn. O 2 + 4 OH–; Е = +0, 59 B

Благодарю за внимание!!!
Lektsia_11_7V_gruppa_Marganets.ppt