Лекция. 8В группа. Семейство железа..ppt
- Количество слайдов: 60

Химия d-элементов Общая характеристика элементов VIIIВ группы. Семейство железа.
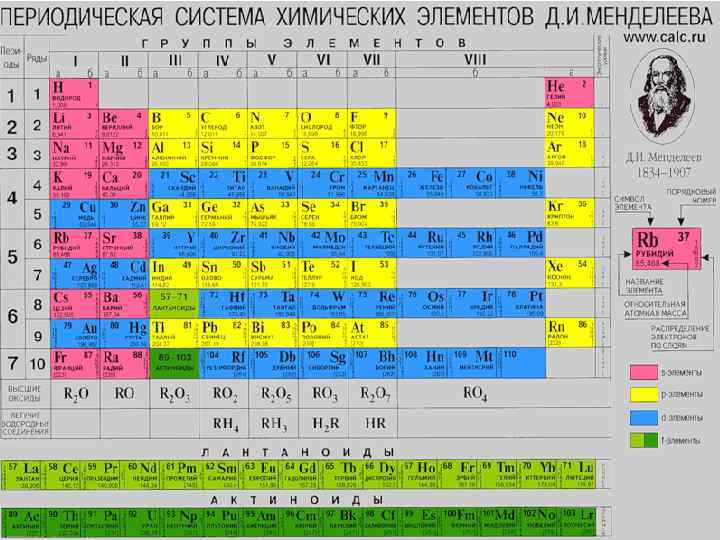

Побочная подгруппа 8 группы периодической системы охватывает триады d – элементов. Первую триаду образуют элементы: Fe, Co, Ni.

Вторую триаду образуют элементы: Ru (рутений), Rh (родий), Pd (палладий).

Третью триаду: Os (осмий), Ir (иридий), Pt (платина).
![Общая электронная формула: […] ns 0 2 (n– 1)d 6 10 VIII В 1 Общая электронная формула: […] ns 0 2 (n– 1)d 6 10 VIII В 1](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-6.jpg)
Общая электронная формула: […] ns 0 2 (n– 1)d 6 10 VIII В 1 VIII В 2 VIII В 3 Fe [Ar] 4 s 23 d 6 Co [Ar] 4 s 23 d 7 Ni [Ar] 4 s 23 d 8 Ru [Kr] 5 s 14 d 7 Rh [Kr] 5 s 14 d 8 Pd [Kr] 5 s 04 d 10 Os [Xe, 4 f 14] 6 s 25 d 6 Ir [Xe, 4 f 14] 6 s 25 d 7 Pt [Xe, 4 f 14] 6 s 15 d 9

Рост уст. высш. ст. ок. Степени окисления VIII В 1 VIII В 2 VIII В 3 Fe II, III (I-IV, VIII) Co II, III (I-IV) Ni II (I-IV) Ru II, IV (I-VIII) Rh III (I-IV, VI) Pd II (I-IV) Os VIII (II-VIII) Ir III, IV (I-VI) Pt II, IV (I-IV) Рост устойчивости низших ст. ок.

Электроотрицательность VIII В 1 Zn 1, 66 Cd 1, 46 VIII В 2 VIII В 3 Fe 1, 64 Co 1, 70 Ni 1, 75 Ru 1, 42 Rh 1, 45 Pd 1, 35 Os 1, 52 Ir 1, 55 Pt 1, 44

Простые вещества Fe Co Ni Ru Семейство железа Rh Pd Os Ir Pt Семейство платины Температуры плавления, °С 1539 1495 1455 Железо 2607 Кобальт 1963 1554 3027 2443 Никель Платина 1772
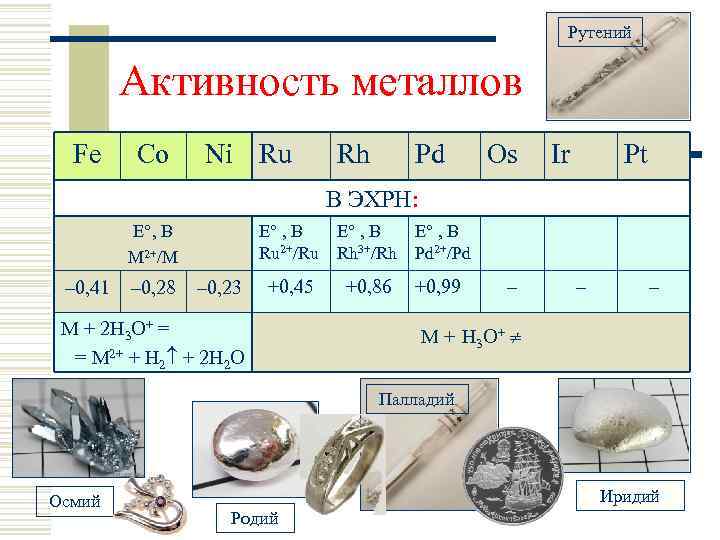
Рутений Активность металлов Fe Co Ni Ru Rh Pd Os Ir Pt В ЭХРН: Е , B Ru 2+/Ru Е , B M 2+/M – 0, 41 – 0, 28 – 0, 23 Е , B Rh 3+/Rh Е , B Pd 2+/Pd +0, 45 +0, 86 +0, 99 M + 2 H 3 O+ = = M 2+ + H 2 + 2 H 2 O – – – M + H 3 O+ Палладий Осмий Иридий Родий
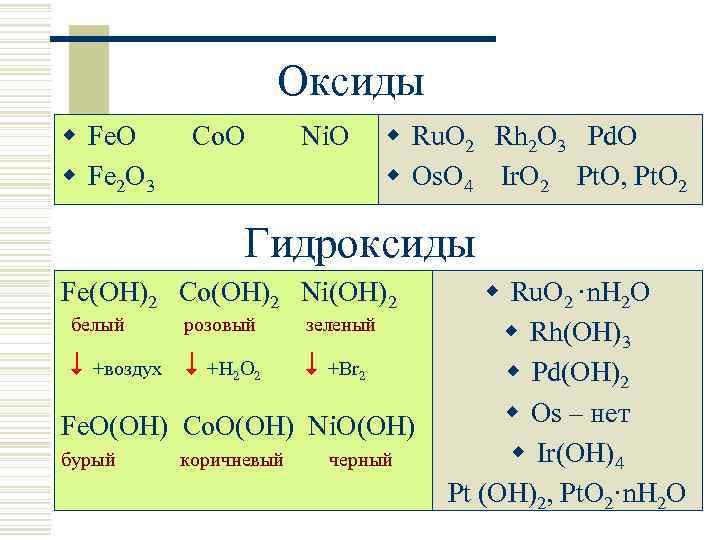
Оксиды w Fe. O w Fe 2 O 3 Co. O Ni. O w Ru. O 2 Rh 2 O 3 Pd. O w Os. O 4 Ir. O 2 Pt. O, Pt. O 2 Гидроксиды Fe(OH)2 Co(OH)2 Ni(OH)2 белый розовый +воздух +H 2 O 2 зеленый +Br 2 Fe. O(OH) Co. O(OH) Ni. O(OH) бурый коричневый черный w Ru. O 2 ·n. H 2 O w Rh(OH)3 w Pd(OH)2 w Os – нет w Ir(OH)4 Pt (OH)2, Pt. O 2·n. H 2 O
![Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-12.jpg)
Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры 6 [Ru. Cl 6]2– Fe. III Co. III Ni. II 6 4 6 Rh. III Pd. II Os. VIII Ir. IV Pt. II Pt. IV 6 4 6 [Fe(H 2 O)6]3+ [Co. Cl 4]2– [Co(NH 3)6]2+ [Co(NH 3)6]3+ [Ni(CN)4]2– [Ni(NH 3)6]2+ [Rh. Cl 6]3– [Pd(H 2 O)4]2+ [Os. O 4(OH)2]2– [Ir. Cl 6]2– [Pt(NH 3)2 Cl 2]0 [Pt. Cl 6]2–

Особые свойства w 3 Pt + 4 HNO 3 + 18 HCl → → 3 H 2[Pt. IVCl 6] + 4 NO + 8 H 2 O w Металлы VIIIВ-группы активно поглощают водород. w 1 объем Pd поглощает ок. 900 объемов H 2. w Pd и Pt – катализаторы гидрирования в органическом синтезе.

Распространение в природе и важнейшие минералы 4. Fe – 4, 65% 22. Ni – 0, 015% 30. Co – 0, 0037% 71. Ru 72. Os 73. Pd 76. Pt 79. Ir 80. Rh Редкие рассеянные элементы w w w w w Лимонит Гематит Железо самородное w. Гематит Fe 2 O 3 w. Магнетит (Fe. IIFe 2 III)O 4 w. Гётит Fe. O(OH) w. Сидерит Fe. CO 3 w. Лимонит Fe 2 O 3. n. H 2 O Сидерит Гётит

Халькогениды Пирит Пирротин w. Пирротин Fe 0, 877 S w. Пирит Fe(S 2) w. Смальтин (Ni, Co, Fe)As 2 w. Кобальтин Co. As. S w. Арсенопирит Ni. As. S w. Никелин Ni. As w. Хлоантит (Co, Ni)As 2 w. Пентландит (Fe, Ni)9 S 8 Пентландит Хлоантит Эритрин w Эритрин Co 3(As. O 4)2. 8 H 2 O w Гарниерит (Mg, Ni)6(Si 4 O 10)(OH)8 w Платиновые металлы: самородные сплавы. Гарниерит Арсенопирит Никелин

Семейство железа: Fe, Co и Ni Простые в-ва: w пирофорность высокодисперсн. порошков, получаемых по р-ции (способность твёрдого материала в мелкораздробленном состоянии к самовоспламенению на воздухе при отсутствии нагрева. ): Fe. C 2 O 4 = Fe + 2 CO 2 w В кислотах-окисл. на холоду Fe, Co и Ni пассивируются. w Склонность к коррозии (только железо): 4 Fe + 2 O 2 + 3 H 2 O = 4 Fe. O(OH)

Химические свойства Fe, Co и Ni восст. св-ва падают w w w Взаимодействие с O 2: Fe + O 2 (150 °C) «Fe 3 O 4» (Fe. IIFe 2 III)O 4 Co + O 2 (900 °C) «Co 3 O 4» (Co. IICo 2 III)O 4 Ni + O 2 Ni. O В ЭХРН: Ga, Fe, Cd … Co, Ni … Sn… H Взаимодействие с кислотами-неокислителями: M + 2 H 3 O+ + 4 H 2 O [M(H 2 O)6]2+ + H 2 С конц. р-рами щелочей (Fe, Co): M + 2 OH– + 4 H 2 O [M(OH)4]2– + H 2 [M(OH)6]4–
![Семейство железа : w Fe [Ar] 4 s 2 3 d 6 Максимальное число Семейство железа : w Fe [Ar] 4 s 2 3 d 6 Максимальное число](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-18.jpg)
Семейство железа : w Fe [Ar] 4 s 2 3 d 6 Максимальное число валентных электронов 6 w Co [Ar] 4 s 2 3 d 7 Максимальное число валентных электронов 5 w Ni [Ar] 4 s 2 3 d 8 Максимальное число валентных электронов 4

Железо один из наиболее распространенных элементов в земной коре (4, 65%). Встречается в виде скоплений железных руд, и очень редко встречается самородное железо. Находится в природе в свободном состоянии только в метеоритах.

Железо входит в состав следующих минералов: w Fe 2 O 3 красный железняк w Fe 2 O 3 · H 2 O бурый железняк w Fe 3 O 4 магнитный железняк w Fe CO 3 шпатовый железняк w Fe. S 2 железный колчедан (пирит)

Fe(II) может образовывать комплексные соединения. Координационное число для Fe (II) = 6. При растворении в воде солей Fe (II) образуется [Fe(H 2 O)6] 2+ - октаэдрический комплексный катион. При взаимодействии : Fe 2+ + 2 CN¯ → Fe(CN)2 ↓ белый осадок который в избытке CN¯ растворяется: Fe(CN)2 + 4 CN¯→ [Fe(CN)6 ] 4‾
![Наиболее широко применяется K 4 [Fe(CN)6 ] · 3 H 2 O – желтая Наиболее широко применяется K 4 [Fe(CN)6 ] · 3 H 2 O – желтая](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-22.jpg)
Наиболее широко применяется K 4 [Fe(CN)6 ] · 3 H 2 O – желтая кровяная соль. Она служит реактивом для качественного обнаружения Fe 3+. 4 Fe 3+ + 3[Fe(CN)6 ] 4‾ → Fe 4 [Fe(CN)6 ]3 ↓ интенсивно синего цвета осадок, мало растворим, берлинская лазурь Fe. Cl 3 + K 4 [Fe(CN)6 ] → KFe [Fe(CN)6 ] ↓+ 3 KCl Известно комплексное соединение [Fe(NH 3)6] Cl 2 устойчивое в твердом состоянии.

Соли Fe(II) – восстановители. 10 Fe S O 4 +2 KMn. O 4 + 8 H 2 SO 4→ 5 Fe 2 (S O 4 )3 + 2 Mn. SO 4 +K 2 SO 4 +8 H 2 O Эта реакция лежит в основе количественного определения солей Fe 2+ методом перманганатометрии. Fe (II) образует соли почти со всеми анионами. Распространенной солью является (NH 4)2 Fe (SO 4)2· 6 H 2 O – соль Мора, она более устойчива к окислению кислородом воздуха, чем соль Fe. SO 4· 7 H 2 O.

Соединения Fe (III) Fe 2 O 3 - красно-бурый порошок, нерастворимый в воде, входит в состав краски охры, амфотерный. спекание Fe 2 O 3 + 6 HCl → 2 Fe. Cl 3 + 3 H 2 O Fe 2 O 3 + 2 Na. OH → 2 Na Fe. O 2 + H 2 O феррит натрия Fe. Cl 3 + 3 Na. OH → Fe(OH)3 + 3 Na. Cl

Fe(OH)3 – очень слабое основание, обладает аморфными свойствами. Доказать аморфные свойства Fe(OH)3 можно: Fe(OH)3 + 3 HCl → Fe. Cl 3 + 3 H 2 O Fe(OH)3 + 3 Na. OH → Na 3[Fe(OH)6] H 3 Fe. O 3 – ортожелезистая кислота HFe. O 2 – метажелезистая кислота Fe(OH)3 + 3 HCl + 3 H 2 O → [Fe(H 2 O)6]Cl 3

Соли Fe(III) гидролизируются сильнее, чем соли Fe (II), при этом окраска растворов становится желто-коричневой. Например, гидролиз соли Fe. Cl 3: [Fe(H 2 O)6]3+ + H 2 O → [Fe(H 2 O)5 OH]2+ + H 3 O+ к. о. с. к. [Fe(H 2 O)5 OH]2+ + H 2 O → [Fe(H 2 O)4 (OH) 2]+ + H 3 O+ к. о. с. к. [Fe(H 2 O)4(OH) 2]+ + H 2 O→ [Fe(H 2 O)3 (OH) 3] + H 3 O+ к. о. с. к.
![Комплексные соединения Fe(III) Для Fe 3+ особо устойчив комплексный ион - [Fe(CN)6]3 -. Широко Комплексные соединения Fe(III) Для Fe 3+ особо устойчив комплексный ион - [Fe(CN)6]3 -. Широко](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-27.jpg)
Комплексные соединения Fe(III) Для Fe 3+ особо устойчив комплексный ион - [Fe(CN)6]3 -. Широко используется соль K 3[Fe(CN)6] – красная кровяная соль. Она служит реактивом на Fe 2+: 3 Fe 2+ + 2[Fe(CN)6]3 - → Fe 3[Fe(CN)6]2 турнбулева синь Fe. Cl 2 + K 3[Fe(CN)6]3+ → KFe[Fe(CN)6] + 2 KCl Соединения Fe(III) – окислители и восстановители: 2 Fe. Cl 3 + H 2 S → 2 Fe. Cl 2 + S + 2 HCl окислитель Fe 2 O 3 + 3 KNO 3 + 4 KOH → 2 K 2 Fe. O 4 + 3 KNO 2 + 2 H 2 O восстановитель

Качественной реакцией на Fe 3+ - позволяющей отличить его от Fe 2+ является взаимодействие с SCN ─ : Fe 3+ + 6 SCN─ → [Fe(SCN)6]3─ красного цвета Широко используются соли: Ø NH 4 Fe(SO 4 )2 ∙ 12 H 2 O - железоаммонийные квасцы. Ø Fe 2(SO 4 )3∙ 10 H 2 O - кристаллогидрат сульфата железа

Соединения Fe (VI) Для соединений Fe (VI) известна H 2 Fe. O 4 – железная кислота, но она не может быть выделена, так как мгновенно разлагается с выделением O 2. Устойчивые соли ее – ферраты. Они образуются при окислении Fe(OH)3 в щелочной среде сильными окислителями: 2 Fe(OH)3 + 3 Br 2 + 10 KOH→ 2 K 2 Fe. O 4+ 6 KBr + 8 H 2 O феррат калия

Ферраты, кристаллические вещества, имеют окраску от пурпурно-красной до фиолетовой, при нагревании разлагаются. Ферраты – сильные окислители, сильнее, чем KMn. O 4 : 2 K 2 Fe. O 4 + 2 NH 4 OH → 2 Fe(OH)3 + N 2 + 4 KOH +2 +3 +6 Fe. O Fe(OH)2 Основные свойства, восстановитель Fe 2 O 3 H 3 Fe. O 3 Амфотерные свойства, окислитель, восстановитель H 2 Fe. O 4 Кислотные свойства, окислитель

КОБАЛЬТ

Был получен в 1735 году шведским химиком Брандтом. В природе чисто кобальтовые руды встречаются редко. Распространенным является Co. ASS – кобальтовый блеск (кобальтин) минерал. Степени окисления - +2, +3, +5. Блестящий белый с сероватым оттенком металл. По сравнению с Fe более тверд и хрупок. В обычных условиях он довольно устойчив. При нагревании взаимодействует почти со всеми неметаллами. К кислотам кобальт несколько устойчивее железа, HNO 3 – пассивирует, с водой, со щелочами практическими не взаимодействует.

Соединения кобальта (II) Co. O (II) – серо-зеленые кристаллы. Получают термическим разложением Co. CO 3 → Co. O + CO 2 холод При действии: Co. Cl 2 + Na. OH → Co. OHCl↓ + Na. Cl синий осадок основной соли а при нагревании: Co. OHCl + Na. OH → Co(OH)2↓ + Na. Cl розовый цвет 4 Co(OH)2 + 2 H 2 O + O 2 → 4 Co(OH)3↓ бурый осадок Co(OH)2 - в воде не растворим.

При действии соли Co 2+ и избытка NH 4 OH в присутствии NH 4 Cl образуются : [Co(NH 3)6]2+ → [Co(NH 3)6]3+ легко окисляется в аммиакат Co(III). Для Co 2+ характерно координационные числа 6 и 4. В водном растворе Co 2+ образует высокоспиновые катионные октаэдрические комплексы [Co(H 2 O)6]2+.
![Аквакомплексы [Co(H 2 O)6]2+ розового цвета. Эта же окраска характерна для кристаллогидратов Co. Cl Аквакомплексы [Co(H 2 O)6]2+ розового цвета. Эта же окраска характерна для кристаллогидратов Co. Cl](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-35.jpg)
Аквакомплексы [Co(H 2 O)6]2+ розового цвета. Эта же окраска характерна для кристаллогидратов Co. Cl 2∙ 6 H 2 O, Co. SO 4∙ 6 H 2 O, но безводная соль Co. Cl 2 – синего цвета. Анионные комплексы Co 2+ обычно имеют тетраэдрическую структуру [Co Cl 4]2─, которые имеют синюю и фиолетовую окраску. Аналитической качественной реакцией на ионы Co 2+ : Co. Cl 2 + 4 NH 4 SCN → (NH 4)2[Co(SCN)4] + 2 NH 4 Cl ярко-синего цвета тетратиоциоцианокобальтат (II) аммония

Соединения кобальта(III) Известно ограниченное число простых соединений Co 3+. Они не устойчивы, обладают окислительными свойствами и легко гидролизуются. • Co 2 O 3 – черные кристаллы, окисляют HCl до Cl 2: Co 2 O 3 + 6 HCl → Co. Cl 2 + 3 H 2 O • Co(OH)3 образуется при окислении Co(OH)2: 4 Co(OH)2 + O 2 + 2 H 2 O → 4 Co(OH)3 2 Co(OH)2 + Na. Cl. O + H 2 O → 2 Co(OH)3 + Na. Cl

Амфотерные свойства Co(OH)3 выражены гораздо слабее, чем у Fe(OH)3. При действии на Co(OH)3 кислород содержащих кислот, соли Co 3+ не образуются, а выделяется O 2 и соль Co 2+: 4 Co(OH)3 + 4 H 2 SO 4 → 4 Co. SO 4 + 10 H 2 O + O 2↑ При обезвоживании Co(OH)3 нагреванием не получается Co 2 O 3, а образуется Co 3 O 4 – это смешанный оксид Co. Co 2 O 4. Этот оксид сильный окислитель.
![Для Co 3+ характерны многочисленные комплексные соединения: w [Co(H 2 O)6]Cl 3 – катионные Для Co 3+ характерны многочисленные комплексные соединения: w [Co(H 2 O)6]Cl 3 – катионные](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-38.jpg)
Для Co 3+ характерны многочисленные комплексные соединения: w [Co(H 2 O)6]Cl 3 – катионные w Na 3[Co(NO 2)6] – анионные w [Co(NH 3)3(NO 2)3] – нейтральные Строение: w Co - [Ar] 4 S 2 3 d 7 w Co 3+ - [Ar] 4 S 0 3 d 6

sp 3 d 2 – гибридизация, если лигандом является H 2 O, то образуется внешнеорбитальный высокоспиновый комплекс. d 2 sp 3 – гибридизация, если лигандом является CN- , то образуется внутримолекулярный низкоспиновый комплекс. Многочисленность комплексных соединений Co 3+ обусловлены наличием изомерии к. с. кобальта.
![Например: гидратная коричневый [Co(NH 3)4 Cl 2] Cl ∙ H 2 O – розовый Например: гидратная коричневый [Co(NH 3)4 Cl 2] Cl ∙ H 2 O – розовый](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-40.jpg)
Например: гидратная коричневый [Co(NH 3)4 Cl 2] Cl ∙ H 2 O – розовый [Co(NH 3)4 Cl∙ H 2 O] Cl 2 – ионизационная [Co(NH 3)5 SO 4] Br – красный [Co(NH 3)5 Br] SO 4 – краснофиолетовый геометрическая (пространственная) NH 3 NO 2 ↑ ↑ (NH 3)2 ← Co → (NO 2)2 (NH 3)2 ← Co →(NH 3)2 ↓ ↓ NH 3 NO 2 транс-изомер, коричневый цис-изомер, желтый

НИКЕЛЬ

Впервые был получен в 1751 г. Кронштадтом. Никель довольно распространен на земле. Содержится обычно в сульфидных медноникелевых рудах, но встречается и в самородном состоянии Ni. S. Ni – блестящий белый с серебристым оттенком металл. По химической активности уступает Fe и Co. С кислородом начинает взаимодействовать при 5000 С. при нагревании легко взаимодействует с галогенами, S, P, N. По отношению к кислотам и щелочам ведет себя подобно Fe и Co. Степень окисления - +2, +3, +4 (не характерна).

Соединения Ni (II) Ni. O (II) – оксид, зеленые кристаллы, нерастворимые в воде, образуются при термическом разложении карбоната никеля Ni. CO 3 → Ni. O + CO 2 Ni. O применяется в качестве катализатора и зеленого пигмента в керамической промышленности. Ni. Cl 2 + 2 Na. OH → Ni(OH)2↓ + 2 Na. Cl зеленый Ni(OH)2 плохо растворяется в воде и концентрированных растворах щелочей, растворяется в NH 4 OH: Ni(OH)2 + 6 NH 4 OH → [Ni(NH 3)6](OH)2 + 6 H 2 O
![Из катионных комплексов Ni 2+ устойчивы октаэдрические аква и аминокомплексы. Аквакомплекс [Ni(H 2 O)6]2+ Из катионных комплексов Ni 2+ устойчивы октаэдрические аква и аминокомплексы. Аквакомплекс [Ni(H 2 O)6]2+](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-44.jpg)
Из катионных комплексов Ni 2+ устойчивы октаэдрические аква и аминокомплексы. Аквакомплекс [Ni(H 2 O)6]2+ имеет ярко-зеленую окраску, образуется при растворении в воде солей Ni 2+. Такая же окраска характерна для шестиводных кристаллогидратов солей никеля Ni. SO 4 ∙ 6 H 2 O. Безводные соли Ni 2+ обычно желтого цвета, например: Ni. Cl 2, Ni. SO 4. Аминокомплекс [Ni(NH 3)6]2+ имеет интенсивно синюю окраску. Известно также много комплексов Ni 2+ с кратным числом = 4. Причем комплексы со слабовзаимодействующими лигандами имеет форму тетраэдра [Ni. Cl 4]2 -, а с сильным – плоского квадрата [Ni(CN)4]2 -.

Соединения Ni (III) Ni(OH)3 зеленого цвета, проявляет основные свойства, не окисляется кислородом воздуха, поэтому получить Ni(OH)3 можно только действием очень сильных окислителей: 2 Ni(OH)2 + Br 2 + 2 KOH → 2 Ni(OH)3 + 2 KBr черный

Соединения Ni (IV) Соединений Ni 4+ известно немного. Это неустойчивые соединения, окислители. Из соединений Ni 4+ наиболее распространены никелаты – Na 2 Ni. O 3.

Благодарю за внимание!!!

Химические свойства железа. Феррат(VI) с сильными окислителями: w Fe + 2 KNO 3 (+t°) K 2 Fe. VIO 4 + 2 NO феррат(VI) калия • Fe 2 O 3 + 3 KNO 3 + 4 KOH (+t°) K 2 Fe. VIO 4 + 3 KNO 2 + 2 H 2 O • 2 Fe. O(OH) +3 Br 2 + 10 KOH 2 K 2 Fe. O 4 + 6 KBr + 6 H 2 O Fe. O(OH) + 5 OH – 3 e Fe. O 42 + 3 H 2 O Br 2 + 2 e 2 Br– • Ba. Cl 2 + K 2 Fe. O 4 Ba. Fe. O 4 + 2 KCl красный
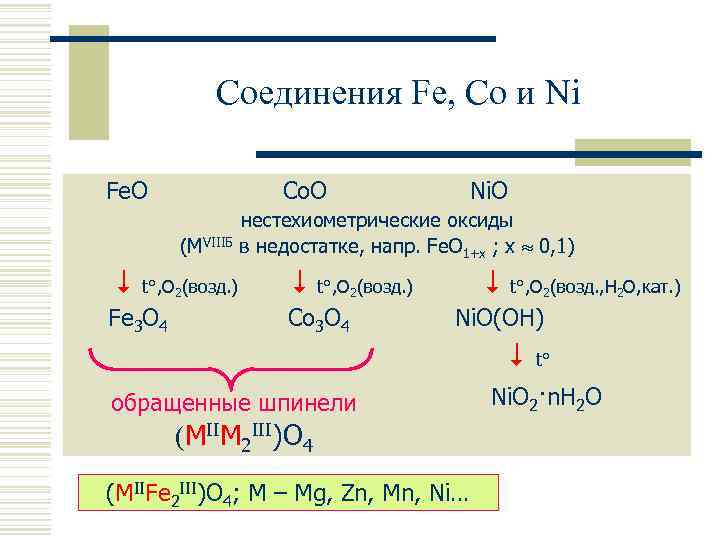
Соединения Fe, Co и Ni Fe. O Co. O (MVIIIБ t°, O 2(возд. ) Fe 3 O 4 Ni. O нестехиометрические оксиды в недостатке, напр. Fe. O 1+x ; x 0, 1) t°, O (возд. , H O, кат. ) 2 Co 3 O 4 2 Ni. O(OH) обращенные шпинели (MIIM 2 III)O 4 (MIIFe 2 III)O 4; M – Mg, Zn, Mn, Ni… t° Ni. O 2·n. H 2 O 2
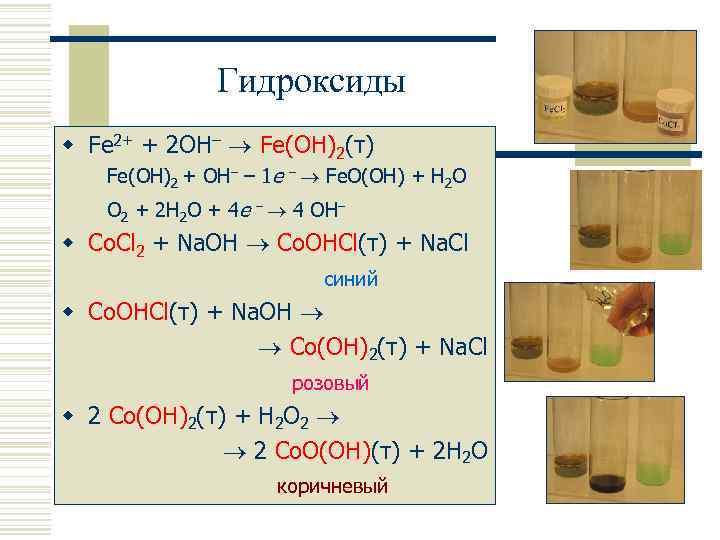
Гидроксиды w Fe 2+ + 2 OH– Fe(OH)2(т) Fe(OH)2 + OH– – 1 e – Fe. O(OH) + H 2 O O 2 + 2 H 2 O + 4 e – 4 OH– w Co. Cl 2 + Na. OH Co. OHCl(т) + Na. Cl синий w Co. OHCl(т) + Na. OH Co(OH)2(т) + Na. Cl розовый w 2 Co(OH)2(т) + H 2 O 2 2 Co. O(OH)(т) + 2 H 2 O коричневый

Гидроксиды никеля w Ni(OH)2 уст. на воздухе w 4 Ni(NO 3)2. 6 H 2 O 4 Ni. O(OH) + 8 NO 2 + 22 H 2 O w 4 Ni. O(OH) 4 Ni. O + O 2 + 2 H 2 O w 2 Ni(OH)2(т) + Br 2 + 2 Na. OH зеленый 2 Ni. O(OH)(т) + 2 Na. Br + 2 H 2 O черный w. Е (Ni. O(OH)/Ni(OH)2) = 0, 78 В w. Е (Br 2/Br–) = 1, 09 В

Окислительные свойства w 2 Ni. O(OH)(т) + 6 HCl = = 2 Ni. Cl 2 + 4 H 2 O Ni. O(OH) + 3 H+ + 1 e– = Ni 2+ + 2 H 2 O 2 Cl– – 2 e – = Cl 2 w Ni. O(OH)/Ni 2+ = +2, 25 В w Cl 2/Cl– = 1, 34 В w 4 Ni. IIIO(OH)(т) + 4 H 2 SO 4 = = O 2 + 4 Ni. SO 4 + 6 H 2 O Ni. O(OH) + 3 H+ + 1 e – = Ni 2+ + 2 H 2 O – 4 e – = O 2 + 4 H+ O 2/H 2 O= 1, 23 В
![Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2 Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-53.jpg)
Состояние ионов в растворе w [Fe(Н 2 О)6]2+ + H 2 O [Fe(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 7 w [Co(Н 2 О)6]2+ + H 2 O [Co(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 9 w [Ni(Н 2 О)6]2+ + H 2 O [Ni(Н 2 О)5 OH]+ + H 3 O+; Kк 10– 11 Fe. II Co. II Ni. II рост основных свойств w[Fe(Н 2 О)6]3+ + H 2 O [Fe(Н 2 О)5 OH]2+ + H 3 O+ ; Kк 10– 3 Kк Fe 2+·H 2 O/Fe. OH+ << Kк Fe 3+·H 2 O/Fe. OH 2+ Влияние ст. окисл. : рост кислотных св-в с ростом ст. ок.
![Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-54.jpg)
Катионы железа(III) в растворе р. Н 0 [Fe(H 2 O)6]3+ св. -фиол. 4+ H 2 O + H 2 O; Kк 10– 3 OH]2+ р. Н [Fe(H 2 O)5 2 3 + H 2 O; Kк 10– 4 [Fe(H 2 O)4(OH)2]+ H 2 O OH Fe H 2 O OH 2 Fe OH OH 2 + H 2 O [(H 2 O)4 Fe(OH)2 Fe(H 2 O)4]4+ (многоядерный компл. ; желт. ) + H 2 O Fe. O(OH)(т) р. Н > 3
![Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х + Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х +](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-55.jpg)
Комплексные соединения железа [Fe(H 2 O)6]3+ + x. NCS− [Fe(Н 2 О)6 -х(NCS)х]3−х + x. H 2 O; смесь комплексов 4 -х видов β 3 105 [Fe(Н 2 О)6 -х(NCS)х]3−х + 4 F− [Fe(H 2 O)2 F 4]− + x. NCS− + (4−x)H 2 O; β 4 1015 Получение и разрушение тиоцианатного к-са Fe(III)
![[Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ + [Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ +](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-56.jpg)
[Fe(H 2 PO 4)2]– бидент. и Комплексные соединения железа монодент. [Fe(H 2 O)6]3+ + H 3 PO 4 [Fe(HPO 4)3]3– H 2 PO 4– Kк 10– 3 бидент. HPO 42– Kк 10– 8 [Fe(PO 4)3]6– PO 43– Kк 10– 13 бидент. Fe 2+ + [Fe. III(CN)6]3– + K+ Fe 3+ + [Fe. II(CN) 6 ]4– + K(Fe. III, Fe. II )[(Fe. II, Fe. III)(CN)6] K+ синий осадок (берлинская лазурь, турнбуллева синь) KFe. II[Fe. III(NC)6]; яд (дисс. c выдел. CN–) KFe. III[Fe. II (CN)6]; β 6 1037
![Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca. Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca.](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-57.jpg)
Комплексные соединения кобальта w [Co(H 2 O)6]2+ d 2 sp 3 розовый + Ca. Cl 2 w [Co(H 2 O)4]2+ sp 3 фиолет. + Ca. Cl 2 w [Co(H 2 O)2 Cl 2] sp 3 синий + Ca. Cl 2 w [Co. Cl 4]2– sp 3 темно-синий w При нагревании Co[Co. Cl 4] [Co(H 2 O)6]2+ + 4 NCS (к) +эфир [Co(NCS)4]2 + 6 H 2 O синий, sp 3, β 4 102
![Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6 Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6](https://present5.com/presentation/3/139737901_134932490.pdf-img/139737901_134932490.pdf-58.jpg)
Комплексы кобальта(III) более устойчивы w [Co. II(NH 3)6]2+ [Co. III(NH 3)6]3+ w β 6 105 < β 6 1036 w 2 Co. IICl 2 + 12 NH 3·H 2 O + H 2 O 2 = = 2[Co. III(NH 3)6](OH)Cl 2 + 12 H 2 O Co 2+ + 6 NH 3·H 2 O – 1 e – = [Co. III(NH 3)6]3+ + 6 H 2 O H 2 O 2 + 2 e – = 2 OH– w Побочные продукты: красный [Co(NH 3)5 Cl]2+, коричневый [(NH 3)5 Co(O 22 )Co(NH 3)5]4+, фиолетовый цис-[Со(NH 3)4 Cl 2]+, зеленый транс-[Co(NH 3)4 Cl 2]+, красный [Co(H 2 O)(NH 3)5]3+.

Комплексы кобальта и никеля • Co. IICl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3[Co. III(NO 2)6] + NO + 2 KCl + 2 CH 3 COOK + H 2 O Co 2+ + 6 NO 2– + 3 K+ – 1 e – = K 3[Co. III(NO 2)6] NO 2– + 2 CH 3 COOH + 1 e – = NO + 2 CH 3 COO– + H 2 O w Ni. Cl 2 + 6 NH 3·H 2 O = [Ni(NH 3)6]Cl 2 + 6 H 2 O β 6 109 w Ni. Cl 2 + 2 NH 3·H 2 O + 2 H 2 L = = [Ni(HL)2] + 2 NH 4 Cl + 2 H 2 O H 2 L – диметилглиоксим (CH 3)2 C 2(NOH)2 (см. «Компл. соединения. Хелаты» )

Окислительно-восстановительные свойства Fe. VI – сильный окислитель w р. Н < 7: 4 Fe. O 42– + 20 H 3 O+ = 4 [Fe(H 2 O)6]3+ + 3 O 2 + 6 H 2 O Fe. O 42–/Fe 3+ = +1, 9 В w р. Н > 7: 4 Fe. O 42– + 3 S 2– + 4 H 2 O = Fe. S + 2 S + 8 OH– Fe. O 42–/Fe(OH)2 = +0, 34 В Fe. III – мягкий окислитель w 2 Fe. Cl 3 + 2 KI = 2 Fe. Cl 2 + I 2(т) + 2 KCl w 2 Fe. Cl 3 + H 2 S = 2 Fe. Cl 2 + S(т) + 2 HCl w Fe 3+/Fe 2+ = +0, 77 В
Лекция. 8В группа. Семейство железа..ppt