Основные понятия химии.ppt
- Количество слайдов: 81
 ХИМИЯ 1
ХИМИЯ 1
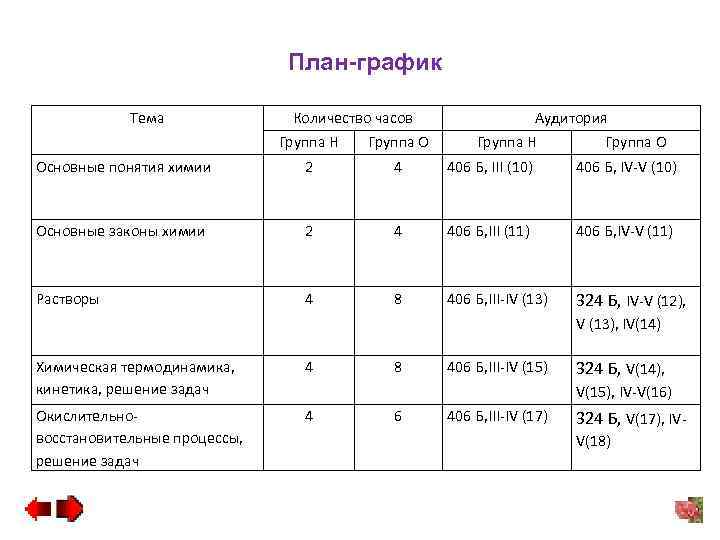 План-график Тема Количество часов Аудитория Группа Н Группа О Основные понятия химии 2 4 406 Б, III (10) 406 Б, IV-V (10) Основные законы химии 2 4 406 Б, III (11) 406 Б, IV-V (11) Растворы 4 8 406 Б, III-IV (13) 324 Б, IV-V (12), V (13), IV(14) Химическая термодинамика, кинетика, решение задач 4 Окислительновосстановительные процессы, решение задач 4 8 406 Б, III-IV (15) 324 Б, V(14), V(15), IV-V(16) 6 406 Б, III-IV (17) 324 Б, V(17), IVV(18)
План-график Тема Количество часов Аудитория Группа Н Группа О Основные понятия химии 2 4 406 Б, III (10) 406 Б, IV-V (10) Основные законы химии 2 4 406 Б, III (11) 406 Б, IV-V (11) Растворы 4 8 406 Б, III-IV (13) 324 Б, IV-V (12), V (13), IV(14) Химическая термодинамика, кинетика, решение задач 4 Окислительновосстановительные процессы, решение задач 4 8 406 Б, III-IV (15) 324 Б, V(14), V(15), IV-V(16) 6 406 Б, III-IV (17) 324 Б, V(17), IVV(18)
 Для освоения дисциплины следующие источники: 1. Библиотека института 2. Сайты преподавателя химии: http: //tanq 60. 16 mb. com/ http: //tanq. hut 4. ru http: //tanq-60. fo. ru/ http: //tanq. wmsite. ru/ http: //wal 32. fo. ru/ https: //sites. google. com/site/kafedraohet/ Сайт кафедры ОХЭТ 3
Для освоения дисциплины следующие источники: 1. Библиотека института 2. Сайты преподавателя химии: http: //tanq 60. 16 mb. com/ http: //tanq. hut 4. ru http: //tanq-60. fo. ru/ http: //tanq. wmsite. ru/ http: //wal 32. fo. ru/ https: //sites. google. com/site/kafedraohet/ Сайт кафедры ОХЭТ 3
 Т. И. Макрушина, Л. Д. Шамонаева Основные понятия химии Методические рекомендации к лабораторный работам по дисциплине «Химия» Бийск Издательство Алтайского государственного технического университета им. И. И. Ползунова 2008 4
Т. И. Макрушина, Л. Д. Шамонаева Основные понятия химии Методические рекомендации к лабораторный работам по дисциплине «Химия» Бийск Издательство Алтайского государственного технического университета им. И. И. Ползунова 2008 4
 Предмет и задачи химии Традиционное определение химии – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Современное определение: химия – система представлений, методов, знаний и теоретических концепций, направленных на изучение атомномолекулярных систем. 5
Предмет и задачи химии Традиционное определение химии – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Современное определение: химия – система представлений, методов, знаний и теоретических концепций, направленных на изучение атомномолекулярных систем. 5
 Перед современной химией стоят три главные задачи. Во-первых, – исследование строения вещества, развитие теории строения и свойств молекул и материалов. Во-вторых, − осуществление направленного синтеза новых веществ с заданными свойствами. В-третьих, анализ состава вещества. 6
Перед современной химией стоят три главные задачи. Во-первых, – исследование строения вещества, развитие теории строения и свойств молекул и материалов. Во-вторых, − осуществление направленного синтеза новых веществ с заданными свойствами. В-третьих, анализ состава вещества. 6
 Основные понятия химии Весь окружающий нас многообразный мир – это материя. Материя проявляется в трех формах вещества, поля, информации. Вещество – вид материи, которая обладает массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Химическая форма движения сопровождается химическими реакциями. 7
Основные понятия химии Весь окружающий нас многообразный мир – это материя. Материя проявляется в трех формах вещества, поля, информации. Вещество – вид материи, которая обладает массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Химическая форма движения сопровождается химическими реакциями. 7
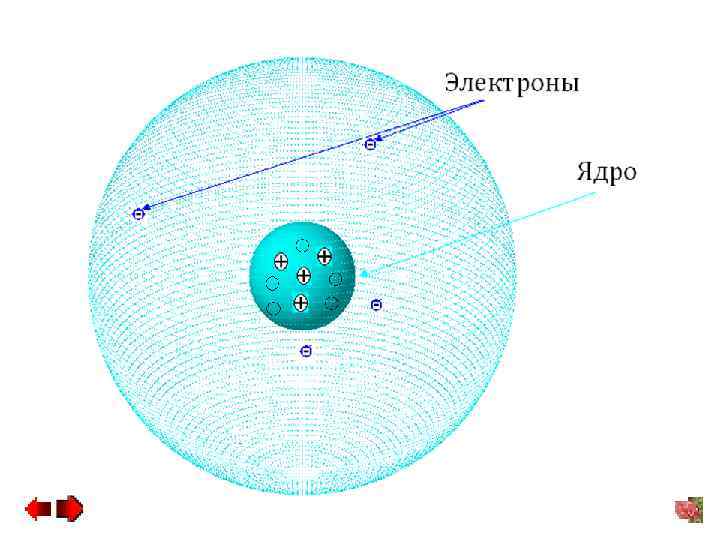
 Атом − наименьшая частица химического элемента, неделимой химическим путем, сохраняющей все его свойства, определенные зарядом ядра и электронной оболочкой. Химический элемент – разновидность атомов, имеющих одинаковый заряд. Каждому химическому элементу соответствует совокупность определенных атомов. Тип атома определяется составом его ядра. Атомное ядро − центральная часть атома, состоящая из Z протонов (положительные элементарные частицы) и N нейтронов (нейтральные элементарные частицы), в которой сосредоточена основная масса атома. 8
Атом − наименьшая частица химического элемента, неделимой химическим путем, сохраняющей все его свойства, определенные зарядом ядра и электронной оболочкой. Химический элемент – разновидность атомов, имеющих одинаковый заряд. Каждому химическому элементу соответствует совокупность определенных атомов. Тип атома определяется составом его ядра. Атомное ядро − центральная часть атома, состоящая из Z протонов (положительные элементарные частицы) и N нейтронов (нейтральные элементарные частицы), в которой сосредоточена основная масса атома. 8
 Заряд ядра – положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом: где Z – число протонов; N – число нейтронов. 10
Заряд ядра – положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом: где Z – число протонов; N – число нейтронов. 10
 Химический элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
Химический элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
 Международная единица атомных масс равна 1/12 массы изотопа 12 C - основного изотопа природного углерода. 1 а. е. м = 1/12 ∙ m (12 C) = 1, 66057 ∙ 10 -27 кг = 1, 661 ∙ 10 -24 г Относительная атомная масса (Ar) − безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома углерода:
Международная единица атомных масс равна 1/12 массы изотопа 12 C - основного изотопа природного углерода. 1 а. е. м = 1/12 ∙ m (12 C) = 1, 66057 ∙ 10 -27 кг = 1, 661 ∙ 10 -24 г Относительная атомная масса (Ar) − безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома углерода:
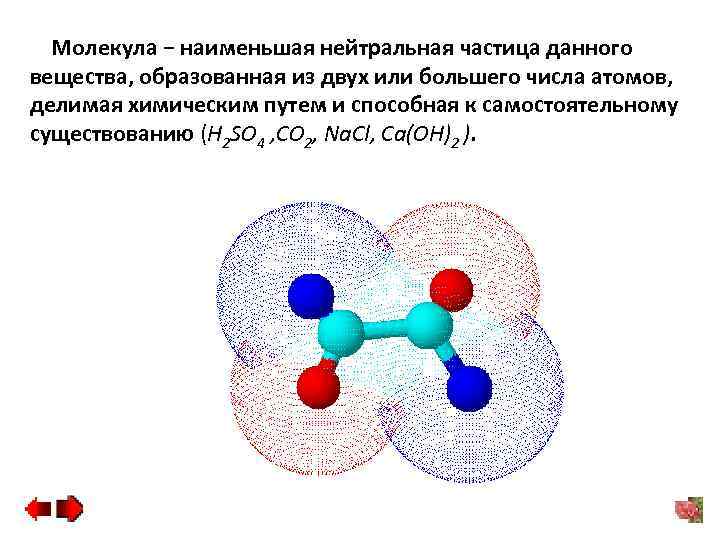 Молекула − наименьшая нейтральная частица данного вещества, образованная из двух или большего числа атомов, делимая химическим путем и способная к самостоятельному существованию (H 2 SO 4 , CO 2, Na. Cl, Ca(OH)2 ).
Молекула − наименьшая нейтральная частица данного вещества, образованная из двух или большего числа атомов, делимая химическим путем и способная к самостоятельному существованию (H 2 SO 4 , CO 2, Na. Cl, Ca(OH)2 ).
 Относительная молекулярная масса (Mr) − безразмерная величина, равная отношению средней массы молекулы вещества к 1/12 массы атома углерода :
Относительная молекулярная масса (Mr) − безразмерная величина, равная отношению средней массы молекулы вещества к 1/12 массы атома углерода :
 Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов или других), сколько атомов содержится в 12 г изотопа углерода. Молярная масса M(x) – это масса одного моля вещества, равная отношению массы вещества к количеству вещества:
Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов или других), сколько атомов содержится в 12 г изотопа углерода. Молярная масса M(x) – это масса одного моля вещества, равная отношению массы вещества к количеству вещества:
 Количество молей вещества n(x) находят как отношение массы вещества m к его молярной массе M(x): Один моль газообразного вещества содержит одно и то же число молекул, равное 6, 023 1023 (NА, число Авогадро): где N − число молекул в данном объеме газа.
Количество молей вещества n(x) находят как отношение массы вещества m к его молярной массе M(x): Один моль газообразного вещества содержит одно и то же число молекул, равное 6, 023 1023 (NА, число Авогадро): где N − число молекул в данном объеме газа.
 Молярный объем газа – это объем, занимаемый одним молем газообразного вещества, равный отношению объема газообразного вещества к его количеству. Один моль газообразного вещества нормальных занимает объем, равный 22, 4 л. при
Молярный объем газа – это объем, занимаемый одним молем газообразного вещества, равный отношению объема газообразного вещества к его количеству. Один моль газообразного вещества нормальных занимает объем, равный 22, 4 л. при
 Ионы – одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называются катионами: а отрицательные – анионами: Радикалы – частицы, образующиеся при разрыве химической связи и содержащие нескомпенсированную валентность:
Ионы – одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называются катионами: а отрицательные – анионами: Радикалы – частицы, образующиеся при разрыве химической связи и содержащие нескомпенсированную валентность:
 Валентность – способность атомов присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно- , а кислород двухвалентен. Есть элементы, которые имеют постоянную валентность: − одновалентны (I): H, Li, Na, K, Rb, Cs, Fr, F; − двухвалентны (II): O, Be, Mg, Ca, Sr, Ba, Zn, Cd; − трехвалентны (III): B, Al. Это нужно знать наизусть. 2 I II K 2 О.
Валентность – способность атомов присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно- , а кислород двухвалентен. Есть элементы, которые имеют постоянную валентность: − одновалентны (I): H, Li, Na, K, Rb, Cs, Fr, F; − двухвалентны (II): O, Be, Mg, Ca, Sr, Ba, Zn, Cd; − трехвалентны (III): B, Al. Это нужно знать наизусть. 2 I II K 2 О.
 Химические реакции – это превращение одних веществ в другие при неизменности ядер атомов Характерные признаки химических реакций: • изменение цвета, • выделение газа, • горение, • свечение, • выпадение осадка. 20
Химические реакции – это превращение одних веществ в другие при неизменности ядер атомов Характерные признаки химических реакций: • изменение цвета, • выделение газа, • горение, • свечение, • выпадение осадка. 20
 21
21
 ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ: -СОЕДИНЕНИЯ - когда два (или более) вещества-реагента соединяются в одно, более сложное вещество; -РАЗЛОЖЕНИЯ - когда одно сложное исходное вещество разлагается на два или несколько более простых; -ОБМЕНА - когда реагенты обмениваются между собой атомами или целыми составными частями своих молекул ; -ЗАМЕЩЕНИЯ - реакции обмена, в которых участвует какоелибо простое вещество, замещающее один из элементов в сложном веществе;
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ: -СОЕДИНЕНИЯ - когда два (или более) вещества-реагента соединяются в одно, более сложное вещество; -РАЗЛОЖЕНИЯ - когда одно сложное исходное вещество разлагается на два или несколько более простых; -ОБМЕНА - когда реагенты обмениваются между собой атомами или целыми составными частями своих молекул ; -ЗАМЕЩЕНИЯ - реакции обмена, в которых участвует какоелибо простое вещество, замещающее один из элементов в сложном веществе;
 - НЕЙТРАЛИЗАЦИИ - (важная разновидность реакций обмена): реакции обмена между кислотой и основанием, в результате которых образуется соль и вода; - ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ - реакции всех перечисленных выше типов, в которых происходит изменение степени окисления каких-либо атомов в реагирующих молекулах.
- НЕЙТРАЛИЗАЦИИ - (важная разновидность реакций обмена): реакции обмена между кислотой и основанием, в результате которых образуется соль и вода; - ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ - реакции всех перечисленных выше типов, в которых происходит изменение степени окисления каких-либо атомов в реагирующих молекулах.
 Химические реакции: соединения (синтеза), разложения, обмена и замещения.
Химические реакции: соединения (синтеза), разложения, обмена и замещения.
 Все вещества делятся на смеси (воздух, морская вода) и индивидуальные вещества. СМЕСЬ - вещество, состоящее из молекул или атомов двух или нескольких веществ (неважно - простых или сложных). Вещества, из которых состоит смесь, могут быть разделены. Примеры: воздух, морская вода, сплав двух металлов, раствор сахара и т. д. Индивидуальные вещества принято делить на две группы: - простые вещества и - сложные вещества, различающихся между собой по химическому составу
Все вещества делятся на смеси (воздух, морская вода) и индивидуальные вещества. СМЕСЬ - вещество, состоящее из молекул или атомов двух или нескольких веществ (неважно - простых или сложных). Вещества, из которых состоит смесь, могут быть разделены. Примеры: воздух, морская вода, сплав двух металлов, раствор сахара и т. д. Индивидуальные вещества принято делить на две группы: - простые вещества и - сложные вещества, различающихся между собой по химическому составу
 ПРОСТОЕ ВЕЩЕСТВО - вещество, которое состоит из атомов только одного элемента или из молекул, построенных из атомов одного элемента. Примеры: кислород O 2, металлическое железо Fe, водород H 2, ромбическая сера S 8. Простые вещества делятся на металлы и неметаллы. Особую группу составляют инертные газы. Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, обладают высокой тепло- и электропроводностью, ковкие, пластичные. Неметаллы являются полной противоположностью металлам, могут быть газообразными, жидкими и твердыми веществами, в основном не обладают металлическим блеском, имеют низкую тепло- и электропроводность (кислород O 2 , бром Br 2 , cера S).
ПРОСТОЕ ВЕЩЕСТВО - вещество, которое состоит из атомов только одного элемента или из молекул, построенных из атомов одного элемента. Примеры: кислород O 2, металлическое железо Fe, водород H 2, ромбическая сера S 8. Простые вещества делятся на металлы и неметаллы. Особую группу составляют инертные газы. Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, обладают высокой тепло- и электропроводностью, ковкие, пластичные. Неметаллы являются полной противоположностью металлам, могут быть газообразными, жидкими и твердыми веществами, в основном не обладают металлическим блеском, имеют низкую тепло- и электропроводность (кислород O 2 , бром Br 2 , cера S).


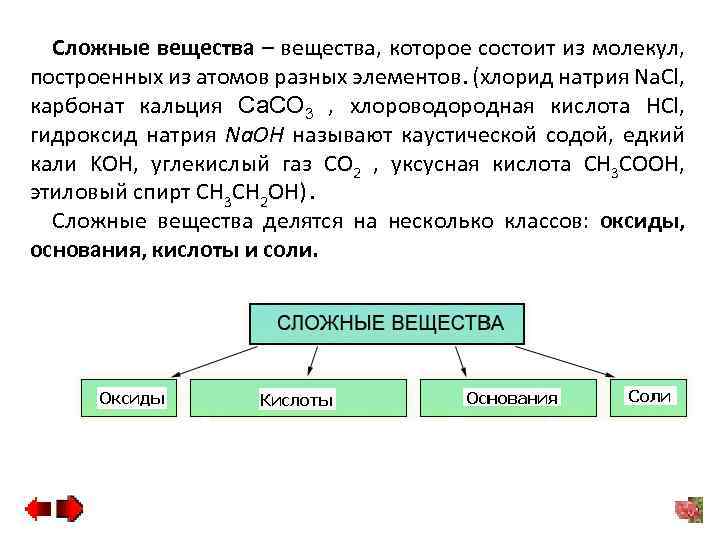 Сложные вещества – вещества, которое состоит из молекул, построенных из атомов разных элементов. (хлорид натрия Na. Cl, карбонат кальция Ca. CO 3 , хлороводородная кислота HCl, гидроксид натрия Na. OH называют каустической содой, едкий кали KOH, углекислый газ CO 2 , уксусная кислота CH 3 COOH, этиловый спирт CH 3 CH 2 OH). Сложные вещества делятся на несколько классов: оксиды, основания, кислоты и соли.
Сложные вещества – вещества, которое состоит из молекул, построенных из атомов разных элементов. (хлорид натрия Na. Cl, карбонат кальция Ca. CO 3 , хлороводородная кислота HCl, гидроксид натрия Na. OH называют каустической содой, едкий кали KOH, углекислый газ CO 2 , уксусная кислота CH 3 COOH, этиловый спирт CH 3 CH 2 OH). Сложные вещества делятся на несколько классов: оксиды, основания, кислоты и соли.
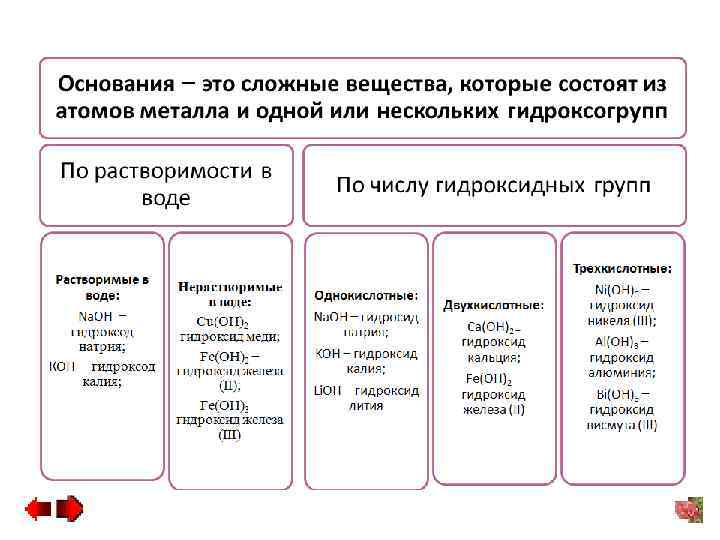
 2. 1 Основания − это сложные вещества, которые состоят из атомов металла и одной или нескольких гидроксогрупп. ОН- − это гидроксид-ион, заряд его равен минус единице. Водные растворы оснований обладают своеобразным мыльным вкусом. Все неорганические основания – твердые вещества (кроме гидроксида аммония NH 4 OH).
2. 1 Основания − это сложные вещества, которые состоят из атомов металла и одной или нескольких гидроксогрупп. ОН- − это гидроксид-ион, заряд его равен минус единице. Водные растворы оснований обладают своеобразным мыльным вкусом. Все неорганические основания – твердые вещества (кроме гидроксида аммония NH 4 OH).
 Номенклатура. Название основания составляется из слов “гидроксид” + название металла в родительном падеже. Например, КОН — гидроксид калия, Ва(ОH)2 — гидроксид бария, La(OH)3 — гидроксид лантана. Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 — гидроксид железa (II), Bi(OH)3 — гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 — дигидроксид кальция, Вi (ОН)3 — тригидроксид висмута. Число гидроксогрупп в молекуле основания определяет его кислотность. Например, Na. OH, КОН, NH 4 OH — однокислотные основания, Ca(OH)2, Sr(OH)2, Ва(OH)2 — двухкислотные основания, La(OH)3, Bi(OH)3 — трехкислотные основания, Th(OH)4 — четырехкислотное основание. Пятикислотные и шестикислотные основания неизвестны.
Номенклатура. Название основания составляется из слов “гидроксид” + название металла в родительном падеже. Например, КОН — гидроксид калия, Ва(ОH)2 — гидроксид бария, La(OH)3 — гидроксид лантана. Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 — гидроксид железa (II), Bi(OH)3 — гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 — дигидроксид кальция, Вi (ОН)3 — тригидроксид висмута. Число гидроксогрупп в молекуле основания определяет его кислотность. Например, Na. OH, КОН, NH 4 OH — однокислотные основания, Ca(OH)2, Sr(OH)2, Ва(OH)2 — двухкислотные основания, La(OH)3, Bi(OH)3 — трехкислотные основания, Th(OH)4 — четырехкислотное основание. Пятикислотные и шестикислотные основания неизвестны.
 Основания по растворимости в воде принято делить на две группы: − растворимые: Li. OH − гидроксид лития, Na. OH − гидроксид натрия, KOH − гидроксид калия; − нерастворимые: Сu(OH)2 − гидрокcид меди (II), Fe(OH)2 − гидроксид железа (II), Fe(OH)3 − гидроксид железа (III). Хорошо растворимые в воде основания называются щелочами. Na. OH – едкий натр, KOH – едкое кали.
Основания по растворимости в воде принято делить на две группы: − растворимые: Li. OH − гидроксид лития, Na. OH − гидроксид натрия, KOH − гидроксид калия; − нерастворимые: Сu(OH)2 − гидрокcид меди (II), Fe(OH)2 − гидроксид железа (II), Fe(OH)3 − гидроксид железа (III). Хорошо растворимые в воде основания называются щелочами. Na. OH – едкий натр, KOH – едкое кали.
 Щелочи являются сильными электролитами – это вещества, растворы которых полностью распадаются в водных растворах на ионы и хорошо проводят электрический ток. Все остальные гидроксиды металлов являются трудно растворимыми в воде соединениями и являются слабыми электролитами (частично в водных растворах распадаются на ионы). Существуют два исключения: NH 4 OH − гидроксид аммония − хорошо растворимое в воде соединение, но слабый электролит; Ca(OH)2 − гидроксид кальция − трудно растворимое в воде соединение, но сильный электролит.
Щелочи являются сильными электролитами – это вещества, растворы которых полностью распадаются в водных растворах на ионы и хорошо проводят электрический ток. Все остальные гидроксиды металлов являются трудно растворимыми в воде соединениями и являются слабыми электролитами (частично в водных растворах распадаются на ионы). Существуют два исключения: NH 4 OH − гидроксид аммония − хорошо растворимое в воде соединение, но слабый электролит; Ca(OH)2 − гидроксид кальция − трудно растворимое в воде соединение, но сильный электролит.
 Количество гидроксидных групп в молекуле основания зависит от валентности металла и определяет кислотность основания. По числу гидроксидных групп в молекуле основания делятся на: − однокислотные, молекула которых содержит одну гидроксидную группу: Na. OH гидросид натрия, гидроксид калия KOH, гидроксид лития Li. OH; − двухкислотные, молекулы которых содержат две гидроксидные группы: гидроксид кальция Ca(OH)2, гидроксид железа (II) Fe(OH)2; − трехкислотные, молекулы которых содержат три гидроксидные группы: гидроксид никеля (III) Ni(OH)3, гидроксид алюминия Al(OH)3, гидрокид висмута (III) Bi(OH)3; − четырехкислотные, молекулы которых содержат четыре гидроксильные группы: гидросид тория (IV) Th(OH)4.
Количество гидроксидных групп в молекуле основания зависит от валентности металла и определяет кислотность основания. По числу гидроксидных групп в молекуле основания делятся на: − однокислотные, молекула которых содержит одну гидроксидную группу: Na. OH гидросид натрия, гидроксид калия KOH, гидроксид лития Li. OH; − двухкислотные, молекулы которых содержат две гидроксидные группы: гидроксид кальция Ca(OH)2, гидроксид железа (II) Fe(OH)2; − трехкислотные, молекулы которых содержат три гидроксидные группы: гидроксид никеля (III) Ni(OH)3, гидроксид алюминия Al(OH)3, гидрокид висмута (III) Bi(OH)3; − четырехкислотные, молекулы которых содержат четыре гидроксильные группы: гидросид тория (IV) Th(OH)4.
 Основания Задания 1. Какие соединения называются основанием? 2. Как составляются названия оснований? 3. Чем определяется кислотность оснований? 4. Что называется остатком основания? 5. Напишите названия оснований: Ва(ОН)2, КОН, Cа(ОН)2, La(OH)3, Th(OH)4. 6. Приведите примеры однокислотных, двухкислотных и трехкислотных оснований.
Основания Задания 1. Какие соединения называются основанием? 2. Как составляются названия оснований? 3. Чем определяется кислотность оснований? 4. Что называется остатком основания? 5. Напишите названия оснований: Ва(ОН)2, КОН, Cа(ОН)2, La(OH)3, Th(OH)4. 6. Приведите примеры однокислотных, двухкислотных и трехкислотных оснований.
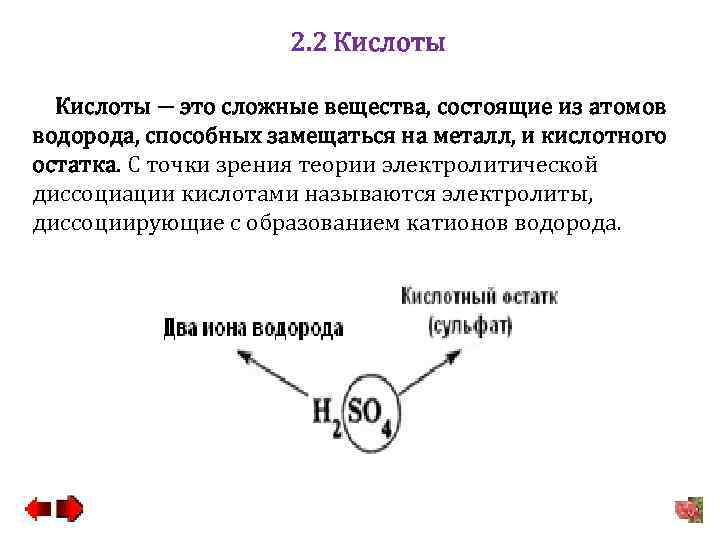 2. 2 Кислоты − это сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка. С точки зрения теории электролитической диссоциации кислотами называются электролиты, диссоциирующие с образованием катионов водорода.
2. 2 Кислоты − это сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка. С точки зрения теории электролитической диссоциации кислотами называются электролиты, диссоциирующие с образованием катионов водорода.
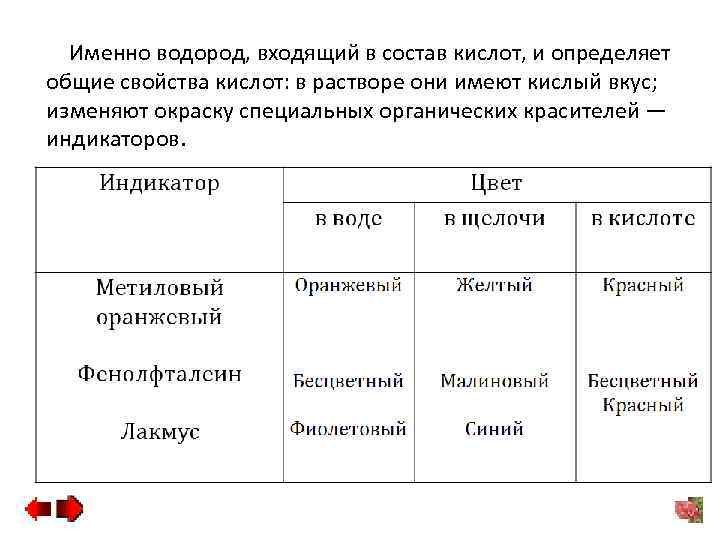 Именно водород, входящий в состав кислот, и определяет общие свойства кислот: в растворе они имеют кислый вкус; изменяют окраску специальных органических красителей — индикаторов.
Именно водород, входящий в состав кислот, и определяет общие свойства кислот: в растворе они имеют кислый вкус; изменяют окраску специальных органических красителей — индикаторов.
 Номенклатура. Названия кислот составляют из названия элемента + слово “водородная” (в случае бескислородной кислоты: HCl – Хлороводородная (соляная) кислота) или с соответствующим суффиксом (в случае кислородсодержащей кислоты: H 2 SO 4 - Серная кислота) Кислоты могут быть - твердыми (борная Н 3 ВО 3, ортофосфорная Н 3 РO 4, йодная кислота HIO 4) или - жидкими (серная H 2 SO 4, азотная НNО 3) веществами - кислотами являются - также растворы газов в воде (например, НСl, НВr, H 2 S ).
Номенклатура. Названия кислот составляют из названия элемента + слово “водородная” (в случае бескислородной кислоты: HCl – Хлороводородная (соляная) кислота) или с соответствующим суффиксом (в случае кислородсодержащей кислоты: H 2 SO 4 - Серная кислота) Кислоты могут быть - твердыми (борная Н 3 ВО 3, ортофосфорная Н 3 РO 4, йодная кислота HIO 4) или - жидкими (серная H 2 SO 4, азотная НNО 3) веществами - кислотами являются - также растворы газов в воде (например, НСl, НВr, H 2 S ).
 По содержанию атомов кислорода в молекуле кислоты делятся на: − бескислородные, молекулы которых не содержат атомов кислорода: Н 2 S − сероводородная кислота, H 2 Se − селеноводородная кислота, HF − фтороводородная кислота (плавиковая кислота), HCl − хлороводородная кислота (соляная кислота), HBr − бромоводородная кислота, HI − йодоводородная кислота, a HCN − циановодородная кислота (синильная кислота); − кислородсодержащие, молекулы которых содержат атомы кислорода: угольная кислота Н 2 СО 3 − продукт соединения СО 2 с водой; серная кислота H 2 SO 4 − продукт соединения SО 3 с водой; хромовая кислота H 2 Сr. О 4 − продукт соединения Сr. О 3 с водой. Кислородсодержащие кислоты называют оксокислотами.
По содержанию атомов кислорода в молекуле кислоты делятся на: − бескислородные, молекулы которых не содержат атомов кислорода: Н 2 S − сероводородная кислота, H 2 Se − селеноводородная кислота, HF − фтороводородная кислота (плавиковая кислота), HCl − хлороводородная кислота (соляная кислота), HBr − бромоводородная кислота, HI − йодоводородная кислота, a HCN − циановодородная кислота (синильная кислота); − кислородсодержащие, молекулы которых содержат атомы кислорода: угольная кислота Н 2 СО 3 − продукт соединения СО 2 с водой; серная кислота H 2 SO 4 − продукт соединения SО 3 с водой; хромовая кислота H 2 Сr. О 4 − продукт соединения Сr. О 3 с водой. Кислородсодержащие кислоты называют оксокислотами.
 Основность кислоты – это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла. По основности кислоты делятся на: − одноосновные, молекулы которых содержат один атом водорода: HCl, HNO 3, HCN; − двухосновные, молекулы которых содержат два атома водорода: H 2 S, H 2 SO 4, H 2 CO 3; − трехосновные, молекулы которых содержат три атома водорода: H 3 PO 4, H 3 BO 3; − четырехосновные, H 4 P 2 O 7 пирофосфорная (дифосфорная) кислота.
Основность кислоты – это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла. По основности кислоты делятся на: − одноосновные, молекулы которых содержат один атом водорода: HCl, HNO 3, HCN; − двухосновные, молекулы которых содержат два атома водорода: H 2 S, H 2 SO 4, H 2 CO 3; − трехосновные, молекулы которых содержат три атома водорода: H 3 PO 4, H 3 BO 3; − четырехосновные, H 4 P 2 O 7 пирофосфорная (дифосфорная) кислота.
 Как электролиты кислоты делятся на две группы: сильные и слабые. Сильные электролиты: сильные кислоты (HCl, HBr, HI, HCl. O 4, HNO 3). К слабым электролитам относятся: - почти все органические кислоты (CH 3 COOH, C 2 H 5 COOH и др. ); - некоторые неорганические кислоты (H 2 CO 3, H 2 Si. O 3, H 2 S, НNO 2, HCN, H 3 BO 3, H 3 PO 4, HCl. O.
Как электролиты кислоты делятся на две группы: сильные и слабые. Сильные электролиты: сильные кислоты (HCl, HBr, HI, HCl. O 4, HNO 3). К слабым электролитам относятся: - почти все органические кислоты (CH 3 COOH, C 2 H 5 COOH и др. ); - некоторые неорганические кислоты (H 2 CO 3, H 2 Si. O 3, H 2 S, НNO 2, HCN, H 3 BO 3, H 3 PO 4, HCl. O.



 Кислоты Задания 1. Какие соединения называются кислотами? 2. Чем определяется основность кислоты? 3. Что называется кислотным остатком? 4. Чем определяется заряд кислотного остатка? 5. Приведите названия для следующих кислот и кислотных остатков: HCN, H 2 Se, H 3 As. O 4, HBr. O 3 H 2 Cr. O 4.
Кислоты Задания 1. Какие соединения называются кислотами? 2. Чем определяется основность кислоты? 3. Что называется кислотным остатком? 4. Чем определяется заряд кислотного остатка? 5. Приведите названия для следующих кислот и кислотных остатков: HCN, H 2 Se, H 3 As. O 4, HBr. O 3 H 2 Cr. O 4.
 2. 3 Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых кислород, в оксидах кислород имеет степень окисления -2. Номенклатура. Названия оксидов элементов, имеющих постоянную степень окисления, составляются из двух слов: оксид + нaзвaние элемента в родительном падеже: Mg. O — оксид магния, Na 2 O - оксид натрия, Са. О - оксид кальция. Если элемент образует несколько оксидов, то после названия элемента указывается его степень окисления римской цифрой в скобках: Мn. О — оксид марганца (II), Мn 2 О 3 — оксид марганца (III). Название оксидов можно также образовывать добавлением к слову “оксид” греческих числительных. Например, СО 2 -диоксид углерода, SО 2 — диоксид серы, SO 3 — триоксид серы, Os. O 4 — тетраоксид осмия.
2. 3 Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых кислород, в оксидах кислород имеет степень окисления -2. Номенклатура. Названия оксидов элементов, имеющих постоянную степень окисления, составляются из двух слов: оксид + нaзвaние элемента в родительном падеже: Mg. O — оксид магния, Na 2 O - оксид натрия, Са. О - оксид кальция. Если элемент образует несколько оксидов, то после названия элемента указывается его степень окисления римской цифрой в скобках: Мn. О — оксид марганца (II), Мn 2 О 3 — оксид марганца (III). Название оксидов можно также образовывать добавлением к слову “оксид” греческих числительных. Например, СО 2 -диоксид углерода, SО 2 — диоксид серы, SO 3 — триоксид серы, Os. O 4 — тетраоксид осмия.
 Большинство оксидов твердые вещества (Fe 3 O 4 , K 2 O, Al 2 O 3, P 2 O 3), но могут быть жидкими (SO 3, N 2 O 3 Mn 2 O 7) и газообразными веществами (СO 2, SO 2, N 2 O ). По растворимости в воде оксиды делятся на растворимые (SO 2, CO 2, K 2 O) и нерастворимые (Сu. O, Fe. O, Si. O 2, Al 2 O 3). Оксиды подразделяются на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам принадлежат безразличные (индифферентные) оксиды: CO , N 2 O , NO, Si. O.
Большинство оксидов твердые вещества (Fe 3 O 4 , K 2 O, Al 2 O 3, P 2 O 3), но могут быть жидкими (SO 3, N 2 O 3 Mn 2 O 7) и газообразными веществами (СO 2, SO 2, N 2 O ). По растворимости в воде оксиды делятся на растворимые (SO 2, CO 2, K 2 O) и нерастворимые (Сu. O, Fe. O, Si. O 2, Al 2 O 3). Оксиды подразделяются на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам принадлежат безразличные (индифферентные) оксиды: CO , N 2 O , NO, Si. O.
 Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды. ОКСИДЫ ОСНОВНЫЕ - оксиды, которые взаимодействуют с кислотами с образованием соли и воды. Основные оксиды образуют металлы с небольшими степенями окисления +1 и +2. Все основные оксиды – твердые вещества, преимущественно с ионным типом кристаллической решетки. Следует помнить, что из этого правила есть исключения (Be. O и Zn. O – амфотерные оксиды). Ca+2 O – Ca+2 (OH)2 – Ca+2 Cl 2 (Са. О – основный оксид) оксид – основание – соль
Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды. ОКСИДЫ ОСНОВНЫЕ - оксиды, которые взаимодействуют с кислотами с образованием соли и воды. Основные оксиды образуют металлы с небольшими степенями окисления +1 и +2. Все основные оксиды – твердые вещества, преимущественно с ионным типом кристаллической решетки. Следует помнить, что из этого правила есть исключения (Be. O и Zn. O – амфотерные оксиды). Ca+2 O – Ca+2 (OH)2 – Ca+2 Cl 2 (Са. О – основный оксид) оксид – основание – соль
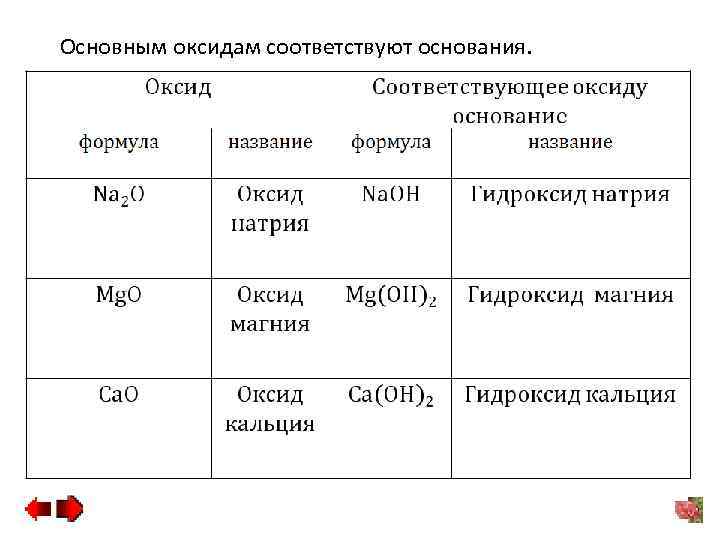 Основным оксидам соответствуют основания.
Основным оксидам соответствуют основания.
 ОКСИДЫ КИСЛОТНЫЕ - оксиды, которые взаимодействуют с основаниями с образованием соли и воды. Кислотные оксиды образуют неметаллы и металлы в степенях окисления больше чем +4. Они могут находиться в различных агрегатных состояниях: газообразные (SO 2, CO 2) и жидкие (SO 3, Mn 2 O 7) имеют молекулярное строение, твердые (P 2 O 5, Si. O 2) имеют атомную кристаллическую решетку. SO 3 – H 2 SO 4 – Na 2 SO 4 (SO 3 – кислотный оксид) оксид – кислота – соль
ОКСИДЫ КИСЛОТНЫЕ - оксиды, которые взаимодействуют с основаниями с образованием соли и воды. Кислотные оксиды образуют неметаллы и металлы в степенях окисления больше чем +4. Они могут находиться в различных агрегатных состояниях: газообразные (SO 2, CO 2) и жидкие (SO 3, Mn 2 O 7) имеют молекулярное строение, твердые (P 2 O 5, Si. O 2) имеют атомную кристаллическую решетку. SO 3 – H 2 SO 4 – Na 2 SO 4 (SO 3 – кислотный оксид) оксид – кислота – соль
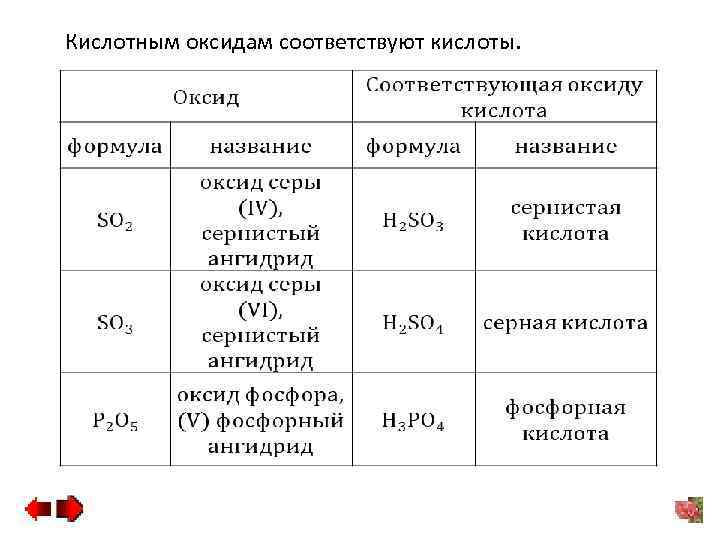 Кислотным оксидам соответствуют кислоты.
Кислотным оксидам соответствуют кислоты.
 Амфотерные оксиды образуют металлы со степенями окисления +3 и +4, бериллий и цинк в степени окисления +2. Они находятся в твердом агрегатном состоянии, но имеют преимущественно атомные кристаллические решетки. К амфотерным оксидам относятся, прежде всего, Аl 2 О 3 − оксид алюминия, Zn. O − оксид цинка, Ве. О − оксид бериллия, Cu. O − оксид меди (II), Fе 2 О 3 − оксид железа (III), а также ряд других оксидов (Pb. O 2 , Pb. O, Sn. O 2 , Sn. O). Амфотерными называются оксиды, которые могут взаимодействовать как с кислотами, так и основаниями.
Амфотерные оксиды образуют металлы со степенями окисления +3 и +4, бериллий и цинк в степени окисления +2. Они находятся в твердом агрегатном состоянии, но имеют преимущественно атомные кристаллические решетки. К амфотерным оксидам относятся, прежде всего, Аl 2 О 3 − оксид алюминия, Zn. O − оксид цинка, Ве. О − оксид бериллия, Cu. O − оксид меди (II), Fе 2 О 3 − оксид железа (III), а также ряд других оксидов (Pb. O 2 , Pb. O, Sn. O 2 , Sn. O). Амфотерными называются оксиды, которые могут взаимодействовать как с кислотами, так и основаниями.

 Оксиды Задания 1. Какие вещества называют оксидами? 2. Как составляются названия оксидов? 3. Составьте формулы и дайте названия оксидов следующих элементов: а) калия; б) цинка; в) фосфора (III); г) кремния (IV); д) хрома (VI); е) хлора (VII); ж) ртути (II).
Оксиды Задания 1. Какие вещества называют оксидами? 2. Как составляются названия оксидов? 3. Составьте формулы и дайте названия оксидов следующих элементов: а) калия; б) цинка; в) фосфора (III); г) кремния (IV); д) хрома (VI); е) хлора (VII); ж) ртути (II).
 Соли - это продукты полного или частичного замещения водорода в кислоте на металл или гидроксо-групп в основании на кислотный остаток. Большинство солей − твердые кристаллические вещества белого цвета. По растворимости в воде соли делятся на растворимые в воде (р), малорастворимые (м) и нерастворимые (н). Различают несколько типов солей: нормальные (средние), кислые, основные, двойные, смешанные, комплексные. Нормальные соли (средние соли) − это продукты полного замещения ионов водорода кислоты металлом или гидроксогруппы основания кислотным остатком. Например, Na 2 SO 4, Ca(NO 3)2 − средние соли.
Соли - это продукты полного или частичного замещения водорода в кислоте на металл или гидроксо-групп в основании на кислотный остаток. Большинство солей − твердые кристаллические вещества белого цвета. По растворимости в воде соли делятся на растворимые в воде (р), малорастворимые (м) и нерастворимые (н). Различают несколько типов солей: нормальные (средние), кислые, основные, двойные, смешанные, комплексные. Нормальные соли (средние соли) − это продукты полного замещения ионов водорода кислоты металлом или гидроксогруппы основания кислотным остатком. Например, Na 2 SO 4, Ca(NO 3)2 − средние соли.
 Кислая соль − продукт неполного замещения водорода многоосновной кислоты металлом. Например, Na. HSO 4 − гидросульфат натрия, Са(НСО 3)2 − гидросульфат кальция. 2 Na + 2 H 2 SO 4 = 2 Na. HSO 4 + Н 2 Основная соль − продукт неполного замещения гидроксогрупп многокислотного основания кислотными остатками. Помимо атомов металла и кислотного остатка содержат также гидросо-группу. Например, Mg. OНСl − хлорид гидроксомеди, Bi. OHCl 2 − дихлорид гидроксовисмута. Mg (ОН)2 + НСl = Mg. OHCI + Н 2 О
Кислая соль − продукт неполного замещения водорода многоосновной кислоты металлом. Например, Na. HSO 4 − гидросульфат натрия, Са(НСО 3)2 − гидросульфат кальция. 2 Na + 2 H 2 SO 4 = 2 Na. HSO 4 + Н 2 Основная соль − продукт неполного замещения гидроксогрупп многокислотного основания кислотными остатками. Помимо атомов металла и кислотного остатка содержат также гидросо-группу. Например, Mg. OНСl − хлорид гидроксомеди, Bi. OHCl 2 − дихлорид гидроксовисмута. Mg (ОН)2 + НСl = Mg. OHCI + Н 2 О
 Двойные соли − это сложные вещества, образованные в результате замещения атомов водорода многоосновных кислот атомами разных металлов. Например, сульфат калияалюминия KAI(SO 4)2. Смешанные соли − это сложные вещества, образованные в результате замещения гидроксогруппы многокислотных оснований различными кислотными остатками. Например, хлорид-гипохлорит кальция Са(ОСl)Сl. Комплексными солями называют соли, в состав которых входят комплексные ионы (катионы или анионы), ион металла или кислотного остатка. Например, K 4[Fe(CN)6] (гексацианоферрат калия)− комплексная, в ее состав входит комплексный ион [Fe(CN)6]4 -.
Двойные соли − это сложные вещества, образованные в результате замещения атомов водорода многоосновных кислот атомами разных металлов. Например, сульфат калияалюминия KAI(SO 4)2. Смешанные соли − это сложные вещества, образованные в результате замещения гидроксогруппы многокислотных оснований различными кислотными остатками. Например, хлорид-гипохлорит кальция Са(ОСl)Сl. Комплексными солями называют соли, в состав которых входят комплексные ионы (катионы или анионы), ион металла или кислотного остатка. Например, K 4[Fe(CN)6] (гексацианоферрат калия)− комплексная, в ее состав входит комплексный ион [Fe(CN)6]4 -.

 Номенклатура солей. Названия солей составляют из названия кислотного остатка в именительном падеже и названия остатка основания в родительном падеже (без слова “ион”). Например, Mg. С 12 — хлорид магния Ba 3(РО 4)2 — ортофосфат бария Na 2 S — сульфид натрия Ca. HPO 4 - гидрофосфат кальция K 2 SO 3 — сульфит калия Ca(H 2 PO 4)2 — дигидрофосфат кальция А 12(SO 4)3 — сульфат алюминия (Mg. OH)2 SO 4 — сульфат гидроксомагния K 2 Na. PO 4 — ортофосфат калия – натрия (2: 1) Mn. Cl 2 – хлорид марганца Са(OCI)Cl — хлорид – гипохлорит кальция
Номенклатура солей. Названия солей составляют из названия кислотного остатка в именительном падеже и названия остатка основания в родительном падеже (без слова “ион”). Например, Mg. С 12 — хлорид магния Ba 3(РО 4)2 — ортофосфат бария Na 2 S — сульфид натрия Ca. HPO 4 - гидрофосфат кальция K 2 SO 3 — сульфит калия Ca(H 2 PO 4)2 — дигидрофосфат кальция А 12(SO 4)3 — сульфат алюминия (Mg. OH)2 SO 4 — сульфат гидроксомагния K 2 Na. PO 4 — ортофосфат калия – натрия (2: 1) Mn. Cl 2 – хлорид марганца Са(OCI)Cl — хлорид – гипохлорит кальция
 Составление формул солей Можно сказать, что соли состоят из остатков оснований и остатков кислот. При составлении формул солей нужно помнить правило: абсолютная величина произведения заряда остатка основания на число остатков основания равна абсолютной величине произведения заряда кислотного остатка на число кислотных остатков. Для тх = nу, где K — остаток основания, A — кислотный остаток, т — заряд остатка основания, n — заряд кислотного остатка, х — число остатков основания, у — число кислотных остатков.
Составление формул солей Можно сказать, что соли состоят из остатков оснований и остатков кислот. При составлении формул солей нужно помнить правило: абсолютная величина произведения заряда остатка основания на число остатков основания равна абсолютной величине произведения заряда кислотного остатка на число кислотных остатков. Для тх = nу, где K — остаток основания, A — кислотный остаток, т — заряд остатка основания, n — заряд кислотного остатка, х — число остатков основания, у — число кислотных остатков.
 Формулы: 2 x = 3 y x = 3, y = 2 Ba 3(PO 4)2 2 x = 1 y x = 1, y = 2 Ca(H 2 PO 4)2 1 x = 3 y x = 3; y = 1 (Mg. OH)3 PO 4
Формулы: 2 x = 3 y x = 3, y = 2 Ba 3(PO 4)2 2 x = 1 y x = 1, y = 2 Ca(H 2 PO 4)2 1 x = 3 y x = 3; y = 1 (Mg. OH)3 PO 4
 Соли Задания 1. Какие соединения называются солями? Какие соли вы знаете? 2. Составьте формула солей из следующих остатков: а) гидромагний - ион и ортофосфат - ион; б) гидроксовисмут (III) ион и сульфат - ион; в) гидроксовисмут(III) - ион и нитрат - ион; г) висмут(III) ион и xлорид – ион; д) никель (II) - ион и ортофосфат - ион. 3. Дайте названия следующим солям: Mg. Cl 2, Na 2 SO 4, K 3 PO 4, Cu(NO 3)2, Ba. CO 3, Fe(NO 3)3 Fe. S, KHCO 3, Na 2 HPO 4, Na. H 2 PO 4, Fe. OHCl. 4. Напишите формулы следующих солей; а) сульфат железа(III); б) дигидрофосфат магния; в) хлорид гидроксоалюминия.
Соли Задания 1. Какие соединения называются солями? Какие соли вы знаете? 2. Составьте формула солей из следующих остатков: а) гидромагний - ион и ортофосфат - ион; б) гидроксовисмут (III) ион и сульфат - ион; в) гидроксовисмут(III) - ион и нитрат - ион; г) висмут(III) ион и xлорид – ион; д) никель (II) - ион и ортофосфат - ион. 3. Дайте названия следующим солям: Mg. Cl 2, Na 2 SO 4, K 3 PO 4, Cu(NO 3)2, Ba. CO 3, Fe(NO 3)3 Fe. S, KHCO 3, Na 2 HPO 4, Na. H 2 PO 4, Fe. OHCl. 4. Напишите формулы следующих солей; а) сульфат железа(III); б) дигидрофосфат магния; в) хлорид гидроксоалюминия.
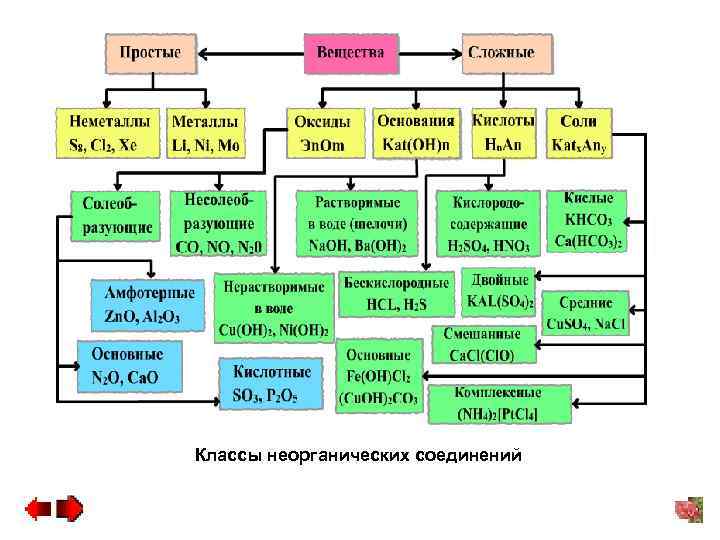 Классы неорганических соединений
Классы неорганических соединений
 Номенклатура неорганических соединений Составление химических формул и названий неорганических веществ проводится в соответствии с номенклатурными правилами Международного союза теоретической и прикладной химии (ИЮПАК), адаптированных к традициям русского языка. Химическая формула полностью отражает состав данного вещества. По формуле строится систематическое название, также полностью отражающее состав вещества. Например, Hg 2 Cl 2 – дихлорид диртути, Mn 2 O 7 – оксид марганца (VII), Na 2 CO 3 – триоксокарбонат (IV) натрия.
Номенклатура неорганических соединений Составление химических формул и названий неорганических веществ проводится в соответствии с номенклатурными правилами Международного союза теоретической и прикладной химии (ИЮПАК), адаптированных к традициям русского языка. Химическая формула полностью отражает состав данного вещества. По формуле строится систематическое название, также полностью отражающее состав вещества. Например, Hg 2 Cl 2 – дихлорид диртути, Mn 2 O 7 – оксид марганца (VII), Na 2 CO 3 – триоксокарбонат (IV) натрия.
 Для наиболее распространенных неорганических веществ применяются, помимо систематических названий, традиционные (отражающие состав не полностью). Например, HNO 3 – азотная кислота, KNO 3 – нитрат калия. Также допускается использование специальных названий (совсем не отражающих состав), таких как H 2 O – вода, NН 3 – аммиак. Эти названия обычно более короткие и поэтому удобны в использовании.
Для наиболее распространенных неорганических веществ применяются, помимо систематических названий, традиционные (отражающие состав не полностью). Например, HNO 3 – азотная кислота, KNO 3 – нитрат калия. Также допускается использование специальных названий (совсем не отражающих состав), таких как H 2 O – вода, NН 3 – аммиак. Эти названия обычно более короткие и поэтому удобны в использовании.
 Кроме того, в технической литературе зачастую применяют бессистемные тривиальные названия, например, сода, едкий натр, медный купорос, соляная кислота, негашеная известь, бура. Для большинства элементов корни их русских названий совпадают с корнями латинских названий элементов. В случае такого несовпадения в производные названия вводятся корни латинских названий элементов (табл. 1. 1).
Кроме того, в технической литературе зачастую применяют бессистемные тривиальные названия, например, сода, едкий натр, медный купорос, соляная кислота, негашеная известь, бура. Для большинства элементов корни их русских названий совпадают с корнями латинских названий элементов. В случае такого несовпадения в производные названия вводятся корни латинских названий элементов (табл. 1. 1).
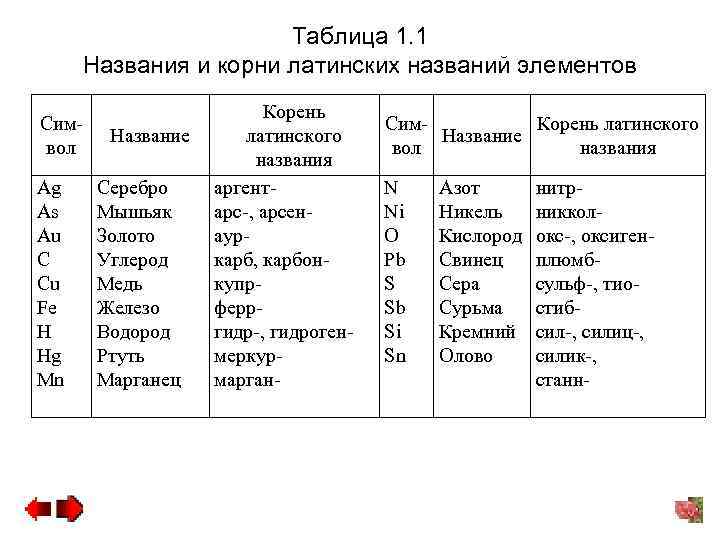 Таблица 1. 1 Названия и корни латинских названий элементов Символ Ag As Au C Cu Fe H Hg Mn Корень Название латинского названия Серебро аргент. Мышьяк арс-, арсен. Золото аур. Углерод карб, карбон. Медь купр. Железо ферр. Водород гидр-, гидроген. Ртуть меркур. Марганец марган- Сим. Корень латинского Название вол названия N Ni O Pb S Sb Si Sn Азот Никель Кислород Свинец Сера Сурьма Кремний Олово нитрникколокс-, оксигенплюмбсульф-, тиостибсил-, силиц-, силик-, станн-
Таблица 1. 1 Названия и корни латинских названий элементов Символ Ag As Au C Cu Fe H Hg Mn Корень Название латинского названия Серебро аргент. Мышьяк арс-, арсен. Золото аур. Углерод карб, карбон. Медь купр. Железо ферр. Водород гидр-, гидроген. Ртуть меркур. Марганец марган- Сим. Корень латинского Название вол названия N Ni O Pb S Sb Si Sn Азот Никель Кислород Свинец Сера Сурьма Кремний Олово нитрникколокс-, оксигенплюмбсульф-, тиостибсил-, силиц-, силик-, станн-
 Количественный состав вещества в названии характеризуется с помощью греческих числительных, используемых как числовые приставки: моно - 1; пента - 5; нона - 9; ди 2; гекса - 6; дека - 10. три 3; гепта - 7; тетра - 4; окта - 8; Римскими цифрами, приводимыми в скобках после названия элемента, указывается (при необходимости) его степень окисления, например: SO 2 – оксид серы (IV), Fe. Cl 3 – хлорид железа (III), Cu 2+ - катион меди (II), читается «катион меди два» .
Количественный состав вещества в названии характеризуется с помощью греческих числительных, используемых как числовые приставки: моно - 1; пента - 5; нона - 9; ди 2; гекса - 6; дека - 10. три 3; гепта - 7; тетра - 4; окта - 8; Римскими цифрами, приводимыми в скобках после названия элемента, указывается (при необходимости) его степень окисления, например: SO 2 – оксид серы (IV), Fe. Cl 3 – хлорид железа (III), Cu 2+ - катион меди (II), читается «катион меди два» .
 Одноэлементные анионы называют с добавлением к названию элемента окончания – ид и слова «ион» : O 2 - - оксид-ион, Cl- - хлорид-ион, S 2 - - сульфид-ион, H- - гидрид-ион. Для некоторых ионов применяются вместо систематических названий – специальные, например O 22 – пероксид-ион. Специальные названия присваивают многим многоэлементным ионам: NH 4+ - катион аммония, H 3 O+ - катион оксония, CN- - цианид-ион, HS- - гидросульфид-ион,
Одноэлементные анионы называют с добавлением к названию элемента окончания – ид и слова «ион» : O 2 - - оксид-ион, Cl- - хлорид-ион, S 2 - - сульфид-ион, H- - гидрид-ион. Для некоторых ионов применяются вместо систематических названий – специальные, например O 22 – пероксид-ион. Специальные названия присваивают многим многоэлементным ионам: NH 4+ - катион аммония, H 3 O+ - катион оксония, CN- - цианид-ион, HS- - гидросульфид-ион,
 Специальные названия катионов и анионов переходят в названия сложных веществ без изменения. Например, NH 4 Cl – хлорид аммония, H 2 O 2 – пероксид водорода, Ba(OH)2 – гидроксид бария, HCN – циановодород, Fe(NCS)3 – тиоцианат железа (III). Для наиболее распространенных оксокислот и их кислотных остатков используются следующие традиционные названия:
Специальные названия катионов и анионов переходят в названия сложных веществ без изменения. Например, NH 4 Cl – хлорид аммония, H 2 O 2 – пероксид водорода, Ba(OH)2 – гидроксид бария, HCN – циановодород, Fe(NCS)3 – тиоцианат железа (III). Для наиболее распространенных оксокислот и их кислотных остатков используются следующие традиционные названия:
 HAs. O 2 – метамышьяковая кислота - - метарсенит As. O 2 H 3 As. O 3 – ортомышьяковая кислота 3 - - ортоарсенит As. O 3 H 3 As. O 4 – мышьяковая кислота - арсенат As. O 43 HBO 2 – метаборная кислота BO 2 - - метаборат H 3 BO 3 – ортоборная кислота - ортоборат BO 33 H 2 CO 3 – угольная CO 32 - карбонат HCl. O – хлорноватистая Cl. O- гипохлорит HCl. O 2 – хлористая Cl. O 2 - - хлорит HCl. O 3 - хлорноватая Cl. O 3 - - хлорат HCl. O 4 – хлорная - перхлорат Cl. O 4 H 2 Cr. O 4 ромовая –х Cr. O 42 - - хромат
HAs. O 2 – метамышьяковая кислота - - метарсенит As. O 2 H 3 As. O 3 – ортомышьяковая кислота 3 - - ортоарсенит As. O 3 H 3 As. O 4 – мышьяковая кислота - арсенат As. O 43 HBO 2 – метаборная кислота BO 2 - - метаборат H 3 BO 3 – ортоборная кислота - ортоборат BO 33 H 2 CO 3 – угольная CO 32 - карбонат HCl. O – хлорноватистая Cl. O- гипохлорит HCl. O 2 – хлористая Cl. O 2 - - хлорит HCl. O 3 - хлорноватая Cl. O 3 - - хлорат HCl. O 4 – хлорная - перхлорат Cl. O 4 H 2 Cr. O 4 ромовая –х Cr. O 42 - - хромат
 HCr 2 O 7 – дихромовая 2 - - дихромат Cr 2 O 7 HMn. O 4 – марганцовая - - перманганат Mn. O 4 H 2 Mn. O 4 – марганцовистая 2 - - манганат Mn. O 4 HNO 3 – азотная NO 3 - - нитрат HNO 2 - азотистая NO 2 - - нитрит H 3 PO 4 – офтофосфорная PO 43 - - ортофосфат H 2 SO 4 – серная SO 42 - - сульфат H 2 SO 3 – сернистая SO 32 - - сульфит H 2 SO 3 S (H 2 S 2 O 3) – тиосерная 33 - - тиосульфат S 2 O
HCr 2 O 7 – дихромовая 2 - - дихромат Cr 2 O 7 HMn. O 4 – марганцовая - - перманганат Mn. O 4 H 2 Mn. O 4 – марганцовистая 2 - - манганат Mn. O 4 HNO 3 – азотная NO 3 - - нитрат HNO 2 - азотистая NO 2 - - нитрит H 3 PO 4 – офтофосфорная PO 43 - - ортофосфат H 2 SO 4 – серная SO 42 - - сульфат H 2 SO 3 – сернистая SO 32 - - сульфит H 2 SO 3 S (H 2 S 2 O 3) – тиосерная 33 - - тиосульфат S 2 O
 В русском варианте правил ИЮПАК название вещества читается справа налево, т. е. в начале называется его электроотрицательная составляющая (анион) в именительном падеже, а затем электроположительная (катион) в родительном падеже. При этом в случае одноэлементного аниона используют суффикс – ид, а в случае многоэлементного аниона суффикс – ат (если элемент имеет постоянную степень окисления или элемент с переменной степенью окисления находится в высшей степени окисления) или суффикса – ит (если элемент находится в низшей степени окисления). Например: CO – оксид углерода (II), CO 2 – оксид углерода (IV), HCl – хлорид водорода (хлороводород),
В русском варианте правил ИЮПАК название вещества читается справа налево, т. е. в начале называется его электроотрицательная составляющая (анион) в именительном падеже, а затем электроположительная (катион) в родительном падеже. При этом в случае одноэлементного аниона используют суффикс – ид, а в случае многоэлементного аниона суффикс – ат (если элемент имеет постоянную степень окисления или элемент с переменной степенью окисления находится в высшей степени окисления) или суффикса – ит (если элемент находится в низшей степени окисления). Например: CO – оксид углерода (II), CO 2 – оксид углерода (IV), HCl – хлорид водорода (хлороводород),
 Традиционные названия кислых солей образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-, например: KHSO 4 – гидросульфат калия, Na. H 2 PO 4 – дигидросульфат натрия. Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-, например: Fe. OHNO 3 – гидроксонитрат железа (II), (Co. OH)2 SO 4 – гидроксосульфат кобальта (II), Bi. OCl – оксохлорид висмута (III). Задания
Традиционные названия кислых солей образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-, например: KHSO 4 – гидросульфат калия, Na. H 2 PO 4 – дигидросульфат натрия. Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-, например: Fe. OHNO 3 – гидроксонитрат железа (II), (Co. OH)2 SO 4 – гидроксосульфат кобальта (II), Bi. OCl – оксохлорид висмута (III). Задания
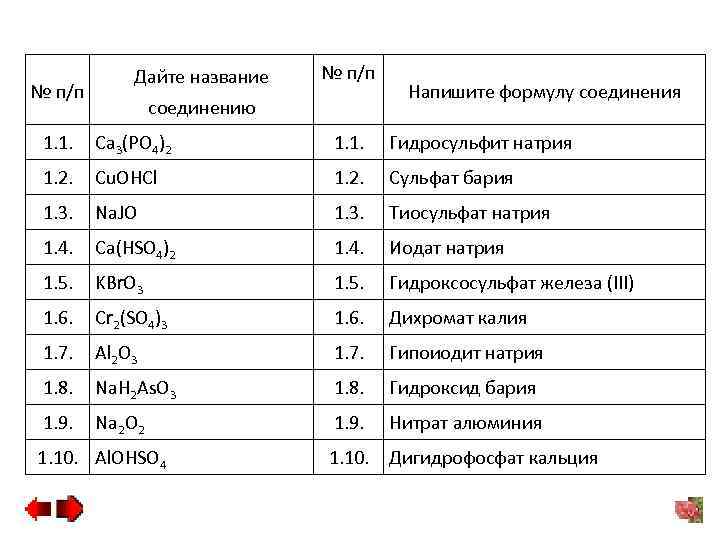 № п/п Дайте название № п/п соединению Напишите формулу соединения 1. 1. Ca 3(PO 4)2 1. 1. Гидросульфит натрия 1. 2. Cu. OHCl 1. 2. Сульфат бария 1. 3. Na. JO 1. 3. Тиосульфат натрия 1. 4. Ca(HSO 4)2 1. 4. Иодат натрия 1. 5. KBr. O 3 1. 5. Гидроксосульфат железа (III) 1. 6. Cr 2(SO 4)3 1. 6. Дихромат калия 1. 7. Al 2 O 3 1. 7. Гипоиодит натрия 1. 8. Na. H 2 As. O 3 1. 8. Гидроксид бария 1. 9. Na 2 O 2 1. 9. Нитрат алюминия 1. 10. Дигидрофосфат кальция 1. 10. Al. OHSO 4
№ п/п Дайте название № п/п соединению Напишите формулу соединения 1. 1. Ca 3(PO 4)2 1. 1. Гидросульфит натрия 1. 2. Cu. OHCl 1. 2. Сульфат бария 1. 3. Na. JO 1. 3. Тиосульфат натрия 1. 4. Ca(HSO 4)2 1. 4. Иодат натрия 1. 5. KBr. O 3 1. 5. Гидроксосульфат железа (III) 1. 6. Cr 2(SO 4)3 1. 6. Дихромат калия 1. 7. Al 2 O 3 1. 7. Гипоиодит натрия 1. 8. Na. H 2 As. O 3 1. 8. Гидроксид бария 1. 9. Na 2 O 2 1. 9. Нитрат алюминия 1. 10. Дигидрофосфат кальция 1. 10. Al. OHSO 4
 1. 11. (Ni. OH)2 SO 4 1. 11. Иодид аммония 1. 12. Pb. S 1. 12. Гидросульфат кальция 1. 13. NO 2 1. 13. Гидроксосульфат меди (II) 1. 14. Na. H 2 As. O 4 1. 14. Гидрид кальция 1. 15. Ag. CN 1. 15. Сульфат гидроксомеди (II) 1. 16. Cu. Cr. O 4 1. 16. Сульфит серебра 1. 17. (Cu. OH)2 CO 3 1. 17. Хромат серебра 1. 18. Ag. NCS 1. 18. Сульфид висмута (III) 1. 19. Pb(JO 3)2 1. 19. Гидроксид кальция 1. 20. KJO 4 1. 20. Сульфид серебра 1. 21. Cr. PO 4 1. 21. Иодид серебра 1. 22. KNO 2 1. 22. Перманганат серебра 1. 23. Fe(OH)2 Cl 1. 23. Тиоцианат меди 1. 24. Mg 3(As. O 4)2 1. 24. Бромид гидроксосвинца (II) 1. 25. Cu. NCS 1. 25. Тиосульфат серебра
1. 11. (Ni. OH)2 SO 4 1. 11. Иодид аммония 1. 12. Pb. S 1. 12. Гидросульфат кальция 1. 13. NO 2 1. 13. Гидроксосульфат меди (II) 1. 14. Na. H 2 As. O 4 1. 14. Гидрид кальция 1. 15. Ag. CN 1. 15. Сульфат гидроксомеди (II) 1. 16. Cu. Cr. O 4 1. 16. Сульфит серебра 1. 17. (Cu. OH)2 CO 3 1. 17. Хромат серебра 1. 18. Ag. NCS 1. 18. Сульфид висмута (III) 1. 19. Pb(JO 3)2 1. 19. Гидроксид кальция 1. 20. KJO 4 1. 20. Сульфид серебра 1. 21. Cr. PO 4 1. 21. Иодид серебра 1. 22. KNO 2 1. 22. Перманганат серебра 1. 23. Fe(OH)2 Cl 1. 23. Тиоцианат меди 1. 24. Mg 3(As. O 4)2 1. 24. Бромид гидроксосвинца (II) 1. 25. Cu. NCS 1. 25. Тиосульфат серебра

 Задачи 1. Определите какое количество вещества атомарной серы содержится в сере 176 г. Ответ: n=5, 5 моль 2. Вычислите сколько молей карбоната кальция заключается в 40 г карбоната кальция. Ответ: n=0, 4 моль 3. Определите массу 15 молей нитрата калия. Ответ: m = 1515 г. 4. Относительная атомная масса серебра равна 108. Определите массу одного атома серебра в граммах. Ответ: m = 1, 79 х10 -22 г. 5. Сколько молекул содержится в 6, 8 г сероводорода? Вычислите массу одной молекулы сероводорода. Ответ: N = 1, 21 х1023 г. ; m = 5, 64 х10 -23 г.
Задачи 1. Определите какое количество вещества атомарной серы содержится в сере 176 г. Ответ: n=5, 5 моль 2. Вычислите сколько молей карбоната кальция заключается в 40 г карбоната кальция. Ответ: n=0, 4 моль 3. Определите массу 15 молей нитрата калия. Ответ: m = 1515 г. 4. Относительная атомная масса серебра равна 108. Определите массу одного атома серебра в граммах. Ответ: m = 1, 79 х10 -22 г. 5. Сколько молекул содержится в 6, 8 г сероводорода? Вычислите массу одной молекулы сероводорода. Ответ: N = 1, 21 х1023 г. ; m = 5, 64 х10 -23 г.
 6. Определите массовую долю марганца в оксидах марганца (IV) и марганца (VII). Ответ: % (Mn. O 2)= 63, 23 %; % (Mn 2 O 7)= 49, 55 %. 7. Сколько граммов мышьяка можно получить из 200 г смеси, содержащей 40 % оксида мышьяка (III) и 60% оксида мышьяка (V)? Ответ: m = 138, 86 г. 8. Определите массу 5 л аммиака при н. у. Сколько молей газа заключено в этом объеме? Ответ: m = 3, 8 г. ; n = 0, 22 моль 9. Имеется 20 г аммиака. Определите объем газа при н. у. Ответ: V = 26, 34 л. 10. Определите молекулярную массу газа, если 9, 51 г его занимают объем при н. у. 3 л. Ответ: М = 71 г/моль.
6. Определите массовую долю марганца в оксидах марганца (IV) и марганца (VII). Ответ: % (Mn. O 2)= 63, 23 %; % (Mn 2 O 7)= 49, 55 %. 7. Сколько граммов мышьяка можно получить из 200 г смеси, содержащей 40 % оксида мышьяка (III) и 60% оксида мышьяка (V)? Ответ: m = 138, 86 г. 8. Определите массу 5 л аммиака при н. у. Сколько молей газа заключено в этом объеме? Ответ: m = 3, 8 г. ; n = 0, 22 моль 9. Имеется 20 г аммиака. Определите объем газа при н. у. Ответ: V = 26, 34 л. 10. Определите молекулярную массу газа, если 9, 51 г его занимают объем при н. у. 3 л. Ответ: М = 71 г/моль.



