Лекция 1(новая программа).ppt
- Количество слайдов: 44

ХИМИЯ 1

Лекция 1 Поверхностные явления. Адсорбция. Коллоидные ПАВ. Хроматография. Доцент кафедры ОБОХимии Анисимова Надежда Александровна 2

Исходный уровень: фаза – однородная по составу и одинаковая по физическим и химическим свойствам часть физико химической системы, отделенная от других ее частей поверхностями раздела; гомогенная система; гетерогенная система. 3

Поверхностные явления — это процессы, происходящие на границах раздела фаз, составляющих физико химические системы, и обусловленные особенностями состава и строения поверхностного слоя (адсорбция, смачивание, растекание, адгезия и др. ) Поверхность раздела фаз характеризуется определенным видом энергии — поверхностной энергией Гиббса Gs. Удельная поверхностная энергия называется поверхностным натяжением = Gs/S (энергия Гиббса, приходящаяся на единицу площади поверхностного слоя). Энергия поверхности Gs = S. Чем больше площадь поверхности раздела, тем больше в системе свободная поверхностная энергия. Площадь поверхности раздела при данной массе возрастает с уменьшением размера частей, на которые разделяется система (дисперсности). 4

Поверхностные явления сильнее всего проявляются в системах с очень большой поверхностью раздела фаз. К таким системам относятся поверхностные слои, пленки, нити, капилляры, мелкие частицы. Их совокупность вместе со средой, в которой они находятся, образует дисперсную коллоидную систему. Та часть системы, которая находится в измельченном состоянии, называется дисперсной фазой. Сплошная фаза, в которой распределена дисперсная фаза, называется дисперсионной средой. Большой запас энергии определяет характерную особенность дисперсных коллоидных систем — их неустойчивость. В живом организме имеет место большое количество поверхностей раздела. Это стенки сосудов, альвеол, поверхности клеток, клеточных ядер, форменных элементов крови, коллоидных частиц и, наконец, поверхности раздела между организмом и окружающей средой. 5
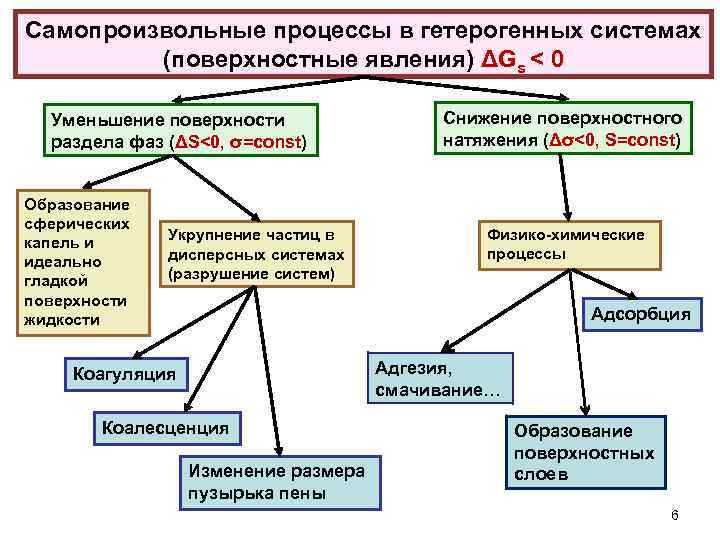
Самопроизвольные процессы в гетерогенных системах (поверхностные явления) ΔGs < 0 Уменьшение поверхности раздела фаз (ΔS<0, σ=const) Образование сферических капель и идеально гладкой поверхности жидкости Укрупнение частиц в дисперсных системах (разрушение систем) Снижение поверхностного натяжения (Δσ<0, S=const) Физико химические процессы Адсорбция Адгезия, смачивание… Коагуляция Коалесценция Изменение размера пузырька пены Образование поверхностных слоев 6
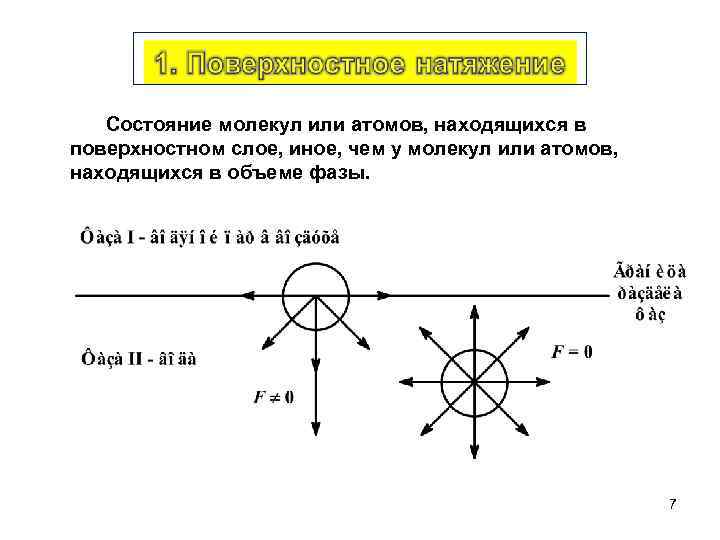
Состояние молекул или атомов, находящихся в поверхностном слое, иное, чем у молекул или атомов, находящихся в объеме фазы. 7

Поверхностное натяжение (σ) — избыток энергии частиц в поверхностном слое на единицу площади поверхности [Дж/м 2 = Н/м]. Поверхностное натяжение (σ) — это работа, которую требуется совершить для образования единицы поверхности. Силовое определение поверхностного натяжения: σ это сила, действующая на поверхности по касальной к ней и стремящаяся сократить поверхность тела [Н/м]. 8
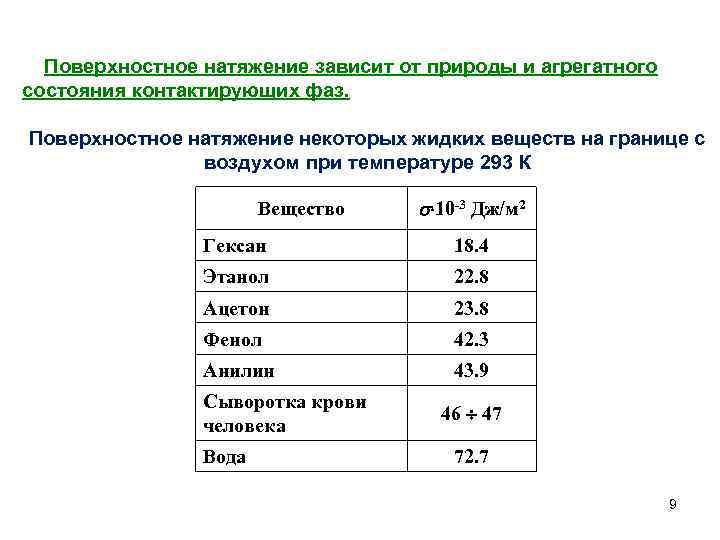
Поверхностное натяжение зависит от природы и агрегатного состояния контактирующих фаз. Поверхностное натяжение некоторых жидких веществ на границе с воздухом при температуре 293 К Вещество 10 -3 Дж/м 2 Гексан 18. 4 Этанол 22. 8 Ацетон 23. 8 Фенол 42. 3 Анилин 43. 9 Сыворотка крови человека Вода 46 47 72. 7 9

Зависимость поверхностного натяжения от температуры. При повышении температуры силы межмолекулярных взаимодействий ослабевают и поверхностное натяжение уменьшается. Зависимость поверхностного натяжения от введения различных веществ (на примере водных растворов ПАВ и ПИВ). ПАВ (поверхностно активные вещества) — вещества, понижающие поверхностное натяжение водных растворов. Это органические соединения, обладающие дифильной природой — их молекулы одновременно содержат неполярные гидрофобные участки (слабо взаимодействующие с молекулами воды) и полярные гидрофильные группы (сильно взаимодействующие с молекулами воды). Неионогенные ПАВ — спирты, альдегиды, кетоны, сложные эфиры. 10
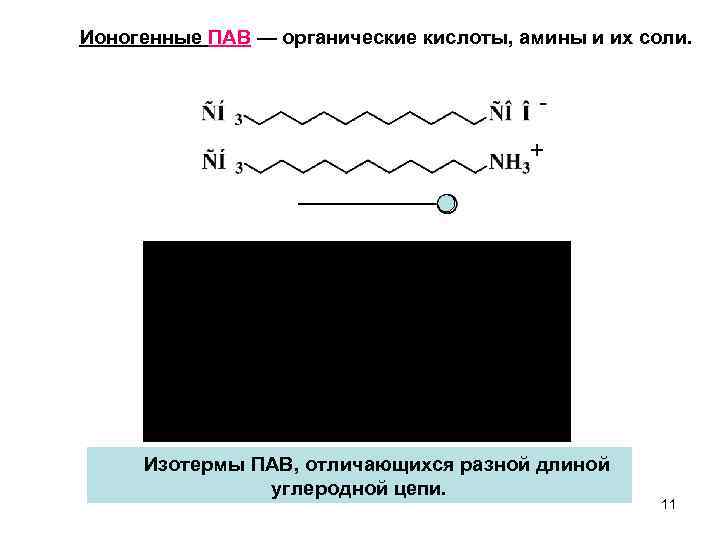
Ионогенные ПАВ — органические кислоты, амины и их соли. Изотермы ПАВ, отличающихся разной длиной углеродной цепи. 11

Молекулы ПАВ накапливаются на поверхности раздела фаз, понижая поверхностное натяжение. Образование "частокола Ленгмюра" из молекул ПАВ на границе раздела раствор воздух. ПИВ (поверхностно инактивные вещества) — вещества, повышающие поверхностное натяжение водных растворов (при больших концентрациях). Сильные неорганические электролиты — соли, кислоты, щелочи. Ионы ПИВ сильно взаимодействуют с молекулами воды и стремятся уйти с поверхности вглубь жидкости. Появление их на поверхности повышает поверхностное натяжение. 12
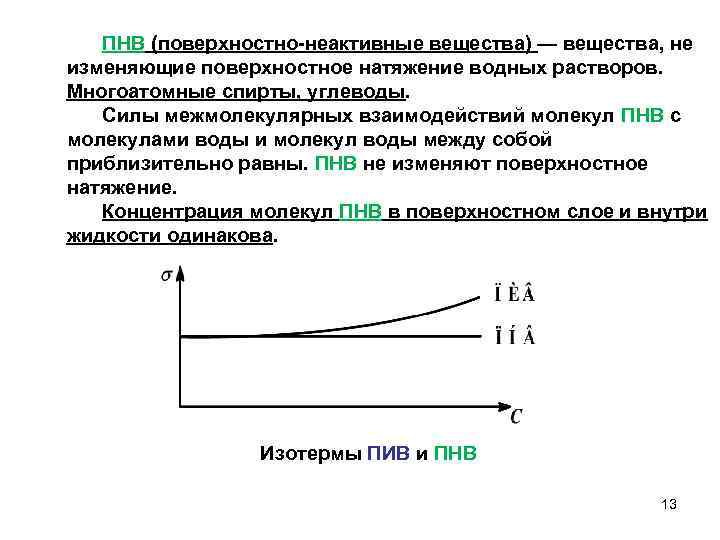
ПНВ (поверхностно неактивные вещества) — вещества, не изменяющие поверхностное натяжение водных растворов. Многоатомные спирты, углеводы. Силы межмолекулярных взаимодействий молекул ПНВ с молекулами воды и молекул воды между собой приблизительно равны. ПНВ не изменяют поверхностное натяжение. Концентрация молекул ПНВ в поверхностном слое и внутри жидкости одинакова. Изотермы ПИВ и ПНВ 13
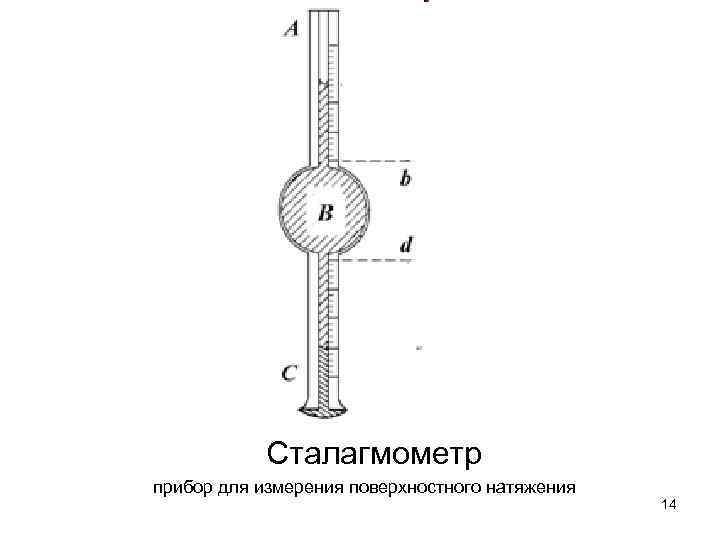
Сталагмометр прибор для измерения поверхностного натяжения 14

2. Адсорбция — процесс самопроизвольного перераспределения вещества между поверхностным слоем и объемом фазы. Адсорбент — фаза, на поверхности которой происходит адсорбция. Адсорбат или адсорбтив — вещество, которое адсорбируется на поверхности. Десорбция — процесс обратный адсорбции. Адсорбционное равновесие. Сорбция — поглощение твердым телом или жидкостью вещества из окружающей среды. Основные закономерности адсорбции Правило выравнивания полярностей ( П. А. Ребиндер ) Вещество может адсорбироваться на поверхности раздела фаз, если его присутствие в межфазном слое уравнивает разность полярностей этих фаз в зоне их контакта. 15
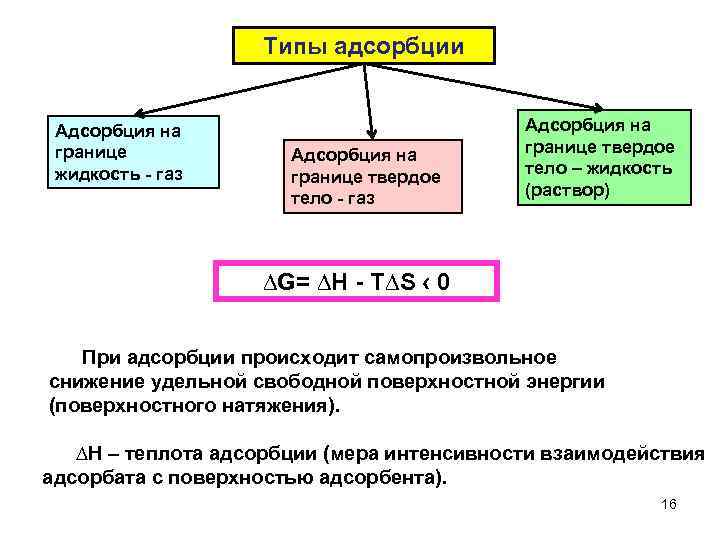
Типы адсорбции Адсорбция на границе жидкость газ Адсорбция на границе твердое тело – жидкость (раствор) ∆G= ∆Н Т∆S ‹ 0 При адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения). ∆Н – теплота адсорбции (мера интенсивности взаимодействия адсорбата с поверхностью адсорбента). 16

Количественные характеристики адсорбции Избыточная гиббсовская адсорбция (Г ) – избыток адсорбата в поверхностном слое по сравнению с его количеством в объеме фазы, отнесенный к единице площади поверхности (моль/м 2), характеризует адсорбцию на жидкой поверхности. Абсолютная адсорбция (ɑ) – количество адсорбата на единице массы адсорбента (моль/г), используется для характеристики адсорбции на твердой поверхности. 17

Адсорбция на границе жидкость (раствор) – газ (гиббсовская адсорбция) Фундаментальное уравнение адсорбции Гиббса. где с концентрация вещества в растворе, R универсальная газовая постоянная, T абсолютная температура. Размерность [ Г ] = [моль/ед. пл ди поверхности], например, [моль/м 2]. а) Если б) Если , то Г > 0 — вещество накапливается в поверхностном слое (ПАВ) , то Г < 0 — вещество уходит в объем раствора (ПИВ) в) Для ПНВ Г = 0. 18

Поверхностная активность (только для ПАВ) Характеризует способность ПАВ накапливаться в поверхностном слое, снижая поверхностное натяжение. Размерность [ g ] = [Дж ∙ моль– 1] = [Н∙м 2∙моль– 1]. 19
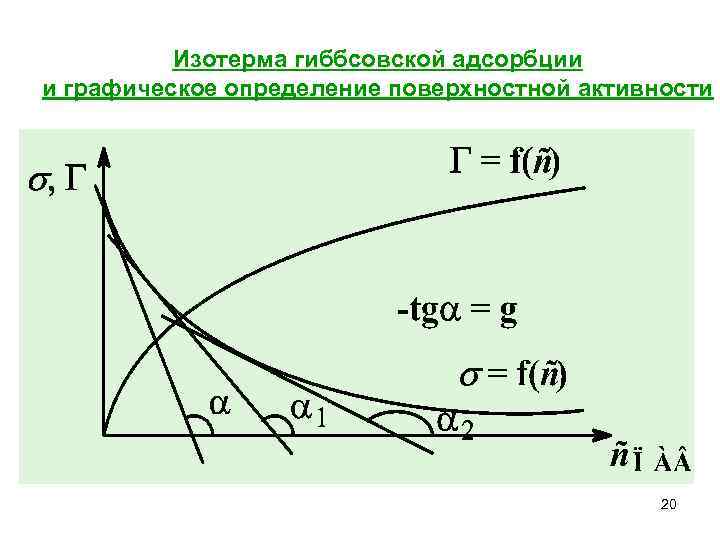
Изотерма гиббсовской адсорбции и графическое определение поверхностной активности 20
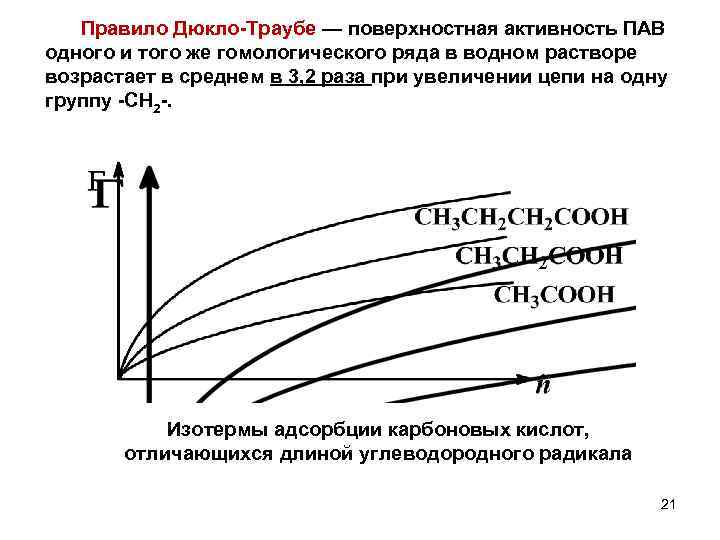
Правило Дюкло Траубе — поверхностная активность ПАВ одного и того же гомологического ряда в водном растворе возрастает в среднем в 3, 2 раза при увеличении цепи на одну группу СН 2. Изотермы адсорбции карбоновых кислот, отличающихся длиной углеводородного радикала 21

Адсорбция на твердом теле Физическая Химическая (хемосорбция) Взаимодействие адсорбента и адсорбата за счет сил Ван дер Ваальса и водородных связей (малоспецифична). Взаимодействие адсорбента и адсорбата за счет образования химических связей (строго специфична). Примеры: физическая адсорбция: адсорбция аммиака на угле; химическая адсорбция: адсорбция углекислого газа на извести. 22
![Типичная изотерма мономолекулярной адсорбции на твердой поверхности равн Размерность [ɑ ] = [моль/единица массы Типичная изотерма мономолекулярной адсорбции на твердой поверхности равн Размерность [ɑ ] = [моль/единица массы](https://present5.com/presentation/60238170_26550331/image-23.jpg)
Типичная изотерма мономолекулярной адсорбции на твердой поверхности равн Размерность [ɑ ] = [моль/единица массы адсорбента]. 23

Уравнение изотермы Ленгмюра где ɑ — величина предельной адсорбции, когда вся поверхность адсорбента заполнена адсорбатом, постоянна для всего гомологического ряда адсорбатов; к — постоянная для данного вещества, численно равная равновесной концентрации адсорбата при адсорбции, равной половине предельной; сравн ─ равновесная концентрация адсорбата в фазе над адсорбентом. 24

Для экспериментального определения величины адсорбции на поверхности твердого тела используется уравнение: где с0 — исходная концентрация вещества; сравн — равновесная концентрация, установившаяся после определенного по времени контакта адсорбента с раствором (газовой смесью); V — объем раствора (газовой смеси); m — масса адсорбента. Размерность [ɑ] = [моль/кг]. 25

Виды адсорбции на поверхности твердого тела, граничащего с жидкостью Молекулярная адсорбция — характерна для неэлектролитов. Ионная адсорбция — характерна для электролитов: – эквивалентная — оба иона адсорбируются в эквивалентных количествах (слабые электролиты); – обменная адсорбция — адсорбция одного из ионов электролита сопровождается одновременным вытеснением с адсорбента эквивалентного количества другого иона того же знака (сильные электролиты); – избирательная адсорбция — на адсорбенте адсорбируются преимущественно ионы одного типа (сильные электролиты). 26
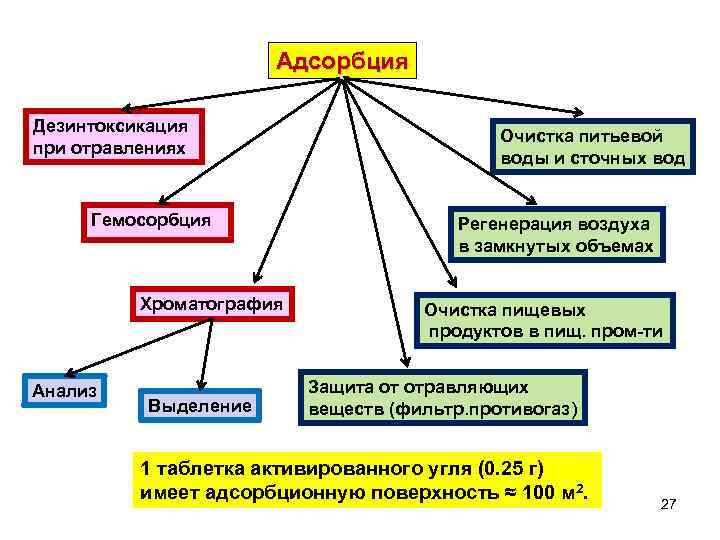
Адсорбция Дезинтоксикация при отравлениях Гемосорбция Хроматография Анализ Выделение Очистка питьевой воды и сточных вод Регенерация воздуха в замкнутых объемах Очистка пищевых продуктов в пищ. пром ти Защита от отравляющих веществ (фильтр. противогаз) 1 таблетка активированного угля (0. 25 г) имеет адсорбционную поверхность ≈ 100 м 2. 27
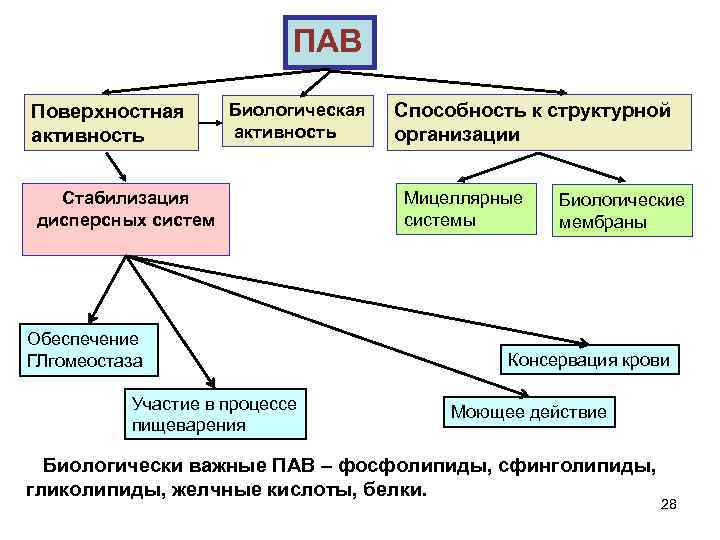
ПАВ Поверхностная активность Биологическая активность Стабилизация дисперсных систем Обеспечение ГЛгомеостаза Участие в процессе пищеварения Способность к структурной организации Мицеллярные системы Биологические мембраны Консервация крови Моющее действие Биологически важные ПАВ – фосфолипиды, сфинголипиды, гликолипиды, желчные кислоты, белки. 28

Коллоидные ПАВ — длинноцепочечные дифильные органические соединения с числом атомов углерода в радикале от 10 до 20. Мицеллообразование в растворах коллоидных ПАВ Растворимость коллоидных ПАВ невелика — 10 6 10 3 моль/л. В результате малой растворимости при повышении концентрации происходит ассоциация молекул ПАВ, при определенной концентрации переходящая в мицеллообразование. Концентрация раствора ПАВ, при которой начинается мицеллообразование, называется критической концентрацией мицеллобразования (ККМ). 29
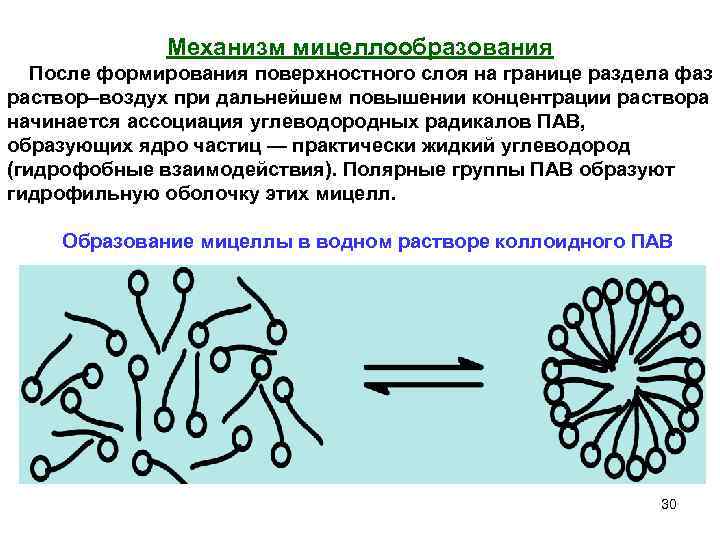
Механизм мицеллообразования После формирования поверхностного слоя на границе раздела фаз раствор–воздух при дальнейшем повышении концентрации раствора начинается ассоциация углеводородных радикалов ПАВ, образующих ядро частиц — практически жидкий углеводород (гидрофобные взаимодействия). Полярные группы ПАВ образуют гидрофильную оболочку этих мицелл. Образование мицеллы в водном растворе коллоидного ПАВ 30
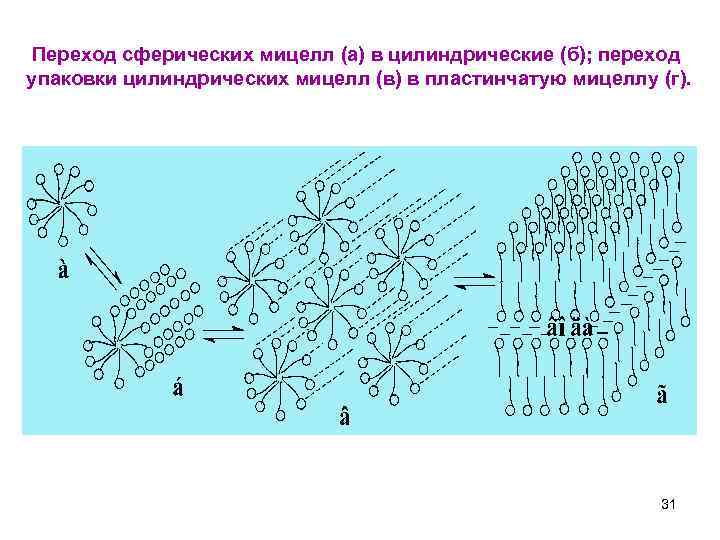
Переход сферических мицелл (а) в цилиндрические (б); переход упаковки цилиндрических мицелл (в) в пластинчатую мицеллу (г). 31
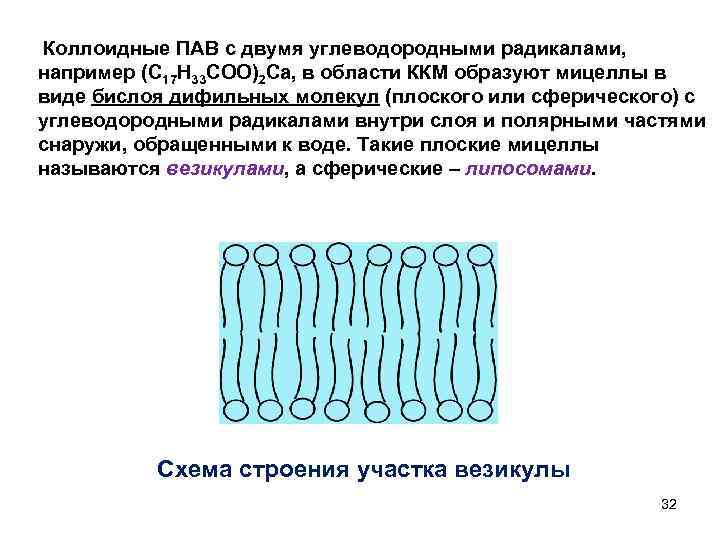
Коллоидные ПАВ с двумя углеводородными радикалами, например (С 17 Н 33 СОО)2 Са, в области ККМ образуют мицеллы в виде бислоя дифильных молекул (плоского или сферического) с углеводородными радикалами внутри слоя и полярными частями снаружи, обращенными к воде. Такие плоские мицеллы называются везикулами, а сферические – липосомами. Схема строения участка везикулы 32

Солюбилизация в растворах коллоидных ПАВ Солюбилизацией называется явление растворения веществ в мицеллах ПАВ. В водных мицеллярных растворах ПАВ солюбилизируются вещества, практически нерастворимые в воде, например, гептан, бензол, красители, жиры. Это обусловлено тем, что вводимые в раствор ПАВ вещества включаются в состав мицелл. Они растворяются в ядрах мицелл, обладающих свойствами неполярных жидкостей углеводородов. Вещество, растворяющееся в мицеллах — солюбилизат. Способ включения веществ в мицеллу зависит от природы солюбилизата. 33
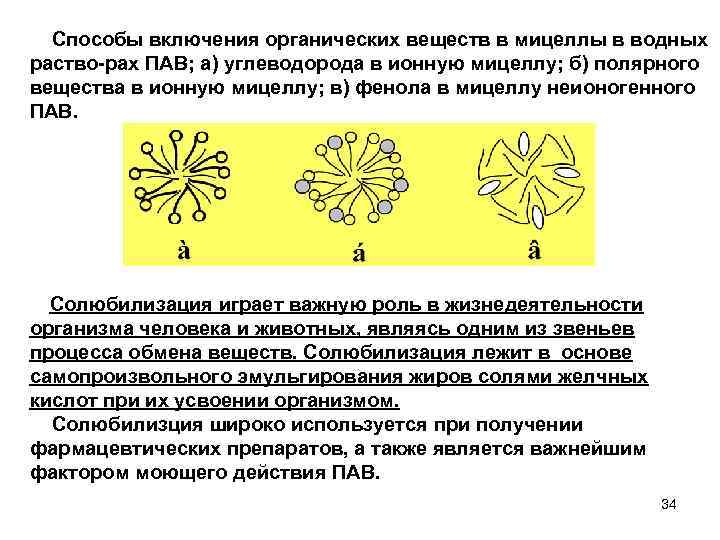
Способы включения органических веществ в мицеллы в водных раство рах ПАВ; а) углеводорода в ионную мицеллу; б) полярного вещества в ионную мицеллу; в) фенола в мицеллу неионогенного ПАВ. Солюбилизация играет важную роль в жизнедеятельности организма человека и животных, являясь одним из звеньев процесса обмена веществ. Солюбилизация лежит в основе самопроизвольного эмульгирования жиров солями желчных кислот при их усвоении организмом. Солюбилизция широко используется при получении фармацевтических препаратов, а также является важнейшим фактором моющего действия ПАВ. 34
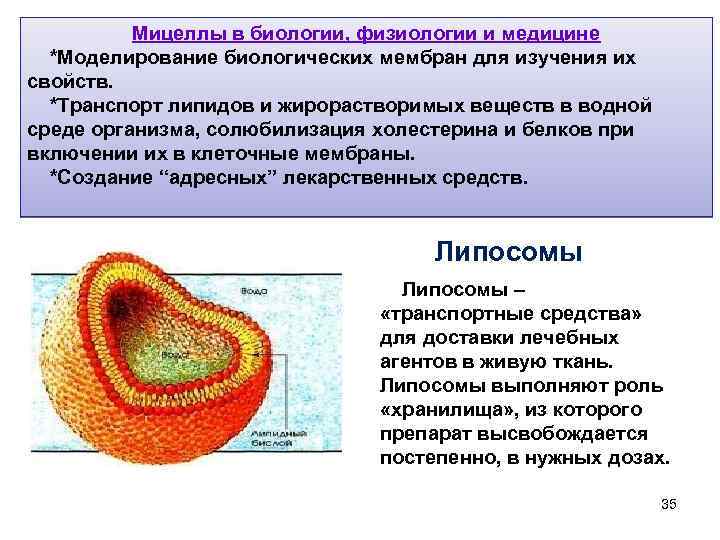
Мицеллы в биологии, физиологии и медицине *Моделирование биологических мембран для изучения их свойств. *Транспорт липидов и жирорастворимых веществ в водной среде организма, солюбилизация холестерина и белков при включении их в клеточные мембраны. *Создание “адресных” лекарственных средств. Липосомы – «транспортные средства» для доставки лечебных агентов в живую ткань. Липосомы выполняют роль «хранилища» , из которого препарат высвобождается постепенно, в нужных дозах. 35

Липосомы состоят из природных липидов, поэтому нетоксичны и биодеградируемы. 36
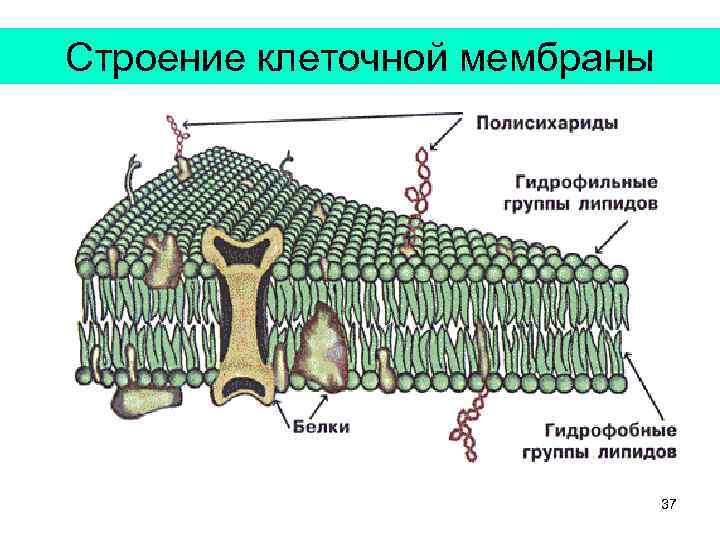
Строение клеточной мембраны 37

Хроматография — физико химический метод, применяемый для выделения, разделения и идентификации разнообразных веществ природного и синтетического происхождения и качественного и количественного анализа их смесей. Основной принцип хроматографии Разделение веществ основано на различии в скоростях движения концентрационных зон веществ, перемещающихся в потоке подвижной фазы (элюента) вдоль слоя неподвижной фазы (адсорбента). Классификация хроматографических методов а) По агрегатному состоянию подвижной фазы: газовая жидкостная 38
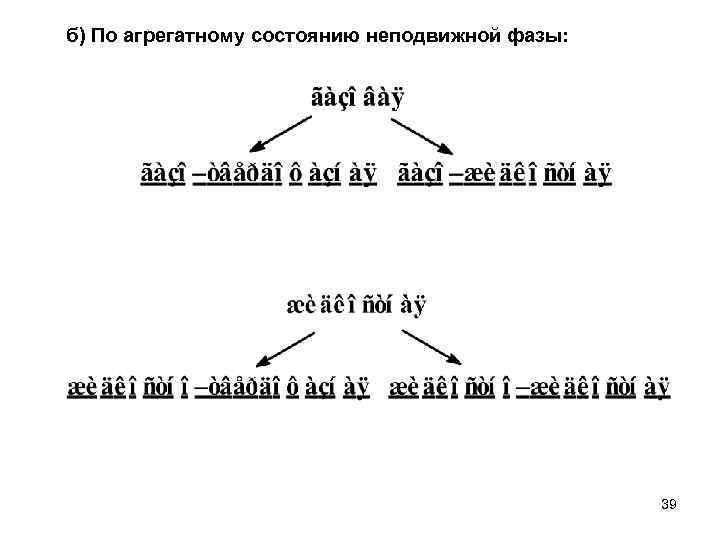
б) По агрегатному состоянию неподвижной фазы: 39

в) По доминирующему механизму взаимодействия разделяемых веществ с подвижной и неподвижной фазами: – адсорбционная — основана на различии в физической адсорбции веществ; – молекулярно ситовая — основана на различной проницаемости молекул веществ в неподвижную фазу; – ионообменная — основана на различной способности веществ к ионному обмену с адсорбентом; – биоспецифическая— основана на высокой специфичности связывания веществ с неподвижной фазой; – распределительная — основана на различии коэффициентов распределения веществ между подвижной и неподвижной жидкими фазами. г) По геометрии неподвижной фазы: колоночная (в том числе капиллярная) и плоскостная (бумажная и тонкослойная). 40
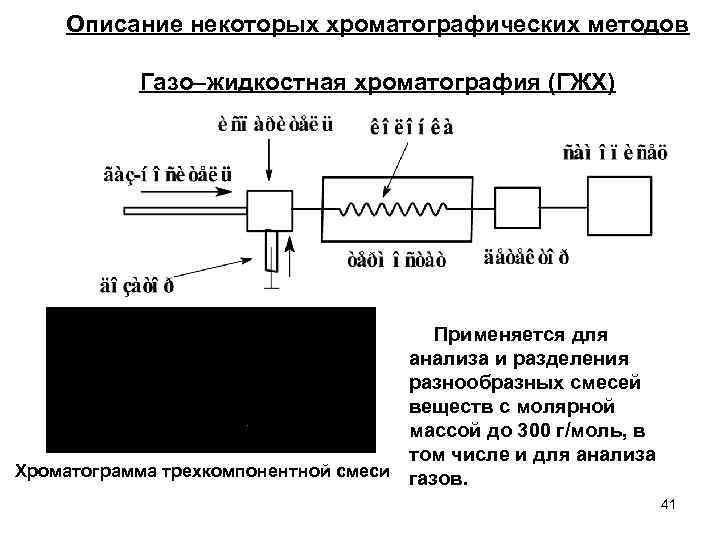
Описание некоторых хроматографических методов Газо–жидкостная хроматография (ГЖХ) Применяется для анализа и разделения разнообразных смесей веществ с молярной массой до 300 г/моль, в том числе и для анализа Хроматограмма трехкомпонентной смеси газов. 41
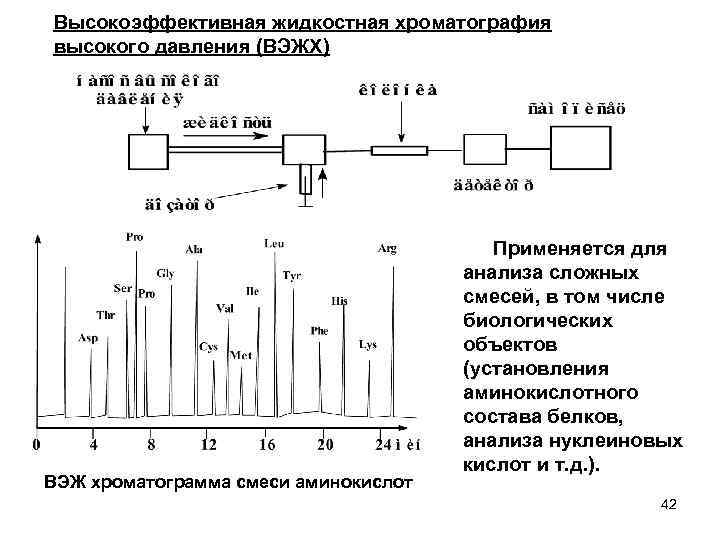
Высокоэффективная жидкостная хроматография высокого давления (ВЭЖХ) Применяется для ВЭЖ хроматограмма смеси аминокислот анализа сложных смесей, в том числе биологических объектов (установления аминокислотного состава белков, анализа нуклеиновых кислот и т. д. ). 42
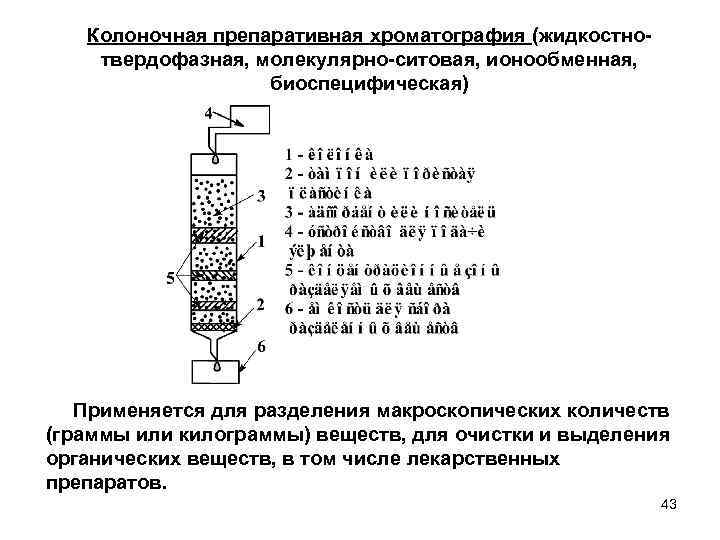
Колоночная препаративная хроматография (жидкостно твердофазная, молекулярно ситовая, ионообменная, биоспецифическая) Применяется для разделения макроскопических количеств (граммы или килограммы) веществ, для очистки и выделения органических веществ, в том числе лекарственных препаратов. 43
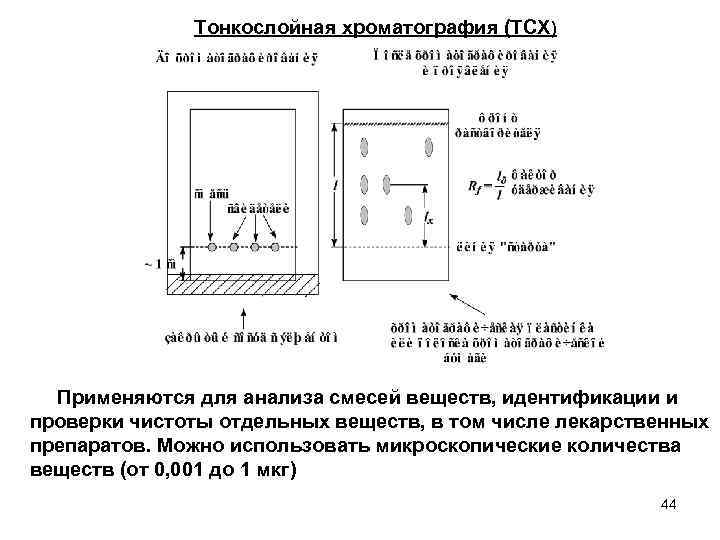
Тонкослойная хроматография (ТСХ) Применяются для анализа смесей веществ, идентификации и проверки чистоты отдельных веществ, в том числе лекарственных препаратов. Можно использовать микроскопические количества веществ (от 0, 001 до 1 мкг) 44
Лекция 1(новая программа).ppt