5.2 Электрохимия Потенциометрия.ppt
- Количество слайдов: 88
 ХИМИКО-АНАЛИТИЧЕСКИЙ КОНТРОЛЬ Электрохимические методы. Потенциометрические методы определения веществ Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 1
ХИМИКО-АНАЛИТИЧЕСКИЙ КОНТРОЛЬ Электрохимические методы. Потенциометрические методы определения веществ Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 1
 Потенциометрические методы анализа 1. 2. 3. 4. Сущность метода; Средства измерений; Прямая потенциометрия. Потенциометрическое титрование; Применение метода для контроля качества продукции. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 2
Потенциометрические методы анализа 1. 2. 3. 4. Сущность метода; Средства измерений; Прямая потенциометрия. Потенциометрическое титрование; Применение метода для контроля качества продукции. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 2
 Потенциометрические методы Сущность зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона. Измеряют напряжение на электродах ячейки в отсутствие тока. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 3
Потенциометрические методы Сущность зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона. Измеряют напряжение на электродах ячейки в отсутствие тока. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 3
 Потенциометрические методы Сущность метода Уравнение Нернста E = E° + (RT/z. F) ln (aox/ared) E = E° + (RT/z. F) ln (a. Ag+) Ag Ag + Анализируемый раствор Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 4
Потенциометрические методы Сущность метода Уравнение Нернста E = E° + (RT/z. F) ln (aox/ared) E = E° + (RT/z. F) ln (a. Ag+) Ag Ag + Анализируемый раствор Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 4
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 5
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 5
 Потенциометрические методы Измерительная система ─ гальванический элемент v v v Неполяризуемый индикаторный электрод; Электрод сравнения; Анализируемый раствор. Приборы для измерения потенциала v v v р. Н-метры; Иономеры; Вольтметры. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 6
Потенциометрические методы Измерительная система ─ гальванический элемент v v v Неполяризуемый индикаторный электрод; Электрод сравнения; Анализируемый раствор. Приборы для измерения потенциала v v v р. Н-метры; Иономеры; Вольтметры. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 6
 Потенциометрические методы Измерительная система ─ гальванический элемент v Непляризуемый индикаторный электрод; ü Ионоселективные (ИСЭ); Металлические инертные; Металлические активные (I рода). ü ü Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 7
Потенциометрические методы Измерительная система ─ гальванический элемент v Непляризуемый индикаторный электрод; ü Ионоселективные (ИСЭ); Металлические инертные; Металлические активные (I рода). ü ü Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 7
 Потенциометрические методы. ИСЭ Ионселективные электроды (ИСЭ) Отличительная особенность отсутствие окислительно-восстановительной реакции. Зависимость потенциала ИСЭ от состава раствора обусловлена равновесиями v ионного обмена; v комплексообразования; v распределения; v осадок-раствор. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 8
Потенциометрические методы. ИСЭ Ионселективные электроды (ИСЭ) Отличительная особенность отсутствие окислительно-восстановительной реакции. Зависимость потенциала ИСЭ от состава раствора обусловлена равновесиями v ионного обмена; v комплексообразования; v распределения; v осадок-раствор. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 8
 Потенциометрические методы. ИСЭ Ионселективные электроды (ИСЭ) Позволяют определять v v v активности; концентрации (градуировка по значениям концентраций поддерживая постоянную ионную силу раствора). отдельные химические формы вещества (например, отдельные степени окисления или свободные ионы металлов в присутствии их комплексов). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 9
Потенциометрические методы. ИСЭ Ионселективные электроды (ИСЭ) Позволяют определять v v v активности; концентрации (градуировка по значениям концентраций поддерживая постоянную ионную силу раствора). отдельные химические формы вещества (например, отдельные степени окисления или свободные ионы металлов в присутствии их комплексов). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 9
 Потенциометрические методы Сущность метода Уравнение Нернста E = E° + (RT/z. F) ln (aox/ared) E = E° + (RT/z. F) ln (a. Ag+) Ag Ag + Анализируемый раствор Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 10
Потенциометрические методы Сущность метода Уравнение Нернста E = E° + (RT/z. F) ln (aox/ared) E = E° + (RT/z. F) ln (a. Ag+) Ag Ag + Анализируемый раствор Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 10
 Потенциометрические методы. р. Н-селективный электрод Стеклянный электрод для измерения р. Н Структура v корпус; v буферный раствор; v внутренний электрод сравнения. Нижняя шарообразная часть корпуса Стеклянная мембрана из тонкого стекла. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 11
Потенциометрические методы. р. Н-селективный электрод Стеклянный электрод для измерения р. Н Структура v корпус; v буферный раствор; v внутренний электрод сравнения. Нижняя шарообразная часть корпуса Стеклянная мембрана из тонкого стекла. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 11
 Потенциометрические методы. р. Н-селективный электрод Стеклянный электрод для измерения р. Н При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на ионы H+. E = (RT/F) ln (a 2/a 1), a 1 активность ионов H+ в анализируемом растворе; a 2 активность ионов H+ во внутреннем растворе электрода. E = Econst – k · 59, 16 p. H (м. В) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 12
Потенциометрические методы. р. Н-селективный электрод Стеклянный электрод для измерения р. Н При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на ионы H+. E = (RT/F) ln (a 2/a 1), a 1 активность ионов H+ в анализируемом растворе; a 2 активность ионов H+ во внутреннем растворе электрода. E = Econst – k · 59, 16 p. H (м. В) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 12
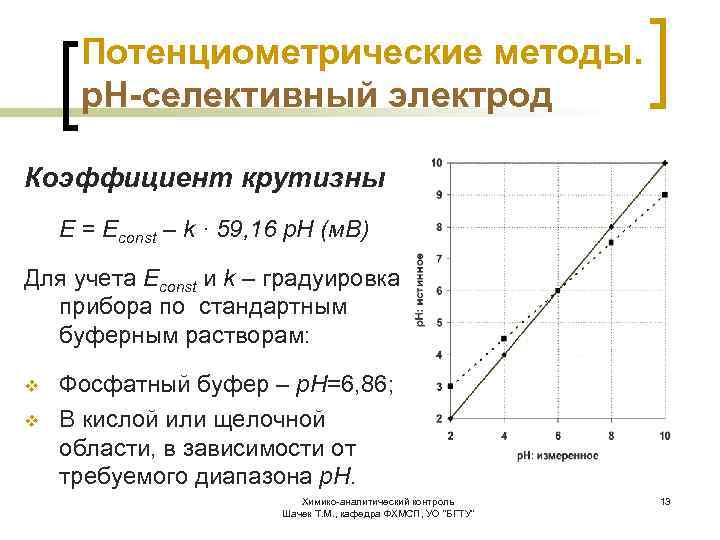 Потенциометрические методы. р. Н-селективный электрод Коэффициент крутизны E = Econst – k · 59, 16 p. H (м. В) Для учета Econst и k – градуировка прибора по стандартным буферным растворам: v v Фосфатный буфер – р. Н=6, 86; В кислой или щелочной области, в зависимости от требуемого диапазона р. Н. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 13
Потенциометрические методы. р. Н-селективный электрод Коэффициент крутизны E = Econst – k · 59, 16 p. H (м. В) Для учета Econst и k – градуировка прибора по стандартным буферным растворам: v v Фосфатный буфер – р. Н=6, 86; В кислой или щелочной области, в зависимости от требуемого диапазона р. Н. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 13
 Потенциометрические методы. р. Н-селективный электрод Стеклянный комбинированный электрод для измерения р. Н Датчики, объединяющие в одном корпусе измерительный электрод и электрод сравнения: ü ü стеклянный корпус, в нижней части которого расположена сферическая рабочая мембрана; внутри корпуса вмонтирован хлоридсеребряный электрод сравнения, состоящий из стеклянной трубки, заполненной раствором KCl (С=3 моль/дм 3). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 14
Потенциометрические методы. р. Н-селективный электрод Стеклянный комбинированный электрод для измерения р. Н Датчики, объединяющие в одном корпусе измерительный электрод и электрод сравнения: ü ü стеклянный корпус, в нижней части которого расположена сферическая рабочая мембрана; внутри корпуса вмонтирован хлоридсеребряный электрод сравнения, состоящий из стеклянной трубки, заполненной раствором KCl (С=3 моль/дм 3). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 14
 Потенциометрические методы. ИСЭ Критерии классификации ИСЭ тип определяемых частиц: ионы, молекулярные соединения; v тип используемой мембраны: жидкая или твердая, гомогенная или гетерогенная; v вид (структура) материала мембраны: стеклянная, кристаллическая, ионообменная; v размер и форма. v Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 15
Потенциометрические методы. ИСЭ Критерии классификации ИСЭ тип определяемых частиц: ионы, молекулярные соединения; v тип используемой мембраны: жидкая или твердая, гомогенная или гетерогенная; v вид (структура) материала мембраны: стеклянная, кристаллическая, ионообменная; v размер и форма. v Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 15
 Потенциометрические методы. ИСЭ Классификация ИСЭ по типу материала мембраны v v v со стеклообразными мембранами; с кристаллическими мембранами – монокристаллическими и поликристаллическими мембранами; с жидкими мембранами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 16
Потенциометрические методы. ИСЭ Классификация ИСЭ по типу материала мембраны v v v со стеклообразными мембранами; с кристаллическими мембранами – монокристаллическими и поликристаллическими мембранами; с жидкими мембранами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 16
 Потенциометрические методы. ИСЭ Электроды со стеклообразными мембранами v v v При р. Н>10 стеклянный электрод чувствителен к ионам щелочных металлов; Состав стекла селективного к ионам натрия: 21% Na 2 O и 18% Al 2 O 3; Серийно выпускаются стеклянные электроды селективные к ионам Li+, Na+, K+ и NH 4+. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 17
Потенциометрические методы. ИСЭ Электроды со стеклообразными мембранами v v v При р. Н>10 стеклянный электрод чувствителен к ионам щелочных металлов; Состав стекла селективного к ионам натрия: 21% Na 2 O и 18% Al 2 O 3; Серийно выпускаются стеклянные электроды селективные к ионам Li+, Na+, K+ и NH 4+. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 17
 Потенциометрические методы. ИСЭ Nа+ - селективный электрод Интервал линейности электродной характеристики ( 0, 5) 4, 0 р. Na Наклон электродной характеристики, м. В 56 ± 3 Потенциометрические коэффициенты селективности: КK+ 6 : 1 Отклонение значения измеряемого потенциала, р. Na ± 0, 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 18
Потенциометрические методы. ИСЭ Nа+ - селективный электрод Интервал линейности электродной характеристики ( 0, 5) 4, 0 р. Na Наклон электродной характеристики, м. В 56 ± 3 Потенциометрические коэффициенты селективности: КK+ 6 : 1 Отклонение значения измеряемого потенциала, р. Na ± 0, 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 18
 Потенциометрические методы. ИСЭ Электроды с кристаллическими мембранами v v v Мембраны из ионных кристаллов или их смесей заключаются в корпус из химически устойчивого материала – пластмассы или тефлона; Электрическая проводимость мембран обусловлена способностью иона решетки с наименьшим радиусом и зарядом перемещаться по вакансиям решетки; Высокая специфичность – размер, форма и распределение заряда вакансии решетки позволяют занять это место только определенному подвижному иону. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 19
Потенциометрические методы. ИСЭ Электроды с кристаллическими мембранами v v v Мембраны из ионных кристаллов или их смесей заключаются в корпус из химически устойчивого материала – пластмассы или тефлона; Электрическая проводимость мембран обусловлена способностью иона решетки с наименьшим радиусом и зарядом перемещаться по вакансиям решетки; Высокая специфичность – размер, форма и распределение заряда вакансии решетки позволяют занять это место только определенному подвижному иону. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 19
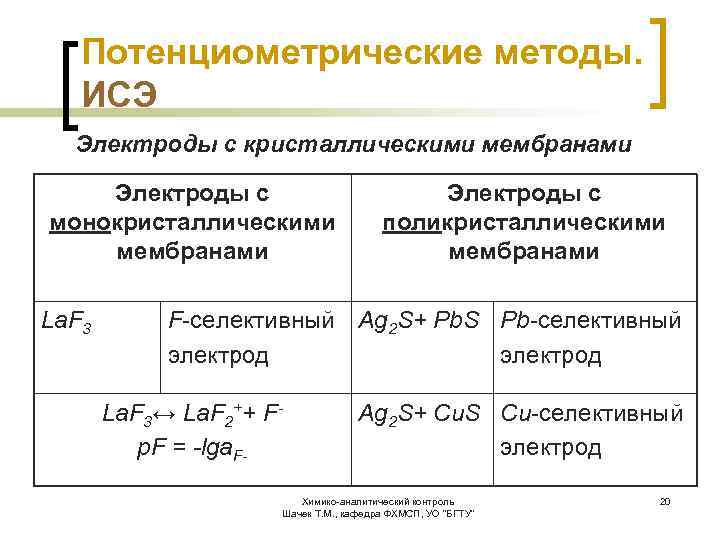 Потенциометрические методы. ИСЭ Электроды с кристаллическими мембранами Электроды с монокристаллическими мембранами La. F 3 F-селективный электрод La. F 3↔ La. F 2++ Fр. F = -lga. F- Электроды с поликристаллическими мембранами Ag 2 S+ Pb. S Pb-селективный электрод Ag 2 S+ Cu. S Cu-селективный электрод Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 20
Потенциометрические методы. ИСЭ Электроды с кристаллическими мембранами Электроды с монокристаллическими мембранами La. F 3 F-селективный электрод La. F 3↔ La. F 2++ Fр. F = -lga. F- Электроды с поликристаллическими мембранами Ag 2 S+ Pb. S Pb-селективный электрод Ag 2 S+ Cu. S Cu-селективный электрод Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 20
 Потенциометрические методы. ИСЭ Электроды с жидкими мембранами v Основа мембраны – несмешивающаяся с водой жидкость; v Основное вещество мембраны для определения ионов металла (М 2+, М+) – жидкий ионообменник или ионофор (I-). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 21
Потенциометрические методы. ИСЭ Электроды с жидкими мембранами v Основа мембраны – несмешивающаяся с водой жидкость; v Основное вещество мембраны для определения ионов металла (М 2+, М+) – жидкий ионообменник или ионофор (I-). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 21
 Потенциометрические методы. ИСЭ Электроды с жидкими мембранами Ca – селективный электрод на основе алифатических диэфиров фосфорной кислоты v v Использование полярных растворителей – диоктилфенилфосфонат – электрод селективен к ионам Са 2+; Использование растворителя – деканол – электрод селективен ко всем ионам щелочноземельных металлов – определение жесткости воды. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 22
Потенциометрические методы. ИСЭ Электроды с жидкими мембранами Ca – селективный электрод на основе алифатических диэфиров фосфорной кислоты v v Использование полярных растворителей – диоктилфенилфосфонат – электрод селективен к ионам Са 2+; Использование растворителя – деканол – электрод селективен ко всем ионам щелочноземельных металлов – определение жесткости воды. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 22
 Потенциометрические методы. ИСЭ Электроды с жидкими мембранами v Разработана техника иммобилизации ионофоров в полимерной матрице, в частности в ПВХ; v Ионофоры для ИСЭ с мембранами из ПВХ – тысячи различных веществ. v Большинство синтезировано и запатентовано проф. Симоном из Высшей технической школы (ЕТН, Цюрих). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 23
Потенциометрические методы. ИСЭ Электроды с жидкими мембранами v Разработана техника иммобилизации ионофоров в полимерной матрице, в частности в ПВХ; v Ионофоры для ИСЭ с мембранами из ПВХ – тысячи различных веществ. v Большинство синтезировано и запатентовано проф. Симоном из Высшей технической школы (ЕТН, Цюрих). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 23
 Потенциометрические методы. ИСЭ Смешивание Ионофор + измельченный ПВХ+ пластификатор Растворение в полярном растворителе Выливают раствор тонким слоем внутрь кольца Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 24
Потенциометрические методы. ИСЭ Смешивание Ионофор + измельченный ПВХ+ пластификатор Растворение в полярном растворителе Выливают раствор тонким слоем внутрь кольца Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 24
 Потенциометрические методы. ИСЭ Электроды с жидкими мембранами К+ селективный электрод на основе валиномицина Валиномицин удерживает ионы К за счет иондипольных взаимодействий с атомами кислорода. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 25
Потенциометрические методы. ИСЭ Электроды с жидкими мембранами К+ селективный электрод на основе валиномицина Валиномицин удерживает ионы К за счет иондипольных взаимодействий с атомами кислорода. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 25
 Потенциометрические методы. ИСЭ К+ - селективный электрод Интервал линейности электродной характеристики Наклон электродной характеристики, м. В Потенциометрические коэффициенты селективности: КK+, Na+ КK+, NН 4+ 10 -1 5· 10 -5 [56+0, 198(t-20)] ± 3 не более 2 · 10 -3 не более 3 · 10 -2 Стандартное среднеквадратичное отклонение значения измеряемого потенциала, м. В Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" ± 2 26
Потенциометрические методы. ИСЭ К+ - селективный электрод Интервал линейности электродной характеристики Наклон электродной характеристики, м. В Потенциометрические коэффициенты селективности: КK+, Na+ КK+, NН 4+ 10 -1 5· 10 -5 [56+0, 198(t-20)] ± 3 не более 2 · 10 -3 не более 3 · 10 -2 Стандартное среднеквадратичное отклонение значения измеряемого потенциала, м. В Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" ± 2 26
 Потенциометрические методы. ИСЭ Электроды с жидкими мембранами Основа анионселективных жидких мембран – положительно заряженные жидкие ионообменники. Мембрана NO 3 - – селективного электрода – нитробензольный раствор катионного комплекса Fe(II) с 1, 10 -фенантролином [Fe(Phen 3)]2+. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 27
Потенциометрические методы. ИСЭ Электроды с жидкими мембранами Основа анионселективных жидких мембран – положительно заряженные жидкие ионообменники. Мембрана NO 3 - – селективного электрода – нитробензольный раствор катионного комплекса Fe(II) с 1, 10 -фенантролином [Fe(Phen 3)]2+. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 27
 Потенциометрические методы. ИСЭ NO 3 - селективный электрод Интервал линейности электродной характеристики 0, 35 4, 7 р. NО 3 Наклон электродной характеристики, м. В Потенциометрические коэффициенты селективности: К Cl. КF- 53 ± 3 не более 1· 10 -2 не более 1 · 10 -3 Отклонение значения измеряемого потенциала, м. В Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" ± 12 28
Потенциометрические методы. ИСЭ NO 3 - селективный электрод Интервал линейности электродной характеристики 0, 35 4, 7 р. NО 3 Наклон электродной характеристики, м. В Потенциометрические коэффициенты селективности: К Cl. КF- 53 ± 3 не более 1· 10 -2 не более 1 · 10 -3 Отклонение значения измеряемого потенциала, м. В Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" ± 12 28
 Потенциометрические методы. Серийно выпускаемые ИСЭ Определяемый ион Тип мембраны Рабочий диапазон, М Коэффициенты селективности Сl- твердая 5· 10 -5 - 100 20(l-), 1, 2 (Br-), 400 (СN-) Br- твердая 5· 10 -6 – 100 20(l-), 6· 10 -3 (Сl-), 25 (СN-) l- твердая 5· 10 -8 – 101 6, 5· 10 -5(Br-), 6· 10 -6 (Сl-), 5, 5· 102(СN-, S 2 -) NO 3 - жидкая 7· 10 -6 – 100 1· 10 -7(CIO 4 -), 5· 10 -6 (l-), 5· 10 -5(Сl. O 3 -), 2· 10 -2 (CO 32 -), 3· 10 -2 (Cl-) Ca 2+ жидкая 5· 10 -7 – 100 6· 10 -3(Sr 2+), 4· 10 -2 (Сu 2+), 5· 10 -2(Ni 2+) Cu 2+ твердая 10 -8 – 10 -1 7· 10 -3(Pb 2+), 3· 10 -3 (Сd 2+), Ca 2++Mg 2+ (жесткость воды) жидкая 6· 10 -6 - 10 -3 1· 10 -4(Ni 2+), 4· 10 -4(Sr 2+), 3· 10 -2 (Na+), 0, 1(K+) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 29
Потенциометрические методы. Серийно выпускаемые ИСЭ Определяемый ион Тип мембраны Рабочий диапазон, М Коэффициенты селективности Сl- твердая 5· 10 -5 - 100 20(l-), 1, 2 (Br-), 400 (СN-) Br- твердая 5· 10 -6 – 100 20(l-), 6· 10 -3 (Сl-), 25 (СN-) l- твердая 5· 10 -8 – 101 6, 5· 10 -5(Br-), 6· 10 -6 (Сl-), 5, 5· 102(СN-, S 2 -) NO 3 - жидкая 7· 10 -6 – 100 1· 10 -7(CIO 4 -), 5· 10 -6 (l-), 5· 10 -5(Сl. O 3 -), 2· 10 -2 (CO 32 -), 3· 10 -2 (Cl-) Ca 2+ жидкая 5· 10 -7 – 100 6· 10 -3(Sr 2+), 4· 10 -2 (Сu 2+), 5· 10 -2(Ni 2+) Cu 2+ твердая 10 -8 – 10 -1 7· 10 -3(Pb 2+), 3· 10 -3 (Сd 2+), Ca 2++Mg 2+ (жесткость воды) жидкая 6· 10 -6 - 10 -3 1· 10 -4(Ni 2+), 4· 10 -4(Sr 2+), 3· 10 -2 (Na+), 0, 1(K+) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 29
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v v v Электродная функция; Крутизна электродной функции; Селективность; Предел обнаружения; Рабочая область р. Н; Временя отклика. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 30
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v v v Электродная функция; Крутизна электродной функции; Селективность; Предел обнаружения; Рабочая область р. Н; Временя отклика. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 30
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Электродная функция интервал активностей (концентраций), где зависимость потенциала от р. А линейна и имеет угловой коэффициент 59, 16/z. ; Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 31
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Электродная функция интервал активностей (концентраций), где зависимость потенциала от р. А линейна и имеет угловой коэффициент 59, 16/z. ; Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 31
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) параметр, выражающий связь между величинами ЭДС и логарифма концентрации (активности) определяемого вещества Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 32
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) параметр, выражающий связь между величинами ЭДС и логарифма концентрации (активности) определяемого вещества Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 32
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) ü угловой коэффициент наклона зависит от температуры; при 25 °С и изменении р. С на один порядок равен 59, 16 м. В для однозарядных ионов и 29, 58 м. В для двухзарядных ионов; Перед проведением анализа обязателен контроль S. ü ü Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 33
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) ü угловой коэффициент наклона зависит от температуры; при 25 °С и изменении р. С на один порядок равен 59, 16 м. В для однозарядных ионов и 29, 58 м. В для двухзарядных ионов; Перед проведением анализа обязателен контроль S. ü ü Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 33
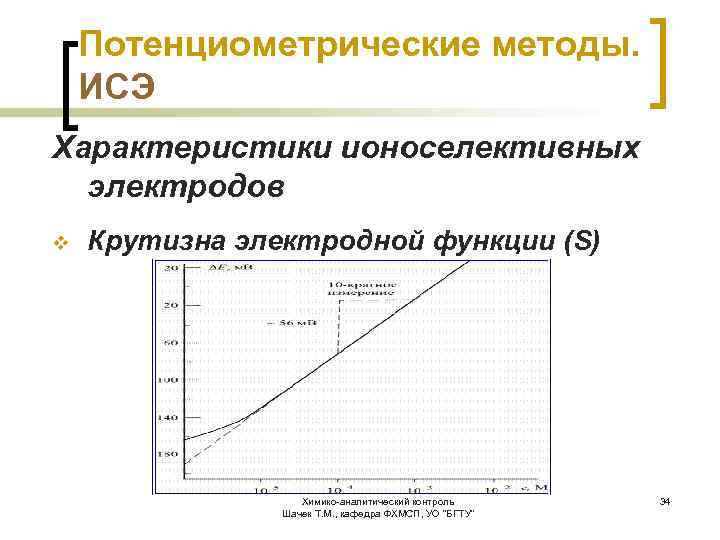 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 34
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Крутизна электродной функции (S) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 34
 Потенциометрические методы. ИСЭ Селективность ИСЭ Количественно характеризуется с использованием уравнения Никольского: E = E‘ + RT/zi. F·ln [ai + K· ajzi/zj] ai – активность определяемого иона с зарядом zi; aj – активность постороннего иона с зарядом zj; K – потенциометрический коэффициент селективности. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 35
Потенциометрические методы. ИСЭ Селективность ИСЭ Количественно характеризуется с использованием уравнения Никольского: E = E‘ + RT/zi. F·ln [ai + K· ajzi/zj] ai – активность определяемого иона с зарядом zi; aj – активность постороннего иона с зарядом zj; K – потенциометрический коэффициент селективности. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 35
 Потенциометрические методы. ИСЭ Селективность ИСЭ K – потенциометрический коэффициент селективности показывает при каком соотношении концентраций определяемого и постороннего иона последний начинает оказывать мешающее влияние. v 0
Потенциометрические методы. ИСЭ Селективность ИСЭ K – потенциометрический коэффициент селективности показывает при каком соотношении концентраций определяемого и постороннего иона последний начинает оказывать мешающее влияние. v 0
 Потенциометрические методы. Серийно выпускаемые ИСЭ Определяемый ион Тип мембраны Рабочий диапазон, М Коэффициенты селективности Сl- твердая 5· 10 -5 - 100 20(l-), 1, 2 (Br-), 400 (СN-) Br- твердая 5· 10 -6 – 100 20(l-), 6· 10 -3 (Сl-), 25 (СN-) l- твердая 5· 10 -8 – 101 6, 5· 10 -5(Br-), 6· 10 -6 (Сl-), 5, 5· 102(СN-, S 2 -) NO 3 - жидкая 7· 10 -6 – 100 1· 10 -7(CIO 4 -), 5· 10 -6 (l-), 5· 10 -5(Сl. O 3 -), 2· 10 -2 (CO 32 -), 3· 10 -2 (Cl-) Ca 2+ жидкая 5· 10 -7 – 100 6· 10 -3(Sr 2+), 4· 10 -2 (Сu 2+), 5· 10 -2(Ni 2+) Cu 2+ твердая 10 -8 – 10 -1 7· 10 -3(Pb 2+), 3· 10 -3 (Сd 2+), Ca 2++Mg 2+ (жесткость воды) жидкая 6· 10 -6 - 10 -3 1· 10 -4(Ni 2+), 4· 10 -4(Sr 2+), 3· 10 -2 (Na+), 0, 1(K+) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 37
Потенциометрические методы. Серийно выпускаемые ИСЭ Определяемый ион Тип мембраны Рабочий диапазон, М Коэффициенты селективности Сl- твердая 5· 10 -5 - 100 20(l-), 1, 2 (Br-), 400 (СN-) Br- твердая 5· 10 -6 – 100 20(l-), 6· 10 -3 (Сl-), 25 (СN-) l- твердая 5· 10 -8 – 101 6, 5· 10 -5(Br-), 6· 10 -6 (Сl-), 5, 5· 102(СN-, S 2 -) NO 3 - жидкая 7· 10 -6 – 100 1· 10 -7(CIO 4 -), 5· 10 -6 (l-), 5· 10 -5(Сl. O 3 -), 2· 10 -2 (CO 32 -), 3· 10 -2 (Cl-) Ca 2+ жидкая 5· 10 -7 – 100 6· 10 -3(Sr 2+), 4· 10 -2 (Сu 2+), 5· 10 -2(Ni 2+) Cu 2+ твердая 10 -8 – 10 -1 7· 10 -3(Pb 2+), 3· 10 -3 (Сd 2+), Ca 2++Mg 2+ (жесткость воды) жидкая 6· 10 -6 - 10 -3 1· 10 -4(Ni 2+), 4· 10 -4(Sr 2+), 3· 10 -2 (Na+), 0, 1(K+) Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 37
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v v Предел обнаружения наименьшая концентрация иона, которую можно определить данным методом Рабочий диапазон – от практически насыщенных растворов до 10 -7– 10 -8 М (в присутствии подходящих катионных или анионных буферов). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 38
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v v Предел обнаружения наименьшая концентрация иона, которую можно определить данным методом Рабочий диапазон – от практически насыщенных растворов до 10 -7– 10 -8 М (в присутствии подходящих катионных или анионных буферов). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 38
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 39
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 39
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v ü ü Рабочая область р. Н мера активности ионов Н+ и косвенно ОН–-ионов в растворе; Ионы Н+ или ОН– могут взаимодействовать с определяемыми ионами, уменьшая их концентрацию. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 40
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v ü ü Рабочая область р. Н мера активности ионов Н+ и косвенно ОН–-ионов в растворе; Ионы Н+ или ОН– могут взаимодействовать с определяемыми ионами, уменьшая их концентрацию. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 40
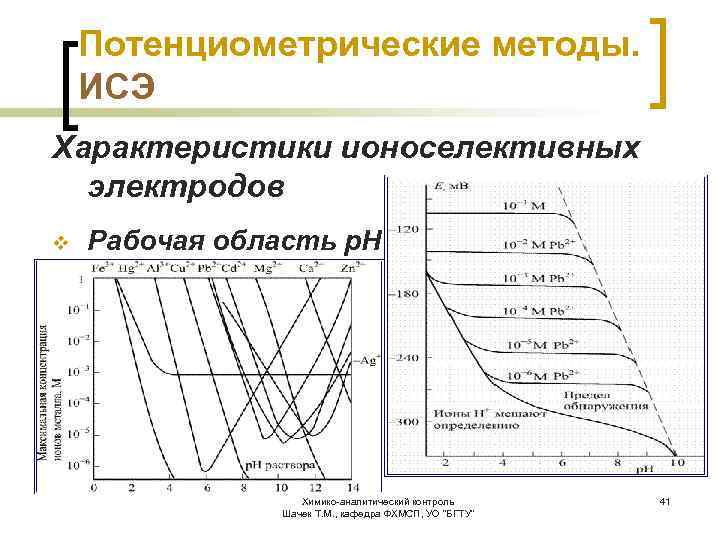 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Рабочая область р. Н Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 41
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Рабочая область р. Н Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 41
 Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Время отклика – время установления постоянного значения потенциала Для сравнения времени отклика для различных сенсоров используется величина t » t 63 или кратные величины 3 t » t 95 и 5 t » t 99 (время, за которое потенциал сенсора достигает 63, 95 и 99% от величины равновесного значения потенциала соответственно). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 42
Потенциометрические методы. ИСЭ Характеристики ионоселективных электродов v Время отклика – время установления постоянного значения потенциала Для сравнения времени отклика для различных сенсоров используется величина t » t 63 или кратные величины 3 t » t 95 и 5 t » t 99 (время, за которое потенциал сенсора достигает 63, 95 и 99% от величины равновесного значения потенциала соответственно). Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 42
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений Средства измерений (р. Н-метры, иономеры, электроды) должны быть подготовлены к выполнению измерений в соответствии с паспортами или инструкциями по эксплуатации. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 43
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений Средства измерений (р. Н-метры, иономеры, электроды) должны быть подготовлены к выполнению измерений в соответствии с паспортами или инструкциями по эксплуатации. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 43
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 44
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 44
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; ü Разбавление; ü Концентрирование; ü Озоление пробы и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 45
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; ü Разбавление; ü Концентрирование; ü Озоление пробы и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 45
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; Состав анализируемого раствора: Проба (экстракт, зола, фильтрат, вытяжка и др. ) + фоновый электролит. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 46
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; Состав анализируемого раствора: Проба (экстракт, зола, фильтрат, вытяжка и др. ) + фоновый электролит. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 46
 Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 47
Потенциометрические методы Процесс потенциометрического анализа включает этапы: v подготовка средств измерений; v подготовка пробы; v выполнение измерений; v обработка и расчет результатов анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 47
 Потенциометрические методы Классификация v v Прямая потенциометрия (р. Н-метрия, ионометрия); Потенциометрическое титрование. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 48
Потенциометрические методы Классификация v v Прямая потенциометрия (р. Н-метрия, ионометрия); Потенциометрическое титрование. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 48
 Потенциометрические методы. Ионометрия р. Н-метрия частный случай ионометрии. v v v Градуировка р. Н-метра по буферным растворам; Подготовка пробы; Измерение р. Н анализируемой пробы. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 49
Потенциометрические методы. Ионометрия р. Н-метрия частный случай ионометрии. v v v Градуировка р. Н-метра по буферным растворам; Подготовка пробы; Измерение р. Н анализируемой пробы. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 49
 Потенциометрические методы. Ионометрия р. Н-метрия частный случай ионометрии. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 50
Потенциометрические методы. Ионометрия р. Н-метрия частный случай ионометрии. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 50
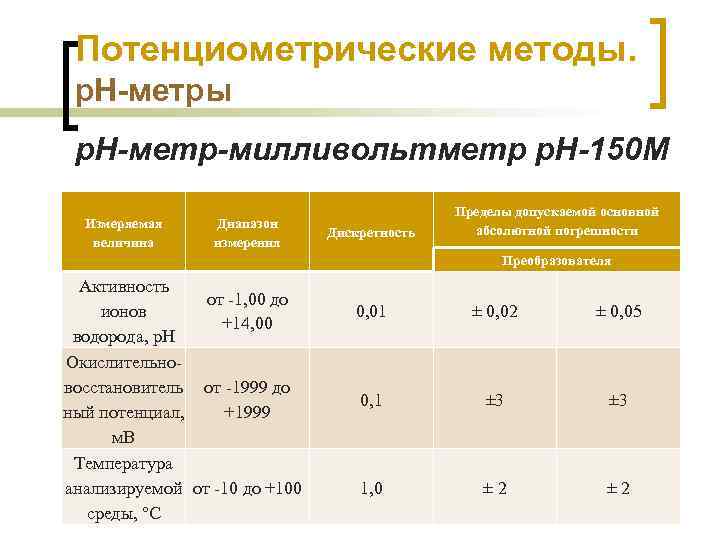
 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 51
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 51
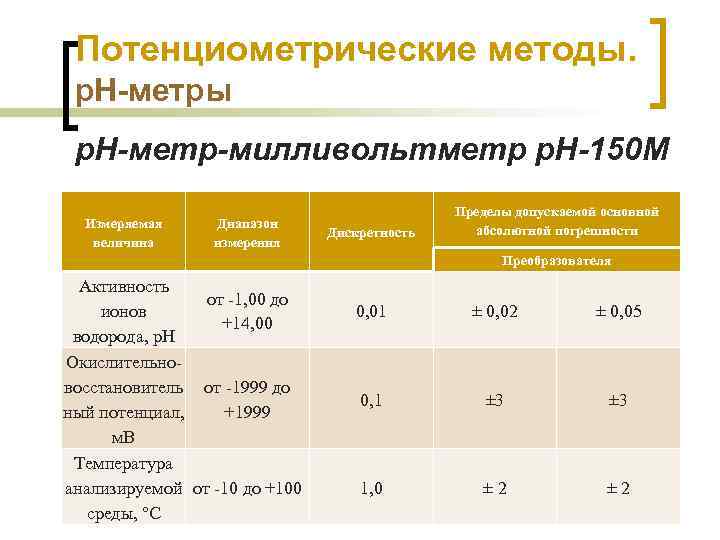 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 52
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 52
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 53
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 53
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 54
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 54
 Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 55
Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 55
 Потенциометрические методы. р. Н-метрия. Применение Определение активной кислотности v воды (СТБ ISO 10523); v молока (ГОСТ 26781); v маргаринов и спредов (СТБ 1889); v консервов и продуктов из рыбы (ГОСТ 28972) и других продовольственных товаров. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 56
Потенциометрические методы. р. Н-метрия. Применение Определение активной кислотности v воды (СТБ ISO 10523); v молока (ГОСТ 26781); v маргаринов и спредов (СТБ 1889); v консервов и продуктов из рыбы (ГОСТ 28972) и других продовольственных товаров. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 56
 Потенциометрические методы. р. Н-метрия. Применение Определение активной кислотности органических удобрений (ГОСТ 27979); v кормов (ГОСТ 26180); v косметических изделий (ГОСТ 29188. 2); v водных вытяжек почв (ГОСТ 26423); v целлюлозы, бумаги и картона (ГОСТ 12523) и других промышленных товаров. v Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 57
Потенциометрические методы. р. Н-метрия. Применение Определение активной кислотности органических удобрений (ГОСТ 27979); v кормов (ГОСТ 26180); v косметических изделий (ГОСТ 29188. 2); v водных вытяжек почв (ГОСТ 26423); v целлюлозы, бумаги и картона (ГОСТ 12523) и других промышленных товаров. v Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 57
 Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Методы определения концентрации v v Метод градуировочного графика; Метод стандартных добавок. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 58
Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Методы определения концентрации v v Метод градуировочного графика; Метод стандартных добавок. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 58
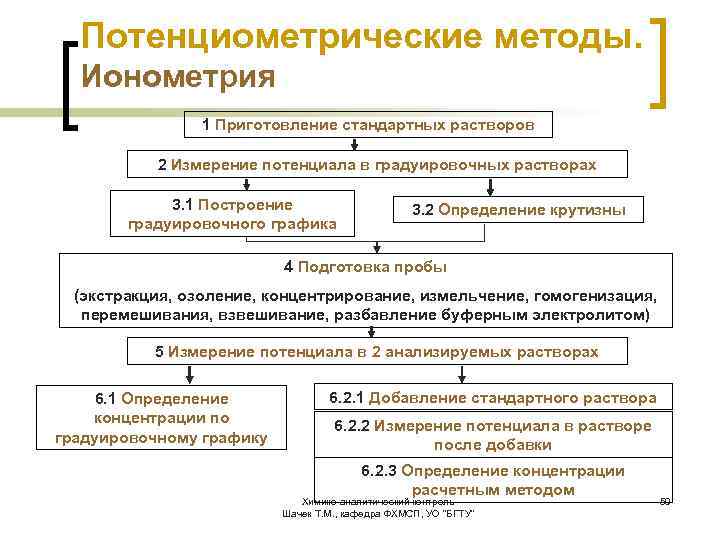 Потенциометрические методы. Ионометрия 1 Приготовление стандартных растворов 2 Измерение потенциала в градуировочных растворах 3. 1 Построение градуировочного графика 3. 2 Определение крутизны 4 Подготовка пробы (экстракция, озоление, концентрирование, измельчение, гомогенизация, перемешивания, взвешивание, разбавление буферным электролитом) 5 Измерение потенциала в 2 анализируемых растворах 6. 1 Определение концентрации по градуировочному графику 6. 2. 1 Добавление стандартного раствора 6. 2. 2 Измерение потенциала в растворе после добавки 6. 2. 3 Определение концентрации расчетным методом Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 59
Потенциометрические методы. Ионометрия 1 Приготовление стандартных растворов 2 Измерение потенциала в градуировочных растворах 3. 1 Построение градуировочного графика 3. 2 Определение крутизны 4 Подготовка пробы (экстракция, озоление, концентрирование, измельчение, гомогенизация, перемешивания, взвешивание, разбавление буферным электролитом) 5 Измерение потенциала в 2 анализируемых растворах 6. 1 Определение концентрации по градуировочному графику 6. 2. 1 Добавление стандартного раствора 6. 2. 2 Измерение потенциала в растворе после добавки 6. 2. 3 Определение концентрации расчетным методом Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 59
 Потенциометрические методы. Ионометрия 1. Метод градуировочного графика Е = const + s·lga. A v v Градуировочный график, Е = f(р. С), ─ прямая линия; Концентрация определяемого иона в пробе (ci, мг/кг) : где С – концентрация определяемого иона в анализируемом растворе (С = 10 -р. С), моль/дм 3; V – объем анализируемого раствора, 50 см 3; M – молярная масса определяемого иона, г/моль; m – масса навески, взятой для анализа, г; 103 – коэффициент пересчета с массы пробы на 1 кг продукта. Химико-аналитический контроль 60 Шачек Т. М. , кафедра ФХМСП, УО "БГТУ"
Потенциометрические методы. Ионометрия 1. Метод градуировочного графика Е = const + s·lga. A v v Градуировочный график, Е = f(р. С), ─ прямая линия; Концентрация определяемого иона в пробе (ci, мг/кг) : где С – концентрация определяемого иона в анализируемом растворе (С = 10 -р. С), моль/дм 3; V – объем анализируемого раствора, 50 см 3; M – молярная масса определяемого иона, г/моль; m – масса навески, взятой для анализа, г; 103 – коэффициент пересчета с массы пробы на 1 кг продукта. Химико-аналитический контроль 60 Шачек Т. М. , кафедра ФХМСП, УО "БГТУ"
 Потенциометрические методы. Ионометрия 2. Метод добавок где ü ü ü Vст – объем стандартного раствора (например 1 см 3); Vр-ра - объем анализируемого раствора (например 50 см 3); Сст – концентрация стандартного раствора, моль/дм 3; ΔЕ – разность э. д. с. анализируемого раствора, содержащего добавку стандартного раствора (Е 1), и анализируемого раствора без добавки (Е 0), м. В; S – крутизна электродной функции, м. В. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 61
Потенциометрические методы. Ионометрия 2. Метод добавок где ü ü ü Vст – объем стандартного раствора (например 1 см 3); Vр-ра - объем анализируемого раствора (например 50 см 3); Сст – концентрация стандартного раствора, моль/дм 3; ΔЕ – разность э. д. с. анализируемого раствора, содержащего добавку стандартного раствора (Е 1), и анализируемого раствора без добавки (Е 0), м. В; S – крутизна электродной функции, м. В. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 61
 Потенциометрические методы. Ионометрия Области применения Вода питьевая Cl-, NO 3 -, NO 2 -, F, жесткость Сточные воды жесткость, токсичные ионы (СN-, S 2 -, NH 4+) Медицина Na+, K+, Ca 2+, Cl- и др. Пищевая промышленность Na+, K+, Ca 2+, NO 3 -, NO 2 -, Cl- и др. Сельское хозяйство Na+, K+, Ca 2+, Cl- и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 62
Потенциометрические методы. Ионометрия Области применения Вода питьевая Cl-, NO 3 -, NO 2 -, F, жесткость Сточные воды жесткость, токсичные ионы (СN-, S 2 -, NH 4+) Медицина Na+, K+, Ca 2+, Cl- и др. Пищевая промышленность Na+, K+, Ca 2+, NO 3 -, NO 2 -, Cl- и др. Сельское хозяйство Na+, K+, Ca 2+, Cl- и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 62
 Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Достоинства метода: v Простота; v Доступность; v Экспрессность – не более 15 мин с пробоподготовкой; v Низкая стоимость; v Возможность миниатюризации. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 63
Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Достоинства метода: v Простота; v Доступность; v Экспрессность – не более 15 мин с пробоподготовкой; v Низкая стоимость; v Возможность миниатюризации. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 63
 Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Недостатки метода: v v v Различие ионного состава анализируемого и стандартного растворов; Ограниченное применение мембранных ИСЭ в неводных растворах из-за неустойчивости их корпуса и мембраны к действию органических растворителей; Низкая точность, т. к. определяемой величиной служит lg. С, а не сама концентрация. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 64
Потенциометрические методы. Ионометрия Прямая потенциометрия где индикаторным электродом служит ионоселективный электрод. Недостатки метода: v v v Различие ионного состава анализируемого и стандартного растворов; Ограниченное применение мембранных ИСЭ в неводных растворах из-за неустойчивости их корпуса и мембраны к действию органических растворителей; Низкая точность, т. к. определяемой величиной служит lg. С, а не сама концентрация. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 64
 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 65
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 65
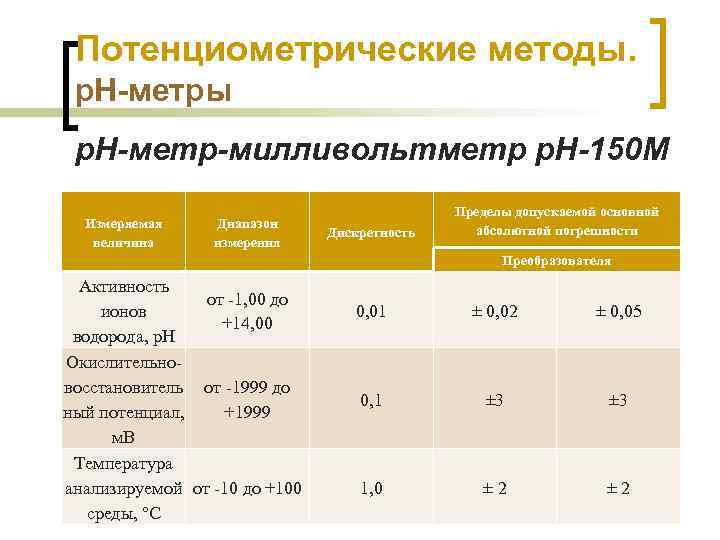 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 66
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 66
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 67
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 67
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 68
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 68
 Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 69
Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 69
 Потенциометрические методы. Иономеры Лабораторный иономер И-160 М предназначен для прямого и косвенного потенциометрического измерения p. H, p. X, Eh и t в водных растворах. p. X: NO 3 -, Cl. O 4 -, F-, Cl-, Br-, I-, CN -, SCN-, CO 3 --, S--, H+, Li+, Na+, K+, NH 4+, Ag+, Ca++, Ba++, Mg++, (Ca+Mg)++, Pb++, Cd++, Cu++, Hg++ и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 70
Потенциометрические методы. Иономеры Лабораторный иономер И-160 М предназначен для прямого и косвенного потенциометрического измерения p. H, p. X, Eh и t в водных растворах. p. X: NO 3 -, Cl. O 4 -, F-, Cl-, Br-, I-, CN -, SCN-, CO 3 --, S--, H+, Li+, Na+, K+, NH 4+, Ag+, Ca++, Ba++, Mg++, (Ca+Mg)++, Pb++, Cd++, Cu++, Hg++ и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 70
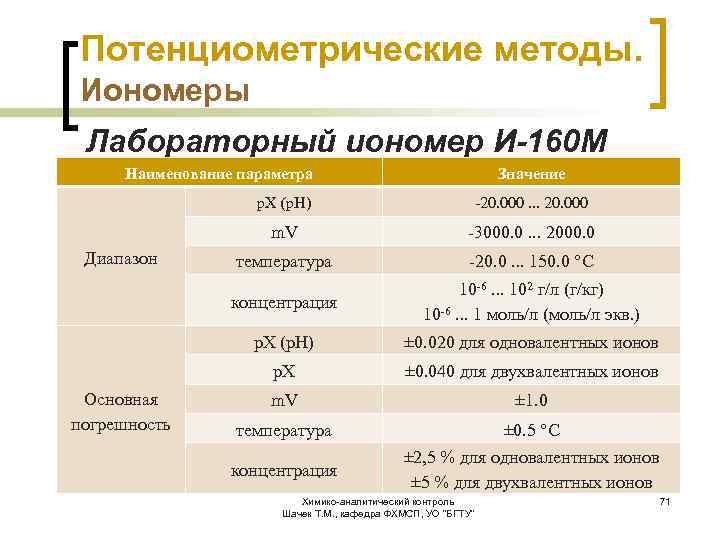 Потенциометрические методы. Иономеры Лабораторный иономер И-160 М Наименование параметра Значение p. X (p. H) m. V температура -20. 0. . . 150. 0 °C 10 -6. . . 102 г/л (г/кг) 10 -6. . . 1 моль/л (моль/л экв. ) p. X (p. H) ± 0. 020 для одновалентных ионов p. X Основная погрешность -3000. 0. . . 2000. 0 концентрация Диапазон -20. 000. . . 20. 000 ± 0. 040 для двухвалентных ионов m. V ± 1. 0 температура ± 0. 5 °C концентрация ± 2, 5 % для одновалентных ионов ± 5 % для двухвалентных ионов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 71
Потенциометрические методы. Иономеры Лабораторный иономер И-160 М Наименование параметра Значение p. X (p. H) m. V температура -20. 0. . . 150. 0 °C 10 -6. . . 102 г/л (г/кг) 10 -6. . . 1 моль/л (моль/л экв. ) p. X (p. H) ± 0. 020 для одновалентных ионов p. X Основная погрешность -3000. 0. . . 2000. 0 концентрация Диапазон -20. 000. . . 20. 000 ± 0. 040 для двухвалентных ионов m. V ± 1. 0 температура ± 0. 5 °C концентрация ± 2, 5 % для одновалентных ионов ± 5 % для двухвалентных ионов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 71
 Потенциометрические методы. Потенциометрическое титрование Обоснование применения v Не для всех определяемых ионов существуют подходящие ионоселективные электроды; v Не высокая точность прямого потенциометрического анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 72
Потенциометрические методы. Потенциометрическое титрование Обоснование применения v Не для всех определяемых ионов существуют подходящие ионоселективные электроды; v Не высокая точность прямого потенциометрического анализа. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 72
 Потенциометрические методы. Потенциометрическое титрование Обоснование применения v Не высокая точность прямого потенциометрического анализа : Воспроизводимость потенциала ± 1 м. В; Число электронов, участвующих в реакции – 1; ü При изменении концентрации в 10 раз Е изменится на 59, 16 ±…. м. В; ü Погрешность в определении концентрации: ü ü ∆lg. C = ∆ E/59, 16 ∆C/C = 2, 303 ∆lg. C = 2, 303 · 1 /59, 16 ~ 0, 04 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 73
Потенциометрические методы. Потенциометрическое титрование Обоснование применения v Не высокая точность прямого потенциометрического анализа : Воспроизводимость потенциала ± 1 м. В; Число электронов, участвующих в реакции – 1; ü При изменении концентрации в 10 раз Е изменится на 59, 16 ±…. м. В; ü Погрешность в определении концентрации: ü ü ∆lg. C = ∆ E/59, 16 ∆C/C = 2, 303 ∆lg. C = 2, 303 · 1 /59, 16 ~ 0, 04 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 73
 Потенциометрические методы. Потенциометрическое титрование Применение 1. Кислотно-основное титрование (стеклянные электрод для измерения р. Н); 2. Окислительно-восстановительное титрование (металлические, в частности инертные электроды). 3. Осадительное титрование (металл-селективные электроды, ИСЭ); Комплексонометрическое титрование (металлселективные электроды); Для индикации используется электрод чувствительный к определяемому иону или иону-титранту. Химико-аналитический контроль 4. Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 74
Потенциометрические методы. Потенциометрическое титрование Применение 1. Кислотно-основное титрование (стеклянные электрод для измерения р. Н); 2. Окислительно-восстановительное титрование (металлические, в частности инертные электроды). 3. Осадительное титрование (металл-селективные электроды, ИСЭ); Комплексонометрическое титрование (металлселективные электроды); Для индикации используется электрод чувствительный к определяемому иону или иону-титранту. Химико-аналитический контроль 4. Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 74
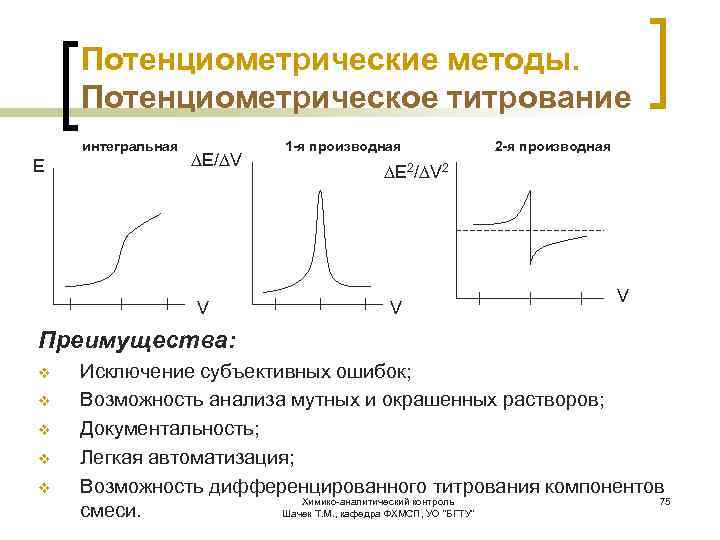 Потенциометрические методы. Потенциометрическое титрование интегральная Е ∆E/∆V V 1 -я производная 2 -я производная ∆E 2/∆V 2 V V Преимущества: v v v Исключение субъективных ошибок; Возможность анализа мутных и окрашенных растворов; Документальность; Легкая автоматизация; Возможность дифференцированного титрования компонентов Химико-аналитический контроль 75 смеси. Шачек Т. М. , кафедра ФХМСП, УО "БГТУ"
Потенциометрические методы. Потенциометрическое титрование интегральная Е ∆E/∆V V 1 -я производная 2 -я производная ∆E 2/∆V 2 V V Преимущества: v v v Исключение субъективных ошибок; Возможность анализа мутных и окрашенных растворов; Документальность; Легкая автоматизация; Возможность дифференцированного титрования компонентов Химико-аналитический контроль 75 смеси. Шачек Т. М. , кафедра ФХМСП, УО "БГТУ"
 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 76
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М предназначен для оперативного измерения p. H, Eh и t технологических растворов, природных и сточных вод. Совместим с любыми отечественными и импортными комбинированными р. Нэлектродами. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 76
 Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 77
Потенциометрические методы. р. Н-метры р. Н-метр-милливольтметр р. Н-150 М Измеряемая величина Диапазон измерения Дискретность Пределы допускаемой основной абсолютной погрешности Преобразователя Активность от -1, 00 до ионов 0, 01 ± 0, 02 +14, 00 водорода, р. Н Окислительновосстановитель от -1999 до 0, 1 ± 3 ный потенциал, +1999 м. В Температура анализируемой от -10 до +100 1, 0 ± 2 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" среды, °С ± 0, 05 ± 3 ± 2 77
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 78
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 микропроцессорный предназначен для оперативного измерения p. H, Eh и t. Поставляется с: v р. Н-электродом в стеклянном корпусе HI 1131 B; v 1 м кабелем; v температурным датчиком HI 7669/2 W; v калибровочными растворами p. H 4 и 7. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 78
 Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 79
Потенциометрические методы. р. Н-метры р. Н-метр р. Н-211 Измеряемый диапазон 0. 00 … 14. 00 p. H, ± 399. 9 (ISE); ± 1999 (ORP) m. V, 0. 0 … 100. 0°C Разрешение 0. 01 p. H, 0. 1 (ISE); 1 (ORP) m. V, 0. 1°C Точность ± 0. 01 p. H, ± 0. 2 (ISE); ± 1 (ORP) m. V, ± 0. 5°C p. H калибровка Автоматическая по 1 или 2 точкам, в памяти 5 значений буферов (4. 01, 6. 86, 7. 01, 9. 18 или 10. 01) Внешние условия 0 … 50°C ; RH 95% Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 79
 Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 80
Потенциометрические методы. р. Н-метры р. Н-метр CHECKER Точность ± 0. 2 p. H Диапазон измерения 0. . . 14 p. H Разрешение 0. 01 p. H Отличительные особенности: v малые размеры и вес; v большой легкосчитываемый экран; v совместимость почти со всеми типами комбинированных p. H-электродов; v исключительная продолжительность работы батарей 3000 часов работы; v низкая стоимость; двухточечная быстрая и простая калибровка. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 80
 Потенциометрические методы. Иономеры Лабораторный иономер И-160 М предназначен для прямого и косвенного потенциометрического измерения p. H, p. X, Eh и t в водных растворах. p. X: NO 3 -, Cl. O 4 -, F-, Cl-, Br-, I-, CN -, SCN-, CO 3 --, S--, H+, Li+, Na+, K+, NH 4+, Ag+, Ca++, Ba++, Mg++, (Ca+Mg)++, Pb++, Cd++, Cu++, Hg++ и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 81
Потенциометрические методы. Иономеры Лабораторный иономер И-160 М предназначен для прямого и косвенного потенциометрического измерения p. H, p. X, Eh и t в водных растворах. p. X: NO 3 -, Cl. O 4 -, F-, Cl-, Br-, I-, CN -, SCN-, CO 3 --, S--, H+, Li+, Na+, K+, NH 4+, Ag+, Ca++, Ba++, Mg++, (Ca+Mg)++, Pb++, Cd++, Cu++, Hg++ и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 81
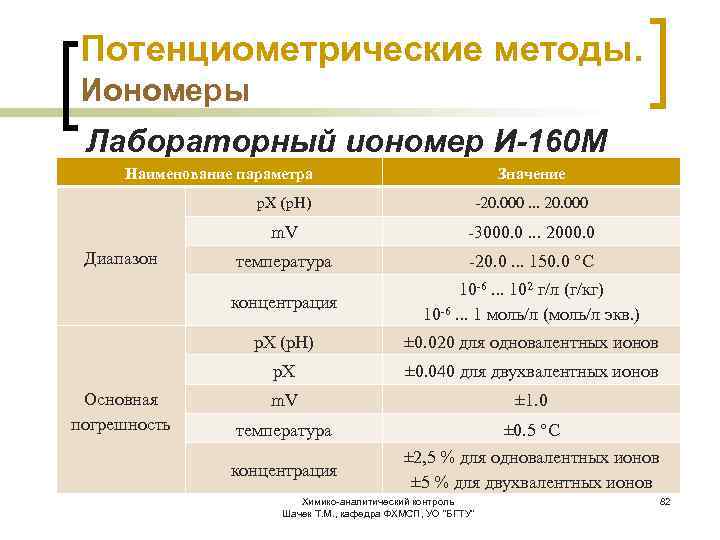 Потенциометрические методы. Иономеры Лабораторный иономер И-160 М Наименование параметра Значение p. X (p. H) m. V температура -20. 0. . . 150. 0 °C 10 -6. . . 102 г/л (г/кг) 10 -6. . . 1 моль/л (моль/л экв. ) p. X (p. H) ± 0. 020 для одновалентных ионов p. X Основная погрешность -3000. 0. . . 2000. 0 концентрация Диапазон -20. 000. . . 20. 000 ± 0. 040 для двухвалентных ионов m. V ± 1. 0 температура ± 0. 5 °C концентрация ± 2, 5 % для одновалентных ионов ± 5 % для двухвалентных ионов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 82
Потенциометрические методы. Иономеры Лабораторный иономер И-160 М Наименование параметра Значение p. X (p. H) m. V температура -20. 0. . . 150. 0 °C 10 -6. . . 102 г/л (г/кг) 10 -6. . . 1 моль/л (моль/л экв. ) p. X (p. H) ± 0. 020 для одновалентных ионов p. X Основная погрешность -3000. 0. . . 2000. 0 концентрация Диапазон -20. 000. . . 20. 000 ± 0. 040 для двухвалентных ионов m. V ± 1. 0 температура ± 0. 5 °C концентрация ± 2, 5 % для одновалентных ионов ± 5 % для двухвалентных ионов Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 82
 Потенциометрические методы. Автоматические титраторы АТП-02 Полностью автоматизированный высокоточный потенциометрический титратор. vнепрерывная и дискретная подача титранта (диапазон от 0, 1 до 36 мл/мин – при объёме дозирующего устройства 20 мл; и от 0, 25 до 90 мл/мин – при объёме дозирующего устройства 50 мл); vавтоматическое изменение скорости подачи по мере приближения к точке эквивалентности или заданной точке и т. д. Прибор позволяют проводить титрование, используя следующие методы: vобщий метод потенциометрического титрования; vкислотно-основное титрование; vтитрование по методу осаждения; vтитрование по методу комплексообразования и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 83
Потенциометрические методы. Автоматические титраторы АТП-02 Полностью автоматизированный высокоточный потенциометрический титратор. vнепрерывная и дискретная подача титранта (диапазон от 0, 1 до 36 мл/мин – при объёме дозирующего устройства 20 мл; и от 0, 25 до 90 мл/мин – при объёме дозирующего устройства 50 мл); vавтоматическое изменение скорости подачи по мере приближения к точке эквивалентности или заданной точке и т. д. Прибор позволяют проводить титрование, используя следующие методы: vобщий метод потенциометрического титрования; vкислотно-основное титрование; vтитрование по методу осаждения; vтитрование по методу комплексообразования и др. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 83
 Потенциометрические методы. Автоматические титраторы АТП-02 Управление титратором осуществляется с помощью программного комплекса «Titrate 3. 0» , обеспечивающего: vвыбор метода и задание режима титрования; vрегистрацию и обработку кривых титрования; vформирование, редактирование и хранение методик (включая методики ГОСТ), протоколов и отчетов измерений. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 84
Потенциометрические методы. Автоматические титраторы АТП-02 Управление титратором осуществляется с помощью программного комплекса «Titrate 3. 0» , обеспечивающего: vвыбор метода и задание режима титрования; vрегистрацию и обработку кривых титрования; vформирование, редактирование и хранение методик (включая методики ГОСТ), протоколов и отчетов измерений. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 84
 Потенциометрические методы. Источники ошибок v v Ø Ø Неточности в измерении E, S, Vx и Va и концентрации сх; Ошибка в определении сx зависит от: Точности построения градуировочного графика; Отношения объемов анализируемого и стандартного растворов. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 85
Потенциометрические методы. Источники ошибок v v Ø Ø Неточности в измерении E, S, Vx и Va и концентрации сх; Ошибка в определении сx зависит от: Точности построения градуировочного графика; Отношения объемов анализируемого и стандартного растворов. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 85
 Потенциометрические методы. Достоинства v v Простота конструкции, дешевизна, надежность в эксплуатации и возможность миниатюризации ионселективных электродов; Определение веществ в широких пределах изменения их концентрации; Измерения как в стационарных, так и в полевых условиях; Удобство для непрерывного и дистанционного контроля. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 86
Потенциометрические методы. Достоинства v v Простота конструкции, дешевизна, надежность в эксплуатации и возможность миниатюризации ионселективных электродов; Определение веществ в широких пределах изменения их концентрации; Измерения как в стационарных, так и в полевых условиях; Удобство для непрерывного и дистанционного контроля. Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 86
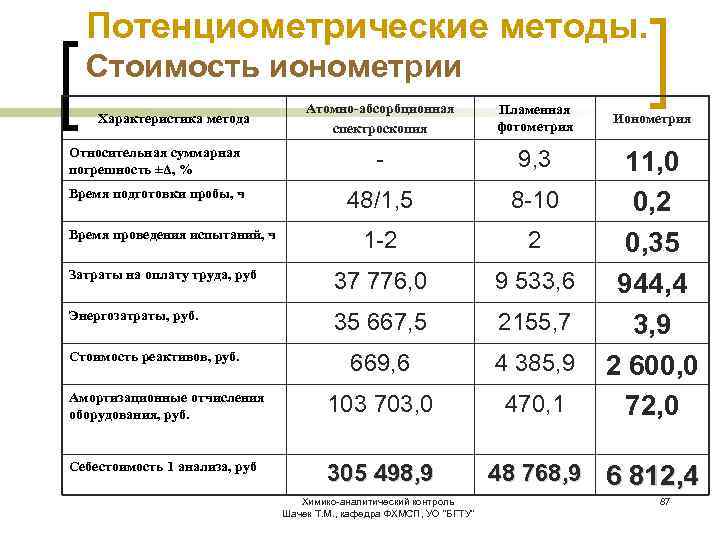 Потенциометрические методы. Стоимость ионометрии Атомно-абсорбционная спектроскопия Пламенная фотометрия Относительная суммарная погрешность ±Δ, % - 9, 3 Время подготовки пробы, ч 48/1, 5 8 -10 1 -2 2 Затраты на оплату труда, руб 37 776, 0 9 533, 6 Энергозатраты, руб. 35 667, 5 2155, 7 669, 6 4 385, 9 Амортизационные отчисления оборудования, руб. 103 703, 0 470, 1 Себестоимость 1 анализа, руб 305 498, 9 Характеристика метода Время проведения испытаний, ч Стоимость реактивов, руб. Ионометрия 11, 0 0, 2 0, 35 944, 4 3, 9 2 600, 0 72, 0 48 768, 9 6 812, 4 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 87
Потенциометрические методы. Стоимость ионометрии Атомно-абсорбционная спектроскопия Пламенная фотометрия Относительная суммарная погрешность ±Δ, % - 9, 3 Время подготовки пробы, ч 48/1, 5 8 -10 1 -2 2 Затраты на оплату труда, руб 37 776, 0 9 533, 6 Энергозатраты, руб. 35 667, 5 2155, 7 669, 6 4 385, 9 Амортизационные отчисления оборудования, руб. 103 703, 0 470, 1 Себестоимость 1 анализа, руб 305 498, 9 Характеристика метода Время проведения испытаний, ч Стоимость реактивов, руб. Ионометрия 11, 0 0, 2 0, 35 944, 4 3, 9 2 600, 0 72, 0 48 768, 9 6 812, 4 Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 87
 Классификация электрохимических методов Измеряемый параметр Условия измерения I=0 Потенциал, Е, м. В Метод Потенциометрия I=f(Eналож) Ток, I, мк. А Вольтамперометрия Удельная электропроводность, æ, См·см-1 I (1000 Гц) Кондуктометрия Количество электричества, Q, Кл I=const или E=const Кулонометрия Масса, m, г I=const или E=const Электрогравиметрия Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 88
Классификация электрохимических методов Измеряемый параметр Условия измерения I=0 Потенциал, Е, м. В Метод Потенциометрия I=f(Eналож) Ток, I, мк. А Вольтамперометрия Удельная электропроводность, æ, См·см-1 I (1000 Гц) Кондуктометрия Количество электричества, Q, Кл I=const или E=const Кулонометрия Масса, m, г I=const или E=const Электрогравиметрия Химико-аналитический контроль Шачек Т. М. , кафедра ФХМСП, УО "БГТУ" 88


