Химическое восстановление.ppt
- Количество слайдов: 12
 Химическое восстановление
Химическое восстановление
 Введение Химическая очистка применяется в тех случаях, когда выделение загрязнений из сточных вод возможно только в результате химических реакций между этими загрязнениями и вводимыми в очищаемые воды реагентами. При этом происходит восстановление растворенных в воде примесей с получением нетоксичных или малотоксичных продуктов; превращение в нерастворимые в воде соединения. При реагентной очистке в основном производят обработку хлорной известью Na. Cl, KCl, перманганатом калия, пероксидом водорода, солями железа, а так же хлорирование и озонировнаие. Эти методы широко употребительны для удаления из сточных вод соединений ртути, хрома, мышьяка. Так, для восстановления ртути и ее соединений предложено применять сульфид железа, боргидрид и гидросульфит натрия, гидразин, железный порошок, алюминиевую пудру и другие.
Введение Химическая очистка применяется в тех случаях, когда выделение загрязнений из сточных вод возможно только в результате химических реакций между этими загрязнениями и вводимыми в очищаемые воды реагентами. При этом происходит восстановление растворенных в воде примесей с получением нетоксичных или малотоксичных продуктов; превращение в нерастворимые в воде соединения. При реагентной очистке в основном производят обработку хлорной известью Na. Cl, KCl, перманганатом калия, пероксидом водорода, солями железа, а так же хлорирование и озонировнаие. Эти методы широко употребительны для удаления из сточных вод соединений ртути, хрома, мышьяка. Так, для восстановления ртути и ее соединений предложено применять сульфид железа, боргидрид и гидросульфит натрия, гидразин, железный порошок, алюминиевую пудру и другие.
 Суть метода Если сточные воды содержат легко восстанавливаемые примеси, то их можно отделить методом восстановления. Такой способ заключается в том, что в очищаемые воды вводятся специальные вещества-реагенты – флокулянты и коагулянты для очистки сточных вод. При вступлении в химическую реакцию с примесями, находящимися в воде, данные вещества способствуют скорейшему и более полному выделению нерастворенных примесей, частей растворенных соединений и коллоидов, уменьшая тем самым их концентрацию в очищаемых сточных водах промышленных предприятий или хозяйственно-бытовых. Они также способны переводить растворимые примеси в нерастворимые либо в растворимые, однако безвредные.
Суть метода Если сточные воды содержат легко восстанавливаемые примеси, то их можно отделить методом восстановления. Такой способ заключается в том, что в очищаемые воды вводятся специальные вещества-реагенты – флокулянты и коагулянты для очистки сточных вод. При вступлении в химическую реакцию с примесями, находящимися в воде, данные вещества способствуют скорейшему и более полному выделению нерастворенных примесей, частей растворенных соединений и коллоидов, уменьшая тем самым их концентрацию в очищаемых сточных водах промышленных предприятий или хозяйственно-бытовых. Они также способны переводить растворимые примеси в нерастворимые либо в растворимые, однако безвредные.
 Реакции окисления-восстановления. Любая реакция окисления-восстановления есть одновременное окисление одних компонентов и восстановление других. Наиболее распространенные восстановители: Хлорит Сульфат Fe 2+ Гидросульфит Диоксид серы Сероводород
Реакции окисления-восстановления. Любая реакция окисления-восстановления есть одновременное окисление одних компонентов и восстановление других. Наиболее распространенные восстановители: Хлорит Сульфат Fe 2+ Гидросульфит Диоксид серы Сероводород
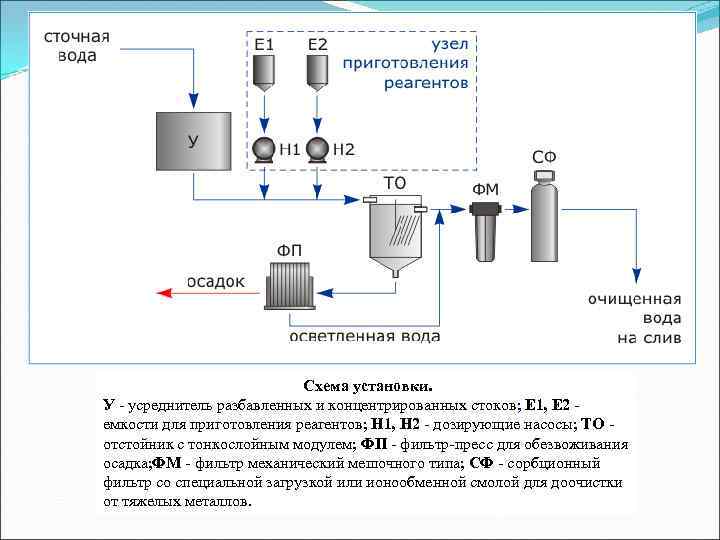 Схема установки. У - усреднитель разбавленных и концентрированных стоков; Е 1, Е 2 - емкости для приготовления реагентов; Н 1, Н 2 - дозирующие насосы; ТО - отстойник с тонкослойным модулем; ФП - фильтр-пресс для обезвоживания осадка; ФМ - фильтр механический мешочного типа; СФ - сорбционный фильтр со специальной загрузкой или ионообменной смолой для доочистки от тяжелых металлов.
Схема установки. У - усреднитель разбавленных и концентрированных стоков; Е 1, Е 2 - емкости для приготовления реагентов; Н 1, Н 2 - дозирующие насосы; ТО - отстойник с тонкослойным модулем; ФП - фильтр-пресс для обезвоживания осадка; ФМ - фильтр механический мешочного типа; СФ - сорбционный фильтр со специальной загрузкой или ионообменной смолой для доочистки от тяжелых металлов.
 Установка для химреагентной очистки сточных производственных вод, производительностью 0, 5 м 3/час, с емкостью для сбора промывных вод.
Установка для химреагентной очистки сточных производственных вод, производительностью 0, 5 м 3/час, с емкостью для сбора промывных вод.
 Применение Основная задача при реагентной очистке хромсодержащих стоков является восстановление шестивалентного хрома в трехвалентный хром. Так как соединения последнего значительно менее токсичны и наиболее полно удаляются в щелочной среде в виде труднорастворимого гидроксида хрома (III). Недостатком реагентных способов очистки хромсодержащих стоков является большой расход реагентов для очистки, значительно (в несколько раз) превышающий стехиометрический расход. Наиболее близким по технической сущности и достигаемому эффекту является способ обезвреживания хромсодержащих сточных вод, основанный на восстановлении шестивалентного хрома в трехвалентный.
Применение Основная задача при реагентной очистке хромсодержащих стоков является восстановление шестивалентного хрома в трехвалентный хром. Так как соединения последнего значительно менее токсичны и наиболее полно удаляются в щелочной среде в виде труднорастворимого гидроксида хрома (III). Недостатком реагентных способов очистки хромсодержащих стоков является большой расход реагентов для очистки, значительно (в несколько раз) превышающий стехиометрический расход. Наиболее близким по технической сущности и достигаемому эффекту является способ обезвреживания хромсодержащих сточных вод, основанный на восстановлении шестивалентного хрома в трехвалентный.
 В качестве реактивов - восстановителей наибольшее применение получили натриевые соли сернистой кислоты – сульфит, бисульфит, пиросульфит (Na 2 S 2 O 5), а также дитионит натрия (Na 2 S 2 O 4). Восстановление Cr 6+ до Cr 3+ происходит по реакциям: Cr 2 O 72 - + 3 SO 34 - + 8 H+ = 2 Cr 3+ + 3 SO 42 - + 4 H 2 O; Cr 2 O 72 - + 3 HSO 3¯ + 5 H+ = 2 Cr 3+ + 3 SO 42 - + 4 H 2 O
В качестве реактивов - восстановителей наибольшее применение получили натриевые соли сернистой кислоты – сульфит, бисульфит, пиросульфит (Na 2 S 2 O 5), а также дитионит натрия (Na 2 S 2 O 4). Восстановление Cr 6+ до Cr 3+ происходит по реакциям: Cr 2 O 72 - + 3 SO 34 - + 8 H+ = 2 Cr 3+ + 3 SO 42 - + 4 H 2 O; Cr 2 O 72 - + 3 HSO 3¯ + 5 H+ = 2 Cr 3+ + 3 SO 42 - + 4 H 2 O
 Восстановление в сочетании с последующим химическим осаждением применяется для очистки сточных вод от соединений хрома (VI): K 2 Cr 2 O 7 + 3 Na. HSO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + 3 Na. HSO 4 + 4 H 2 O Cr 2(SO 4)3 + 6 Na. OH = 2 Cr(OH)3↓ + 3 Na 2 SO 4
Восстановление в сочетании с последующим химическим осаждением применяется для очистки сточных вод от соединений хрома (VI): K 2 Cr 2 O 7 + 3 Na. HSO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + 3 Na. HSO 4 + 4 H 2 O Cr 2(SO 4)3 + 6 Na. OH = 2 Cr(OH)3↓ + 3 Na 2 SO 4
 Поставленная цель достигается за счет того, что восстановление шестивалентного хрома в трехвалентный и отделение твердой фазы проводят в две стадии, причем первую стадию проводят водными растворами реагентов, а вторую стадию проводят путем добавления сухого реагента к фильтрату после отделения осадка первой стадии, при этом первую стадию ограничивают степенью восстановления не более 98, 4% Очистка сточных вод от шестивалеитного хрома и ионов тяжелых металлов производится в реактореотстойнике непрерывного или периодического действия, куда поступают очищенные сточные воды и суспензия коагулянта. При этом протекают процессы химического восстановления шестивалентного хрома. Реакторы-отстойники периодического действия представлены на рисунках:
Поставленная цель достигается за счет того, что восстановление шестивалентного хрома в трехвалентный и отделение твердой фазы проводят в две стадии, причем первую стадию проводят водными растворами реагентов, а вторую стадию проводят путем добавления сухого реагента к фильтрату после отделения осадка первой стадии, при этом первую стадию ограничивают степенью восстановления не более 98, 4% Очистка сточных вод от шестивалеитного хрома и ионов тяжелых металлов производится в реактореотстойнике непрерывного или периодического действия, куда поступают очищенные сточные воды и суспензия коагулянта. При этом протекают процессы химического восстановления шестивалентного хрома. Реакторы-отстойники периодического действия представлены на рисунках:




