равновесия, рН. Лукция 2 для заочников pptx
- Количество слайдов: 55
 Химическое равновесие в аналитической химии. Протолитические равновесия
Химическое равновесие в аналитической химии. Протолитические равновесия
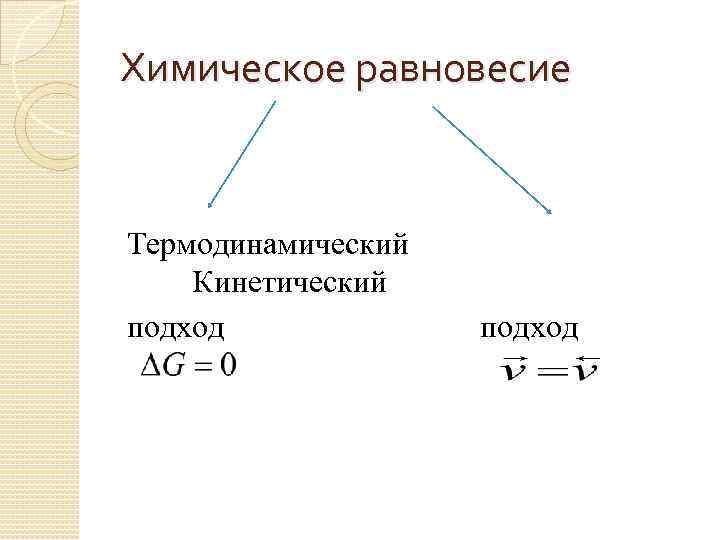 Химическое равновесие Термодинамический Кинетический подход
Химическое равновесие Термодинамический Кинетический подход
 Константа химического равновесия – отношение произведения концентраций, находящихся в состоянии равновесия продуктов химической реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к соответствующему произведению равновесных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Константа химического равновесия – отношение произведения концентраций, находящихся в состоянии равновесия продуктов химической реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к соответствующему произведению равновесных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
 Термодинамический подход Равновесие – состояние системы, при котором ее энергия Гиббса не изменяется. Уравнение изотермы химической реакции
Термодинамический подход Равновесие – состояние системы, при котором ее энергия Гиббса не изменяется. Уравнение изотермы химической реакции
 Кинетический подход Равновесие – такое состояние системы, при котором скорости прямой и обратной реакции равны
Кинетический подход Равновесие – такое состояние системы, при котором скорости прямой и обратной реакции равны
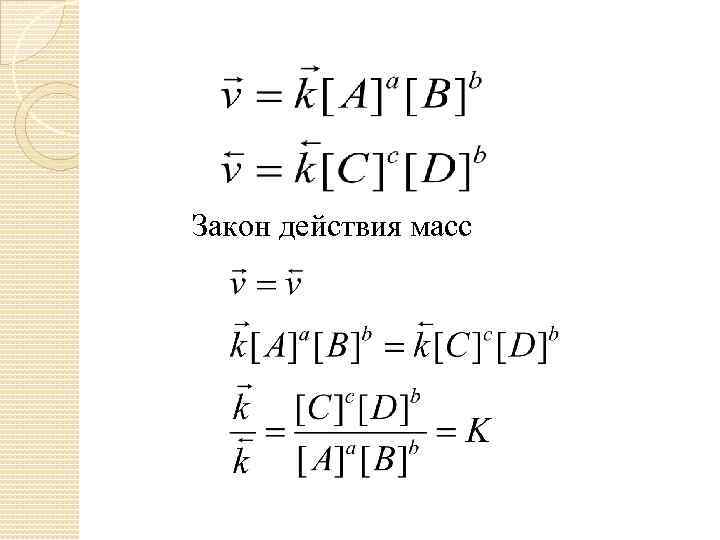 Закон действия масс
Закон действия масс
 Активность (эффективная концентрация, действующая концентрация) (a) – это такая концентрация вещества, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
Активность (эффективная концентрация, действующая концентрация) (a) – это такая концентрация вещества, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
 а имеет ту же размерность, что и величина, характеризующая состав раствора, вместо которой эта активность используется. а=1 (чистого растворителя, нерастворимых веществ) а=c (в бесконечно разбавленном растворе)
а имеет ту же размерность, что и величина, характеризующая состав раствора, вместо которой эта активность используется. а=1 (чистого растворителя, нерастворимых веществ) а=c (в бесконечно разбавленном растворе)
 Коэффициент активности (y, γ, f)– поправочный коэффициент, показывающий, насколько отличаются свойства реального и идеального раствора. Коэффициент активности – отношение активности вещества в данном растворе к его концентрации.
Коэффициент активности (y, γ, f)– поправочный коэффициент, показывающий, насколько отличаются свойства реального и идеального раствора. Коэффициент активности – отношение активности вещества в данном растворе к его концентрации.
 Коэффициент активности Молярный Моляльный Рациональный y=0 1
Коэффициент активности Молярный Моляльный Рациональный y=0 1
 Коэффициент активности Среднеионный – характеризует поведение электролита в целом, устанавливается экспериментально. Am B n Индивидуальный – характеризует активность отдельных ионов, входящих в состав электролита, получаются расчетным путем.
Коэффициент активности Среднеионный – характеризует поведение электролита в целом, устанавливается экспериментально. Am B n Индивидуальный – характеризует активность отдельных ионов, входящих в состав электролита, получаются расчетным путем.
 Ионная сила раствора Активность вещества, находящегося в растворе электролита, зависит от концентрации всех ионов, находящихся в растворе, и их заряда.
Ионная сила раствора Активность вещества, находящегося в растворе электролита, зависит от концентрации всех ионов, находящихся в растворе, и их заряда.
 Предельный закон Дебая – Хюккеля I < 0, 01 где А – коэффициент, зависящий от температуры и диэлектрической проницаемости среды. А ≈ 0, 511
Предельный закон Дебая – Хюккеля I < 0, 01 где А – коэффициент, зависящий от температуры и диэлектрической проницаемости среды. А ≈ 0, 511
 Расширенное уравнение Дебая. Хюккеля 0, 01 < I < 0, 1 где В = 0, 328; а – электрическая константа, характеризующая размер ионной атмосферы, значение величины а берут из таблицы, (величина а выражена в Å).
Расширенное уравнение Дебая. Хюккеля 0, 01 < I < 0, 1 где В = 0, 328; а – электрическая константа, характеризующая размер ионной атмосферы, значение величины а берут из таблицы, (величина а выражена в Å).
 Уравнение Дэвиса I > 0, 1
Уравнение Дэвиса I > 0, 1
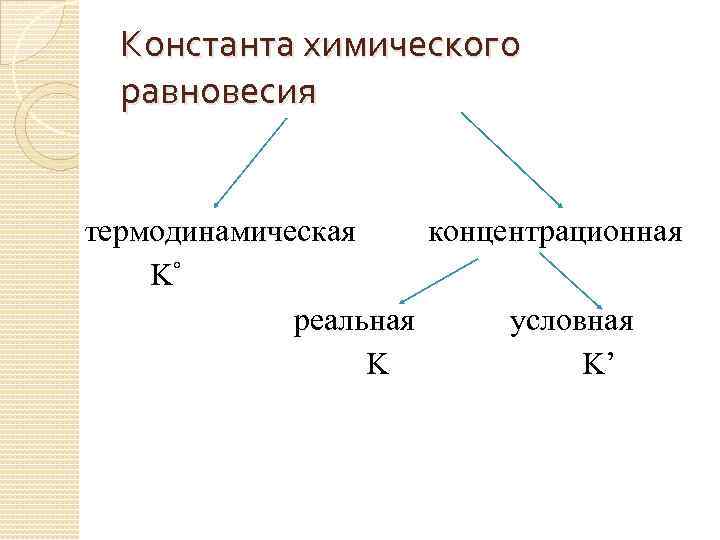 Константа химического равновесия термодинамическая концентрационная K° реальная условная K K’
Константа химического равновесия термодинамическая концентрационная K° реальная условная K K’
 Термодинамическая константа равновесия выражается как отношение активностей (или парциальных давлений для равновесных реакций, протекающих в газовой фазе) продуктов реакции к активностям (парциальным давлениям) исходных веществ. K°= f (природы в-в, T, р-ль)
Термодинамическая константа равновесия выражается как отношение активностей (или парциальных давлений для равновесных реакций, протекающих в газовой фазе) продуктов реакции к активностям (парциальным давлениям) исходных веществ. K°= f (природы в-в, T, р-ль)
 Концентрационная константа равновесия представляет собой отношение равновесных концентраций продуктов реакции к равновесным концентрациям исходных веществ. K= f (природы в-в, T, р-ль, I)
Концентрационная константа равновесия представляет собой отношение равновесных концентраций продуктов реакции к равновесным концентрациям исходных веществ. K= f (природы в-в, T, р-ль, I)
 Условная константа равновесия выражается через общие концентрации веществ, участвующих в равновесии. K’= f (природы в-в, T, р-ль, I, побочные р-и, р. Н и т. д. )
Условная константа равновесия выражается через общие концентрации веществ, участвующих в равновесии. K’= f (природы в-в, T, р-ль, I, побочные р-и, р. Н и т. д. )
 Равновесная концентрация – концентрация определенной формы вещества, участвующего в равновесии. Общая концентрация – сумма всех равновесных концентраций всех форм существования данного вещества.
Равновесная концентрация – концентрация определенной формы вещества, участвующего в равновесии. Общая концентрация – сумма всех равновесных концентраций всех форм существования данного вещества.

 Взаимосвязь констант равновесия
Взаимосвязь констант равновесия
 Константы химического равновесия
Константы химического равновесия
 Показатель константы – отрицательный десятичный логарифм константы равновесия. p. K = -lg. K
Показатель константы – отрицательный десятичный логарифм константы равновесия. p. K = -lg. K
 Теории кислот и оснований Ионная теория Аррениуса и Оствальда Протолитическая теория Брёнстеда Электронная теория Льюиса Теория Усановича
Теории кислот и оснований Ионная теория Аррениуса и Оствальда Протолитическая теория Брёнстеда Электронная теория Льюиса Теория Усановича
 Ионная теория Аррениуса и Оствальда Кислота – электролит, при диссоциации которого в водном растворе образуются катионы только одно вида – катионы водорода (Н+). Основание – электролит, при диссоциации которого в водном растворе образуются анионы только одно вида – гидроксид-ионы (ОН-).
Ионная теория Аррениуса и Оствальда Кислота – электролит, при диссоциации которого в водном растворе образуются катионы только одно вида – катионы водорода (Н+). Основание – электролит, при диссоциации которого в водном растворе образуются анионы только одно вида – гидроксид-ионы (ОН-).
 Кислота и основание взаимодействуют друг с другом с образованием соли и воды (реакция нейтрализации). Если в реакцию нейтрализации вступает хотя бы один слабый электролит – реакция обратима. Обратная реакция – реакция гидролиза.
Кислота и основание взаимодействуют друг с другом с образованием соли и воды (реакция нейтрализации). Если в реакцию нейтрализации вступает хотя бы один слабый электролит – реакция обратима. Обратная реакция – реакция гидролиза.
 Недостатки ионной теории Применима только для водных растворов Не описывает кислотно-основных свойства веществ, не попадающих под определение кислота и основание.
Недостатки ионной теории Применима только для водных растворов Не описывает кислотно-основных свойства веществ, не попадающих под определение кислота и основание.
 Протолитическая теория Брёнстеда Кислота – соединение, способное отдавать протон. Основание – соединение, способное принимать протон. Амфолит – вещество, способное проявлять как кислотные, так и основные свойства.
Протолитическая теория Брёнстеда Кислота – соединение, способное отдавать протон. Основание – соединение, способное принимать протон. Амфолит – вещество, способное проявлять как кислотные, так и основные свойства.
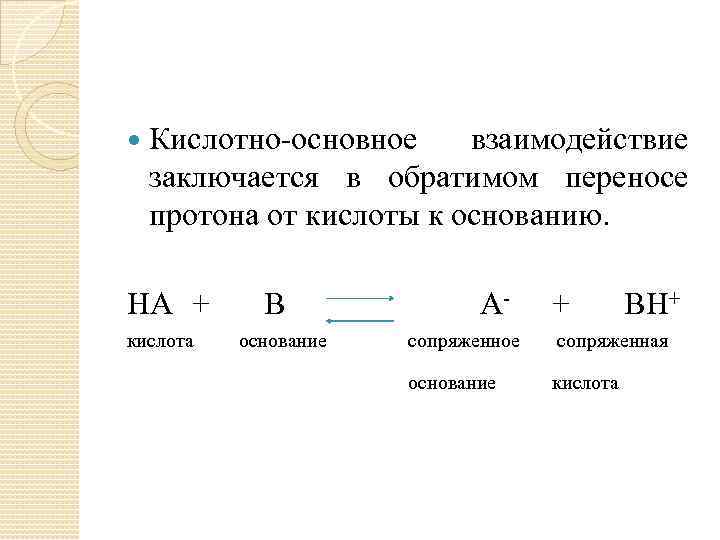 Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. HA + кислота B основание A- + BH+ сопряженное сопряженная основание кислота
Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. HA + кислота B основание A- + BH+ сопряженное сопряженная основание кислота
 Кислоты и основания существуют как сопряженные пары. В процессе взаимодействия кислоты и основания они не исчезают, образуя соль и воду, а превращаются в новое основание и новую кислоту. Понятия соль и гидролиз отсутствуют. Протон не существует в растворе в свободном виде, а связывается с молекулами растворителя. (H 3 O+)
Кислоты и основания существуют как сопряженные пары. В процессе взаимодействия кислоты и основания они не исчезают, образуя соль и воду, а превращаются в новое основание и новую кислоту. Понятия соль и гидролиз отсутствуют. Протон не существует в растворе в свободном виде, а связывается с молекулами растворителя. (H 3 O+)
 Электронная теория Льюиса Кислота – соединение, способное принимать пару электронов. Основание – соединение, способное присоединять пару электронов. Взаимодействие кислоты и основания приводит к образованию ковалентной связи по донорно-акцепторному механизму.
Электронная теория Льюиса Кислота – соединение, способное принимать пару электронов. Основание – соединение, способное присоединять пару электронов. Взаимодействие кислоты и основания приводит к образованию ковалентной связи по донорно-акцепторному механизму.
 Теория Усановича Кислота – вещество, которое выделяет катионы и взаимодействует с анионами или электронами. Основание – вещество, которое отдает протоны или электроны.
Теория Усановича Кислота – вещество, которое выделяет катионы и взаимодействует с анионами или электронами. Основание – вещество, которое отдает протоны или электроны.
 Колическтвенное описание силы кислот и оснований Константа кислотности (Ка) – величина, характеризующая способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания.
Колическтвенное описание силы кислот и оснований Константа кислотности (Ка) – величина, характеризующая способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания.

 Показатель константы кислотности p. Kа = -lg. Kа Чем больше Ka и меньше p. Ka, тем сильнее кислота
Показатель константы кислотности p. Kа = -lg. Kа Чем больше Ka и меньше p. Ka, тем сильнее кислота


 Показатель константы сопряженной кислоты p. KBH+ = -lg. KBH+ кислотности Чем больше KBH+ и меньше p. KBH+ , тем сильнее сопряженная с основанием кислота и тем слабее само основание
Показатель константы сопряженной кислоты p. KBH+ = -lg. KBH+ кислотности Чем больше KBH+ и меньше p. KBH+ , тем сильнее сопряженная с основанием кислота и тем слабее само основание
 Растворители протонные полярные ε > 15 апротонные неполярные ε < 15
Растворители протонные полярные ε > 15 апротонные неполярные ε < 15
 Протонные растворители – растворители, в составе молекул которых имеется склонный к ионизации атом водорода. Вода, спирты, карбоновые кислоты Апротонные неполярные – гексан, бензол, тетрахлорметан. Апротонные полярные – ацетонитрил, диметилформамид, ацетон.
Протонные растворители – растворители, в составе молекул которых имеется склонный к ионизации атом водорода. Вода, спирты, карбоновые кислоты Апротонные неполярные – гексан, бензол, тетрахлорметан. Апротонные полярные – ацетонитрил, диметилформамид, ацетон.
 Растворители Кислотные (протогенные) – карбоновые кислоты Основные (протофильные) – аммиак, диетилформамид Амфотерные – спирты, вода Инертные – тетрахлорметан, бензол, гексан, ацетонитрил, диметилсульфоксид
Растворители Кислотные (протогенные) – карбоновые кислоты Основные (протофильные) – аммиак, диетилформамид Амфотерные – спирты, вода Инертные – тетрахлорметан, бензол, гексан, ацетонитрил, диметилсульфоксид
 Автопротолиз – процесс кислотноосновного взаимодействия между двумя молекулами вещества, при котором одна молекула ведет себя как кислота, а вторая как основание. H 2 O + H 2 O H 3 O+ + OH- NH 3 + NH 3 NH 4+ + NH 2 -
Автопротолиз – процесс кислотноосновного взаимодействия между двумя молекулами вещества, при котором одна молекула ведет себя как кислота, а вторая как основание. H 2 O + H 2 O H 3 O+ + OH- NH 3 + NH 3 NH 4+ + NH 2 -



 Общие принципы расчета состава равновесных систем Уравнение материального баланса отражает тот факт, что число атомов определенного элемента в изолированной системе остается неизменным. Уравнение электронейтральности основано на том, что в одном и том же объеме суммарное чиcло положительных зарядов должно быть равно числу отрицательных. Соблюдаются для равновесных концентраций, но не для активностей
Общие принципы расчета состава равновесных систем Уравнение материального баланса отражает тот факт, что число атомов определенного элемента в изолированной системе остается неизменным. Уравнение электронейтральности основано на том, что в одном и том же объеме суммарное чиcло положительных зарядов должно быть равно числу отрицательных. Соблюдаются для равновесных концентраций, но не для активностей
 Расчет р. Н водных растворов
Расчет р. Н водных растворов
 Кислотно-основные буферные системы Буферный раствор – системы, поддерживающие определенное значение какого-либо параметра при изменении состава системы. Кислотно-основный буферный раствор – раствор, сохраняющий примерно постоянным значение р. Н при добавлении к нему не слишком больших количеств сильной кислоты или основания, а также при разбавлении и концентрировании.
Кислотно-основные буферные системы Буферный раствор – системы, поддерживающие определенное значение какого-либо параметра при изменении состава системы. Кислотно-основный буферный раствор – раствор, сохраняющий примерно постоянным значение р. Н при добавлении к нему не слишком больших количеств сильной кислоты или основания, а также при разбавлении и концентрировании.
 Кислотно-основные буферные системы содержат слабые кислоты и сопряженные с ними основания. Ацетатный CH 3 COOH + CH 3 COONa Аммиачный NH 4 Cl + NH 3 Фосфатный KH 2 PO 4 + Na 2 HPO 4 Гидрокарбонатный CO 2˙H 2 O+ Na. HCO 3 Карбонатный Na. HCO 3 + Na 2 CO 3
Кислотно-основные буферные системы содержат слабые кислоты и сопряженные с ними основания. Ацетатный CH 3 COOH + CH 3 COONa Аммиачный NH 4 Cl + NH 3 Фосфатный KH 2 PO 4 + Na 2 HPO 4 Гидрокарбонатный CO 2˙H 2 O+ Na. HCO 3 Карбонатный Na. HCO 3 + Na 2 CO 3
 Механизм действия буферных растворов При добавлении к буферному раствору сильной кислоты превращается в слабую кислоту, а сильное основание – в слабое основание.
Механизм действия буферных растворов При добавлении к буферному раствору сильной кислоты превращается в слабую кислоту, а сильное основание – в слабое основание.
 Расчет р. Н буферных растворов
Расчет р. Н буферных растворов


 Спасибо за внимание
Спасибо за внимание


