ХИМ.РАВН.ppt
- Количество слайдов: 29
 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
 План лекции n Константа химического равновесия n Принцип Ле Шателье n Виды сорбции n Поверхностно-активные вещества (ПАВ) n Смачивание n Адгезия и когезия
План лекции n Константа химического равновесия n Принцип Ле Шателье n Виды сорбции n Поверхностно-активные вещества (ПАВ) n Смачивание n Адгезия и когезия
 Химические реакции необратимые 1. С образованием осадков Ag. NO 3 + HCl = Ag. Cl ↓ + HNO 3 2. С образованием газообразных малорастворимых веществ Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2↑ + H 2 O 3. С образованием малодиссоциирующих веществ (слабых электролитов): HCl + KOH = KCl + H 2 O 4. С образованием комплексных соединений Cu. SO 4∙ 5 H 2 O+4 NH 3=[Cu(NH 3)4]SO 4+ H 2 O обратимые m. А + n В → p С + q Д ←
Химические реакции необратимые 1. С образованием осадков Ag. NO 3 + HCl = Ag. Cl ↓ + HNO 3 2. С образованием газообразных малорастворимых веществ Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2↑ + H 2 O 3. С образованием малодиссоциирующих веществ (слабых электролитов): HCl + KOH = KCl + H 2 O 4. С образованием комплексных соединений Cu. SO 4∙ 5 H 2 O+4 NH 3=[Cu(NH 3)4]SO 4+ H 2 O обратимые m. А + n В → p С + q Д ←
 КОНСТАНТА РАВНОВЕСИЯ ХИМИЧЕСКОЙ РЕАКЦИИ → ← m. А + n В p. С + q. Д
КОНСТАНТА РАВНОВЕСИЯ ХИМИЧЕСКОЙ РЕАКЦИИ → ← m. А + n В p. С + q. Д
 СМЕЩЕНИЕ РАВНОВЕСИЯ ПО ПРИНЦИПЦУ ЛЕ ШАТЕЛЬЕ n Влияние концентрации и температуры ← N 2 + 3 H 2 → 2 NH 3 Q = +92, 4 Кдж/моль (∆Н=-46, 2 к. Дж/моль) n Влияние давления ← 2 NО + О 2 → 2 NО 2 ← N 2+O 2 → 2 NO
СМЕЩЕНИЕ РАВНОВЕСИЯ ПО ПРИНЦИПЦУ ЛЕ ШАТЕЛЬЕ n Влияние концентрации и температуры ← N 2 + 3 H 2 → 2 NH 3 Q = +92, 4 Кдж/моль (∆Н=-46, 2 к. Дж/моль) n Влияние давления ← 2 NО + О 2 → 2 NО 2 ← N 2+O 2 → 2 NO
 ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ 1. КОНСТАНТА РАВНОВЕСИЯ РЕАКЦИИ 2. УКАЖИТЕ ПРИ КАКОЙ ТЕМПЕРАТУРЕ ВИХОД HCl В РЕАКЦИИ H 2 + + ↔ (г) ИМЕЕТ Si(т) + 2 Н 2 О(г) ↔ Si. O 2(т)Cl 22 Н 22 HCl, ВЫРАЖЕНИЕ МАКСИМАЛЬНЫЙ, ЕСЛИ ЗНАЧЕНИЯ КОНСТАНТ РАВНОВЕСИЯ СЛЕДУЮЩИЕ А. К=3, 2∙ 1016 (300 K) Б. К=2, 5∙ 108 (600 K) В. К=5, 5∙ 105 (900 K)
ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ 1. КОНСТАНТА РАВНОВЕСИЯ РЕАКЦИИ 2. УКАЖИТЕ ПРИ КАКОЙ ТЕМПЕРАТУРЕ ВИХОД HCl В РЕАКЦИИ H 2 + + ↔ (г) ИМЕЕТ Si(т) + 2 Н 2 О(г) ↔ Si. O 2(т)Cl 22 Н 22 HCl, ВЫРАЖЕНИЕ МАКСИМАЛЬНЫЙ, ЕСЛИ ЗНАЧЕНИЯ КОНСТАНТ РАВНОВЕСИЯ СЛЕДУЮЩИЕ А. К=3, 2∙ 1016 (300 K) Б. К=2, 5∙ 108 (600 K) В. К=5, 5∙ 105 (900 K)
 ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ 3. ПРИ УВЕЛИЧЕНИИ ДАВЛЕНИЯ В 10 РАЗ В СИСТЕМЕ 2 NО(г) + O 2(г) ↔ 2 NO 2(г) СКОРОСТЬ ПРЯМОЙ РЕАКЦІИИ ИЗМЕНИТСЯ ПО СРАВНЕНИЮ СО СКОРОСТЬЮ ОБРАТНОЙ РЕАКЦИИ А. уменьшится в 10 раз Б. уменьшится в 100 раз В. уменьшится в 1000 раз Г. увеличится в 10 раз Д. увеличится в 100 раз Е. увеличится в 1000 раз 4. ИСХОДЯ ИЗ ТОГО, ЧТО ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ РЕАКЦИИ А. 2 SO 2 + O 2 ↔ 2 SO 3 СМЕЩАЕТСЯ ВЛЕВО, А РЕАКЦИИ Б. N 2 + O 2 ↔ 2 NO СМЕЩАЕТСЯ ВПРАВО, МОЖНО СДЕЛАТЬ ВЫВОД, ЧТО ПРЯМАЯ РЕАКЦИЯ 1. ЭНДОТЕРМИЧЕСКАЯ 2. ЭКЗОТЕРМИЧЕСКАЯ
ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ 3. ПРИ УВЕЛИЧЕНИИ ДАВЛЕНИЯ В 10 РАЗ В СИСТЕМЕ 2 NО(г) + O 2(г) ↔ 2 NO 2(г) СКОРОСТЬ ПРЯМОЙ РЕАКЦІИИ ИЗМЕНИТСЯ ПО СРАВНЕНИЮ СО СКОРОСТЬЮ ОБРАТНОЙ РЕАКЦИИ А. уменьшится в 10 раз Б. уменьшится в 100 раз В. уменьшится в 1000 раз Г. увеличится в 10 раз Д. увеличится в 100 раз Е. увеличится в 1000 раз 4. ИСХОДЯ ИЗ ТОГО, ЧТО ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ РАВНОВЕСИЕ РЕАКЦИИ А. 2 SO 2 + O 2 ↔ 2 SO 3 СМЕЩАЕТСЯ ВЛЕВО, А РЕАКЦИИ Б. N 2 + O 2 ↔ 2 NO СМЕЩАЕТСЯ ВПРАВО, МОЖНО СДЕЛАТЬ ВЫВОД, ЧТО ПРЯМАЯ РЕАКЦИЯ 1. ЭНДОТЕРМИЧЕСКАЯ 2. ЭКЗОТЕРМИЧЕСКАЯ
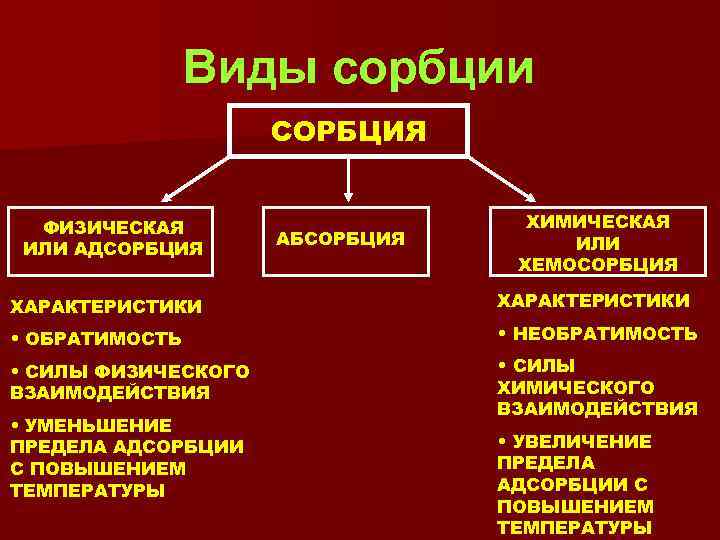 Виды сорбции СОРБЦИЯ ФИЗИЧЕСКАЯ ИЛИ АДСОРБЦИЯ АБСОРБЦИЯ ХИМИЧЕСКАЯ ИЛИ ХЕМОСОРБЦИЯ ХАРАКТЕРИСТИКИ • ОБРАТИМОСТЬ • НЕОБРАТИМОСТЬ • СИЛЫ ФИЗИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ • СИЛЫ ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ • УМЕНЬШЕНИЕ ПРЕДЕЛА АДСОРБЦИИ С ПОВЫШЕНИЕМ ТЕМПЕРАТУРЫ • УВЕЛИЧЕНИЕ ПРЕДЕЛА АДСОРБЦИИ С ПОВЫШЕНИЕМ ТЕМПЕРАТУРЫ
Виды сорбции СОРБЦИЯ ФИЗИЧЕСКАЯ ИЛИ АДСОРБЦИЯ АБСОРБЦИЯ ХИМИЧЕСКАЯ ИЛИ ХЕМОСОРБЦИЯ ХАРАКТЕРИСТИКИ • ОБРАТИМОСТЬ • НЕОБРАТИМОСТЬ • СИЛЫ ФИЗИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ • СИЛЫ ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ • УМЕНЬШЕНИЕ ПРЕДЕЛА АДСОРБЦИИ С ПОВЫШЕНИЕМ ТЕМПЕРАТУРЫ • УВЕЛИЧЕНИЕ ПРЕДЕЛА АДСОРБЦИИ С ПОВЫШЕНИЕМ ТЕМПЕРАТУРЫ
 АБСОРБЦИЯ - ПРОЦЕСС ПОГЛОЩЕНИЯ СОРБАТА ВО ВСЕМ ОБЪЕМЕ СОРБЕНТА Скрубберный процесс – барботаж газа через поглотительную колонну очищенный газ загрязненный газ
АБСОРБЦИЯ - ПРОЦЕСС ПОГЛОЩЕНИЯ СОРБАТА ВО ВСЕМ ОБЪЕМЕ СОРБЕНТА Скрубберный процесс – барботаж газа через поглотительную колонну очищенный газ загрязненный газ
 ХЕМОСОРБЕНТЫ • активированный уголь С • силикагель Si. O 2 аморфный • цеолиты n. Al 2 O 3. m. Si. O 2 (молекулярные сита) Активные центры
ХЕМОСОРБЕНТЫ • активированный уголь С • силикагель Si. O 2 аморфный • цеолиты n. Al 2 O 3. m. Si. O 2 (молекулярные сита) Активные центры
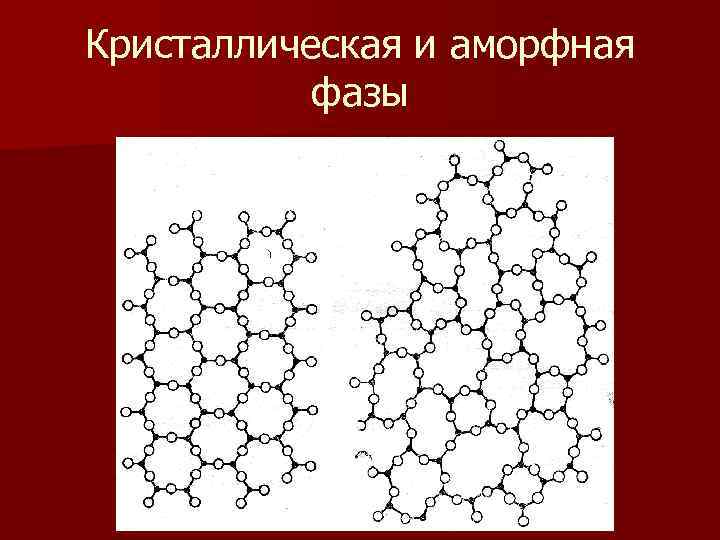 Кристаллическая и аморфная фазы
Кристаллическая и аморфная фазы
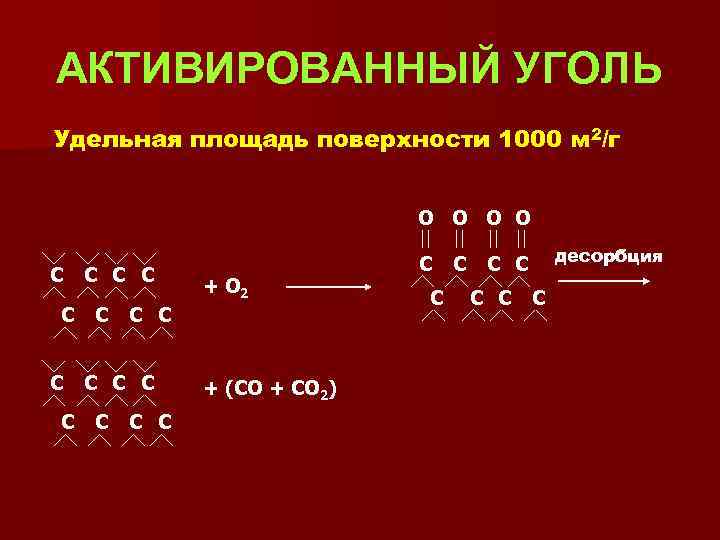 АКТИВИРОВАННЫЙ УГОЛЬ Удельная площадь поверхности 1000 м 2/г О О С С С С + О 2 С С + (СО + СО 2) С С С десорбция С С С
АКТИВИРОВАННЫЙ УГОЛЬ Удельная площадь поверхности 1000 м 2/г О О С С С С + О 2 С С + (СО + СО 2) С С С десорбция С С С
 Постепенное изменение структуры угля при его активировании
Постепенное изменение структуры угля при его активировании
 РЕЖИМЫ СОРБЦИИ • СТАТИЧЕСКИЙ • ДИНАМИЧЕСКИЙ С 1 С О Р Б Е Н Т С 2 КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ: • ВРЕМЯ ПРОСКОКА • ДСОЕ=С 1 -С 2/m, мг-экв/кг. л С 1 >> С 2
РЕЖИМЫ СОРБЦИИ • СТАТИЧЕСКИЙ • ДИНАМИЧЕСКИЙ С 1 С О Р Б Е Н Т С 2 КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ: • ВРЕМЯ ПРОСКОКА • ДСОЕ=С 1 -С 2/m, мг-экв/кг. л С 1 >> С 2
 Межмолекулярные силы, действующие на молекулу в поверхностном слое и в объеме жидкости
Межмолекулярные силы, действующие на молекулу в поверхностном слое и в объеме жидкости
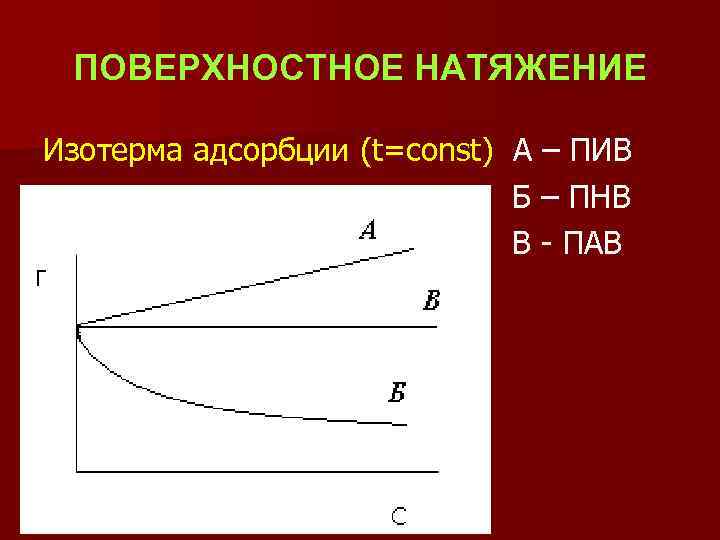 ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Изотерма адсорбции (t=const) А – ПИВ Б – ПНВ В - ПАВ
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Изотерма адсорбции (t=const) А – ПИВ Б – ПНВ В - ПАВ
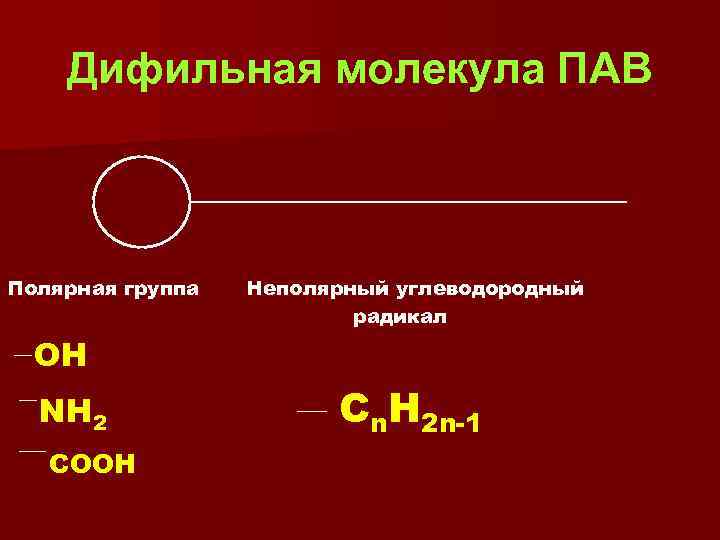 Дифильная молекула ПАВ Полярная группа Неполярный углеводородный радикал ОН NH 2 COOH Cn. H 2 n-1
Дифильная молекула ПАВ Полярная группа Неполярный углеводородный радикал ОН NH 2 COOH Cn. H 2 n-1
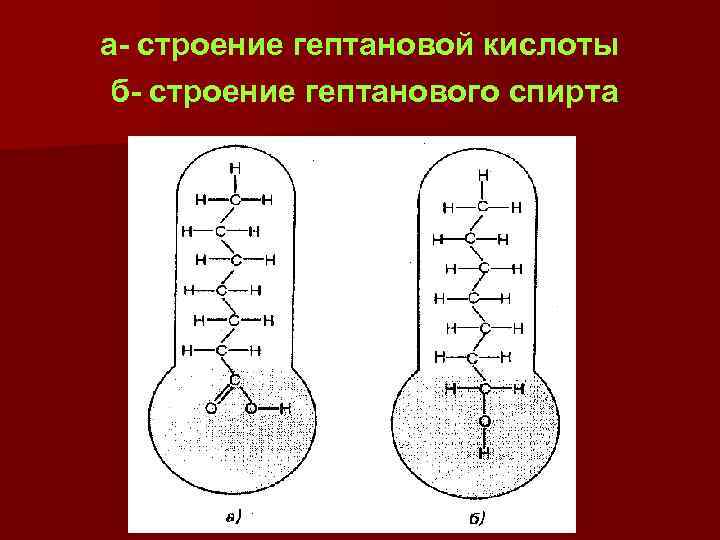 а- строение гептановой кислоты б- строение гептанового спирта
а- строение гептановой кислоты б- строение гептанового спирта
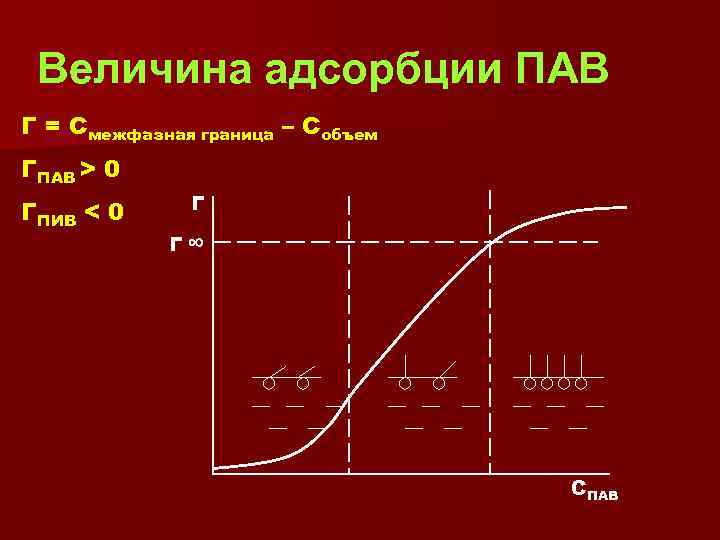 Величина адсорбции ПАВ Г = Смежфазная граница – Собъем ГПАВ > 0 ГПИВ < 0 Г Г ∞ СПАВ
Величина адсорбции ПАВ Г = Смежфазная граница – Собъем ГПАВ > 0 ГПИВ < 0 Г Г ∞ СПАВ
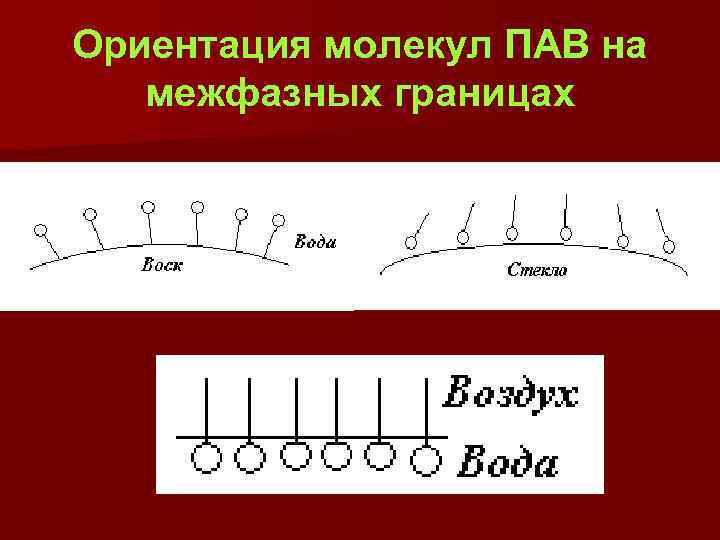 Ориентация молекул ПАВ на межфазных границах
Ориентация молекул ПАВ на межфазных границах
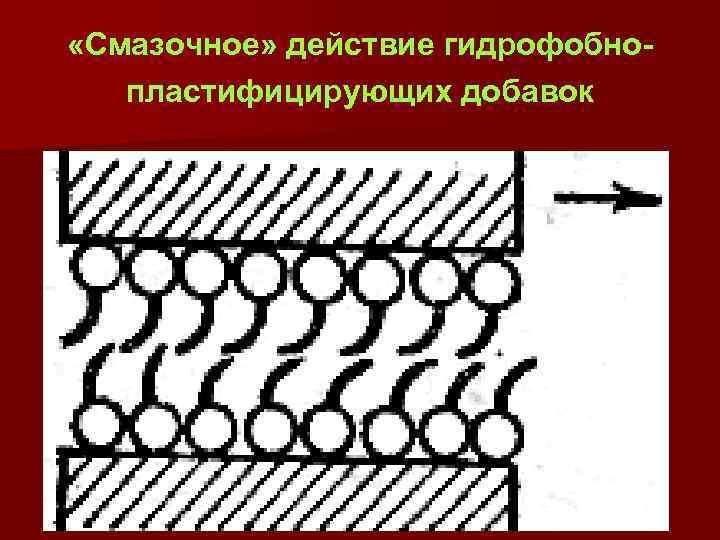 «Смазочное» действие гидрофобнопластифицирующих добавок
«Смазочное» действие гидрофобнопластифицирующих добавок
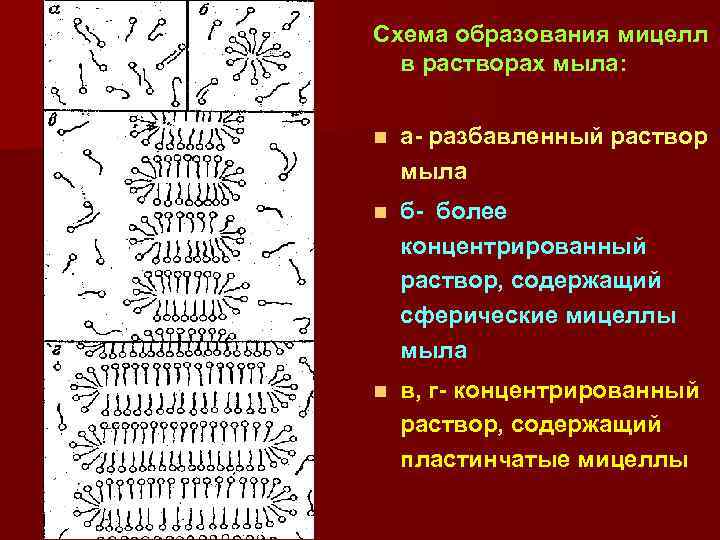 Схема образования мицелл в растворах мыла: n а- разбавленный раствор мыла n б- более концентрированный раствор, содержащий сферические мицеллы мыла n в, г- концентрированный раствор, содержащий пластинчатые мицеллы
Схема образования мицелл в растворах мыла: n а- разбавленный раствор мыла n б- более концентрированный раствор, содержащий сферические мицеллы мыла n в, г- концентрированный раствор, содержащий пластинчатые мицеллы
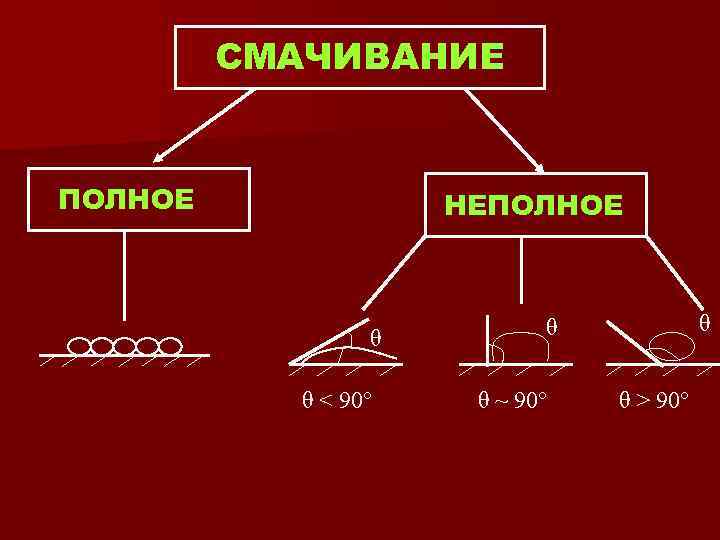 СМАЧИВАНИЕ ПОЛНОЕ НЕПОЛНОЕ θ θ < 90° θ θ θ ~ 90° θ > 90°
СМАЧИВАНИЕ ПОЛНОЕ НЕПОЛНОЕ θ θ < 90° θ θ θ ~ 90° θ > 90°
 Смачивание поверхностей Гидрофильные поверхности Гидрофобные поверхности Алмаз Корунд Кварц Силикаты (стекло) Оксиды металлов Гидроксиды металлов Сера Сульфиды металлов Тальк Углеводороды
Смачивание поверхностей Гидрофильные поверхности Гидрофобные поверхности Алмаз Корунд Кварц Силикаты (стекло) Оксиды металлов Гидроксиды металлов Сера Сульфиды металлов Тальк Углеводороды
 Флотационное обогащение руд
Флотационное обогащение руд
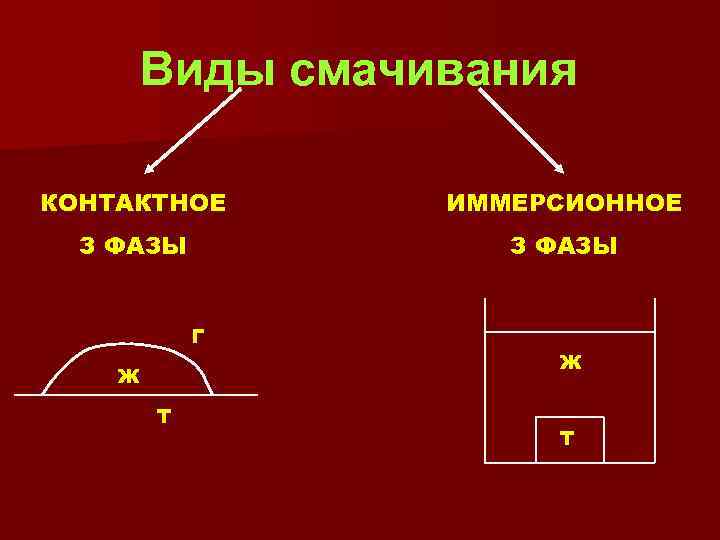 Виды смачивания КОНТАКТНОЕ ИММЕРСИОННОЕ З ФАЗЫ Г Ж Т
Виды смачивания КОНТАКТНОЕ ИММЕРСИОННОЕ З ФАЗЫ Г Ж Т
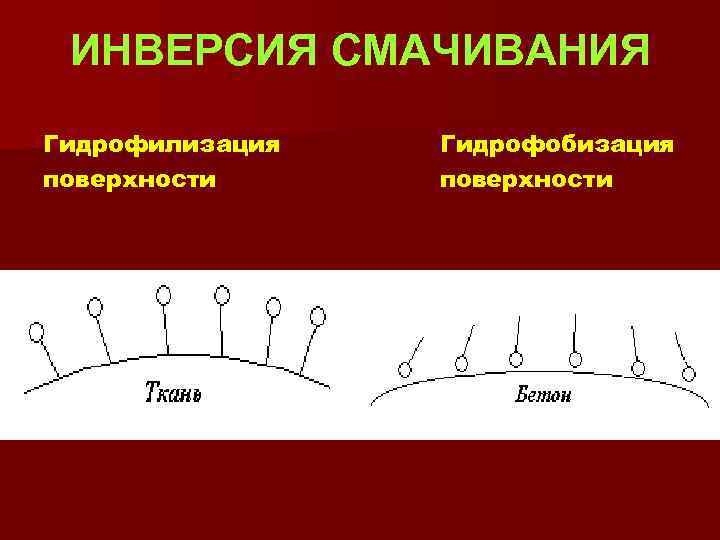 ИНВЕРСИЯ СМАЧИВАНИЯ Гидрофилизация поверхности Гидрофобизация поверхности
ИНВЕРСИЯ СМАЧИВАНИЯ Гидрофилизация поверхности Гидрофобизация поверхности
 Адгезия и когезия а в а σа σв σав в Wa = σа + σв - σав а а Wс = 2σ σ σ
Адгезия и когезия а в а σа σв σав в Wa = σа + σв - σав а а Wс = 2σ σ σ
 СПАСИБО ЗА ВНИМАНИЕ ЛЕКЦИЯ ЗАКОНЧЕНА
СПАСИБО ЗА ВНИМАНИЕ ЛЕКЦИЯ ЗАКОНЧЕНА


