Лекция 3. Количественный анализ.pptx
- Количество слайдов: 18
 Химический практикум для олимпиадной команды Лекция 3 Количественный анализ
Химический практикум для олимпиадной команды Лекция 3 Количественный анализ
 Гравиметрия (весовой анализ) • Химический метод анализа, при котором определяемый компонент выделяют в виде малорастворимого соединения определенного состава, которое после соответствующей обработки взвешивают с высокой точностью. • Al 3+ + 3 NH 3∙H 2 O Al(OH)3↓ + 3 NH 4+ Al(OH)3 – осаждаемая форма • 2 Al(OH)3 (t⁰C) Al 2 O 3 + 3 H 2 O↑ Al 2 O 3 – весовая форма
Гравиметрия (весовой анализ) • Химический метод анализа, при котором определяемый компонент выделяют в виде малорастворимого соединения определенного состава, которое после соответствующей обработки взвешивают с высокой точностью. • Al 3+ + 3 NH 3∙H 2 O Al(OH)3↓ + 3 NH 4+ Al(OH)3 – осаждаемая форма • 2 Al(OH)3 (t⁰C) Al 2 O 3 + 3 H 2 O↑ Al 2 O 3 – весовая форма
 Гравиметрия (весовой анализ) Требования к осаждаемой форме: • Количественное осаждение (в пределах обнаружения) • Строго селективное осаждение (отсутствие примесей) • Легкость фильтрации (достаточно крупнокристаллическое вещество)
Гравиметрия (весовой анализ) Требования к осаждаемой форме: • Количественное осаждение (в пределах обнаружения) • Строго селективное осаждение (отсутствие примесей) • Легкость фильтрации (достаточно крупнокристаллическое вещество)
 Гравиметрия (весовой анализ) Требования к весовой форме: • Химическая устойчивость • Строго постоянный стехиометрический состав • Малое значение гравиметрического фактора Гравиметрический фактор (f)– массовая доля определяемого компонента в весовой форме. m(Al) = f ∙ m(Al 2 O 3) = 0, 52926 ∙ m(Al 2 O 3)
Гравиметрия (весовой анализ) Требования к весовой форме: • Химическая устойчивость • Строго постоянный стехиометрический состав • Малое значение гравиметрического фактора Гравиметрический фактор (f)– массовая доля определяемого компонента в весовой форме. m(Al) = f ∙ m(Al 2 O 3) = 0, 52926 ∙ m(Al 2 O 3)
 Представление результатов (точность расчетов) • Сложение, вычитание – по меньшему количеству цифр после запятой: 1 + 0, 1 = 1 (т. к. 1 с равным успехом получается при округлении 0, 6 и 1, 4) 1, 0 + 0, 1 = 1, 1 • Умножение, деление: на экспериментальные величины – см. выше (округляем) на строго известные величины – без округления (стехиометрический коэффициент 2 = 2. 0000…) • Логарифмирование: +1 значащая цифра ln(6) = 1, 8 log 10(3 ∙ 102) = 2, 5 log 10(300) = 2, 477 • Потенцирование: -1 значащая цифра e 1, 8 = 6 e 1, 80 = 6, 0 e 1, 800 = 6, 05
Представление результатов (точность расчетов) • Сложение, вычитание – по меньшему количеству цифр после запятой: 1 + 0, 1 = 1 (т. к. 1 с равным успехом получается при округлении 0, 6 и 1, 4) 1, 0 + 0, 1 = 1, 1 • Умножение, деление: на экспериментальные величины – см. выше (округляем) на строго известные величины – без округления (стехиометрический коэффициент 2 = 2. 0000…) • Логарифмирование: +1 значащая цифра ln(6) = 1, 8 log 10(3 ∙ 102) = 2, 5 log 10(300) = 2, 477 • Потенцирование: -1 значащая цифра e 1, 8 = 6 e 1, 80 = 6, 0 e 1, 800 = 6, 05
 Представление результатов (точность расчетов) • Сложный (многостадийный) расчет - ответ округляется в соответствии с точностью наименее точной из исходных величин: 4, 0 ∙ (82353 – 2, 43 ∙ 104) = 2, 3 ∙ 105 НО! Результаты промежуточных расчетов не округляются (их оставляют с запасом в 1 -2 значащих цифры, которые будут отсечены в окончательном ответе) • Маленький гравиметрический фактор: минимизация влияния погрешности весов: m = (1, 0219 ± 0, 0004) г 0, 10000 ∙ m = (0, 10219± 0, 00004) г
Представление результатов (точность расчетов) • Сложный (многостадийный) расчет - ответ округляется в соответствии с точностью наименее точной из исходных величин: 4, 0 ∙ (82353 – 2, 43 ∙ 104) = 2, 3 ∙ 105 НО! Результаты промежуточных расчетов не округляются (их оставляют с запасом в 1 -2 значащих цифры, которые будут отсечены в окончательном ответе) • Маленький гравиметрический фактор: минимизация влияния погрешности весов: m = (1, 0219 ± 0, 0004) г 0, 10000 ∙ m = (0, 10219± 0, 00004) г
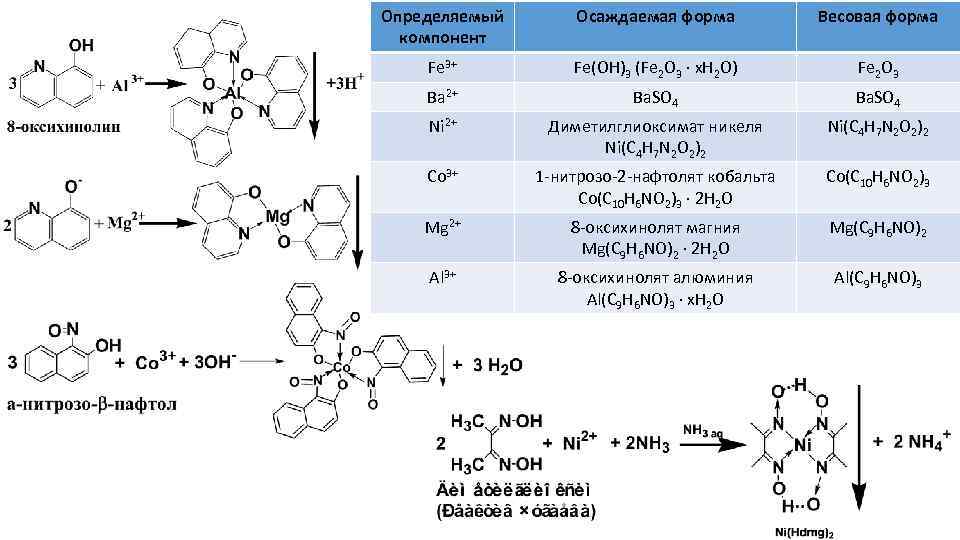 Определяемый компонент Осаждаемая форма Весовая форма Fe 3+ Fe(OH)3 (Fe 2 O 3 ∙ x. H 2 O) Fe 2 O 3 Ba 2+ Ba. SO 4 Ni 2+ Диметилглиоксимат никеля Ni(C 4 H 7 N 2 O 2)2 Co 3+ 1 -нитрозо-2 -нафтолят кобальта Со(С 10 Н 6 NО 2)3 ∙ 2 Н 2 О Со(С 10 Н 6 NО 2)3 Mg 2+ 8 -оксихинолят магния Mg(C 9 H 6 NO)2 ∙ 2 H 2 O Mg(C 9 H 6 NO)2 Al 3+ 8 -оксихинолят алюминия Al(C 9 H 6 NO)3 ∙ x. H 2 O Al(C 9 H 6 NO)3
Определяемый компонент Осаждаемая форма Весовая форма Fe 3+ Fe(OH)3 (Fe 2 O 3 ∙ x. H 2 O) Fe 2 O 3 Ba 2+ Ba. SO 4 Ni 2+ Диметилглиоксимат никеля Ni(C 4 H 7 N 2 O 2)2 Co 3+ 1 -нитрозо-2 -нафтолят кобальта Со(С 10 Н 6 NО 2)3 ∙ 2 Н 2 О Со(С 10 Н 6 NО 2)3 Mg 2+ 8 -оксихинолят магния Mg(C 9 H 6 NO)2 ∙ 2 H 2 O Mg(C 9 H 6 NO)2 Al 3+ 8 -оксихинолят алюминия Al(C 9 H 6 NO)3 ∙ x. H 2 O Al(C 9 H 6 NO)3
 Титриметрия (объемный анализ) • Химический метод анализа, при котором количество (массу, концентрацию etc) анализируемого вещества определяют по объему вещества известной концентрации, вступившего в реакцию с анализируемым. • Фактор эквивалентности (f) – часть молекулы, дающая одну активную в данной реакции частицу • H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O • H 3 PO 4 + Na. OH = Na. H 2 PO 4 + 3 H 2 O f(H 3 PO 4) = 1/3 f(H 3 PO 4) = 1
Титриметрия (объемный анализ) • Химический метод анализа, при котором количество (массу, концентрацию etc) анализируемого вещества определяют по объему вещества известной концентрации, вступившего в реакцию с анализируемым. • Фактор эквивалентности (f) – часть молекулы, дающая одну активную в данной реакции частицу • H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O • H 3 PO 4 + Na. OH = Na. H 2 PO 4 + 3 H 2 O f(H 3 PO 4) = 1/3 f(H 3 PO 4) = 1
 Титриметрия (объемный анализ) • Эквивалентная концентрация (нормальность) – условная концентрация активных частиц, эквивалентная концентрации вещества в растворе. Имеет размерность моль/л, но со своим специальным обозначением – N. Сэкв = C/f • H 2 SO 4 2 H+ + SO 42 C(H 2 SO 4) = 0, 1 M f(H 2 SO 4) = 1/2 Сэкв(H 2 SO 4) = 0, 2 N • Mn. O 4 - + 8 H+ + 5 e- Mn 2+ + 4 H 2 O C(KMn. O 4) = 0, 02 M f(Mn. O 4 -/8 H+) = 1/5 Сэкв(Mn. O 4 -) = 0, 1 N
Титриметрия (объемный анализ) • Эквивалентная концентрация (нормальность) – условная концентрация активных частиц, эквивалентная концентрации вещества в растворе. Имеет размерность моль/л, но со своим специальным обозначением – N. Сэкв = C/f • H 2 SO 4 2 H+ + SO 42 C(H 2 SO 4) = 0, 1 M f(H 2 SO 4) = 1/2 Сэкв(H 2 SO 4) = 0, 2 N • Mn. O 4 - + 8 H+ + 5 e- Mn 2+ + 4 H 2 O C(KMn. O 4) = 0, 02 M f(Mn. O 4 -/8 H+) = 1/5 Сэкв(Mn. O 4 -) = 0, 1 N
 Титриметрия (объемный анализ) • Аналит – вещество, концентрация которого неизвестна (определяемое) • Титрант – вещество известной концентрации. • Стандартизация – процесс уточнения концентрации титранта • Аликвота – точно известный объем аналита • Титрование – процесс установления концентрации аналита. • Закон эквивалентов: Cэкв. V (аналита) = Cэкв. V (титранта) C 1 V 1/f 1 = С 2 V 2/f 2
Титриметрия (объемный анализ) • Аналит – вещество, концентрация которого неизвестна (определяемое) • Титрант – вещество известной концентрации. • Стандартизация – процесс уточнения концентрации титранта • Аликвота – точно известный объем аналита • Титрование – процесс установления концентрации аналита. • Закон эквивалентов: Cэкв. V (аналита) = Cэкв. V (титранта) C 1 V 1/f 1 = С 2 V 2/f 2
 Титриметрия (объемный анализ) Требования к титриметрическим реакциям: • Протекание строго количественное (в пределах обнаружения) • Высокая скорость протекания • Отсутствие побочных процессов • Возможность фиксации конечной точки (индикации)
Титриметрия (объемный анализ) Требования к титриметрическим реакциям: • Протекание строго количественное (в пределах обнаружения) • Высокая скорость протекания • Отсутствие побочных процессов • Возможность фиксации конечной точки (индикации)
 Классификация титриметрических реакций По химии процесса: • Кислотно-основное титрование ацидиметрическое (титрант – кислота) алкалиметрическое (титрант – щелочь) • Окислительно-восстановительное титрование перманганатометрия, дихроматометрия, иодометрия (прямая, обратная, заместительная), иодатометрия, цериметрия etc • Осадительное титрование аргентометрия, гексацианоферратометрия • Комлексонометрическое титрование (самый распространенный титрант – ЭДТА)
Классификация титриметрических реакций По химии процесса: • Кислотно-основное титрование ацидиметрическое (титрант – кислота) алкалиметрическое (титрант – щелочь) • Окислительно-восстановительное титрование перманганатометрия, дихроматометрия, иодометрия (прямая, обратная, заместительная), иодатометрия, цериметрия etc • Осадительное титрование аргентометрия, гексацианоферратометрия • Комлексонометрическое титрование (самый распространенный титрант – ЭДТА)
 Классификация титриметрических реакций По способу фиксации конечной точки: • Визуальная индикация (в присутствии специальных веществ, меняющих окраску при достижении конечной точки – индикаторов. Фенолфталеин, метиловый оранжевый в К-О титровании; крахмал в иодометрии; хромат калия в аргентометрии по Мору etc) • Самоиндикация (перманганат) • Физико-химическая индикация скачок электрохимического потенциала (потенциометрия) скачок проводимости (кондуктометрия)
Классификация титриметрических реакций По способу фиксации конечной точки: • Визуальная индикация (в присутствии специальных веществ, меняющих окраску при достижении конечной точки – индикаторов. Фенолфталеин, метиловый оранжевый в К-О титровании; крахмал в иодометрии; хромат калия в аргентометрии по Мору etc) • Самоиндикация (перманганат) • Физико-химическая индикация скачок электрохимического потенциала (потенциометрия) скачок проводимости (кондуктометрия)
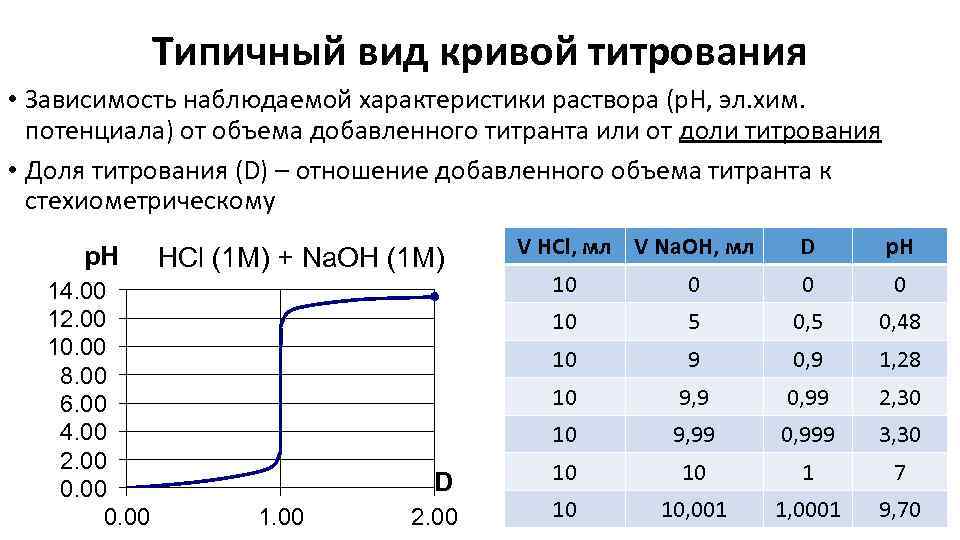 Типичный вид кривой титрования • Зависимость наблюдаемой характеристики раствора (р. Н, эл. хим. потенциала) от объема добавленного титранта или от доли титрования • Доля титрования (D) – отношение добавленного объема титранта к стехиометрическому p. H 14. 00 12. 00 10. 00 8. 00 6. 00 4. 00 2. 00 0. 00 HCl (1 M) + Na. OH (1 M) V HCl, мл V Na. OH, мл D р. Н 0 5 0, 48 9 0, 9 1, 28 10 9, 9 0, 99 2, 30 10 2. 00 0 10 1. 00 0 10 D 10 9, 99 0, 999 3, 30 10 10 1 7 10 10, 001 1, 0001 9, 70
Типичный вид кривой титрования • Зависимость наблюдаемой характеристики раствора (р. Н, эл. хим. потенциала) от объема добавленного титранта или от доли титрования • Доля титрования (D) – отношение добавленного объема титранта к стехиометрическому p. H 14. 00 12. 00 10. 00 8. 00 6. 00 4. 00 2. 00 0. 00 HCl (1 M) + Na. OH (1 M) V HCl, мл V Na. OH, мл D р. Н 0 5 0, 48 9 0, 9 1, 28 10 9, 9 0, 99 2, 30 10 2. 00 0 10 1. 00 0 10 D 10 9, 99 0, 999 3, 30 10 10 1 7 10 10, 001 1, 0001 9, 70
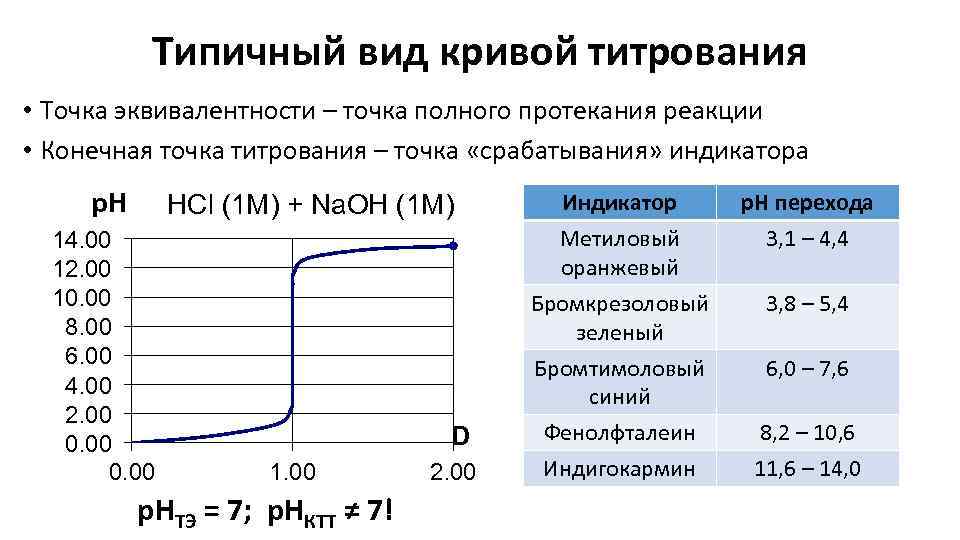 Типичный вид кривой титрования • Точка эквивалентности – точка полного протекания реакции • Конечная точка титрования – точка «срабатывания» индикатора p. H HCl (1 M) + Na. OH (1 M) 14. 00 12. 00 10. 00 8. 00 6. 00 4. 00 2. 00 0. 00 D 1. 00 р. НТЭ = 7; р. НКТТ ≠ 7! 2. 00 Индикатор Метиловый оранжевый Бромкрезоловый зеленый р. Н перехода 3, 1 – 4, 4 Бромтимоловый синий Фенолфталеин Индигокармин 6, 0 – 7, 6 3, 8 – 5, 4 8, 2 – 10, 6 11, 6 – 14, 0
Типичный вид кривой титрования • Точка эквивалентности – точка полного протекания реакции • Конечная точка титрования – точка «срабатывания» индикатора p. H HCl (1 M) + Na. OH (1 M) 14. 00 12. 00 10. 00 8. 00 6. 00 4. 00 2. 00 0. 00 D 1. 00 р. НТЭ = 7; р. НКТТ ≠ 7! 2. 00 Индикатор Метиловый оранжевый Бромкрезоловый зеленый р. Н перехода 3, 1 – 4, 4 Бромтимоловый синий Фенолфталеин Индигокармин 6, 0 – 7, 6 3, 8 – 5, 4 8, 2 – 10, 6 11, 6 – 14, 0
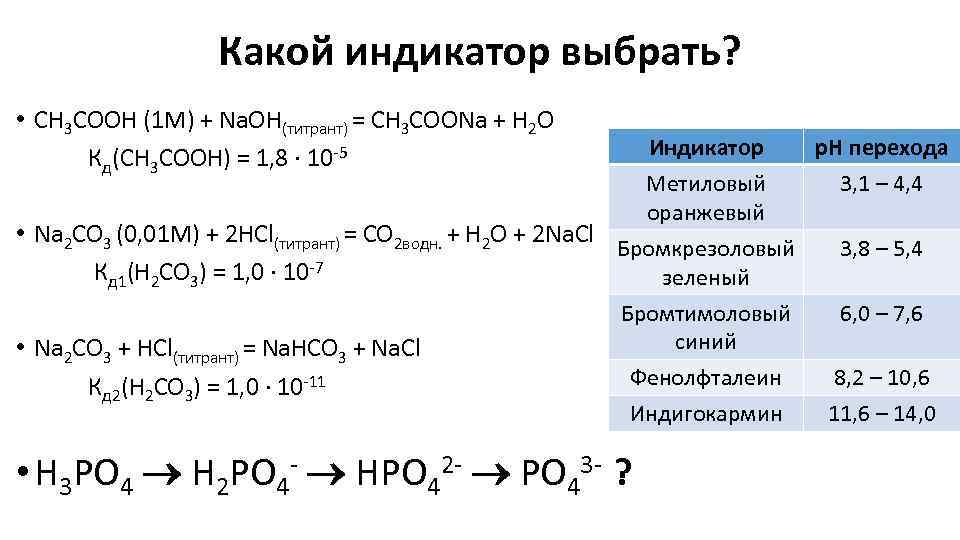 Какой индикатор выбрать? • CH 3 COOH (1 M) + Na. OH(титрант) = CH 3 COONa + H 2 O Кд(CH 3 COOH) = 1, 8 ∙ 10 -5 Индикатор Метиловый оранжевый • Na 2 CO 3 (0, 01 M) + 2 HCl(титрант) = CO 2 водн. + H 2 O + 2 Na. Cl Бромкрезоловый Кд 1(H 2 CO 3) = 1, 0 ∙ 10 -7 зеленый • Na 2 CO 3 + HCl(титрант) = Na. HCO 3 + Na. Cl Кд 2(H 2 CO 3) = 1, 0 ∙ 10 -11 Бромтимоловый синий Фенолфталеин Индигокармин • H 3 PO 4 H 2 PO 4 - HPO 42 - PO 43 - ? р. Н перехода 3, 1 – 4, 4 3, 8 – 5, 4 6, 0 – 7, 6 8, 2 – 10, 6 11, 6 – 14, 0
Какой индикатор выбрать? • CH 3 COOH (1 M) + Na. OH(титрант) = CH 3 COONa + H 2 O Кд(CH 3 COOH) = 1, 8 ∙ 10 -5 Индикатор Метиловый оранжевый • Na 2 CO 3 (0, 01 M) + 2 HCl(титрант) = CO 2 водн. + H 2 O + 2 Na. Cl Бромкрезоловый Кд 1(H 2 CO 3) = 1, 0 ∙ 10 -7 зеленый • Na 2 CO 3 + HCl(титрант) = Na. HCO 3 + Na. Cl Кд 2(H 2 CO 3) = 1, 0 ∙ 10 -11 Бромтимоловый синий Фенолфталеин Индигокармин • H 3 PO 4 H 2 PO 4 - HPO 42 - PO 43 - ? р. Н перехода 3, 1 – 4, 4 3, 8 – 5, 4 6, 0 – 7, 6 8, 2 – 10, 6 11, 6 – 14, 0
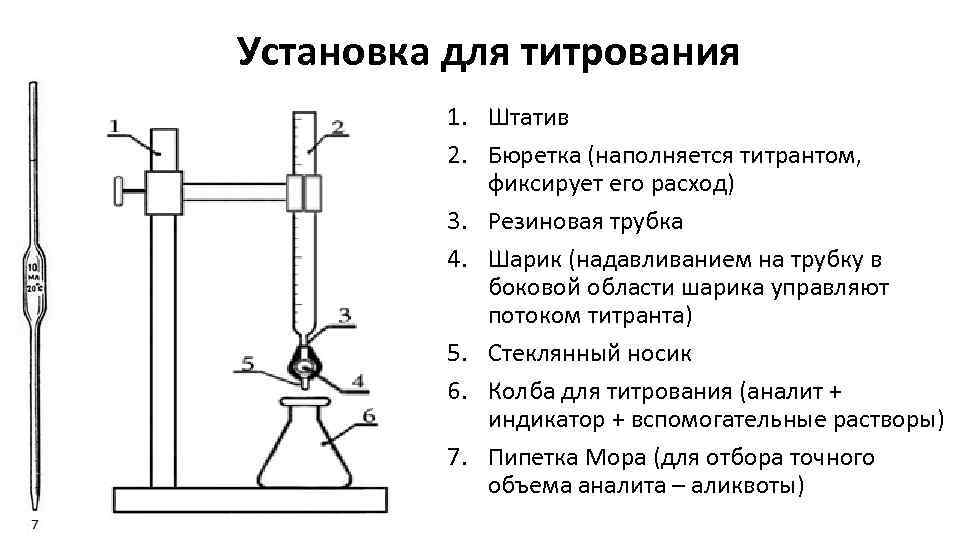 Установка для титрования 1. Штатив 2. Бюретка (наполняется титрантом, фиксирует его расход) 3. Резиновая трубка 4. Шарик (надавливанием на трубку в боковой области шарика управляют потоком титранта) 5. Стеклянный носик 6. Колба для титрования (аналит + индикатор + вспомогательные растворы) 7. Пипетка Мора (для отбора точного объема аналита – аликвоты)
Установка для титрования 1. Штатив 2. Бюретка (наполняется титрантом, фиксирует его расход) 3. Резиновая трубка 4. Шарик (надавливанием на трубку в боковой области шарика управляют потоком титранта) 5. Стеклянный носик 6. Колба для титрования (аналит + индикатор + вспомогательные растворы) 7. Пипетка Мора (для отбора точного объема аналита – аликвоты)
 Спасибо за внимание!
Спасибо за внимание!


